37: Epispádias feminina
Este capítulo levará aproximadamente 15 minutos para ler.
Introdução
A extrofia vesical (BE) é uma anomalia congênita devastadora do trato urinário na qual os recém-nascidos nascem com a bexiga urinária exteriorizada através da parede abdominal, uma uretra aberta dorsalmente e anomalias secundárias significativas da genitália. É amplamente considerada o distúrbio congênito do trato urinário mais desafiador e complexo do ponto de vista cirúrgico.1 A BE varia quanto ao grau de gravidade e existe em um contínuo descrito como o complexo extrofia vesical-epispádias (BEEC).2 A incidência do BEEC é de ~1 em 10,000.2
A extrofia cloacal (CE) situa-se no extremo mais grave do espectro do BEEC. A CE é uma doença congênita rara com incidência de 1 em 200.000–400.000 nascidos vivos.3,4 Anomalias associadas comuns incluem onfalocele, extrofia vesical, ânus imperfurado e disrafismo espinhal.4 Outras características incluem uma placa mediana de ceco extrofiado ladeada por 2 metades da bexiga, um segmento de íleo prolapsando a partir da placa cecal e um intestino posterior rudimentar, de fundo cego, acompanhado por um ânus imperfurado.4
No extremo oposto do espectro encontra-se o epispádias. O epispádias está mais comumente presente como componente de BE e CE, mas quando o epispádias ocorre isoladamente, na ausência de BE e CE, é considerado a variante menos grave do BEEC. O epispádias é definido por uma fusão incompleta da uretra dorsal.5 Isso varia desde um defeito glandular leve em um pênis coberto até a variedade penopúbica que se estende proximalmente até o colo vesical e resulta em incontinência completa em homens ou mulheres.5 Curiosamente, o primeiro caso de epispádias descrito é atribuído ao imperador bizantino Heráclio (CE 610–641).6 O epispádias masculino isolado é uma anomalia rara, com incidência relatada de 1 em 117,000 homens.6 O epispádias feminino isolado é ainda mais raro, com incidência de 1 em 484,000 pacientes do sexo feminino.6 Neste capítulo, nos concentraremos exclusivamente no epispádias feminino.
Em 1928, Davis classificou a epispádia feminina em três categorias com base na gravidade. Esse sistema de classificação ainda é utilizado atualmente.7 No grau menos acentuado de epispádia, o orifício uretral se apresenta apenas patuloso. Na epispádia intermediária, a uretra encontra-se cindida dorsalmente ao longo de grande parte de sua extensão. No grau mais grave de epispádia, a fenda uretral envolve todo o comprimento da uretra e o mecanismo esfincteriano torna-se incompetente. Vale notar que a prevalência real da epispádia feminina pode ser maior do que a relatada, pois, nos casos menos graves, as alterações dos genitais externos podem ser mínimas e, na ausência de incontinência, as pacientes permanecem sem diagnóstico.8,9
Embriologia
Uma das principais teorias de maldesenvolvimento embrionário na extrofia, proposta por Marshall e Muecke, é que o defeito básico seja um hiperdesenvolvimento anormal da membrana cloacal durante a quarta semana de gestação, o que impede a migração medial do tecido mesenquimatoso e o desenvolvimento adequado da parede abdominal inferior. O momento da ruptura dessa membrana cloacal defeituosa é considerado determinante da variante resultante.10 Acredita-se que haja uma falha da membrana cloacal em ser reforçada pela ingressão do mesoderma. A membrana cloacal é uma camada bilaminar situada na extremidade caudal do disco germinativo que ocupa a parede abdominal infraumbilical. A ingressão mesenquimal entre as camadas ectodérmica e endodérmica da membrana cloacal resulta na formação dos músculos da parede abdominal inferior e dos ossos da pelve. A membrana cloacal é suscetível à ruptura prematura e, se isso resultar em um pequeno defeito infraumbilical, ou a ruptura ocorrer em estágio mais tardio do desenvolvimento, acredita-se que resultará em epispádias, ao passo que, em casos de defeitos maiores ou de ruptura mais precoce, podem resultar em BE ou CE.10,11
Existem outras teorias plausíveis sobre a causa do complexo extrofia-epispádias. Desenvolvimento anormal das eminências genitais caudalmente à posição normal, com fusão na linha média
abaixo, e não acima, da membrana cloacal, tem sido acolhida por outros pesquisadores.11,12 Outra hipótese interessante, que permanece controversa, descreve uma inserção caudal anormal do pedúnculo corporal, o que resulta em falha na interposição do tecido mesenquimal na linha média.13 Como consequência dessa falha, não ocorre a translocação da cloaca para as porções profundas da cavidade abdominal. Uma membrana cloacal que permanece em posição infraumbilical superficial representa um estado embrionário instável, com forte tendência à desintegração, o que foi corroborado pelo trabalho laboratorial de Thomalla et al.14,15 Outra teoria interessante é que o desenvolvimento anômalo da pelve óssea, em vez disso, é o fator desencadeante para o desenvolvimento da extrofia. Beaudoin et al sugeriram que a falta de “rotação” do primórdio do anel pélvico impede que as estruturas fixadas ao anel pélvico se unam na linha média, permitindo que ocorra herniação da bexiga.16
Epidemiologia
Epispádia feminina completa é um defeito congênito extremamente raro, ocorrendo em cerca de 1/484.000 nascidos vivos, muito menos frequente do que BE, a qual se estima ocorrer em 1/10.000 a 1/50.000.6 A razão homem-mulher da exstrofia vesical derivada de múltiplas séries é de 2,3:1 e a epispádia feminina também é menos comum do que a epispádia masculina, que tem uma incidência relatada de 1 em 117.000 homens.17
O risco de recorrência de BE em uma determinada família é de aproximadamente 1 em 100.18 Shapiro et al, por meio de um questionário, identificaram a recorrência de BE e epispádias em apenas 9 de aproximadamente 2,500 casos indexados.19 Shapiro et al determinaram que o risco de BE na descendência de indivíduos com BE e epispádias é de 1 em 70 nascidos vivos, uma incidência 500 vezes maior do que na população geral.17
Patogénese
Nossa compreensão atual da patogênese do epispádias é incompleta. Devido à escassez de pesquisas de qualidade, especialistas ainda não têm certeza sobre as origens embriológicas e os mecanismos genéticos que dão origem ao epispádias. No entanto, avanços foram feitos nos últimos anos no que diz respeito à identificação de genes candidatos no BEEC, o que também englobaria o desenvolvimento de epispádias isolado. von Lowtow et al avaliaram 169 indivíduos com BEEC (recrutados majoritariamente da Europa, origem genética geoétnica não relatada).20 Eles identificaram vários indivíduos com variantes patogênicas no número de cópias, incluindo um com uma duplicação previamente relatada em 22q11. Essa região também está associada à Síndrome de Deleção 22q11 (Síndrome de DiGeorge) e a CAKUT.21 Uma metanálise subsequente de GWAS combinando 568 pacientes com BEEC e 3,241 controles de origem europeia identificou uma associação com um lócus contendo o potenciador transcricional ISL1 (p = 2.22 × 10−08).22,23,24,25,26 Estudos funcionais e de modelos adicionais reforçaram um possível papel causal de ISL1 na BEEC. Por exemplo, modelos de biologia do desenvolvimento foram usados para esclarecer a localização da atividade de ISL1 no trato urinário em formação.26 A análise de linhagem genética de células que expressam ISL1 por meio de um modelo de camundongo traçador de linhagem mostrou células que expressam ISL1 no trato urinário de embriões de camundongo.26
Avaliação e Diagnóstico
Mesmo com modalidades ultrassonográficas modernas, o diagnóstico pré-natal de BE é frequentemente difícil de delinear, e o diagnóstico pré-natal de epispádias isolado é quase impossível.27 Em 2012, Goyal et al. verificaram que apenas 25% dos casos de BEEC são diagnosticados no período pré-natal.27 Vários grupos tentaram delinear critérios importantes para o diagnóstico pré-natal de BE, mas não há características específicas para epispádias. Constatou-se que, na BE clássica, a ausência de uma bexiga normal repleta de líquido em exames repetidos sugere o diagnóstico, assim como uma massa de tecido ecogênico na parede abdominal inferior.28,29 Uma distância da inserção do cordão umbilical ao tubérculo genital abaixo do quinto percentil para a idade gestacional também fornece uma medida quantitativa pela qual um diagnóstico de BE pode ser avaliado.30 Em uma revisão de 25 exames de ultrassonografia pré-natal com o subsequente nascimento de um recém-nascido com BE, Gearhart et al fizeram várias observações:1 ausência de enchimento vesical,2 umbigo de implantação baixa,3 alargamento do ramo púbico,4 genitália diminuta, e5 uma massa no abdome inferior que aumentava de tamanho conforme a gestação progredia e conforme as vísceras intra-abdominais aumentavam de tamanho.31 Não é difícil entender por que o diagnóstico pré-natal de epispádias isolado é mais difícil. Dentre as observações pré-natais mencionadas anteriormente, apenas um umbigo de implantação baixa, um ramo púbico alargado e genitália diminuta poderiam estar potencialmente presentes no contexto de epispádias isolado. Todos esses achados seriam menos graves no contexto de epispádias isolado, e genitália diminuta não seria aplicável no contexto de epispádias feminino isolado.
Como resultado, o diagnóstico de epispádias feminino isolado é geralmente feito por exame físico no período pós-natal. As alterações no aspecto externo da genitália podem ser mínimas, particularmente em casos de epispádias leve. Externamente, será identificado um defeito genital marcado por um clitóris bífido. O monte do púbis terá um formato deprimido e será recoberto por uma área de pele lisa e glabra. Abaixo dessa área, pode haver uma quantidade moderada de tecido subcutâneo e gordura, ou a pele pode estar diretamente anterior e inferior à superfície da sínfise púbica. Os pequenos lábios geralmente são pouco desenvolvidos e terminam anteriormente na metade correspondente do clitóris bífido, onde pode haver um rudimento de dobra prepucial. A sínfise púbica geralmente está fechada, mas pode estar separada por uma estreita banda fibrosa. Ao separar os lábios, identifica-se a anomalia uretral, que pode variar consideravelmente dependendo do grau de epispádias presente. A anomalia uretral variará desde um defeito distal curto até outro que se estende proximalmente até o colo vesical (Figura 1). A vagina e os genitais internos geralmente são normais. Como as alterações do aspecto externo podem ser mínimas, algumas crianças são identificadas apenas devido à incontinência persistente e, em casos leves em que não há incontinência, o diagnóstico pode nunca ser feito. É por isso que a prevalência real do epispádias feminino pode ser maior do que a relatada.8,9 Assim, o epispádias feminino isolado envolve sempre uma anomalia da uretra, mas podem coexistir anomalias do colo vesical que não podem ser ignoradas ao manejar essas pacientes. Nas formas mais graves de epispádias feminino, a bexiga pode ser pequena e comparável às bexigas de pacientes com extrofia vesical que foi fechada, uma vez que não houve ciclagem vesical intrauterina. De fato, um terço de todos os pacientes com epispádias incontinentes têm capacidade vesical inferior a 60 mL, e a incidência de refluxo vesicoureteral é de 30% a 75%.32
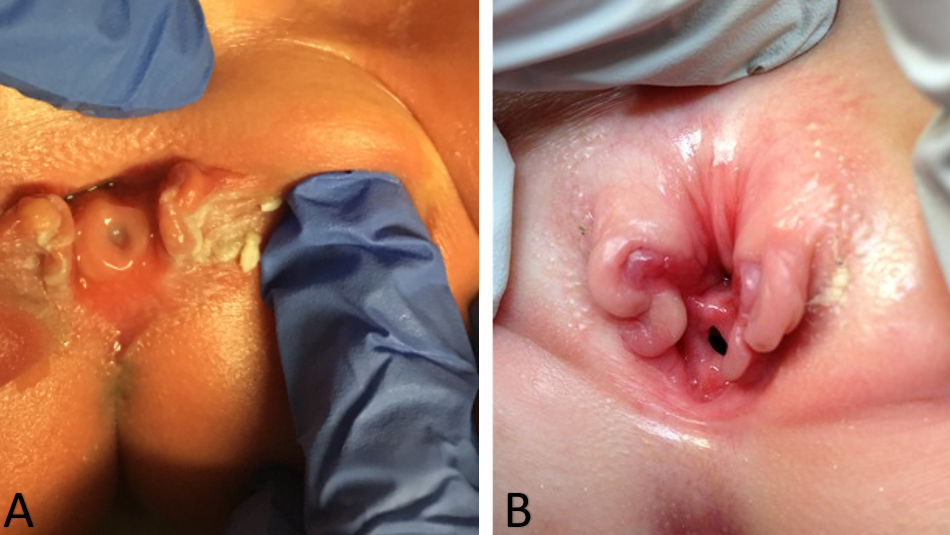
Figura 1 Casos graves de epispádia feminina. Epispádia penopúbica em uma recém-nascida (A). Epispádia penopúbica em uma criança de 4 anos (B).
Tratamento e desfechos
Na paciente com epispádia feminina, os objetivos do tratamento são a obtenção da continência urinária, a preservação das vias urinárias superiores e a reconstrução de uma genitália externa funcional e esteticamente aceitável. Em pacientes com epispádia leve que são continentes e apresentam apenas alterações mínimas na genitália externa, a reconstrução cirúrgica pode não ser necessária. Para formas mais graves de epispádia feminina, a reconstrução cirúrgica é necessária para obter continência e corrigir as anomalias da genitália externa.
Historicamente, foram relatadas muitas operações na tentativa de alcançar a continência no grupo com epispádias, mas os resultados foram decepcionantes. Esses procedimentos incluíam plicatura transvaginal da uretra e do colo vesical, transplantes musculares, torção da uretra, cauterização da uretra, retalho vesical e suspensão vesicouretral de Marshall-Marchetti.33,34,35,36 Esses procedimentos visavam aumentar a resistência uretral, mas não corrigiam a incontinência, pois não tentavam normalizar a anatomia da uretra e do colo vesical.
Como mencionado anteriormente, pacientes com epispádias distal sem incontinência podem não necessitar de qualquer intervenção cirúrgica. Nos casos de epispádias proximal em pacientes do sexo feminino, frequentemente realizamos a correção da epispádias e a reconstrução do colo vesical, com ou sem osteotomias, no mesmo tempo cirúrgico (Figura 2). Esse procedimento é semelhante à correção primária completa da extrofia que realizamos nos casos de BE e geralmente é realizado entre 3–6 meses de vida. Observamos que a resistência adicional obtida com a correção da epispádias e a reconstrução do colo vesical permite a ciclagem vesical e frequentemente pode resultar em aumento da capacidade vesical. Esses achados foram corroborados por outros autores, que demonstraram que o fechamento primário da uretra epispádica em crianças com extrofia fechada aumentou a capacidade vesical sem causar hidronefrose. Essa abordagem tem sido aplicada a pacientes do sexo masculino e feminino com epispádias.37,38,39
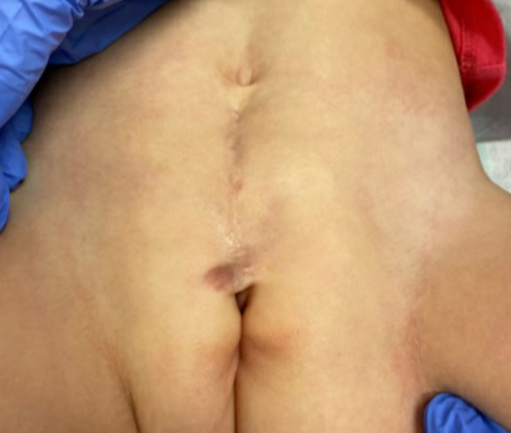
Figura 2 Imagem pós-operatória de uma paciente com epispádia feminina grave, após correção da epispádia e reconstrução do colo vesical.
As taxas de continência em pacientes do sexo feminino com epispádia isolada foram encontradas entre 67 e 87,5%.6,32,40 O intervalo médio após a reconstrução até a obtenção de continência foi citado como entre 18 e 30 meses.6,41 Também há relatos raros de pacientes que alcançaram continência completa tardiamente, vários anos após a reconstrução.32 Postula-se que o atraso prolongado para alcançar a continência seja secundário a um aumento do desenvolvimento da musculatura pélvica ao longo do tempo e especialmente após as mudanças hormonais durante a puberdade.32
Complicações
O manejo cirúrgico da epispádia é notoriamente desafiador e, como resultado, as complicações não são incomuns. As complicações potenciais após o reparo da uretra epispádica incluem fístula uretrocutânea, estenose meatal e estenoses uretrais. Para pacientes que necessitam de um procedimento no colo vesical, a importância de um seguimento próximo não pode ser superestimada. Quando a resistência da via de saída vesical é aumentada, os pacientes correm risco de desenvolver uma bexiga de alta pressão devido à contração da bexiga para vencer a alta resistência, o que coloca as vias urinárias superiores em risco. Assim, é fundamental que os cirurgiões acompanhem os pacientes muito de perto após a reconstrução, a fim de identificar precocemente hidronefrose de aparecimento recente ou outros sinais de um sistema de alta pressão. Isto é particularmente importante em pacientes que tinham bexigas pequenas e de baixa complacência no pré-operatório, embora isso seja muito raro na epispádia. Além disso, após um procedimento no colo vesical, os pacientes podem ainda apresentar incontinência e podem necessitar de procedimentos adicionais para alcançar a continência.
Em pacientes com formas graves de epispádia proximal, osteotomias ilíacas bilaterais podem ser necessárias no momento da reconstrução urológica para reduzir a tensão do fechamento, diminuindo a diástase púbica. Os riscos associados às osteotomias ilíacas bilaterais incluem perda de sangue, diminuição da perfusão dos membros inferiores e, em casos muito graves, diminuição da perfusão do clitóris. A diminuição da perfusão do clitóris pode ocorrer quando os ossos púbicos são aproximados de forma excessivamente apertada após as osteotomias. Fístulas vesicocutâneas também são possíveis em pacientes que necessitam de reconstrução do colo vesical. Curiosamente, quando Suson et al compararam 22 meninas com epispádia completa com 23 meninas com BE clássica, não encontraram diferença no número de procedimentos cirúrgicos, no desenvolvimento da continência com ou sem necessidade de reconstrução do colo vesical, ou na necessidade eventual de derivação urinária continente.5
Acompanhamento sugerido
Pacientes com epispádia distal que urinam normalmente e têm vias urinárias superiores saudáveis podem, muitas vezes, ser apenas acompanhados e, potencialmente, receber alta do acompanhamento após um período de seguimento. Por outro lado, pacientes com formas mais graves de epispádia que se submetem à reconstrução devem ser acompanhados durante toda a infância e até a vida adulta. É fundamental transferir seu cuidado, na vida adulta, para um urologista de transição com experiência no tratamento de pacientes com anomalias urológicas congênitas complexas.
Como mencionado anteriormente, os pacientes submetidos à correção de epispádias e à reconstrução do colo vesical exigem acompanhamento pós-operatório muito estreito. Estudos demonstraram que pacientes submetidos a procedimentos isolados no colo vesical, sem aumento vesical concomitante, apresentam risco de desenvolver pressões vesicais elevadas e consequente deterioração do trato urinário superior. Isso foi observado mesmo quando é realizada uma avaliação pré-operatória extensa para assegurar pressões vesicais e complacência pré-operatórias seguras. Apesar da seleção pré-operatória, ocorrem alterações significativas na dinâmica vesical e 40% dos pacientes com bexiga neurogênica necessitaram de aumento vesical subsequente.42 Assim, o acompanhamento anual com ultrassonografia renal e vesical é absolutamente crucial nesses pacientes.
Conclusões
Epispádias feminino isolado é uma condição extremamente rara e é considerada a variante menos grave do BEEC. Varia desde um defeito distal leve que não afeta a continência até um fenótipo completo que se estende proximalmente até o colo vesical e resulta em incontinência completa.5 Semelhante ao BE, o epispádias proximal é amplamente considerado um dos distúrbios congênitos do trato urinário mais complexos e desafiadores do ponto de vista cirúrgico.1 A correção do epispádias, a reconstrução do colo vesical e até osteotomias podem ser necessárias nas formas mais graves. Muitos pacientes com epispádias precisarão de acompanhamento ao longo da vida com um urologista com experiência no cuidado de pacientes com anomalias urológicas complexas.
Pontos-chave
- O epispádias é a variante menos grave do BEEC e é definido por uma fusão incompleta da uretra dorsal.
- O epispádias feminino completo é um defeito congênito extremamente raro, ocorrendo em cerca de 1/484,000 nascidos vivos, muito menos frequente do que BE, que se estima ocorrer em 1/10,000 a 1/50,000.
- O diagnóstico de epispádias feminino isolado é geralmente feito por exame físico no pós-natal, pois o diagnóstico por exames de imagem pré-natais não é confiável.
- A anomalia uretral pode variar de um defeito distal curto até outro que se estende proximalmente até o colo vesical
- Em pacientes com epispádias feminino, os objetivos do tratamento são alcançar a continência urinária, preservar as vias urinárias superiores e reconstruir uma genitália externa funcional e cosmeticamente aceitável.
- Em pacientes com epispádias leve que são continentes e apresentam apenas alterações mínimas na genitália externa, a reconstrução cirúrgica pode não ser necessária.
- Para formas mais graves de epispádias feminino, a reconstrução cirúrgica é necessária para obter continência e corrigir as anomalias da genitália externa.
- As taxas de continência em mulheres com epispádias isolado foram observadas entre 67-87.5%.
Referências
- Weiss DA, Shukla AR, Borer JG, Sack BS, Kryger JV, Roth EB, et al.. Evaluation of outcomes following complete primary repair of bladder exstrophy at three individual sites prior to the establishment of a multi-institutional collaborative model. J Pediatr Urol 2020; 16 (4): 435.e1–435.e6. DOI: 10.1016/j.jpurol.2020.05.153.
- Reutter H, Keppler-Noreuil K, E. Keegan C, Thiele H, Yamada G, Ludwig M. Genetics of Bladder-Exstrophy-Epispadias Complex (BEEC): Systematic Elucidation of Mendelian and Multifactorial Phenotypes. Curr Genomics 2005; 17 (1): 4–13. DOI: 10.2174/1389202916666151014221806.
- Phillips TM. Spectrum of cloacal exstrophy. Semin Pediatr Surg 2011; 20 (2): 113–118. DOI: 10.1053/j.sempedsurg.2010.12.007.
- Woo LL, Thomas JC, Brock JW. Cloacal exstrophy: A comprehensive review of an uncommon problem. J Pediatr Urol 2010; 6 (2): 102–111. DOI: 10.1016/j.jpurol.2009.09.011.
- Suson KD, Preece J, Baradaran N, Di Carlo HN, Gearhart JP. The Fate of the Complete Female Epispadias and Exstrophy Bladder–Is There a Difference? J Urol 2013; 190 (4s): 1583–1589. DOI: 10.1016/j.juro.2013.01.093.
- Gearhart JP. Exstrophy-Epispadias Complex in Campbell-Walsh-Wein Urology 2021. Elsevier; .
- Davis DM. Epispadias in Females and Its Surgical Treatment. J Urol 1928; 20 (6): 673–678. DOI: 10.1016/s0022-5347(17)73196-5.
- Yeni E, Unal D, Verit A, Karatas OF. An adult female epispadias without exstrophy was presented with urinary incontinence: a case report. Int Urogynecol J 2004; 15 (3): 212–213. DOI: 10.1007/s00192-004-1131-2.
- Krishna Shetty MV, Sen TK, Bhaskaran VA. Female epispadias. Afr J Paediatr Surg 2011; 8 (2): 215. DOI: 10.4103/0189-6725.86066.
- Muecke EC. The Role of the Cloacae Membrane in Exstrophy: The First Successful Experimental Study. J Urol 1964; 92 (6): 659–668. DOI: 10.1016/s0022-5347(17)64028-x.
- Ambrose SS, O’Brien DP. Surgical Embryology of the Exstrophy-Epispadias Complex. Surg Clin North Am 1974; 54 (6): 1379–1390. DOI: 10.1016/s0039-6109(16)40493-7.
- Patten BM, Barry A. The genesis of exstrophy of the bladder and epispadias. Am J Anat 1952; 90 (1): 35–57. DOI: 10.1002/aja.1000900103.
- Mildenberger H, Kluth D, Dziuba M. Embryology of bladder exstrophy. J Pediatr Surg 1988; 23 (2): 166–170. DOI: 10.1016/s0022-3468(88)80150-7.
- Johnston JH, Kogan SJ. The exstrophic anomalies and their surgical reconstruction. Curr Probl Surg 1974; 11 (8): 1–39. DOI: 10.1016/s0011-3840(74)80011-0.
- Thomalla JV, Rudolph RA, Rink RC, Mitchell ME. Induction of Cloacal Exstrophy in the Chick Embryo Using the CO 2 Laser. J Urol 1985; 134 (5): 991–995. DOI: 10.1016/s0022-5347(17)47573-2.
- Beaudoin S, Simon L, Bargy F. Anatomical basis of a common embryological origin for epispadias and bladder or cloacal exstrophies. Surg Radiol Anat 1997; 19 (1): 11–16. DOI: 10.1007/bf01627728.
- Shapiro E, Lepor H, Jeffs RD. The Inheritance of the Exstrophy-Epispadias Complex. J Urol 1984; 132 (2): 308–310. DOI: 10.1016/s0022-5347(17)49605-4.
- Ives E, Coffey R, Carter CO. A family study of bladder exstrophy. J Med Genet 1980; 17 (2): 139–141. DOI: 10.1136/jmg.17.2.139.
- Shapiro E, Jeffs RD, Gearhart JP, Lepor H. Muscarinic Cholinergic Receptors in Bladder Exstrophy: Insights Into Surgical Management. J Urol 1985; 134 (2): 308–310. DOI: 10.1016/s0022-5347(17)47139-4.
- Reutter H, Boyadjiev SA, Gambhir L, Ebert A-K, Rösch WH, Stein R, et al.. Phenotype Severity in the Bladder Exstrophy-Epispadias Complex: Analysis of Genetic and Nongenetic Contributing Factors in 441 Families from North America and Europe. J Pediatr 2011; 159 (5): 825–831.e1. DOI: 10.1016/j.jpeds.2011.04.042.
- WOOD HADLEYM, TROCK BRUCEJ, GEARHART JOHNP. In Vitro Fertilization and the Cloacal-Bladder Exstrophy-Epispadias Complex: Is there an Association? J Urol 2003; 169 (4): 1512–1515. DOI: 10.1097/01.ju.0000054984.76384.66.
- Lowtzow C von, Hofmann A, Zhang R, Marsch F, Ebert A-K, Rösch W, et al.. CNV analysis in 169 patients with bladder exstrophy-epispadias complex. BMC Med Genet 2016; 17 (1): 35. DOI: 10.1186/s12881-016-0299-x.
- Sanna-Cherchi S, Kiryluk K, Burgess KE, Bodria M, Sampson MG, Hadley D, et al.. Copy-Number Disorders Are a Common Cause of Congenital Kidney Malformations. Am J Hum Genet 2012; 91 (6): 987–997. DOI: 10.1016/j.ajhg.2012.10.007.
- Arkani S, Cao J, Lundin J, Nilsson D, Källman T, Barker G, et al.. Evaluation of the ISL1 gene in the pathogenesis of bladder exstrophy in a Swedish cohort. Hum Genome Var 2018; 5 (1): 18009. DOI: 10.1038/hgv.2018.9.
- Draaken M, Knapp M, Pennimpede T, Schmidt JM, Ebert A-K, Rösch W, et al.. Genome-wide Association Study and Meta-Analysis Identify ISL1 as Genome-wide Significant Susceptibility Gene for Bladder Exstrophy. PLoS Genet 2015; 11 (3): e1005024. DOI: 10.1371/journal.pgen.1005024.
- Reutter H, Draaken M, Pennimpede T, Wittler L, Brockschmidt FF, Ebert A-K, et al.. Genome-wide association study and mouse expression data identify a highly conserved 32 kb intergenic region between WNT3 and WNT9b as possible susceptibility locus for isolated classic exstrophy of the bladder. Hum Mol Genet 2014; 23 (20): 5536–5544. DOI: 10.1093/hmg/ddu259.
- Reutter H, Hoischen A, Ludwig M, Stein R, Radlwimmer B, Engels H, et al.. Genome-wide analysis for micro-aberrations in familial exstrophy of the bladder using array-based comparative genomic hybridization. BJU Int 2007; 100 (3): 646–650. DOI: 10.1111/j.1464-410x.2007.07086.x.
- Zhang R, Knapp M, Suzuki K, Kajioka D, Schmidt JM, Winkler J, et al.. ISL1 is a major susceptibility gene for classic bladder exstrophy and a regulator of urinary tract development. Sci Rep 2017; 7 (1): 42170. DOI: 10.1038/srep42170.
- Goyal A, Fishwick J, Hurrell R, Cervellione RM, Dickson AP. Antenatal diagnosis of bladder/cloacal exstrophy: Challenges and possible solutions. J Pediatr Urol 2012; 8 (2): 140–144. DOI: 10.1016/j.jpurol.2011.05.003.
- Mirk P, Calisti A, Fileni A. Prenatal sonographic diagnosis of bladder extrophy. J Ultrasound Med 1986; 5 (5): 291–293. DOI: 10.7863/jum.1986.5.5.291.
- VERCO PW, KHOR BH, BARBARY J, ENTHOVEN C. Ectopia Vesicae in Utero. Australas Radiol 1986; 30 (2): 117–120. DOI: 10.1111/j.1440-1673.1986.tb02400.x.
- Fishel-Bartal M, Perlman S, Messing B, Bardin R, Kivilevitch Z, Achiron R, et al.. Early Diagnosis of Bladder Exstrophy: Quantitative Assessment of a Low-Inserted Umbilical Cord. J Ultrasound Med 2017; 36 (9): 1801–1805. DOI: 10.1002/jum.14212.
- GEARHART J, BENCHAIM J, JEFFS R, SANDERS R. Criteria for the prenatal diagnosis of classic bladder exstrophy. Obstet Gynecol 1995; 85 (6): 961–964. DOI: 10.1016/0029-7844(95)00069-4.
- Kelalis PP, Kramer SA. Surgical Correction of Female Epispadias. Eur Urol 1982; 8 (6): 321–324. DOI: 10.1159/000473547.
- Jonuzi A, Popović N, Zvizdić Z, Milišić E, Karavdić K, Dewan P. Female Epispadias Presenting as Urinary Incontinence. APSP J Case Rep 2017; 8 (2): 10. DOI: 10.21699/ajcr.v8i2.548.
- Gross RE, Cresson SL. Exstrophy Of Bladder. J Am Med Assoc 1952; 149 (18): 1640. DOI: 10.1001/jama.1952.02930350028008.
- MARSHALL VICTORFRAY, MARCHETTI ANDREWA, KRANTZ KERMITE. The Correction of Stress Incontinence by Simple Vesicourethral Suspension. J Urol 1949; 88 (4): 1326–1331. DOI: 10.1097/00005392-200210010-00005.
- &Na;. Epispadias and Incontinence. Plast Reconstr Surg 1983; 37 (5): 468. DOI: 10.1097/00006534-196605000-00023.
- Ben-Chaim J, Peppas DS, Jeffs RD, Gearhart JP. Complete Male Epispadias: Genital Reconstruction and Achieving Continence. J Urol 1995; 153 (5): 1665–1667. DOI: 10.1016/s0022-5347(01)67499-8.
- Gearhart JP, Jeffs RD. Bladder Exstrophy: Increase in Capacity Following Epispadias Repair. J Urol 1989; 142 (2 Part 2): 525–526. DOI: 10.1016/s0022-5347(17)38804-3.
- Peters CA, Gearhart JP, Jeffs RD. Epispadias and Incontinence: The Challenge of the Small Bladder. J Urol 1988; 140 (5 Part 2): 1199–1201. DOI: 10.1016/s0022-5347(17)42001-5.
- Hanna MK, Williams DI. Genital Function In Males With Vesical Exstrophy And Epispadias. Br J Urol 1972; 44 (2): 169–174. DOI: 10.1111/j.1464-410x.1972.tb10062.x.
- Klauber GT, Williams DI. Epispadias with incontinence. Plast Reconstr Surg 1974; 54 (4): 504. DOI: 10.1097/00006534-197410000-00053.
- Weiss D. Faculty Opinions recommendation of Clinical outcomes after increasing bladder outlet resistance without augmentation cystoplasty in neurogenic bladder. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2021; 17 (2): 235 1–235 7. DOI: 10.3410/f.739262243.793583985.
Ultima atualização: 2025-09-21 13:35