33: Reoperação de hipospádia
Este capítulo levará aproximadamente 16 minutos para ler.
Introdução
A hipospádia secundária é um termo reservado para indivíduos com complicações anatómicas e funcionais persistentes após múltiplas cirurgias corretivas de hipospádia. Estas incluem formação de estenose, fístula uretrocutânea, deiscência da glande, deiscência uretral, curvatura peniana persistente e deformidade da glande. A hipospádia é definida por três características principais: um meato situado ventralmente, grau variável de curvatura peniana, e um aspeto 'em capuz’ do prepúcio devido ao excesso de pele preputial dorsal, sendo que cada componente apresenta um amplo espectro de gravidade. Assim, em pacientes que se apresentam para uma reoperação após uma correção primária, é vital reconhecer a combinação de componentes individuais que falhou, para maximizar o resultado numa reoperação. Há também uma maior taxa de fistulização recorrente e estenoses devido à redução da vascularização tecidual.
Outro aspecto crítico a ter em mente é que a população de pacientes que necessitam de uma reparação secundária tende a ser mais velha, com estudos destacando um grau significativo de comorbidade psicológica e transtornos do neurodesenvolvimento.1,2 A maioria dos ‘aleijados’ por hipospádia teria tido, em média, mais de três tentativas fracassadas de uretroplastia, e o insucesso tende a ocorrer muitos anos após alcançar um resultado inicial satisfatório.3 Anthony Mundy descreveu a magnitude desse desafio no manejo dessas coortes de pacientes em sua revisão editorial. Ele enfatizou que é quase impossível escrever um bom artigo de periódico científico sobre falha de reparação de hipospádia.4 Ao reconhecer as complicações após uma reparação primária de hipospádia, não se pode adotar uma abordagem ‘tamanho único serve para todos’, mas requer-se uma abordagem individualmente personalizada. Este capítulo delineia a incidência e os fatores predisponentes e propõe um algoritmo geral de manejo para crianças que necessitam de reoperação de hipospádia. Além disso, será descrita a técnica cirúrgica preferencialmente utilizada em nossa instituição. Este capítulo também revisará estratégias alternativas para cada uma das complicações individuais comuns que subsequentemente levam à necessidade de uma reoperação.
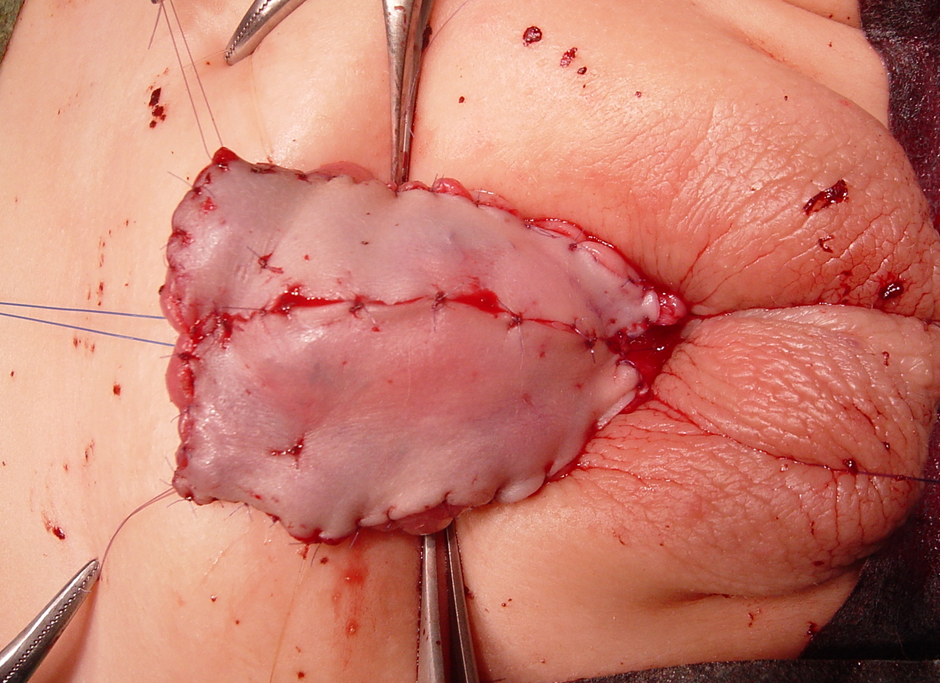
Figura 1 Enxerto cutâneo prepucial com suturas de quilting em uma correção de hipospádia em 1º estágio. Observe a glande do pênis, que foi dividida e mantida amplamente aberta.
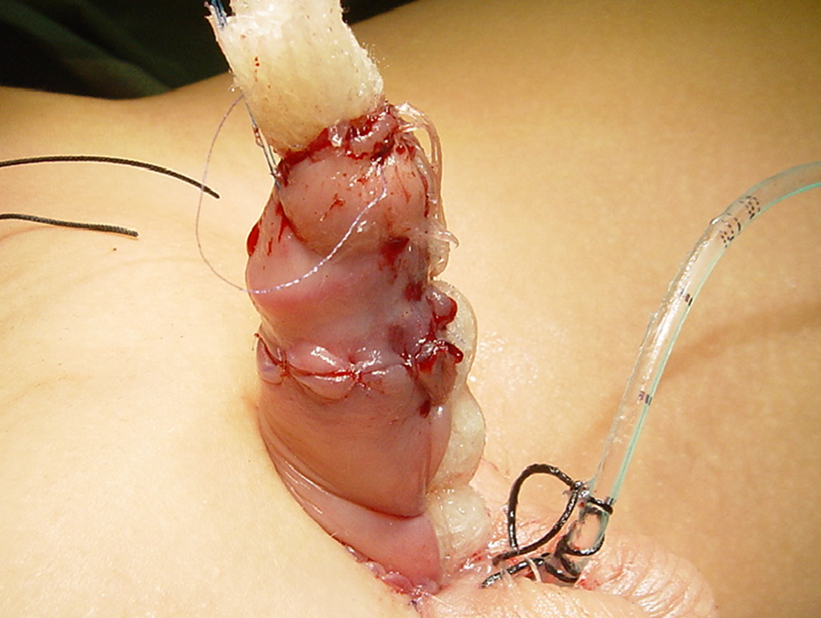
Figura 2 Jelonet enrolado, fixado para proporcionar umidade e imobilizar o enxerto cutâneo.
Incidência
Reoperações dependem principalmente de dois fatores críticos: o volume de casos da instituição e a experiência técnica do cirurgião responsável. Portanto, essa incidência varia amplamente entre os centros. Barbagli et al relataram, em sua análise retrospectiva de uma única coorte de adolescentes, que 50% dos pacientes com estenose uretral peniana tinham histórico de falha de correção de hipospádia. Da coorte, 16,4% haviam sido submetidos a cirurgia por hipospádia distal primária, e a maioria havia passado por mais de uma operação para corrigir o defeito primário. Em termos demográficos, 21,2% dos pacientes tinham entre 1 e 16 anos, e 38,4% tinham entre 17 e 20 anos.5 Esses achados ressaltaram a necessidade de seguimento a longo prazo e enfatizaram a necessidade de uma transição eficaz dos cuidados.
Fatores de Risco
As complicações da uretroplastia são duas vezes mais frequentes em pessoas que se submetem a uma segunda uretroplastia por hipospádia, em comparação com aquelas reparadas primariamente. Esses riscos aumentam para 40% com três ou mais novas reoperações.6 A etiopatogenia da falha na correção de hipospádia é multifatorial. Infecção pós-operatória, extravasamento de urina, tecidos cicatriciais residuais, hematoma e técnicas cirúrgicas inadequadas contribuem para a cicatrização tecidual prejudicada e isquemia do enxerto. Os tecidos ventrais cicatrizados, combinados com a falta de tecido circundante em hipospádias reparadas secundariamente, predispõem os pacientes a um desfecho desfavorável.7 Teoricamente, a discrepância entre o crescimento da neouretra reconstruída e o surto de crescimento do tecido cavernoso circundante no início da puberdade pode potencialmente resultar em um tubo curto e estreito e manifestar-se como uma estenose. Na população pediátrica, reconhece-se que maior idade no momento da correção está associada a um risco mais elevado de complicações.8 A nossa opinião é que um cirurgião experiente em hipospádia deve realizar a correção secundária em um centro de alto volume. Há evidências de que o volume cirúrgico se correlaciona positivamente com os desfechos dos pacientes, especialmente nesse grupo de pacientes.9
Diagnóstico
A avaliação clínica dos pacientes não difere muito daquela dos que se apresentam primariamente com hipospádia. Os detalhes operatórios de cirurgias prévias são imprescindíveis se os pacientes vierem de um centro diferente. Ao considerar o reparo, deve-se documentar a localização do meato, o volume da glande, o comprimento peniano, a curvatura peniana recorrente (se houver), a profundidade e a largura da placa uretral. Outras considerações igualmente críticas são a extensão do tecido cicatricial e a disponibilidade de áreas doadoras para enxerto, caso seja adotada uma abordagem em dois tempos. Um exame físico minucioso é obrigatório e deve ser documentado em detalhes, sendo raramente necessária avaliação radiológica adicional. As características do paciente e a preferência técnica e a experiência do cirurgião terão papel na escolha do tipo de reparo. Por fim, os potenciais riscos e benefícios do reparo secundário devem ser discutidos junto com os pais, como parte de um processo de tomada de decisão compartilhada.
Planejamento perioperatório
Realizar uma reoperação para hipospádia é tecnicamente desafiador e está associado a taxas mais altas de complicações. O desfecho funcional sempre terá prioridade sobre a estética, o que deve ser comunicado de forma clara. A localização meatal “normal” é amplamente considerada a ponta distal da glande. No entanto, foi relatada variação significativa da localização do meato que preserva a função sexual e miccional ao longo da vida adulta em homens com hipospádia não tratada.10 Além do local do meato, um estudo constatou que homens com hipospádia “mais leve” ou distal, não tratada, relatam dificuldades na relação sexual, principalmente associadas à curvatura peniana, mas sem problemas urinários significativos em comparação com homens normais.10 Considerando o resultado do estudo e aplicando-o ao contexto de reparações secundárias, a correção da curvatura (chordee) seria a principal consideração. Se uma abordagem cirúrgica em dois estágios for considerada, recomenda-se um intervalo mínimo de 6 meses entre os procedimentos para permitir a cicatrização adequada da ferida. Adjuvantes para apoiar a cicatrização tecidual em reoperações de hipospádia foram relatados na literatura, especialmente injeções de nitroglicerina e oxigenoterapia hiperbárica para aumentar a vascularidade tecidual e promover a cicatrização.11 No entanto, essas terapias de suporte ainda não obtiveram ampla aceitação. Em crianças com glande peniana pequena e falo curto, há um debate contínuo na comunidade sobre o uso de estimulação androgênica pré-operatória. Alguns defendem seu uso em hipospádia grave para aumentar o comprimento do falo, a circunferência da glande, a vascularização peniana e a robustez tecidual, que são essenciais em qualquer reoperação. Contudo, evidências conflitantes sugerem que a estimulação hormonal pré-operatória está associada a taxas aumentadas de complicações na hipospádia proximal, embora sem significância estatística.12
Antibióticos
Defendemos cobertura antibiótica em reoperação de hipospádia para minimizar o risco de infecções do sítio cirúrgico e do trato urinário. Deve ser colhida uma urocultura pré-operatória, e a presença de bacteriúria deve ser tratada com base na cultura e sensibilidade. Apesar de estudos não encontrarem diferença significativa nas infecções do sítio cirúrgico e do trato urinário com ou sem profilaxia antibiótica pré-operatória,13,14 utilizamos co-amoxiclav (amoxicilina/ácido clavulânico 30 mg/kg) por via intravenosa como antibiótico de primeira escolha. Em seguida, ele é mantido por via oral no período pós-operatório por uma semana, até que o cateter e o curativo sejam removidos. Nossa prática está, em geral, alinhada com o estudo que relatou que 91% dos urologistas pediátricos prescrevem antibióticos no pós-operatório quando um cateter uretral é mantido no local.15 Embora debatível, uma metanálise recente que avaliou os efeitos da profilaxia antibiótica pós-operatória após o reparo da hipospádia encontrou utilidade limitada na prevenção de infecções e complicações de cicatrização de feridas, embora o risco de viés fosse alto em muitos dos estudos.16,17 Apoiar a recuperação dos pacientes com analgesia adequada é essencial, pois geralmente será necessária uma dissecção tecidual mais extensa com reconstrução mais complexa. O bloqueio caudal é a escolha mais comum para o controle da dor perioperatória. Alternativamente, bloqueios de nervos periféricos (bloqueio do nervo dorsal do pênis e bloqueio do nervo pudendo) também podem ser utilizados. As evidências permanecem inconclusivas quanto à escolha da analgesia e sua relação com o desfecho pós-operatório em correções de hipospádia.18,19
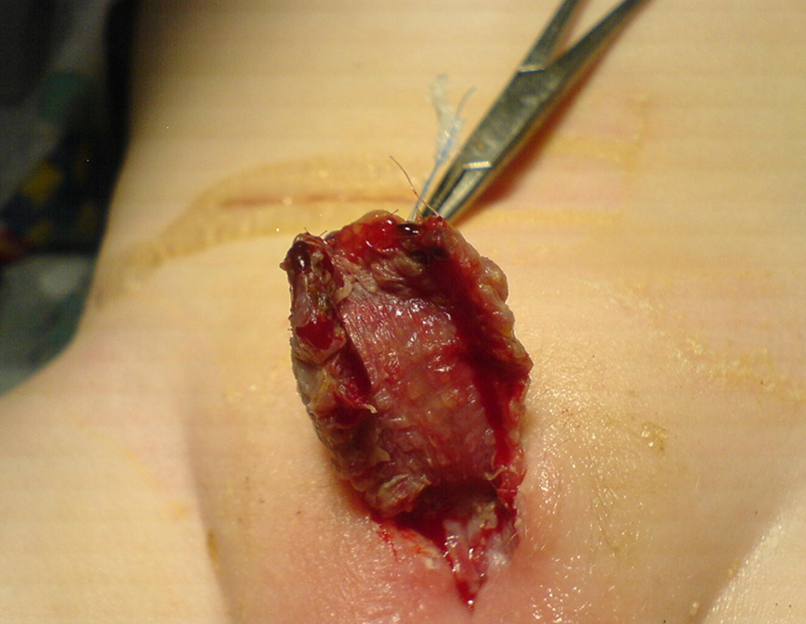
Figura 3 Aspecto do enxerto de pele uma semana após a cirurgia. O cuidador familiar deve continuar a massagear o enxerto com vaselina ou pomada de manteiga de cacau para otimizar a cicatrização e prevenir a contratura do enxerto.
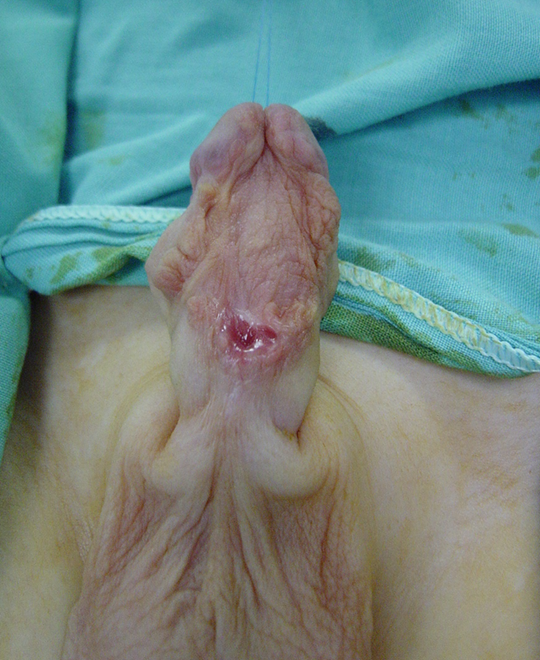
Figura 4 Aspecto do enxerto de pele 6 meses após o 1º estágio da correção. Boa cicatrização, sem evidência de contratura do enxerto. Está pronto para o 2º estágio da correção.
Técnicas Cirúrgicas
Abordagens diferentes para técnicas de resgate foram relatadas na reoperação de hipospádia, incluindo uretroplastia com placa incisa tubularizada (TIP), a técnica de Mathieu, retalhos em ilha onlay tubularizados (OIF) e enxertos livres, realizadas em abordagem de estágio único ou em dois estágios. Independentemente das diferentes técnicas, devem-se sempre aplicar os princípios gerais de cirurgia e reparo. Uso mínimo de cautério, suturas sem tensão, enxertos ou tecidos adjacentes bem vascularizados e múltiplas camadas com fechamento estanque minimizarão as complicações potenciais habituais. Uma uretroplastia TIP pode ser uma opção em reparo de estágio único se a placa uretral estiver presente e for suficientemente larga. Snodgrass e Lorenzo relataram sua experiência inicial com o uso de uretroplastia TIP na reoperação de hipospádia. Eles incluíram 15 pacientes, com seguimento médio de 5 meses. Obtiveram um meato cosmeticamente normal em 13 de 15 pacientes, e as complicações incluíram duas fístulas e uma deiscência da glande.6 Shanberg e colegas relataram uretroplastia TIP em 13 casos de reoperação, com seguimento médio de 22 meses. Os resultados cosméticos foram excelentes, com duas complicações: um paciente com deiscência da glande e fístula uretrocutânea, e um segundo paciente que desenvolveu estenose meatal.20 Uma placa uretral marcadamente cicatrizada que contribui para a curvatura peniana deve ser excisada e substituída por um enxerto de mucosa bucal para reparo em dois estágios, como preconizado por Bracka.21
Bracka popularizou a correção em dois tempos na cirurgia da hipospádia como uma solução potencial para as altas taxas de complicações observadas após uma abordagem em tempo único. Ele relatou a série mais extensa na literatura, com seiscentos casos (457 crianças e 143 adultos), dos quais 34.8% eram correções secundárias. No total, 3.7% necessitaram revisão do primeiro tempo. A taxa de fístula uretrocutânea foi de 10.5% nas cirurgias de resgate, enquanto a taxa de formação de estenose uretral foi de 7%.22 Hayes et al relataram o uso de enxertos bucais em correções em múltiplos tempos em 25 pacientes (adultos e crianças) com falha prévia da correção de hipospádia. 22% necessitaram revisão do primeiro tempo, enquanto apenas um paciente (4%) desenvolveu uma fístula uretrocutânea.23 Barbagli et al estudaram 60 adultos com hipospádia secundária, dos quais 31 casos foram submetidos a correções em múltiplos tempos. Os enxertos bucais resultaram em 82% de sucesso em procedimentos em tempo único e 82% em procedimentos em múltiplos tempos. A taxa de fístula para operações em tempo único e em dois tempos foi de 10.3% e 6.5%, respectivamente.5 Kulkarni et al destacaram a maior incidência de contratura do enxerto de mucosa bucal em sua série de pacientes submetidos a correção em 2 tempos com BMGs (enxerto de mucosa bucal), o que motivou a mudança de técnica para uma abordagem híbrida.24
No Hospital Great Ormond Street for Children (GOSH), o nosso reparo em dois tempos combina técnicas descritas historicamente por Turner-Warwick, Duplay e Cloutier.25 No reparo de primeira etapa, a uretra cicatrizada é aberta ventralmente na linha média até tecido saudável e sangrante. Completa-se uma incisão de circuncisão em torno da coroa da glande, frequentemente coincidindo com a incisão prévia e deixando um manguito de mucosa proximal à glande. A área cicatrizada no interior da glande é então excisada, e a glande é aberta, exposta por uma incisão profunda na linha média, e depois descolando o tecido glandular do ápice. A uretra é prolongada até uma área saudável com tecido de bom calibre antes da excisão da neo-uretra distal e do tecido cicatricial. A neouretra falhada é excisada parcial ou totalmente até ao tecido saudável. A curvatura peniana é identificada por uma ereção artificial, usando um garrote e injeção de soro fisiológico, e é corrigida por uma combinação da libertação ventral da neo-uretra cicatrizada e plicaturas dorsais da túnica albugínea, quando indicado. É necessário confeccionar uma ampla abertura uretral proximal, e a pele do corpo do pénis é readaptada ao dorso do pénis. Isto deixa uma área cruenta variável na superfície ventral desde a abertura uretral até à ponta distal da glande e entre os bordos cutâneos. Se houver excesso de pele prepucial saudável, utilizamo-la de preferência a outros enxertos. No entanto, é habitualmente necessário recorrer a enxertos de locais alternativos. Estes são, geralmente, o enxerto cutâneo retroauricular (Wolfe), o enxerto de mucosa bucal da face interna da bochecha e enxertos compostos (enxerto de mucosa bucal mais prepúcio interno). O enxerto cutâneo de eleição é colhido e depois desengordurado antes de ser aplicado na área cruenta na superfície ventral do pénis. Os enxertos são geralmente retangulares (pelo menos 2 cm de largura), suturados circunferencialmente com 6/0 monocryl, e fixamo-los aos corpos penianos com suturas adicionais de capitonagem. Os enxertos são comprimidos contra o corpo do pénis usando um jelonet enrolado (gaze parafinada) e suturados no local unindo os bordos da pele do corpo por cima. Em seguida, cobrimos o pénis e aplicamos pressão adicional usando uma espuma e uma envoltura exterior de fita Elastoplast. Um stent gotejante ou um cateter de drenagem contínua é utilizado de acordo com a idade do doente (todos os doentes com menos de seis anos de idade terão um stent gotejante).
Antibióticos e anticolinérgicos serão administrados durante a primeira semana. O curativo é removido e o enxerto é inspecionado sob anestesia geral. Os pais são orientados a aplicar pomada de cloranfenicol no enxerto duas vezes ao dia por dez dias. Após revisão aos três meses no ambulatório, o procedimento de segunda etapa é planejado se o enxerto estiver satisfatório. Se não, será instituído um período de aplicação de pomada de dihidrotestosterona para amadurecer ainda mais o enxerto e estimular o crescimento peniano. Os procedimentos de segunda etapa são realizados não antes de seis meses, e a maioria dos casos é corrigida mais próximo de 1 ano. A placa uretral e a glande são fechadas ao redor de um cateter 8-Fr, usando suturas Monocryl 6-0. Aplica-se outro curativo de espuma com drenagem por cateter, antibióticos e anticolinérgicos por uma semana. Em seguida, o curativo é removido por nossa equipe de enfermagem na enfermaria (sem qualquer sedação). Os pacientes são acompanhados aos 3 e 12 meses no ambulatório.
Fístula uretrocutânea
A fístula uretrocutânea é uma das complicações mais comuns após a correção primária da hipospádia, com incidência relatada entre 5% e 15%. Os riscos reconhecidos incluem a idade no momento da correção, hematoma, necrose do enxerto, extravasamento urinário, infecção da ferida e a experiência do cirurgião responsável. Uma revisão retrospectiva multicêntrica de 591 pacientes, de Duarsa et al, concluiu que a drenagem suprapúbica reduz o risco de fístula uretrocutânea após a correção da hipospádia. Os autores postularam que a criação de uma derivação urinária temporária percutânea reduz a drenagem urinária para a neouretra e minimiza a reação tecidual, a mobilidade dos pontos e o risco de infecção.10 Também é vital excluir estenose do neo-meato distal ou isquemia da pele ventral. O manejo cirúrgico dependerá do tamanho do meato, do número de fístulas e da presença de estenoses concomitantes da neo-uretra. Kulkarni et al descreveram suas técnicas de reparo da fístula, nas quais, em casos de meato estreito com estenose uretral, a uretra é incisada ventralmente até que se observe uma uretra de bom calibre. Se a placa uretral tiver mais de 8 mm, realiza-se uma uretroplastia de aumento com enxerto em inlay dorsal em tempo único de Asopa. Se a largura for menor que 8 mm, emprega-se uma abordagem em dois tempos para tubularizar uma neouretra. Por fim, se a uretra for de bom calibre e sem obstrução distal, a fístula uretrocutânea pode ser fechada primariamente.24
Encurvamento Ventral Recorrente
A curvatura ventral (CV) é observada com mais frequência em pacientes que foram submetidos a uma plicatura dorsal, em contraste com um procedimento de alongamento peniano ventral. Outro fator contribuinte é a contratura da pele ventral cicatricial e do tecido fibroso periuretral. Flynn et al relataram o aparecimento tardio de curvatura peniana recorrente após a correção da hipospádia, após a puberdade. A maioria de seus pacientes relatou que a curvatura peniana estava associada ao crescimento do falo na puberdade. Eles postularam que a CV recorrente, especialmente em adolescentes, se deve à assimetria da parede dos corpos cavernosos, que pode ser secundária ao crescimento desproporcional da parede ventral hipoplásica dos corpos cavernosos ou da uretra reconstruída.26 Uma discrepância entre uma uretra ventral curta e os tecidos dos corpos cavernosos é crucial na curvatura ventral recorrente.27 Na maioria, uma curvatura ‘leve’ (inferior a 30 graus) pode ser corrigida por dissecção cutânea ou transecção da placa uretral. A maioria nos casos de reoperação de hipospádia precisará que uma desproporção subjacente dos corpos cavernosos seja abordada, com essencialmente duas opções: encurtar o lado longo ou alongar o lado curto. Entre pacientes com hipospádia em que o comprimento é crítico, provavelmente é melhor evitar a plicatura dorsal. As corporotomias ventrais transversas são preferidas nas curvaturas recorrentes, levando a um grau razoável de correção. Em casos de curvatura superior a 30 graus, uma correção em estágios iniciando com excisão da uretra e colocação de um enxerto dérmico nos corpos cavernosos, com cobertura por retalho de dartos e retalho cutâneo local, é uma opção que pode ser considerada.24
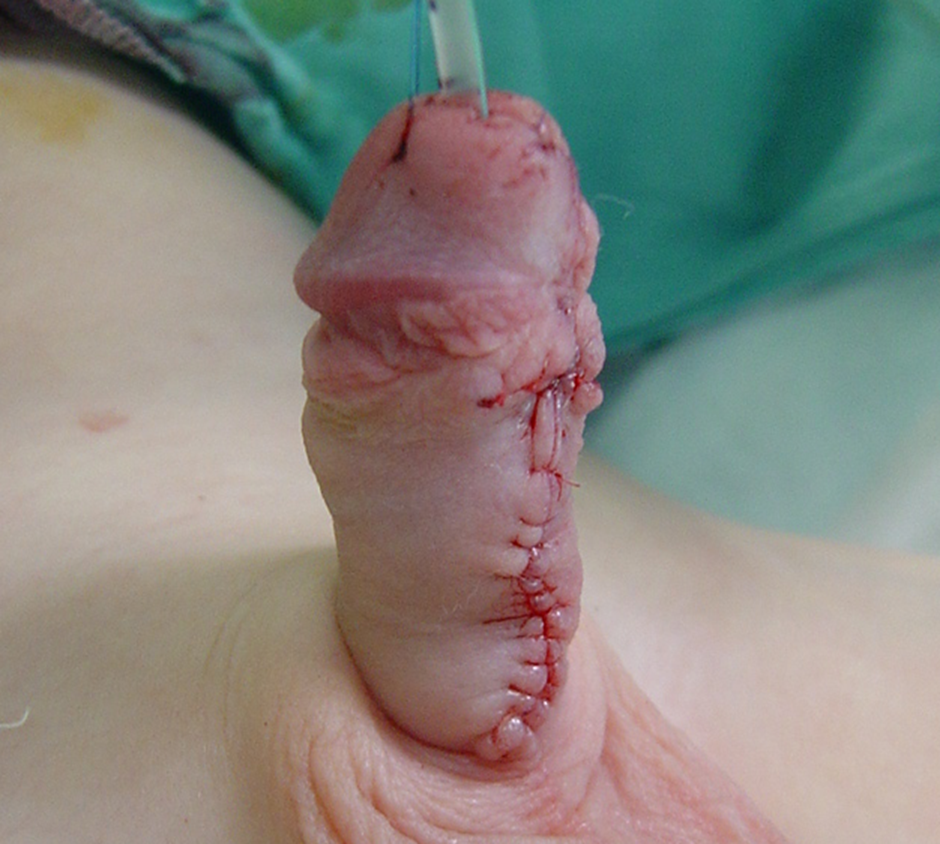
Figura 5 Aparência final após a tubularização ao final da correção em 2º estágio. O cateter será mantido por sete dias, seguido da remoção do curativo na enfermaria.
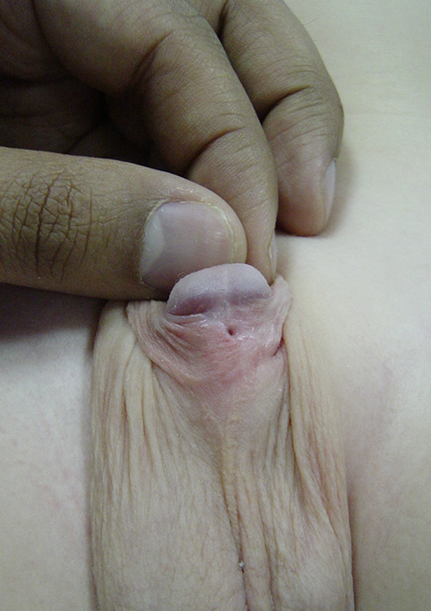
Figura 6 Presença de fístula uretrocutânea isolada após correção de hipospádia. É passível de excisão e fechamento simples da fístula
Cuidados pós-operatórios
A correção secundária de hipospádia no GOSH é realizada como um procedimento de internamento de um dia, com alta da criança no dia seguinte após observação durante a noite. Cateterizamos todos os meninos com uma sonda de alimentação macia 8-French e ela é fixada à glande com um ponto de fixação de prolene 4-0, que permanece no local por sete dias. O penso oclusivo envolvente otimiza a cicatrização pós-operatória ao promover imobilização, proteção do local cirúrgico, aderência tecidual e compressão. Atualmente, não há consenso sobre o tipo de penso mais eficaz ou sequer se a aplicação de um penso é benéfica. Um ensaio aleatorizado não encontrou diferença significativa nas taxas de complicações ou nos desfechos clínicos quando se compararam doentes com penso e sem penso. Importa notar que houve aumento significativo de chamadas pós-operatórias por parte dos pais no grupo sem penso.28 Seguindo a técnica de penso descrita anteriormente, colocamos fraldas duplas em crianças que ainda não têm controlo de esfíncteres. O cateter e o penso são removidos após sete dias, sob anestesia geral nas correções de primeiro tempo com enxerto e localmente na enfermaria após as correções de segundo tempo. Nas crianças mais velhas, uma sonda de Foley é ligada a um saco de drenagem. Prescrevemos antibióticos orais de acordo com a nossa política local de microbiologia e oxibutinina 0,2 g/kg uma vez ao dia até à remoção do cateter, para prevenir espasmos vesicais. O bloqueio caudal pré-operatório ajuda a atenuar a dor pós-operatória.29 O controlo adicional da dor é obtido com baixas doses de analgésicos AINE (anti-inflamatórios não esteroides).
Conclusão
A reoperação da hipospádia constitui um desafio cirúrgico para os cirurgiões que cuidam ativamente de crianças com hipospádia. Devido à baixa taxa de complicações e à reprodutibilidade da técnica, os autores defendem a correção em dois tempos para a reoperação da hipospádia. Ainda assim, se tudo falhar apesar das melhores tentativas, a uretrostomia perineal também pode ser considerada uma opção para preservar a qualidade de vida nesses pacientes. Há evidências de alta qualidade limitadas na literatura atual examinando os diversos aspectos do manejo cirúrgico da reoperação da hipospádia. Portanto, devem ser incentivados maiores esforços em pesquisas adicionais para melhorar os desfechos dos pacientes. A seguir, apresenta-se um esboço de um algoritmo simples para o manejo cirúrgico da reoperação da hipospádia.
Figura 7 Algoritmo de manejo proposto para hipospádia de reoperação ou reabordagem.
Recursos para a família
- Recursos sobre hipospádia, Children’s Hospital of Philadelphia
- Informações sobre urologia para pais e visitantes, Great Ormond Street Hospital for Children
Leituras recomendadas
- Shukla AR, Patel RP, Canning DA. Hypospadias. J Pediatr Urol: 103–126. DOI: 10.1385/1-59259-421-2:103.
- Chapter 15: Hypospadia Paediatric Urology WebBook, European Society of Paediatric Urology. 20AD: 227–256.
Referências
- Butwicka A, Lichenstein P, Landen M. Hypospadias and increased risk for neurodevelopmental disorders. Child Psychol Psychiatry 2015; 56 (2): 155–161.
- Jin TT, Wu WZ, Shen ML. Hypospadias and Increased Risk for Psychiatric Symptoms in Both Childhood and Adolescence: A Literature Review. Front Psychiatry 2022; 13: 799335. DOI: 10.3389/fpsyt.2022.799335.
- Craig W JR, C B, WO H, JM M, J.B.. Management of adults with prior failed hypospadias surgery. 2014; 3 (2): 196–204.
- Mundy AR. Failed hypospadias repair presenting in adults. Eur Urol 2006 (5): 774–776.
- Barbagli G, Perovic S, Djinovic R, Sansalone S, Lazzeri M. Retrospective descriptive analysis of 1,176 patients with failed hypospadias repair. J Urol 2010 (1): 207–211. DOI: 10.1016/s0084-4071(10)79536-1.
- Snodgrass WT. A Lorenzo Tubularized incised plate for hypospadias reoperation. BJU Int 2002; 89: 98–100. DOI: 10.1097/01.ju.0000125018.90605.a5.
- Al-Sayyad A, Pike JG, Leonard MP. Redo hypospadias repair: experience at a tertiary care children’s hospital. Can Urol Assoc J 2007; 1 (1). DOI: 10.5489/cuaj.39.
- Duarsa GWK, Tirtayasa PMW. Risk factors for urethrocutaneous fistula following hypospadias repair surgery in Indonesia. J Pediatr Urol 2020; 16 (3): 317.e1–317. DOI: 10.1016/j.jpurol.2020.04.011.
- Wilkinson DJ, Green PA, Beglinger S. Hypospadias surgery in England: Higher volume centres have lower complication rates. J Pediatr Urol 2017; 13 (5): 481.e1–481.e6.
- Fichtner J, Filipas D, Mottrie AM, Voges GE, Hohenfellner R. Analysis of Meatal Location in 500 Men: Wide Variation Questions Need for Meatal Advancement in All Pediatric Anterior Hypospadias Cases. J Urol 1995; 154 (2): 833–834. DOI: 10.1016/s0022-5347(01)67177-5.
- Dodds PR, Batter SJ, Shield DE, Serels SR, Garafalo FA, Maloney PK. Adaptation of Adults to Uncorrected Hypospadias. Urology 2008; 71 (4): 682–685. DOI: 10.1016/j.urology.2007.07.078.
- Chang C, White C, Katz A, Hanna MK. Management of ischemic tissues and skin flaps in Re-Operative and complex hypospadias repair using vasodilators and hyperbaric oxygen. J Pediatr Urol 2020; 16 (5): 672.e1–672.e8. DOI: 10.1016/j.jpurol.2020.07.034.
- Wright I, Cole E, Farrokhyar F, Pemberton J, Lorenzo AJ, Braga LH. Effect of Preoperative Hormonal Stimulation on Postoperative Complication Rates After Proximal Hypospadias Repair: A Systematic Review. J Urol 2013; 190 (2): 652–660. DOI: 10.1016/j.juro.2013.02.3234.
- Smith J, Patel A, Zamilpa I. Commentary to ‘Is parenteral antibiotic prophylaxis associated with fewer infectious complications stented, distal hypospadias repair?’ J Pediatr Urol 2017; 18 (6): 764. DOI: 10.1016/j.jpurol.2022.05.024.
- Baillargeon E, Duan K, Brzezinski A, Jednak R, El-Sherbiny M. The role of preoperative prophylactic antibiotics in hypospadias repair. Can Urol Assoc J 2014; 8 (7-8): 236. DOI: 10.5489/cuaj.1838.
- Hsieh MH, Wildenfels P, Gonzales ET. Surgical antibiotic practices among pediatric urologists in the United States. J Pediatr Urol 2011; 7 (2): 192–197. DOI: 10.1016/j.jpurol.2010.05.001.
- Chua ME, Kim JK, Rivera KC. Commentary to ‘The use of postoperative prophylactic antibiotics in stented distal hypospadias repair: a systematic review and meta-analysis.’ J Pediatr Urol 2019; 15 (2): 149. DOI: 10.1016/j.jpurol.2018.10.024.
- Zhu C, Wei R, Tong Y, Liu J, Song Z, Zhang S. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Tanseco PP, Randhawa H, Chua ME, Blankstein U, Kim JK, McGrath M, et al.. Postoperative complications of hypospadias repair in patients receiving caudal block vs. non-caudal anesthesia: A meta-analysis. Can Urol Assoc J 2019; 13 (8): 249–257. DOI: 10.5489/cuaj.5688.
- Retik AB, Borer JG. Primary and Reoperative Hypospadias Repair With the Snodgrass Technique. J Urol 1998; 16 (3): 1561. DOI: 10.1097/00005392-199910000-00122.
- Bracka A. Hypospadias repair: the two-stage alternative. Br J. Br J Urol 1995; 76: 31–41. DOI: 10.1111/j.1464-410x.1995.tb07819.x.
- Bracka A. The role of two-stage repair in modern hypospadiology. Indian J Urol 2008; 24 (2): 210–218.
- Hayes MC, Malone PS. The use of a dorsal buccal mucosal graft with urethral plate incision (Snodgrass) for hypospadias salvage. BJU Int 1999; 83 (4): 508–509. DOI: 10.1046/j.1464-410x.1999.00043.x.
- Kulkarni S, Joglekar O, Alkandari M, Joshi P. Redo hypospadias surgery: current and novel techniques. Res Rep Urol 2018; Volume 10: 117–126. DOI: 10.2147/rru.s142989.
- S JN, T N, K OM, M CP. The two-stage repair for severe primary hypospadias. Eur Urol 2006; 50 (2): 366–371.
- Flynn JT, Johnston SR, Blandy JP. Late Sequelae of Hypospadias Repair. Br J Urol 1980; 52 (6): 555–559. DOI: 10.1111/j.1464-410x.1980.tb03114.x.
- Abosena W, Talab SS. Moneer K Hanna Recurrent chordee in 59 adolescents and young adults following childhood hypospadias repair. J Pediatr Urol 2020; 162 (e1-162.e5). DOI: 10.1016/j.jpurol.2019.11.013.
- Van Savage JG, Palanca LG, Slaughenhoupt BL. A Prospective Randomized Trial Of Dressings Versus No Dressings For Hypospadias Repair. J Urol 2000: 981–983. DOI: 10.1097/00005392-200009020-00015.
- O’Kelly F, Pokarowski M, DeCotiis KN, McDonnell C, Milford K, Koyle MA. Structured opioid-free protocol following outpatient hypospadias repair - A prospective SQUIRE 2.0-compliant quality improvement initiative. J Pediatr Urol 2020; 16 (5): 647.e1–647.e9. DOI: 10.1016/j.jpurol.2020.06.012.
- Shukla AR, Patel RP, Canning DA. Hypospadias. J Pediatr Urol: 103–126. DOI: 10.1385/1-59259-421-2:103.
- Chapter 15: Hypospadia Paediatric Urology WebBook, European Society of Paediatric Urology. 20AD: 227–256.
Ultima atualização: 2025-09-21 13:35