4: Evaluación urodinámica pediátrica
Este capítulo durará aproximadamente 22 minutos para leer.
Introducción
La evaluación urodinámica de la función del tracto urinario inferior (TUI) comprende el uso de métodos de evaluación adecuados durante las fases de llenado vesical y miccional. La adecuada instrumentación de los estudios proporciona la comprensión fisiopatológica de entidades urológicas que pueden afectar a niños y adolescentes, con el objetivo de optimizar su manejo terapéutico.
La urodinamia pediátrica requiere personal capacitado que debe implementar una metodología adecuada en un entorno adaptado al universo pediátrico con el fin de manejar correctamente las situaciones de estrés y obtener la mayor cantidad posible de información urológica clínica.
El estudio urodinámico del LUT puede realizarse de forma invasiva o no invasiva. En general, la tendencia actual consiste en manejar las entidades de LUT con evaluación urodinámica no invasiva y utilizar métodos invasivos solo en caso de disfunción neurourológica o malformaciones urológicas complejas.
Evaluación urodinámica no invasiva
Las afecciones del tracto urinario inferior (TUI) en los niños abarcan un grupo de entidades con síntomas urinarios que se superponen. Estas afecciones son el resultado de trastornos en la fase de llenado, la fase de vaciado, o una combinación de ambas con distintos grados de compromiso. Los síntomas del TUI pueden observarse en hasta el 20% de los niños en edad escolar.1
La evaluación adecuada la determina el pediatra, y otros especialistas continúan con esta evaluación. Este abordaje se inicia cuando el niño tiene alrededor de 4 años de edad, y será más completo si se pueden obtener los siguientes datos:
- Diario miccional (2-3 días).2
- Escala de Bristol / criterios de Roma IV / trastornos gastrointestinales funcionales.3,4
- Cuestionarios (opcional): hábitos miccionales y defecatorios, ingesta de líquidos, calidad de vida.5
- Examen físico de los genitales, región lumbosacra, región glútea, periné, extremidades inferiores y reflejos.
- Análisis de orina / urocultivo: proteinuria / glucosuria.
- Uroflujometría / medición del residuo posmiccional (PVR).
- Electromiografía (EMG) del suelo pélvico con electrodos de superficie (parche)
- Ecografía del tracto urinario superior, características vesicales, signos de estreñimiento.
- Estudios urodinámicos / videourodinámicos (no requeridos a menos que los pacientes sean refractarios al tratamiento inicial).
- Cistouretrografía miccional (VCUG) para detectar reflujo vesicoureteral
Existe una variedad de cuestionarios para la evaluación y medición de la disfunción vesical e intestinal, la calidad de vida y las comorbilidades conductuales que incluyen indicaciones y posibles dificultades. El instrumento más útil será seleccionado por el médico considerando la evaluación clínica, el tiempo disponible y la población de pacientes en estudio.5
Los trastornos gastrointestinales funcionales en los niños se manifiestan de diversas maneras y pueden estar presentes en niños de 3 o 4 años de edad, y posteriormente asociarse a disfunción vesical e infecciones urinarias.6,7
Uroflujometría
La uroflujometría (con medición del residuo posmiccional) puede combinarse con la electromiografía del suelo pélvico (EMG) para confirmar la micción disfuncional con falta de coordinación entre el detrusor y el esfínter uretral. Los estudios urodinámicos se reservan para los pacientes refractarios al tratamiento inicial.8,9
La uroflujometría es un procedimiento no invasivo utilizado para medir el flujo urinario y se define como el volumen de orina que pasa a través de la uretra por unidad de tiempo, expresado en mL/s. Las variables evaluadas son la tasa de flujo máxima (Qmax), la tasa de flujo promedio (Qavg), el volumen total miccionado y el tiempo total de micción. Este método también muestra la morfología de la curva obtenida durante la micción. Un flujo normal se presenta como una curva en forma de campana (Figura 1). Es uno de los estudios iniciales utilizados para evaluar el vaciamiento vesical, ya que proporciona información sobre la contractilidad del detrusor y la vía de salida vesical. Con esta técnica es posible evitar pruebas invasivas y monitorizar las respuestas terapéuticas.
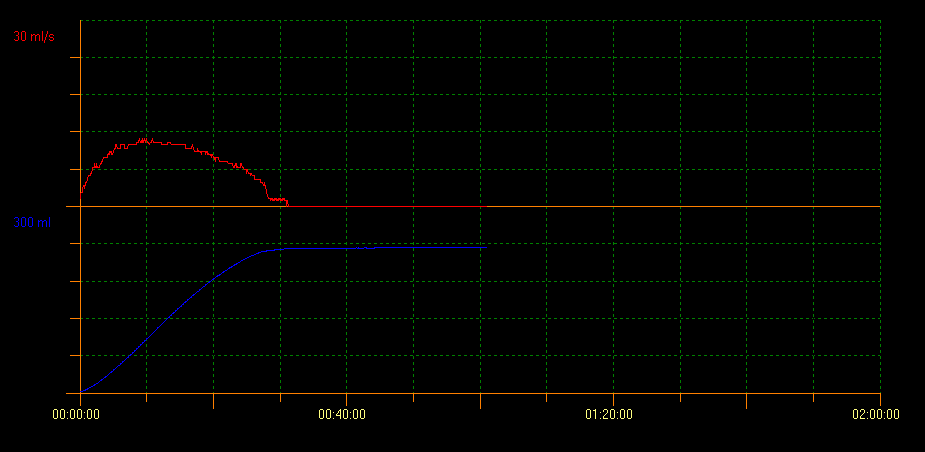
Figura 1 Flujo normal que muestra una curva en forma de campana
La uroflujometría con determinación del PVR mediante ecografía evalúa la capacidad de vaciamiento vesical. Con este método se pueden identificar varios patrones de curva que indican diferentes condiciones. Un patrón de curva en torre es indicativo de vejiga hiperactiva; un patrón de curva en staccato muestra micción disfuncional, y un patrón de flujo interrumpido puede ser sugestivo de vejiga hipoactiva. Un patrón de curva en meseta se observa generalmente en pacientes con obstrucción vesical anatómica (Figura 2, Figura 3, y Figura 4).10
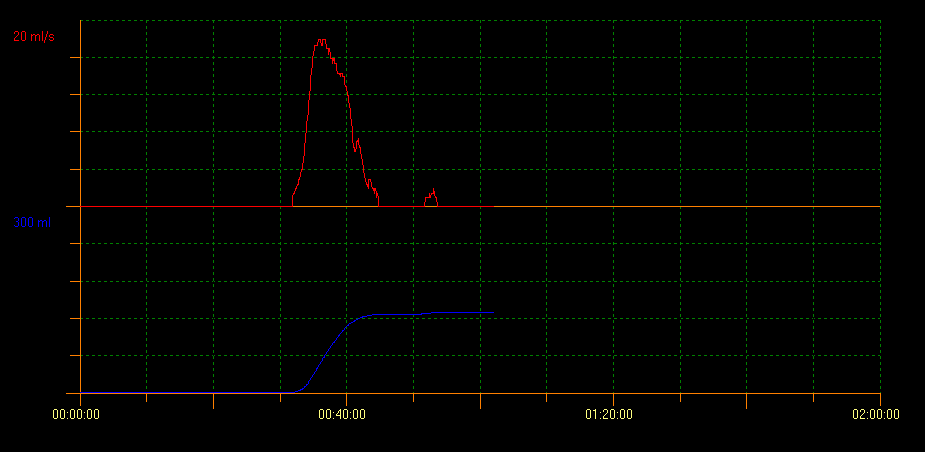
Figura 2 Patrón de curva en torre
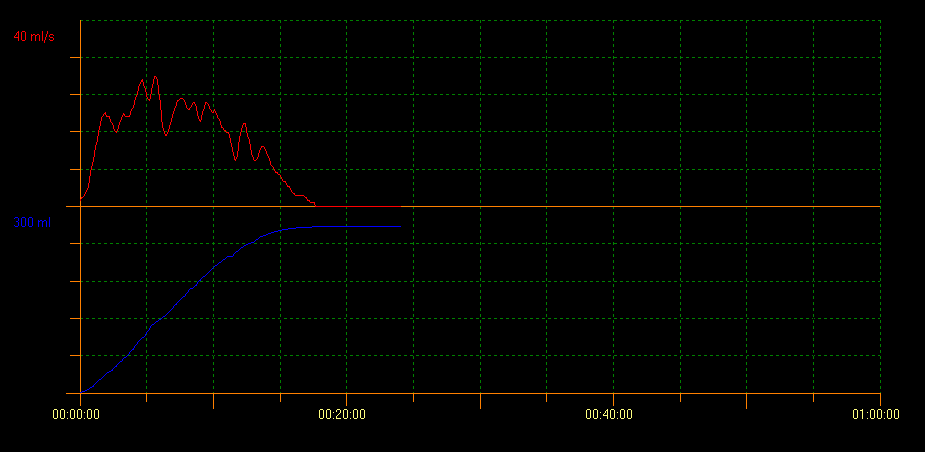
Figura 3 Patrón de curva tipo staccato
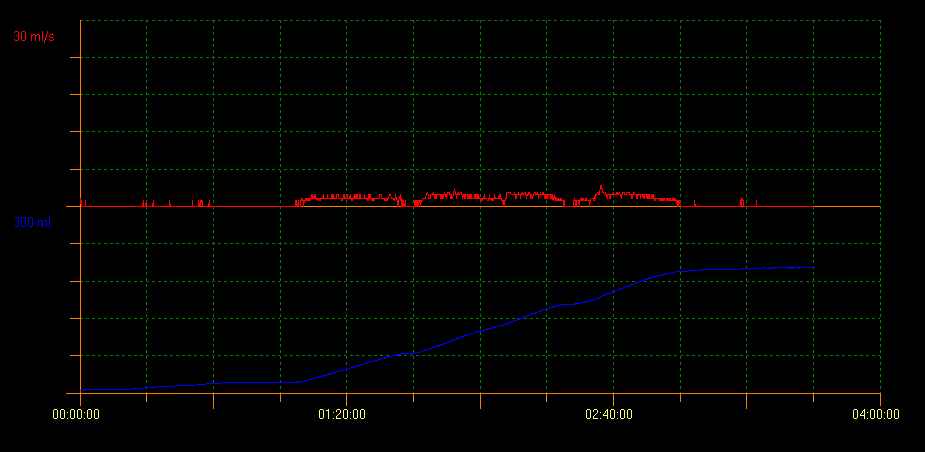
Figura 4 Patrón de curva en meseta
Existe una variabilidad interobservador considerable en los resultados, especialmente en el caso de pruebas de uroflujometría anormales, y esta es una de las principales limitaciones de esta herramienta. Franco et al desarrollaron el concepto de índice de flujo (FI). El FI se creó como una medida de la tasa de flujo real en relación con la tasa de flujo esperada: AQavg/EQavg o AQmax/EQmax) para obtener una evaluación cuantitativa del vaciamiento vesical. Así, el FI puede ayudar a predecir de forma fiable la tasa de flujo estimada dado un volumen urinario específico dentro de parámetros razonables; ayuda a comparar las tasas de flujo reales con las ideales y, por lo tanto, aporta mayor objetividad al análisis de las curvas.11 Un FI más alto es indicativo de una micción eficiente y de un patrón de curva en torre, mientras que un FI más bajo muestra una micción disfuncional y un patrón de curva en meseta.
Uroflujometría y EMG del suelo pélvico
Aunque el patrón de uroflujo en staccato es el más común observado en niños con diagnóstico de disfunción miccional, tal como se evidencia en una uroflujometría/EMG con hallazgos positivos durante la micción, casi un tercio de la población pediátrica presenta un patrón de uroflujo interrumpido o mixto en la disfunción miccional. Por lo tanto, es importante incorporar electrodos de EMG de superficie en el estudio de uroflujometría, especialmente cuando existe sospecha de disfunción miccional debida a disinergia detrusor-esfinteriana.12 La uroflujometría más EMG del suelo pélvico no solo es útil para diagnosticar trastornos específicos del tracto urinario inferior (LUT), sino también para monitorizar objetivamente la eficacia del tratamiento.13 Esto se muestra en Figura 5.
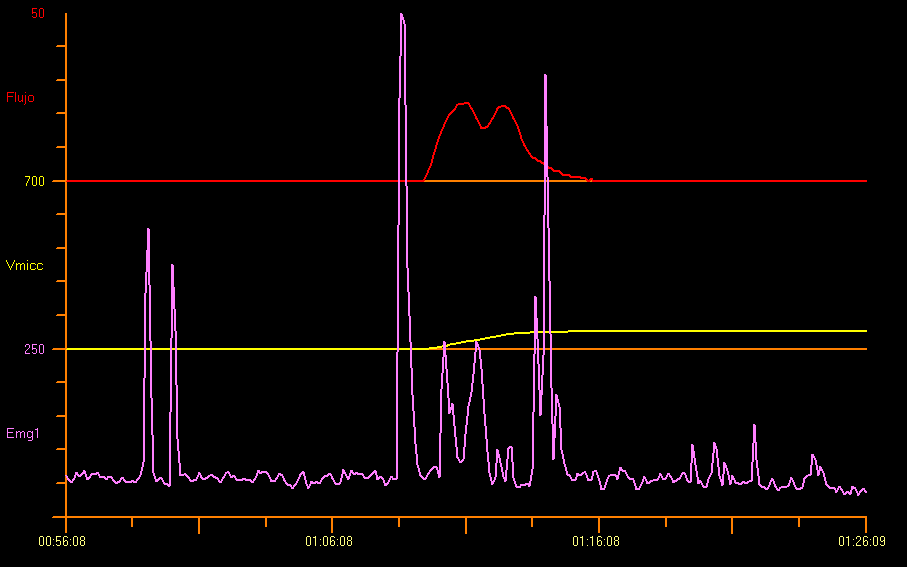
Figura 5 Uroflujometría y electromiografía perineal (EMG)
El tiempo de latencia en la EMG del suelo pélvico se define como el intervalo entre el inicio de la relajación del suelo pélvico y el inicio de la curva de flujo urinario. Esta medición no invasiva, expresada en segundos, no es útil para el cribado de afecciones como la disfunción primaria del cuello vesical, entre otras.13,14 Véase la Figura 6 para una explicación gráfica del tiempo de latencia.
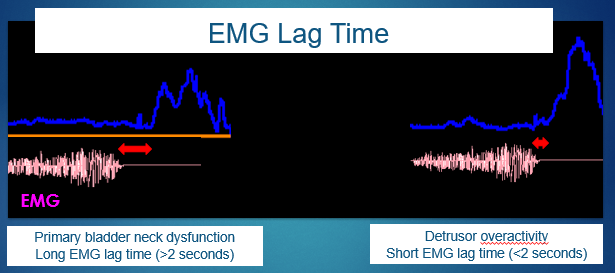
Figura 6 Tiempo de latencia de la electromiografía (EMG).
No obstante, aun considerando las limitaciones del uso de la EMG con electrodos de superficie, es posible correlacionar el FI y el tiempo de latencia de la EMG para definir el diagnóstico específico de las afecciones del tracto urinario inferior (LUT). Un tiempo de latencia cercano a 0 segundos se asocia con un FI mayor, lo que representa sobreactividad que se observa comúnmente en el patrón de flujo en torre. Sin embargo, los niños que presentan un tiempo de latencia superior a 6 segundos o incluso valores negativos de tiempo de latencia inferiores a 4 segundos mostraron un FI menor, lo que implica una micción hipoeficiente y un patrón de flujo en meseta.15
Residuo posmiccional en la ecografía
Las mediciones del residuo posmiccional en niños neurológicamente intactos son muy variables. En niños de 4–6 años un PVR único > 30 ml o > 21% de la capacidad vesical (BC), donde la BC se determina como volumen miccional (VV) + PVR y se expresa como porcentaje de la capacidad vesical esperada (EBC = [edad (años)+1] × 30 mL), se recomienda que se realice un PVR repetido con mediciones dobles, y un PVR repetido > 20 mL o > 10% BC se considera significativamente elevado. En niños de 7–12 años, un PVR único > 20 ml o 15% BC, o PVR repetido > 10 ml o 6% BC se considera elevado. Deben aplicarse condiciones estándar para medir el PVR: la vejiga no debe estar subdistendida (< 50%) ni sobredistendida (> 115%) en relación con la EBC, y el PVR debe obtenerse inmediatamente después de la micción (< 5 min).16
Cuando existe una afección del tracto urinario inferior (LUT), está indicada una ecografía del tracto urinario superior para descartar otras anomalías, como hidronefrosis y sistemas colectores dobles. Las alteraciones en la pared vesical, como engrosamiento, trabeculación o divertículos, pueden ser marcadores de una disfunción crónica del tracto urinario inferior (LUT).
Evaluación urodinámica invasiva—Cistometría
Los estudios urodinámicos no suelen utilizarse para evaluar los síntomas del tracto urinario inferior en niños neurológicamente íntegros, y rara vez aportan más información que justifique su uso. Estos estudios se utilizan cuando existen hallazgos patológicos en estudios no invasivos, si los tratamientos no son eficaces y cuando síntomas como la incontinencia o las infecciones urinarias se agravan.17
Sin embargo, los estudios urodinámicos invasivos se utilizan de forma rutinaria en la evaluación inicial, en el seguimiento de niños con vejiga neurógena debida a espina bífida, cuando existe sospecha de disfunción detrusor-esfinteriana neurógena (disrafismo espinal oculto), obstrucción (por válvulas uretrales posteriores), anomalías genitourinarias (extrofia, epispadias), disfunción vesical no neurógena o residuo posmiccional significativo de etiología desconocida.9
Durante la cistometría, se mide la relación presión/volumen intravesical para documentar la función de almacenamiento y vaciamiento. En la primera etapa del estudio, se obtienen estos datos: estabilidad del detrusor, presiones de punto de fuga, sensación vesical y capacidad vesical. En la fase de vaciamiento, se miden otros parámetros: presión miccional; presión de apertura del cuello vesical y del esfínter urinario; eficacia y sostenimiento de la contracción del detrusor; patrón de flujo urinario, y sinergia EMG. A través de un catéter rectal con balón, se evalúan los cambios de la presión abdominal y su influencia en la presión vesical.
Se utilizaron la estandarización y la nomenclatura definidas por las guías de la International Children's Continence Society (ICCS).9 La presión intravesical se mide con un catéter de doble lumen de 6 French colocado a través de la uretra. La presión intraabdominal se midió mediante un catéter de 8 French y un catéter con balón de vinilo colocado en el recto. La vejiga se llenó con solución salina al 0.9% a 37.5° Celsius a una velocidad de 5–10% de la capacidad vesical teórica o esperada del niño por minuto, hasta una velocidad máxima de 10 mL/min.
Se evalúan las siguientes variables urodinámicas: capacidad cistométrica máxima (MCC en mL); presión detrusora al final del llenado (Pdet en cm de agua) y presión de punto de fuga del detrusor (DLPP en cm de agua). Calculamos la capacidad vesical esperada (EBC) según la fórmula: 30 × (edad en años + 1) mL. Se definió capacidad vesical reducida como < 65% EBC.7 Definimos la capacidad cistométrica máxima cuando detenemos el llenado por las siguientes razones: contracción del detrusor con volumen significativo de fugas; fugas que exceden la tasa de llenado (> 10 ml / s); presiones de riesgo (> 40 cm de agua), reflujo vesicoureteral de alto grado en estudios videourodinámicos y dilatación del tracto urinario. La hiperactividad del detrusor se definió por la presencia de dos o más contracciones detrusoras mayores de 15 cm de agua.18 La micción vesical ineficiente se define por hipoactividad del detrusor o detrusor neurogénico acontráctil.7
Etapa previa a los estudios urodinámicos
Es importante explicar en detalle los procedimientos a los padres y a los pacientes y mostrarles la sala de urodinámica y el material que se va a utilizar. La instalación debe estar adaptada a los pacientes pediátricos y contar con personal capacitado para manejar a niños despiertos. El entorno ideal incluiría entretenimiento disponible, como juegos, tabletas, televisor y videojuegos según la edad. Además, conviene destacar la importancia de asegurarse de que el recto esté vacío, especialmente en el caso de los niños con estreñimiento.
Se recomienda iniciar el procedimiento con un urocultivo negativo obtenido como máximo 15 días antes. En los niños que van a iniciar el cateterismo intermitente limpio (CIC), puede no requerirse el urocultivo, ya que si existe bacteriuria asintomática, no se considera un factor de riesgo adicional y, en general, no requiere profilaxis antibiótica. La incidencia global de infecciones del tracto urinario (ITU) posteriores a estudios urodinámicos es baja (0,7%). Los pacientes sin urocultivo previo a someterse a estudios urodinámicos no presentan un aumento significativo de ITU.19
Si el paciente controla esfínteres, no está en un programa de CIC y tiene la vejiga llena, se realiza una uroflujometría libre con instrumentación previa. Estos datos complementarían el informe final sobre ese paciente.
La sedación con midazolam administrada por una de tres vías, oral, nasal o rectal, es un método seguro y eficaz y una opción práctica durante la cistometría, especialmente en el grupo de pacientes jóvenes que pueden sentirse asustados y estresados ante el procedimiento que se va a realizar. La mayoría de los pacientes están satisfechos con la aplicación de la sedación, según lo informado por Özmert. En ese informe, el grupo que recibió un inicio más rápido de la sedación y las dosis más bajas aplicadas por vía nasal tuvo resultados más favorables, a pesar de presentar escozor nasal, en comparación con el grupo que recibió sedación oral. Otra ventaja de la sedación fue que la cistometría se realizó en menos tiempo en los pacientes sedados en comparación con el grupo control, y la cistometría no se vio alterada por el midazolam.20 El hidrato de cloral como sedante se utiliza ampliamente en niños en procedimientos diagnósticos o terapéuticos. La solución oral es una alternativa eficaz y adecuada para la sedación en niños.21
Instrumentación urodinámica
En general, tras aplicar xilocaína como anestésico, se inserta un catéter transuretral de doble lumen de 6 French. En algunos casos, como en niños no colaboradores, aquellos con dificultades de comprensión o con sensibilidad uretral conservada, o aquellos con sospecha de obstrucción uretral (válvulas uretrales posteriores), la colocación de un catéter suprapúbico de doble lumen 24 horas antes de la prueba permite realizar mejor el estudio.22 También es posible colocar un catéter de doble lumen en una vesicostomía o una ureterostomía y luego cerrar el estoma con un catéter Foley con balón de silicona.
Los catéteres transuretrales y rectales deben fijarse con cinta adhesiva al orificio cutáneo y, mediante tubos de conexión, se conectan a los transductores de presión externos y se nivelan a la altura de la sínfisis púbica. Antes de colocar al paciente en posición sentada y tras limpiar la piel del periné, se conectan simétricamente dos electrodos de EMG de superficie, a izquierda y derecha del área perianal, con el fin de registrar la actividad de los músculos del suelo pélvico. Además, se coloca un tercer electrodo de referencia sobre una prominencia ósea. La cistometría de llenado se realiza generalmente en posición sentada; sin embargo, también es aceptable la posición supina o que el niño sea sostenido en brazos de la madre.23 Véase Figura 7 para un ejemplo de la posición.
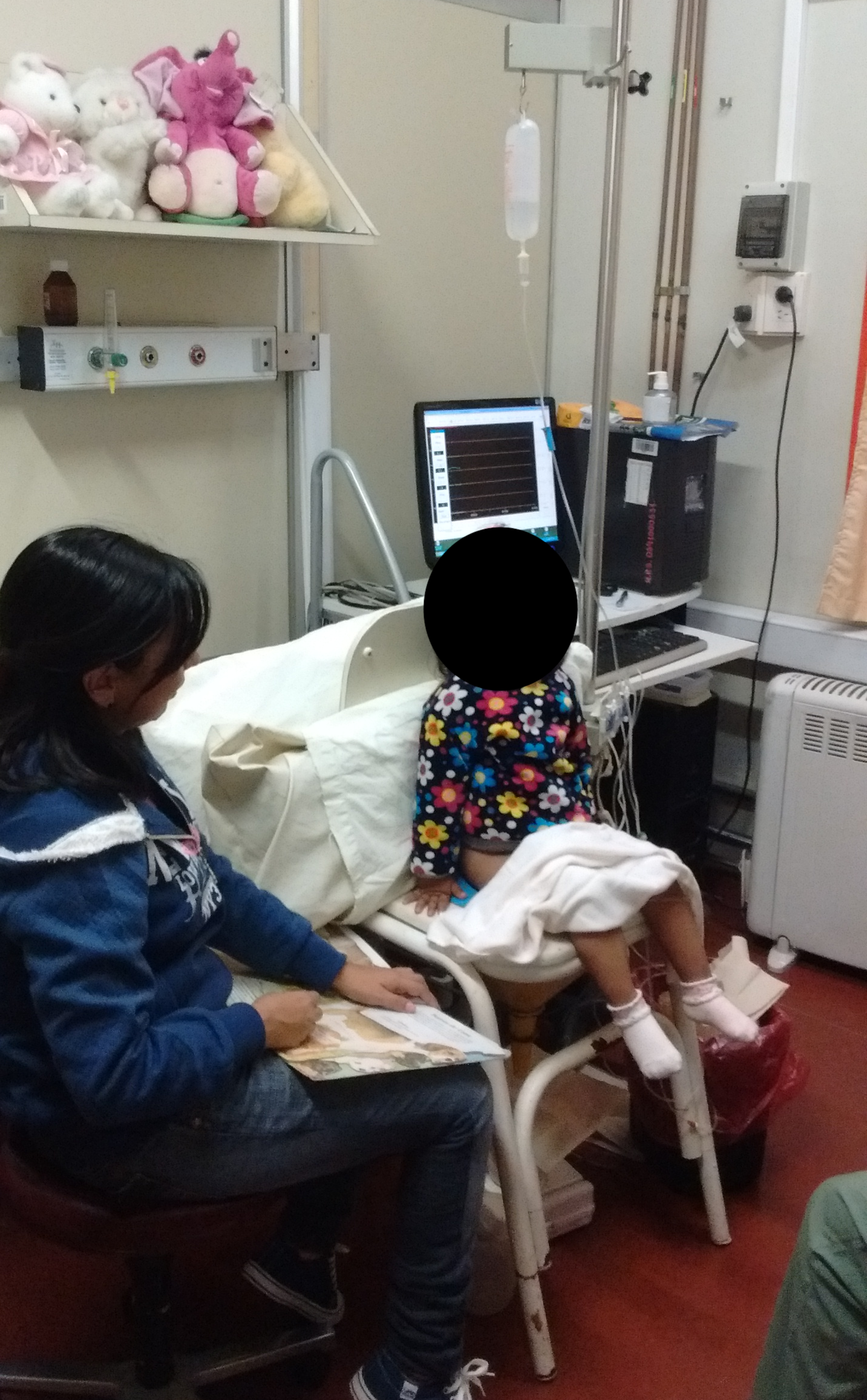
Figura 7 Posición del paciente
En niños neurológicamente íntegros y con edad suficiente para responder, la sensación de llenado debe determinarse siguiendo la secuencia estándar establecida por la ICS (Sociedad Internacional de Continencia): “primera sensación de llenado”, “primer deseo de orinar” y “deseo intenso de orinar”. Una vez finalizado el ciclo miccional y dependiendo de la calidad de la curva, deberíamos considerar si es necesario repetir la prueba. Una vez retirados los catéteres y los electrodos de EMG, se indica a los pacientes aumentar la ingesta de líquidos para disminuir el riesgo de infección del tracto urinario,23 y, en caso de presentar molestias, utilizar medicación analgésica.
Interpretación de los resultados urodinámicos
Es esencial saber que gran parte del tiempo del estudio se consume en la fase de llenado y una proporción menor del tiempo en la fase de vaciado. Ciclo vesical en Figura 8.
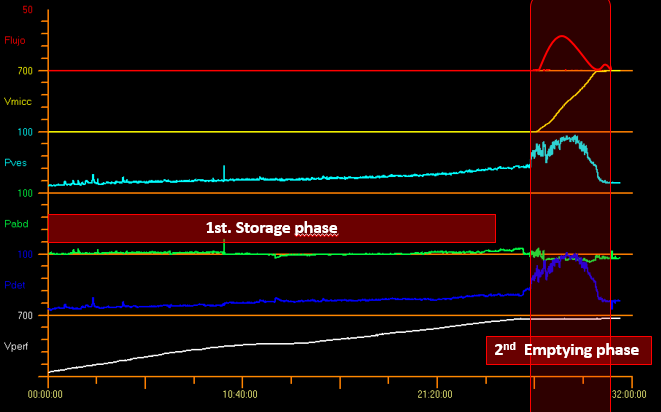
Figura 8 Ciclo vesical.
Fase de llenado
La sensación vesical puede ser un parámetro relevante solo en el caso de niños que son capaces de miccionar voluntariamente. A partir de los 4 años pueden documentarse los siguientes datos: “primer deseo de miccionar” y “fuerte deseo de miccionar”. El niño suele expresar un deseo normal de miccionar cuando flexiona los dedos de los pies. Además, la sensación vesical puede clasificarse como normal, aumentada (hipersensible), reducida (hiposensible) o ausente.
Los parámetros medidos durante la fase de almacenamiento incluyen: presión intravesical (Pves), presión abdominal (Pabd) y presión del detrusor (Pdet) donde Pdet = Pves - Pabd (Figura 8).
La presión detrusora de llenado (Pdet fill) es la presión detrusora durante la fase de llenado, y la presión detrusora alcanzada al final del llenado se denomina presión detrusora máxima (Pdet fill max). La elasticidad de la pared vesical, o distensibilidad de la pared, normalmente aumenta progresivamente durante la fase de llenado y puede calcularse con base en los puntos inicial y final de la tasa de llenado (considerando la presión en reposo en caso de hiperactividad detrusora). Así, la distensibilidad vesical se define como la relación entre el cambio de volumen vesical y el cambio de presión detrusora (C= ΔV/ΔP; valor normal: > 10 mL/cm H2O).24 El volumen instilado no tiene en cuenta la cantidad de diuresis real producida durante la prueba. Para integrar este volumen, la capacidad cistométrica máxima (MCC) se calcula con el volumen miccional y el volumen residual posmiccional. La variabilidad de la distensibilidad depende de varios factores tales como: la sección de la curva utilizada para el cálculo; la forma, el grosor y las propiedades mecánicas/viscoelásticas de la pared vesical; la capacidad de relajación del detrusor, la contractilidad y el grado de resistencia de la vía de salida vesical.25
Además, debe considerarse la forma de la curva de llenado, ya que aporta información sobre la laxitud vesical. Normalmente, la presión detrusora se mantiene relativamente estable durante el llenado vesical, lo que da como resultado una curva lineal. En condiciones patológicas, la curva de llenado es “no lineal”, con un aumento de la presión detrusora, y estos cambios deben documentarse.7 En general, hay poco o ningún cambio de presión durante la fase de llenado, cuando la complacencia está asegurada, pero no existen valores de corte para definir la complacencia patológica. En niños sin lesiones neuropáticas, la complacencia no debería exceder en 0.05 Y mL/cm H2O la presión vesical basal (Y= capacidad cistométrica [mL] según la edad). No hay informes en la literatura sobre la relación entre la capacidad vesical esperada (EBC) y la capacidad vesical cistométrica. No obstante, algunos autores sugieren que Pdet no debería superar 30 cm H2O en la EBC.26 En nuestro centro consideramos presiones patológicas desde 20 cm de agua hasta la capacidad vesical esperada (Figura 9).
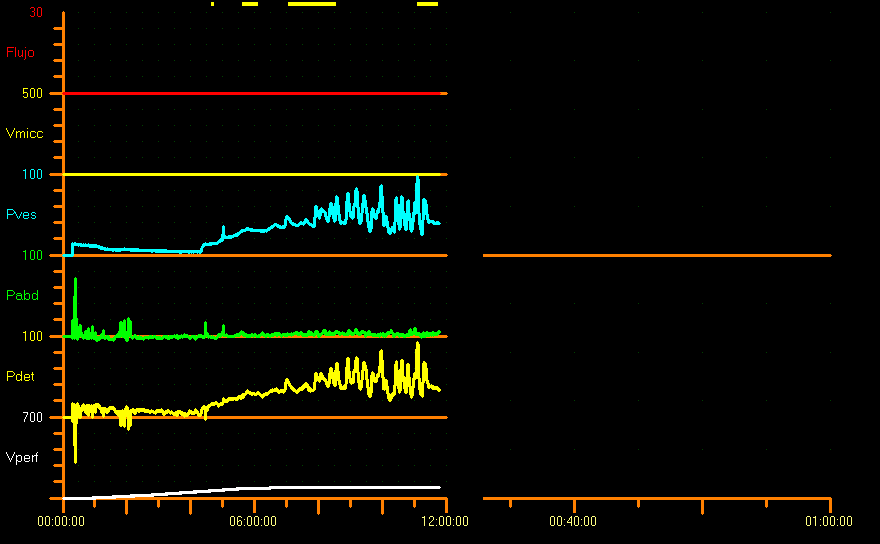
Figura 9 Patrón de complacencia reducida
Debido a esta limitación, podemos extrapolar y utilizar la presión detrusora alcanzada en la capacidad vesical esperada y Pdet fill max. Tarcan et al estudiaron las presiones vesicales en niños con mielomeningocele a los 3 años de edad y concluyeron que un valor de corte de DLPP de 20 cm H2O mostró una mayor sensibilidad en la predicción del daño del tracto urinario superior, mientras que una DLPP entre 20 y 40 cm H2O no fue confiable en términos de predicción del daño. Así, en el estudio de Tarcan, el 57.1% de los niños con DLPP entre 20 y 40 cm H2O, y el 62.2% de los niños con DLPP mayor que 40 cm H2O tenían un tracto urinario superior normal. Por lo tanto, el valor de corte de DLPP usado como único parámetro para predecir daño del tracto urinario en niños con mielomeningocele no es ni confiable ni preciso. Es probable que coexistan otros factores de riesgo, como baja capacidad vesical, baja distensibilidad de la pared vesical, presión de llenado elevada, disinergia detrusor-esfinteriana y adherencia al cateterismo vesical, entre otros.27
Cualquier aumento fásico de la presión detrusora durante la cistometría de llenado se define como hiperactividad del detrusor. Esta hiperactividad implica la presencia de dos o más contracciones del detrusor mayores de 15 cm H2O18 y puede ocurrir de forma espontánea o ser causada por la tos o por Credé. Este incremento o hiperactividad del detrusor puede ser neurogénica o idiopática, como en la Figura 10.28,29
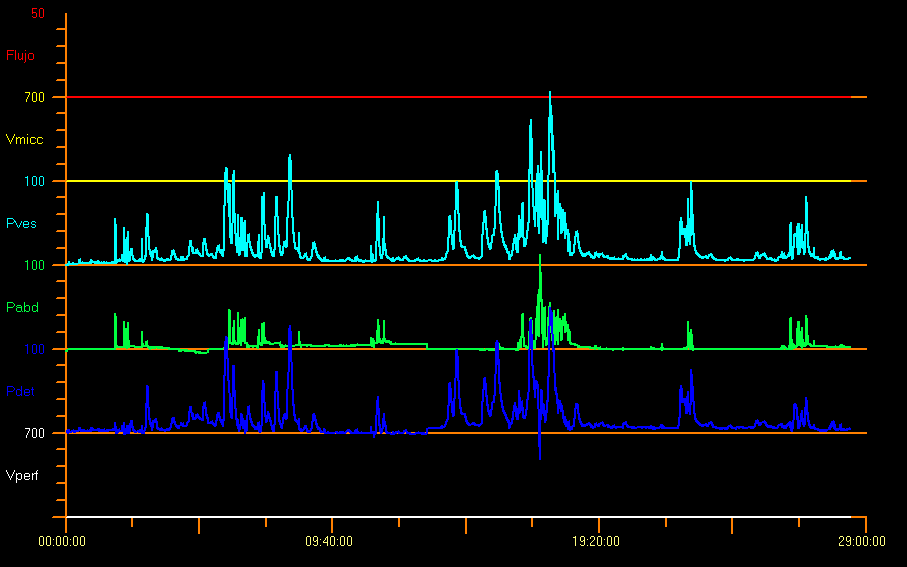
Figura 10 Patrón hiperactivo
También es probable que el niño no suprima completamente estas contracciones y, por lo tanto, se observe un aumento de la actividad EMG del suelo pélvico, como reflejo protector. Algunos factores desencadenantes, como toser, reír, caminar o saltar, pueden generar hiperactividad del detrusor. Sin embargo, la presencia de estas contracciones no implica necesariamente un trastorno neurológico. En el caso de los lactantes sin ninguna enfermedad, el 10 % de ellos presenta contracciones del detrusor. Cuando hay contracción del detrusor con poco esfuerzo o sin finalizar el llenado (cuando el llenado alcanza el 150 % de EBC), el músculo detrusor se vuelve hipoactivo.9
La presión del punto de fuga del detrusor (DLPP) indica la presión del detrusor más baja a la que se produce fuga de orina en ausencia de un aumento de la presión abdominal o de una contracción del detrusor. La presión del punto de fuga abdominal (ALPP) se refiere al valor más bajo de la presión intravesical que se incrementa intencionalmente (por ejemplo, debido a la tos) y que provoca fuga urinaria en ausencia de una contracción del detrusor. Una DLPP elevada (> 40 cm H2O) suele estar inducida por la disminución de la laxitud de la pared vesical. Una DLPP baja indica incompetencia esfinteriana.7 La incontinencia de esfuerzo está presente en adolescentes físicamente activos, cuando la ALPP es mayor que la presión uretral.30
A pesar de los estímulos, probablemente sea necesario retirar el catéter para que el niño pueda orinar. Si el volumen miccional es bajo, estamos ante una hipoactividad del detrusor debida a una obstrucción crónica de la salida vesical o a una lesión neuropática que progresa hacia un deterioro de la micción.7
Fase de vaciado
La micción normal se realiza con el inicio voluntario de una contracción del detrusor; es sostenida y no puede suprimirse fácilmente una vez que ha comenzado. Durante la micción, el detrusor puede clasificarse como normal, hipoactivo o acontráctil, es decir, no muestra ninguna actividad durante la micción. Si la falta de contractilidad tiene una causa neurológica se denomina arreflexia del detrusor. Se caracteriza por la ausencia completa de una contracción coordinada por los mecanismos de control nervioso. Cuando la contracción del detrusor es inadecuada en magnitud y duración para vaciar la vejiga de manera eficaz, estamos ante una hipoactividad del detrusor durante la micción.9
Algunos autores han informado de presiones muy superiores a lo normal en niños neurológicamente sanos de 1 mes de edad, con una presión detrusora media durante la micción de 127 cm H2O en varones y 72 cm H2O en niñas.31 Figura 11 muestra un estudio de ejemplo con obstrucción del tracto de salida vesical. Esto se debe probablemente a una actividad esfinteriana considerable y a un efecto relacionado con el catéter. En el caso de niños con miedo a orinar puede haber presiones miccionales elevadas, uroflujo interrumpido o PVR considerable.9
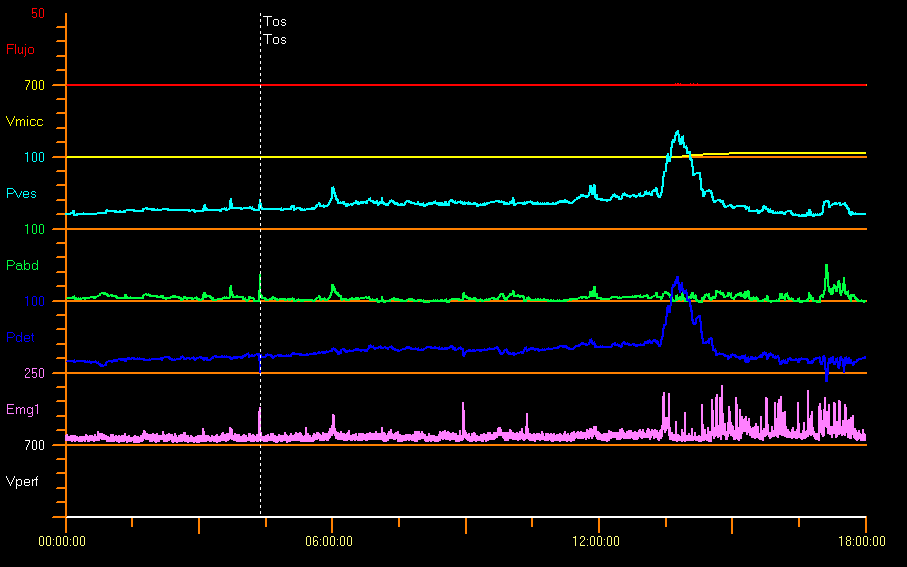
Figura 11 Obstrucción infravesical
Cuando existe obstrucción uretral anatómica (válvulas uretrales posteriores, estenosis uretral, ureterocele ectópico), hay una curva de uroflujo en meseta, con Qmax baja y constante, a pesar de la presión detrusora elevada y la relajación completa del esfínter uretral externo. Véase la sección de Uroflujometría.
La obstrucción funcional se debe a la contracción del esfínter uretral externo (constante o intermitente) durante la micción, que crea un segmento uretral estrecho. Es posible documentar la actividad del suelo pélvico con registros simultáneos de presión/flujo y EMG del suelo pélvico, utilizando electrodos de superficie.12,15
Videourodinámica
Los estudios videourodinámicos combinan los beneficios tanto de la cistouretrografía fluoroscópica como de la urodinámica convencional en un único sistema, lo que permite realizar la evaluación anatómica y funcional simultánea del tracto urinario. Figura 12 muestra la videourodinámica.
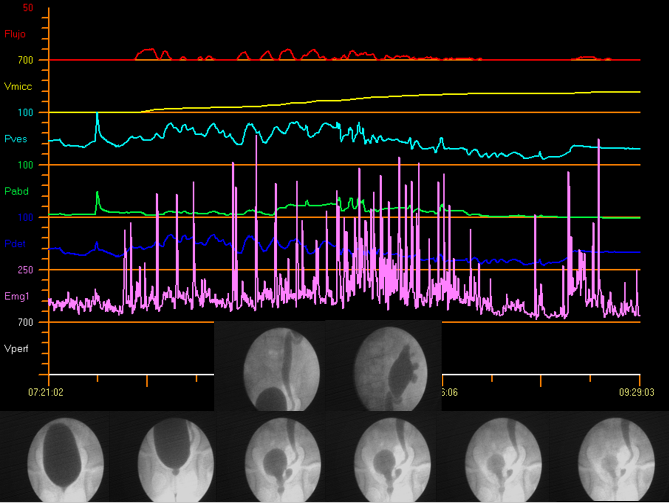
Figura 12 Videourodinámica
La radiología adyuvante se ha convertido en una herramienta útil en el diagnóstico diferencial. Además, facilita el análisis de imágenes con tecnología digital.32
Indicaciones para realizar estudios urodinámicos con video
Los estudios videourodinámicos están indicados cuando el diagnóstico no es claro después de realizar pruebas más simples o en el caso de pacientes con afecciones complejas tales como:
- Infecciones urinarias recurrentes: sospecha de reflujo vesicoureteral y síntomas urinarios como incontinencia urinaria.
- Malformaciones congénitas del tracto urinario: válvula uretral posterior; Síndrome de Prune-Belly.
- Divertículos vesicales múltiples; cirugías previas del tracto urinario.
- Antecedentes de tratamiento en el área pélvica: resección de tumores, quimioterapia o radioterapia.
- Sospecha o antecedente de obstrucción vesical.
- Sospecha de disinergia detrusor-esfínter (como en EMG).32
- Espina bífida; disrafismo espinal oculto.
- Parálisis cerebral; malformación anorrectal y mielopatías.
- Malformaciones espinales; escoliosis severa; agenesia sacra.
- Otras entidades inmunológicas y neurológicas.
- Evaluación renal pretrasplante y seguimiento de anomalías congénitas del riñón y del tracto urinario (CAKUT).
En nuestra evaluación inicial de pacientes con mielomeningocele (n:60), pudimos realizar estudios videourodinámicos en todos los pacientes, en promedio dentro de los primeros 8 meses de vida, y detectamos reflujo vesicoureteral en el 20% de los niños, hiperactividad en el 55%, hipertonía de la pared vesical en el 13% y PVR elevado en el 98%.33
Obtener la información adicional que proporciona la videourodinamia tiene un costo: los niños están expuestos a radiación. El peso del paciente y la capacidad vesical son predictores independientes de la exposición total a la radiación. Ser consciente de esta exposición puede ayudar al médico a utilizar la fluoroscopia con cautela y a asesorar mejor a los padres sobre la exposición a la radiación.34
Urodinámica no convencional
En 1996 De Gennaro demostró que es factible realizar monitorización urodinámica continua en niños y que tiene ventajas sobre la cistometría estándar en la evaluación de niños con vejiga neurógena incluso si se lleva a cabo a corto plazo (6 horas).35
Cuando no existe correlación entre los volúmenes del diario miccional (en condiciones de LUT) o del diario de cateterización vesical (en vejiga neurógena) y los resultados urodinámicos convencionales, existe un método opcional: la urodinamia con llenado espontáneo. Con esta modalidad no es necesario utilizar un llenado con líquido, pero el paciente debe permanecer más tiempo en el hospital, conectado al equipo urodinámico para ser monitorizado. Aunque una vez ingresado se indica iniciar hidratación, la duración del estudio es variable y, en general, finaliza cuando se produce un escape urinario. Durante el vaciamiento vesical, las presiones continúan midiéndose de manera alternante (verificación de presiones y vaciado), y luego se correlacionan con los volúmenes de forma inversa a la urodinamia estándar, hasta que finaliza la micción.
Urodinámica ambulatoria frente a convencional
La urodinámica convencional consiste en una evaluación altamente estandarizada. Sin embargo, al evaluar a los niños, la fiabilidad de las mediciones puede verse influida por los efectos del desarrollo y la variabilidad de los datos, así como por el entorno clínico poco familiar. La urodinámica ambulatoria proporciona una alternativa a estas limitaciones: requiere un llenado natural, se mide durante un período de tiempo prolongado y se lleva a cabo en un entorno amigable para los niños.
Lu et al identificaron diferentes patrones miccionales en la urodinámica ambulatoria en comparación con la urodinámica estándar, con falta de consistencia en el patrón miccional identificado con cada método.36 Quizás, al tener en cuenta la última evacuación intestinal, la cantidad de líquido ingerido previamente y la hora del día en que se realiza el estudio, se pueda explicar por qué se observaron patrones miccionales menos consistentes en los estudios urodinámicos ambulatorios.
Consideraciones finales
La mayoría de las entidades LUT pueden evaluarse con herramientas urodinámicas no invasivas y pueden manejarse con un tratamiento y seguimiento adecuados.
Para algunos niños, los estudios urodinámicos invasivos se viven como una situación estresante en un entorno poco amigable. Para contrarrestar este escenario y aprovechar todos los beneficios de una práctica invasiva, es esencial contar con personal profesional capacitado con la suficiente paciencia para apoyar a los niños y a sus familias.
Es fundamental que el equipo urodinámico y todos los demás profesionales involucrados conozcan las estandarizaciones y las nomenclaturas actualizadas de las entidades y las buenas prácticas urodinámicas, para comunicar e informar resultados en un lenguaje común. De este modo, la investigación proporcionará hallazgos más sólidos.
Referencias
- Linde JM, Nijman RJM, Trzpis M, Broens PMA. Prevalence of urinary incontinence and other lower urinary tract symptoms in children in the Netherlands. J Pediatr Urol 2019; 15 (2): 164.e1–164.e7. DOI: 10.1016/j.jpurol.2018.10.027.
- Lopes I, Veiga ML, Braga AANM, Brasil CA, Hoffmann A, Barroso U. A two-day bladder diary for children: Is it enough? J Pediatr Urol 2015; 11 (6): 348.e1–348.e4. DOI: 10.1016/j.jpurol.2015.04.032.
- Burgers RE, Mugie SM, Chase J, Cooper CS, Gontard A von, Rittig CS, et al.. Management of Functional Constipation in Children with Lower Urinary Tract Symptoms: Report from the Standardization Committee of the International Children’s Continence Society. J Urol 2013; 190 (1): 29–36. DOI: 10.1016/j.juro.2013.01.001.
- Robin SG, Keller C, Zwiener R, Hyman PE, Nurko S, Saps M, et al.. Prevalence of Pediatric Functional Gastrointestinal Disorders Utilizing the Rome IV Criteria. J Pediatr 2018; 195: 134–139. DOI: 10.1016/j.jpeds.2017.12.012.
- Chase J, Bower W, Gibb S, Schaeffer A, Gontard A von. Diagnostic scores, questionnaires, quality of life, and outcome measures in pediatric continence: A review of available tools from the International Children’s Continence Society. J Pediatr Urol 2018; 14 (2): 98–107. DOI: 10.1016/j.jpurol.2017.12.003.
- Lee LC, Koyle MA. The Role of Bladder and Bowel Dysfunction (BBD) in Pediatric Urinary Tract Infections. Curr Bladder Dysfunct Rep 2014; 9 (3): 188–196. DOI: 10.1007/s11884-014-0240-0.
- Austin PF, Bauer SB, Bower W, Chase J, Franco I, Hoebeke P, et al.. Faculty Opinions recommendation of The standardization of terminology of lower urinary tract function in children and adolescents: update report from the Standardization Committee of the International Children’s Continence Society. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2016; 35: 471–481. DOI: 10.3410/f.718270635.793500042.
- Schewe J, Brands FH, Pannek J. Voiding Dysfunction in Children: Role of Urodynamic Studies. Urol Int 2002; 69 (4): 297–301. DOI: 10.1159/000066129.
- Bauer SB, Nijman RJ, Drzewiecki BA, Sillen U. Faculty Opinions recommendation of International Children’s Continence Society standardization report on urodynamic studies of the lower urinary tract in children. Neurourol Urodyn 2015; 34 (7): 640–647. DOI: 10.3410/f.725510393.793507237.
- Tekgul S, Stein R, Bogaert G, Undre S, Nijman RJM, Quaedackers J, et al.. EAU-ESPU guidelines recommendations for daytime lower urinary tract conditions in children. Eur J Pediatr 2020; 179 (7): 1069–1077. DOI: 10.1007/s00431-020-03681-w.
- Franco I, Shei-Dei Yang S, Chang S-J, Nussenblatt B, Franco JA. A quantitative approach to the interpretation of uroflowmetry in children. Neurourol Urodyn 2016; 35 (7): 836–846. DOI: 10.1002/nau.22813.
- Wenske S, Van Batavia JP, Combs AJ, Glassberg KI. Analysis of uroflow patterns in children with dysfunctional voiding. J Pediatr Urol 2014; 10 (2): 250–254. DOI: 10.1016/j.jpurol.2013.10.010.
- Van Batavia JP, Combs AJ, Fast AM, Glassberg KI. Use of non-invasive uroflowmetry with simultaneous electromyography to monitor patient response to treatment for lower urinary tract conditions. J Pediatr Urol 2014; 10 (3): 532–537. DOI: 10.1016/j.jpurol.2013.11.015.
- Combs AJ, Grafstein N, Horowitz M, Glassberg KI. Primary Bladder Neck Dysfunction In Children And Adolescents I: Pelvic Floor Electromyography Lag Time–a New Noninvasive Method To Screen For And Monitor Therapeutic Response. J Urol 2005; 173 (1): 207–211. DOI: 10.1097/01.ju.0000147269.93699.5a.
- Ha JS, Lee YS, Han SW, Kim SW. The relationship among flow index, uroflowmetry curve shape, and EMG lag time in children. Neurourol Urodyn 2020; 39 (5): 1387–1393. DOI: 10.1002/nau.24349.
- Chang S-J, Chiang I-N, Hsieh C-H, Lin C-D, Yang SS-D. Age- and gender-specific nomograms for single and dual post-void residual urine in healthy children. Neurourol Urodyn 2013; 32 (7): 1014–1018. DOI: 10.1002/nau.22342.
- Bauer SB, Austin PF, Rawashdeh YF, Jong TP de, Franco I, Siggard C, et al.. International children’s continence society’s recommendations for initial diagnostic evaluation and follow-up in congenital neuropathic bladder and bowel dysfunction in children. Neurourol Urodyn 2012; 31 (5): 610–614. DOI: 10.1002/nau.22247.
- Tanaka ST, Yerkes EB, Routh JC, Tu DD, Austin JC, Wiener JS, et al.. Urodynamic characteristics of neurogenic bladder in newborns with myelomeningocele and refinement of the definition of bladder hostility: Findings from the UMPIRE multi-center study. J Pediatr Urol 2021; 17 (5): 726–732. DOI: 10.1016/j.jpurol.2021.04.019.
- Lopez Imizcoz F, Burek CM, Sager C, Vasquez Patiño M, Gomez YR, Szklarz MT, et al.. Pediatric Urodynamic Study Without a Preprocedural Urine Culture, Is It Safe in Clinical Practice? Urology 2020; 145: 224–228. DOI: 10.1016/j.urology.2020.07.054.
- Özmert S, Sever F, Tiryaki HT. Evaluation of the effects of sedation administered via three different routes on the procedure, child and parent satisfaction during cystometry. Springerplus 2016; 5 (1): 10 1186 40064–40016–3164–3167. DOI: 10.1186/s40064-016-3164-7.
- Chen Z, Lin M, Huang Z, Zeng L, Huang L, Yu D, et al.. Efficacy of Chloral Hydrate Oral Solution for Sedation in Pediatrics: a Systematic Review and Meta-Analysis [Corrigendum]. Drug Des Devel Ther 2022; Volume 16 (13): 3491–3492. DOI: 10.2147/dddt.s392339.
- Wagner AA, Godley ML, Duffy PG, Ransley PG. A Novel, Inexpensive, Double Lumen Suprapubic Catheter for Urodynamics. J Urol 2004; 171 (3): 1277–1279. DOI: 10.1097/01.ju.0000110761.60356.44.
- Wen JG, Djurhuus JC, Rosier PFWM, Bauer SB. ICS educational module: Cystometry in children. Neurourol Urodyn 2018; 37 (8): 2306–2310. DOI: 10.1002/nau.23729.
- Gilmour RF, Churchill BM, Steckler RE, Houle A-M, Khoury AE, McLorie GA. A New Technique for Dynamic Analysis of Bladder Compliance. J Urol 1993; 150 (4): 1200–1203. DOI: 10.1016/s0022-5347(17)35727-0.
- Chin-Peuckert L, Komlos M, Rennick JE, Jednak R, Capolicchio J-P, Salle JLP. What is the Variability Between 2 Consecutive Cystometries in the Same Child? J Urol 2003; 170 (4 Part 2): 1614–1617. DOI: 10.1097/01.ju.0000084298.49645.27.
- Landau EH, Churchill BM, Jayanthi VR. The sensitivity of pressure specific bladder volume versus total bladder capacity as a measure of bladder storage dysfunction. J Pediatr Surg 1994; 30 (5): 761. DOI: 10.1016/0022-3468(95)90736-x.
- Tarcan T, Sekerci CA, Akbal C, Tinay I, Tanidir Y, Sahan A, et al.. Is 40 cm H2O detrusor leak point pressure cut-off reliable for upper urinary tract protection in children with myelodysplasia? Neurourol Urodyn 2017; 36 (3): 759–763. DOI: 10.1002/nau.23017.
- Rosier PFWM, Schaefer W, Lose G, Goldman HB, Guralnick M, Eustice S, et al.. International Continence Society Good Urodynamic Practices and Terms 2016: Urodynamics, uroflowmetry, cystometry, and pressure-flow study. Neurourol Urodyn 2017; 36 (5): 1243–1260. DOI: 10.1002/nau.23124.
- Abrams P. Describing bladder storage function: overactive bladder syndrome and detrusor overactivity. Urology 2003; 62 (5): 28–37. DOI: 10.1016/j.urology.2003.09.050.
- Bauer SB, Vasquez E, Cendron M, Wakamatsu MM, Chow JS. Pelvic floor laxity: A not so rare but unrecognized form of daytime urinary incontinence in peripubertal and adolescent girls. J Pediatr Urol 2018; 14 (6): 544.e1–544.e7. DOI: 10.1016/j.jpurol.2018.04.030.
- Bachelard M, Sillén U, Hansson S, Hermansson G, Jodal U, Jacobsson B. Urodynamic Pattern In Asymptomatic Infants: Siblings Of Children With Vesicoureteral Reflux. J Urol 1999; 162 (5): 1733–1738. DOI: 10.1016/s0022-5347(05)68226-2.
- Marks BK, Goldman HB. Videourodynamics. Urol Clin North Am 2014; 41 (3): 383–391. DOI: 10.1016/j.ucl.2014.04.008.
- Sager C, Burek C, Corbetta JP, Weller S, Ruiz J, Perea R, et al.. Initial urological evaluation and management of children with neurogenic bladder due to myelomeningocele. J Pediatr Urol 2017; 13 (3): 271.e1–271.e5. DOI: 10.1016/j.jpurol.2016.12.024.
- Ngo TC, Clark CJ, Wynne C, Kennedy WA. Radiation Exposure During Pediatric Videourodynamics. J Urol 2011; 186 (4s): 1672–1677. DOI: 10.1016/j.juro.2011.04.014.
- De Gennaro M, Capitanucci M, Silveri M, Mosiello G, Broggi M, Pesce F. Continuous (6 Hour) Urodynamic Monitoring in Children with Neuropathic Bladder. Eur J Pediatr Surg 1996; 6 (S 1): 21–24. DOI: 10.1055/s-2008-1071032.
- Lu YT, Jakobsen LK, Djurhuus JC, Bjerrum SN, Wen JG, Olsen LH. What is a representative voiding pattern in children with lower urinary tract symptoms? Lack of consistent findings in ambulatory and conventional urodynamic tests. J Pediatr Urol 2016; 12 (3): 154.e1–154.e7. DOI: 10.1016/j.jpurol.2016.02.006.
Última actualización: 2025-09-21 13:35