23: 膀胱外翻管理的最新进展
阅读本章大约需要 7 分钟。
引言
膀胱外翻-尿道上裂复合体(EEC)涵盖广泛的先天性畸形,均源于相同的胚胎学缺陷,范围从单纯的龟头部尿道上裂到泄殖腔外翻。1
流行病学
膀胱外翻-尿道上裂-泄殖腔外翻复合体(BEEC)在高加索人群中更为常见。经典型膀胱外翻(BEX)是主要亚型(50%),发生于每 100,000 名活产儿中的 2.15 - 3.3 例,而泄殖腔外翻(CEX)为 1/200,000。近几十年来,随着胎儿医学的进步,诊断警觉性有所提高。2,3
存在男性占优势的情况,男:女比例据报道介于2.3-6:1。4 然而,泄殖腔外翻在两性中的发生率相同(1:1)。
膀胱外翻患者的死亡率较低(4%)。得益于外科技术的进步和当前的管理,这些患者的长期生存率极佳,报告显示患有 BEX 的女性和男性的生育力和性功能均有所改善。此外,CEX 儿童的生存率已从1960年的50%提高到如今的80%以上。
病因与发病机制
胚胎学
原始泄殖腔分隔为泌尿生殖窦和后肠发生在妊娠第一孕期,约与前腹壁形成同时。泄殖腔膜是位于胚盘尾端的双层膜,所占区域为脐下腹壁。在该双层泄殖腔膜的外胚层与内胚层之间,中胚层的长入促成下腹部肌群和骨盆骨骼的形成。间充质长入后,泌尿直肠隔向尾侧推进,将泄殖腔分为前方的膀胱和后方的直肠。远端处,该隔与双层膜的后部残余相接,后者最终穿孔并形成泌尿生殖与肛门开口。成对的生殖结节向内侧移行并在中线融合,在穿孔发生前位于背侧膜的头侧。下腹壁外胚层与内胚层之间的间充质细胞迁移失败会导致泄殖腔膜的不稳定性。5 在其向尾侧迁移之前,该膜的早期破裂会导致这一组脐下畸形的发生。脐下缺损的范围以及破裂发生时的发育阶段决定了最终表现为膀胱外翻、泄殖腔外翻或尿道上裂。如果在泌尿生殖道与胃肠道完全分离之后发生破裂,则出现经典型BEX。然而,若其发生在泌尿直肠隔下降之前,则下尿路和胃肠道远端会外翻,导致形成泄殖腔外翻(图 1)。
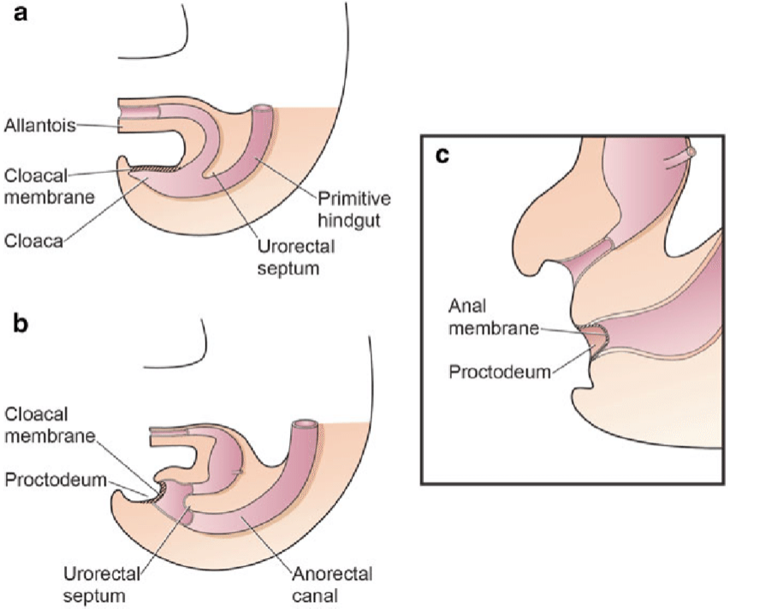
图 1 妊娠第4至第6周期间,泄殖腔分隔为前部原始尿生殖窦和后部直肠
Marshall 和 Muecke 所提出的、关于外翻的最相关胚胎发育理论6,将其基本缺陷描述为泄殖腔膜下部的异常过度发育,从而阻止间充质组织向中线迁移。因此,腹壁不能正常发育。该泄殖腔缺损破裂的时间决定了疾病的严重程度。导致经典型外翻的中央穿孔发生率最高(60%),而外翻变异型占 30%,泄殖腔外翻占 10%。
关于膀胱外翻-尿道上裂复合体的病因,还提出了其他理论。7,8 Ambrose 和 O’Brian9 认为,生殖小丘发育异常,使其在泄殖腔膜之下而非其上方于中线融合,从而导致外翻畸形。另一种假说描述为体柄尾侧附着异常,并伴随中线间充质组织未能介入。10 由于这种失败,泄殖腔未能移位至腹腔深部。持续处于脐下浅表位置的泄殖腔膜代表一种不稳定的胚胎状态,具有强烈的解体倾向。11 目前尚无任何一种理论能够阐明临床所见该复合体的所有方面,仍需进一步研究以全面描述最终形成膀胱外翻-尿道上裂复合体的发育过程。
病因
这种疾病的确切病因尚未明确。尽管如此,已证实其触发事件发生在妊娠早期。8 多项正在进行的研究提示这些疾病的发生可能具有遗传学基础。11 在妊娠早期接受大剂量黄体酮的母亲所生儿童的发生率更高,例如在辅助生殖治疗的情况下,据估计,在采用体外受精时,其发生率可高出至多7.5倍。11
复发风险
与 EEC 的表达相关的遗传因素可能发挥作用,这一推断基于受累个体子代复发风险的增加。8 在同胞中,Ives 等人 估计,在 BEX 病例的非近亲且未受累的父母所生子女中,复发风险约为 1%。12 Shapiro 等人.13 估计,欧洲背景人群中孤立性 BEX 患者的同胞复发风险为 1/275,他们调查了 2,500 个 CEB 家系。他们还描述了,与一般人群相比,受累个体的子代发生经典型 BEX 的风险增加了 400 倍。基于欧洲背景人群中孤立性 BEX 的患病率为 3.3:100,000 (~1:30.000),同胞的复发风险比计算为 108 (1:275/1:30.000 ~108)。14 虽然女性 EEC 患者占少数,但有趣的是,只有受累的女性才产生受累的子代。13 在其他解释之外,这种表面上受累女性更高的复发风险,可能归因于对 EEC 更高的遗传易感性(所谓 Carter 效应)。15
家族性复发
尽管家族聚集较为罕见,但已有报道的30个多发病例家系支持EEC存在遗传易感性的观点。16 在这些家系中的大多数,受累者为两名成员。然而,在少数情况下,EEC的遗传方式可能与外显率降低的常染色体显性遗传、常染色体隐性遗传或X连锁遗传相一致。17 这些观察提示,存在对表型具有主要效应的一个或多个基因,尽管在大多数情况下,表型的出现仍需要额外的致病因素。少数病例可能遵循孟德尔遗传,而在大多数情况下,EEC作为一种复杂性状遗传,其形成涉及多种遗传因素(可遗传的或*de novo *体细胞或生殖系突变),以及复杂的基因-基因或基因-环境相互作用。8
EEC 的分子遗传学
迄今为止,细胞遗传学和分子学分析在20例EEC患者中发现了染色体异常,尽管这些异常似乎都不是致病性的。8 在6例患者中观察到染色体数目异常。在另外4名BEX男性、1名BEX女性以及1名CEX女孩中,发现与唐氏综合征的关联。16 其中5例的性染色体非整倍体可能提示存在一个参与EEC形成的性染色体位点。已在6例EEC病例以及1例同时表现为CEX和Ito低色素症的患者中鉴定出结构异常。尽管这些病例均未确定精确的断点,但检测到数个涉及9号染色体q32至末端(q32-ter)区域的易位。
致畸因子与EEC
双生子研究和流行病学数据提示环境因素在EEC的病因学中起作用。然而,现有的流行病学研究尚未发现主要的致畸因素。4,12,18 多项研究已证实,男性、种族、父母高龄4以及经产次数增加,即使在校正年龄后,19都是易感危险因素。Gambhir 等.18 描述了围受孕期母亲的吸烟暴露在CEX患者中显著更为常见,较尿道上裂与经典BEX患者的合并组更为常见。多篇报告描述了由体外 *受精所生婴儿出现EEC的情况,但关于通过体外 *受精受孕的EEC患儿的发生率是否高于预期仍存在争议。8,20
临床表现
产前期
尽管下腹壁和盆腔脏器发育的缺陷幅度很大,膀胱外翻在产前超声检查中仍然难以可靠诊断。21 这可能是由于其发病率罕见,且常被误认为更常见的脐膨出或腹裂。
在妊娠期间,出现以下情况时可怀疑这些病症:
- 在连续的超声检查中未见膀胱(膀胱充盈缺如)。
- 腹壁厚度减少。
- 存在下腹部肿块,且随妊娠进展变得更加明显。
- 低位脐带。
- 外生殖器位置异常(前位或后位),且难以判定胎儿性别。
- 阴茎短小。
- 盆腔直径增大,伴耻骨支分离。
- 可见脐膨出。
- 可见下肢畸形和/或脊髓脊膜膨出的证据(提示泄殖腔外翻)。
三维超声以及胎儿MRI的日益应用将提高对膀胱外翻和泄殖腔外翻的诊断能力。21 产前诊断可进行产前咨询,并为在专门的外翻中心分娩作出安排。这使得由具备处理外翻-上裂复合体独特特性经验的团队采取多学科协作方式成为可能。
新生儿期
大多数变体在出生时易于识别。
- 膀胱外翻通常见于足月且出生体重良好的婴儿。
- 伴有泄殖腔外翻的新生儿通常为早产儿,且为小于胎龄儿。
儿童期
- 少见的变型可能不被察觉。
- 它们通常仅在较大年龄时,因持续性尿失禁或步态异常才被发现。
体格检查
在典型的膀胱外翻(BEX)中,大多数异常由腹壁、膀胱、生殖器、骨盆骨和肛门的缺损构成,因而累及下尿路、生殖器以及肌肉骨骼系统(四肢);而在泄殖腔外翻中,胃肠道和中枢神经系统的受累更为显著。
经典型膀胱外翻
腹壁延长,脐位偏低,位于膀胱板的上缘;可伴有疝缺损或小型脐膨出。膀胱前方开放,黏膜完全暴露;表面可见息肉。尿液从膀胱表面的输尿管开口流出。延迟闭合可能导致进一步的炎性或机械性改变,出现黏膜炎症征象,如白色覆盖物、溃疡及增生性形成物。外翻旁区光亮的薄皮肤条带标示正常皮肤与鳞状上皮化生区之间的过渡。肛门更前位,但括约肌功能正常。耻骨分离明显,并可伴有缩短和外旋(30%)。耻骨在膀胱板两侧及三角形边缘的远端可触及。在大多数男女患者中可触及双侧腹股沟疝。
- 女性 BEX: 存在阴蒂分叉、大阴唇分离以及耻丘向外分离(图 2)。阴道较正常短,深度不超过 6 cm,但管腔口径正常。阴道口常狭窄且位置前位。由于肛门同样位于腹侧(前位),会阴缩短。
- 男性 BEX: 生殖器缺陷严重,可能是外科重建中最具挑战性的方面之一。尿道板开放,并沿一条短、宽、背侧弯曲的阴茎,从开放的膀胱延伸至龟头沟。两侧海绵体位于尿道板之下。仔细检查可见该区域的精阜和射精管的小开口,其背侧推测为前列腺所在。龟头开放且扁平(图 3),睾丸大小正常,通常位于阴囊内。
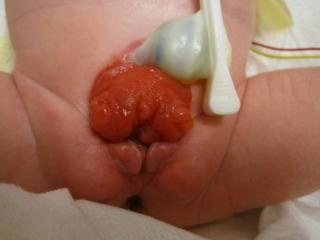
图2 经典型BEX,伴低位脐和会阴部前位肛门。女性BEX,伴开放的膀胱和尿道板,并有分裂的阴蒂。
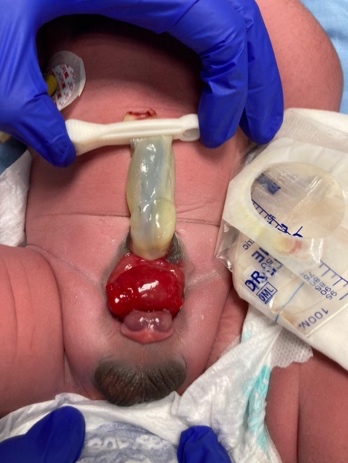
图 3 男性BEX,阴茎短而宽,并向背侧弯曲。阴囊与阴茎之间的距离异常。
尿道上裂
该缺陷源于发育停滞,表现为尿道板未闭合,并且尿道背侧定位异常。因此,男性在阴茎背侧可见异位外尿道口或黏膜条带,女性则可见不同程度的尿道裂隙。8 腹壁和腹直肌以及脐部发育完全正常。耻骨联合通常闭合,或仅存在轻微间隙,提示仅有轻度骨盆及盆底异常。尿失禁似为主要临床症状,取决于尿道括约肌受累程度。多数远端型尿道上裂不见不自主漏尿,而在近端型病例中,尿液可经尿道口持续滴漏。由于临床表现有时“较轻微”,远端型尿道上裂在出生时可能被遗漏,尤其在女婴中。随后常在学龄期因对常规治疗不敏感的尿失禁而确诊。
- **男性尿道上裂 (图 4): 根据尿道外口的位置,尿道上裂分为阴茎耻骨型、阴茎型或龟头型。
- **女性尿道上裂 (图 5): 按照 Davis 分为三度, 轻度为尿道外口张开,中度,或重度为裂隙累及整个尿道及膀胱颈,并可见膀胱黏膜脱垂。
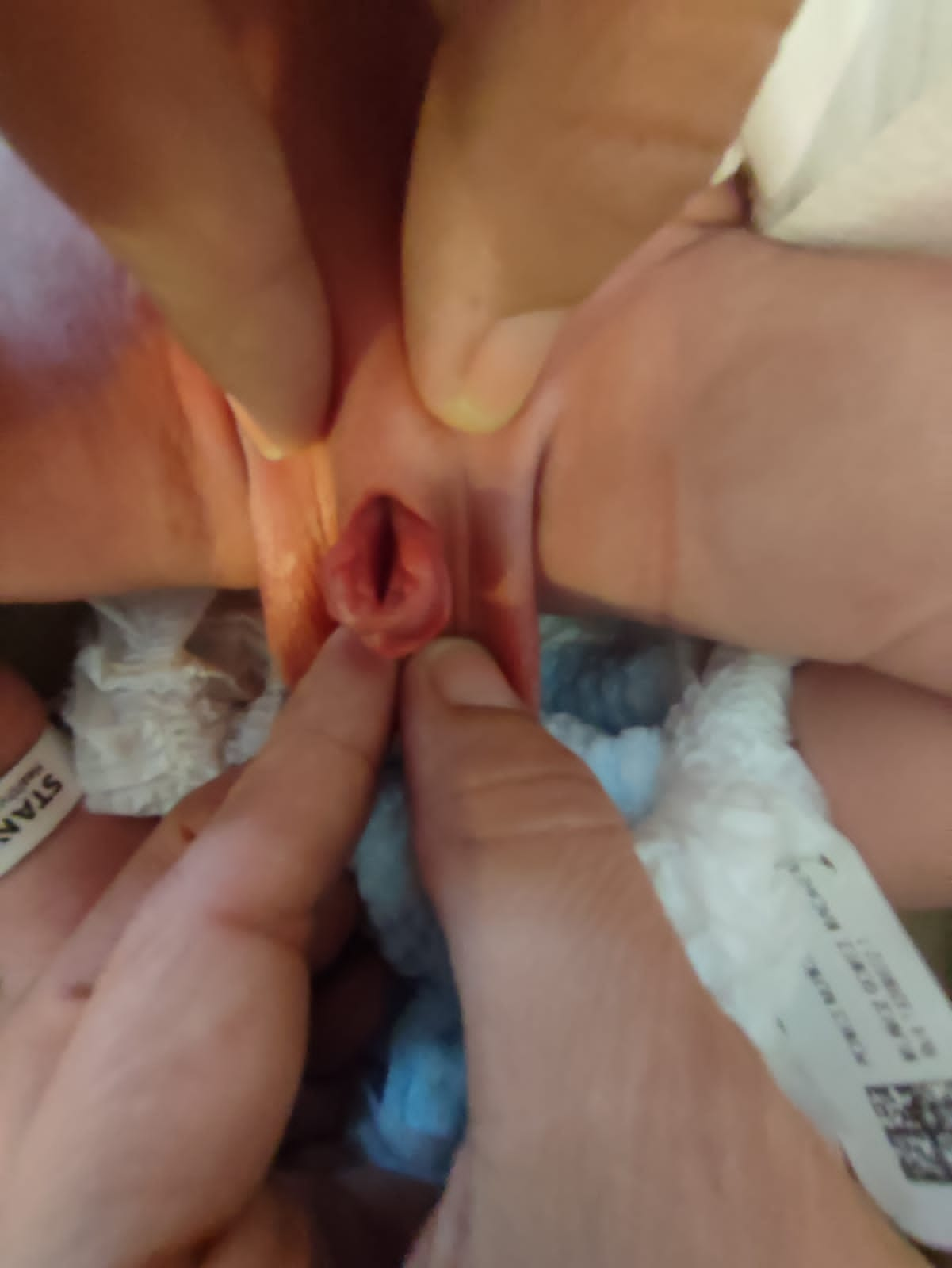
图 4 男性尿道上裂
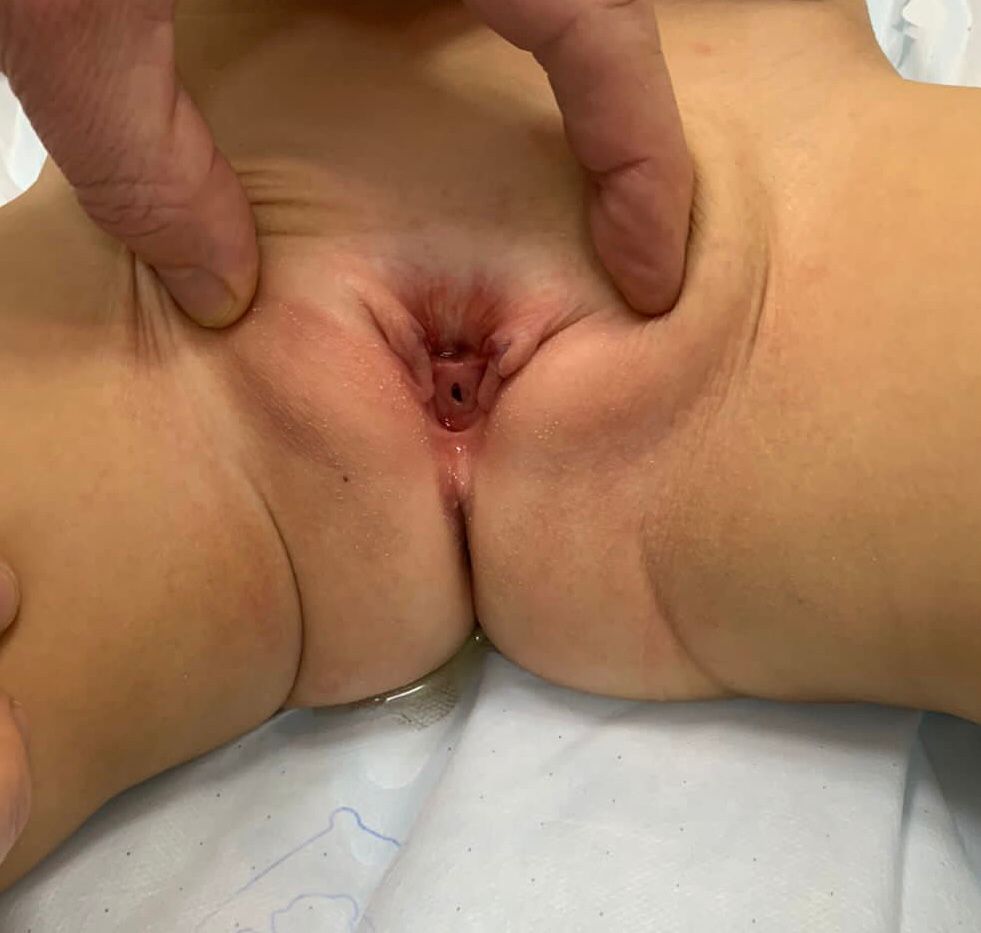
图 5 女性尿道上裂
泄殖腔外翻
腹直肌及耻骨分离。膀胱在下腹壁开放,并分为两半,位于暴露的盲肠段两侧。盲肠板内可见与回肠末端、阑尾(一个或两个)及远端肠道相通的开口,回肠末端可如“象鼻”一般自其中脱出(象鼻样外观)。其表现为肛门闭锁,并可伴有脐膨出。95% 伴有脊髓发育不良,65% 有下肢畸形。
-
男性 CEX: 阴茎通常呈分裂且较小,每个半龟头位于相应半膀胱的尾侧,或阴茎缺如。
-
女性 CEX: 阴蒂分裂,并可能存在两个半阴道,伴有双角子宫 (图 6).
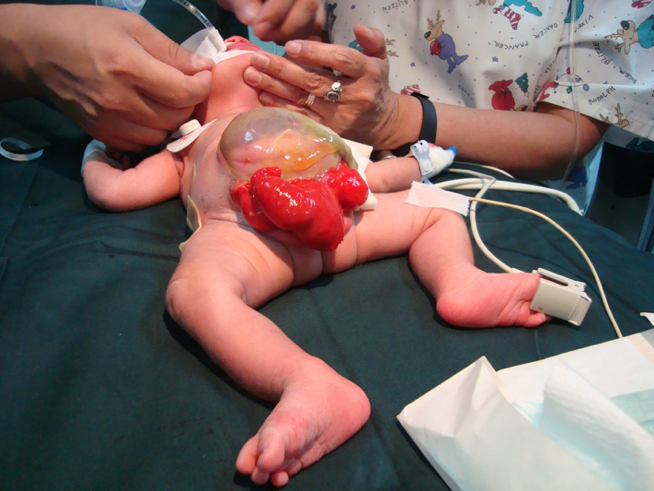
图 6 泄殖腔外翻。巨大脐膨出,2 个半膀胱紧邻外翻的盲肠板。阴茎小且二裂,其半龟头和半阴囊位于每个膀胱板的远侧。
膀胱外翻变异
这包括临床上范围广泛且异质性强的一系列异常。覆盖型膀胱外翻的表现与经典型BEX相似,其部分膀胱黏膜被皮肤覆盖;也可表现为合并膀胱脱出的重度尿道上裂。脐部可能位于解剖学正位。然而,假性膀胱外翻在出生后可能非常难以识别,常在较大年龄时才被发现。外生殖器外观正常,患者可能没有任何泌尿症状,其中一些人可完全控尿。体格检查可见不同程度的腹直肌分离。盆腔X线可显示耻骨联合分离,尽管这作为偶然发现的情况并不少见。
相关异常
泌尿系统畸形
大约三分之一的EEC病例存在多种泌尿系统畸形,主要见于EC人群(肾盂输尿管连接部梗阻、骨盆异位肾、马蹄肾、肾缺如、巨输尿管、输尿管异位和输尿管膨出)。1,8 所有患者在每次进行膀胱颈成形术时都应同时接受抗反流手术,因为在整个EEC谱系中,由于输尿管膀胱连接部发育失败,双侧膀胱输尿管反流的发生率为100%。
脊柱与骨科畸形
在EEC谱系内,脊柱异常的发生率各不相同。在患有CEB的患儿中,约有7%的病例出现脊柱异常,而在CEX患者中,几乎100%可以通过磁共振成像(MRI)识别并证实一组异质性的先天性脊柱异常,这些异常源于胎儿期早期神经管闭合缺陷以及尾侧细胞团发育异常。8 在这些患者的膀胱功能、下肢功能以及勃起功能方面,必须考虑神经学因素。22,23 骨骼和肢体异常(马蹄足畸形、足缺如、胫骨或腓骨畸形以及髋关节脱位)在CEX中更常见。1,8 然而,在EEC的长期随访中尚无关于髋关节发育不良的报道。
胃肠道畸形
这些主要与CEX相关。除大小不等的共同后肠残余外,在CEX病例中有88-100%可见脐膨出。胃肠道旋转不良或重复畸形,以及短肠综合征,在多达46%的病例中可见。1,8 约25%的病例中,无论为解剖性还是功能性短肠综合征,均可导致吸收功能障碍。
妇科异常
除了外生殖器异常之外,在大多数病例中,宫颈在靠近阴道口的阴道上壁处呈低位插入。1,8,24 尽管如此,子宫及其附件(输卵管和卵巢)的解剖结构和功能是正常的。盆底及提肛肌的缺陷,加之子宫主韧带的缺如,使约50%的女性易发生阴道或子宫脱垂。CEX中苗勒管畸形相当常见,即阴道和子宫重复、阴道发育缺如。1,8
影像学检查
它们通常用于识别和诊断可能的伴随异常(骨盆和腹部畸形、脊柱和脊髓异常等)。
主要检查包括肾脏超声、脊髓超声,以及脊柱和骨盆的X线检查。所有患有CEX的新生儿都应进行脊柱超声和X线片检查,以明确个体的脊柱异常,范围可从半椎体到脊髓脊膜膨出。随访中进一步建议行MRI,以识别易导致症状性脊髓栓系的隐匿性脊柱异常。
髋关节超声评估对所有EEC患者至关重要。骨盆平片有助于估计耻骨联合间隙的大小以及髋关节的位置。
诊断
在产前阶段,自妊娠第16周起即可怀疑EEC。随着产前超声检查敏感性的提高,产前对该病的怀疑有所增加。
在大多数情况下,该畸形在出生时即被诊断出来,因为其在临床上已显而易见。
处理
如果存在产前诊断或怀疑EEC,理想的做法是为父母提供咨询,并应在专科中心安排分娩(必要时转诊)。目前尚无可支持胎儿手术指征的经验。由于膀胱板损伤风险增加,不推荐阴道分娩。
如今,它不再被视为急症和/或外科急症,从而可以在安全条件下将患儿转运至专科中心,这些中心能够照护这些患有低发生率且高度复杂畸形的儿童。
手术策略最初侧重于尿路转流,以保护肾功能。然而,自从 Young 于 1942 年首次报道膀胱关闭术获得成功,1,8,11,24,25 在分期重建、外生殖器外观以及控尿能力和肾功能的保护方面均取得了显著进展。随着手术技术以及围手术期护理的改进,如今可望获得优异的长期生存。
手术
当前手术方法的目标包括;1 腹壁重建,2 膀胱外翻的复位与解剖学闭合,3 保护肾功能并实现尿控,以及4 外生殖器重建。26,27,28,29,30 历史上,重建自新生儿期开始分3期进行。然而,目前有高度专门化的中心或多中心团队对该疾病进行管理,并可组织实施延期管理,通过在低发病率且高度复杂的病种中积累经验,从而为每位患者提供最佳治疗。31,32,33,34,35,36,37,38,39,40
手术阶段如下
- 膀胱关闭,伴耻骨对合,无需行截骨术。对于CEX患者,应行肠道转流术。
- 第二阶段为完全的生殖器重建。在某些中心,还会进行 Kelly 手术或根治性软组织重建,以在男性中获得控尿能力并增加阴茎长度。
- 最后,应在中长期评估尿控情况。对于尚未达到该目标或存在肾功能受损风险的病例,可进入第三阶段:行膀胱颈手术和/或膀胱扩大成形术,并建立用于清洁间歇性导尿的控尿型尿路转流。
在全球各地的多家高度专科中心,已选择在生后2至4个月进行延迟关闭,采用单期手术,并结合Kelly所描述的手术,26,30,39 其内容包括:1 分离与膀胱关闭,可伴或不伴抗反流手术(若膀胱大小及壁特性允许);2 自耻骨支脱附的彻底软组织松解;3 借助Peña刺激器以识别新肌性括约肌复合体而进行的膀胱颈或控尿机制的建立,以及4 阴茎重建或阴道入口成形术。
这种方法的优势在于可避免在新生儿期进行手术,因而保留原有组织,并避免因一期闭合而导致的瘢痕与纤维化。这也有利于亲子依恋和孩子与父母之间纽带的建立,同时无需在出生后最初几天延长住院。
已经证明,延迟膀胱关闭术可以安全且成功地实施,并且原则上不影响膀胱发育。推迟手术可使新生儿进一步成熟,从而降低长时间麻醉的风险,并有利于婴儿在“小青春期”(mini-puberty)期间的生长,此外还促进专家团队为每个病例做好准备。39
并发症
由于其复杂性和极低的发生频率,这些病症往往伴随一系列并发症,主要与重建手术相关:34,39
- 早期:手术切口裂开、膀胱脱垂、尿道瘘或膀胱皮肤瘘 (4 – 19%)、尿道狭窄 (8%)、阴茎缺血。
- 晚期:膀胱输尿管返流、反复性尿路感染、膀胱排空不全、尿失禁、膀胱结石、腹壁纤维化、膀胱破裂、子宫脱垂、肾功能衰竭、逆行射精、少精症和不育,以及短肠综合征和粪失禁 (泄殖腔外翻)。
预后
如果这些患者未接受治疗,他们将遭受反复尿路感染、永久性尿失禁以及性活动方面的问题,并且膀胱癌的风险也更高,这些问题共同意味着生活质量更差。26,27,28,29,30,31,32,33,34,35
然而,如果按照建议对该病进行恰当的管理,这些患者的预期生活质量可能与普通人群相当。此外,鉴于超过90%的病例不伴有其他先天畸形,估计他们很可能能够过上完全正常的生活。另外,这些患者有可能在无需进行膀胱扩大术或为排空而进行间歇性导尿的情况下获得尿控能力,尽管成功率有限(采用MSRE技术经尿道自主排尿仅23%,41 采用CPRE技术为39%,28 采用Kelly技术为53%26)。
表 1 不同方法的控尿率范围很广,取决于控尿的定义和观察期。42
| 方法 | 控尿率(%) | 文献 |
|---|---|---|
| MSRE | 74 | Gearhart 等 |
| 62 | Gupta 等 | |
| 22 | Dickson 等 | |
| CPRE | 80 | Grady 等 |
| 74 | Hammouda 等 | |
| 23 | Arab 等 | |
| RSTM | 73 | Kelly 等 |
| 70 | Jarzebowski 等 | |
| 33–67(女性) | Cuckow 等 | |
| 44–81(男性) |
目前,这些患者的长期生存率极佳,在膀胱外翻患者中多达75-80%可实现控尿,在泄殖腔外翻病例中为65-70%;39,43,41 然而,其中许多人需要永久性的尿路和肠道改道。总体而言,性功能得以保留,大多数患者具有生育能力。对于接受过手术的女性患者,建议通过剖宫产分娩,以避免损伤控尿机制。
参考文献
- Gearhart JP, Gearhart JP, Rink RC. The Bladder Exstrophy–epispadias–cloacal Exstrophy Complex. J Pediatr Urol 2001: 386–415. DOI: 10.1016/b978-1-4160-3204-5.00030-x.
- Siffel C, Correa A, Amar E, Bakker MK, Bermejo-Sánchez E, Bianca S, et al.. Bladder exstrophy: An epidemiologic study from the International Clearinghouse for Birth Defects Surveillance and Research, and an overview of the literature. Am J Med Genet C Semin Med Genet 2011; 157 (4): 321–332. DOI: 10.1002/ajmg.c.30316.
- Cervellione RM, Mantovani A, Gearhart J, Bogaert G, Gobet R, Caione P, et al.. Prospective study on the incidence of bladder/cloacal exstrophy and epispadias in Europe. J Pediatr Urol 2015; 11 (6): 337.e1–337.e6. DOI: 10.1016/j.jpurol.2015.03.023.
- Boyadjiev SA, Dodson JL, Radford CL, Ashrafi GH, Beaty TH, Mathews RI, et al.. Clinical and molecular characterization of the bladder exstrophy-epispadias complex: analysis of 232 families. BJU Int. 2004;94:1337-1343. . DOI: 10.1111/j.1464-410X.2004.05170.x..
- Männer J, Kluth D. The morphogenesis of the exstrophy-epispadias complex: a new concept based on observations made in early embryonic cases of cloacal exstrophy. Anat Embryol (Berl) 2005; 210 (1): 51–57. DOI: 10.1007/s00429-005-0008-6.
- Marshall VF, Muecke EC. Variations in exstrophy of the bladder. Plast Reconstr Surg 1962; 31 (4): 396. DOI: 10.1097/00006534-196304000-00030.
- Stephens FD, Hutson JM. Differences in embryogenesis of epispadias, exstrophy–epispadias complex and hypospadias. J Pediatr Urol 2005; 1 (4): 283–288. DOI: 10.1016/j.jpurol.2005.01.008.
- Ebert AK, Reutter H, Ludwig M, Rösch WH. Exstrophy-epispadias complex. Definitions 2009; 4 (23). DOI: 10.32388/7eqi40.
- Ambrose SS, O’Brien DP. Surgical Embryology of the Exstrophy-Epispadias Complex. Surg Clin North Am 1974; 54 (6): 1379–1390. DOI: 10.1016/s0039-6109(16)40493-7.
- Mildenberger H, Kluth D, Dziuba M. Embryology of bladder exstrophy. J Pediatr Surg. 1988;23:166-170. . DOI: 10.1016/s0022-3468(88)80150-7..
- Gearhart JP. Exstrophy-Epispadias Complex. Campbell-Walsh-Wein Urology, vol. 31. 12th ed. 2021. DOI: 10.1016/b978-1-4160-6911-9.00124-9.
- Ives E, Coffey R, Carter CO. A family study of bladder exstrophy. J Med Genet. 1980;17:139-141. . DOI: 10.1136/jmg.17.2.139..
- Shapiro E, Lepor H, Jeffs RD. The inheritance of the exstrophy-epispadias complex. J Urol. 1984;132:308-310. .
- Reutter H, Qi L, Gearhart JP, Boemers T, Ebert AK, Rösch WH, et al.. Concordance analyses of twins with bladder exstrophy-epispadias complex suggest genetic etiology. Am J Med Genet A. 2007;143:2751-2756. . DOI: 10.1002/ajmg.a.31975.
- Carter CO. Genetics of common single malformations. Br Med Bull. 1976;32:21-26. .
- Ludwig M, Ching B, Reutter H, Boyadjiev SA. The bladder exstrophy-epispadias complex. Birth Defects Res Part A Clin Mol Teratol. 2009;85:509-22. . DOI: 10.1002/bdra.20557..
- Reutter H, Shapiro E, Gruen JR. Seven new cases of familial isolated bladder exstrophy and epispadias complex (BEEC) and review of the literature. Am J Med Genet A. 2003;120A:215-221. . DOI: 10.1002/ajmg.a.20057..
- Gambhir L, Höller T, Müller M, Schott G, Vogt H, Detlefsen B, et al.. Epidemiological survey of 214 European families with Bladder Exstrophy-Epispadias Complex (BEEC) J Urol. 2008;179:1539-1543. . DOI: 10.1016/j.juro.2007.11.092..
- Byron-Scott R, Haan E, Chan A, Bower C, Scott H, Clark K. A population-based study of abdominal wall defects in South Australia and Western Australia. Paediatr Perinat Epidemiol. 1998;12:136-151. . DOI: 10.1046/j.1365-3016.1998.00090.x..
- Wood HM, Babineau D, Gearhart JP. In vitro fertilization and the cloacal/bladder exstrophy-epispadias complex: A continuing association. J Pediatr Urol. 2007;3:305-310. . DOI: 10.1016/j.jpurol.2006.10.007..
- Palmer B, Frimberger D, Kropp B. Bladder exstrophy-epispadias complex and cloacal exstrophy. Section 7.D: Developmental anomalies. Paediatric Urology Book. Paediatric Urology Department, University of Oklahoma; 2011. DOI: 10.1007/978-1-84882-132-3\\_45.
- Rösch WH, Hanisch E, Hagemann M, Neuhuber WL. The Characteristic innervation pattern of the urinary bladder in particular forms of exstrophy-epispadias-complex. BJU. 2001;87:30. .
- Schober JM, Carmichael PA, Hines M, Ransley PG. The ultimate challenge of cloacal exstrophy. J Urol. 2002;167:300-304. . DOI: 10.1016/s0022-5347(05)65455-9..
- Woodhouse CRJ, Hinsch R. The anatomy and reconstruction of the adult female genitalia in classical exstrophy. BJU. 1997;79:618-622. . DOI: 10.1046/j.1464-410X.1997.00148.x..
- Woodhouse. C.R.J.: Genitoplasty in exstrophy and epispadias. Cambridge University Press; 2006, DOI: 10.1017/cbo9780511545757.046.
- Kelly JH. Vesical exstrophy: repair using radical mobilisation of soft tissues. Pediatr Surg Int 1995; 10 (5-6): 298–304. DOI: 10.1007/bf00182207.
- Grady RW, Mitchell ME. Complete primary repair of exstrophy. J Urol. 1999; 62 (4): 415–1420. DOI: 10.1097/00005392-199910000-00071.
- Groth. Bladder exstrophy consortium (MIBEC) after 5 years. AUA Chicago; 2019.
- Dickson AP. The management of bladder exstrophy: the Manchester experience. J Pediatr Surg. 2014; 9 (2): 44–250. DOI: 10.1016/j.jpedsurg.2013.11.031.
- Cuckow P, López PJ. Bladder Exstrophy Closure and Epispadias. In: Spitz L, Coran A, editors. En Operative Pediatric Surgery. 7th ed. 2013. DOI: 10.1201/b13237-101.
- Borer JG, Gargollo PC, Hendren WH, Diamond DA, Peters CA, Atala A, et al.. Early Outcome Following Complete Primary Repair Of Bladder Exstrophy In The Newborn. J Urol 2005; 174 (4 Part 2): 1674–1679. DOI: 10.1097/01.ju.0000175942.27201.59.
- Baird AD, Nelson CP, Gearhart JP. Modern staged repair of bladder exstrophy: a contemporary series. J Pediatr Urol 2007. 4: 11–315. DOI: 10.1016/j.jpurol.2006.09.009.
- Borer JG, Vasquez E, Canning DA, Kryger JV, Mitchell ME. An initial report of a novel multi-institutional bladder exstrophy consortium: a collaboration focused on primary surgery and subsequent care. J Urol. 2015. DOI: 10.1016/j.juro.2014.10.114.
- Ellison JS, Shnorhavorian M, Willihnganz-Lawson K, Grady R, Merguerian PA. A critical appraisal of continence in bladder exstrophy: Long-term outcomes of the complete primary repair. J Pediatr Urol 2016. 2 (4): 05 1–205 2057. DOI: 10.1016/j.jpurol.2016.04.005.
- Schaeffer AJ, Stec AA, Purves JT, Cervellione RM, Nelson CP, Gearhart JP. Complete primary repair of bladder exstrophy: a single institution referral experience. J Urol. 2011; 86 (3): 041–1046. DOI: 10.1016/j.juro.2011.04.099.
- Pathak P, Ring JD, Delfino KR, Dynda DI, Mathews RI. Complete primary repair of bladder exstrophy: a systematic review. J Pediatr Urol. 2020; 6 (2): 49–153. DOI: 10.1016/j.jpurol.2020.01.004.
- Ahn JJ, Shnorhavorian M, Katz C, Goldin AB, Merguerian PA. Early versus delayed closure of bladder exstrophy: A National Surgical Quality Improvement Program Pediatric analysis. J Pediatr Urol. 2018; 4 (1): 7 1–27 5. DOI: 10.1016/j.jpurol.2017.11.008.
- Leclair MD, Villemagne T, Faraj S, Suply E. The radical soft-tissue mobilization (Kelly repair) for bladder exstrophy. J Pediatr Urol. 2015; 1 (6): 64–365. DOI: 10.1016/j.jpurol.2015.08.007.
- Leclair MD, Faraj S, Sultan S. One-stage combined delayed bladder closure with Kelly radical soft-tissue mobilization in bladder exstrophy: preliminary results. J Pediatr Urol. 2018; 4 (6): 58–564. DOI: 10.1016/j.jpurol.2018.07.013.
- Baradaran N, Stec AA, Schaeffer AJ, Gearhart JP, Mathews RI. Delayed primary closure of bladder exstrophy: immediate postoperative management leading to successful outcomes. Urology. 2012; 9 (2): 15–419. DOI: 10.1016/j.urology.2011.08.077.
- Jarzebowski AC, McMullin ND, Grover S SR, BR H, J.M.. The Kelly technique of bladder exstrophy repair: continence, cosmesis and pelvic organ prolapse outcomes. J Urol. 2009. DOI: 10.1016/j.juro.2009.02.083.
- Cervellione RM, Husmann DA, Bivalacqua TJ, Sponseller PD, Gearhart JP. Penile ischemic injury in the exstrophy/epispadias spectrum: new insights and possible mechanisms. J Pediatr Urol. 2010; 5: 50–456. DOI: 10.1016/j.jpurol.2010.04.007.
- Purves JT, Gearhart JP. Complications of radical soft-tissue mobilization procedure as a primary closure of exstrophy. J Pediatr Urol 2008. 1: 5–69. DOI: 10.1016/j.jpurol.2007.02.006.
- Maruf M, Manyevitch R, Michaud J. Urinary Continence Outcomes in Classic Bladder Exstrophy: A Long-Term Perspective. J Urol. 2020; 03 (1): 00–205. DOI: 10.1097/ju.0000000000000505.
- Promm M, Roesch WH. Recent Trends in the Management of Bladder Exstrophy: The Gordian Knot Has Not Yet Been Cut. Front Pediatr 2019; 7. DOI: 10.3389/fped.2019.00110.
最近更新时间: 2025-09-22 08:00