4: 儿童尿动力学评估
阅读本章大约需要 8 分钟。
引言
对下尿路(LUT)功能的尿动力学评估包括在膀胱充盈期和排尿期采用适当的评估方法。对检查所用器械与技术的正确设置与规范应用,可提供对可能影响儿童和青少年的泌尿系统疾病的病理生理学认识,旨在优化其治疗管理。
儿科尿动力学需要受过专门培训的人员,在适应儿科特点的环境中实施适当的方法学,以便正确处理压力情境,并尽可能多地获取临床泌尿学信息。
下尿路的尿动力学检查可采用有创或无创方式进行。总体而言,当前趋势是通过无创尿动力学评估来管理下尿路病症,仅在存在神经泌尿功能障碍或复杂泌尿系畸形的情况下才采用有创方法。
无创尿动力学评估
儿童下尿路(LUT)状况涵盖一组具有重叠尿路症状的实体。这些状况是充盈期、排尿期的障碍所致,或为二者不同程度功能受损的组合。LUT症状在多达20%的学龄儿童中可见。1
恰当的评估由儿科医生决定,其他专科医生继续进行这一评估。该做法通常在儿童约4岁时开始,如果能够获得以下资料,将更为充分:
- 排尿日记(2-3 天)。2
- 布里斯托大便形态量表 / 罗马IV标准 / 功能性胃肠道疾病。3,4
- 问卷(可选):排尿与排便习惯、液体摄入、生活质量。5
- 对生殖器、腰骶区、臀区、会阴、下肢及反射的体格检查。
- 尿常规 / 尿培养:蛋白尿 / 糖尿。
- 尿流率测定 / 排尿后残余尿(PVR)测量。
- 使用表面(贴片)电极的盆底肌电图(EMG)
- 上尿路、膀胱特征及便秘征象的超声检查。
- 尿动力学 / 视频尿动力学检查(除非对初始治疗无反应,否则不必常规进行)。
- 排尿性膀胱尿道造影(VCUG)用于检测膀胱输尿管返流
存在多种用于评估和测量膀胱与肠道功能障碍、生活质量以及行为共病的问卷,内容包括适应证和可能的困难。医生将根据临床评估、可用时间以及所研究的患者人群选择最有用的工具。5
儿童功能性胃肠疾病的表现形式多样,可在3或4岁时即出现,随后可能与膀胱功能障碍和尿路感染相关。6,7
尿流率测定
尿流率测定(伴随排尿后残余尿量测定)可与盆底肌肌电图(EMG)联合用于确认逼尿肌与尿道括约肌缺乏协调的功能性排尿障碍。尿动力学检查通常保留用于对初始治疗无反应的患者。8,9
尿流率测定是一种无创检查,用于测量尿流,其定义为单位时间内通过尿道的尿液体积,以 mL/sec 表示。评估的变量包括最大尿流率(Qmax)、平均尿流率(Qavg)、总排尿量和总排尿时间。该方法还显示排尿过程中获得的曲线形态。正常尿流呈钟形曲线(图 1)。这是评估膀胱排空的初始检查之一,因为它可提供逼尿肌收缩力和膀胱出口的信息。通过该技术可以避免侵入性检查,并监测治疗反应。
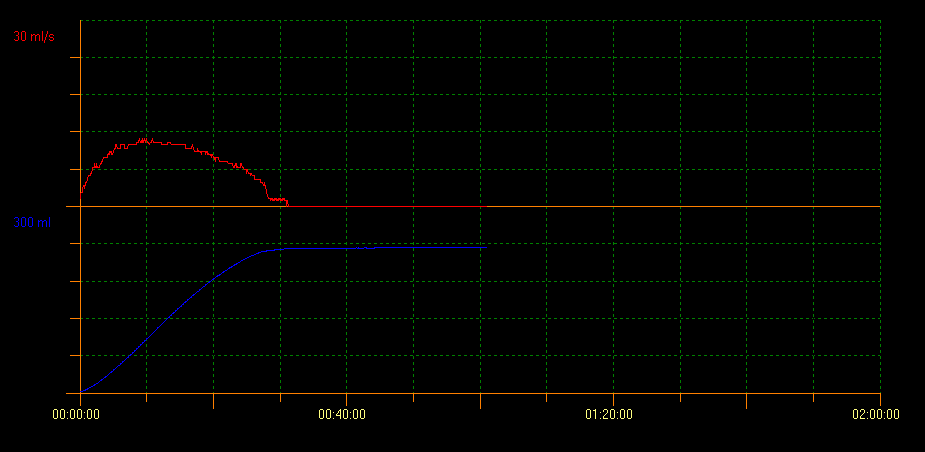
图 1 正常尿流呈钟形曲线
尿流率检查联合超声测量排尿后残余尿(PVR)用于评估膀胱排空能力。采用该方法可识别多种提示不同状况的曲线模式。塔形曲线提示膀胱过度活动症;断续型曲线提示功能性排尿障碍,而中断型尿流曲线可提示低活动性膀胱。平台型曲线通常见于存在解剖性膀胱出口梗阻的患者(图2、图3和图4)。10
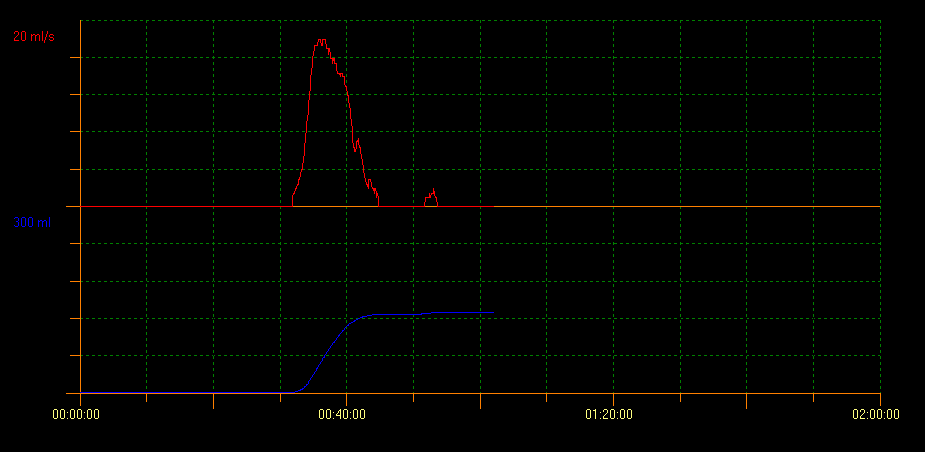
图 2 塔形曲线模式
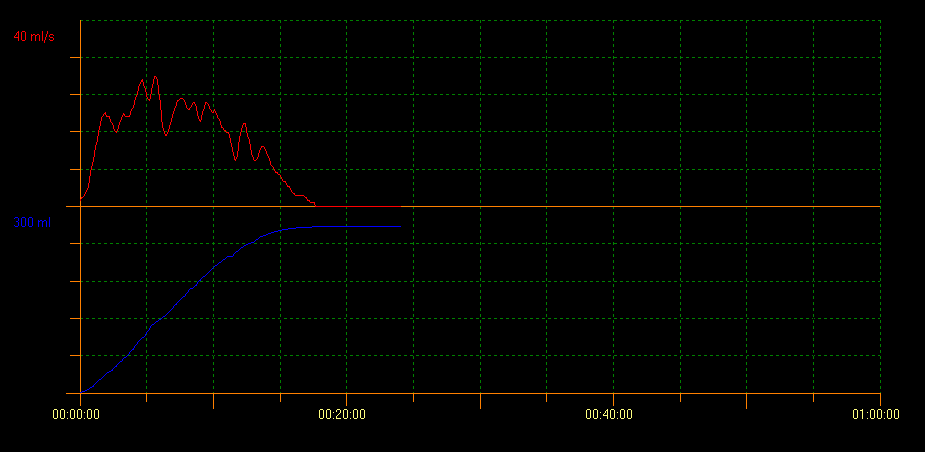
图 3 断续型曲线模式
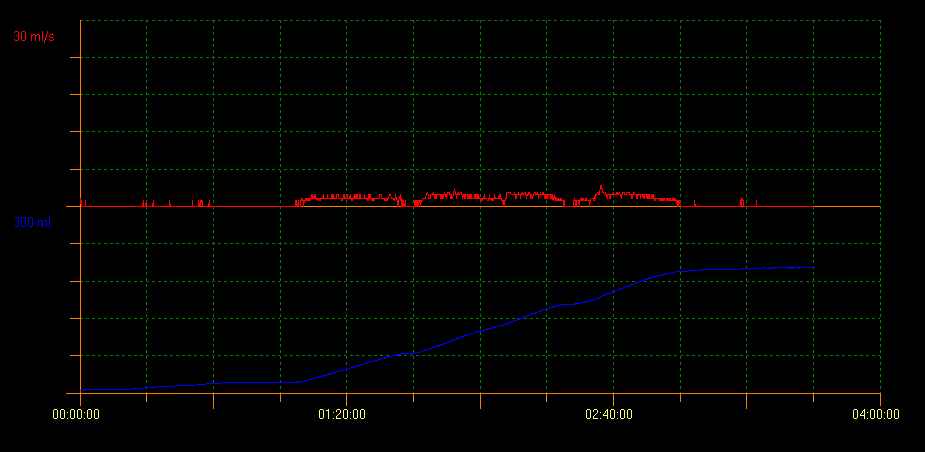
图 4 平台样曲线模式
观察者之间的结果存在相当大的差异,尤其是在尿流率检查异常的情况下,这是该工具的主要局限之一。Franco 等 提出了流量指数(FI)的概念。FI 用于衡量实际尿流率与期望尿流率之间的关系:AQavg/EQavg 或 AQmax/EQmax),以获得对膀胱排空的定量评估。因此,在合理参数范围内、针对特定尿量,FI 能够以可靠方式预测预计的尿流率;它有助于将实际尿流率与理想值进行比较,从而使曲线分析更具客观性。11 较高的 FI 表明排尿效率高并呈塔形曲线模式,而较低的 FI 则提示功能性排尿障碍并呈平台样曲线模式。
尿流率测定与盆底肌电图
尽管在排尿期尿流/肌电检查呈阳性所证实、被诊断为排尿功能障碍的儿童中,最常见的模式是断续型尿流,但其中近三分之一的患儿在排尿功能障碍中表现为中断型或混合型尿流模式。因此,在尿流检查中纳入表面肌电电极尤为重要,尤其当怀疑由逼尿肌–括约肌协同失调导致的排尿功能障碍时。12 尿流率测定联合盆底肌电不仅有助于诊断特定的下尿路(LUT)疾病,也可客观监测治疗的疗效。13 如图5所示。
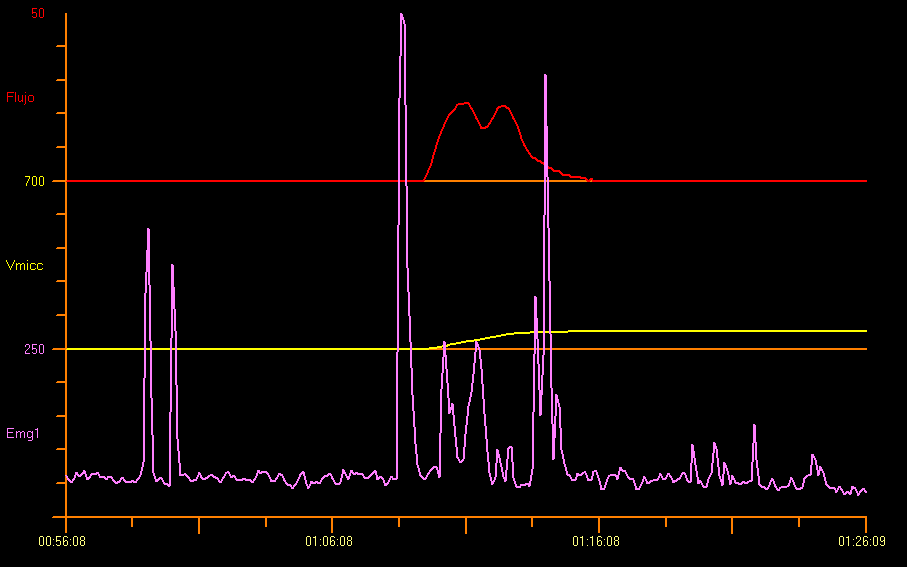
图 5 尿流测定与会阴肌电图(EMG)
盆底肌电图(EMG)滞后时间被定义为从盆底肌放松开始到尿流曲线开始之间的时间间隔。这种以秒为单位的无创测量对于筛查诸如原发性膀胱颈功能障碍等情况并无用处。13,14 有关滞后时间的图示说明,见图 6。
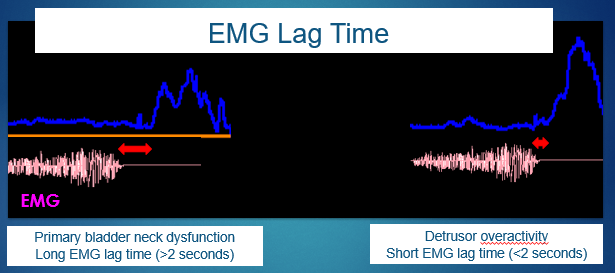
图 6 肌电图(EMG)滞后时间。
尽管如此,即便考虑到使用表面电极进行肌电图(EMG)的局限性,仍可将FI与EMG的滞后时间进行相关,以界定下尿路(LUT)状况的特异性诊断。滞后时间接近0秒与更高的FI相关,这代表在塔形尿流模式中常见的过度活动。然而,滞后时间超过6秒,或甚至为负且低于4秒的滞后时间值的患儿,其FI较低,这提示低效排尿以及平台型尿流模式。15
超声检查中的排尿后残余尿量
神经系统完好儿童的排尿后残余(PVR)测量值高度可变。在4–6岁儿童中,单次PVR > 30 ml 或 > 膀胱容量(BC)的21%,其中BC定义为排尿量(VV)+ PVR,并以预期膀胱容量(EBC = [age (yrs)+1] × 30 mL)的百分比表示,建议重复进行PVR的双次测量,并且重复PVR > 20 mL 或 > 10% BC 被认为显著升高。在7–12岁儿童中,单次PVR > 20 ml 或 15% BC,或重复PVR > 10 ml 或 6% BC 被认为升高。测量PVR应遵循标准条件:相对于EBC,膀胱不应欠充盈(< 50%),也不应过度充盈(> 115%),并且必须在排尿后立即(< 5 min)获取PVR。16
当存在 LUT 状况时,应行上尿路超声检查,以排除其他异常,如肾积水和重复集合系统。膀胱壁的改变,如增厚、小梁形成或憩室,可作为慢性 LUT 功能障碍的标志。
侵入性尿动力学评估—膀胱测压
在神经系统完整的儿童中,通常不使用尿动力学检查来评估下尿路(LUT)症状,而且很少能提供足以证明其使用合理性的更多信息。这些检查用于当无创检查出现病理性发现、治疗无效,以及失禁或尿路感染等症状加重时。17
尽管如此,侵入性尿动力学检查仍常规用于初始评估、脊柱裂所致神经源性膀胱患儿的随访,以及在怀疑神经源性逼尿肌-括约肌功能障碍(隐性脊柱裂)、梗阻(如后尿道瓣膜)、泌尿生殖系统畸形(膀胱外翻、尿道上裂)、非神经源性膀胱功能障碍,或病因不明的显著排尿后残余尿时。9
在膀胱测压过程中,测定膀胱内压/容量关系,以记录储尿和排尿的功能。研究的第一阶段获取以下数据:逼尿肌稳定性、漏点压力、膀胱感觉和膀胱容量。于排尿期测量其他参数:排尿压力;膀胱颈开放压力及尿道括约肌压力;逼尿肌收缩效率及可持续性;尿流模式,以及肌电图协同性。通过直肠气囊导管评估腹压的变化及其对膀胱压力的影响。
采用了国际儿童控尿学会(ICCS)指南所规定的标准化和命名法。9 膀胱内压通过经尿道置入的 6F 双腔导管进行测量。腹腔内压力使用置于直肠内的 8F 导管和乙烯基球囊导管进行测量。以 37.5° 摄氏度的 0.9% 生理盐水对膀胱进行充盈,充盈速度为每分钟相当于患儿理论或预期膀胱容量的 5–10%,最高速率为 10 mL/min。
评估以下尿动力学变量:最大膀胱测压容量(MCC,单位:mL);充盈末期逼尿肌压力(Pdet,单位:厘米水柱)以及逼尿肌漏点压力(DLPP,单位:厘米水柱)。我们按照以下公式计算预期膀胱容量(EBC):30 ×(年龄(岁)+ 1)mL。膀胱容量减少定义为 < 65% 的 EBC。7 当因以下原因停止充盈时,我们将其定义为最大膀胱测压容量:逼尿肌收缩并出现大量漏尿;漏出量超过充盈速率(> 10 ml / sec);危险性压力(> 40 厘米水柱);视频尿动力学检查中的高级别膀胱输尿管返流;以及泌尿道扩张。逼尿肌过度活动的定义为出现两次以上幅度大于 15 厘米水柱的逼尿肌收缩。18 膀胱排空低效定义为逼尿肌低活动或神经源性无收缩逼尿肌。7
尿动力学检查前阶段
向家长和患儿详细解释各项操作,并向他们展示尿动力学检查室和将使用的器材。设施应针对儿科患者进行适配,并配备能够管理清醒儿童的受过培训的工作人员。理想的环境还应根据年龄提供可用的娱乐,如游戏、平板电脑、电视机和电子游戏。此外,值得强调的是,确保直肠为空的重要性,尤其是在便秘儿童中。
建议在开始该操作前15天内进行尿培养,并确认结果为阴性。对于将要开始清洁间歇性导尿(CIC)的儿童,可不必进行尿培养,因为即便存在无症状性菌尿,也不被视为额外的风险因素,且一般不需要抗生素预防。尿动力学检查后发生尿路感染(UTIs)的总体发生率较低(0.7%)。在进行尿动力学检查前未做尿培养的患者,其UTIs发生率并未显著增加。19
如果患者能控制括约肌、未纳入CIC方案且膀胱充盈,则在先前完成器械操作的情况下进行自由尿流率测定。这些数据将补充关于该患者的最终报告。
通过口服、经鼻或经直肠三种途径之一给予咪达唑仑进行镇静,是在膀胱测压检查期间一种安全且高效的方法,也是便捷的选择,尤其适用于在面对拟实施的操作时可能感到恐惧和紧张的年轻患者群体。根据Özmert的报道,大多数患者对镇静的应用感到满意。在该报告中,与接受口服镇静的组相比,经鼻给予且起效更快、所用剂量最低的组,即使出现鼻部刺痛,仍获得了更好的结局。镇静的另一优点是,与对照组相比,接受镇静的患者完成膀胱测压检查所需时间更短,且膀胱测压不受咪达唑仑影响。20 作为镇静剂,水合氯醛在儿童的诊断性或治疗性操作中被广泛使用。其口服溶液是儿童镇静的一种有效且适当的替代方案。21
尿动力学检查设备
一般情况下,在使用利多卡因作为麻醉剂后,经尿道置入一根6F双腔导尿管。某些情况下,如儿童不配合、存在理解困难或尿道敏感性保留者,或怀疑尿道梗阻(后尿道瓣膜)者,在检查前24小时置入耻骨上双腔导尿管,可使检查更好地进行。22 也可以在膀胱造口或输尿管造口处放置双腔导管,然后用硅胶Foley囊导尿管关闭造口。
经尿道和直肠导管必须用胶带固定于皮肤开口处,并通过连接管与外置压力换能器相连,并将换能器调至与耻骨联合同一水平。在将患儿置于坐位之前,并在清洁会阴皮肤之后,于肛周区域左右对称连接两个表面肌电(EMG)电极,以记录盆底肌活动。此外,将第三个参考电极置于骨性隆起处。充盈性膀胱测压通常在坐位进行;然而,仰卧位或由母亲怀抱患儿也同样可接受。23 参见图 7以了解示例体位。
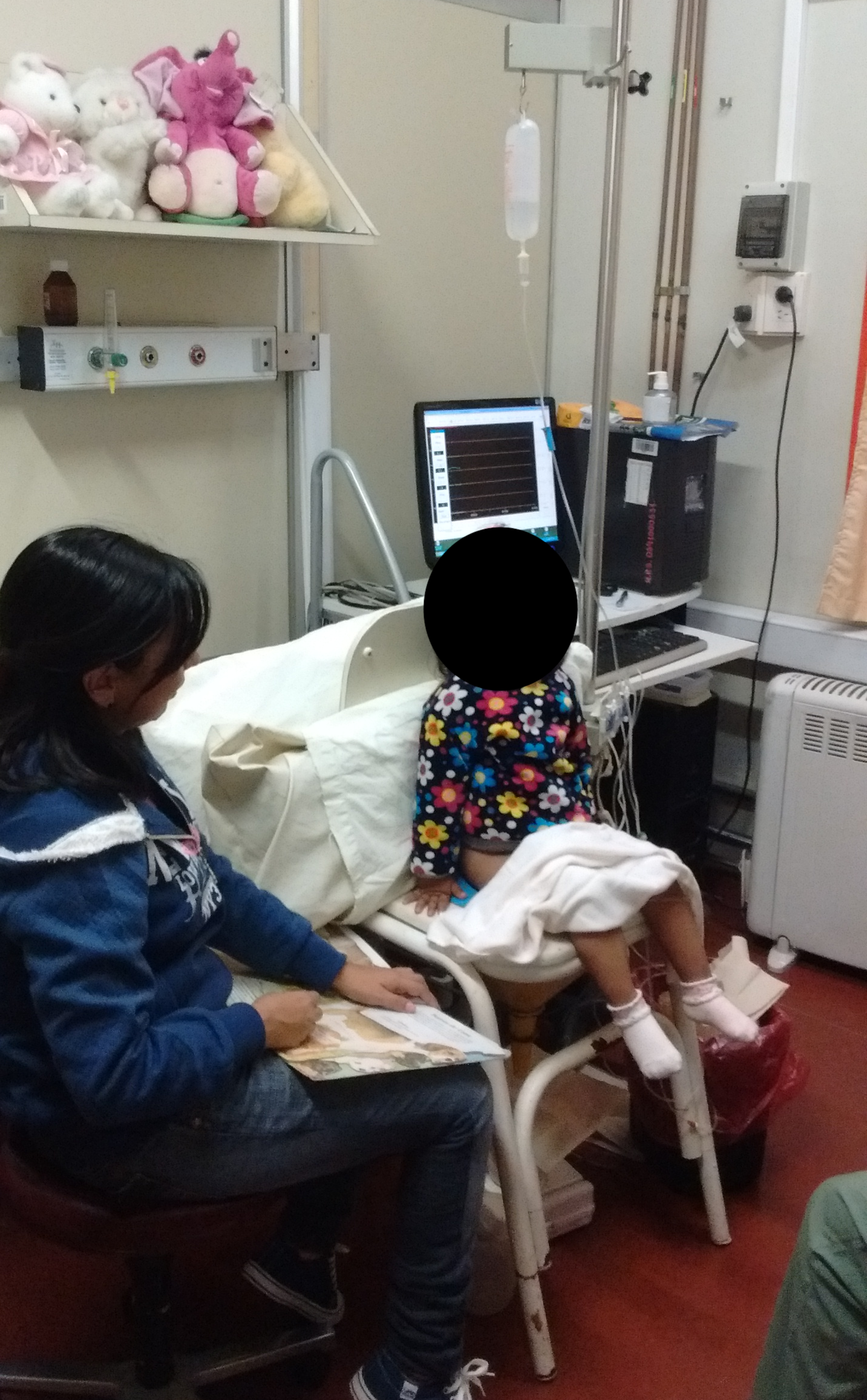
图 7 患者体位
对于神经功能正常且年龄足以进行配合的儿童,需按照 ICS(国际尿控学会)设定的标准顺序确定充盈感觉:“首次充盈感觉”、“首次排尿欲望”和“强烈排尿欲望”。在排尿周期完成后,并根据曲线质量,考虑是否有必要重复检查。一旦拔除导管和 EMG 电极,应指导患者增加液体摄入量以降低尿路感染的风险,23 如有不适,可使用镇痛药物。
尿动力学结果的解读
必须认识到,检查时间的大部分消耗在充盈期,而较小部分时间在排空期。膀胱周期见图8。
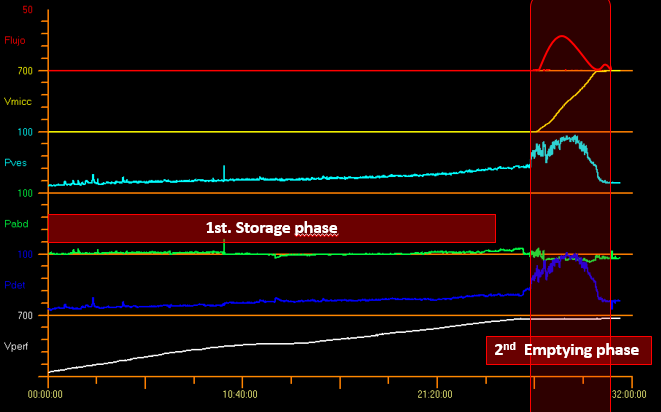
图 8 膀胱周期。
充盈期
仅对能够自愿排尿的儿童而言,膀胱感觉才可能是一个相关参数。自4岁起,可记录以下数据:“首次尿意”和“强烈尿意”。当孩子蜷起脚趾时,通常会表现出正常的尿意。此外,膀胱感觉可分为正常、增高(高敏)、降低(低敏)或缺如。
在储尿期测量的参数包括:膀胱内压 (Pves)、腹压 (Pabd) 和逼尿肌压力 (Pdet),其中 Pdet = Pves - Pabd (图 8).
充盈期逼尿肌压力(Pdet fill)是指充盈期内的逼尿肌压力,而在充盈结束时达到的逼尿肌压力称为最大充盈期逼尿肌压力(Pdet fill max)。膀胱壁的弹性,或壁顺应性,通常在充盈期逐步增加,并可基于充盈速率的起点和终点进行计算(在出现逼尿肌过度活动时需考虑静息压力)。因此,膀胱顺应性被定义为膀胱容量变化与逼尿肌压力变化之间的关系(C= ΔV/ΔP; 正常值:> 10 mL/cm H2O).24 充盈体积并未将检查过程中产生的实际尿生成量计算在内。为将该体积纳入考虑,最大膀胱测压容量(MCC)通过排尿量与排尿后残余尿量计算。顺应性的变异性取决于多种因素,例如:用于计算的曲线段;膀胱的形状、厚度以及膀胱壁的机械/黏弹性特性;逼尿肌的舒张能力、收缩力,以及膀胱出口阻力的程度。25
此外,应考虑充盈曲线的形状,因为它提供关于膀胱松弛度的信息。正常情况下,膀胱充盈期间逼尿肌压力相对稳定,因此呈线性曲线。在病理情况下,充盈曲线为”非线性”,伴随逼尿肌压力升高,应记录这些变化。7 一般而言,当顺应性得到保证时,充盈期的压力变化很小或没有变化,但尚无用于界定病理性顺应性的截断值。在无神经病变的儿童中,顺应性相对于基础膀胱压力不应超过0.05 Y mL/cm H2O(Y= 按年龄计算的膀胱测压容量[mL])。关于预期膀胱容量(EBC)与膀胱测压容量之间关系,文献中尚无报道。尽管如此,一些作者建议在EBC时Pdet不应超过30 cm H2O。26 在我们中心,我们认为从20 cm水柱到预期膀胱容量的压力为病理性(图9)。
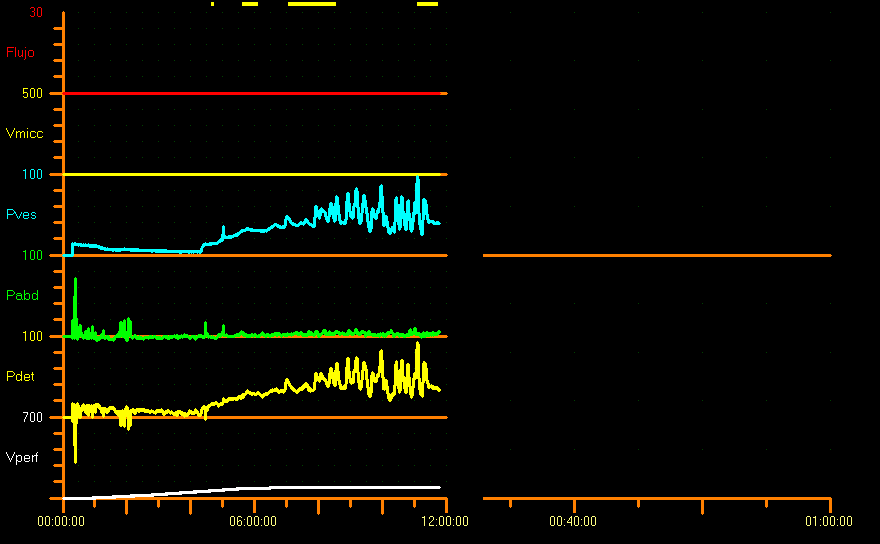
图 9 顺应性降低模式
由于这一限制,我们可以进行外推,并使用在预期膀胱容量时达到的逼尿肌压力以及Pdet fill max。Tarcan 等 在3岁脊髓脊膜膨出患儿中研究了膀胱压力,并得出结论:在预测上尿路损害方面,DLPP阈值为20 cm H2O显示出更高的敏感性,而DLPP在20至40 cm H2O之间时在损害预测方面并不可靠。因此,在Tarcan的研究中,DLPP在20至40 cm H2O之间的患儿中有57.1%,而DLPP大于40 cm H2O的患儿中有62.2%具有正常的上尿路。因此,将DLPP阈值作为单一参数来预测脊髓脊膜膨出患儿的尿路损害既不可靠也不准确。其他风险因素可能同时存在,例如膀胱容量低、膀胱壁顺应性低、高充盈压力、逼尿肌-括约肌不协调以及膀胱导尿依从性等。27
在充盈膀胱测压过程中,任何逼尿肌压力的相位性升高被定义为逼尿肌过度活动。这种过度活动表现为出现两次或以上幅度超过 15 cm H2O18 的逼尿肌收缩,可自发发生,或由咳嗽或 Credé 手法诱发。这种逼尿肌的增幅或亢进可以是神经源性或特发性的,如图 10。28,29
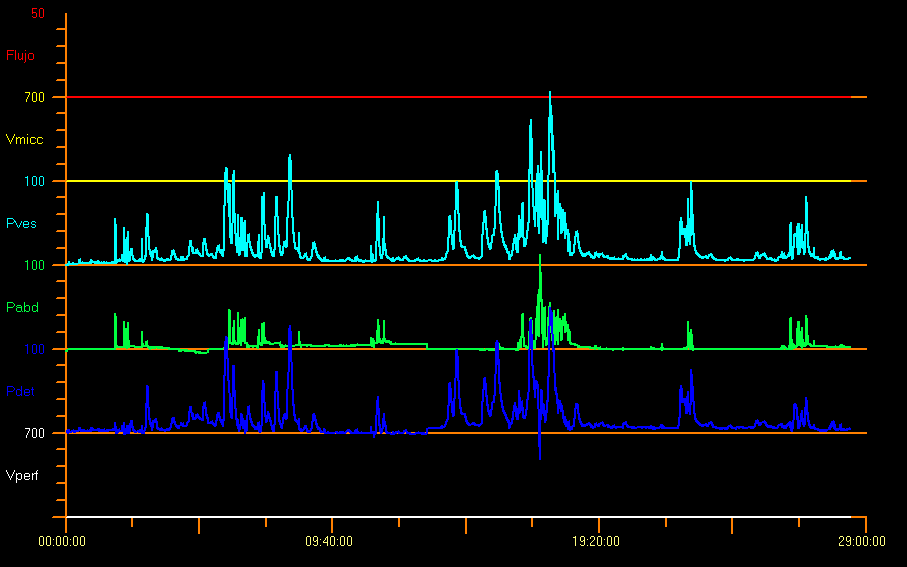
图 10 过度活跃模式
儿童也可能无法完全抑制这些收缩,因此作为一种保护性反射,可以观察到盆底肌电活动的增加。某些诱发因素,如咳嗽、笑、行走或跳跃,可引发逼尿肌过活动。然而,出现这些收缩并不一定意味着神经系统疾病。在无任何疾病的婴儿中,10% 会出现逼尿肌收缩。当在几乎不需用力的情况下或在未达到终末充盈(终末充盈指充盈达到预计膀胱容量 EBC 的 150%)时出现逼尿肌收缩,逼尿肌会呈低活动状态。9
逼尿肌漏点压力(DLPP)指在腹压未增加且无逼尿肌收缩的情况下发生尿漏的最低逼尿肌压力。腹压漏点压力(ALPP)指在无逼尿肌收缩的情况下,通过有意增加膀胱内压力(例如因咳嗽)而致出现尿漏时的最低膀胱内压力值。高 DLPP(> 40 cm H2O)常由膀胱壁顺应性降低所致。低 DLPP 提示括约肌功能不全。7 对于体育活动活跃的青少年,当 ALPP 大于尿道压力时,可出现压力性尿失禁。30
尽管存在刺激,可能仍需拔除导尿管,以便患儿能够排尿。如果排尿量较低,我们面对的很可能是由于慢性膀胱出口梗阻或神经源性病变所致的逼尿肌收缩低下,并进展为排尿功能恶化。7
排尿期
正常排尿由随意性启动的逼尿肌收缩来完成;一旦开始即为持续性的,且不易被抑制。排尿过程中,逼尿肌可分为正常、低活动或无收缩,即在排尿时不出现任何活动。若收缩缺失由神经因素导致,则称为逼尿肌无反射。其表现为由神经控制机制协调的收缩完全缺如。当逼尿肌收缩的强度和持续时间不足以有效排空膀胱时,即为排尿期的逼尿肌低活动。9
一些作者报道,在1个月大且神经系统健康的儿童中,测得的压力远高于正常,排尿时逼尿肌的平均压力男孩为127 cm H2O,女孩为72 cm H2O。31 图 11 展示了一个膀胱出口梗阻的示例研究。这可能是由于显著的括约肌活动和导尿管相关效应所致。在害怕排尿的儿童中,可能出现较高的排尿压力、尿流中断或显著的PVR。9
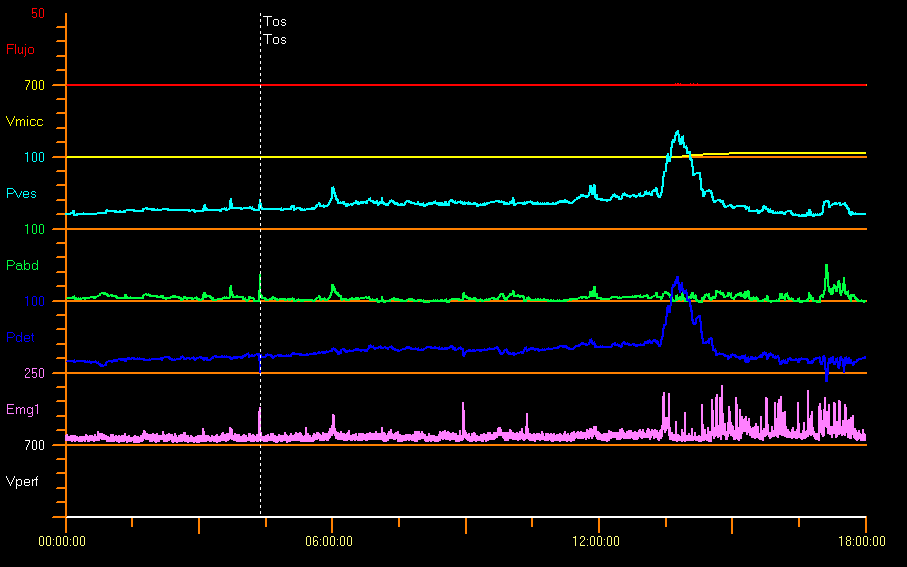
图 11 膀胱出口梗阻
当存在解剖性尿道梗阻(后尿道瓣膜、尿道狭窄、异位输尿管囊肿)时,会出现平台型尿流曲线,Qmax低且恒定,尽管逼尿肌压力很高且外尿道括约肌完全松弛。参见尿流测定部分。
功能性梗阻是由于排尿过程中外尿道括约肌收缩(持续或间歇性)所致,从而形成狭窄的尿道段。可以通过同时进行压力/流率记录和采用表面电极的盆底肌电图来记录盆底肌活动。12,15
视频尿动力学检查
视频尿动力学检查将透视下膀胱尿道造影与常规尿动力学的优点整合于同一套设备,使能够同时进行尿路的解剖学与功能评估。图 12展示了视频尿动力学。
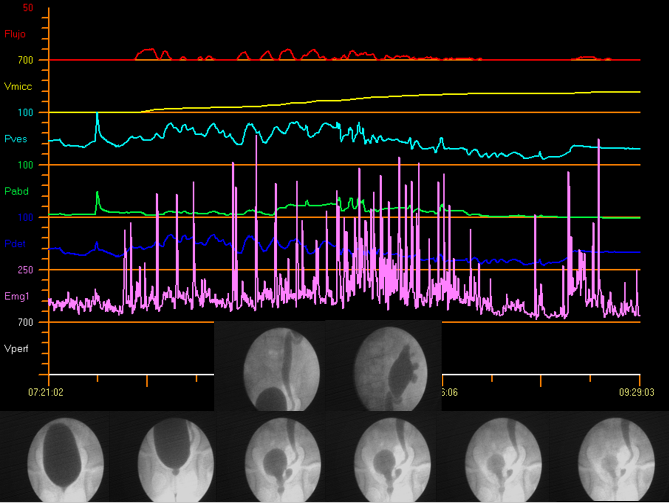
图 12 视频尿动力学
辅助性的放射学检查已成为鉴别诊断的有用工具。此外,它借助数字技术促进了图像分析。32
进行视频尿动力学检查的适应证
在完成较为简单的检查后诊断仍不明确时,或患者存在以下复杂情况时,视频尿动力学检查有指征:
- 反复尿路感染:怀疑膀胱输尿管反流,以及诸如尿失禁等尿路症状。
- 泌尿道先天畸形:后尿道瓣膜;梅干腹综合征。
- 多发性膀胱憩室;既往泌尿道手术史。
- 盆腔部位治疗史:肿瘤切除、化疗或放疗。
- 怀疑或既往膀胱梗阻史。
- 怀疑逼尿肌-括约肌协同失调(如肌电图所示)。32
- 脊柱裂;隐匿性脊髓发育异常。
- 脑性瘫痪;肛门直肠畸形和脊髓病变。
- 脊柱畸形;重度脊柱侧弯;骶骨发育不全。
- 其他免疫学和神经系统疾病。
- 移植前肾脏评估以及肾脏与泌尿道先天异常(CAKUT)的随访。
在我们对脊髓脊膜膨出患儿的初始评估中(n:60),我们平均在生命最初的8个月内对所有患儿完成了视频尿动力学检查,并发现20%的患儿存在膀胱输尿管返流,55%存在过度活动,13%存在膀胱壁高张,98%存在高PVR。33
通过视频尿动力学获得的额外信息是有代价的:儿童会暴露于辐射。患儿的体重和膀胱容量是总辐射暴露量的独立预测因素。意识到这种暴露可能有助于医师谨慎使用X线透视,并更好地就辐射暴露问题与家长沟通。34
非常规尿动力学
1996年,De Gennaro 表明,在儿童中进行连续尿动力学监测是可行的,并且即使仅进行短期(6小时)监测,在对神经源性膀胱儿童的评估中也优于标准膀胱测压检查。35
当尿日记中的尿量(在 LUT 条件下)或膀胱导尿日记(在神经源性膀胱中)与常规尿动力学结果缺乏相关性时,有一种可选方法:自然充盈尿动力学检查。采用此种方式无需使用液体灌注进行充盈,但患者必须在医院停留更长时间,连接尿动力学设备进行监测。尽管患者一旦入院就需要开始补水,但检查的持续时间是可变的,一般在出现漏尿时结束。在膀胱排尿过程中,持续以交替的方式测量压力(测压与排空),然后以与标准尿动力学相反的方式将其与容量进行关联,直到排尿结束。
动态(携带式)尿动力学与常规尿动力学
常规尿动力学包括高度标准化的评估。然而,在评估儿童时,测量结果的可靠性可能受到发育相关因素和数据变异性的影响,也可能受到陌生临床环境的影响。动态尿动力学监测为这些局限提供了一种替代方案:它要求膀胱自然充盈,在较长时间内进行测量,并在对儿童友好的环境中实施。
Lu 等人 发现,与标准尿动力学相比,动态尿动力学中的排尿模式不同,且各方法所识别的排尿模式缺乏一致性。36 或许,将最后一次排便、先前饮入的液体量以及进行检查的时段纳入考虑,可以解释为何在动态尿动力学检查中观察到的排尿模式一致性较差。
最终考虑事项
大多数下尿路疾病可通过非侵入性尿动力学工具进行评估,并可通过适当的治疗和随访进行管理。
对某些儿童而言,侵入性尿动力学检查会在不友善的环境中被体验为一种令人紧张的情境。为应对这一情况并充分发挥侵入性操作的全部益处,必须依靠受过良好培训、具备充足耐心的专业医护人员来支持孩子及其家属。
至关重要的是,尿动力学团队及所有相关专业人员应了解实体的最新标准化与命名法以及良好尿动力学实践,以便用共同语言进行沟通并报告结果。这样,研究将产生更为可靠的结果。
参考文献
- Linde JM, Nijman RJM, Trzpis M, Broens PMA. Prevalence of urinary incontinence and other lower urinary tract symptoms in children in the Netherlands. J Pediatr Urol 2019; 15 (2): 164.e1–164.e7. DOI: 10.1016/j.jpurol.2018.10.027.
- Lopes I, Veiga ML, Braga AANM, Brasil CA, Hoffmann A, Barroso U. A two-day bladder diary for children: Is it enough? J Pediatr Urol 2015; 11 (6): 348.e1–348.e4. DOI: 10.1016/j.jpurol.2015.04.032.
- Burgers RE, Mugie SM, Chase J, Cooper CS, Gontard A von, Rittig CS, et al.. Management of Functional Constipation in Children with Lower Urinary Tract Symptoms: Report from the Standardization Committee of the International Children’s Continence Society. J Urol 2013; 190 (1): 29–36. DOI: 10.1016/j.juro.2013.01.001.
- Robin SG, Keller C, Zwiener R, Hyman PE, Nurko S, Saps M, et al.. Prevalence of Pediatric Functional Gastrointestinal Disorders Utilizing the Rome IV Criteria. J Pediatr 2018; 195: 134–139. DOI: 10.1016/j.jpeds.2017.12.012.
- Chase J, Bower W, Gibb S, Schaeffer A, Gontard A von. Diagnostic scores, questionnaires, quality of life, and outcome measures in pediatric continence: A review of available tools from the International Children’s Continence Society. J Pediatr Urol 2018; 14 (2): 98–107. DOI: 10.1016/j.jpurol.2017.12.003.
- Lee LC, Koyle MA. The Role of Bladder and Bowel Dysfunction (BBD) in Pediatric Urinary Tract Infections. Curr Bladder Dysfunct Rep 2014; 9 (3): 188–196. DOI: 10.1007/s11884-014-0240-0.
- Austin PF, Bauer SB, Bower W, Chase J, Franco I, Hoebeke P, et al.. Faculty Opinions recommendation of The standardization of terminology of lower urinary tract function in children and adolescents: update report from the Standardization Committee of the International Children’s Continence Society. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2016; 35: 471–481. DOI: 10.3410/f.718270635.793500042.
- Schewe J, Brands FH, Pannek J. Voiding Dysfunction in Children: Role of Urodynamic Studies. Urol Int 2002; 69 (4): 297–301. DOI: 10.1159/000066129.
- Bauer SB, Nijman RJ, Drzewiecki BA, Sillen U. Faculty Opinions recommendation of International Children’s Continence Society standardization report on urodynamic studies of the lower urinary tract in children. Neurourol Urodyn 2015; 34 (7): 640–647. DOI: 10.3410/f.725510393.793507237.
- Tekgul S, Stein R, Bogaert G, Undre S, Nijman RJM, Quaedackers J, et al.. EAU-ESPU guidelines recommendations for daytime lower urinary tract conditions in children. Eur J Pediatr 2020; 179 (7): 1069–1077. DOI: 10.1007/s00431-020-03681-w.
- Franco I, Shei-Dei Yang S, Chang S-J, Nussenblatt B, Franco JA. A quantitative approach to the interpretation of uroflowmetry in children. Neurourol Urodyn 2016; 35 (7): 836–846. DOI: 10.1002/nau.22813.
- Wenske S, Van Batavia JP, Combs AJ, Glassberg KI. Analysis of uroflow patterns in children with dysfunctional voiding. J Pediatr Urol 2014; 10 (2): 250–254. DOI: 10.1016/j.jpurol.2013.10.010.
- Van Batavia JP, Combs AJ, Fast AM, Glassberg KI. Use of non-invasive uroflowmetry with simultaneous electromyography to monitor patient response to treatment for lower urinary tract conditions. J Pediatr Urol 2014; 10 (3): 532–537. DOI: 10.1016/j.jpurol.2013.11.015.
- Combs AJ, Grafstein N, Horowitz M, Glassberg KI. Primary Bladder Neck Dysfunction In Children And Adolescents I: Pelvic Floor Electromyography Lag Time–a New Noninvasive Method To Screen For And Monitor Therapeutic Response. J Urol 2005; 173 (1): 207–211. DOI: 10.1097/01.ju.0000147269.93699.5a.
- Ha JS, Lee YS, Han SW, Kim SW. The relationship among flow index, uroflowmetry curve shape, and EMG lag time in children. Neurourol Urodyn 2020; 39 (5): 1387–1393. DOI: 10.1002/nau.24349.
- Chang S-J, Chiang I-N, Hsieh C-H, Lin C-D, Yang SS-D. Age- and gender-specific nomograms for single and dual post-void residual urine in healthy children. Neurourol Urodyn 2013; 32 (7): 1014–1018. DOI: 10.1002/nau.22342.
- Bauer SB, Austin PF, Rawashdeh YF, Jong TP de, Franco I, Siggard C, et al.. International children’s continence society’s recommendations for initial diagnostic evaluation and follow-up in congenital neuropathic bladder and bowel dysfunction in children. Neurourol Urodyn 2012; 31 (5): 610–614. DOI: 10.1002/nau.22247.
- Tanaka ST, Yerkes EB, Routh JC, Tu DD, Austin JC, Wiener JS, et al.. Urodynamic characteristics of neurogenic bladder in newborns with myelomeningocele and refinement of the definition of bladder hostility: Findings from the UMPIRE multi-center study. J Pediatr Urol 2021; 17 (5): 726–732. DOI: 10.1016/j.jpurol.2021.04.019.
- Lopez Imizcoz F, Burek CM, Sager C, Vasquez Patiño M, Gomez YR, Szklarz MT, et al.. Pediatric Urodynamic Study Without a Preprocedural Urine Culture, Is It Safe in Clinical Practice? Urology 2020; 145: 224–228. DOI: 10.1016/j.urology.2020.07.054.
- Özmert S, Sever F, Tiryaki HT. Evaluation of the effects of sedation administered via three different routes on the procedure, child and parent satisfaction during cystometry. Springerplus 2016; 5 (1): 10 1186 40064–40016–3164–3167. DOI: 10.1186/s40064-016-3164-7.
- Chen Z, Lin M, Huang Z, Zeng L, Huang L, Yu D, et al.. Efficacy of Chloral Hydrate Oral Solution for Sedation in Pediatrics: a Systematic Review and Meta-Analysis [Corrigendum]. Drug Des Devel Ther 2022; Volume 16 (13): 3491–3492. DOI: 10.2147/dddt.s392339.
- Wagner AA, Godley ML, Duffy PG, Ransley PG. A Novel, Inexpensive, Double Lumen Suprapubic Catheter for Urodynamics. J Urol 2004; 171 (3): 1277–1279. DOI: 10.1097/01.ju.0000110761.60356.44.
- Wen JG, Djurhuus JC, Rosier PFWM, Bauer SB. ICS educational module: Cystometry in children. Neurourol Urodyn 2018; 37 (8): 2306–2310. DOI: 10.1002/nau.23729.
- Gilmour RF, Churchill BM, Steckler RE, Houle A-M, Khoury AE, McLorie GA. A New Technique for Dynamic Analysis of Bladder Compliance. J Urol 1993; 150 (4): 1200–1203. DOI: 10.1016/s0022-5347(17)35727-0.
- Chin-Peuckert L, Komlos M, Rennick JE, Jednak R, Capolicchio J-P, Salle JLP. What is the Variability Between 2 Consecutive Cystometries in the Same Child? J Urol 2003; 170 (4 Part 2): 1614–1617. DOI: 10.1097/01.ju.0000084298.49645.27.
- Landau EH, Churchill BM, Jayanthi VR. The sensitivity of pressure specific bladder volume versus total bladder capacity as a measure of bladder storage dysfunction. J Pediatr Surg 1994; 30 (5): 761. DOI: 10.1016/0022-3468(95)90736-x.
- Tarcan T, Sekerci CA, Akbal C, Tinay I, Tanidir Y, Sahan A, et al.. Is 40 cm H2O detrusor leak point pressure cut-off reliable for upper urinary tract protection in children with myelodysplasia? Neurourol Urodyn 2017; 36 (3): 759–763. DOI: 10.1002/nau.23017.
- Rosier PFWM, Schaefer W, Lose G, Goldman HB, Guralnick M, Eustice S, et al.. International Continence Society Good Urodynamic Practices and Terms 2016: Urodynamics, uroflowmetry, cystometry, and pressure-flow study. Neurourol Urodyn 2017; 36 (5): 1243–1260. DOI: 10.1002/nau.23124.
- Abrams P. Describing bladder storage function: overactive bladder syndrome and detrusor overactivity. Urology 2003; 62 (5): 28–37. DOI: 10.1016/j.urology.2003.09.050.
- Bauer SB, Vasquez E, Cendron M, Wakamatsu MM, Chow JS. Pelvic floor laxity: A not so rare but unrecognized form of daytime urinary incontinence in peripubertal and adolescent girls. J Pediatr Urol 2018; 14 (6): 544.e1–544.e7. DOI: 10.1016/j.jpurol.2018.04.030.
- Bachelard M, Sillén U, Hansson S, Hermansson G, Jodal U, Jacobsson B. Urodynamic Pattern In Asymptomatic Infants: Siblings Of Children With Vesicoureteral Reflux. J Urol 1999; 162 (5): 1733–1738. DOI: 10.1016/s0022-5347(05)68226-2.
- Marks BK, Goldman HB. Videourodynamics. Urol Clin North Am 2014; 41 (3): 383–391. DOI: 10.1016/j.ucl.2014.04.008.
- Sager C, Burek C, Corbetta JP, Weller S, Ruiz J, Perea R, et al.. Initial urological evaluation and management of children with neurogenic bladder due to myelomeningocele. J Pediatr Urol 2017; 13 (3): 271.e1–271.e5. DOI: 10.1016/j.jpurol.2016.12.024.
- Ngo TC, Clark CJ, Wynne C, Kennedy WA. Radiation Exposure During Pediatric Videourodynamics. J Urol 2011; 186 (4s): 1672–1677. DOI: 10.1016/j.juro.2011.04.014.
- De Gennaro M, Capitanucci M, Silveri M, Mosiello G, Broggi M, Pesce F. Continuous (6 Hour) Urodynamic Monitoring in Children with Neuropathic Bladder. Eur J Pediatr Surg 1996; 6 (S 1): 21–24. DOI: 10.1055/s-2008-1071032.
- Lu YT, Jakobsen LK, Djurhuus JC, Bjerrum SN, Wen JG, Olsen LH. What is a representative voiding pattern in children with lower urinary tract symptoms? Lack of consistent findings in ambulatory and conventional urodynamic tests. J Pediatr Urol 2016; 12 (3): 154.e1–154.e7. DOI: 10.1016/j.jpurol.2016.02.006.
最近更新时间: 2025-09-22 08:00