51: Desenvolvimentos Futuros no Manejo de Cálculos
Este capítulo levará aproximadamente 19 minutos para ler.
Introdução
As últimas duas décadas testemunharam um aumento dramático na incidência de cálculos renais pediátricos, sendo os adolescentes o grupo etário de crescimento mais rápido entre todas as faixas etárias afetadas por esta doença.1 Como crianças e adultos jovens enfrentam desafios únicos em termos de prestação de cuidados, riscos do tratamento e processos patológicos subjacentes, os avanços na litíase renal em termos de miniaturização dos equipamentos, redução da exposição à radiação ionizante e melhoria dos cuidados para pacientes com predisposição genética à litíase urinária podem beneficiar preferencialmente os pacientes pediátricos. Este capítulo revisará os avanços não apenas em equipamentos cirúrgicos, mas também em diagnóstico, terapêutica e prestação de cuidados.
Diagnóstico e Avaliação Inicial
Embora a ultrassonografia (US) continue sendo a estratégia de imagem de primeira linha preferida para a maioria das crianças com suspeita de nefrolitíase, essa modalidade de imagem apresenta limitações quanto à dependência do operador, à disponibilidade e à acurácia.2,3 Por outro lado, a tomografia computadorizada (CT) é a modalidade de imagem padrão-ouro para acurácia diagnóstica, mas acarreta altos riscos de exposição à radiação ionizante, riscos que são ainda mais agravados na população pediátrica.4 As inovações no campo da imagem diagnóstica incluem aprimorar a acurácia da US, reduzir a exposição à radiação associada à CT e ampliar funcionalidades adicionais, como a propulsão de cálculos.
Acurácia da ultrassonografia
A US baseia-se nas propriedades sonográficas na interface entre o cálculo e a urina para produzir a imagem clássica de um foco ecogênico na US em modo B. Além disso, a deflexão das ondas acústicas nos focos ecogênicos pode produzir uma sombra acústica posterior enquanto a aplicação de configurações de Doppler pode criar um artefato twinkle sobre o cálculo.5 Ambas as técnicas podem melhorar a acurácia da imagem por US.6 Além disso, a sombra acústica posterior tem o potencial de fornecer uma estimativa de tamanho mais acurada do cálculo urinário.7 No entanto, atualmente as modalidades de imagem para capturar e realçar esses achados não são bem padronizadas, tampouco a identificação e o relato dessas medidas são padronizados de qualquer forma, e são necessárias avaliações adicionais para otimizar as tecnologias atuais e a compreensão dos achados na US. Além da otimização das tecnologias atuais de imagem, modificações nas propriedades acústicas do equipamento ultrassônico podem produzir características de imagem mais distintas dos cálculos urinários. Um exemplo desse tipo, atualmente usado em uma plataforma de pesquisa, é a imagem ultrassônica Stone-Mode (isto é, “S-mode™”). A imagem S-mode™ baseia-se em um transdutor de alta frequência para otimizar a interface visual entre o cálculo e o tecido circundante e realçar a aparência da sombra acústica. O uso de algoritmos de pós-processamento que tendem a desfocar as imagens entre o cálculo denso e a sombra posterior é minimizado, resultando em uma imagem mais nítida do cálculo, ao custo de uma redução na imagem de tecidos moles.8
Tomografias Computadorizadas de Baixa Dose
Embora aprimorar a imagem por US seja atraente para minimizar a radiação ionizante em crianças com nefrolitíase, a TC provavelmente continuará sendo uma modalidade de imagem fundamental no diagnóstico de nefrolitíase pelos próximos anos. Vários aspectos dos atuais algoritmos de TC com protocolo para cálculos, como corrente do tubo, tensão do tubo e tempo do gantry, podem ser reduzidos a fim de diminuir a dose de radiação ionizante durante esses exames.9 Embora a TC de baixa dose dificilmente pudesse ser classificada como uma “tecnologia do futuro”, dada a vasta quantidade de literatura que atualmente respalda seu uso, é claro que o futuro do manejo dos cálculos poderia ser melhorado ao ampliar a adoção dessa tecnologia.10 Nesse sentido, o foco para a TC de baixa dose deve estar em estratégias para aprimorar a educação dos profissionais e o suporte à decisão incorporado ao prontuário eletrônico. Estratégias semelhantes têm sido utilizadas para produzir práticas sustentáveis de gestão responsável da radiação nos departamentos de emergência pediátrica.11
Propulsão por imagem
O uso de propulsão ultrassônica na nefrolitíase foi relatado pela primeira vez em ensaios clínicos em humanos em 2016.12,13 Essa tecnologia, que aproveita energia acústica focalizada por meio de uma sonda transcutânea, é capaz de impulsionar cálculos renais dentro do sistema coletor renal (Figura 1). As aplicações dessa tecnologia incluem o reposicionamento de cálculos renais obstrutivos para longe da junção ureteropélvica, o reposicionamento de cálculos para um local de tratamento mais favorável (isto é, do polo inferior para o polo superior), a distinção entre um pequeno aglomerado de cálculos e um cálculo grande dominante, e o estímulo à passagem de fragmentos menores após o tratamento. Ensaios de viabilidade em humanos observaram movimentação do cálculo em 14 de 15 indivíduos, incluindo um que relatou alívio imediato após o reposicionamento de um cálculo parcialmente obstrutivo.12 O uso intraoperatório dessa tecnologia confirmou visualmente a movimentação dos cálculos durante a ureteroscopia, corroborando uma abordagem de prova de conceito para o reposicionamento de cálculos visando facilitar o tratamento endoscópico.14 Embora, até o momento desta redação, essa tecnologia não tenha sido aplicada em pacientes pediátricos, a ausência de radiação ionizante e as oportunidades de aprimorar tanto as abordagens diagnósticas quanto terapêuticas tornam-na uma tecnologia promissora para o futuro no campo da nefrolitíase pediátrica.
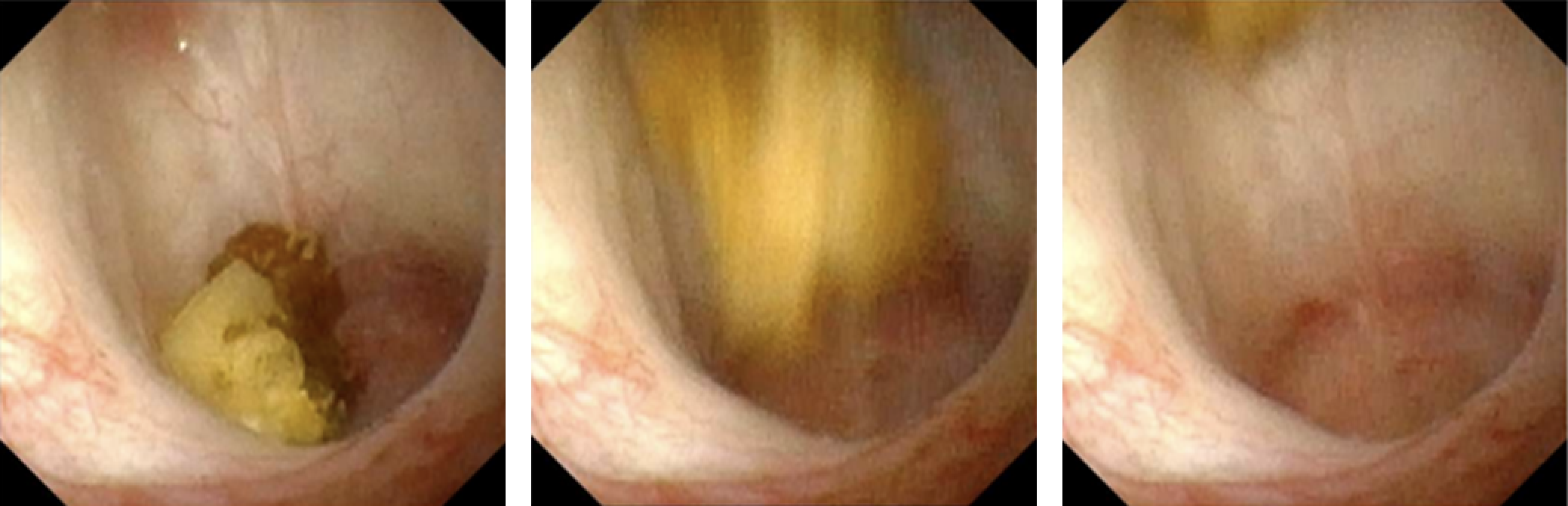
Figura 1 Imagem ureteroscópica em tempo real de propulsão in vivo de um cálculo calicial de 7 mm por propulsão extracorpórea. Cortesia de Michael Bailey e Barbrina Dunmire, da Universidade de Washington.
Avaliação Metabólica e Genética
Embora tenha havido poucos avanços nas avaliações tradicionais para o risco de cálculos renais e patologia subjacente (isto é, estudos de soro ou urina), os avanços no sequenciamento genético ampliaram as oportunidades de testes genéticos no âmbito da doença de cálculo renal de início precoce. Testes genéticos não são necessários para o diagnóstico de certas doenças monogênicas de cálculo renal com cálculos patognomônicos (isto é, cistinúria ou adenina fosforribosiltransferase).15 No entanto, demonstrou-se que os testes genéticos detectam possíveis fontes monogênicas de doença de cálculo renal em até 20% das crianças encaminhadas a um centro terciário de cálculos renais.16 Questões práticas relacionadas à estratégia diagnóstica do teste genético incluem as informações que possam orientar condutas com base nos resultados do teste e a interpretação de variantes de significado incerto. No que diz respeito à primeira questão, muitos genes nos painéis multigênicos mais utilizados como referência (frequentemente > 30) se manifestam de forma multissistêmica, de modo que o diagnóstico pode ser suspeitado, se não já conhecido, antes do teste genético. Além disso, na maioria dessas doenças monogênicas de cálculo renal, não existe um tratamento direcionado e a conduta é majoritariamente guiada pelo contexto clínico. Ainda assim, doenças em que a detecção precoce é importante, como a hiperoxalúria primária, podem justificar a testagem em cenários em que o índice de suspeição é alto, como pacientes mais jovens ou aqueles com forte história familiar de nefrolitíase.17 Notavelmente, aproximadamente um terço das mutações relatadas são novas, o que levanta tanto questões sobre as implicações patológicas dessas variantes de significado incerto quanto a possibilidade de ampliar o conhecimento sobre a doença de cálculo renal de base genética. Nesses casos, análises de bioinformática, incluindo modelagem por software para prever a estrutura proteica e a possível patogenicidade, podem orientar a interpretação de resultados incertos.18 Em resumo, avaliações genéticas podem ser úteis especialmente ao avaliar fontes potencialmente tratáveis de doença monogênica de cálculo renal em populações de alto risco, e a colaboração com geneticistas pode ser inestimável ao manejar variantes de significado incerto ou no aconselhamento.
Prevenção
Tecnologias de lembretes
Independentemente do desenvolvimento de novas terapias para a prevenção secundária de cálculos renais, as medidas dietéticas e de ingestão de líquidos continuam sendo os pilares das estratégias preventivas.19 No entanto, tanto clínicos quanto pacientes reconhecem desafios para a adesão a essas recomendações, especialmente quanto aos altos volumes de ingestão diária de líquidos. Diversas tecnologias novas, como garrafas de água “inteligentes” com capacidade de enviar alertas eletrônicos just-in-time às famílias, foram propostas como ferramentas para melhorar a ingestão de líquidos. É digno de nota que apenas 20% dos adolescentes que receberam essa tecnologia ainda assim atingiram suas metas de ingestão de líquidos durante a maior parte de um estudo de uma semana.20 Outros autores testaram aplicativos para smartphones e/ou tecnologias vestíveis para melhorar a experiência de ingestão de líquidos, com resultados variados.21,22 Uma via promissora para aprimorar as tecnologias de lembrete é o uso de aconselhamento comportamental, que está atualmente sendo explorado no ensaio Prevention of Urinary Stones with Hydration (PUSH). Até o momento desta redação, o ensaio PUSH havia concluído o recrutamento, mas os resultados ainda estavam pendentes.23 Importa notar que há um braço de adolescentes no estudo, oferecendo a possibilidade de investigar especificamente a experiência pediátrica. Embora o verdadeiro valor e o impacto das tecnologias de lembrete para melhorar a adesão à prevenção secundária de cálculos renais permaneçam incertos, deve-se considerar que o uso dessas tecnologias ainda pode evoluir em termos de formato ou interface, enquanto mudanças geracionais na adoção de tecnologias podem ampliar ainda mais as oportunidades de aproveitar tais inovações.
Prevenção Médica
Os avanços mais empolgantes na prevenção médica da litíase renal incluem novas opções terapêuticas na forma de terapias-alvo, bem como abordagens inovadoras de impacto farmacológico. A recente aprovação pela Food and Drug Association do lumasiran para Hiperoxalúria Primária Tipo 1 representa um avanço histórico, por ser tanto a primeira terapia-alvo para essa doença quanto o primeiro fármaco de RNAi aprovado para uso em doença nefro-urológica.24 O medicamento tem como alvo o RNA mensageiro que codifica a glicolato oxidase, inibindo assim a conversão de glicolato em oxalato. É administrado por via subcutânea a cada 1–3 meses e foi aprovado para todo o espectro da população pediátrica, com posologia baseada no peso indicada para crianças mais novas, com pacientes com peso inferior a 10 quilogramas recebendo injeções mensais após uma fase de carga e aqueles com mais de 10 quilogramas recebendo injeções a cada três meses. Efeitos adversos comuns incluem reações no local da injeção (20%) e dor abdominal (15%), embora poucos participantes nos ensaios tenham interrompido a participação devido a efeitos adversos.
Tratamento cirúrgico
Entre a multiplicidade de avanços recentes no manejo cirúrgico da urolitíase, vários são particularmente relevantes para pacientes pediátricos. O menor porte corporal, inclusive do próprio ureter, e a suscetibilidade à exposição à radiação são apenas alguns dos aspectos da urolitíase pediátrica que diferem do tratamento em pacientes adultos. Novas tecnologias a laser têm buscado reduzir a retropulsão dos cálculos e aumentar a taxa de ablação, o que pode levar a tempos operatórios mais curtos na ureteroscopia pediátrica (URS). A instrumentação miniaturizada para nefrolitotomia percutânea (PCNL) pode resultar em menor morbidade e sangramento em pacientes pediátricos. Além disso, a litotripsia por ondas pulsadas (burst wave lithotripsy) é uma nova tecnologia que possibilita tratar a urolitíase em ambiente ambulatorial, poupando as crianças de anestesia e de uma recuperação mais difícil.
Avanços na tecnologia a laser
Houve vários avanços recentes na tecnologia de laser, incluindo otimizações daquele que é o pilar da litotripsia a laser, o sistema de hólmio:YAG, bem como um novo laser de fibra de túlio (TFL) que tem mostrado resultados iniciais promissores. Avanços mais recentes na tecnologia do laser de hólmio oferecem menor deslocamento dos cálculos-alvo durante a fragmentação a laser e a capacidade de fornecer mais energia, enquanto o TFL oferece benefícios semelhantes e, além disso, pode permitir o uso de fibras de laser menores.
Modificações do Hólmio:YAG
O sistema de hólmio:YAG tem sido o padrão-ouro para litotripsia a laser desde sua introdução, devido à facilidade de uso e ao perfil de segurança favorável.25 Modificações mais recentes, como a tecnologia Moses e os modos de pulso longo, alteram essa abordagem de comprimento de pulso único e fixo. Modos de pulso longo entregam a mesma quantidade de energia ao longo de um período de tempo maior, tipicamente de 500–1000 µs, reduzindo a retropulsão à custa de menor entrega de energia.26,27,28,29 O efeito Moses descreve um fenômeno físico que ocorre quando um laser de hólmio é disparado em um meio fluido (Figura 2). Essa energia emitida é altamente absorvida na água, levando à formação de um túnel de vapor. Em um pulso único padrão de um laser de hólmio, essa transferência de energia não consegue alcançar a interface do cálculo. A tecnologia Moses permite que a energia seja entregue em dois pulsos; o primeiro pulso entrega uma pequena quantidade de energia, causando a formação de um canal de vapor, enquanto o segundo pulso entrega a maior parte da energia, que agora pode percorrer o canal de vapor formado até o cálculo alvo.26 Foi demonstrado que a tecnologia Moses reduz o tempo operatório em ambiente clínico devido à diminuição da retropulsão e ao aumento da eficiência de fragmentação de cálculos.30,31
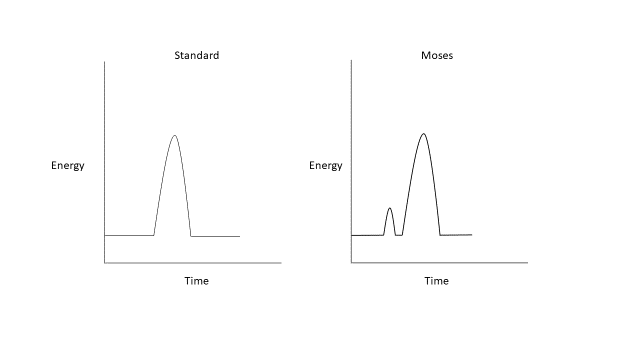
Figura 2 Formas de onda do laser de hólmio:YAG padrão e Moses.
Fibra de túlio
O TFL gera um feixe de laser com mais eficiência do que o hólmio:YAG, baseando-se em um laser de diodo que emite luz dentro do pico de absorção dos íons de túlio, excitando assim íons de túlio dentro de uma fina fibra de silício com perda mínima de energia na forma de calor, permitindo faixas de frequência mais altas e faixas mais amplas de energia de pulso.25,32 Configurações de exemplo usadas na fragmentação de um cálculo renal, assim como o gerador TFL, podem ser vistas na Figura 3. Fibras de laser menores, tão pequenas quanto 150 µm e 50 µm em desenvolvimento in vitro, permitem melhor fluxo de irrigação e o potencial de miniaturizar ainda mais ureteroscópios.33 O TFL emite luz em um comprimento de onda de 1940 nm, ainda mais próximo do pico de absorção da água de 1910 nm do que a luz emitida pelos lasers de hólmio:YAG. Isso leva a um perfil de segurança favorável, pois a profundidade de penetração é reduzida.34

Figura 3 Exemplo de configurações do TFL, utilizadas para o tratamento de um cálculo renal (exemplo mostrado aqui durante litotripsia em adulto).
Vários estudos in vitro sugerem que o TFL pode produzir taxas de ablação mais rápidas e potencialmente melhor eliminação de cálculos do que o sistema de hólmio:YAG.35,36 No entanto, há algum debate se essas diferenças são clinicamente significativas. Jaeger et al compararam TFL ao hólmio:YAG durante URS em 125 pacientes pediátricos, dos quais 32 foram tratados com TFL. Os pacientes tratados com TFL tiveram menor probabilidade de apresentar fragmento de cálculo residual, sem diferença significativa no tempo operatório ou na taxa de complicações, embora com maior tempo de aplicação do laser no grupo TFL.37 Uma meta-análise de estudos clínicos em adultos, incluindo quase 1.700 pacientes, mostrou diversas vantagens do TFL em comparação ao hólmio:YAG, incluindo melhores tempos operatórios, tempos de utilização do laser, menor retropulsão e melhor eliminação de cálculos. Não houve diferenças na eficiência de ablação, no uso total de energia ou no tempo de internação hospitalar.38
Devido tanto ao fato de a energia emitida ser tão semelhante ao pico de absorção da água quanto à capacidade de operar em configurações de potência e frequência mais altas, o calor e a lesão térmica são uma preocupação maior com o TFL do que com um laser de hólmio. Além disso, modelos simulados demonstraram que pacientes mais jovens, com rins menores, podem ser mais suscetíveis a lesão térmica durante ureteroscopia para cálculos renais. No entanto, esses efeitos podem ser mitigados com o uso de uma bainha de acesso e irrigação contínua pressurizada39
Miniaturização do PCNL
A experiência inicial com PCNL em pacientes pediátricos foi complicada por taxas de sangramento mais elevadas e por uma maior proporção de pacientes que necessitaram de transfusões de sangue após os procedimentos, devido ao uso de instrumentos maiores, de tamanho adulto (até 30 Fr).40,41 Houve avanços significativos na miniaturização dos instrumentos necessários para realizar a PCNL; isso levou ao aumento da utilização da PCNL na população pediátrica, com menores taxas de complicações.42 A Mini-PCNL foi descrita pela primeira vez em 1998 por Jackman et al em uma tentativa de desenvolver uma técnica de PCNL menos invasiva que reduzisse a morbidade em crianças pequenas.42 Notavelmente, essa inovação inicialmente descrita em crianças também ganhou espaço na população adulta.
Esforços adicionais para miniaturizar a PCNL resultaram em PCNL ultra-mini (UMP) (11–13 Fr) e micro-PCNL (4.8 Fr). O UMP pode ser realizado com nefroscópio ou ureteroscópio, utilizando fragmentação a laser, e demonstrou eliminação de cálculos equivalente à mini-PCNL, com tempos operatórios mais longos.43,44 A micro-PCNL representa o menor trato de acesso atualmente descrito para procedimentos de PCNL miniaturizados, utilizando uma “all-seeing needle” que mede 4.85 Fr e possui um lúmen capaz de acomodar uma fibra laser de 200 micra.45 É importante notar que esta técnica não permite a remoção significativa de fragmentos de cálculos diretamente pelo trato de acesso.
Há várias vantagens em reduzir o calibre dos instrumentos na PCNL, incluindo: menor sangramento, menor trauma ao parênquima renal e menor dor relacionada ao trajeto de acesso. Uma revisão sistemática recente buscou avaliar a eficácia e as complicações das técnicas de PCNL minimamente invasivas em pacientes pediátricos.46 Foram incluídos ao todo 14 estudos abrangendo 456 pacientes submetidos à micro-PCNL ou UMP. O tamanho médio dos cálculos variou de 12 a 16,5 mm. A taxa livre de cálculos variou de 80–100% e complicações foram observadas em 14% dos pacientes. 77% das complicações foram Clavien-Dindo grau I ou II. As complicações incluíram hematúria, febre, extravasamento de urina, infecção do trato urinário, necessidade de transfusão e 3 pacientes com perfuração da pelve renal. No geral, a taxa de transfusão nesta revisão sistemática foi de 2,1%. A PCNL minimamente invasiva demonstrou ser segura para pacientes pediátricos. Entretanto, há algumas desvantagens, incluindo menor clareza visual e incapacidade de remover cálculos através do trajeto de acesso na micro-PCNL. Há também algumas evidências de aumento da pressão intrarrenal na mini-PCNL.47 Com a crescente gama de opções para o manejo cirúrgico da litíase renal pediátrica, a UMP e a micro-PCNL representam uma opção atraente que deve ser considerada em pacientes com carga litiásica renal moderada.
Avanços na fragmentação ultrassônica de cálculos: litotripsia por ondas de rajada
Embora, historicamente, a SWL tenha sido utilizada como terapia de primeira linha para fragmentar cálculos na população pediátrica, o procedimento requer anestesia geral e, com os avanços mais recentes das técnicas endoscópicas, caiu em desuso em muitas situações: particularmente em pacientes com maior carga litiásica, cálculos de composição mais dura, distância pele-cálculo aumentada e doença litiásica no polo inferior do rim.48 A SWL envolve a aplicação de um único ciclo de energia a uma taxa lenta (0.5–3 Hz) para fragmentar cálculos. A litotripsia por ondas em rajada (BWL) é uma modalidade relativamente nova em estudo que utiliza rajadas sinusoidais de múltiplos ciclos de pulsos de ultrassom focalizado para fraturar cálculos, em vez do único ciclo de compressão/tração criado pela SWL (Figura 4). A BWL oferece uma terapia potencial que poderia ser utilizada em ambiente de consultório ou sala de sedação, sem necessidade de anestesia geral, o que seria uma opção atraente para muitos pacientes pediátricos.13
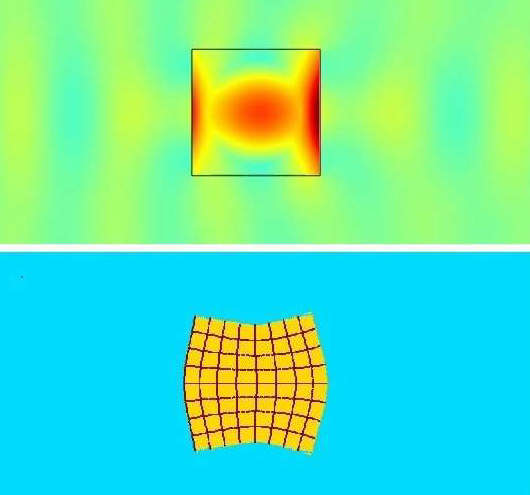
Figura 4 Simulação de litotripsia por ondas de rajada (BWL) através da interface do cálculo. A imagem superior mostra as ondas de pressão amarelas e azul-esverdeadas atravessando o cálculo, com amplificação central da tensão em 5 vezes no interior do cálculo devido aos múltiplos ciclos de pulso da BWL. A imagem inferior demonstra uma imagem exagerada da distorção do cálculo induzida por tensão em razão da amplificação de tensão previamente descrita. Imagem cortesia de Oleg Sapozhnikov, da Universidade de Washington.
Há várias diferenças importantes nas propriedades geradas pela BWL quando comparada com a SWL tradicional. Na SWL, um pulso de aproximadamente 5 µs se repete em intervalos de 0.33 a 2 segundos, resultando em 180 ondas de choque por minuto. A BWL é aplicada usando 10–100 ciclos por vez e foi investigada em uma faixa de 300–500 kHz em humanos.13 A amplitude de pico de uma forma de onda de SWL é aproximadamente 10 vezes maior do que a da BWL. No entanto, a BWL pode fornecer a mesma quantidade de energia por usar muitos mais ciclos do que o pulso único de energia da SWL. Além disso, enquanto a SWL cria uma nuvem de cavitação em uma área focal que pode causar lesão tecidual, na BWL há um crescimento mais brando de bolhas de cavitação. As nuvens de bolhas são mais difusas e tipicamente não sofrem colapso violento, potencialmente minimizando o dano celular.49 Embora haja alguma evidência de que as nuvens de bolhas mais difusas geradas na BWL possam levar à blindagem do cálculo-alvo frente a pulsos subsequentes, a BWL pode superar essa limitação escalonando a entrega de energia.50 Um modelo mostrou que o uso de frequências específicas para diferentes tamanhos de cálculo pode amplificar a tensão interna no cálculo gerada pela BWL, opção não disponível na SWL padrão.51
Há dados limitados sobre o uso de BWL no contexto clínico, e deve-se observar que esse tratamento ainda não foi estudado em crianças.52 As experiências clínicas atuais estão resumidas na Tabela 1. O maior ensaio atualmente relatado, com 19 pacientes, tratou cálculos < 12 mm por até 10 minutos com BWL. A mediana de 90% do volume do cálculo foi completamente cominuída em 10 minutos e 39% dos cálculos-alvo foram fragmentados, com todos os fragmentos <2 mm, dentro de 10 minutos.53 Outro estudo tratou 13 pacientes acordados e não anestesiados com propulsão ultrassônica e BWL, com eliminação de cálculos relatada em 70% e um escore médio de dor de 1,2/10 durante o tratamento.54
Tabela 1 Resumo da pesquisa no PubMed sobre avaliações de litotripsia por ondas em rajadas em ensaios em humanos.
| Ano | Autor | Título | Resultados principais | |
|---|---|---|---|---|
| 2021 | Harper | Primeira litotripsia por ondas de rajada em humanos para cominuição de cálculos renais: dois estudos de caso iniciais54 | Paciente A teve BWL bem-sucedida para cálculo renal observado via URS. Paciente B realizou BWL acordada para cálculo de 7.5 mm em UVJ, tolerou bem o procedimento, o cálculo foi eliminado no POD 15. | |
| 2022 | Harper | Fragmentação de cálculos por litotripsia por ondas de rajada nos primeiros 19 humanos10 | 21 de 23 cálculos fragmentados. Cominuição mediana do cálculo de 90%. Fragmentação completa em <10 minutos para 9/23 cálculos. | |
| 2022 | Hall | Primeira série utilizando propulsão ultrassônica e litotripsia por ondas de rajada para tratar cálculos ureterais11 | 13 pacientes tratados com BWL em conjunto com propulsão ultrassônica. 70% dos pacientes que se submeteram à BWL acordada eliminaram o cálculo. Escore médio de dor durante a BWL 1.2/10. |
Conclusões
De muitas maneiras—como estratégias de imagem otimizadas, inibidores de RNA para hiperoxalúria primária e avanços cirúrgicos em tecnologia a laser e PCNL miniaturizada—o futuro do manejo de cálculos renais pediátricos já chegou. No entanto, essas tecnologias precisam ser mais bem compreendidas quanto ao uso clínico mais eficaz, questões que estão maduras para pesquisa de efetividade comparativa. Outros avanços tecnológicos, como propulsão por imagem e BWL, permanecem no horizonte do manejo, mas oferecem caminhos promissores para tratamentos para crianças nas próximas várias décadas.
Referências
- Tasian GE, Ross ME, Song L, Sas DJ, Keren R, Denburg MR, et al.. Annual Incidence of Nephrolithiasis among Children and Adults in South Carolina from 1997 to 2012. Clin J Am Soc Nephrol 2016; 11 (3): 488–496. DOI: 10.2215/cjn.07610715.
- Roberson NP, Dillman JR, O’Hara SM, DeFoor WR, Reddy PP, Giordano RM, et al.. Comparison of ultrasound versus computed tomography for the detection of kidney stones in the pediatric population: a clinical effectiveness study. Pediatr Radiol 2018; 48 (7): 962–972. DOI: 10.1007/s00247-018-4099-7.
- Ellison JS, Thakrar P. The Role of Imaging in Management of Stone Disease. Diagnosis and Management of Pediatric. Nephrolithiasis: Springer; 2022. DOI: 10.1007/978-3-031-07594-0\\_8.
- Frush DP. Pediatric CT: practical approach to diminish the radiation dose. Pediatr Radiol 2002; 32 (10): 714–717. DOI: 10.1007/s00247-002-0797-1.
- Dai JC, Bailey MR, Sorensen MD, Harper JD. Innovations in Ultrasound Technology in the Management of Kidney Stones. Urol Clin North Am 2019; 46 (2): 273–285. DOI: 10.1016/j.ucl.2018.12.009.
- Masch WR, Cohan RH, Ellis JH, Dillman JR, Rubin JM, Davenport MS. Clinical Effectiveness of Prospectively Reported Sonographic Twinkling Artifact for the Diagnosis of Renal Calculus in Patients Without Known Urolithiasis. AJR Am J Roentgenol 2016; 206 (2): 326–331. DOI: 10.2214/ajr.15.14998.
- Verhagen MV, Watson TA, Hickson M, Smeulders N, Humphries PD. Acoustic shadowing in pediatric kidney stone ultrasound: a retrospective study with non-enhanced computed tomography as reference standard. Pediatr Radiol 2019; 49 (6): 777–783. DOI: 10.1007/s00247-019-04372-x.
- Simon JC, Dunmire B, Bailey MR, Sorensen MD. Developing Complete Ultrasonic Management of Kidney Stones for Spaceflight. J Space Saf Eng 2016; 3 (2): 50–57. DOI: 10.1016/s2468-8967(16)30018-0.
- Lira D, Padole A, Kalra MK, Singh S. Tube Potential and CT Radiation Dose Optimization. AJR Am J Roentgenol 2015; 204 (1): W4–w10. DOI: 10.2214/ajr.14.13281.
- Niemann T, Kollmann T, Bongartz G. Diagnostic Performance of Low-Dose CT for the Detection of Urolithiasis: A Meta-Analysis. AJR Am J Roentgenol 2008; 191 (2): 396–401. DOI: 10.2214/ajr.07.3414.
- Ellison JS, Crowell CS, Clifton H, Whitlock K, Haaland W, Chen T, et al.. A clinical pathway to minimize computed tomography for suspected nephrolithiasis in children. J Pediatr Urol 2019; 15 (5): 518.e1–518.e7. DOI: 10.1016/j.jpurol.2019.06.014.
- Harper JD, Cunitz BW, Dunmire B. Faculty Opinions recommendation of First in human clinical trial of ultrasonic propulsion of kidney stones. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2016; 195: 956, DOI: 10.3410/f.725901820.793511249.
- Raskolnikov D, Bailey MR, Harper JD. Recent Advances in the Science of Burst Wave Lithotripsy and Ultrasonic Propulsion. BME Front 2022; 2022. DOI: 10.34133/2022/9847952.
- Dai JC, Sorensen MD, Chang HC, Samson PC, Dunmire B, Cunitz BW, et al.. Quantitative Assessment of Effectiveness of Ultrasonic Propulsion of Kidney Stones. J Endourol 2019; 33 (10): 850–857. DOI: 10.1089/end.2019.0340.
- Goldstein R, Goldfarb DS. Early Recognition and Management of Rare Kidney Stone Disorders. Urol Nurs 2017; 37 (2): 81. DOI: 10.7257/1053-816x.2017.37.2.81.
- Daga A, Majmundar AJ, Braun DA, Gee HY, Lawson JA, Shril S, et al.. Whole exome sequencing frequently detects a monogenic cause in early onset nephrolithiasis and nephrocalcinosis. Kidney Int 2018; 93 (1): 204–213. DOI: 10.1016/j.kint.2017.06.025.
- Langman CB. A rational approach to the use of sophisticated genetic analyses of pediatric stone disease. Kidney Int 2018; 93 (1): 15–18. DOI: 10.1016/j.kint.2017.08.023.
- Ma Y, Lv H, Wang J, Tan J. Heterozygous mutation of SLC34A1 in patients with hypophosphatemic kidney stones and osteoporosis: a case report. J Int Med Res 2020; 48 (3): 030006051989614. DOI: 10.1177/0300060519896146.
- Tasian GE, Copelovitch L. Evaluation and Medical Management of Kidney Stones in Children. J Urol 2014; 192 (5): 1329–1336. DOI: 10.1016/j.juro.2014.04.108.
- Tasian GE, Ross M, Song L. Ecological Momentary Assessment of Factors Associated with Water Intake Among Adolescents with Kidney Stone Disease. 2018. DOI: 10.1016/j.juro.2018.07.064.
- Conroy DE, West AB, Brunke-Reese D, Thomaz E, Streeper NM. Just-in-time adaptive intervention to promote fluid consumption in patients with kidney stones. Health Psychol 2020; 39 (12): 1062–1069. DOI: 10.1037/hea0001032.
- Wright HC, Alshara L, DiGennaro H, Kassis YE, Li J, Monga M, et al.. The impact of smart technology on adherence rates and fluid management in the prevention of kidney stones. Urolithiasis 2022; 50 (1): 29–36. DOI: 10.1007/s00240-021-01270-6.
- Scales CD, Desai AC, Harper JD, Lai HH, Maalouf NM, Reese PP, et al.. Prevention of Urinary Stones With Hydration (PUSH): Design and Rationale of a Clinical Trial. Am J Kidney Dis 2020; 77 (6): 898–906.e1. DOI: 10.1053/j.ajkd.2020.09.016.
- Garrelfs SF, Frishberg Y, Hulton SA. Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1. N Engl J Med 2021; 385 (20): e69. DOI: 10.1056/nejmc2107661.
- Traxer O, Keller EX. Thulium fiber laser: the new player for kidney stone treatment? A comparison with Holmium:YAG laser. World J Urol 2020; 38 (8): 1883–1894. DOI: 10.1007/s00345-019-02654-5.
- Aldoukhi AH, Black KM, Ghani KR. Emerging Laser Techniques for the Management of Stones. Urol Clin North Am 2019; 46 (2): 193–205. DOI: 10.1016/j.ucl.2018.12.005.
- Kang HW, Lee H, Teichman JMH, Oh J, Kim J, Welch AJ. Dependence of calculus retropulsion on pulse duration during HO: YAG laser lithotripsy. Lasers Surg Med 2006; 38 (8): 762–772. DOI: 10.1002/lsm.20376.
- Bell JR, Penniston KL, Nakada SY. In Vitro Comparison of Holmium Lasers: Evidence for Shorter Fragmentation Time and Decreased Retropulsion Using a Modern Variable-pulse Laser. Urology 2017; 107: 37–42. DOI: 10.1016/j.urology.2017.06.018.
- Kronenberg P, Traxer O. Update on lasers in urology 2014: current assessment on holmium:yttrium–aluminum–garnet (Ho:YAG) laser lithotripter settings and laser fibers. World J Urol 2015; 33 (4): 463–469. DOI: 10.1007/s00345-014-1395-1.
- Wang M, Shao Q, Zhu X, Wang Z, Zheng A. Efficiency and Clinical Outcomes of Moses Technology with Flexible Ureteroscopic Laser Lithotripsy for Treatment of Renal Calculus. Urol Int 2021; 105 (7-8): 587–593. DOI: 10.1159/000512054.
- Ibrahim A, Fahmy N, Carrier S, Elhilali M, Andonian S. Double-blinded prospective randomized clinical trial comparing regular and moses modes of holmium laser lithotripsy: Preliminary results. European Urology Supplements 2020; 17 (2): e1390. DOI: 10.1016/s1569-9056(18)31815-3.
- Panthier F, Doizi S, Berthe L, Traxer O. In vitro comparison of ablation rates between superpulsed thulium fiber laser and ho:Yag laser for endocorporeal lithotripsy. Eur Urol Open Sci 2020; 19: e1884–e1885. DOI: 10.1016/s2666-1683(20)33870-2.
- Khusid JA, Khargi R, Seiden B, Sadiq AS, Atallah WM, Gupta M. Thulium fiber laser utilization in urological surgery: A narrative review. Investig Clin Urol 2021; 62 (2): 136. DOI: 10.4111/icu.20200467.
- Taratkin M, Azilgareeva C, Cacciamani GE, Enikeev D. Thulium fiber laser in urology: physics made simple. Curr Opin Urol 2022; 32 (2): 166–172. DOI: 10.1097/mou.0000000000000967.
- Andreeva V, Vinarov A, Yaroslavsky I, Kovalenko A, Vybornov A, Rapoport L, et al.. Preclinical comparison of superpulse thulium fiber laser and a holmium:YAG laser for lithotripsy. World J Urol 2020; 38 (2): 497–503. DOI: 10.1007/s00345-019-02785-9.
- Jiang P, Okhunov Z, Afyouni AS, Ali SN, Sharifi H, Bhatt R, et al.. Comparison of Superpulse Thulium Fiber Laser vs. Holmium Laser for Ablation of Renal Calculi in an In-Vivo Porcine Model. J Endourol 2022. DOI: 10.1089/end.2022.0445.
- Jaeger CD, Nelson CP, Cilento BG, Logvinenko T, Kurtz MP. Comparing Pediatric Ureteroscopy Outcomes with SuperPulsed Thulium Fiber Laser and Low-Power Holmium:YAG Laser. J Urol 2022; 208 (2): 426–433. DOI: 10.1097/ju.0000000000002666.
- Chua ME, Bobrowski A, Ahmad I. Thulium fibre laser vs holmium: yttrium-aluminium-garnet laser lithotripsy for urolithiasis: meta-analysis of clinical studies. 2022. DOI: 10.1111/bju.15921.
- Ellison JS, MacConaghy B, Hall TL, Roberts WW, Maxwell AD. A simulated model for fluid and tissue heating during pediatric laser lithotripsy. J Pediatr Urol 2020; 16 (5): 626.e1–626.e8. DOI: 10.1016/j.jpurol.2020.07.014.
- Quhal F, Al Faddagh A, Silay MS, Straub M, Seitz C. Paediatric stone management: innovations and standards. Curr Opin Urol 2022; 32 (4): 420–424. DOI: 10.1097/mou.0000000000001004.
- Zeren S, Satar N, Bayazit Y, Bayazit AK, Payasli K, Özkeçeli R. Percutaneous Nephrolithotomy in the Management of Pediatric Renal Calculi. J Endourol 2002; 16 (2): 75–78. DOI: 10.1089/089277902753619546.
- Jackman SV, Hedican SP, Peters CA, Docimo SG. Percutaneous nephrolithotomy in infants and preschool age children: experience with a new technique. Urology 1998; 52 (4): 697–701. DOI: 10.1016/s0090-4295(98)00315-x.
- Wright A, Rukin N, Smith D, Rosette J De la, Somani BK. ‘Mini, ultra, micro’ – nomenclature and cost of these new minimally invasive percutaneous nephrolithotomy (PCNL) techniques. Ther Adv Urol 2016; 8 (2): 142–146. DOI: 10.1177/1756287215617674.
- Mishra DK, Bhatt S, Palaniappan S, Reddy TVK, Rajenthiran V, Sreeranga YL, et al.. Mini versus ultra-mini percutaneous nephrolithotomy in a paediatric population. Asian J Urol 2022; 9 (1): 75–80. DOI: 10.1016/j.ajur.2021.06.002.
- Desai MR, Sharma R, Mishra S, Sabnis RB, Stief C, Bader M. Single-Step Percutaneous Nephrolithotomy (Microperc): The Initial Clinical Report. J Urol 2011; 186 (1): 140–145. DOI: 10.1016/j.juro.2011.03.029.
- Jones P, Bennett G, Aboumarzouk OM, Griffin S, Somani BK. Role of Minimally Invasive Percutaneous Nephrolithotomy Techniques–Micro and Ultra-Mini PCNL (<15F) in the Pediatric Population: A Systematic Review. J Endourol 2017; 31 (9): 816–824. DOI: 10.1089/end.2017.0136.
- Loftus CJ, Hinck B, Makovey I, Sivalingam S, Monga M. Mini Versus Standard Percutaneous Nephrolithotomy: The Impact of Sheath Size on Intrarenal Pelvic Pressure and Infectious Complications in a Porcine Model. J Endourol 2018; 32 (4): 350–353. DOI: 10.1089/end.2017.0602.
- Silay MS, Ellison JS, Tailly T, Caione P. Update on Urinary Stones in Children: Current and Future Concepts in Surgical Treatment and Shockwave Lithotripsy. Eur Urol Focus 2017; 3 (2-3): 164–171. DOI: 10.1016/j.euf.2017.07.005.
- Maeda K, Colonius T. Bubble cloud dynamics in an ultrasound field. J Fluid Mech 2019; 862: 1105–1134. DOI: 10.1017/jfm.2018.968.
- Maeda K, Maxwell AD, Colonius T. Investigation of the Energy Shielding of Kidney Stones by Cavitation Bubble Clouds during Burst Wave Lithotripsy. Proceedings of the 10th International Symposium on Cavitation (CAV2018) 2018; 144: 626–630. DOI: 10.1115/1.861851_ch119.
- Sapozhnikov OA, Maxwell AD, Bailey MR. Maximizing mechanical stress in small urinary stones during burst wave lithotripsy. J Acoust Soc Am 2021; 150 (6): 4203–4212. DOI: 10.1121/10.0008902.
- Harper JD, Metzler I, Hall MK. Faculty Opinions recommendation of First In-Human Burst Wave Lithotripsy for Kidney Stone Comminution: Initial Two Case Studies. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2020. DOI: 10.3410/f.738685997.793585856.
- Harper JD, Lingeman JE, Sweet RM. Re: Fragmentation of Stones by Burst Wave Lithotripsy in the First 19 Humans. Eur Urol 2022; 82 (5): 569. DOI: 10.1016/j.eururo.2022.07.012.
- Hall MK, Thiel J, Dunmire B. First Series Using Ultrasonic Propulsion and Burst Wave Lithotripsy to Treat Ureteral Stones. Letter. J Urol 2022; 209 (2): 325–326. DOI: 10.1097/ju.0000000000003060.
Ultima atualização: 2025-09-21 13:35