24: Válvulas uretrais posteriores e obstrução infravesical
Este capítulo levará aproximadamente 29 minutos para ler.
Introdução
Válvulas uretrais posteriores (PUV) permanecem a causa congênita mais comum de obstrução da saída vesical em neonatos do sexo masculino. É a principal causa de doença renal terminal (ESRD) em crianças do sexo masculino.1 A grande maioria dos casos hoje em dia é suspeitada no período pré-natal e encaminhada para centros especializados após o nascimento. Além disso, há um baixo limiar para investigar uma criança do sexo masculino com infecção do trato urinário e, portanto, o diagnóstico oportuno costuma ser a norma. O espectro de disfunção renal e os desfechos funcionais subsequentes variam amplamente em crianças com essa condição. As PUV e suas consequências, incluindo displasia renal, dilatação do trato urinário superior, refluxo vesicoureteral, infecção do trato urinário e disfunção vesical, correspondem a 25–30% dos transplantes renais pediátricos no Reino Unido (UK Transplant Registry).
Este capítulo tem como objetivo fornecer uma visão geral atualizada sobre as válvulas uretrais posteriores e como são manejadas em nosso centro.
Embriologia
Existem duas teorias distintas para explicar a origem das VUP. A primeira teoria postula uma inserção anômala do ducto mesonéfrico no seio urogenital, impedindo a migração normal desses ductos e sua fusão anterior. A outra teoria sugere que as válvulas representam uma membrana urogenital persistente.2 A classificação inicial das VUP foi feita por Hugh Hampton Young em 1919, que descreveu os tipos I-III com base em estudos de dissecação pós-morte. Estudos posteriores sugeriram um aspecto mais uniforme da membrana uretral posterior obstrutiva, e a avaliação prospectiva de uretras não instrumentadas realizada por Dewan et al., encontrou aspectos semelhantes em todos os casos estudados.3 Sua avaliação endoscópica revelou que a membrana se fixava posteriormente, logo distal ao verumontanum. A membrana estendia-se anteriormente e obliquamente além do esfíncter externo, com um orifício de tamanho variável localizado nela, ao nível do verumontanum, e eles descreveram a condição como membrana uretral posterior obstrutiva congênita (COPUM).
Incidência e Aspectos Genéticos
A incidência comumente relatada de VUP é de 1 em 5000 nascidos vivos, com 50% desses evoluindo para doença renal terminal dentro de 10 anos.4 Observou-se alguma variação, com incidência de 1:7800 na Austrália e 1 em 3800 no Reino Unido e na Irlanda.5,6 A compreensão da base genética, ou de potenciais fatores ambientais ou maternos para essa anomalia, continua a evoluir. Chiraramonte et al. propuseram um papel específico do braço curto do cromossomo 11.7 Anomalias associadas estarão presentes em cerca de 40% desses meninos, principalmente do sistema cardiovascular, sistema gastrointestinal e outras condições urológicas, como hipospádia, micro/macro falo e válvulas uretrais anteriores.8,9,10 Há relatos de ausência de meato acústico externo e de agenesia adrenal bilateral em meninos com válvulas uretrais posteriores.
Diagnóstico pré-natal
O número de casos de PUV diagnosticados no período pré-natal aumentou com a maior utilização e sensibilidade do rastreamento pré-natal de anomalias. No Reino Unido, são realizados pelo menos dois exames de ultrassonografia para gestantes. O primeiro é um exame de datação realizado por volta de 10–12 semanas de gestação. O segundo é um exame morfológico mais detalhado por volta de 20 semanas de gestação. Em aproximadamente metade a dois terços dos meninos com PUV haverá suspeita no pré-natal. Achados pré-natais na ultrassonografia em casos suspeitos podem incluir bexiga de parede espessada, o sinal do ‘buraco da fechadura’ com bexiga dilatada e uretra posterior, hidroureteronefrose unilateral ou bilateral, rins hiperecogênicos e oligoidrâmnio. O diagnóstico diferencial inclui a síndrome de Prune-Belly, atresia uretral, refluxo vesicoureteral bilateral e, com menor frequência, o distúrbio de hipoperistalse intestinal com megacistite-microcólon. A recente auditoria nacional BAPS CASS identificou 35% de PUV no pré-natal e cerca de 40% no primeiro ano de vida.6 Esta auditoria também mostrou uma relação estatisticamente significativa entre o momento do diagnóstico e o aumento do risco de comprometimento renal.
Intervenção pré-natal
As intervenções antenatais para válvulas uretrais posteriores (PUV) incluem aspiração vesical, colocação de derivação vésico-amniótica e ablação endoscópica fetal das válvulas. A justificativa é que a descompressão precoce do trato urinário fetal permitirá melhor sobrevida com preservação da função renal, redução do comprometimento respiratório e das anomalias de membros observados em associação com oligoidrâmnio grave. No entanto, um volume normal de líquido amniótico não é garantia de boa função renal pós-natal. Um estudo da North American Fetal Therapy Network avaliou o desfecho de 32 gestações consecutivas com obstrução do trato urinário inferior (LUTO) e volume de líquido amniótico normal no meio da gestação.11 A sobrevivência perinatal foi de 97%. A terapia renal substitutiva (TRS) foi necessária quando houve desenvolvimento de oligoidrâmnio e/ou anidrâmnio, cistos renais corticais, PUV, prematuridade e permanência prolongada em unidade de terapia intensiva neonatal, conforme a análise univariada. Pela análise multivariada, o único preditor de TRS foi o parto prematuro.
Historicamente, o algoritmo introduzido por Johnson em 1994 tem sido usado para selecionar fetos para intervenção pré-natal.12 Os critérios incluem um cariótipo masculino normal na ausência de outras anomalias fetais que afetariam negativamente o prognóstico, e oligoâmnio/anhidrâmnio materno ou volumes de líquido amniótico em diminuição. poderiam se beneficiar da intervenção. Nos últimos anos, Ruano et al. propuseram um modelo de seleção de pacientes baseado em 4 estágios de obstrução. A intervenção fetal não é recomendada para os Estágios III-IV.13
Tabela 1 Sistema de estadiamento de Ruano
| Ultrassonografia fetal | Bioquímica fetal 18-30 semanas | Terapias possíveis | |
|---|---|---|---|
| Stage 1 | AFI normal Sem cistos renais ou displasia | Favorável após amostragem sequencial | Monitorização semanal por ultrassonografia |
| Stage 2 | Oligoâmnio Hidronefrose bilateral grave Ausência de cistos ou displasia | Favorável após no máximo 3 amostragens sequenciais | Cistoscopia ou derivação vesicoamniótica |
| Stage 3 | Anidrâmnio ou oligoâmnio Rins hiperecogênicos Cistos renais e/ou displasia | Desfavorável após amostragem sequencial | VAS com possível amnioinfusão |
| Stage 4 | Anidrâmnio e anúria após monitorização da taxa de enchimento vesical. Displasia renal e rins hiperecogênicos | Bioquímica desfavorável e anúria documentada após monitorização para reenchimento | Amnioinfusão |
Bioquímica favorável: sódio <100 mEq/L, cloreto <90 mEq/L, osmolalidade <200 mOsm/L e β-2 microglobulina <6 mg/L.
Uma revisão sistemática e meta-análise recente de 10 artigos sobre intervenção antenatal para LUTO, que incluiu 355 fetos, estabeleceu que a sobrevivência global foi maior no grupo VAS em comparação com o grupo conservador.14 Pouco mais da metade (57%) sobreviveu no grupo VAS em comparação ao grupo controle. Cinco estudos mostraram que a função renal pós-natal foi maior no grupo VAS em comparação ao grupo conservador. Dois estudos envolvendo 45 fetos submetidos à cistoscopia fetal demonstraram que a sobrevivência perinatal foi maior no grupo da cistoscopia em comparação ao grupo de manejo conservador. Função renal normal foi observada em 13/34 fetos no grupo da cistoscopia versus 12/61 no grupo de manejo conservador aos 6 meses de seguimento.
Mais recentemente, buscou-se abordar a questão do benefício da intervenção pré-natal na forma de derivação vesicoamniótica em casos de suspeita de obstrução da via de saída vesical. O ensaio PLUTO foi concebido como um ensaio multicêntrico pan-europeu.15 A inclusão neste ensaio baseou-se no princípio da incerteza. Na presença de dúvida quanto ao benefício da intervenção, os pacientes foram randomizados para derivação vesicoamniótica ou ausência de tratamento. As medidas de desfecho incluíram mortalidade pós-natal, função renal avaliada pela creatinina sérica com 1 ano de idade e qualquer morbidade associada ou complicações do procedimento. O ensaio durou 5 anos, mas não conseguiu recrutar o número necessário de pacientes e está agora encerrado. Infelizmente, devido ao pequeno número de pacientes recrutados, não foi possível identificar se a intervenção pré-natal proporciona benefício significativo no tratamento de casos com suspeita de obstrução da via de saída vesical.
Manejo Neonatal
Para os recém-nascidos com suspeita de PUV no pré-natal, sem preocupação quanto ao volume de líquido amniótico, o parto pode ocorrer fora de centros especializados de urologia pediátrica. A prioridade é drenar a bexiga usando um cateter uretral sem balão de calibre 6/8 Fr. Deve-se iniciar profilaxia antibiótica, por exemplo, trimetoprim 2 mg/kg. Um cateter sem balão é mais seguro do que um cateter com balão, especialmente em mãos inexperientes. Há possibilidade de causar trauma uretral ao insuflar o balão na uretra posterior em vez da bexiga.
Nos neonatos em que não é possível cateterizar pela via uretral, geralmente devido à indisponibilidade de um cateter de 6 Fr ou a um colo vesical muito alto que inviabiliza a cateterização bem-sucedida, torna-se necessário um cateter suprapúbico. Após a drenagem vesical bem-sucedida, deve-se prestar estreita atenção ao débito urinário e às dosagens de eletrólitos, pois esses pacientes podem desenvolver diurese pós-obstrutiva, resultando em alterações dos níveis de sódio, potássio e bicarbonato. A creatinina deve ser monitorizada diariamente até se atingir o nadir da creatinina. Para pacientes com disfunção renal significativa e distúrbios eletrolíticos, um colega de nefrologia deve ser envolvido precocemente para otimizar a função renal e a homeostase.
Em meninos nascidos com história de oligoidrâmnio e hipoplasia pulmonar significativa, a prioridade do manejo é o suporte respiratório e a drenagem vesical. Um cateter uretral ou suprapúbico é suficiente para otimizar a drenagem urinária enquanto se aguarda homeostase e estabilidade respiratória.
Recém-nascidos e lactentes em que não se suspeitou de PUV no período pré-natal podem apresentar-se com urosepse, sintomas miccionais obstrutivos, bexiga distendida ou rins palpáveis, e os princípios de manejo são os mesmos. Embora um jato urinário fraco seja sugestivo de obstrução da via de saída vesical, a observação de um jato urinário normal não exclui o diagnóstico.
Confirmação do diagnóstico no período neonatal
Uma vez estabilizado o recém-nascido, o diagnóstico deve ser confirmado. A ultrassonografia renal (USS) fornecerá informações sobre o tamanho e a qualidade do parênquima renal, o grau de hidroureteronefrose e a avaliação da espessura da parede vesical. Também pode evidenciar uma uretra posterior dilatada.
Cistouretrografia miccional (MCUG) confirmará o diagnóstico e deve incluir incidências com o cateter retirado para demonstrar o calibre da uretra posterior (Figura 1) A criança é coberta com um esquema de antibióticos por 3 dias para reduzir o risco de infecção e urosepse.
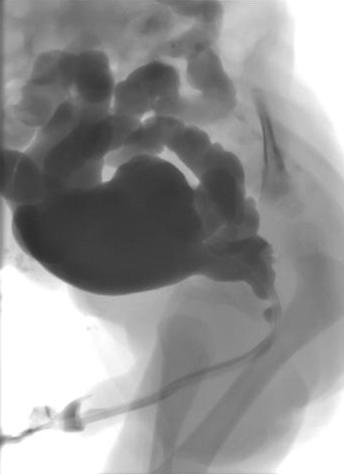
Figura 1 MCUG demonstrando uretra posterior dilatada, bexiga irregular e refluxo vesicoureteral bilateral.
Informações adicionais obtidas na MCUG incluem o tamanho da bexiga, irregularidade da bexiga decorrente de espessamento, trabeculação e formação de divertículos, refluxo vesicoureteral (RVU) e a configuração do colo vesical. Aproximadamente 50% dos recém-nascidos com PUV terão RVU. Se o RVU foi de alto grau e unilateral, um “pop-off” pode ter permitido a dissipação seletiva da pressão retrógrada resultante da obstrução uretral.
A síndrome VURD (válvulas, refluxo unilateral, displasia) descrita por Hoover e Duckett resulta em função muito precária ou ausência de função do rim do lado com refluxo, com relativa preservação da função renal no lado contralateral, sem refluxo.16 Esses autores também postularam que esse mecanismo de ‘pop-off’ resulta em função renal normal a longo prazo, uma vez que o rim contralateral é poupado e normal. Essa hipótese foi posteriormente contestada por Cuckow et al., que demonstraram, com creatinina sérica e medições da TFG, que a função renal estava comprometida nos casos com VURD, implicando que a proteção oferecida pelo mecanismo de ‘pop-off’ não era completa.17
Ressecção Primária de Válvula
O procedimento de escolha para PUV é a ablação primária das válvulas, realizada quando o bebé estiver estável do ponto de vista médico. Na indução da anestesia, administra-se uma dose de antibiótico intravenoso, por exemplo, co-amoxiclav 30 mg/kg. O bebé é colocado na posição de litotomia e é realizada uma cistoscopia diagnóstica utilizando cistoscópio neonatal 0° 6/8 Fr. A uretra posterior deve ser cuidadosamente inspecionada e a configuração das válvulas registada. A configuração do colo vesical e o aspeto da bexiga e dos orifícios ureterais também devem ser registados. O ressectoscópio de 11 Fr é montado com lâmina fria/em foice ou eletrodo Bugbee e a resseção das válvulas é tipicamente realizada nas posições das 5, 7 e 12 horas (Figura 2)
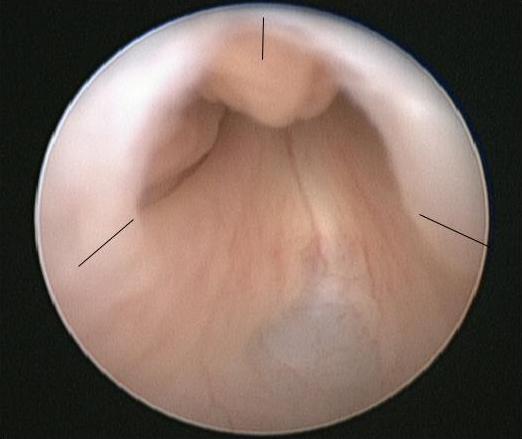
Figura 2 Vista endoscópica de PUV com os locais para incisão da válvula assinalados.
Um cateter uretral é colocado no final do procedimento e removido 24-48 horas depois. A creatinina deve ser verificada após a remoção do cateter e as fraldas pesadas para documentar o débito urinário. A profilaxia antibiótica e os suplementos renais devem ser mantidos até nova reavaliação.
As complicações da ablação primária das válvulas incluem hemorragia, ressecção incompleta das válvulas, estenose uretral ou lesão inadvertida do esfíncter externo. A escolha da técnica é determinada pelos instrumentos disponíveis, pelo calibre da uretra neonatal e pelo tamanho e maturidade do bebê.
Para prematuros ou neonatos muito pequenos, a ressecção endoscópica é adiada devido às dificuldades impostas pelo pequeno calibre da uretra e às potenciais complicações do uso de instrumentos relativamente maiores. Essas crianças podem ser manejadas com um cateter uretral ou suprapúbico até que estejam grandes o suficiente para o procedimento. Como orientação aproximada, um peso corporal de 2,5 kg deve permitir uma ressecção de PUV segura e precisa com instrumentos endoscópicos padrão.
Para alguns neonatos pequenos, podem ocorrer problemas repetidos com cateteres uretrais ou suprapúbicos que se soltam, ficam obstruídos, se deslocam ou não drenam adequadamente e, nessas circunstâncias, a realização de uma vesicostomia pode ser considerada a opção mais segura para garantir uma drenagem vesical adequada e contínua.
Recomendamos que todos os meninos realizem uma cistoscopia de seguimento em até 3 meses após o procedimento primário para garantir a completude da ablação das válvulas. Isso se deve à baixa correlação entre a MCUG repetida no diagnóstico de folhetos valvares residuais e a avaliação cistoscópica de folhetos valvares residuais que exigem nova ressecção; valor preditivo positivo de 56%.18 Entretanto, alguns centros optariam por realizar uma MCUG repetida nesta fase e proceder à cistoscopia apenas se a MCUG sugerir obstrução uretral persistente. Uma vantagem adicional de seguir diretamente para a cistoscopia de revisão é que isso oferece a oportunidade de realizar a circuncisão, que demonstrou reduzir a taxa de infecção do trato urinário em pelo menos 83% em meninos com válvulas uretrais posteriores.19 Isso foi validado por um RCT multicêntrico recente, o ensaio CIRCUP. Na população do estudo de 91 meninos, a probabilidade de apresentar uma ITU febril foi de 20% no grupo antibiótico versus 3% no grupo circuncisão + antibiótico.20
Apresentação, Diagnóstico e Manejo na Criança Mais Velha
Um número menor de pacientes com PUV não se apresentará como neonatos ou lactentes, mas comparecerá a consultas na infância ou na adolescência precoce com sintomas de enurese diurna, gotejamento ou jato urinário fraco, infecção ou, menos comumente, hematúria. Uma história miccional cuidadosa pode sugerir o diagnóstico e estudos não invasivos, como taxas de fluxo e medição dos volumes residuais pós-miccionais, também podem apontar para a anormalidade. A cateterização uretral na criança mais velha é invasiva e repleta de dificuldades; portanto, nossa preferência é omitir a MCUG e, em vez disso, proceder diretamente a uma cistoscopia diagnóstica e ablação primária das valvas se o diagnóstico for confirmado. O seguimento após ablação completa e bem-sucedida das valvas é conforme descrito abaixo, com maior suspeita de disfunção vesical persistente naqueles que se apresentam tardiamente.
Acompanhamento
Cada instituição terá um esquema único de seguimento para crianças com valvas uretrais posteriores. No entanto, os objetivos do seguimento são:
- Otimizar a função renal
- Minimizar infecções urinárias e cicatrizes renais
- Avaliação e manejo da disfunção miccional com o objetivo de alcançar continência urinária total
- Transição para serviços de adolescentes e adultos
O envolvimento da nefrologia pediátrica é imperativo para maximizar os desfechos e garantir o manejo médico adequado dessas crianças.
Tabela 2 Exemplo de protocolo de seguimento de pacientes com PUV utilizado no Great Ormond Street Hospital, Reino Unido. FBC=hemograma completo, GFR=taxa de filtração glomerular, US=ultrassonografia do trato renal, MCUG=cistouretrograma miccional, MSU=amostra de urina de jato médio incluindo teste para proteinúria, BFA=avaliação da função vesical. Definido por idade; em lactentes, alarmes de fralda e medidas do resíduo pós-miccional; em crianças mais velhas, gráficos de frequência-volume, estudos de fluxo e medidas de resíduo pós miccional, SPC=cateter suprapúbico.
| Creatinina e eletrólitos | Hemograma completo | TFG corrigida | Ultrassonografia | Cistouretrografia miccional | MAG3 | Cistoscopia/ablação de válvula | Amostra de urina de jato médio | Avaliação da função vesical | Urodinâmica com vídeo via cateter suprapúbico | |
|---|---|---|---|---|---|---|---|---|---|---|
| Nascimento | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 3 meses | ✓ | ✓ | ✓ | ✓ | +/- circuncisão | ✓ | ||||
| 1 ano | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 2 anos | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 3 anos | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 4 anos | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 5 anos | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | |||
| 6 anos | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 7 anos | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 8 anos | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 9 anos | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 10 anos | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | |||
| 11-14 anos Anual | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| >15 anos | ✓ | ✓ | ✓ | ✓ | +/- | ✓ | ✓ | Encaminhamento para serviço de adolescentes |
Derivação urinária precoce
Há um pequeno grupo de meninos em que as medidas padrão descritas acima não produzem o resultado desejado e cuja função renal permanece frágil ou se deteriora, ou sofrem infecções do trato urinário recorrentes, ou há deterioração significativa no aspecto das vias urinárias superiores, ou o esvaziamento vesical é incompleto em ultrassonografias seriadas. O objetivo nestas crianças é maximizar o seu potencial renal e adiar ou evitar a substituição renal. O desvio urinário precoce, seja por vesicostomia, ureterostomia bilateral ou pielostomia, visa proteger as vias urinárias superiores e minimizar os riscos de infecção.
Chua et al. realizaram uma revisão retrospectiva de 40 meninos submetidos a ablação de válvula isolada ou ablação + vesicostomia/ derivação supravesical. Eles observaram que a derivação urinária após a ablação da válvula em crianças com doença renal crônica estágio 3 associada a válvulas uretrais posteriores pode atrasar temporariamente a progressão para doença renal terminal. Portanto, isso pode não proporcionar quaisquer benefícios a longo prazo e é mais uma medida temporizadora.21 Isso reitera os achados de trabalhos anteriores de Tietjen e Lopez-Pereira et al.22,23
O conceito de ureterostomia refluxiva como forma de derivação urinária tem mostrado alguma promessa. Trata-se de uma técnica elegante que permite a continuidade da ciclagem vesical e, ao mesmo tempo, dissipa as altas pressões de armazenamento e micção presentes na bexiga valvar nessa idade. O requisito primário é um ureter livremente refluxivo, e o procedimento é realizado por meio de uma incisão na prega cutânea inguinal baixa. O ureter é identificado e isolado extravesicalmente no retroperitônio. Em seguida, confecciona-se uma ureterostomia refluxiva em alça, que drenará para a fralda. Diferentemente da ureterostomia terminal, a reversão é relativamente fácil. Uma vez que o procedimento tenha cumprido seu propósito ou deixe de apresentar refluxo, a ureterostomia é simplesmente fechada e o ureter devolvido ao espaço retroperitoneal. A ureterostomia refluxiva é particularmente útil em meninos com função renal frágil, pois minimizará os potenciais efeitos deletérios da bexiga de alta pressão que está presente no período inicial após a ablação das válvulas. Isso é crítico no manejo desses neonatos, pois a substituição renal na infância é extremamente precária e difícil de manter.
Há preocupações legítimas de que desviar a bexiga ou ter uma bexiga continuamente vazia possa afetar negativamente a função vesical futura. Além disso, faltam evidências convincentes de que a derivação urinária melhore a função renal a longo prazo.
Ao comparar a ablação primária da válvula com a vesicostomia primária, Godbole et al. não encontraram diferença significativa na creatinina sérica e na taxa de filtração glomerular (TFG) com 1 ano de idade entre os dois grupos.24 O grupo que teve a confecção de vesicostomia como procedimento primário permaneceu derivado por um tempo mediano de 18 meses e, em 7 meninos que realizaram urodinâmica subsequente, foi demonstrada capacidade vesical normal. Jaureguizar et al. compararam os desfechos de função vesical em meninos tratados com derivação supravesical com aqueles submetidos apenas à ablação primária da válvula.25 O tempo médio em que a derivação supravesical esteve presente foi de 13 meses e todos foram derivados nos primeiros 2 meses de vida. Eles realizaram estudos urodinâmicos invasivos aos 9–10 anos de idade e encontraram proporções muito semelhantes de bexigas normais, pouco complacentes, instáveis e descompensadas em ambos os grupos.
Resultados vesicais mais favoráveis, maior capacidade, menor pressão detrusora ao final do enchimento na capacidade vesical esperada e menor frequência de instabilidade detrusora foram demonstrados em 8 pacientes tratados com ablação primária de válvula em comparação com 11 meninos tratados com ureterostomia em alça alta e baixa.26 Os estudos urodinâmicos foram realizados nesses meninos a uma idade média mínima de 11 anos, e a duração da derivação foi, em média, de 57 meses.
Assim, o papel da derivação urinária precoce no manejo de meninos com PUV é limitado. Ela tem o potencial de melhorar a função renal a curto prazo, o que é muito importante em meninos com função renal frágil, e pode adiar a terapia de substituição renal para uma fase posterior. Não há evidências convincentes que sustentem seu papel como meio de melhorar a função renal a longo prazo, e permanece incerto o seu efeito sobre a função vesical a longo prazo. Portanto, a derivação urinária deve ser considerada em casos selecionados, com objetivos e desfechos bem definidos, e tem um papel no manejo de meninos com PUV.
Resultados a Longo Prazo: Trato Urinário Superior
A produção de urina começa com 8-9 semanas de gestação e o sistema coletor está formado ao final do primeiro trimestre. A bexiga fetal pode ser visualizada logo depois disso na ultrassonografia pré-natal. A presença de obstrução à saída vesical transmite pressão intraluminal elevada ao parênquima renal em desenvolvimento e, uma vez atingido um nível crítico, causa apoptose, diferenciação celular anormal e alterações glomerulares que ocorrem no rim. Essas alterações precoces determinam o potencial funcional renal na vida posterior. Nos casos em que a obstrução é menos grave ou se manifesta mais tardiamente na gestação, os efeitos da obstrução tendem a incidir mais sobre a bexiga e os efeitos renais limitam-se à dilatação do sistema coletor, com mínima perturbação da nefrogênese normal. Uma teoria alternativa, ou talvez complementar, para explicar a displasia renal observada em associação com válvulas uretrais posteriores relaciona-se à posição anormal do broto ureteral e à implantação no blastema metanéfrico.27 Assim, a disfunção renal parece ser o resultado de graus variados de displasia inerente e dos efeitos da obstrução à saída vesical. Na vida pós-natal, esses efeitos podem ser ainda mais exacerbados por infecções do trato urinário, RVU e disfunção vesical
Quando há uma perda significativa de néfrons, ocorre hiperfiltração dos néfrons funcionais remanescentes por meio de vasodilatação das arteríolas aferentes. A hipertensão capilar glomerular resultante permite que a função renal normal seja mantida temporariamente. Com o tempo, esse mecanismo compensatório descompensa; instala-se glomeruloesclerose, com consequente proteinúria, hipertensão e redução da taxa de filtração glomerular. A lesão do néfron distal compromete a capacidade de concentração do rim, resultando em poliúria e polidipsia (diabetes insípido nefrogênico), o que pode piorar a função vesical e, assim, aumentar ainda mais o risco para a função do trato urinário superior.
O artigo de Parkhouse et al é frequentemente citado e descreve os desfechos em longo prazo de 98 meninos diagnosticados com válvulas uretrais posteriores que se apresentaram entre 1966-1975, antes da era do diagnóstico pré-natal.28 O período de seguimento deste estudo variou de 11 a 22 anos. 66% da coorte apresentaram-se no primeiro ano de vida e metade da coorte de pacientes foi tratada com ablação primária das válvulas, o restante foi derivado. 32% (31 pacientes) tiveram um ‘mau desfecho renal em longo prazo;’ 10 pacientes morreram de insuficiência renal aguda, 15 desenvolveram doença renal terminal e 6 apresentaram insuficiência renal crônica estabelecida ao longo do período de seguimento. Apresentação com menos de um ano de idade (p<0.05), presença de refluxo vésico-ureteral bilateral (p<0.0010), ureia plasmática na alta inicial de >10 mmol/litro e, aos 5 anos de idade, presença de proteinúria (p<0.001) juntamente com incontinência urinária persistente estiveram todas associadas a um mau desfecho renal.
Séries mais contemporâneas relatam resultados bastante semelhantes. Kousidis et al relataram uma série de 42 pacientes com válvulas de uretra posterior diagnosticadas pré- e pós-natalmente entre 1984–1996.29 O período de seguimento foi de 10-23 anos. Houve 3 (7%) óbitos (2 no período neonatal e 1 paciente com 3 anos de idade após transplante malsucedido), 11 pacientes (26 %) evoluíram para insuficiência renal terminal, um destes ocorrendo apenas no final da adolescência.
Em um grupo de 65 pacientes com PUV que se apresentaram no período de 1987–2004 e foram acompanhados por um período mais curto (intervalo 1–14.3 anos; mediana de seguimento 6.8 anos), Sarhan et al encontraram uma taxa global de comprometimento renal de 17%, dos quais 9% haviam progredido para ESRD.30 Idade gestacional precoce ao diagnóstico (<24 semanas; p=0.003) e oligodrâmnio ou anidrâmnio pré-natal (p=0.02) foram associados a um desfecho desfavorável. Não houve óbitos nesse grupo, mas, durante o mesmo período do estudo, houve 14 fetos com diagnóstico pré-natal em que a gestação foi interrompida. A análise da urina fetal havia sido realizada em todos os casos e os achados post mortem confirmaram alterações histológicas renais graves. Isso sugere que a incidência global de insuficiência renal, levando em conta os fetos cuja gestação foi interrompida, é semelhante à dos outros estudos mencionados acima.
O grupo maior de DeFoor, de 119 pacientes com PUV acompanhados por um período de tempo semelhante (intervalo 3–24 anos; seguimento médio de 7.2 anos), verificou que 13% desenvolveram insuficiência renal terminal até uma idade mediana de 8.2 anos (intervalo 7 dias–17.5 anos).31 Neste estudo, a disfunção vesical, necessitando de cateterismo intermitente limpo e/ou uso de medicação anticolinérgica, associou-se a um risco aumentado de ESRD. A creatinina sérica nadir > 1.0 mg/dl também se associou a um aumento do risco de ESRD (OR 71, IC 10–482) e isso foi corroborado em vários estudos anteriores e subsequentes, nos quais a creatinina sérica <1.0 mg/dl com 1 ano de idade proporciona um bom desfecho renal a longo prazo.
Heikkila et al avaliaram uma coorte maior de pacientes (n=193) com válvulas uretrais posteriores ao longo de um período de tempo muito mais longo (intervalo de 6–69 anos; seguimento mediano de 31 anos).32 A taxa de progressão para insuficiência renal terminal foi de 22.8%, com 68% desenvolvendo IRT antes dos 17 anos de idade e o restante após os 17 anos de idade. A deterioração da função renal na época da puberdade em crianças com rins displásicos é amplamente reconhecida, e uma explicação provável é que represente alterações no rim em resposta ao crescimento, ao aumento da massa corporal e ao aumento da pressão arterial.33 No entanto, esta deterioração tardia da função renal após a puberdade, destacada por este artigo, ressalta a necessidade de seguimento destes pacientes até a idade adulta e além.
Pereira et al., em sua série de 77 casos de PUV, diagnosticados < 6 meses de idade e acompanhados por uma média de 11,7 anos, observaram que 27 (35,1%) tinham CRF, dos quais 14 estavam em ESRD. Desses 27 meninos com CRF, 22 progrediram para CRF nos primeiros 3 anos de vida: 4 entre 15-16 anos de idade e 1 aos 20 anos de idade.34
O início da doença renal em estágio terminal permanece imprevisível. A proteinúria pode indicar o início da deterioração da função renal e deve ser monitorada. A poliúria pode aumentar os volumes residuais pós-miccionais, causando uropatia progressiva e uma deterioração na capacidade de concentração da medula renal que agrava ainda mais a poliúria, criando um ciclo de declínio. Um bom esvaziamento vesical é vital; em casos extremos, a drenagem vesical noturna pode retardar a deterioração renal e pode melhorar o sono de pacientes com poliúria.35
Refluxo Vesicoureteral
Na apresentação, aproximadamente 50% dos pacientes apresentam refluxo vesicoureteral (RVU) na MCUG inicial. Acredita-se que isso seja secundário à obstrução da via de saída da bexiga e à disfunção vesical coexistente. Aproximadamente 15% dos pacientes apresentarão RVU unilateral de alto grau com ausência de função do rim ipsilateral. Após a ablação das válvulas, a gravidade do RVU pode diminuir ou resolver-se completamente em 25-50% dos casos, e essa melhora é mais provável naqueles que se apresentam como neonatos ou durante a infância. O RVU persistente, especialmente de alto grau e bilateral, após ablação valvar bem-sucedida, está associado a pior desfecho renal em longo prazo e é um dos indicadores de mau prognóstico identificados por Parkhouse et al.28 Já não há a tendência de realizar procedimentos antirrefluxo em meninos com PUV, pois as taxas de falha associadas a essa abordagem são altas. Nos casos em que o grau de refluxo é alto e está associado a função ruim no rim ipsilateral, o ureter dilatado tem sido utilizado para ampliar a bexiga em associação com a remoção do rim não funcionante. Outras estratégias inovadoras incluem criar uma ureterostomia refluxante, como discutido anteriormente, e, ocasionalmente, o ureter distal tem sido utilizado como um canal de Mitrofanoff com ou sem um procedimento antirrefluxo associado. Graus mais elevados de refluxo persistente são um potencial fator de risco para infecção urinária recorrente e podem impactar negativamente os rins transplantados e, portanto, geralmente são tratados cirurgicamente antes do transplante renal.
Em um ECR recente, Abdelhalim et al. observaram alguma melhora do refluxo após a ablação de válvula, com o uso de oxibutinina. Houve 24 pacientes no grupo oxibutinina e 25 no grupo controle. As unidades renais no grupo oxibutinina apresentaram maior probabilidade de melhora da hidronefrose (61.9% vs 34.8%, p=0.011) e de resolução do refluxo vesicoureteral (62.5% vs 25%, p=0.023).36
Hidroureteronefrose
A maioria dos neonatos que se apresentam com válvulas uretrais posteriores apresentará hidroureteronefrose bilateral. Observa-se frequentemente melhora com a cateterização inicial, mas pode ocorrer piora temporária devido à obstrução funcional ao nível da VUJ pela parede vesical espessada que colapsa, pinçando os óstios ureterais após a cateterização e descompressão. É importante reconhecer esse fenómeno e, ocasionalmente, isso pode resultar em anúria que dura por 24-48 horas. A obstrução resolve-se espontaneamente em 48-72 horas e é geralmente seguida por diurese pós-obstrutiva. É importante manter a calma e resistir à tentação de tentar descomprimir os tratos superiores com colocação de stent JJ interno ou de nefrostomias. Após a ablação primária das válvulas, deve-se esperar que o grau de dilatação dos tratos superiores melhore gradualmente ou se resolva completamente.37 Essa melhoria será influenciada por VUR persistente, disfunção vesical, poliúria e motilidade ureteral anormal, e todos esses fatores devem ser considerados ao avaliar os desfechos após a ablação das válvulas. A reimplantação ureteral, com ou sem afilamento, deixou de ser realizada no contexto de agravamento da hidroureteronefrose em casos de PUV, à medida que o papel da bexiga e da sua disfunção associada, bem como a disfunção tubular renal com consequente poliúria, têm sido cada vez mais reconhecidos com a melhor compreensão da fisiopatologia da obstrução à saída vesical.
Desfechos a Longo Prazo: Trato Urinário Inferior
A etiologia subjacente do comportamento vesical nas válvulas uretrais posteriores permanece tema de intenso debate. Os dois principais fatores implicados na etiologia são: que a bexiga anormal resulta de alterações intrauterinas em resposta à obstrução da via de saída vesical e/ou que a disfunção vesical é resultado de derivação urinária. Não há consenso quanto à segunda teoria, pois, atualmente, a maioria dos casos não é submetida a derivação, embora a incidência de disfunção vesical permaneça alta. Godbole et al. demonstraram que a derivação não é necessariamente prejudicial ao desfecho da função vesical e pode até melhorá-la.24
Histologicamente, a bexiga obstruída em modelos animais fetais demonstra um aumento da massa de músculo liso, um aumento no número de receptores muscarínicos e um aumento na deposição de colágeno. Mas trabalhos mais recentes implicam aumento da fibrose na patogênese da disfunção vesical.38 Um artigo de um dos autores deste capítulo identificou que a substituição do músculo liso por fibrose é um importante fator contributivo para a disfunção contrátil na bexiga PUV hipertônica. Isso abre caminhos para pesquisas sobre o potencial de agentes antifibróticos para restaurar a contratilidade normal.39
Pesquisadores também demonstraram reversibilidade em algumas dessas alterações com a remoção da obstrução, embora a recuperação possa ser parcial, dependendo do momento da reversão e do grau de lesão irreversível que já ocorreu. A apresentação precoce decorrente do diagnóstico pré-natal permite tratamento imediato e, portanto, seria razoável esperar melhores resultados para a função vesical na população atual de meninos com suspeita pré-natal de obstrução da saída vesical.
O termo ‘síndrome da bexiga valvular’ foi introduzido como um conceito na década de 1980 para englobar os padrões miccionais anormais e os sintomas de disfunção miccional, a bexiga de parede espessada persistente, o esvaziamento vesical incompleto e a dilatação do trato urinário superior associada observados em muitos meninos com válvulas de uretra posterior tratadas. Peters et al., em sua coorte de 41 meninos avaliados principalmente por incontinência urinária persistente e ‘síndrome da bexiga valvular’, identificaram três padrões urodinâmicos predominantes em testes invasivos: bexiga hiperativa, bexiga de baixa complacência ou bexiga acontrátil, com alguma sobreposição entre esses padrões.40
Ao longo dos últimos 30 anos, os clínicos passaram a reconhecer e compreender a importância da disfunção vesical e seu impacto nos desfechos tanto da continência urinária quanto da função renal em meninos com válvulas uretrais posteriores. Diferenças marcantes nas técnicas de urodinâmica, na classificação de diferentes padrões e no momento de realização dos exames são observadas ao se revisar a literatura sobre este tema.
Holmdahl et al acompanharam 12 meninos com PUV com menos de 15 anos de idade. Observou-se instabilidade durante o enchimento urodinâmico em 2/3 dos pacientes aos 5 anos de idade, mas até a puberdade isso havia diminuído.41 A capacidade vesical aos 5 anos parecia ser normal, mas após a puberdade mostrou-se aproximadamente o dobro da capacidade esperada. O padrão urodinâmico mudou ao longo do tempo, com a instabilidade diminuindo em favor de um padrão sobredistendido com o aumento da idade. Essa mudança no comportamento vesical também foi demonstrada por De Gennaro et al, em que 71% dos 48 pacientes estudados apresentaram estudos urodinâmicos anormais entre as idades de 10 meses-15 anos.42 No grupo etário <8 anos, 44% tinham bexigas hipercontráteis e 31% hipocontráteis e os pacientes >8 anos demonstraram 28 % padrões urodinâmicos hipercontráteis e 50% hipocontráteis. Misseri et al demonstraram uma menor taxa (5.9%) de falência miogênica (acontrátil ou incapaz de gerar uma contração detrusora sustentada para um esvaziamento vesical adequado) em seu estudo retrospectivo de 51 meninos e concluíram que a falência do detrusor se deveu a tratamento anticolinérgico coexistente em sua coorte de casos.43
A disfunção vesical é fundamental para os desfechos de função renal a longo prazo, como ilustrado no estudo de seguimento a longo prazo de Parkhouse et al, em que a constatação de incontinência aos 5 anos em 44% dos pacientes, definida como não permanecer seco durante o dia, esteve associada a um desfecho renal desfavorável em 46% desse grupo (p<0.001).20,24 No grupo de Ansari, composto por 227 meninos com válvulas uretrais posteriores, foi demonstrado um risco global de 30% de desenvolver doença renal crônica, com 10% progredindo para falência renal terminal.1 Disfunção vesical grave, definida como baixa complacência com pressão de enchimento final >40 cm de H20 ou volume residual pós-miccional >30% ou detrusor hipoativo ou necessidade de CIC, foi mais prevalente nos pacientes que progrediam para ESRD (p<0.0001). O estudo de Mazen, com 116 pacientes com PUV acompanhados por uma média de 10,3 anos (intervalo de 18 meses–22 anos), constatou que 42% dos pacientes tinham ESRF ou haviam sido transplantados. Anomalias urodinâmicas foram observadas em 80% do grupo total de pacientes, e a instabilidade vesical e a baixa complacência correlacionaram-se com um desfecho funcional renal desfavorável (p=0.04).44
Na coorte de PUV tratadas no pré-natal, os dados relativos à disfunção vesical são escassos. Abbo et al. compararam os desfechos de 38 meninos com PUV diagnosticados no pré-natal e 31 diagnosticados no pós-natal, sem diferença significativa na incidência de disfunção miccional (27% vs. 31%) em 7,2 anos de seguimento.45
A função vesical continua a evoluir durante a adolescência e o manejo vesical eficaz deve continuar na idade adulta. O crescimento prostático altera a dinâmica do trato de saída vesical e o padrão variável da dinâmica vesical observado na infância precoce continua a mudar ao longo da adolescência, sendo mais prevalentes a capacidade vesical aumentada e volumes residuais pós-miccionais elevados. Alguns homens jovens podem ter de iniciar cateterismo intermitente limpo para abordar essa deterioração irreversível da função vesical.
Transplante Renal
Com um número significativo de meninos com PUV evoluindo para insuficiência renal terminal, a importância de uma avaliação abrangente da bexiga como parte da investigação pré-transplante não pode ser subestimada. Uma bexiga de alta pressão, pouco complacente e de baixa capacidade pode colocar em risco o rim transplantado, e a perda do enxerto torna-se uma possibilidade real. As taxas de sobrevida do enxerto em cinco anos na população com PUV melhoraram nas últimas duas décadas, de 40% na década de 1980 para 70% na década de 1990 e para quase 90% na década de 2000.46
Para os pacientes que necessitam de intervenção cirúrgica para obter uma bexiga considerada um receptáculo ‘seguro’ para o transplante, há opiniões divididas quanto a se essa cirurgia deve ser realizada antes ou depois do transplante. A realização de aumento vesical com/sem um conduto cateterizável antes do transplante renal permite cicatrização pós-operatória sem imunossupressão, mas acarreta o risco de uma ‘cistoplastia seca’, que deve ser manejada por ciclagem vesical e lavagens, especialmente se houver produção nativa de urina ausente ou mínima. Um risco adicional dessa abordagem é que essa cirurgia de grande porte pode desequilibrar a função renal frágil e acelerar a necessidade de terapia substitutiva e diálise temporária no cenário de transplante pré-emptivo. Com o aumento vesical pré-transplante, quaisquer procedimentos adicionais, incluindo o próprio transplante, não devem lesar o pedículo vascular da cistoplastia de aumento, particularmente quando há um curto intervalo de tempo entre os procedimentos, e deve-se ter cuidado extra para garantir a segurança da bexiga reconstruída. Para os pacientes em que a cistoplastia de aumento é realizada após o transplante renal, é importante que as necessidades de imunossupressão tenham sido estabilizadas e que a melhora da função renal ofereça vantagens claras. Neste cenário, o uréter do transplante pode ser reimplantado na bexiga nativa ou exteriorizado como uma ureterostomia cutânea. Jesus e Pippi Salle concluíram, após uma revisão da literatura disponível, que a cistoplastia de aumento aumenta o risco de ITU após o transplante.47 Eles concordaram que a cistoplastia de aumento pré-emptiva deve ser realizada apenas em casos selecionados, nos quais os riscos associados ao aumento das pressões vesicais superam aqueles decorrentes da cistoplastia de aumento e das ITUs. Sabendo que um número significativo de meninos com PUV desenvolverá falência miogênica, a cistoplastia de aumento pode ser adiada desde que permaneçam sob vigilância estreita. No contexto de válvulas de uretra posterior e transplante renal, é crucial que a vigilância contínua da função vesical prossiga após o transplante. Riley et al. apresentam uma revisão abrangente das diferentes estratégias de manejo da bexiga no contexto da disfunção do trato urinário inferior e do transplante renal.48
Fertilidade
Há poucos estudos que relatam desfechos de fertilidade e paternidade em homens com histórico de válvulas uretrais posteriores. A dilatação persistente da uretra posterior, a lesão dos tecidos ao redor do veromontanum ou estenoses uretrais secundárias resultantes de cirurgias prévias influenciarão a eficácia da ejaculação. A disfunção erétil é observada com mais frequência em pacientes com doença renal crônica e naqueles em diálise. Em 9 pacientes com histórico de PUV estudados por Woodhouse , a análise do sêmen foi considerada dentro dos limites da normalidade, ao passo que, entre 6 homens que enviaram sêmen para análise a Lopez Pereira, 2 pacientes apresentaram formas anormais ou alta porcentagem de espermatozoides imóveis.49,50
Linhas de pesquisa futuras
O manejo das válvulas uretrais posteriores oferece ampla margem para a exploração de estratégias inovadoras de predição de desfechos e sobrevida. Uma ferramenta recente de aprendizado de máquina foi desenvolvida por Kwong et al para prever desfechos clinicamente relevantes. Isso demonstra algum potencial e merece validação adicional.51
Pontos-chave
- As válvulas uretrais posteriores continuam a ser a causa mais comum de obstrução da via de saída vesical neonatal em recém-nascidos do sexo masculino.
- Um número crescente de casos é diagnosticado no período pré-natal, mas a intervenção pré-natal não parece conferir benefício no desfecho a longo prazo da função renal.
- A ablação primária das válvulas é o tratamento de escolha recomendado, reservando-se a derivação para casos individuais específicos.
- Um número significativo de meninos com PUV desenvolverá doença renal crônica e insuficiência renal terminal.
- O seguimento estruturado visa prevenir a deterioração do trato urinário superior, prevenir infecções do trato urinário, maximizar o crescimento e permitir a monitorização da disfunção vesical tanto no pré- quanto no pós-transplante em pacientes com PUV.
Referências
- Ansari MS. Risk factors for progression to end-stage renal disease in children with posterior urethral valves. Journal of Pediatric Urology 6 (ue 3): 261–264. DOI: 10.1590/s1677-55382011000200030.
- Krishnan A, Souza A, Konijeti R, Baskin LS. The anatomy and embryology of posterior urethral valves. J Urol 2006; Apr;175(4):1214-20. DOI: 10.1016/s0022-5347(05)00642-7.
- Dewan PA, Zappala SM, Ransley PG, Duffy PG. Endoscopic reappraisal of the morphology of congenital obstruction of the posterior urethra. J Urol 1992; 70: 439–444. DOI: 10.1111/j.1464-410x.1992.tb15805.x.
- Casella DP, Tomaszewski JJ, Ost MC. Posterior urethral valves: renal failure and prenatal treatment. Int J Nephrol 2012; 2012 (351067). DOI: 10.1155/2012/351067.
- Thakkar D, Deshpande AV, Kennedy SE. Epidemiology and demography of recently diagnosed cases of posterior urethral valves. Pediatr Res 2014; Dec;76(6):560-3. DOI: 10.1038/pr.2014.134.
- Brownlee E, Wragg R, Robb A, Chandran H, Knight M, L. MC, et al.. Current epidemiology and antenatal presentation of posterior urethral valves: Outcome of BAPS CASS National Audit. J Pediatr Surg 2019; Feb;54(2):318-321. DOI: 10.1016/j.jpedsurg.2018.10.091.
- Chiaramonte C, Bommarito D, Zambaiti E, Antona V, Li Voti G. Genetic Basis of Posterior Urethral Valves Inheritance. Urology 2016. DOI: 10.1016/j.urology.2016.05.043.
- A. HS, D. RP, H. PD, L. M-JM, obstruction CWHP. Prenatal sonographic findings and clinical outcome in fourteen cases. Journal of Ultrasound in Medicine 1988; 7 (7). DOI: 10.7863/jum.1988.7.7.371.
- J. C, R M. A case of hypospadias, anterior and posterior urethral valves. Journal of Surgical Case Reports 2013; 2013 (2). DOI: 10.1093/jscr/rjt003.
- L. RK, B. E, P M. Anterior and posterior urethral valves: a rare association. Journal of Pediatric Surgery 2003; 38 (7). DOI: 10.1016/s0022-3468(03)00218-5.
- Johnson MP, Danzer E, Koh J, Polzin W, Harman C, O’Shaughnessy R. Natural history of fetal lower urinary tract obstruction with normal amniotic fluid volume at initial diagnosis. Fetal Diagn Ther 2018; 44 (1): 10–17. DOI: 10.1159/000478011.
- Johnson MP, Bukowski TP, Reitleman C, Isada NB, Pryde PG, Evans MI. In utero surgical treatment of fetal obstructive uropathy: a new comprehensive approach to identify appropriate candidates for vesicoamniotic shunt therapy. Am J Obs Gynecol 1994; 170 (6): 1770–1779. DOI: 10.1016/s0002-9378(12)91847-5.
- Ruano R, Dunn T, Braun MC, Angelo JR, Safdar A. Lower urinary tract obstruction: fetal intervention based on prenatal staging, Pediatr. Nephrol 2017; 32 (10): 1871–1878. DOI: 10.1007/s00467-017-3593-8.
- Saccone G, D’Alessandro P, Escolino M, Esposito R, Arduino B, Vitagliano A. Antenatal intervention for congenital fetal lower urinary tract obstruction (LUTO): a systematic review and meta-analysis. J Matern Fetal Neonatal Med 2020; 33 (15): 2664–2670. DOI: 10.1080/14767058.2018.1555704.
- group PLUTO, M K, K K, K M, J D. PLUTO trial protocol: percutaneous shunting for lower urinary tract obstruction randomised controlled trial. BJOG 2007; 114 (7): 904–905. DOI: 10.1111/j.1471-0528.2007.01382.x.
- Hoover DL, Duckett JJ. Posterior urethral valves, unilateral reflux and renal dysplasia: a syndrome. J Urol 1982; 128 (5): 994–997. DOI: 10.1016/s0022-3468(83)80243-7.
- Cuckow PM, Dineen MD, Risdon RA, PG R. Longterm renal function in posterior urethral valves, unilateral reflux and renal dysplasia syndrome. J Urol 1997; 158(3: 2 1004–1007. DOI: 10.1016/s0022-5347(01)64375-1.
- Smeulders N, Makin E, Desai D, P D. The predictive value of a repeat micturating cystourethrogram for remnant leaflets after primary endoscopic ablation of posterior urethral valves. J Ped Urol 2011; 7 (2): 203–208. DOI: 10.1016/j.jpurol.2010.04.011.
- Mukherjee S, Joshi A, Carroll D, al CH. What is the effect of circumcision on risk of urinary tract infection in boys with posterior urethral valves? J Ped Surg 2009; 44: 417–421. DOI: 10.1016/j.jpedsurg.2008.10.102.
- Harper L, Blanc T, Peycelon M, Michel JL, Leclair MD, Garnier S, et al.. Circumcision and Risk of Febrile Urinary Tract Infection in Boys with Posterior Urethral Valves: Result of the CIRCUP Randomized Trial. Eur Urol 2021; 22:S0302-2838(21)01993-X. DOI: 10.1016/j.eururo.2021.08.024.
- Chua ME, Ming JM, Carter S, El Hout Y, Koyle MA, Noone D, et al.. Impact of Adjuvant Urinary Diversion versus Valve Ablation Alone on Progression from Chronic to End Stage Renal Disease in Posterior Urethral Valves: A Single Institution 15-Year Time-to-Event Analysis. J Urol 2018. DOI: 10.1016/j.juro.2017.10.024.
- Tietjen DN, Gloor JM, Husmann DA. Proximal urinary diversion in the management of posterior urethral valves: is it necessary? J Urol 1997; 158: 1008–1010. DOI: 10.1016/s0022-3468(98)90257-3.
- P LP, L E, MJ MU, R L. Posterior urethral valves: prognostic factors. BJU Int 2003; 91: 687–690. DOI: 10.1016/s0022-5347(05)61251-7.
- Godbole P, Wade A, Mushtaq I, Wilcox D. Vesicostomy vs. primary valve ablation of posterior urethral valves: Always a difference in outcome? J Ped Urol 2007; 3: 273–275. DOI: 10.1016/j.jpurol.2006.11.007.
- Jaureguizar E, Lopez Pereira P, Urrutina MJM, L E. Does neonatal pyeloureterostomy worsen bladder function in children with posterior urethral valves? J Urol 2000; 164: 1031–1034. DOI: 10.1097/00005392-200009020-00027.
- Podesta M, Ruarte A, Garguilo C, R M. Bladder function associated with posterior urethral valves after primary valve ablation or proximal urinary diversion in children and adolescents. J Urol 2002; 168: 1830–1835. DOI: 10.1097/00005392-200210020-00042.
- Henneberry MO, Stephens FD. Renal hypoplasia and dysplasia in infants with posterior urethral valves. J Urol 1980; 123: 912–915. DOI: 10.1016/s0022-5347(17)56190-x.
- Parkhouse HF, Barratt TM, Dillon MJ, al DPG. Long-term otcome of boys with posterior urethral valves. Br J Urol 1988; 62: 59–62. DOI: 10.1111/j.1464-410x.1988.tb04267.x.
- Kousidis G, Thomas DFM, Morgan H, N H. The long-term outcome of prenatally detected posterior urethral valves:10 to 23 year follow-up study. BJU Int 2008; 102: 1020–1024. DOI: 10.1111/j.1464-410x.2008.07745.x.
- Sarhan O, Zaccaria I, Macher M, F M. Long-term outcome of prenatally detected posterior urethral valves: a single centre study of 65 cases managed by primary valve ablation. J Urol 2008; 179 (1): 307–312. DOI: 10.1016/j.juro.2007.08.160.
- DeFoor W, Clark C, Jackson E, P R. Risk factors for end stage renal disease in children with posterior urethral valves. J Urol 2008; 180: 1705–1708. DOI: 10.1016/s0084-3954(09)79530-2.
- Heikkila J, Holmberg C, Kyllonen L, al RR. Long term risk of end stage renal disease in patients with posterior urethral valves. J Urol 2011; 186: 2392–2396. DOI: 10.1016/j.juro.2011.07.109.
- Celedon CG, Bitsori M, Tullus K. Progression of chronic renal failure in children with dysplastic kidneys. Pediatr Nephrol 2007; 22: 1014–1020. DOI: 10.1007/s00467-007-0459-5.
- P LP, MJ MU, L E, E J. Long-term consequences of posterior urethral valves. J Pediatr Urol 2013; Oct;9(5):590-6. DOI: 10.1016/j.jpurol.2013.06.007.
- Nguyen MT, Pavlock CL, Zderic SA, Carr MC, Canning DA. Overnight catheter drainage in children with poorly compliant bladders improves post-obstructive diuresis and urinary incontinence. J Urol 2005; 174 (1633). DOI: 10.1097/01.ju.0000179394.57859.9d.
- Abdelhalim A, El-Hefnawy AS, Dawaba ME, Bazeed MA, Hafez AT. Effect of Early Oxybutynin Treatment on Posterior Urethral Valve Outcomes in Infants: A Randomized Controlled Trial. J Urol 2020; Apr;203(4):826-831. DOI: 10.1097/ju.0000000000000691.
- Farhat W, McLorie G, Capolicchio G, A K. Outcomes of primary valve ablation versus upper tract diversion in patients with posterior urethral valves. Urology 2000; 56 (4): 653–657. DOI: 10.1016/s0090-4295(00)00784-6.
- Metcalfe PD, Wang J, Jiao H, Huang Y, Hori K, Moore RB. Bladder outlet obstruction: progression from inflammation to fibrosis. BJU Int 2010; 106 (1686). DOI: 10.1111/j.1464-410x.2010.09445.x.
- Johal N, Cao K, Arthurs C, Millar M, Thrasivoulou C, Ahmed A, et al.. Contractile function of detrusor smooth muscle from children with posterior urethral valves - The role of fibrosis. J Pediatr Urol 2021; 100 (e1-100.e10). DOI: 10.1016/j.jpurol.2020.11.001.
- Peters CA, Bolkier M, Bauer SB, WH H. The urodynamic consequences of posterior urethral valves. J Urol 1990; 144 (1): 122–126. DOI: 10.1016/s0022-5347(17)39388-6.
- Holmdahl G, Sillen U, Hanson E, G H. Bladder dysfunction in boys with posterior urethral valves before and after puberty. J Urol 1996; 155: 694–698. DOI: 10.1016/s0022-5347(01)66502-9.
- M G, G M, ML C, M S. Early detection of bladder dysfunction following posterior urethral valves ablation. Eur J Pediatr Surg 1996; 6: 163–165. DOI: 10.1055/s-2008-1066497.
- Misseri R, Combs AJ, Hrowitz DJM. Myogenic failure in posterior urethral valve disease: real or imagined? J Urol 2002; 168: 1844–1848. DOI: 10.1097/00005392-200210020-00045.
- Ghanem MA, Wolffenbuttel KP, Vylder A, Nijman RJM. Long-term bladder dysfunction and renal function in boys with posterior urethral valves based on urodynamic findings. J Urol 2004; 171: 2409–2412. DOI: 10.1097/01.ju.0000127762.95045.93.
- Abbo O, Bouali O, Ballouhey Q, Mouttalib S, Lemandat A. Decramer S, et al.\[Is there an outcome difference between posterior urethral valves diagnosed prenatally and postnatally at the time of antenatal screening?\. Prog Urol 2013; 23: 144–149.
- Marchal S, Kalfa N, Iborra F, Badet L, Karam G, Broudeur L, et al.. Long-term Outcome of Renal Transplantation in Patients with Congenital Lower Urinary Tract Malformations: A Multicenter Study. Transplantation 2020; Jan;104(1):165-171. DOI: 10.1097/tp.0000000000002746.
- Jesus LE, Pippi Salle JL. Pre-transplant management of valve bladder: a critical literature review. J Pediatr Urol 2015; Feb;11(1):5-11. DOI: 10.1016/j.jpurol.2014.12.001.
- Riley P, Marks SD, Desai D, I M. Challenges facing renal transplantation in pediatric patients with lower urinary tract dysfunction. Transplantation 2010; 89 (11): 1299–1307. DOI: 10.1097/tp.0b013e3181de5b8c.
- Woodhouse C, Reilly JM, Bahadur G. Sexual function and fertility in patients treated for posterior urethral valves. J Urol 1989; 142 (2 part 2): 586–588. DOI: 10.1016/s0022-5347(17)38824-9.
- P LP, M M, MJ MU, JA M. Long-term bladder function, fertility and sexual function in patients with posterior urethral valves treated in infancy. J Pediatr Urol 2011. DOI: 10.1016/j.jpurol.2011.11.006.
- Wong JC, Khondker A, Kim JK, Chua M, Keefe DT, Dos Santos J, et al.. Posterior Urethral Valves Outcomes Prediction (PUVOP): a machine learning tool to predict clinically relevant outcomes in boys with posterior urethral valves. Pediatr Nephrol 2021. DOI: 10.1007/s00467-021-05321-3.
Ultima atualização: 2025-09-21 13:35