20: Disfunção miccional
Este capítulo levará aproximadamente 41 minutos para ler.
Introdução
Os sintomas do trato urinário inferior (LUTS), a disfunção da bexiga e do intestino (BBD) ou a síndrome de eliminação disfuncional são todos termos que descrevem o conjunto comum de sintomas que vão desde a síndrome da bexiga hiperativa (OAB), adiamento da micção, incontinência de esforço, incontinência do riso até a micção disfuncional, entre outros.1 O impacto dos molhamentos diurnos em crianças pode ser bastante profundo — com efeitos sociais, emocionais e comportamentais na vida diária.2 Com base no entendimento da OAB, sabemos que, se ela persiste por um período prolongado, veremos espessamento da parede vesical, o que pode ter um impacto ao longo da vida. À medida que os pacientes envelhecem, as consequências tornam-se mais pronunciadas e exigem maior esforço para corrigir.3,4
Do ponto de vista da urologia pediátrica, a criança com OAB provavelmente terá problemas de OAB na idade adulta. Essa correlação foi observada em dois estudos publicados. No primeiro estudo, Fitzgerald et al3 revelaram que a micção diurna frequente na infância se correlacionou com urgência na idade adulta, e existia uma correlação entre noctúria na infância e na idade adulta. Incontinência urinária diurna na infância e enurese noturna estiveram associadas a um aumento superior a duas vezes na probabilidade de incontinência urinária de urgência na idade adulta. Além disso, história de infecção do trato urinário (ITU) na infância correlacionou-se com ITU na vida adulta. Em outro estudo de Minassian et al envolvendo 170 mulheres adultas, constatou-se maior prevalência de disfunção miccional na infância em mulheres que apresentavam frequência urinária, urgência e incontinência urinária de esforço ou de urgência.4 Eles também observaram que as pacientes sintomáticas tinham maior probabilidade de apresentar IMC mais elevado. A tendência tem sido tranquilizar os pais de que esses problemas são autolimitados e se resolverão à medida que a criança amadurece. Parece que a resolução espontânea nem sempre ocorre e que algumas crianças, à medida que amadurecem, ficam melhores em compensar seus problemas e acabam deixando de fazer acompanhamento. Uma melhor compreensão das potenciais causas de OAB na infância pode prevenir problemas desnecessários na vida adulta e tornar muitas crianças, pais e professores muito mais felizes.
Genética
Há evidências crescentes de que fatores genéticos têm papel importante na incontinência urinária. Filhos de pais que têm bexiga hiperativa (BHA) e/ou problemas psiquiátricos subjacentes tendem a ser mais refratários aos tratamentos convencionais da BHA.3,5 Esses achados foram corroborados por Labrie et al, cuja pesquisa mostra que mães de crianças com BHA ou micção disfuncional têm maior probabilidade de ter apresentado sintomas semelhantes na infância do que mães de crianças sem sintomas do trato urinário inferior (STUI) (28.9% vs 16.3% p<0.02, respectivamente).5 Pais de crianças com sintomas do trato urinário inferior apresentaram maior probabilidade de ter tido resolução tardia de sua enurese noturna (6% e 6.5% em meninos e meninas, respectivamente) e, além disso, pais que tiveram incontinência diurna apresentaram uma taxa estatisticamente significativa de incontinência quando crianças, 9.25% vs 4.6% (p<0.0001).5 Dados de adultos podem ser usados como proxy para crianças. Observando os dados disponíveis, há alguns estudos que indicam uma predisposição genética para STUI em alguns pacientes. Uma metodologia comumente utilizada para aferir a importância da influência genética é o uso de estudos com gêmeos. Um estudo sueco envolvendo mais de 25000 gêmeos revelou evidências de uma ligação genética para suscetibilidade à incontinência urinária, à frequência urinária e à noctúria em mulheres.6 Houve dados insuficientes em pacientes do sexo masculino para se chegar a conclusões. Por outro lado, em um estudo que analisou uma metanálise de polimorfismos/genes candidatos em homens, foram identificados cinco genes: ACE, ELAC2, GSTM1, TERT e VDR. A heterogeneidade foi alta em três dessas metanálises. A variante rs731236 do receptor de vitamina D teve efeito protetor para STUI (odds ratio: 0.64; intervalo de confiança de 95%, 0.49–0.83) com heterogeneidade moderada (I2 = 27.2%).7
Ao examinar a literatura psiquiátrica, há um grande número de estudos que associam condições psicológicas a LUTS. A associação entre incontinência urinária e bem-estar psicológico em adultos também foi observada por Botlero et al.8 A depressão maior pode prever o início de incontinência urinária em mulheres, numa amostra populacional de risco.9 Um estudo encontrou taxas aumentadas de enurese no transtorno bipolar em adultos (18%).10 Também foi descrita uma associação com transtorno de pânico e cistite intersticial.11 A perda urinária diurna também foi identificada como um marcador desenvolvimental pré-mórbido para esquizofrenia (SCZ).12 Os autores constataram que pacientes com SCZ apresentavam taxas mais altas de enurese na infância (21%) em comparação com irmãos (11%) ou pacientes controle (7%), e o risco relativo de enurese estava aumentado nos irmãos. Pacientes com enurese tiveram pior desempenho em dois testes cognitivos do lobo frontal (fluência de letras e fluência de categorias), em comparação com pacientes não enuréticos. Notavelmente, as alterações cerebrais associadas a esses transtornos tendem a se agrupar em torno do córtex cingulado anterior (ACC) e do córtex pré-frontal (PFC), exatamente onde alterações estão sendo observadas em pacientes com urgência e incontinência de urgência na fMRI.13,14
Epidemiologia
A prevalência da incontinência diurna varia amplamente de estudo para estudo. Aos 7 anos de idade, a taxa de incontinência diurna varia de 4,9 a 11,7%.15,16 Aos 11–12 anos de idade, a prevalência varia entre 0,8% e 12,5%.17,18,19,20,21 Foi realizada uma meta-análise desses 3 estudos, resultando em uma prevalência global de 6,4%. O estudo longitudinal inglês ALSPAC, o mais importante a lançar luz de forma contínua, identificou as seguintes trajetórias para a incontinência diurna ao longo da faixa etária de 4,5-9,5 anos:22
i. Normativo (86,2%); continente aos 4,5 anos ii. Tardio (6,9%); probabilidade de incontinência diurna diminuindo de forma constante de 80% aos 4,5 anos de idade para < 10% aos 9,5 anos de idade iii. Persistente (3,7%); probabilidade de incontinência diurna > 80% até os 7,5 anos de idade, com redução constante para 60% aos 9,5 anos de idade iv. Recidivante (3,2%); probabilidade de incontinência diurna <10% aos 5,5 anos de idade, aumentando para 60% aos 6,5 anos, com declínio lento posteriormente.
Não houve diferença entre os sexos no grupo tardio, mas as meninas superaram os meninos nos grupos persistente e recidivante. Um estudo de Stone et al que avaliou crianças com incontinência urinária persistente, submetidas a investigação urodinâmica e a exames de imagem da coluna vertebral, revelou que, quando extrapolados até os 18 anos de idade, até 33% das crianças que apresentavam perda urinária aos 10 anos de idade tenderiam a persistir com alguma forma de sintomas urinários.23
Comorbidade neuropsiquiátrica
Crianças com transtornos de eliminação apresentam uma taxa aumentada de transtornos comportamentais e psicológicos coexistentes; aproximadamente 20–40% das crianças com incontinência urinária diurna são acometidas por transtornos comportamentais.24,25,26 Em um grande estudo epidemiológico de 8213 crianças de 7.5–9 anos, crianças que se molhavam durante o dia apresentaram taxas significativamente aumentadas de condições psicológicas, especialmente ansiedade de separação (11.4%), transtorno do déficit de atenção e hiperatividade (TDAH) (24.8%), comportamento opositor (10.9%) e problemas de conduta (11.8%).27 Na mesma coorte, 10,000 crianças de 4–9 anos foram avaliadas; atraso no desenvolvimento, temperamento difícil e depressão/ansiedade materna foram associados ao molhar-se durante o dia e à sujidade fecal.28 Em outro estudo populacional que incluiu 2856 crianças, a incidência de incontinência foi de 16.9% nos 6 meses anteriores.29 Em um estudo retrospectivo de pacientes com TDAH, 20.9% molhavam-se à noite e 6.5% durante o dia. As razões de chances foram 2.7 e 4.5, respectivamente, o que demonstra uma associação não específica do TDAH com o molhar-se noturno e diurno.30 Dos possíveis transtornos de eliminação gastrointestinais, as crianças com incontinência fecal (ou encoprese) apresentaram as maiores taxas de transtornos comportamentais comórbidos: 30–50% de todas as crianças tinham transtornos comportamentais clinicamente relevantes.24,25 Em um estudo epidemiológico com mais de 8242 crianças, aquelas com 7 a 8 anos de idade apresentaram uma ampla gama de transtornos coexistentes (DSM-IV), incluindo ansiedade de separação (4.3%), fobias sociais (1.7%), fobias específicas (4.3%), ansiedade generalizada (3.4%), transtornos depressivos (2.6%), TDAH (9.2%) e comportamento opositor desafiador (11.9%). Um estudo anterior constatou que pacientes descritos como portadores de psiconeuroticismo tinham menor probabilidade de responder ao tratamento da instabilidade do detrusor do que aqueles que não apresentavam nenhuma forma de psiconeuroticismo. A maioria dos bons respondedores e um terço dos não respondedores estavam livres de problemas psiquiátricos.31 É importante destacar que 25% dos pacientes deste estudo apresentavam sintomas de síndrome do intestino irritável.
Avaliação
História
A avaliação da criança com BBD começa com uma anamnese detalhada e exame físico. Uma história clara ajuda a determinar a sintomatologia predominante e quando os sintomas tendem a ocorrer. Em geral, é melhor tentar obter a história pertinente da criança, se for colaborativa. Quando não é possível obter a história diretamente da criança, pode não haver alternativa senão obtê-la dos pais. Sinais de urgência, como cruzar as pernas, correr para o banheiro, segurar o pênis, esfregar o clitóris, agachar e sentar sobre os calcanhares (reverência de Vincent), são todos sinais de urgência. Manter um diário miccional é fundamental. A frequência urinária é outra manifestação de OAB e quantificar o volume e o número de vezes que o paciente urina é útil para determinar se há frequência verdadeira. A incontinência urinária de urgência é uma característica clássica da bexiga hiperativa. O momento em que a incontinência ocorre deve ser registrado para ajudar a identificar qualquer associação com o intestino. Não é incomum que crianças com grande carga fecal tenham urgência e incontinência de urgência após uma refeição. Isso provavelmente se deve à estimulação das contrações colônicas pelo reflexo gastrocolônico. Está bem estabelecido que ocorre comunicação cruzada na medula espinhal entre o cólon e a bexiga.32,33,34,35 Isso pode desencadear contrações vesicais ou, pelo menos, levar a sintomas de urgência. Gotejamento pós-miccional é um sinal de relaxamento incompleto de todo o complexo esfincteriano ou do esfíncter externo. É comum em crianças com micção disfuncional. Também são comumente observadas em pacientes com micção disfuncional disúria ou uretrorragia não associadas a infecção, mas sim à micção dissinérgica.33
A disinergia do esfíncter interno tem sido associada a tontura e disfunção autonômica (hipotensão ortostática sem aumento concomitante da frequência cardíaca) tanto em homens quanto em mulheres, quando os pacientes são questionados se sentem tontura ao ficar em pé.36
Um histórico minucioso dos hábitos intestinais do paciente deve ser obtido diretamente com o paciente. Muitos pais não têm consciência da verdadeira natureza das evacuações de seus filhos e muitos relatarão que as evacuações de seus filhos são normais, enquanto as crianças os contradizem firmemente. Deve-se obter documentação do tamanho e da natureza das evacuações. O uso de um diagrama é bastante benéfico e facilita a comunicação com a criança.37 É importante observar se as evacuações são dolorosas ou associadas a sangramento retal. Evacuações de grande volume costumam ser um indicador de evacuações infrequentes. Dor ou sangramento retal podem estar associados à dissinergia do esfíncter externo. Pacientes com diarreia ou sintomas de colite também podem apresentar problemas de bexiga hiperativa. Dor periumbilical crônica é outro sinal de que há um problema de constipação ou alterações na homeostase da serotonina no intestino. Muitas crianças se queixam dessa dor e, uma vez instituído um regime intestinal, a dor desaparece.
Deve-se utilizar um questionário padronizado para avaliar os pacientes quando vistos pela primeira vez e no seguimento. Existem 2 questionários comumente utilizados que foram validados para crianças; o primeiro é o DVSS e o outro é a Escala de Vancouver.38,39 Além disso, há um questionário que avalia o perfil psiquiátrico da criança e é bastante útil para rastrear rapidamente problemas subjacentes de atenção, hiperatividade, depressão e ansiedade em crianças, que são comumente associados a LUTS.40
Exame Físico
O exame físico é útil na avaliação e pode ser muito revelador. O exame do abdome é fundamental para determinar se há fezes palpáveis no cólon. A palpação do quadrante inferior esquerdo até o quadrante superior esquerdo geralmente evidencia grandes quantidades de fezes presentes nesses abdômens. Em muitos casos, os pais podem negar problemas intestinais. A distensão gasosa do cólon é igualmente problemática e deve ser observada, pois pode levar aos mesmos problemas que a constipação.
O exame das costas geralmente revelará costas de aparência normal e pregas anocutâneas. A rara ocorrência de achatamento das nádegas ou de pregueamento anormal na articulação sacroilíaca é indicativa de anomalia sacral (Figura 1) e (Figura 2) Observar a criança caminhar também pode ajudar a identificar um possível problema neurológico, se a criança andar na ponta dos pés. Pés cavos são outra pista potencial de algum tipo de condição neurológica. Fossetas sacrais baixas geralmente não são motivo de preocupação. Somente as fossetas associadas a tufos de pelos ou localizadas mais acima nas costas são motivo de preocupação e devem ser avaliadas com uma ressonância magnética da coluna lombossacra.
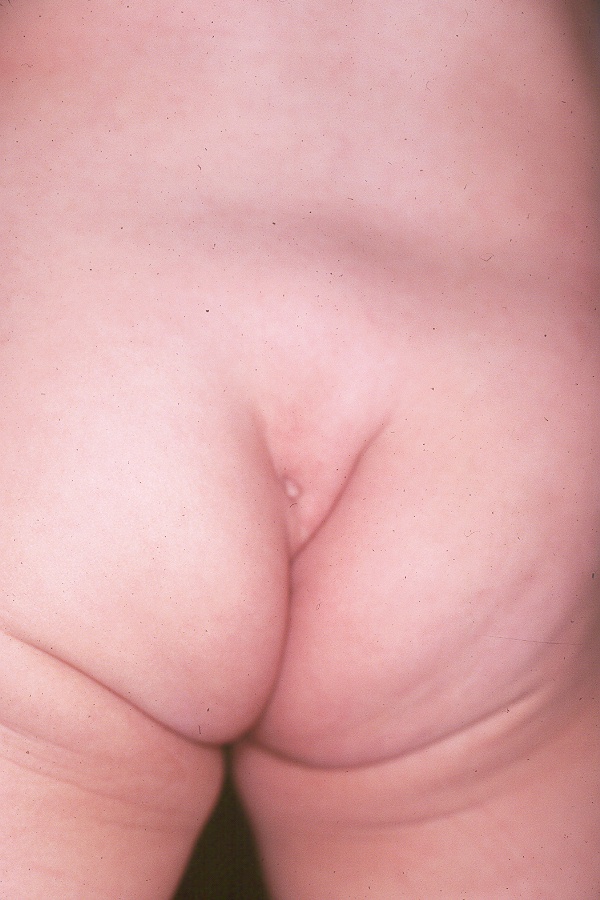
Figura 1 Fenda sacral anormal associada à medula ancorada.
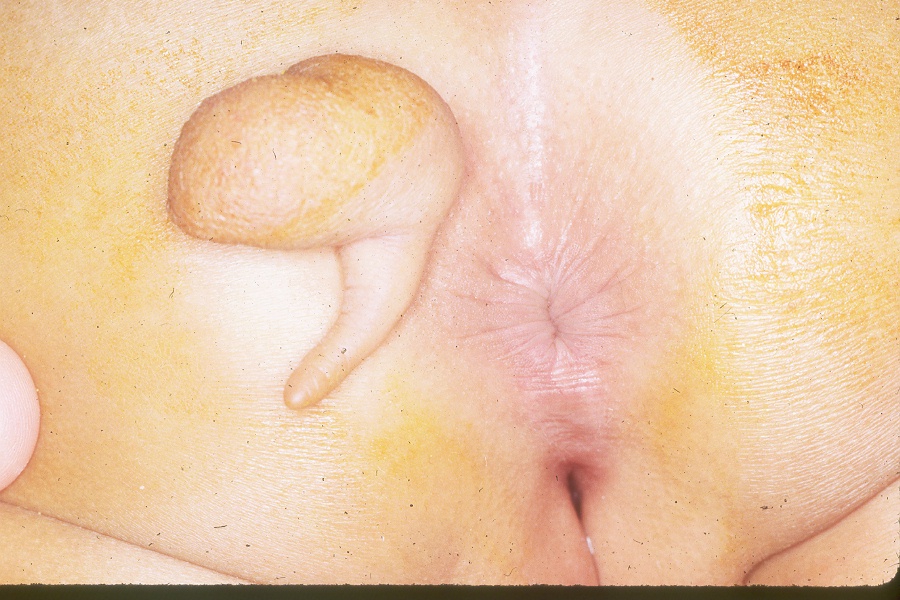
Figura 2 Apêndice parasacro associado à síndrome da medula presa.
Exames Diagnósticos
A seguir, discutimos os exames diagnósticos que realizamos, na ordem em que os realizamos, para otimizar a nossa abordagem e minimizar a necessidade de exames invasivos nos pacientes.
Análise de urina
O primeiro e mais importante exame clínico que deve ser realizado em todas as crianças que apresentam BBD é o exame de urina. Um exame de urina simples deve ajudar a determinar se os sintomas decorrem de infecção ou de BBD. Não é incomum observar hematúria microscópica em pacientes que têm micção dissinérgica, condição comumente associada à BBD.
Resíduo pós-miccional
Um PVR deve ser realizado em todos os pacientes avaliados por LUTS e DV. Esta é a informação mais importante de que você dispõe nas fases iniciais da avaliação e pode lhe fornecer uma percepção imediata adicional sobre os possíveis problemas que precisam ser abordados. Resíduos elevados podem estar associados a UTIs recorrentes ou micções frequentes, enquanto um PVR baixo também pode estar associado à frequência, mas a etiologia subjacente da frequência será diferente.
Um dispositivo capaz de fornecer uma imagem real da bexiga é preferível a um dispositivo que fornece uma imagem representativa. Isso é valioso, pois também se pode medir o diâmetro retal. Diâmetros retais superiores a 4 cm estão associados à BBD e estudos demonstraram que a correção dessa dilatação está associada à melhora dos sintomas.
Urofluxometria/EMG
A urofluxometria é uma ferramenta importante para ajudar a determinar se a criança urina de forma anormal. O uso das 5 curvas clássicas, sino, torre ou hypervoider, staccato, interrompida e curva em platô, está em processo de ser suplantado por um sistema modificado que se baseia em saber se a curva é lisa ou fracionada e em um índice de fluxo. O índice de fluxo é independente do volume e, portanto, pode ser usado para comparar fluxos em todos os volumes e em múltiplas idades.41,42,43 Além disso, os índices de fluxo são uma medida da eficiência miccional, o que é uma representação do fluxo muito mais precisa do que descrições de forma.
O uso da urofluxometria é ainda potencializado pelo uso concomitante de um EMG dos músculos perineais. A utilização do EMG perineal permite determinar se a criança está miccionando com dissinergia do esfíncter externo (aumento da atividade dos músculos perineais) e diagnosticar dissinergia do esfíncter interno com base no tempo de latência e na morfologia da curva de fluxo (tipicamente platô ou índice de fluxo <=0.7).44
Ultrassonografia Renal e Vesical
Ultrassonografia reno-vesical não é essencial para crianças com LUTS não associados à infecção. Por outro lado, um paciente com infecções de repetição deve ter o trato urinário superior examinado para procurar discrepâncias de tamanho e hidronefrose, que podem ser indicativas de refluxo ou de suas consequências. Em pacientes com incontinência persistente, a ultrassonografia é útil para descartar duplicação renal associada a um ureter ectópico. A dilatação de um ureter pode ser outra pista para sugerir a presença de um ureter ectópico. Em pacientes com micção obstrutiva, a ultrassonografia da bexiga é útil para identificar a presença de uma ureterocele obstrutiva. O espessamento da parede vesical pode ser identificado na ultrassonografia e é um indicador útil de obstrução ou hiperatividade vesical.
KUB e AP Lateral da Coluna Vertebral
Em algumas crianças nas quais o habitus corporal torna a palpação das fezes pouco confiável, pode ser necessário considerar um KUB para avaliar a carga fecal colônica ou para avaliar a evolução com um regime intestinal. Se um KUB for realizado, é razoável considerar uma radiografia AP e lateral do sacro para confirmar que não há anomalias sacrais (Figura 3) Em algumas crianças, um KUB pode ser inadequado para verificar se a coluna está normal devido a fezes sobrepostas que obscurecem o sacro.
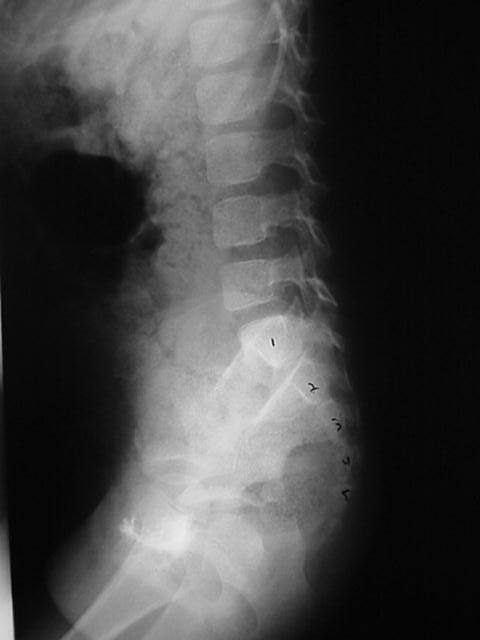
Figura 3 O filme lateral da coluna mostra claramente os segmentos sacrais que não seriam visíveis devido à grande carga fecal neste paciente.
Cistouretrografia miccional
Uma VCUG bem realizada fornece uma quantidade enorme de informações sobre a dinâmica da micção, além da presença ou ausência de refluxo, ureteres ectópicos ou válvulas. O colo vesical pode ser visto abrindo e o esfíncter externo também pode ser visto abrindo e fechando. A presença da uretra em pião é um exemplo clássico de dissinergia do esfíncter externo (Figura 4) Uma VCUG não está indicada em todos os pacientes com LUTS. Uma VCUG deve ser realizada em casos refratários para delinear melhor a dinâmica da micção e confirmar que nenhum problema anatômico passou despercebido.
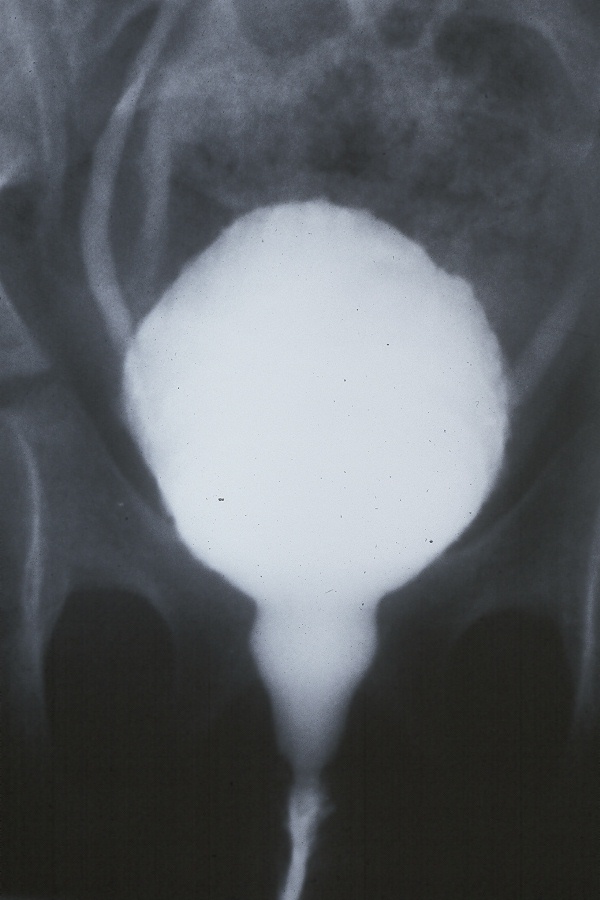
Figura 4 Uretra em pião em paciente do sexo feminino com refluxo e infecções do trato urinário recorrentes.
Ressonância Magnética da Coluna
A realização de exames de imagem do sacro está indicada quando o paciente apresenta uma lesão evidente nas costas, conforme mencionado anteriormente na seção de exame físico. Em pacientes que não responderam a todas as tentativas de tratamento e a incontinência persiste, uma ressonância magnética da coluna vertebral também pode estar indicada. Recomendamos que a ressonância magnética seja realizada antes da urodinâmica, uma vez que a hiperatividade do detrusor na urodinâmica não é diagnóstica de disfunção neurogênica da bexiga. Portanto, o paciente precisará de uma ressonância magnética da coluna de qualquer forma, sendo melhor prosseguir primeiro com o exame definitivo. A medula ancorada oculta ocorre muito raramente quando não há estigmas cutâneos.45
Urodinâmica
Em pacientes com LUTS, o estudo urodinâmico frequentemente apenas confirma a conclusão de uma anamnese minuciosa, de que estão presentes contrações não inibidas (UIC). Bael et al justificam essa afirmação, pois demonstraram não haver benefício em realizar estudo urodinâmico em crianças com BBD.46 A presença de UICs não confirma nem exclui a existência de uma lesão neurológica. O único achado de relevância é a ausência de contração do detrusor, já evidente no estudo de urofluxometria que demonstra uma curva de fluxo ruim. Isso não significa que não haja indicação para realizar UDS em crianças. Em algumas situações, a urodinâmica é realizada simultaneamente com a VCUG. Em alguns casos, a UDS pode ajudar a identificar a origem das perdas urinárias, especialmente quando combinada com fluoroscopia.
Opções de Tratamento
Uroterapia
A uroterapia é um termo abrangente para todas as intervenções não cirúrgicas e não farmacológicas para problemas funcionais da bexiga e do intestino em crianças e adolescentes. Constitui o pilar do tratamento da incontinência urinária diurna, bem como da incontinência urinária noturna, constipação funcional e incontinência fecal.47,48
O objetivo da uroterapia é normalizar o padrão miccional e intestinal e prevenir novas alterações funcionais. Faz-se uma distinção entre uroterapia padrão e uroterapia específica. Três condições devem ser satisfeitas antes que a uroterapia possa ser iniciada. Primeiro, um diagnóstico claro de incontinência funcional. Segundo, a criança deve estar pronta para a escola; quando a criança é imatura demais, pode não ter as habilidades cognitivas ou motoras para compreender e concluir a uroterapia. Terceiro, uma boa anamnese psicossocial, pois problemas psicossociais ou comportamentais também podem influenciar a eficácia da terapia e podem requerer avaliação psiquiátrica ou terapia familiar.49,50
A uroterapia padrão consiste em educação e desmistificação, instruções de modificação comportamental, orientações de estilo de vida quanto à ingestão de líquidos, registro das frequências miccionais, dos volumes miccionais e dos episódios de incontinência, além de apoio e incentivo às crianças e a seus pais.51 A uroterapia começa com uma explicação da função e da disfunção da bexiga e do intestino, explicando as causas da incontinência. Devem ser dadas orientações sobre a ingestão adequada de líquidos e a micção regular durante o dia. Também devem ser fornecidas instruções quanto à postura adequada no vaso sanitário. Um diário miccional deve ser mantido para automonitorização e motivação. O diário proporciona à criança e aos pais uma visão do progresso do tratamento. Após a explicação e as instruções, a criança coloca em prática em casa por, no máximo, três meses. Nesse período, deve ser fornecida orientação frequente e o progresso deve ser avaliado com regularidade. Essas avaliações periódicas podem ser realizadas por telemedicina e/ou em visitas regulares à clínica.
Constipação intestinal ou infecções do trato urinário (ITUs) devem ser abordadas antes da uroterapia.47,48 Como a disfunção intestinal e vesical se afetam mutuamente, a uroterapia é menos bem-sucedida se a função intestinal e/ou as ITUs não forem abordadas durante o tratamento.51,52
O sucesso do tratamento é determinado pelo grau em que a criança e os pais estão satisfeitos com os resultados. A satisfação e a melhoria da qualidade de vida podem ser um motivo para encerrar o tratamento em vez de buscar os melhores resultados possíveis. Quando o tratamento não é bem-sucedido, é importante identificar o motivo.
Quando os resultados da uroterapia padrão são insatisfatórios, recomenda-se a uroterapia específica. Essa terapia combina intervenções especializadas, como biofeedback do assoalho pélvico, terapia cognitivo-comportamental, psicoterapia, neuroestimulação ou cateterismo intermitente limpo.47,48,51,53 A uroterapia específica é adaptada ao tipo específico de disfunção vesical e intestinal e é composta por programas específicos para crianças com sintomas resistentes ao tratamento. Estes programas ajudam as crianças a aprender como urinar, quando urinar e com que frequência urinar. A prática repetida é necessária para habituar o novo comportamento miccional.50
Crianças com problemas comportamentais exigem um plano adaptado às necessidades únicas da criança.54 Para comorbidades e hiperatividade vesical grave, a medicação pode ser necessária.47
A uroterapia é um tratamento eficaz que alcança continência em 56% das crianças em até um ano, enquanto a taxa de cura espontânea da incontinência é de 15% ao ano. A uroterapia aborda todos os aspectos da incontinência, levando ao melhor desfecho clínico. Isso inclui problemas somáticos, psicossociais e comportamentais, e a qualidade de vida.55
Manejo Intestinal
A constipação aguda simples ou a distensão colônica, em muitos casos, pode ser tratada simplesmente aumentando a hidratação e/ou adicionando sucos ricos em sorbitol, como de ameixa, pêra e maçã, juntamente com frutas e vegetais em purê à dieta normal da criança. Extrato de malte de cevada ou xarope de milho também podem ser usados para amolecer as fezes. Outras mudanças dietéticas incluem reduzir a ingestão excessiva de leite, pois o cálcio saponifica as fezes e leva ao endurecimento. Além disso, atualmente não existem evidências que apoiem o uso de suplementos dietéticos prebióticos e/ou probióticos como tratamento da constipação.56 Após a falha das intervenções dietéticas, outras opções de tratamento incluem laxantes osmóticos, como polietilenoglicol (0,7 g/kg de peso corporal por dia) lactulose, sorbitol ou leite de magnésia (dose: 1–3 mL/kg de peso corporal por dia). Não existem evidências de que a suplementação de fibras dietéticas ou o biofeedback isoladamente sejam intervenções eficazes para a constipação que requer tratamento médico.56 Muitos pacientes necessitam de terapia de manutenção para controlar seus sintomas persistentes de constipação. Em nossa própria experiência, os agentes osmóticos não são tão eficazes isoladamente quanto quando usados em combinação com laxantes de sene ou bisacodil. A preocupação de que os alcaloides do sene causem dependência ou prejudiquem a motilidade colônica é um ‘conto de velhas’ e deve ser ignorada: o uso agressivo de tais medicamentos é justificável em algumas crianças.57
O uso de agentes osmóticos por si só foi corroborado por Bush et al, cuja pesquisa mostrou que o polietilenoglicol 350 não foi superior ao placebo durante um ensaio de 1 mês.58 O manejo da constipação pode resultar em até 50% de resolução dos sintomas miccionais ou mais.59
Farmacológico
Anticolinérgicos
Anticolinérgicos, (também conhecidos como antimuscarínicos) são tipicamente usados como tratamentos de primeira linha da OAB em crianças cujos sintomas persistiram após a uroterapia. Atualmente, apenas três antimuscarínicos (oxibutinina [FDA e EMA] , Solifenacina [FDA e EMA] e tolterodina [EMA]) receberam formalmente aprovação para uso em crianças. Os ensaios clínicos realizados em crianças (estudos com oxibutinina, solifenacina, darifenacina) geralmente incluíram pacientes com problemas miccionais neurogênicos comprovados e não investigaram os efeitos dos antimuscarínicos em pacientes com sintomas de LUT não neurogênicos ou idiopáticos. Dados publicados em 2006 sugerem que os efeitos terapêuticos dos antimuscarínicos em pacientes considerados como não apresentando déficits neurológicos são mediados predominantemente por interações com o ramo sensorial/aferente do arco reflexo, em vez do lado eferente/motor.60 Receptores muscarínicos são encontrados em células uroteliais, células suburoteliais de Cajal e em nervos aferentes.61 Os antimuscarínicos atuam durante a fase de enchimento/armazenamento da micção, quando os nervos colinérgicos (eferentes ou motores) não estão ativos. A acetilcolina pode ser gerada e liberada pelo urotélio em resposta ao enchimento vesical/aumento da tensão e também pode ‘vazar’ das terminações nervosas colinérgicas durante o enchimento vesical62 seguida de ligação aos receptores M2 e M3 e pode ser um mecanismo de hiperatividade em pacientes com doenças vesicais..63
Cinco subtipos distintos de receptores colinérgicos muscarínicos foram identificados (M1–M5), e o músculo liso da bexiga expressa predominantemente dois desses subtipos: M2 (70–80%) e M3 (20–30%). Foi demonstrado que a ativação dos receptores M3 evoca a contração do músculo liso, constituindo o principal estímulo para a contração da bexiga. Postula-se que os receptores M2 e M3 estejam envolvidos não apenas na ativação da contração do músculo liso por nervos eferentes, mas também na ativação de nervos sensoriais/aferentes.61 A ativação dos receptores M2 no urotélio pode reverter o relaxamento do músculo liso mediado pelo sistema nervoso simpático que permite a fase de enchimento, ou de armazenamento, do ciclo miccional; contudo, a ativação dos receptores M2 pode provocar contração do músculo liso por outros mecanismos pouco compreendidos.64
Receptores M1 são encontrados no cérebro, em glândulas (como as salivares) e em gânglios simpáticos. A ativação desses receptores é responsável pela maioria dos efeitos adversos dos fármacos antimuscarínicos. A boca seca é o sintoma mais comum. Obstipação, refluxo gastroesofágico, visão turva, retenção urinária e efeitos adversos cognitivos também podem ocorrer; esses sintomas são geralmente menos incômodos em crianças. O potencial para efeitos adversos cognitivos e delírio também existe em crianças, mas geralmente se limita a situações de sobredosagem.65,66,67 Em ensaios clínicos em adultos, dados eletroencefalográficos quantitativos sugerem que a oxibutinina tem mais efeitos no SNC do que o trospio ou a tolterodina.68,69
Alfa-bloqueadores
O uso de α-bloqueadores (também conhecidos como antagonistas dos recetores α-adrenérgicos) na disfunção miccional não neuropática foi popularizado por Austin et al para tratar a disfunção miccional em crianças.70 Estes medicamentos têm sido usados no tratamento de doentes com disfunção do colo vesical e retenção urinária; estes agentes também são úteis para atenuar os sintomas de urgência e de incontinência de urgência em algumas crianças.71 Estudos em adultos indicam que os bloqueadores alfa são eficazes no controlo de sintomas irritativos devido a stents e em homens idosos com hiperplasia benigna da próstata.72,73 Há algumas evidências de que a alfuzosina reduziu a pressão anal em repouso e durante evacuação simulada em mulheres saudáveis e com obstipação, comparativamente ao placebo, mas não melhorou os sintomas intestinais em mulheres com obstipação.74 Em muitos doentes, a terazosina, um α-bloqueador não seletivo, é o fármaco de primeira linha para o tratamento da urgência e do aumento da frequência urinária, devido às propriedades não seletivas deste agente e ao potencial de atravessar a barreira hematoencefálica; no entanto, bloqueadores mais seletivos do recetor α1, como a tamsulosina ou a alfuzosina, são mais adequados para o tratamento da disfunção do colo vesical que pode levar à hipertrofia e instabilidade do detrusor. Os α-bloqueadores não seletivos podem causar hipotensão postural. Portanto, estes agentes devem ser utilizados com cautela, sendo necessária uma titulação gradual da dose. Em doentes com história familiar de desmaiar com facilidade ou de hipotensão postural, a titulação da dose é essencial mesmo com o uso de α-bloqueadores mais seletivos. De um modo geral, as crianças toleram bem os α-bloqueadores.75
Agonistas beta-3
Agonistas do adrenorreceptor β3, como o mirabegron, podem aumentar a capacidade vesical sem aumentar a pressão miccional ou o volume residual pós-miccional.76 O tratamento com esses agentes leva ao relaxamento do músculo liso, e o mecanismo de relaxamento geralmente aceito ocorre por meio de ativação subsequente da adenilato ciclase, com a produção de monofosfato cíclico de adenosina (AMPc), seguida de inibição da via da Rho-quinase.77,78 No entanto, evidências também indicam que o AMPc elevado também ativa a proteína quinase A, que por sua vez ativa canais de K+ de grande condutância dependentes de cálcio (BK). A ativação desses canais BK leva à hiperpolarização do músculo liso da bexiga e ao aumento da estabilidade do detrusor.79 O mirabegron é aprovado para o tratamento de OAB em adultos e crianças nos EUA e na Europa.
Outros medicamentos
A imipramina é um antidepressivo tricíclico que afeta tanto os receptores muscarínicos quanto os adrenérgicos α, com um possível efeito central sobre os reflexos de micção.80 Quando a imipramina foi introduzida para tratar a depressão, verificou-se que tinha efeitos marcantes sobre a incontinência urinária dos pacientes. Observamos que a imipramina é um agente eficaz no controle da incontinência de urgência em algumas crianças que anteriormente se mostraram refratárias à terapia antimuscarínica.81 Os efeitos da imipramina sobre a incontinência urinária podem ser o resultado de um efeito nas áreas frontais do cérebro, que estão envolvidas nas funções executivas, incluindo o controle da urgência urinária. Alternativamente, os efeitos urológicos da imipramina podem refletir um efeito sobre os níveis de dopamina no corpo estriado, afetando assim os níveis de ácido ɣ-aminobutírico (GABA) na PAG. O aumento dos níveis de GABA na PAG confere supressão do reflexo de micção.82,83
A imipramina também tem se mostrado útil no tratamento de nossos pacientes com incontinência do riso. A imipramina pode causar hipotensão postural e também pode ser perigosa em pacientes com anormalidades da condução cardíaca, devendo ser usada com cautela.
ISRS e IRSN
Foi demonstrado que os inibidores seletivos da recaptação de serotonina (ISRS) atuam no núcleo de Onuf, modulando os reflexos de micção e de armazenamento, os quais são dependentes do glutamato. Na presença de glutamato, os ISRS aumentam os efeitos dos sinais aferentes para o armazenamento vesical e também aumentam a descarga eferente para o esfíncter uretral externo, mantendo assim a contração desse esfíncter. Na ausência de glutamato, os ISRS não têm efeito sobre a sinalização, e a ativação parassimpática normal resulta em contração da bexiga e relaxamento do esfíncter.84 Esse efeito dos ISRS no lado de armazenamento do arco reflexo pode explicar como a hiperatividade vesical de alguns pacientes melhora após o tratamento com ISRS. Esses agentes também podem estar atuando em regiões cerebrais associadas ao processamento dos sinais de urgência, tais como o ACG e o PFC.
Estimulação Elétrica
Neuroestimulação sacral
Neuroestimulação sacral (também conhecida como neuromodulação sacral) envolve o posicionamento de um eletrodo nos forames S3 e ao longo do nervo sacral, com implante subcutâneo de um estimulador para fornecer estimulação contínua de baixa intensidade do nervo. A estimulação da medula espinhal é frequentemente utilizada em pacientes adultos, e o interesse no uso dessa abordagem em crianças está aumentando. Em uma série de 20 pacientes com síndrome de eliminação disfuncional monitorados prospectivamente, descrita por Roth et al, ocorreu cessação dos sintomas ou uma melhora >50% dos sintomas em 88% das crianças, das quais 63% tinham enurese noturna, 89% tinham aumento da frequência urinária diurna e 59% tinham constipação. Esse grupo agora tem experiência com neuroestimulação sacral em 187 pacientes, com desfechos consistentes.85,86
Estimulação Parasacral com Estimulação Elétrica Nervosa Transcutânea
A estimulação parassacral envolve o uso de um dispositivo de TENS e almofadas condutoras parassacrais, que são posicionadas de forma parassacral na região S2–3, enquanto os eletrodos são conectados na superfície a um gerador de corrente. Estudos utilizaram estimulação em diversas frequências, variando de 10–80 Hz, e a frequência de tratamento variou de semanal a diária. As durações de estimulação também variaram de 20 minutos até 1 hora por dia. Walsh et al descreveram pela primeira vez o uso de TENS em adultos em 1999, seguido por Hoebeke et al em 2001, que descreveram o uso em crianças.87,88 Em estudos subsequentes, a resolução completa dos sintomas variou de 47–61.9% das crianças tratadas com esta modalidade.89,90,91 Esta modalidade também se mostrou útil para estimular a motilidade intestinal utilizando corrente interferencial cruzada.92
Estimulação periférica do nervo tibial
Estimulação elétrica percutânea do nervo tibial (PTNS) baseia-se na prática tradicional chinesa de usar pontos de acupuntura sobre os nervos fibular comum e tibial posterior para inibir a atividade vesical.87,88 Uma técnica envolve o uso de uma agulha de aço inoxidável calibre 34, que é inserida aproximadamente 5 cm cefálicos ao maléolo medial, logo posterior à margem da tíbia. Um eletrodo adesivo é colocado na superfície medial do calcâneo. Essa abordagem foi avaliada em ensaios clínicos com resultados variáveis. Hoebeke et al relataram que 17 de 28 crianças cujos sintomas de OAB eram refratários ao tratamento medicamentoso tiveram resolução ou melhora de seus sintomas em resposta a sessões semanais de 30 minutos de PTNS.91 DeGennaro et al informaram, após acompanhamento de longo prazo, que 12 de 14 crianças com OAB e 14 de 14 com micção disfuncional estavam assintomáticas após dois anos.88 Os autores observaram que o uso ‘crônico’ e persistente de PTNS a longo prazo foi necessário em 50% e 29% das crianças com OAB e micção disfuncional, respectivamente, para manter esses resultados. Em um estudo que comparou a eficácia da TENS aplicada à região parassacral com a da PTNS em crianças com OAB, observaram-se desfechos significativamente melhores com o uso de TENS em comparação com PTNS (resolução completa observada em 70% versus 9% dos pacientes, respectivamente; P = 0.02).93 Figura 5 mostra tal dispositivo.
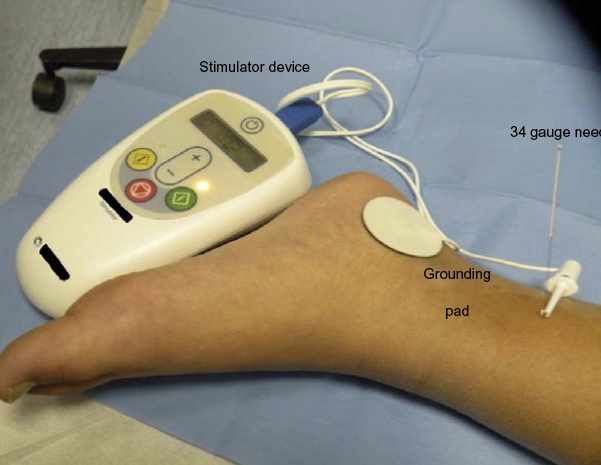
Figura 5 Estimulação por PTNS em uma criança.
Outra forma de estimulação do nervo tibial é aplicar eletrodos adesivos sobre o nervo e estimulá-lo como no TENS parassacral. Em um estudo que comparou a estimulação tibial posterior transcutânea com estimulação simulada em 40 crianças, os escores de QoL e os escores DVISS globais e diurnos diminuíram significativamente em ambos os grupos, simulado e de teste (p < 0.05). Além disso, a frequência de episódios de incontinência e de urgência também foi significativamente reduzida (p < 0.05) no grupo tratado com PTNS. Esse efeito no grupo de teste ainda era observado 2 anos após a intervenção.94
Opções Cirúrgicas
Toxina botulínica A
Injeções intravesicais de toxina botulínica A (BoNT-A) no detrusor foram aprovadas para uso em adultos com OAB. Um estudo recente publicado por Austin et al em pacientes neurogênicos demonstrou a segurança da BoNT-A em crianças e resultou na aprovação pela FDA em crianças com NDO.95 Em adultos, as injeções de BoNT-A mostraram ser um tratamento útil para pacientes com OAB refratária e oferecem uma alternativa para pacientes que não toleram terapia anticolinérgica. Há poucos estudos publicados sobre o uso de BoNT-A em crianças, consistindo principalmente de coortes clínicas selecionadas não randomizadas de crianças neurologicamente saudáveis com OAB refratária ao tratamento e incontinência de urgência.96,97,98 A dose de BoNT-A é variável nesses estudos e varia de 50–200 unidades.96,97,98 Os dados de seguimento desses três estudos, totalizando 55 pacientes, revelam que uma resposta completa, definida por continência total, foi alcançada em 38–70% dessas crianças após uma única ou repetidas injeções. Poucos eventos adversos clinicamente significativos foram relatados; um paciente teve uma ITU e um paciente apresentou retenção urinária temporária.96,97
Biofeedback
O biofeedback é o processo de adquirir maior consciência da ação dos músculos do assoalho pélvico/esfíncter por meio de instrumentos externos que fornecem informações sobre a ação desses músculos, com o objetivo de aumentar a consciência e o controle voluntário por parte da criança.
Na uroterapia específica, o foco costuma estar na reabilitação do assoalho pélvico utilizando treinamento com biofeedback. O benefício teórico do biofeedback é que as crianças são capazes de visualizar diretamente a atividade de seus músculos do assoalho pélvico por meio de EMG ou pela curva de urofluxo.99 Isso facilita a defecação e ajuda a criança a tomar consciência do músculo do assoalho pélvico (contração vs relaxamento). Na micção disfuncional decorrente de dissinergia do esfíncter externo, o objetivo é alcançar uma micção relaxada, sem obstrução, e esvaziamento vesical completo. O feedback pode ser fornecido imediatamente quanto ao desempenho, como com a EMG ou a ultrassonografia, ou como conhecimento dos resultados, como com a urofluxometria e a medição do resíduo pós-miccional.100
O biofeedback da EMG pode ser usado para ensinar a criança a contrair e relaxar os músculos do assoalho pélvico voluntariamente.99 O uso de urofluxometria em tempo real ajuda a criança a observar a curva de fluxo durante a micção. As crianças podem ser ensinadas a urinar com o músculo do assoalho pélvico relaxado e com um volume urinário normal, atingindo uma curva de fluxo contínua, em forma de sino. A ultrassonografia pode ser usada para verificar se a bexiga está vazia após a micção e comunicar isso à criança.
O impacto do biofeedback em indivíduos com micção disfuncional que apresentam refluxo é significativo, pois observamos 60% de resolução espontânea do refluxo em crianças com 6 anos ou mais tratadas com biofeedback.101 Alguns afirmaram que o biofeedback também é eficaz para a urgência; seu mecanismo pode ocorrer por meio da redução da resistência do trato de saída vesical durante a micção, o que leva à hipertrofia do detrusor, resultando assim em instabilidade do detrusor. Por outro lado, há estudos em adultos que indicam que pode ser eficaz em pacientes com OAB devido à terapia contínua individual de um para um recebida pelo paciente e à melhora do bem-estar mental do paciente.102
A terapia de biofeedback é limitada pela capacidade da criança de cooperar com o profissional de saúde que conduz a sessão. Crianças com menos de cinco anos de idade geralmente são incapazes de realizar biofeedback de forma regular. Crianças com deficiências significativas de aprendizagem, problemas de comportamento e outros problemas neurológicos não são candidatas ideais ao biofeedback. Estudos adicionais revelam que a terapia de biofeedback é útil na eliminação do refluxo em crianças que apresentam evidência de dissinergia do esfíncter externo.103,104
É um equívoco acreditar que o biofeedback, por si só, seja suficiente para alcançar a continência. Na prática, os profissionais combinam inadvertidamente o biofeedback com educação e instruções. Ao fazer isso, também promovem modificações comportamentais, enquanto pensam que estão oferecendo apenas treinamento com biofeedback. Na uroterapia, o biofeedback é apenas um dos elementos do tratamento; o tipo de biofeedback não é um fator decisivo no desfecho do tratamento.51
Distúrbios
Bexiga Hiperativa
Avaliação e Diagnóstico
A característica distintiva da OAB é a urgência e, por definição, crianças com esse sintoma podem ser consideradas como tendo OAB. Incontinência e aumento da frequência miccional estão frequentemente presentes. Incontinência de urgência significa simplesmente incontinência na presença de urgência e é aplicável a muitas crianças com OAB. Há evidências crescentes de que a OAB é um problema sensorial; se está localizada no sistema nervoso central (SNC) ou ao nível da bexiga é motivo de debate. Crianças com incontinência não associada a uma urgência súbita de urinar ou que demoram a reconhecer a urgência têm maior probabilidade de apresentar um problema neurológico ou um problema de processamento do lobo frontal, como TDAH.
Opções de Tratamento e Armadilhas
- Uroterapia, programa intestinal
- Evitar diarreia ou acidentes fecais com uso mal controlado ou excessivamente agressivo de agentes osmóticos e catárticos
- Evitar excesso de gases por sobrecarga de fibras; os gases são tão prejudiciais quanto a constipação e resultam em distensão do intestino
- A suplementação de fibras sem água leva à piora da constipação
- Anticolinérgicos ou Terazosina ou Doxazosina
- Boca seca ou problemas de memória podem ser devidos a medicamentos anticolinérgicos. Observar se a constipação piora com anticolinérgicos
- Tontura e fadiga devido aos bloqueadores alfa podem ser prevenidas garantindo que os pacientes se hidratem e aumentem a ingestão de sal.
- Avaliar problemas neuropsiquiátricos e tratar conforme apropriado
- ISRS podem estar associados a irritabilidade e a pensamentos suicidas
- Simpaticomiméticos para TDAH podem levar a estreitamento do colo vesical e a potenciais efeitos negativos nas taxas de fluxo e até disúria. Perda de peso e constipação estão associadas aos simpaticomiméticos.
- Considerar PTNS ou TENS
- Algumas crianças têm medo de agulhas e a PTNS não é viável
- Algumas crianças podem reagir de forma exagerada à sensação e não tolerar a terapia
- Se resistente, pode-se considerar imipramina se os tratamentos falharam
- Pode estar associada à irritabilidade e a pensamentos suicidas
- Pode desmascarar transtorno bipolar, especialmente se houver história familiar
- Não administrar o medicamento a pacientes com história familiar de defeitos de condução ou morte súbita cardíaca
- O medicamento deve permanecer sob controle de um adulto o tempo todo
- Se não houver evidência de resíduos elevados, pode-se considerar injeções de Toxina Botulínica A no detrusor
- Pacientes com índices de fluxo abaixo de 0.3 ou resíduos elevados >150 cc não devem receber injeções de Toxina Botulínica A devido à possibilidade de retenção/CIC
- Se tudo mais falhar, pode-se considerar neuromodulação sacral
- Complicações com deslocamento do eletrodo
Micção Disfuncional
Avaliação e Diagnóstico
A criança com esvaziamento disfuncional contrai habitualmente o esfíncter uretral durante a micção. A urofluxometria com EMG é necessária para confirmar a presença de contração do esfíncter durante a micção. Note que o termo descreve disfunção apenas durante a fase de esvaziamento. O termo esvaziamento disfuncional é independente da fase de armazenamento. É perfeitamente possível que uma criança apresente esvaziamento disfuncional e sintomas de armazenamento, como incontinência, urgência ou aumento da frequência, apresentando assim dois problemas que requerem correção.
Opções de Tratamento e Suas Armadilhas
- Uroterapia, programa intestinal
- Evitar diarreia ou acidentes fecais com uso mal controlado ou excessivamente agressivo de agentes osmóticos e catárticos
- Evitar excesso de gás por sobrecarga de fibras; o gás é tão prejudicial quanto a constipação e resulta em distensão do intestino
- Suplementação de fibras sem água leva à piora da constipação
- Problemas comportamentais, como TDAH e ASS
- Mesmo que a criança pareça cooperativa, ainda pode prevalecer uma atitude evitativa em relação ao comportamento miccional correto, deixando de fazer o esforço real necessário para alcançar o resultado.
- Infecções do trato urinário
- Repetir a urofluxometria e confirmar se o problema persiste
- Se a etiologia for dissinergia do esfíncter externo (ESS)
- Biofeedback
- Micções programadas para prevenir micções infrequentes
- Tratar a hiperatividade do detrusor, se presente. Se a hiperatividade não for controlada adequadamente, os pacientes continuarão a ter urgência, o que anulará o biofeedback realizado.
- Se a etiologia for dissinergia do esfíncter interno (ISS)
- Bloqueadores alfa
- Tontura e fadiga decorrentes de bloqueadores alfa podem ser prevenidas assegurando que os pacientes se hidratem bem e aumentem a ingestão de sal.
- Se houver evidência de ESS, tratar com biofeedback
- Manter o regime intestinal
- Tratar a hiperatividade do detrusor, se presente
- Anticolinérgicos ou Terazosina ou Doxazosina
- problemas com boca seca ou problemas de memória podem ser devidos a medicamentos anticolinérgicos. Observar se a constipação piora com os anticolinérgicos.
- Tontura e fadiga decorrentes de bloqueadores alfa podem ser prevenidas assegurando que os pacientes se hidratem bem e aumentem a ingestão de sal.
- Anticolinérgicos ou Terazosina ou Doxazosina
- Bloqueadores alfa
Uretrite bulbar/Uretrorragia
Avaliação e Diagnóstico
A dor associada à micção é comumente observada em pacientes com alguma forma de micção dissinérgica. Em pacientes com uretrite bulbar (síndrome de disúria/uretrorragia), a dor na ponta ou ao longo do corpo do pênis é muito provavelmente devida à micção dissinérgica. A correção do padrão miccional eliminou os sintomas.33 Em meninas, dor vaginal ou uretral também pode indicar um padrão anormal.
Bexiga hipoativa
Avaliação e Diagnóstico
A antiga entidade “lazy bladder” foi substituída pelo termo neutro underactive bladder e é reservada para crianças com baixa frequência miccional e necessidade de aumentar a pressão intra-abdominal para iniciar, manter ou completar a micção (isto é, fazer esforço). As crianças frequentemente apresentam um padrão interrompido na urofluxometria. O diagnóstico formal é confirmado por meio de estudos urodinâmicos que demonstram baixas pressões miccionais. Infelizmente, não há definições formais para pressões miccionais normais em crianças, portanto tendemos a usar as pressões dos adultos.
Opções de tratamento e armadilhas
- As avaliações incluirão uma urofluxometria com EMG do assoalho pélvico e, se possível, um segundo EMG dos músculos abdominais.
- Se o esforço abdominal for evidente com um fluxo fraco e ineficiente (índice de fluxo <0,7) e resíduo pós-miccional elevado, considerar o diagnóstico de UAB.
- Confirmar com urodinâmica
- Iniciar uroterapia
- Considerar bloqueadores alfa para ajudar a abrir o colo vesical e melhorar o esvaziamento
- Até 50% dos pacientes também apresentam OAB e precisam de tratamento da OAB para prevenir incontinência ou ITUs recorrentes
- ISS é comumente observado em pacientes com UAB e o tratamento com bloqueadores alfa é necessário nesses pacientes.
- Considerar CIC se os pacientes tiverem PVR elevado e/ou ITUs recorrentes; alguns têm utilizado neuromodulação sacral, mas com sucesso limitado
Polaquiúria
Avaliação e Diagnóstico
Este termo aplica-se a crianças que urinam frequentemente e em pequenos volumes durante o dia apenas. A frequência miccional diurna é de pelo menos uma vez por hora e os volumes miccionais médios são inferiores a 50% da capacidade vesical estimada (EBC), geralmente muito menores. A incontinência não é um componente habitual ou necessário da condição e o comportamento vesical noturno é normal para a idade da criança. O termo é aplicável a partir da idade de controlo vesical diurno ou dos 3 anos.
Opções de tratamento e armadilhas
- Avaliar o ambiente, frequentemente observado quando houve um evento de vida recente ou há um evento iminente, como o início das aulas, um acampamento ou as férias
- Certificar-se de que não há constipação de início recente nem mudança na dieta
- Iniciar uroterapia, programa intestinal
- Evitar diarreia ou acidentes fecais decorrentes do uso mal controlado ou excessivamente agressivo de agentes osmóticos e catárticos
- Evitar excesso de gases devido à sobrecarga de fibras; os gases são tão prejudiciais quanto a constipação e resultam em distensão intestinal
- Suplementação de fibras sem água leva ao agravamento da constipação
- Considerar anticolinérgicos ou terazosina ou doxazosina
- Boca seca ou problemas de memória podem ser devidos a medicamentos anticolinérgicos. Atentar para piora da constipação com anticolinérgicos
- Tontura e fadiga devidas aos bloqueadores alfa podem ser prevenidas garantindo boa hidratação e aumento da ingestão de sal.
- Avaliar problemas neuropsiquiátricos; se presentes, considerar tratamento conforme apropriado
- ISRS podem estar associados à irritabilidade e a pensamentos suicidas
- Simpaticomiméticos para TDAH podem levar a estreitamento do colo vesical e possíveis efeitos negativos nas taxas de fluxo e até disúria. Perda de peso e constipação estão associadas aos simpaticomiméticos.
- Pode resolver-se espontaneamente
Incontinência por riso
Avaliação e Diagnóstico
A incontinência ao riso está associada ao esvaziamento vesical completo que ocorre especificamente durante ou imediatamente após o riso. A função vesical é normal quando a criança não está rindo. A incontinência ao riso é claramente diferente da incontinência de esforço, na qual a micção pode ser evitada ou interrompida voluntariamente.
Opções de tratamento e armadilhas
- Confirmar o diagnóstico com uma boa anamnese
- Comumente visto em crianças com transtornos neuropsiquiátricos subjacentes
- Uroterapia e regime intestinal para garantir que isso não seja OAB simples
- Se não houver resposta, então iniciar terapia
- Imipramina: iniciar dose em 10 mg e aumentar até o máximo de 75 mg
- Atomoxetina: iniciar dose em 10 mg e aumentar conforme necessário
- Simpaticomiméticos: a dosagem depende do medicamento escolhido; deve ser a versão de ação prolongada, caso contrário o paciente corre risco de acidentes quando o efeito do medicamento passar
- ISRS: a dosagem depende do medicamento, escolha a menor dose e aumente gradualmente.
- Todos os itens acima apresentam os mesmos problemas
- podem estar associados à irritabilidade e a pensamentos suicidas
- podem desmascarar transtorno bipolar se houver antecedentes familiares
- não administrar o medicamento a pacientes com antecedentes familiares de defeitos de condução ou morte cardíaca súbita
- O medicamento deve estar sob o controle de um adulto o tempo todo
Micção vaginal
Avaliação e Diagnóstico
Meninas pré-púberes já treinadas para o toalete que molham a roupa íntima em até 10 minutos após a micção provavelmente apresentam refluxo vaginal se não houver mecanismo subjacente evidente além da retenção vaginal de urina. A micção vaginal não está associada a outros sintomas do trato urinário inferior. É essencial diferenciar a micção vaginal do gotejamento pós-miccional, pois o tratamento é bastante diferente.
Opções de Tratamento e Armadilhas
- Confirmar o diagnóstico e diferenciar do gotejamento pós-miccional, incontinência por esforço e incontinência de urgência
- Comumente observado em meninas mais novas que não puxam a roupa abaixo dos joelhos
- Comumente observado em meninas com gordura proeminente nos grandes lábios
- Comumente observado em meninas que são obesas
- Recomendar que as pacientes se sentem no vaso sanitário com as pernas afastadas e as coxas separadas ou que se sentem de frente para a parede atrás do vaso, o que força as pernas a ficarem afastadas
- Frequentemente está associado a corrimento vaginal e vaginite
- Pode estar associado a líquen escleroso dos lábios genitais
Incontinência de esforço
Avaliação e Diagnóstico
A incontinência de esforço é a perda de pequenas quantidades de urina ao esforço ou com aumento da pressão intra-abdominal, tipicamente associada à manobra de Valsalva. É rara em crianças neurologicamente normais. Há uma maior associação com meninas hiperflexíveis envolvidas em ginástica e dança.105
Opções de Tratamento e Armadilhas
- Confirmar o diagnóstico e diferenciar de gotejamento pós-miccional, incontinência de esforço e de urgência
- Correção cirúrgica com Burch aberto ou laparoscópico106,107
Pontos-chave
Conclusões
asdf
Referências
- Ruarte AC, E Q. Urodynamic Evaluation in Normal Children. J Urol 1987; 127 (4): 831–831. DOI: 10.1016/s0022-5347(17)54062-8.
- Landgraf JM, Abidari J, Cilento BG, Cooper CS, Schulman SL, Ortenberg J. Coping, Commitment, and Attitude: Quantifying the Everyday Burden of Enuresis on Children and Their Families. Pediatrics 2004; 113 (2): 334–344. DOI: 10.1542/peds.113.2.334.
- Rovner ES. Childhood Urinary Symptoms Predict Adult Overactive Bladder Symptoms. Yearbook of Urology 2006; 2007: 65–66. DOI: 10.1016/s0084-4071(08)70046-0.
- Minassian VA, Lovatsis D, Pascali D, Alarab M, Drutz HP. The Effect of Childhood Dysfunctional Voiding on Urinary Incontinence in Adult Women. Obstet Gynecol 2006; 107 (Supplement): 47s. DOI: 10.1097/00006250-200604001-00112.
- Labrie J, Jong TPVM de, Nieuwhof-Leppink A, Deure J van der, Vijverberg MAW, Vaart CH van der. The Relationship Between Children With Voiding Problems and Their Parents. J Urol 2010; 183 (5): 1887–1891. DOI: 10.1016/j.juro.2010.01.004.
- Wennberg A-L, Altman D, Lundholm C, Klint Å, Iliadou A, Peeker R, et al.. Genetic Influences Are Important for Most But Not All Lower Urinary Tract Symptoms: A Population-Based Survey in a Cohort of Adult Swedish Twins. Eur Urol 2011; 59 (6): 1032–1038. DOI: 10.1016/j.eururo.2011.03.007.
- Kaplan SA. Re: Systematic Review and Meta-Analysis of Candidate Gene Association Studies of Lower Urinary Tract Symptoms in Men. J Urol 2014; 195 (6): 1839–1840. DOI: 10.1016/j.juro.2016.03.051.
- Botlero R, Bell RJ, Urquhart DM, Davis SR. Urinary incontinence is associated with lower psychological general well-being in community-dwelling women. Menopause 2010; 17 (2): 332–337. DOI: 10.1097/gme.0b013e3181ba571a.
- Melville JL, Fan M-Y, Rau H, Nygaard IE, Katon WJ. Major depression and urinary incontinence in women: temporal associations in an epidemiologic sample. Am J Obstet Gynecol 2009; 201 (5): 490.e1–490.e7. DOI: 10.1016/j.ajog.2009.05.047.
- Henin A, Biederman J, Mick E, Hirshfeld-Becker DR, Sachs GS, Wu Y, et al.. Childhood antecedent disorders to bipolar disorder in adults: A controlled study. J Affect Disord 2007; 99 (1-3): 51–57. DOI: 10.1016/j.jad.2006.09.001.
- Weissman MM, Gross R, Fyer A, Heiman GA, Gameroff MJ, Hodge SE, et al.. Interstitial Cystitis and Panic Disorder. Arch Gen Psychiatry 2004; 61 (3): 273. DOI: 10.1001/archpsyc.61.3.273.
- Stockman JA. Enuresis as a premorbid developmental marker of schizophrenia. Yearbook of Pediatrics 2008; 2010: 396–398. DOI: 10.1016/s0084-3954(09)79524-7.
- Fowler CJ, Griffiths DJ. A decade of functional brain imaging applied to bladder control. Neurourol Urodyn 2010; 29 (1): 49–55. DOI: 10.1002/nau.20740.
- Fowler CJ, Griffiths D, Groat WC de. The neural control of micturition. Nat Rev Neurosci 2008; 9 (6): 453–466. DOI: 10.1038/nrn2401.
- Hansen A, Hansen B, Dahm TL. Urinary tract infection, day wetting and other voiding symptoms in seven-to eight-year-old Danish children. Acta Paediatr 1997; 86 (12): 1345–1349. DOI: 10.1111/j.1651-2227.1997.tb14911.x.
- Hellström A-L, Hanson E, Hansson S, Hjälmås K, Jodal U. Micturition habits and incontinence in 7-year-old Swedish school entrants. Eur J Pediatr 1990; 149 (6): 434–437. DOI: 10.1007/bf02009667.
- Lee SD, Sohn DW, Lee JZ, Park NC, Chung MK. An epidemiological study of enuresis in Korean children. BJU Int 2000; 85 (7): 869–873. DOI: 10.1046/j.1464-410x.2000.00617.x.
- Safarinejad MR. Prevalence of nocturnal enuresis, risk factors, associated familial factors and urinary pathology among school children in Iran. J Pediatr Urol 2007; 3 (6): 443–452. DOI: 10.1016/j.jpurol.2007.06.001.
- Wekke J Spee-van der, Hirasing RA, Meulmeester JF, Radder JJ. Childhood Nocturnal Enuresis in the Netherlands. Urology 1998; 51 (6): 1022–1026. DOI: 10.1016/s0090-4295(98)00106-x.
- Swithinbank LV, Brookes ST, Shepherd AM, Abrams P. The natural history of urinary symptoms during adolescence. BJU Int 1998; 81 (s3): 90–93. DOI: 10.1046/j.1464-410x.1998.00016.x.
- Deshpande AV, Craig JC, Smith GHH, Caldwell PHY. Management of daytime urinary incontinence and lower urinary tract symptoms in children. J Paediatr Child Health 2003; 48 (2): E44–e52. DOI: 10.1111/j.1440-1754.2011.02216.x.
- Heron J, Joinson C, Croudace T, Gontard A von. Trajectories of Daytime Wetting and Soiling in a United Kingdom 4 to 9-Year-Old Population Birth Cohort Study. J Urol 2008; 179 (5): 1970–1975. DOI: 10.1016/j.juro.2008.01.060.
- Stone JJ, Rozzelle CJ, Greenfield SP. Intractable Voiding Dysfunction in Children With Normal Spinal Imaging: Predictors of Failed Conservative Management. Urology 2010; 75 (1): 161–165. DOI: 10.1016/j.urology.2009.06.100.
- Tekgul S, R. N, Hoebeke P, Canning D, Bower W, Gontard A. Incontinence. 2009: 701–792.
- Gontard A, Nevéus T. Management of disorders of bladder and bowel control in childhood. 2006. DOI: 10.1136/adc.2006.110023.
- Gontard A, Hussong J, Yang SS, Chase J, Franco I, Wright A. Neurodevelopmental disorders and incontinence in children and adolescents: Attention-deficit/hyperactivity disorder, autism spectrum disorder, and intellectual disability–A consensus document of the International Children’s Continence Society. Neurourol Urodyn 2021; 41 (1): 102–114. DOI: 10.1002/nau.24798.
- Joinson C, Heron J, Butler U, Gontard A von, Parents the Avon Longitudinal Study of, Team CS. Psychological Differences Between Children With and Without Soiling Problems. Pediatrics 2006; 117 (5): 1575–1584. DOI: 10.1542/peds.2005-1773.
- Joinson C, Heron J, Gontard A von, Butler U, Golding J, Emond A. Early Childhood Risk Factors Associated with Daytime Wetting and Soiling in School-age Children. J Pediatr Psychol 2008; 33 (7): 739–750. DOI: 10.1093/jpepsy/jsn008.
- Sureshkumar P, Jones M, Cumming R, Craig J. A Population Based Study of 2,856 School-Age Children With Urinary Incontinence. J Urol 2009; 181 (2): 808–816. DOI: 10.1016/j.juro.2008.10.044.
- ROBSON WMLANEM, JACKSON HAROLDP, BLACKHURST DAWN, LEUNG ALEXANDERk. C. Enuresis in Children With Attention–Deficit Hyperactivity Disorder. South Med J 1997; 90 (5): 503–505. DOI: 10.1097/00007611-199705000-00007.
- MOORE KATEH, SUTHERST JR. Response to Treatment of Detrusor Instability in Relation to Psychoneurotic Status. Br J Urol 1990; 66 (5): 486–490. DOI: 10.1111/j.1464-410x.1990.tb14993.x.
- WARNE STEPHANIEA, GODLEY MARGARETL, WILCOX DUNCANT. Surgical Reconstruction Of Cloacal Malformation Can Alter Bladder Function: A Comparative Study With Anorectal Anomalies. J Urol 2381; 172 (6 Part 1): 2377–2381. DOI: 10.1097/01.ju.0000145201.94571.67.
- Coplen DE. Dysfunctional Elimination Syndrome as an Etiology of Idiopathic Urethritis in Childhood. Yearbook of Urology 2005; 2006: 257–258. DOI: 10.1016/s0084-4071(08)70411-1.
- Pezzone MA, Liang R, Fraser MO. A Model of Neural Cross-Talk and Irritation in the Pelvis: Implications for the Overlap of Chronic Pelvic Pain Disorders. Gastroenterology 2005; 128 (7): 1953–1964. DOI: 10.1053/j.gastro.2005.03.008.
- Ustinova EE, Fraser MO, Pezzone MA. Colonic irritation in the rat sensitizes urinary bladder afferents to mechanical and chemical stimuli: an afferent origin of pelvic organ cross-sensitization. Am J Physiol Renal Physiol 2006; 290 (6): F1478–f1487. DOI: 10.1152/ajprenal.00395.2005.
- Franco I, Grantham EC, Cubillos J, Franco J, Collett-Gardere T, Zelkovic P. Can a simple question predict prolonged uroflow lag times in children? J Pediatr Urol 2016; 12 (3): 157.e1–157.e8. DOI: 10.1016/j.jpurol.2015.12.009.
- Lewis SJ, Heaton KW. Stool Form Scale as a Useful Guide to Intestinal Transit Time. Scand J Gastroenterol 1997; 32 (9): 920–924. DOI: 10.3109/00365529709011203.
- FARHAT WALID, B??GLI DARIUSJ, CAPOLICCHIO GIANPAOLO, O???REILLY SHEILA, MERGUERIAN PAULA, KHOURY ANTOINE, et al.. The Dysfunctional Voiding Scoring System: Quantitative Standardization Of Dysfunctional Voiding Symptoms In Children. J Urol 2000; 164: 1011–1015. DOI: 10.1097/00005392-200009020-00023.
- Afshar K, Mirbagheri A, Scott H, MacNeily AE. Development of a Symptom Score for Dysfunctional Elimination Syndrome. J Urol 2009; 182 (4s): 1939–1944. DOI: 10.1016/j.juro.2009.03.009.
- Van Hoecke E, Baeyens D, Vanden Bossche H, Hoebeke P, Vande Walle J. Early Detection of Psychological Problems in a Population of Children With Enuresis: Construction and Validation of the Short Screening Instrument for Psychological Problems in Enuresis. J Urol 2007; 178 (6): 2611–2615. DOI: 10.1016/j.juro.2007.08.025.
- Franco I, Shei-Dei Yang S, Chang S-J, Nussenblatt B, Franco JA. A quantitative approach to the interpretation of uroflowmetry in children. Neurourol Urodyn 2016; 35 (7): 836–846. DOI: 10.1002/nau.22813.
- Franco I, Franco JA, Nussenblatt B. Can the idealized voider derived flow indexes be a measure of voiding efficiency and how accurate are they? Neurourol Urodyn 2018; 37 (6): 1913–1924. DOI: 10.1002/nau.23585.
- Franco I, Franco J, Lee YS, Choi EK, Han SW. Can a quantitative means be used to predict flow patterns: Agreement between visual inspection vs. flow index derived flow patterns. J Pediatr Urol 2016; 12 (4): 218.e1–218.e8. DOI: 10.1016/j.jpurol.2016.05.026.
- COMBS ANDREWJ, GRAFSTEIN NEIL, HOROWITZ MARK, GLASSBERG KENNETHI. Primary Bladder Neck Dysfunction In Children And Adolescents I: Pelvic Floor Electromyography Lag Time–a New Noninvasive Method To Screen For And Monitor Therapeutic Response. J Urol 2005; 173 (1): 207–211. DOI: 10.1097/01.ju.0000147269.93699.5a.
- Tuite GF, Thompson DNP, Austin PF, Bauer SB. Evaluation and management of tethered cord syndrome in occult spinal dysraphism: Recommendations from the international children’s continence society. Neurourol Urodyn 2018; 37 (3): 890–903. DOI: 10.1002/nau.23382.
- Coplen DE. The Relevance of Urodynamic Studies for Urge Syndrome and Dysfunctional Voiding: A Multicenter Controlled Trial in Children. Yearbook of Urology 2008; 2009: 83–84. DOI: 10.1016/s0084-4071(09)79276-0.
- Birder LA. Faculty Opinions recommendation of Treatment of daytime urinary incontinence: A standardization document from the International Children’s Continence Society. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2017; 36: 43–50, DOI: 10.3410/f.725854188.793540473.
- Yang S, Chua ME, Bauer S, Wright A, Brandström P, Hoebeke P, et al.. Diagnosis and management of bladder bowel dysfunction in children with urinary tract infections: a position statement from the International Children’s Continence Society. Pediatr Nephrol 2018; 33 (12): 2207–2219. DOI: 10.1007/s00467-017-3799-9.
- Gontard A von, Kuwertz-Bröking E. The Diagnosis and Treatment of Enuresis and Functional Daytime Urinary Incontinence. Dtsch Arztebl Int 2019; 116: 279–285, DOI: 10.3238/arztebl.2019.0279.
- MacNeily AE. Should Psychological Assessment be a Part of Incontinence Management in Children and Adolescents? J Urol 2016; 195 (5): 1327–1328. DOI: 10.1016/j.juro.2016.02.071.
- Nieuwhof-Leppink AJ, Hussong J, Chase J, Larsson J, Renson C, Hoebeke P, et al.. Definitions, indications and practice of urotherapy in children and adolescents: - A standardization document of the International Children’s Continence Society (ICCS). J Pediatr Urol 2021; 17 (2): 172–181. DOI: 10.1016/j.jpurol.2020.11.006.
- Borch L, Hagstroem S, Bower WF, Siggaard Rittig C, Rittig S. Bladder and bowel dysfunction and the resolution of urinary incontinence with successful management of bowel symptoms in children. Acta Paediatr 2013; 102 (5): e215–e220. DOI: 10.1111/apa.12158.
- Hagstroem S, Mahler B, Madsen B, Djurhuus JC, Rittig S. Transcutaneous Electrical Nerve Stimulation for Refractory Daytime Urinary Urge Incontinence. J Urol 2009; 182 (4s): 2072–2078. DOI: 10.1016/j.juro.2009.05.101.
- Niemczyk J, Equit M, Hoffmann L, Gontard A von. Incontinence in children with treated attention-deficit/hyperactivity disorder. J Pediatr Urol 2015; 11 (3): 141.e1–141.e6. DOI: 10.1016/j.jpurol.2015.02.009.
- Schäfer SK, Niemczyk J, Gontard A von, Pospeschill M, Becker N, Equit M. Standard urotherapy as first-line intervention for daytime incontinence: a meta-analysis. Eur Child Adolesc Psychiatry 2018; 27 (8): 949–964. DOI: 10.1007/s00787-017-1051-6.
- Medina-Centeno R. Medications for constipation in 2020. Curr Opin Pediatr 2020; 32 (5): 668–673. DOI: 10.1097/mop.0000000000000938.
- Wald A. Constipation. Jama 2016; 315 (2): 185. DOI: 10.1001/jama.2015.16994.
- Cruz F. Faculty of 1000 evaluation for Randomized, double-blind, placebo-controlled trial of polyethylene glycol (MiraLAX(®)) for urinary urge symptoms. F1000 - Post-Publication Peer Review of the Biomedical Literature 2013; 9: 597–604, DOI: 10.3410/f.717964565.793474432.
- Loening-Baucke V. Urinary Incontinence and Urinary Tract Infection and Their Resolution With Treatment of Chronic Constipation of Childhood. Pediatrics 1997; 100 (2): 228–232. DOI: 10.1542/peds.100.2.228.
- Finney SM, Andersson KE, Gillespie JI, Stewart LH. Faculty Opinions recommendation of Antimuscarinic drugs in detrusor overactivity and the overactive bladder syndrome: motor or sensory actions? Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2006; 98: 503–507, DOI: 10.3410/f.1040721.489750.
- Andersson K-E. Antimuscarinic Mechanisms and the Overactive Detrusor: An Update. Eur Urol 2011; 59 (3): 377–386. DOI: 10.1016/j.eururo.2010.11.040.
- Wein AJ, Rackley RR. Overactive Bladder: A Better Understanding of Pathophysiology, Diagnosis and Management. J Urol 2006; 175 (3s): 5–10, DOI: 10.1016/s0022-5347(05)00313-7.
- Kullmann FA, Artim DE, Birder LA, Groat WC de. Activation of Muscarinic Receptors in Rat Bladder Sensory Pathways Alters Reflex Bladder Activity. J Neurosci 2008; 28 (8): 1977–1987. DOI: 10.1523/jneurosci.4694-07.2008.
- Andersson K. Step-by-Step Guide to Treatment of Overactive Bladder (OAB)/Detrusor Overactivity. Urogynecology: Evidence-Based Clinical Practice 2004; 2: 77–91. DOI: 10.1007/1-84628-165-2_7.
- Ferrara P, D’Aleo CM, Tarquini E, Salvatore S, Salvaggio E. Side-effects of oral or intravesical oxybutynin chloride in children with spina bifida. BJU Int 2001; 87 (7): 674–678. DOI: 10.1046/j.1464-410x.2001.02152.x.
- SOMMER BARBARAR, O’HARA RUTH, ASKARI NUSHA, KRAEMER HELENAC, KENNEDY WILLIAMA. The Effect Of Oxybutynin Treatment On Cognition In Children With Diurnal Incontinence. J Urol 2AD; 173 (6): 2125–2127. DOI: 10.1097/01.ju.0000157685.83573.79.
- Giramonti KM, Kogan BA, Halpern LF. The effects of anticholinergic drugs on attention span and short-term memory skills in children. Neurourol Urodyn 2008; 27 (4): 315–318. DOI: 10.1002/nau.20507.
- Todorova A, Vonderheid-Guth B, Dimpfel W. Effects of Tolterodine, Trospium Chloride, and Oxybutynin on the Central Nervous System. J Clin Pharmacol 2001; 41 (6): 636–644. DOI: 10.1177/00912700122010528.
- GUPTA S, SATHYAN G, LINDEMULDER E, HO P, SHEINER L, AARONS L. Quantitative characterization of therapeutic index: Application of mixed-effects modeling to evaluate oxybutynin dose–efficacy and dose–side effect relationships. Clin Pharmacol Ther 1999; 65 (6): 672–684. DOI: 10.1016/s0009-9236(99)90089-9.
- AUSTIN PAULF, HOMSY YVESL, MASEL JONATHANL, CAIN MARKP, CASALE ANTHONYJ, RINK RICHARDC. alpha-ADRENERGIC BLOCKADE IN CHILDREN WITH NEUROPATHIC AND NONNEUROPATHIC VOIDING DYSFUNCTION. J Urol 1999; 162: 1064–1067. DOI: 10.1097/00005392-199909000-00029.
- Franco I, S. C, Collett T, Reda E. Unknown. American Academy of Pediatrics Meeting. San Francisco, CA: 2007.
- Dellis AE, Keeley FX, Manolas V, Skolarikos AA. Role of \ensuremathα-blockers in the Treatment of Stent-related Symptoms: A Prospective Randomized Control Study. Urology 2014; 83 (1): 56–62. DOI: 10.1016/j.urology.2013.08.067.
- Lepor H, Kaplan SA, Klimberg I, Mobley DF, Fawzy A, Gaffney M, et al.. Doxazosin for Benign Prostatic Hyperplasia: Long-term Efficacy and Safety in Hypertensive and Normotensive Patients. J Urol 1997; 157 (2): 525–530. DOI: 10.1016/s0022-5347(01)65193-0.
- Chakraborty S, Feuerhak K, Muthyala A, Harmsen WS, Bailey KR, Bharucha AE. Effects of Alfuzosin, an \ensuremathα1-Adrenergic Antagonist, on Anal Pressures and Bowel Habits in Women With and Without Defecatory Disorders. Clin Gastroenterol Hepatol 2019; 17 (6): 1138–1147.e3. DOI: 10.1016/j.cgh.2018.08.036.
- VanderBrink BA, Gitlin J, Toro S, Palmer LS. Effect of Tamsulosin on Systemic Blood Pressure and Nonneurogenic Dysfunctional Voiding in Children. J Urol 2009; 181 (2): 817–822. DOI: 10.1016/j.juro.2008.10.045.
- Andersson K. Ch. 8. Incontinence 2009.
- Uchida H, Shishido K, Nomiya M, Yamaguchi O. Involvement of cyclic AMP-dependent and -independent mechanisms in the relaxation of rat detrusor muscle via \ensuremathβ-adrenoceptors. Eur J Pharmacol 2005; 518 (2-3): 195–202. DOI: 10.1016/j.ejphar.2005.06.029.
- Frazier EP, Mathy M-J, Peters SLM, Michel MC. Does Cyclic AMP Mediate Rat Urinary Bladder Relaxation by Isoproterenol? J Pharmacol Exp Ther 2005; 313 (1): 260–267. DOI: 10.1124/jpet.104.077768.
- Kobayashi H, Adachi-Akahane S, Nagao T. Involvement of BKCa channels in the relaxation of detrusor muscle via \ensuremathβ-adrenoceptors. Eur J Pharmacol 2000; 404 (1-2): 231–238. DOI: 10.1016/s0014-2999(00)00606-3.
- Hunsballe JM, Djurhuus JC. Clinical options for imipramine in the management of urinary incontinence. Urol Res 2001; 29 (2): 118–125. DOI: 10.1007/s002400100175.
- Franco I, Arlen AM, Collett-Gardere T, Zelkovic PF. Imipramine for refractory daytime incontinence in the pediatric population. J Pediatr Urol 2018; 14 (1): 58.e1–58.e5. DOI: 10.1016/j.jpurol.2017.08.016.
- Groat WC de, Griffiths D, Yoshimura N. Neural Control of the Lower Urinary Tract. Compr Physiol 2015; 5: 327–396. DOI: 10.1002/cphy.c130056.
- Numata A, Iwata T, Iuchi H, Taniguchi N, Kita M, Wada N, et al.. Micturition-suppressing region in the periaqueductal gray of the mesencephalon of the cat. Am J Physiol Regul Integr Comp Physiol 2008; 294 (6): R1996–r2000. DOI: 10.1152/ajpregu.00393.2006.
- Schuessler B. What do we know about duloxetine’s mode of action? Evidence from animals to humans. Bjog 2006; 113: 5–9. DOI: 10.1111/j.1471-0528.2006.00877.x.
- Roth TJ, Vandersteen DR, Hollatz P, Inman BA, Reinberg YE. Sacral Neuromodulation for the Dysfunctional Elimination Syndrome: A 10-Year Single-center Experience With 105 Consecutive Children. Urology 2008; 84 (4): 911–918. DOI: 10.1016/j.urology.2014.03.059.
- Boswell TC, Hollatz P, Hutcheson JC, Vandersteen DR, Reinberg YE. Device outcomes in pediatric sacral neuromodulation: A single center series of 187 patients. J Pediatr Urol 2021; 17 (1): 72.e1–72.e7. DOI: 10.1016/j.jpurol.2020.10.010.
- BOWER WF, MOORE KH, ADAMS RD. A Pilot Study Of The Home Application Of Transcutaneous Neuromodulation In Children With Urgency Or Urge Incontinence. J Urol 2001; 166: 2420–2422. DOI: 10.1097/00005392-200112000-00112.
- Lordelo P, Teles A, Veiga ML, Correia LC, Barroso U Jr. Faculty Opinions recommendation of Transcutaneous electrical nerve stimulation in children with overactive bladder: a randomized clinical trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2010; 184: 683–689, DOI: 10.3410/f.4324972.4410069.
- HOEBEKE P, RENSON C, PETILLON L, WALLE JVANDE, DE PAEPE H. Percutaneous Electrical Nerve Stimulation in Children With Therapy Resistant Nonneuropathic Bladder Sphincter Dysfunction: A Pilot Study. J Urol 2002; 168: 2605–2608. DOI: 10.1097/00005392-200212000-00085.
- CHASE JANET, ROBERTSON VALJ, SOUTHWELL BRIDGET, HUTSON JOHN, GIBB SUSIE. Pilot study using transcutaneous electrical stimulation (interferential current) to treat chronic treatment-resistant constipation and soiling in children. J Gastroenterol Hepatol 2005; 20 (7): 1054–1061. DOI: 10.1111/j.1440-1746.2005.03863.x.
- BALKEN MICHAELR van, VERGUNST HENK, BEMELMANS BARTLH. The Use Of Electrical Devices For The Treatment Of Bladder Dysfunction: A Review Of Methods. J Urol 2004; 172 (3): 846–851. DOI: 10.1097/01.ju.0000134418.21959.98.
- Capitanucci ML, Camanni D, Demelas F, Mosiello G, Zaccara A, De Gennaro M. Long-Term Efficacy of Percutaneous Tibial Nerve Stimulation for Different Types of Lower Urinary Tract Dysfunction in Children. J Urol 2009; 182 (4s): 2056–2061. DOI: 10.1016/j.juro.2009.03.007.
- Barroso U, Viterbo W, Bittencourt J, Farias T, Lordêlo P. Posterior Tibial Nerve Stimulation vs Parasacral Transcutaneous Neuromodulation for Overactive Bladder in Children. J Urol 2013; 190 (2): 673–677. DOI: 10.1016/j.juro.2013.02.034.
- Jafarov R, Ceyhan E, Kahraman O, Ceylan T, Dikmen ZG, Tekgul S, et al.. Efficacy of transcutaneous posterior tibial nerve stimulation in children with functional voiding disorders. Neurourol Urodyn 2021; 40 (1): 404–411. DOI: 10.1002/nau.24575.
- Austin PF, Franco I, Dobremez E, Kroll P, Titanji W, Geib T, et al.. OnabotulinumtoxinA for the treatment of neurogenic detrusor overactivity in children. Neurourol Urodyn 2021; 40 (1): 493–501. DOI: 10.1002/nau.24588.
- Hoebeke P, De Caestecker K, Vande Walle J, Dehoorne J, Raes A, Verleyen P, et al.. The Effect of Botulinum-A Toxin in Incontinent Children With Therapy Resistant Overactive Detrusor. J Urol 2006; 176 (1): 328–331. DOI: 10.1016/s0022-5347(06)00301-6.
- Lahdes-Vasama TT, Anttila A, Wahl E, Taskinen S. Urodynamic assessment of children treated with botulinum toxin A injections for urge incontinence: a pilot study. Scand J Urol Nephrol 2011; 45 (6): 397–400. DOI: 10.3109/00365599.2011.590997.
- Marte A, Borrelli M, Sabatino MD, Balzo BD, Prezioso M, Pintozzi L, et al.. Effectiveness of Botulinum-A Toxin for the Treatment of Refractory Overactive Bladder in Children. Eur J Pediatr Surg 2010; 20 (03): 153–157. DOI: 10.1055/s-0029-1246193.
- Chase J, Austin P, Hoebeke P, McKenna P, International Children’s Continence S. The Management of Dysfunctional Voiding in Children: A Report From the Standardisation Committee of the International Children’s Continence Society. J Urol 2010; 183 (4): 1296–1302. DOI: 10.1016/j.juro.2009.12.059.
- Clothier JC, Wright AJ. Dysfunctional voiding: the importance of non-invasive urodynamics in diagnosis and treatment. Pediatr Nephrol 2018; 33 (3): 381–394. DOI: 10.1007/s00467-017-3679-3.
- PALMER LANES, FRANCO ISRAEL, ROTARIO PAUL, REDA EDWARDF, FRIEDMAN STEVENC, KOLLIGIAN MARKE, et al.. Biofeedback Therapy Expedites the Resolution of Reflux In Older Children. J Urol 2002; 168: 1699–1703. DOI: 10.1097/00005392-200210020-00010.
- Resnick NM, Perera S, Tadic S, Organist L, Riley MA, Schaefer W, et al.. What Predicts and what Mediates the response of urge urinary incontinence to biofeedback? Neurourol Urodyn 2013; 32 (5): 408–415. DOI: 10.1002/nau.22347.
- Kibar Y, Demir E, Irkilata C, Ors O, Gok F, Dayanc M. Effect of Biofeedback Treatment on Spinning Top Urethra in Children with Voiding Dysfunction. Urology 2007; 70 (4): 781–784. DOI: 10.1016/j.urology.2007.04.054.
- Kibar Y, Ors O, Demir E, Kalman S, Sakallioglu O, Dayanc M. Results of Biofeedback Treatment on Reflux Resolution Rates in Children with Dysfunctional Voiding and Vesicoureteral Reflux. Urology 2007; 70 (3): 563–566. DOI: 10.1016/j.urology.2007.03.085.
- Bauer SB, Vasquez E, Cendron M, Wakamatsu MM, Chow JS. Pelvic floor laxity: A not so rare but unrecognized form of daytime urinary incontinence in peripubertal and adolescent girls. J Pediatr Urol 2018; 14 (6): 544.e1–544.e7. DOI: 10.1016/j.jpurol.2018.04.030.
- Dobrowolska-Glazar BA, Groen LA, Nieuwhof-Leppink AJ, Klijn AJ, Jong TPVM de, Chrzan R. Open and Laparoscopic Colposuspension in Girls with Refractory Urinary Incontinence. Front Pediatr 2017; 5: 284, DOI: 10.3389/fped.2017.00284.
- Colposuspension in girls: clinical and urodynamic aspects. J Pediatr Urol 2005; 1 (2): 69–74. DOI: 10.1016/j.jpurol.2004.11.011.
Ultima atualização: 2025-09-21 13:35