17: Megauréter
Este capítulo levará aproximadamente 22 minutos para ler.
Introdução
As anomalias congênitas da junção ureterovesical (UVJ) frequentemente se apresentam com um uréter dilatado ou ‘mega’-uréter (Figura 1). Muitos sinônimos para essa condição existem, incluindo hidroureter e megauréter, mas todos representam um uréter com um diâmetro maior que o normal, com ou sem dilatação da pelve renal associada. Smith classificou os megauréteres em quatro categorias, obstrutivos, refluxantes, refluxantes com obstrução e não refluxantes/não obstrutivos, posteriormente subdivididos em primários e secundários por King.1,2 A classificação Pfister-Hendren, estabelecida em 1978, baseou-se no aspecto morfológico: o tipo I envolvia o uréter distal sem hidronefrose associada; o tipo II estendia-se tanto ao uréter quanto à pelve; e o tipo III estava associado a hidroureteronefrose grave e tortuosidade ureteral.3 Megauréteres congênitos são duas vezes mais comuns em indivíduos do sexo masculino, e apresentam uma relação esquerda-direita de 1.8:1.4 Como a anomalia da UVJ com refluxo é discutida em detalhe em outro lugar, o foco deste capítulo serão os megauréteres obstrutivos e os não obstrutivos não refluxantes.
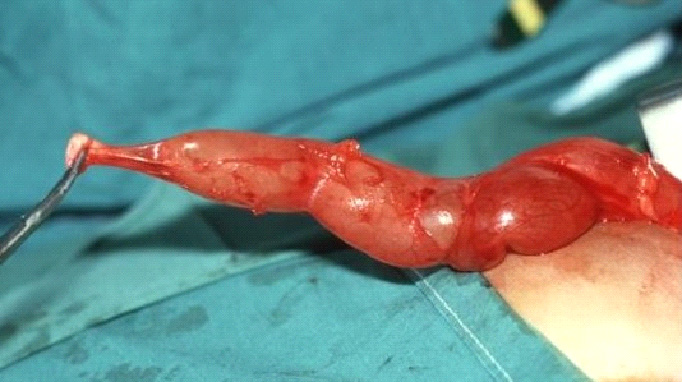
Figura 1 Vista intraoperatória do megauréter (MU) e do segmento justavesical estreitado e aperistáltico (AS).
A definição de ureter dilatado não está bem estabelecida na literatura. Cussen examinou ureteres de fetos com mais de 20 semanas de gestação e de crianças até 12 anos de idade e estabeleceu dimensões ureterais médias para fetos com 30 semanas de gestação e para lactentes e crianças aos 3 meses e aos 3, 6 e 12 anos.5 O limite superior da faixa de diâmetro da porção média do ureter do nascimento aos 12 anos foi de 0,5–0,65 cm; portanto, considerou-se que o limite superior da normalidade se aproximava de 0,7 cm. Hellstrom et al forneceram dados radiológicos do diâmetro ureteral normal em 194 crianças com idades de 0 a 16 anos, e também concluíram que um diâmetro ureteral acima de 7 mm era anormal nesse grupo etário.6
Embriologia e Genética da Junção Ureterovesical
As anomalias da UVJ fazem parte das anomalias congênitas do rim e do trato urinário (CAKUT). O CAKUT inclui um espectro de anomalias que afetam o desenvolvimento do trato urinário, incluindo agenesia renal, displasia ou hipoplasia; obstrução ureteral proximal ou distal (junção ureteropélvica (UPJ) ou obstrução da UVJ); dilatação do ureter (megaureter); refluxo vesicoureteral (VUR) e obstrução uretral (p. ex., devido a válvulas uretrais posteriores ou atresia uretral).7 Embrionariamente, o rim dos mamíferos deriva de dois componentes: o botão ureteral, um epitélio que se ramifica de forma recorrente para formar os ductos coletores, e o mesênquima metanéfrico. O botão ureteral também dá origem ao epitélio da pelve renal e do ureter, conhecido como urotélio.
Até o momento, nosso conhecimento sobre o desenvolvimento ureteral normal limita-se a trabalhos em modelos animais, incluindo camundongos transgênicos com fenótipos renais/ ureterais anormais. Esses estudos sugerem que diversos genes, fatores de transcrição, bem como proteínas secretadas, contribuem para o desenvolvimento ureteral normal e, quando desregulados, manifestam várias formas de CAKUT.8 Um elemento-chave no desenvolvimento ureteral é o eixo do fator neurotrófico derivado da linhagem de células da glia e da tirosina quinase de proteína transmembrana c-ret (GDNF/c-ret).9 O brotamento e a ramificação do broto ureteral dependem da interação entre o GDNF e seu correceptor 1 ancorado em glicosil-fosfaditilinositol (Gfrα1), que se ligam a e ativam o c-ret. O GDNF é expresso predominantemente no mesênquima metanéfrico, na cunha trigonal do ureter distal e no seio urogenital. Em c-ret -/-mutantes, observaram-se agenesia renal, hipodisplasia grave e ureteres de fundo cego; também se verificou que mutantes GDNF -/- e Gfrα1 -/- apresentavam fenótipos semelhantes, sugerindo que o eixo GDNF-c-ret é necessário para a iniciação do broto ureteral e a morfogênese inicial de ramificação.
A expressão de C-ret é dependente de ácido retinoico (um metabólito da vitamina A).9 Batourina et al mostraram que a vitamina A e o proto-oncogene Ret são necessários para a formação de uma conexão adequada entre a bexiga e o ureter.10 Mutantes murinos carentes de Ret ou de Rara e Rarb, dois membros da família dos receptores de retinoides, apresentavam hidronefrose e megaureter, ambos associados a defeitos em estágios precoces da maturação do ureter, quando o remodelamento do “ducto nefrítico comum” (CND—o nome dado por Batourina et al à parte do ducto mesonéfrico proximal à origem do broto ureteral) induz os óstios ureterais a se separarem dos ductos mesonéfricos. Seus estudos sugeriram que a vitamina A e o Ret eram necessários para a expansão do CND em uma estrutura chamada cunha, que eles propuseram ser o provável precursor do trígono.11,12
O momento da diferenciação do músculo liso no ureter distal é desconhecido, mas pode ser a chave para entender por que o VUR ou a obstrução melhoram no período pós-natal. Pirker et al estudaram amostras de bexiga de fetos suínos, leitões recém-nascidos e leitões de 6 meses de idade.13 Eles observaram que, aos 60 dias, o músculo detrusor da bexiga estava bem desenvolvido e inervado, ao passo que o ureter intra e extravesical apenas tinha começado a diferenciar-se. No dia 90, o ureter extravesical estava bem inervado, mas o ureter intravesical só amadureceu após o nascimento. Todos os componentes de músculo liso apresentaram um aumento marcante de massa entre os cortes neonatais e os posteriores. A evolução temporal do desenvolvimento muscular neste estudo correlaciona-se com achados em humanos, nos quais feixes de músculo liso do ureter extramural aparecem pela primeira vez entre as semanas 17 a 22 de gestação, e o desenvolvimento do músculo ureteral prossegue em direção craniocaudal.14 Os autores também notaram que o desenvolvimento da bainha periureteral precede o desenvolvimento do músculo liso ureteral, o que também foi relatado em humanos. A bainha periureteral mostrou considerável desenvolvimento neuromuscular pós-natal. As suas fibras musculares cresceram significativamente e quase formaram uma camada contínua aos 6 meses.13 Tanagho também observou que o ureter distal é a última porção a desenvolver sua camada muscular e que a diferenciação muscular precoce é predominantemente dos músculos circulares. Outros estudos sugeriram possíveis explicações para o desenvolvimento da obstrução da UVJ.15 Estas incluem uma bainha espessa de músculo ao redor da porção distal do ureter, aumento da deposição de fibras de colágeno e neuromodulação desregulada no segmento juxtavesical de megaureteres obstruídos.11,16,17
Diagnóstico pré-natal
A dilatação ureteral está associada à hidronefrose pré-natal em 5–10% dos casos.18 Atualmente, quase 79% dos pacientes com hidroureteronefrose são identificados em ultrassonografia perinatal (USS), com o restante apresentando-se após uma infecção do trato urinário febril (UTI).19 A detecção de um ureter dilatado in útero por ultrassonografia é uma tarefa difícil. O feto pode não estar na posição adequada, ou o ureter pode estar obscurecido por estruturas sobrejacentes ou por gás intestinal materno. Além disso, os técnicos podem não ser treinados para procurar especificamente ureteres dilatados no rastreamento de rotina. Como resultado, a detecção pré-natal de ureteres dilatados provavelmente é pouco confiável. Em um estudo de 101 pacientes com hidroureteronefrose identificada no pós-natal encaminhados ao Great Ormond Street Hospital, apenas 20% tinham um ureter dilatado documentado no período pré-natal. Quarenta e oito (47.5%) lactentes apresentavam VUR ou outra patologia, e 53 (52.5%) eram suspeitos de ter uma obstrução da UVJ.4
Manejo pós-natal
Pacientes com dilatação ureteral superior a 7 mm apresentam risco aumentado de infecção do trato urinário (ITU) e, portanto, recomenda-se profilaxia antibiótica contínua (CAP).20 Um estudo prospectivo multicêntrico recente com 237 pacientes com dilatação ureteral concluiu que pacientes com ureteres de 7 mm ou mais apresentavam quase três vezes o risco de ITU, após ajuste por sexo, status de circuncisão, profilaxia antibiótica e grau de hidronefrose. O risco aumentado também esteve presente em pacientes investigados com cistouretrografia miccional (VCUG) e nos quais não se constatou refluxo vesicoureteral (VUR). A CAP foi significativamente protetora contra ITU.21
Recomenda-se uma ultrassonografia (US) pós-natal entre 48 horas e 4 semanas (consenso UTD), quando a dilatação é unilateral (Figura 2).22 Hidroureteronefrose bilateral deve ser investigada com maior urgência, e a obstrução da saída vesical deve ser excluída antes da alta pós-natal. A presença de ureter(es) dilatado(s) é uma indicação para uma VCUG, a fim de excluir obstrução uretral ou VUR. A presença de VUR confirma um “megaureter refluxante”. É importante assegurar a drenagem do trato urinário superior após o esvaziamento da bexiga na MCUG. Drenagem deficiente na VCUG, especialmente quando há dilatação significativa do trato urinário superior na USS, pode levantar a suspeita de um “megaureter refluxante e obstrutivo”.20
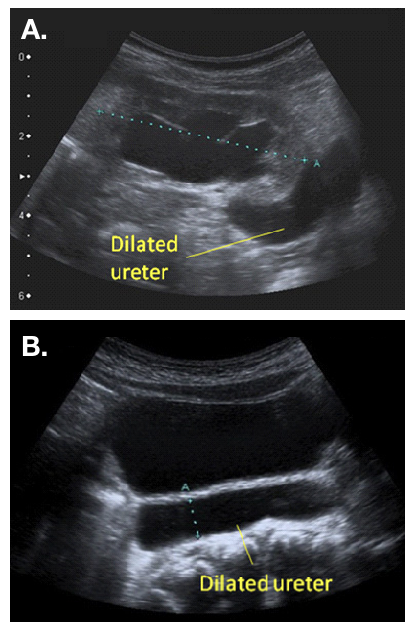
Figura 2 Aspecto ultrassonográfico de um ureter dilatado, visto saindo de uma pelve renal dilatada (a) e visível atrás da bexiga (b)
Na ausência de VUR ou obstrução uretral, um renograma dinâmico, como a renografia diurética com 99mTc-MAG-3, e uma nova ultrassonografia devem ser realizados após 6 semanas de vida. Esses exames ajudarão a diferenciar entre um megauréter ‘obstrutivo’ ou ‘não obstrutivo-não refluxante’. Bebês que se apresentam no pós-natal (por exemplo, com uma ITU) também são investigados de maneira semelhante, embora seja melhor aguardar a recuperação da urosepse antes de realizar uma VCUG ou um renograma MAG-3.20
De acordo com as diretrizes da European Association of Nuclear Medicine (EANM) para renografia padrão e diurética em crianças, a renografia permite estimar dois aspectos da função renal.23 O primeiro aspecto é a depuração renal, ou função renal diferencial (DRF). A estimativa da DRF é melhor realizada entre um e dois minutos após a injeção do traçador. O segundo aspecto é a excreção, ou desaparecimento, do traçador do rim. Tradicionalmente, um atraso importante na excreção é sugerido por uma curva continuamente ascendente e trânsito tardio, isto é, um Tmax (tempo para atingir o máximo, ou pico, da curva) superior a 20 minutos (Figura 3). Contudo, o trânsito tardio pode ser causado pelo aumento de capacidade proporcionado por uma pelve renal e ureter dilatados. Portanto, administra-se furosemida a fim de distinguir entre obstrução e o efeito de um sistema dilatado. Drenagem deficiente também pode ser aparente porque a bexiga está cheia, ou porque o efeito da gravidade sobre a drenagem é incompleto. Por todas essas razões, a interpretação de “impaired drainage” na renografia diurética é controversa.24
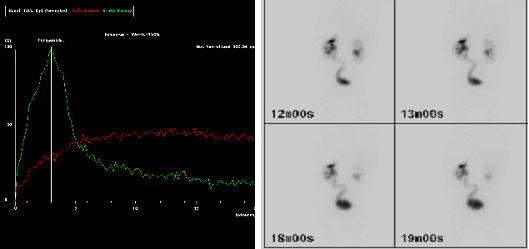
Figura 3 Imagens MAG-3 mostrando drenagem retardada do traçador (curva vermelha) aos 20 minutos (a) e ureter esquerdo (E) visível em imagem tardia (b), sugerindo retenção ao nível da junção ureterovesical (JUV) esquerda.
Deve-se levar em consideração uma combinação de achados clínicos e radiológicos ao classificar um megauréter como “obstruído” ou “não obstruído”. A presença de sintomas, como ITU febril ou dor, é um indicador clínico de possível obstrução. Em pacientes assintomáticos, a presença de DRF abaixo de 40% e/ou dilatação progressiva em ultrassonografias seriadas também são sugestivas de obstrução e constituem indicações para intervenção. Trânsito retardado no MAG-3 na presença de dilatação estável ou em melhora, e DRF acima de 40%, em paciente assintomático, pode ser manejado de forma conservadora.20 Liu et al e McLellan et al sugeriram que crianças com diâmetro ureteral retrovesical maior que 10 mm tinham maior probabilidade de necessitar de intervenção cirúrgica.4,25
É importante estar ciente de que a obstrução ipsilateral da JUP e da JUV pode coexistir. A MAG-3 pré-operatória pode sugerir patologia dupla quando o uréter obstruído preenche-se lentamente e depois não drena. Nesse cenário, um pielograma retrógrado pode ser útil para estabelecer o diagnóstico.26
Manejo
O manejo dos megaureteres primários mudou ao longo dos últimos 30 anos. Em 1989, Peters et al relataram que 89% dos pacientes necessitaram de cirurgia antes dos 8 meses de idade.27 No mesmo ano, Keating et al relataram que, quando a decisão de intervir se baseava na função renal absoluta, até 87% dos pacientes podiam ser acompanhados de forma conservadora.28 Outra publicação da mesma unidade confirmou estabilidade ou melhora no acompanhamento a longo prazo do mesmo grupo de pacientes manejados de forma conservadora.29 Liu et al também sugeriram que a maioria dos megaureteres pode ser acompanhada de forma conservadora, e mostraram que, em um acompanhamento médio de 3.1 anos, 34% dos megaureteres primários apresentaram resolução espontânea. Dos casos restantes, 17% foram submetidos a reimplante devido a infecção de escape ou deterioração da função renal, ao passo que 49% apresentavam dilatação persistente no acompanhamento e continuavam em acompanhamento conservador.4
Megaureteres não obstrutivos e não refluxivos
Megauréteres associados a uma DRF >40% em um paciente assintomático podem ser tratados de forma conservadora. Recomendam-se acompanhamento rigoroso com ultrassonografias seriadas e profilaxia antibiótica, especialmente quando a dilatação ureteral é superior a 7mm21 Song et al mostraram que o risco de infecção do trato urinário é maior com obstrução de UVJ do que de UPJ, e que as infecções do trato urinário tendem a ocorrer nos primeiros seis meses de vida.30 Uma vez observada a melhora da hidronefrose, as consultas de seguimento podem ser reduzidas para semestrais e depois anuais, e a profilaxia antibiótica suspensa. A resolução da hidroureteronefrose pode levar vários anos. McLellan et al mostraram que a hidronefrose havia se resolvido completamente em 72% dos casos em um seguimento mediano de 25.8 meses.25
O acompanhamento de longo prazo é recomendável quando a dilatação é persistente. Um estudo de acompanhamento de longo prazo de Shukla et al relatou deterioração tardia em um menino de 14 anos com megauréteres primários bilaterais, que apresentou aumento da dilatação e deterioração funcional seis anos após ter alta do acompanhamento conservador.31 Hemal et al. 30 relataram o desfecho de 55 pacientes com megauréteres congênitos que se apresentaram pela primeira vez na terceira década de vida, dos quais 20 pacientes foram encontrados com cálculos renais. Cinco pacientes com megauréteres bilaterais estavam em insuficiência renal crônica no momento do diagnóstico, dos quais dois vieram a óbito em decorrência da doença.32 Portanto, a resolução precoce após manejo conservador não é garantia para toda a vida, e o acompanhamento até a idade adulta é recomendável.
Megauréteres obstrutivos
A obstrução é diagnosticada com base em uma DRF reduzida <40% no momento do diagnóstico, ou uma queda da DRF >10% em renografias repetidas em intervalos. A dilatação crescente na USS e os sintomas (ITU/dor) também são sugestivos de obstrução. A escolha da intervenção cirúrgica depende da idade da criança (abaixo ou acima de 1 ano) e da disponibilidade de equipamentos e experiência quando se considera uma opção endoscópica. As opções cirúrgicas incluem:
- Reimplante ureteral (aberto/ laparoscópico ou assistido por robô)
- Colocação temporária de stent JJ
- Dilatação endoscópica com balão ± endoureterotomia
- Ureterocistotomia refluxante
- Ureterostomia cutânea
Reimplante ureteral
O objetivo do reimplante ureteral é excisar o segmento de UVJ estreito e aperistáltico e tunelizar o ureter na bexiga de forma antirrefluxo. O túnel deve ter pelo menos cinco vezes o diâmetro do ureter para ser eficaz, dados baseados em um estudo de Paquin em 1959.33 Para obter essa razão quando o diâmetro do ureter é superior a 10 mm, pode ser necessário afunilar os 10 cm distais do ureter. Também pode ser necessário um psoas hitch para garantir uma entrada retilínea do ureter na bexiga. As duas técnicas mais populares utilizadas para a modelagem de megaureteres são a plicatura, conforme relatado por Starr e Kalicinski et al., e o afunilamento, conforme modificado por Hendren.34,35,36 Kalicinski et al descreveram uma técnica de dobramento na qual a porção lateral, avascular, do ureter foi excluída do lúmen por meio de uma sutura contínua longitudinal e, em seguida, dobrada posteriormente antes do reimplante. Starr modificou esse procedimento, introduzindo múltiplos pontos de Lembert interrompidos que pregueavam a parede ureteral para dentro, preservando assim sua vascularização, mas tornando o reimplante subsequente mais trabalhoso. Hendren recomendou o afunilamento excisional, pelo qual uma faixa longitudinal do ureter redundante é ressecada e o ureter suturado em duas camadas.35,36 Ben-Meir et al compararam os desfechos do reimplante de megaureter com e sem modelagem e mostraram que não houve diferença significativa nos resultados (taxa de sucesso de 94% no grupo com modelagem e de 96% no grupo sem modelagem).37 Um exemplo de reimplante com afunilamento é fornecido em (Figura 4 e Figura 5).
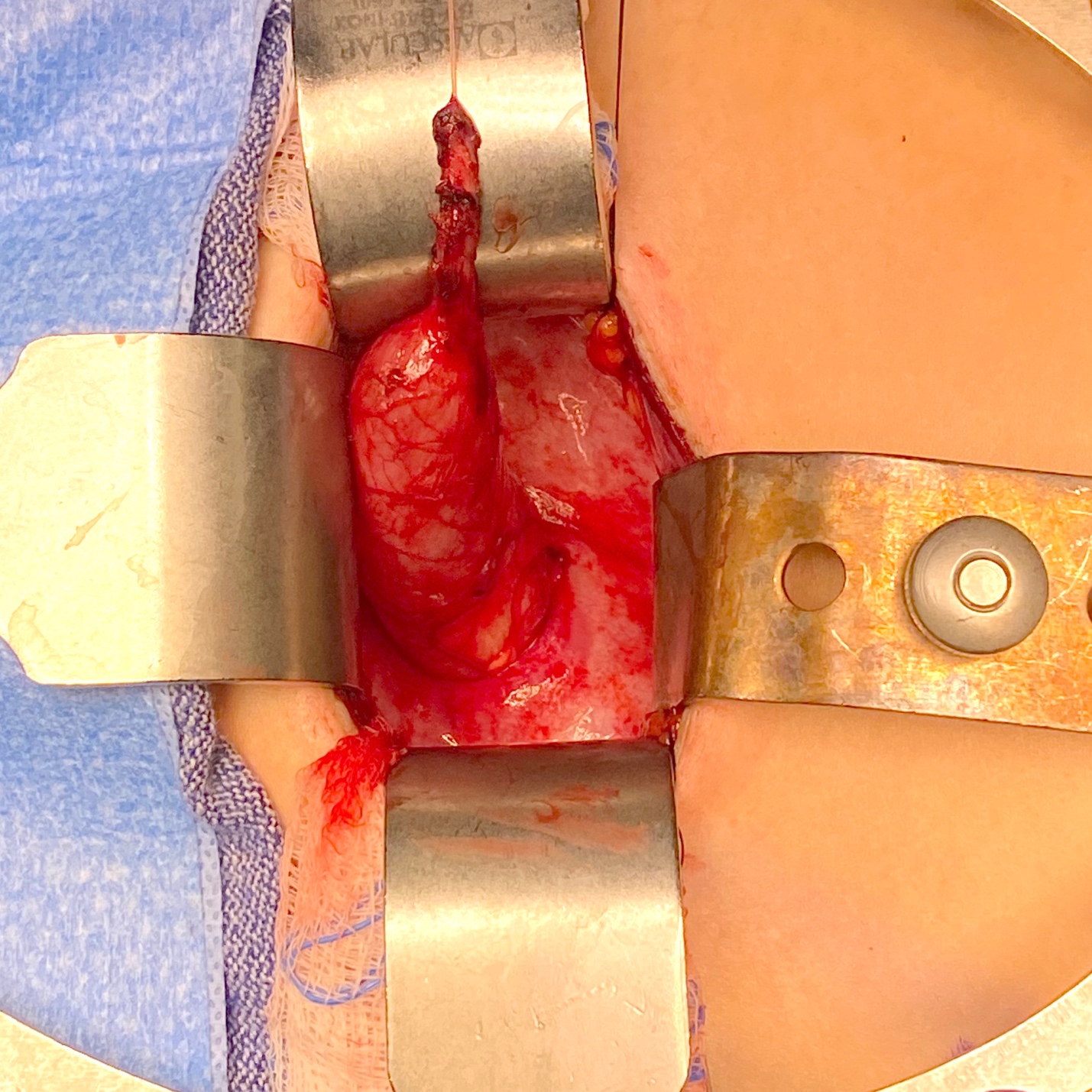
Figura 4 Vista intraoperatória de um megauréter com segmento aperistáltico e dilatação proximal.
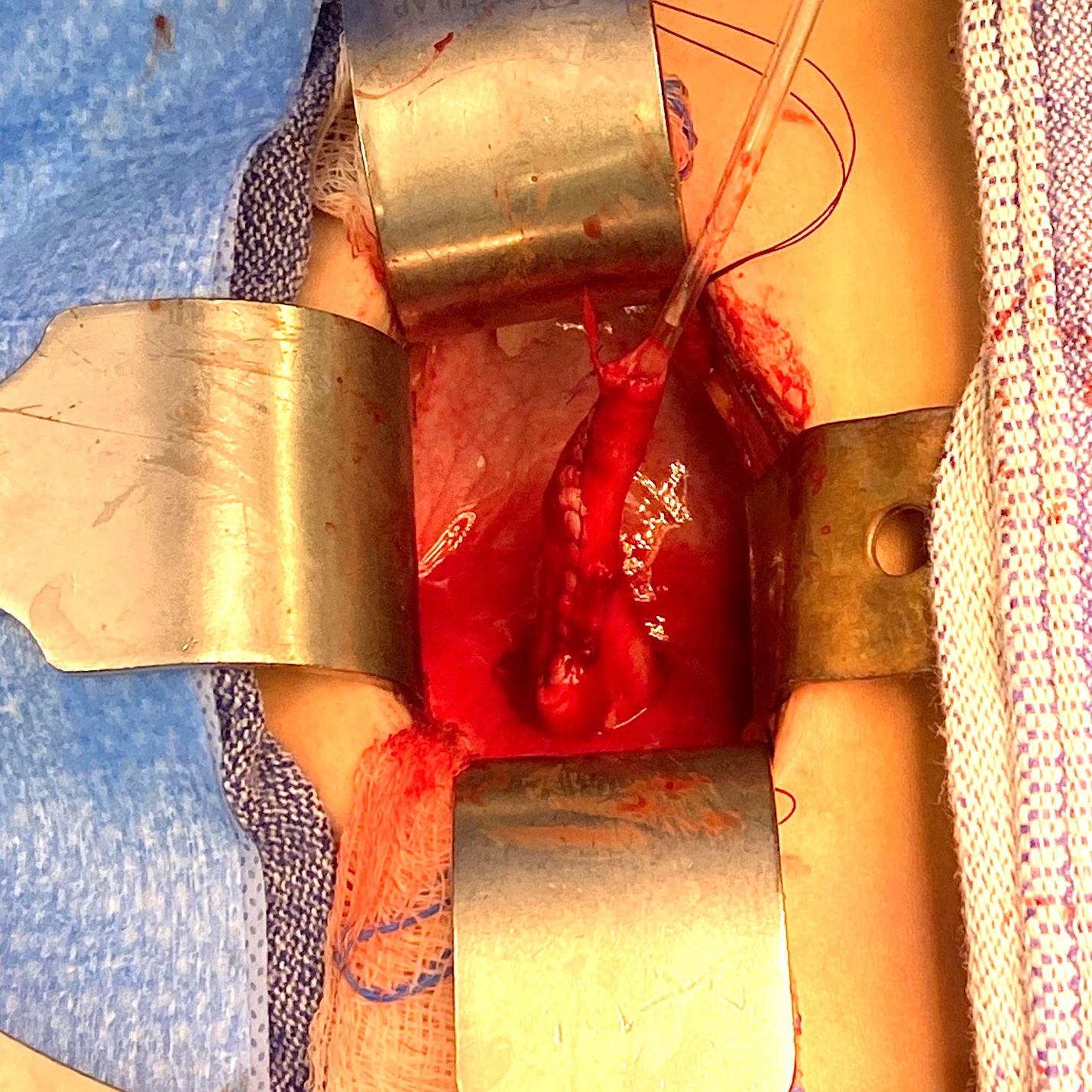
Figura 5 Vista intraoperatória do mesmo uréter da Figura 4 após afunilamento sobre um cateter 10 Fr. Em seguida, foi reimplantado por meio da criação de um túnel trans-trigonal, passando-o através do túnel e fixando-o. Um stent ureteral foi mantido por 2 semanas.
Um reimplante extravesical de Lich–Gregoir é comumente preferido quando são utilizadas técnicas laparoscópicas ou assistidas por robô (RALUR).38,39,40 O ureter dilatado é identificado abaixo dos vasos ilíacos, e o peritônio é dissecado ao longo do ureter até o nível do cruzamento com o ducto deferente. O ureter é mobilizado com dissecção romba para minimizar o risco de lesões nervosas e do suprimento sanguíneo, e então é seccionado ao nível da estenose. O túnel seromuscular é demarcado utilizando eletrocautério em gancho e, em seguida, as fibras do detrusor são seccionadas com tesoura até que a mucosa vesical protrua livremente. A mucosa vesical é aberta na extremidade do túnel e a anastomose ureterovesical é realizada com suturas interrompidas. O ureter é então posicionado no túnel, que é aproximado por suturas contínuas ou interrompidas.
As taxas de resolução do VUR após RALUR extravesical relatadas na literatura variam de 66,7 a 100% em várias séries relativamente pequenas.40 O sucesso geral ao agrupar essas séries é de 91%. Um estudo retrospectivo multi-institucional relatou resolução radiográfica em 87,9% de 280 uréteres. Mais recentemente, um grande estudo prospectivo multi-institucional relatou 93,8% de resolução em 199 uréteres.40 A RALUR pode ser realizada bilateralmente; entretanto, há preocupação de que a dissecção bilateral da parede posterior da bexiga possa comprometer o plexo nervoso pélvico, resultando em taxas mais altas de retenção urinária pós-operatória. A dissecção poupadora de nervos tem sido proposta para reduzir essa complicação. Em 2008, Casale et al relataram uma taxa de sucesso de 97,6% após RALUR bilateral poupadora de nervos em 41 pacientes.41 Não houve complicações nem casos de retenção urinária. Herz et al relataram uma taxa de sucesso de 91,7% para RALUR unilateral, mas uma taxa de sucesso de apenas 77,8% dos uréteres (72,2% das crianças) nos casos bilaterais. Neste estudo, as taxas de complicações (incluindo obstrução ureteral, readmissão e retenção urinária) foram maiores nos casos bilaterais. Não foi utilizada uma técnica poupadora de nervos.42
O reimplante ureteral em lactentes com menos de um ano de idade pode ser desafiador devido à discrepância entre o ureter acentuadamente dilatado e a pequena bexiga infantil, e à preocupação com possível disfunção vesical iatrogênica. De Jong et al investigaram o desfecho funcional vesical de 49 neonatos e lactentes com megaureteres primários obstrutivos ou refluxantes, que foram submetidos ao procedimento de Politano-Leadbetter, com seguimento médio de 7.3 anos.43 Não foi observado início de disfunção miccional no seguimento, e a capacidade vesical para a idade estava significativamente aumentada. Não foi observada obstrução ureteral pós-operatória. O autor concluiu que grandes reconstruções precoces do trato urinário inferior não prejudicam as propriedades urodinâmicas da bexiga e do assoalho pélvico, desde que a cirurgia seja realizada por cirurgiões urológicos pediátricos especializados. Um estudo adicional do mesmo grupo 41 comparou o desfecho urodinâmico em pacientes que foram submetidos a reimplante ureteral antes, ou após, um ano de idade. Não foi encontrada diferença significativa na capacidade vesical, na complacência ou na incidência de instabilidade.44
Colocação temporária de stent JJ
Em 1999, Shenoy e Rance relataram a utilização de stents JJ como medida de temporização em lactentes com megaureteres obstrutivos primários.45 O procedimento envolve a inserção de um stent duplo J, por via endoscópica sempre que possível. Uma obstrução apertada da junção ureterovesical (JUV) pode impedir a inserção endoscópica, caso em que se pode realizar uma inserção aberta por via de uma cistostomia, combinada com dilatação do orifício ureteral utilizando uma sonda lacrimal. Os stents estão licenciados para permanecer in-situ por seis meses; depois desse período, devem ser removidos ou substituídos. O megaureter deve permanecer com stent até que o bebé tenha mais de um ano de idade; nessa altura, pode realizar-se com segurança o reimplante ureteral, se a dilatação não tiver resolvido.45 O bebé deve manter antibioterapia profilática enquanto o stent estiver in-situ, devido ao risco de infeção do stent, e deve ser monitorizado por ecografia para assegurar a descompressão do sistema e verificar a posição do stent.46 Uma ecografia e uma renografia com MAG-3 realizadas três meses após a remoção do stent orientarão a conduta subsequente. Na presença de melhoria da dilatação e da drenagem, e de função preservada, pode não ser necessária qualquer intervenção adicional. Dilatação persistente ou agravada após um período com stent, ou nova infeção, constitui indicação para reimplante ureteral. Um estudo de resultados a longo prazo revelou que, em 56% dos casos, não foi necessária qualquer intervenção adicional após a remoção do stent. No entanto, dois terços dos doentes necessitaram de inserção aberta do stent, e um terço sofreu complicações (migração, formação de cálculos e infeção).47
Dilatação endoscópica com balão
O manejo endoscópico tornou-se aceito como uma opção de tratamento menos invasiva. As vantagens da abordagem endoscópica incluem ser minimamente invasiva, não manipular o suprimento sanguíneo ureteral distal e não exigir cateterização prolongada.48 Além disso, se o manejo endoscópico falhar, a reimplantação ureteral ainda pode ser realizada. Contudo, a possível necessidade de uma segunda anestesia para remoção do stent deve ser considerada nas discussões a respeito dos riscos da abordagem endoscópica. O procedimento é realizado com um cistoscópio rígido pediátrico (8F–10.5F) e um fio-guia flexível é posicionado até a pelve renal. Para dilatação com balão de alta pressão (HPBD), utiliza-se um cateter-balão (geralmente 3F–5F, comprimento do balão de 2–4 cm, diâmetro do balão insuflado de 3–7 mm) para dilatar a junção ureterovesical, seguida da colocação de um stent ureteral duplo J. Para ureterotomia incisional, tanto Kajbafzadeh et al quanto Shirazi e et al realizam incisões na posição de 6 horas.49,50,51
Doudt et al publicaram uma revisão sistemática dos desfechos a longo prazo do manejo endoscópico.48 Onze séries de casos retrospectivas e 1 prospectiva, de uma única instituição, foram analisadas. A idade média no momento da cirurgia foi de 24,6 meses (intervalo 3–84). As tentativas iniciais de manejo endoscópico não foram eficazes em 10,5%, seja por incapacidade de passar o stent endoscopicamente, seja por dificuldade com o avanço do cistoscópio pediátrico pela uretra. As abordagens endoscópicas efetivamente concluídas foram cistoscopia+dilatação com balão de alta pressão (HPBD)+ colocação de stent ureteral duplo J em 49,5%, cistoscopia+ureterotomia incisional+colocação de stent ureteral duplo J em 27,8%, cistoscopia+colocação de stent ureteral duplo J em 18,9% e cistoscopia+HPBD+ ureterotomia incisional+colocação de stent ureteral duplo J em 3,7%. A duração média do stent foi de 2,3 meses (intervalo 0,25–6). Com seguimento médio de 3,2 anos, a taxa de sucesso inicial foi de 76,7%. Retratamento endoscópico foi realizado em 15,1% dos casos, com taxa global de reintervenção cirúrgica de 36,7%. Os autores concluíram que o manejo endoscópico para POM persistente ou progressivo em crianças >12 meses de idade é uma alternativa minimamente invasiva ao reimplante ureteral, com taxas de sucesso modestas. Em lactentes, pode ser melhor utilizado como procedimento de ponte. Aproximadamente um terço dos pacientes requer reintervenção cirúrgica.48
Reimplante Refluxante
Kaefer propôs uma abordagem inovadora para o manejo de megauréteres obstrutivos em lactentes, realizada em duas etapas.52 A primeira etapa corrige a obstrução sem a preocupação de criar um mecanismo antirrefluxo, simplesmente seccionando o uréter proximalmente à obstrução e realizando uma anastomose término-lateral refluxante à bexiga; em seguida, à medida que o tamanho da bexiga aumenta durante a infância, realiza-se a segunda etapa, um reimplante ureteral padrão com afilamento e criação de um mecanismo valvular antirrefluxo.52,53 Alyami et al publicaram sua experiência com a abordagem de reimplante refluxante em 32 pacientes com obstrução ureteral distal diagnosticada no período pré-natal.54 A idade média na cirurgia foi de 3.7 meses (intervalo de 0 a 33) e o seguimento médio foi de 34.3 meses (intervalo de 6 a 58). Também foi realizada circuncisão na maioria dos pacientes do sexo masculino. Dos 32 pacientes, 86% demonstraram melhora significativa da dilatação. Seis pacientes foram submetidos a procedimentos adicionais, incluindo uma circuncisão e 2 reimplantes ureterais por infecções recorrentes. Os autores concluíram que, apesar da contrapartida de aliviar a obstrução ao criar refluxo, este procedimento pode ser considerado uma intervenção potencialmente definitiva em pacientes que permanecem livres de infecção. Acompanhamento rigoroso é fundamental para documentar resultados satisfatórios em longo prazo.54
Ureterostomia Cutânea
A ureterostomia cutânea temporária permanece uma opção segura e eficaz, especialmente na presença de urosepse, ou quando a tecnologia endoscópica não está disponível. Shrestha et al publicaram os resultados de 25 pacientes que se submeteram a uma ureterostomia cutânea terminal (ECU) POM com idade média de 7 meses (intervalo de 23 dias a 2,5 anos). Após a derivação, a insuficiência renal regrediu em todos, e desenvolveu-se infecção do trato urinário febril (ITU) em um enquanto aguardava o reimplante.55 Não foram relatadas complicações do estoma neste estudo, embora outros tenham relatado complicações, incluindo estenose do estoma e pielonefrite.56
Conclusão
Anomalias da junção ureterovesical (UVJ), associadas a um megauréter, podem ser obstrutivas, com refluxo, não obstrutivas e sem refluxo, ou tanto com refluxo quanto obstrutivas. Apenas 10-20% dos megauréteres requerem intervenção, enquanto o restante pode ser acompanhado de forma conservadora. As opções cirúrgicas incluem reimplante ureteral, com ou sem afunilamento ureteral, procedimentos endoscópicos, ureteroneocistostomia refluxiva ou ureterostomia cutânea. A dilatação persistente em megauréteres não obstrutivos e sem refluxo é justificável devido ao risco de longo prazo de formação de cálculos.
Pontos-chave
- Atenção ao raro megaureter refluxante e obstrutivo: observe a drenagem das vias urinárias superiores após o esvaziamento vesical quando VUR de alto grau é diagnosticado na VCUG. Na presença de drenagem deficiente associada à dilatação significativa das vias urinárias superiores, está indicado um renograma MAG-3 diurético. O reimplante ureteral é a melhor opção nesta situação.
- As obstruções da junção ureterovesical (UVJ) e da junção ureteropélvica (UPJ) podem coexistir. Procure discrepâncias na dilatação da pelve renal e do ureter, especialmente quando uma parece melhorar enquanto a outra não. Inspecione as imagens do renograma MAG-3 quanto à drenagem em ambas as junções. Quando houver suspeita, um pielograma retrógrado pode auxiliar no diagnóstico. Uma estratégia cirúrgica pode ser uma pieloplastia com colocação de stent duplo J num primeiro momento; seguida de nova avaliação por imagem após a remoção do stent.
- Quando se adota o manejo conservador do megaureter não obstrutivo e não refluxante, a literatura atual recomenda profilaxia antibiótica para dilatação ureteral acima de 7 mm; o maior risco de ITU é no primeiro ano de vida.
- O acompanhamento a longo prazo é aconselhável nos casos em que a dilatação ureteral não se resolve na infância, devido ao risco a longo prazo de formação de cálculos ou deterioração da função renal em casos bilaterais.
Referências
- Ferenci P, Lockwood A, Mullen K, Tarter R, Weissenborn K, Blei AT. Hepatic encephalopathy-Definition, nomenclature, diagnosis, and quantification: Final report of the Working Party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology 1977; 35 (3): 716–721. DOI: 10.1053/jhep.2002.31250.
- King LR. Megaloureter: Definition, Diagnosis and Management. J Urol 1980; 123 (2): 222–223. DOI: 10.1016/s0022-5347(17)55867-x.
- Pfister RC, Hendren WH. Primary megaureter in children and adults Clinical and pathophysiologic features of 150 ureters. Urology 1978; 12 (2): 160–176. DOI: 10.1016/0090-4295(78)90327-8.
- Liu HYA, Dhillon HK, Yeung CK, Diamond DA, Duffy PG, Ransley PG. Clinical Outcome and Management of Prenatally Diagnosed Primary Megaureters. J Urol 1994; 152 (2 Part 2): 614–617. DOI: 10.1016/s0022-5347(17)32664-2.
- Cussen LJ. Normal Position of the Ureteral Orifice in Infancy and Childhood: A Quantitative Study. J Urol 1967; 121 (5): 646–647. DOI: 10.1016/s0022-5347(17)56920-7.
- Hellström M, Hjälmås K, Jacobsson B, Jodal U, Odén A. Normal Ureteral Diameter in Infancy and Childhood. Acta Radiol Diagn (Stockh) 1985; 26 (4): 433–439. DOI: 10.1177/028418518502600412.
- Stahl DA, Koul HK, Chacko JK, Mingin GC. Congenital anomalies of the kidney and urinary tract (CAKUT): A current review of cell signaling processes in ureteral development. J Pediatr Urol 2006; 2 (1): 2–9. DOI: 10.1016/j.jpurol.2005.04.006.
- Woolf AS. A molecular and genetic view of human renal and urinary tract malformations. Kidney Int 2000; 58 (2): 500–512. DOI: 10.1046/j.1523-1755.2000.00196.x.
- Takahashi M. The GDNF/RET signaling pathway and human diseases. Cytokine Growth Factor Rev 2001; 12 (4): 361–373. DOI: 10.1016/s1359-6101(01)00012-0.
- Batourina E, Choi C, Paragas N, Bello N, Hensle T, Costantini FD. Faculty Opinions recommendation of Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2002; 32. DOI: 10.3410/f.1009006.124259.
- Viana R, Batourina E, Huang H, Dressler GR, Kobayashi A, Behringer RR, et al.. The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134 (20): 3763–3769. DOI: 10.1242/dev.011270.
- Batourina E, Tsai S, Lambert S, Sprenkle P, Viana R, Dutta S. Faculty Opinions recommendation of Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2005; 37. DOI: 10.3410/f.1029077.343528.
- Pirker ME, Rolle U, Shinkai T, Shinkai M, Puri P. Prenatal and Postnatal Neuromuscular Development of the Ureterovesical Junction. J Urol 2007; 177 (4): 1546–1551. DOI: 10.1016/j.juro.2006.11.081.
- Matsuno T, Tokunaka S, Koyanagi T. Muscular Development in the Urinary Tract. J Urol 1984; 132 (1): 148–152. DOI: 10.1016/s0022-5347(17)49508-5.
- Tanagho EA, Meyers FH, Smith DR. The Trigone: Anatomical and Physiological Considerations. 1. In Relation to the Ureterovesical Junction. J Urol 1968; 100 (5): 623–632. DOI: 10.1016/s0022-5347(17)62584-9.
- Tanagho EA. Intrauterine Fetal Ureteral Obstruction. J Urol 1973; 109 (2): 196–203. DOI: 10.1016/s0022-5347(17)60388-4.
- Lee BR, Silver RI, Partin AW, Epstein JI, Gearhart JP. A Quantitative Histologic Analysis of Collagen Subtypes: The Primary Obstructed and Refluxing Megaureter of Childhood. Urology 1998; 51 (5): 820–823. DOI: 10.1016/s0090-4295(98)00013-2.
- Nguyen HT, Herndon CDA, Cooper C, Gatti J, Kirsch A, Kokorowski P. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. Yearbook of Urology 2010; 2010: 209. DOI: 10.1016/s0084-4071(10)79537-3.
- Rubenwolf P, Herrmann-Nuber J, Schreckenberger M, Stein R, Beetz R. Primary non-refluxive megaureter in children: single-center experience and follow-up of 212 patients. Int Urol Nephrol 2016; 48 (11): 1743–1749. DOI: 10.1007/s11255-016-1384-y.
- Farrugia M-K, Hitchcock R, Radford A, Burki T, Robb A, Murphy F. British Association of Paediatric Urologists consensus statement on the management of the primary obstructive megaureter. J Pediatr Urol 2014; 10 (1): 26–33. DOI: 10.1016/j.jpurol.2013.09.018.
- Holzman SA, Braga LH, Zee RS, Herndon CDA, Davis-Dao CA, Kern NG. Correspondence to the article ‘risk of urinary tract infection in patients with hydroureter: an analysis from the society of fetal urology prenatal hydronephrosis registry.’ J Pediatr Urol 2021; 18 (5): 722–723. DOI: 10.1016/j.jpurol.2022.07.031.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 10: 982–998. DOI: 10.3410/f.725257762.793506733.
- Gordon I, Piepsz A, Sixt R. Guidelines for standard and diuretic renogram in children. Eur J Nucl Med Mol Imaging 2011; 38 (6): 1175–1188. DOI: 10.1007/s00259-011-1811-3.
- Gordon I. Diuretic renography in infants with prenatal unilateral hydronephrosis: an explanation for the controversy about poor drainage. BJU Int 2001; 87 (6): 551–555. DOI: 10.1046/j.1464-410x.2001.00081.x.
- McLELLAN DAWNL, RETIK ALANB, BAUER STUARTB, DIAMOND DAVIDA, ATALA ANTHONY, MANDELL JAMES, et al.. Rate and Predictors of Spontaneous Resolution of Prenatally Diagnosed Primary Nonrefluxing Megaureter. J Urol 2002: 2177–2180. DOI: 10.1097/00005392-200211000-00091.
- CAY ALI, IMAMOGLU MUSTAFA, BAHAT ELIF, SARIHAN HALUK. Diagnostic difficulties in children with coexisting pelvi-ureteric and vesico-ureteric junction obstruction. BJU Int 2006; 98 (1): 177–182. DOI: 10.1111/j.1464-410x.2006.06187.x.
- Peters CA, Mandell J, Lebowitz RL, Colodny AH, Bauer SB, Hendren WH. Congenital obstructed megaureters in early infancy: Diagnosis and treatment. J Pediatr Surg 1989; 25 (5): 576. DOI: 10.1016/0022-3468(90)90639-q.
- Keating MA, Escala J, Snyder HMC, Heyman S, Duckett JW. Changing Concepts in Management of Primary Obstructive Megaureter. J Urol 1989; 142 (2 Part 2): 636–640. DOI: 10.1016/s0022-5347(17)38841-9.
- Baskin LS, Zderic SA, Snyder HM, Duckett JW. Primary Dilated Megaureter: Long-Term Followup. J Urol 1994; 152 (2 Part 2): 618–621. DOI: 10.1016/s0022-5347(17)32665-4.
- Song S-H, Lee S-B, Park YS, Kim KS. Is Antibiotic Prophylaxis Necessary in Infants With Obstructive Hydronephrosis? J Urol 2007; 177 (3): 1098–1101. DOI: 10.1016/j.juro.2006.11.002.
- SHUKLA ASEEMR, COOPER JEFFREY, PATEL RAKESHP, CARR MICHAELC, CANNING DOUGLASA, ZDERIC STEPHENA, et al.. Prenatally Detected Primary Megaureter: A Role For Extended Followup. J Urol 2005; 173 (4): 1353–1356. DOI: 10.1097/01.ju.0000152319.72909.52.
- Hemal AK, Ansari MS, Doddamani D, Gupta NP. Symptomatic and complicated adult and adolescent primary obstructive megaureter–indications for surgery: analysis, outcome, and follow-up. Urology 2003; 61 (4): 703–707. DOI: 10.1016/s0090-4295(02)02590-6.
- Paquin AJ. Ureterovesical Anastomosis: the Description and Evaluation of a Technique. J Urol 1959; 82 (5): 573–583. DOI: 10.1016/s0022-5347(17)65934-2.
- Villanueva CA. Extracorporeal ureteral tailoring during HIDES laparoscopic robotic-assisted ureteral reimplantation for megaureter. J Pediatr Urol 1979; 11 (6): 362–363. DOI: 10.1016/j.jpurol.2015.08.006.
- Kaliciński ZH, Kansy J, Kotarbińska B, Joszt WLELA. Surgery of megaureters–Modification of Hendren’s operation. J Pediatr Surg 1977; 12 (2): 183–188. DOI: 10.1016/s0022-3468(77)80005-5.
- Hendren WH. Operative Repair of Megaureter in Children. J Urol 1969; 101 (4): 491–507. DOI: 10.1016/s0022-5347(17)62370-x.
- Ben-Meir D, McMullin N, Kimber C, Gibikote S, Kongola K, Hutson JM. Reimplantation of obstructive megaureters with and without tailoring. J Pediatr Urol 2006; 2 (3): 178–181. DOI: 10.1016/j.jpurol.2005.05.010.
- Stanasel I, Atala A, Hemal A. Robotic Assisted Ureteral Reimplantation: Current Status. Curr Urol Rep 2013; 14 (1): 32–36. DOI: 10.1007/s11934-012-0298-1.
- LEE S, AKBAL C, KAEFER M, Chertin B, Pollack A, Koulikov D. Laparoscopic Ureteral Reimplantation With Extracorporeal Tailoring for Megaureter: A Simple Technical Nuance. J Urol 2006; 176 (6): 2640–2642. DOI: 10.1016/j.juro.2006.08.025.
- Bilgutay AN, Kirsch AJ. Robotic Ureteral Reconstruction in the Pediatric Population. Front Pediatr 2019; 7. DOI: 10.3389/fped.2019.00085.
- Casale P, Patel RP, Kolon TF. Nerve Sparing Robotic Extravesical Ureteral Reimplantation. J Urol 2008; 179 (5): 1987–1990. DOI: 10.1016/j.juro.2008.01.062.
- Herz D, Fuchs M, Todd A, McLeod D, Smith J. Robot-assisted laparoscopic extravesical ureteral reimplant: A critical look at surgical outcomes. J Pediatr Urol 2016; 12 (6): 402.e1–402.e9. DOI: 10.1016/j.jpurol.2016.05.042.
- Nelson CP. Obstructing congenital anomalies of the urinary tract: ureteropelvic junction obstruction, ureterocele, megaureter, and posterior urethral valves. The Brady Urology Manual 1997; 65: 207–220. DOI: 10.1201/9780429194993-21.
- KORT LAETITIAMO de, KLIJN AARTJ, UITERWAAL CUNOSPM, JONG TOMPVM de. Ureteral Reimplantation In Infants And Children: J Urol 2002; 167: 285–287. DOI: 10.1097/00005392-200201000-00084.
- Shenoy, Rance. Is there a place for the insertion of a JJ stent as a temporizing procedure for symptomatic partial congenital vesico-ureteric junction obstruction in infancy? BJU Int 1999; 84 (4): 524–525. DOI: 10.1046/j.1464-410x.1999.00256.x.
- Farrugia M-K, Steinbrecher HA, Malone PS. The utilization of stents in the management of primary obstructive megaureters requiring intervention before 1 year of age. J Pediatr Urol 2011; 7 (2): 198–202. DOI: 10.1016/j.jpurol.2010.04.015.
- Farrugia MK, Steinbrecher HA, Malone PS. Re: The Utilization of Stents in the Management of Primary Obstructive Megaureters Requiring Intervention Before 1 Year of Age. J Urol 2011; 186 (5): 2063–2063. DOI: 10.1016/j.juro.2011.07.142.
- Doudt AD, Pusateri CR, Christman MS. Endoscopic Management of Primary Obstructive Megaureter: A Systematic Review. J Endourol 2018; 32 (6): 482–487. DOI: 10.1089/end.2017.0434.
- Kajbafzadeh A-M, Payabvash S, Salmasi AH, Arshadi H, Hashemi S-M, Arabian S, et al.. Endoureterotomy for Treatment of Primary Obstructive Megaureter in Children. J Endourol 2007; 21 (7): 743–749. DOI: 10.1089/end.2006.0330.
- Tourchi A, Kajbafzadeh AM, Mazaheri T, Raad M. Endoscopic Management of Obstructive Refluxing Megaureter: a Novel Approach. J Pediatr Urol 2010; 6: S62. DOI: 10.1016/j.jpurol.2010.02.110.
- Shirazi M, Natami M, Hekmati P, Farsiani M. Result of Endoureterotomy in the Management of Primary Obstructive Megaureter in the First Year of Life: Preliminary Report. J Endourol 2014; 28 (1): 79–83. DOI: 10.1089/end.2013.0098.
- LEE SANGDON, AKBAL CEM, KAEFER MARTIN. Refluxing Ureteral Reimplant As Temporary Treatment Of Obstructive Megaureter In Neonate And Infant. J Urol 2005; 173 (4): 1357–1360. DOI: 10.1097/01.ju.0000152317.72166.df.
- Kaefer M, Misseri R, Frank E, Rhee A, Lee D. Re: Refluxing Ureteral Reimplantation: A Logical Method for Managing Neonatal UVJ Obstruction. J Urol 2014; 194 (2): 518–518. DOI: 10.1016/j.juro.2015.05.043.
- Alyami FA, Koyle MA, Bowlin PR, Gleason JM, Braga LH, Lorenzo AJ. Side-to-Side Refluxing Nondismembered Ureterocystotomy: A Novel Strategy to Address Obstructed Megaureters in Children. J Urol 2017; 198 (5): 1159–1167. DOI: 10.1016/j.juro.2017.05.078.
- Shrestha AL, Bal HS, Kisku SMC, Sen S. Commentary to “Outcome of end cutaneous ureterostomy (ECU) as a non conservative option in the management of primary obstructive megaureters (POM).” J Pediatr Urol 2018; 15 (3): 294–295. DOI: 10.1016/j.jpurol.2019.02.024.
- Kitchens DM, DeFoor W, Minevich E, Reddy P, Polsky E, McGregor A, et al.. End Cutaneous Ureterostomy for the Management of Severe Hydronephrosis. J Urol 2007; 177 (4): 1501–1504. DOI: 10.1016/j.juro.2006.11.076.
Ultima atualização: 2025-09-21 13:35