16: Refluxo Vesicoureteral
Este capítulo levará aproximadamente 36 minutos para ler.
Introdução
Refluxo vesicoureteral (RVU) é o fluxo retrógrado de urina da bexiga para os ureteres e, às vezes, para os rins. O RVU é um fator de risco para pielonefrite recorrente, cicatrizes renais, insuficiência renal e hipertensão e é citado como causa de doença renal em estágio terminal em crianças.1,2,3,4 O manejo do refluxo é direcionado principalmente a reduzir o desenvolvimento desses efeitos adversos de longo prazo por meio da prevenção de pielonefrite.
Nas últimas várias décadas ocorreu uma mudança de paradigma na avaliação e no manejo do RVU, e os clínicos devem estar cientes das controvérsias no manejo do RVU. Parece que o tratamento ativo do refluxo melhorou os desfechos para algumas crianças, de modo que a incidência de nefropatia associada ao refluxo continua a declinar, mas a literatura urológica recente sugere que a história natural do RVU não segue um curso uniforme. Muitas crianças com refluxo não se beneficiam nem do diagnóstico nem do tratamento, pois há uma alta taxa de resolução espontânea sem efeitos adversos.5,6 Esclarecer quais crianças realmente se beneficiam do tratamento é o maior desafio para o avanço do manejo do refluxo vesicoureteral.
Contexto, Incidência e Fisiopatologia
VUR ocorre em aproximadamente 1-3% das crianças, e relata-se que 2.3% dos pacientes com ESRD de início recente, com idades entre 0-21 anos, nos Estados Unidos, têm diagnóstico principal atribuído à nefropatia por refluxo. A incidência de ESRD com nefropatia por refluxo como etiologia primária diminuiu de forma constante nos últimos vinte anos.7 Estudos internacionais anteriores estimaram uma prevalência mais alta de cerca de 10%.5,8
Embora referências anatômicas ao conceito de refluxo tenham sido feitas já no século I d.C., estudos fundamentais na década de 1950 foram os primeiros a contribuir para a nossa compreensão da associação entre VUR, pielonefrite crônica e cicatrizes renais tal como a entendemos hoje.9,10
O RVU pode ser categorizado como primário ou secundário. O RVU primário é atribuído a uma porção intramural do ureter anormalmente curta que atravessa o músculo detrusor na junção ureterovesical. Numa junção normal, o ureter intramural é comprimido passivamente durante o enchimento vesical, criando um mecanismo antirrefluxo. Este mecanismo depende da relação comprimento intramural/diâmetro e do ângulo de inserção ureterovesical.11
Um túnel intravesical curto está associado ao RVU, e o comprimento do túnel é inversamente proporcional à gravidade do refluxo.12
VUR secundário desenvolve-se quando a função anormal do trato urinário inferior e pressões intravesicais elevadas superam o mecanismo antirrefluxo e está associado a condições como obstrução da via de saída vesical (por exemplo, válvula uretral posterior) ou bexiga neurogênica. O VUR secundário também pode ser observado em crianças sem anomalia anatômica geniturinária ou neurológica, mas que apresentam disfunção vesical e intestinal.13 A causa mais frequente de refluxo secundário é a disfunção vesical e intestinal não neurogênica, que também é um dos maiores fatores de risco para ITUs de escape.
Herança
Existe um forte padrão de herança no VUR primário, com até 80% de gêmeos idênticos e 35% de gêmeos fraternos concordantes quanto à presença de VUR.2 Vários polimorfismos associados a anomalias na formação do broto ureteral foram identificados em pacientes com VUR primário, embora nenhum gene único tenha sido encontrado como predominante.14 A probabilidade de um irmão não gêmeo apresentar refluxo é de cerca de 25% e as chances de os filhos apresentarem refluxo são de aproximadamente 35-50%.15,16 Curiosamente, essa relação não é tão forte em crianças com eliminação disfuncional, o que provavelmente indica a natureza secundária do VUR nessa coorte.17
Refluxo vesicoureteral, infecções do trato urinário e cicatrizes renais
A relevância clínica do VUR reside em grande parte na sua associação com displasia renal congênita, assim como com lesão do parênquima renal secundária à pielonefrite recorrente. Pelo menos um terço dos pacientes com VUR apresentam cicatrizes renais.18,19 A presença de cicatrizes indica regiões de dano renal e aumenta o risco de sequelas adversas a longo prazo.
Nefropatia por Refluxo Congênita
Em recém-nascidos com RVU, cicatrizes foram detectadas em associação com refluxo de alto grau antes da ocorrência de ITU clínica.20 Essas “cicatrizes congênitas” são consideradas regiões de displasia ou hipoplasia focal resultantes de nefrogênese anormal, em oposição a tecido normal lesado após pielonefrite. A displasia renal congênita pode ser indistinguível de cicatrizes renais adquiridas secundárias à infecção. Como cintilografias renais com DMSA não são realizadas rotineiramente em neonatos, desconhece-se qual proporção das cicatrizes renais atribuídas à lesão infecciosa é na realidade devida a anormalidades da embriogênese.21 Embora a etiologia definitiva permaneça incerta, tratam-se de regiões de função renal diminuída e podem estar associadas a morbidade e mortalidade significativas, independentemente do desenvolvimento de cicatrização renal associada à infecção.22
Pielonefrite e Cicatrização Renal
Infecções do trato urinário são comuns em crianças, afetando cerca de 5% das meninas e aproximadamente metade desse percentual em meninos.23 Estima-se que 30-40% das crianças com menos de 5 anos de idade que desenvolvem infecções do trato urinário apresentem VUR após investigação adicional.24,25 Acredita-se que a cicatrização renal ocorra quando a urina infectada entra em contato com o parênquima renal, causando uma reação inflamatória; ela tem sido associada a um risco aumentado de hipertensão, proteinúria e insuficiência renal.3,26
RVU como fator predisponente para lesão renal devido à infecção foi inicialmente reconhecido em pacientes com lesão medular. Após correção cirúrgica, essas crianças tiveram menos episódios de pielonefrite e urosepsia.27 Estudos posteriores demonstraram uma menor taxa de desenvolvimento de novas cicatrizes renais em crianças com refluxo primário, em comparação às com refluxo secundário decorrente de bexiga neurogênica ou disfunção miccional.28,29
A lesão renal permanente decorrente de pielonefrite pode ser identificada como cicatriz renal na cintilografia com ácido dimercaptossuccínico marcado com 99mTc (DMSA). Em uma meta-análise que avaliou a presença de lesão renal em crianças hospitalizadas com infecção do trato urinário, aproximadamente 34% das crianças com pielonefrite apresentavam refluxo vesicoureteral (RVU) e, entre aquelas com RVU e pielonefrite, 72% tinham uma cintilografia com DMSA alterada.30
A cicatrização renal na cintilografia nuclear pode ser detectada durante ou logo após um episódio agudo de pielonefrite. As sequelas decorrentes de cicatrizes renais podem não se tornar aparentes por muitos anos; já foram relatados intervalos de até 30-40 anos entre o primeiro episódio de pielonefrite com formação de cicatriz renal e o desenvolvimento de hipertensão ou doença renal terminal.27 O longo período entre a agressão renal inicial aparente e os efeitos clinicamente aparentes ressalta a necessidade de acompanhamento de longo prazo dos pacientes com VUR.
Classificação do Refluxo e Outros Preditores de Desfechos
Como há uma alta taxa de resolução espontânea do RVU na maioria das crianças, mas sequelas clínicas potencialmente devastadoras em outras, identificar aquelas com maior risco é um objetivo primordial do manejo do RVU. O Estudo Internacional de Refluxo classificou o RVU em uma escala de 5 pontos, definida pelo grau de fluxo retrógrado de urina e pela distorção concomitante do sistema pielocalicial (Figura 1)31 Graus mais elevados estão associados a menores taxas de resolução espontânea e a uma maior prevalência de cicatrizes renais.23,32
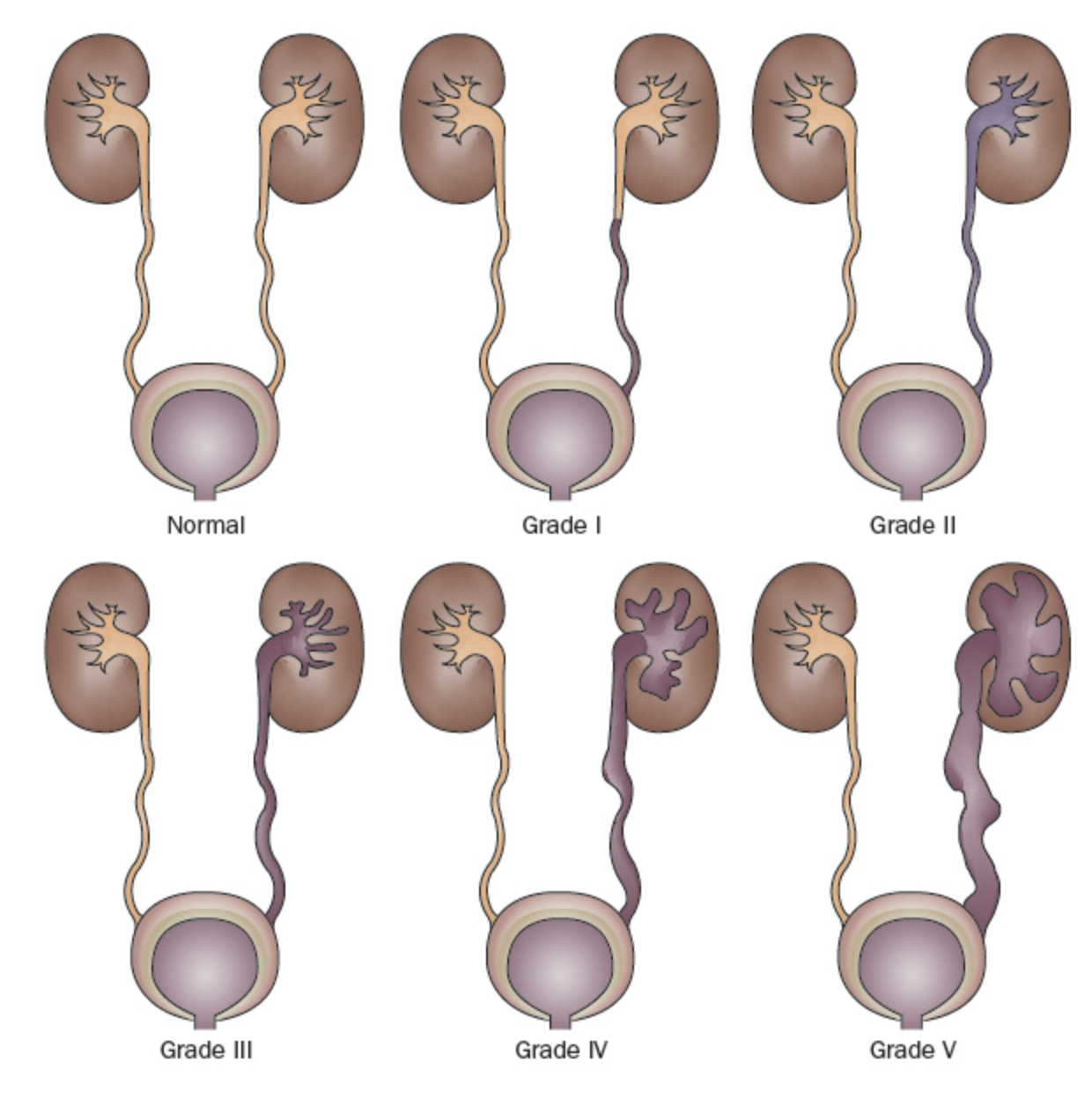
Figura 1 Sistema Internacional de Classificação do Refluxo.31
- Grau I: refluxo apenas para o uréter
- Grau II: refluxo para um sistema pielocalicial não dilatado
- Grau III: dilatação do sistema coletor (Figura 2)
- Grau IV: dilatação mais extensa com embotamento dos cálices e tortuosidade do uréter (Figura 3)
- Grau V: dilatação maciça do sistema coletor e tortuosidade severa do uréter (Figura 4)
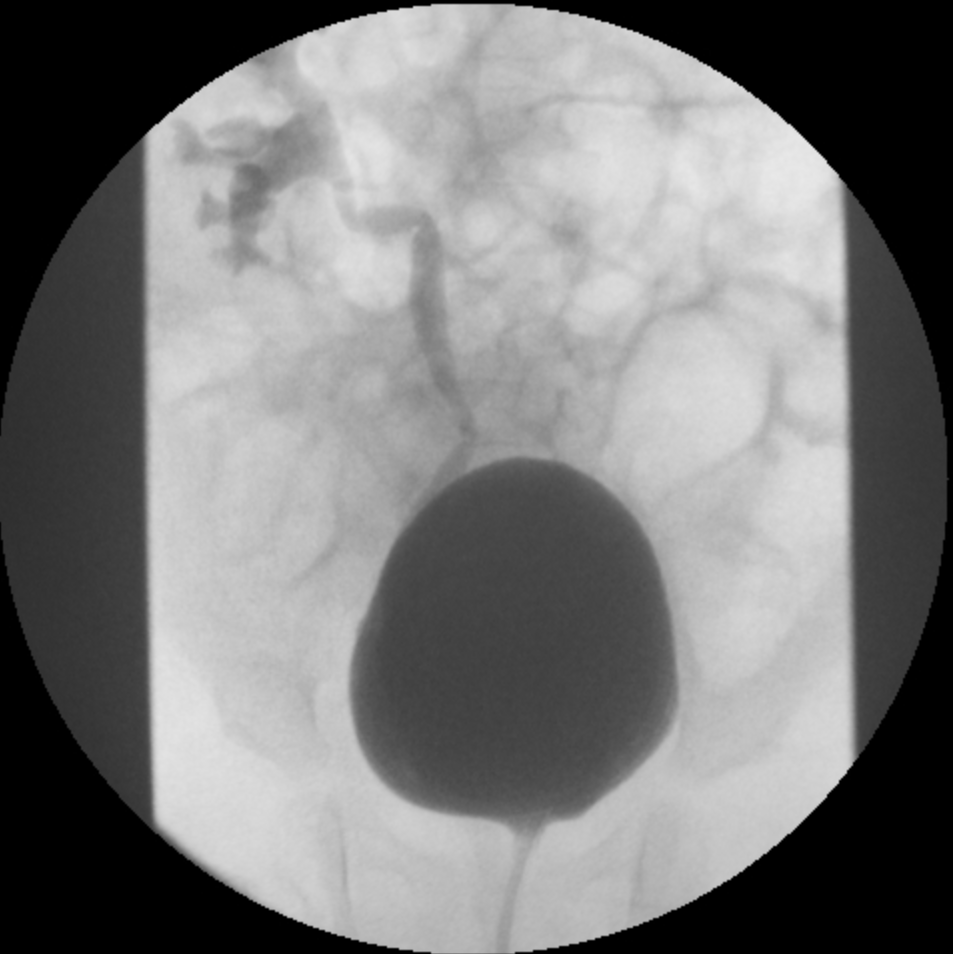
Figura 2 Grau III de RVU
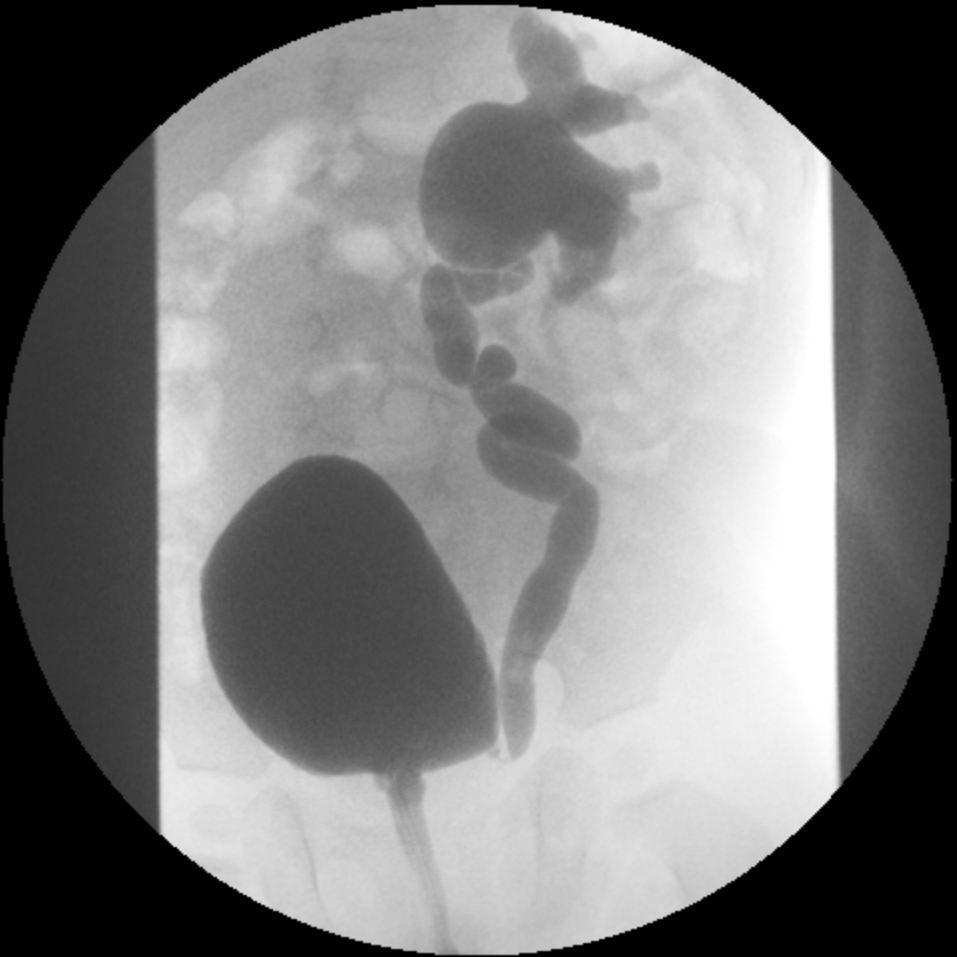
Figura 3 RVU Grau IV
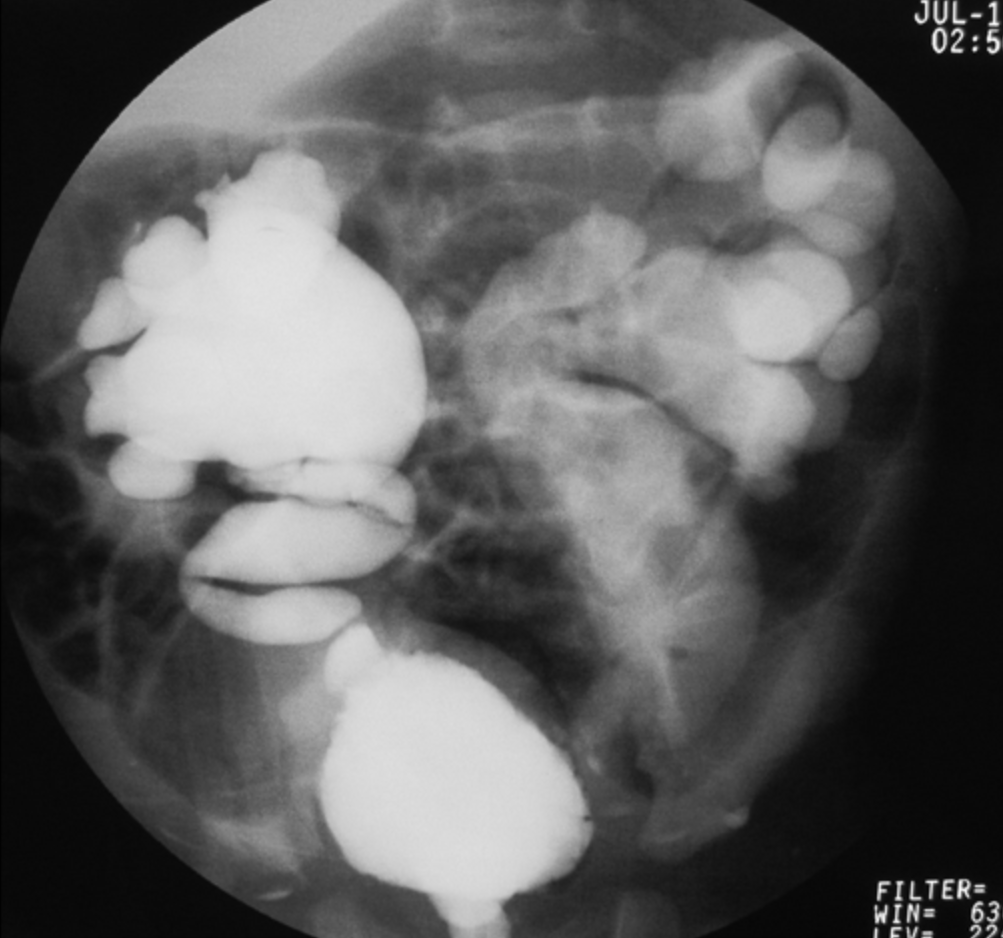
Figura 4 Grau V RVU
Vários estudos demonstram uma correlação direta entre a prevalência de cicatrizes renais e o grau do refluxo..33 A cicatrização renal se desenvolve com menor frequência no refluxo não dilatante.22,34,35 Foi demonstrado que a chance de desenvolver perda adicional de parênquima renal é maior em crianças com refluxo de graus III-V do que naquelas com graus I-II.36,37 Também foi demonstrado que cicatrizes renais são um preditor negativo da resolução do VUR, independentemente do grau do refluxo.38 Infelizmente, o sistema internacional de graduação do refluxo é subjetivo, com baixa confiabilidade interobservador.39,40
Mais recentemente, foram identificados fatores adicionais que influenciam a resolução do refluxo e as ITUs de escape. Fatores clínicos preditivos da resolução do refluxo, risco de lesão renal e/ou ITUs de escape incluem idade, sexo (o sexo feminino aumenta o risco), estado de circuncisão (a circuncisão é protetora contra ITU), presença de disfunção vesical e intestinal e histórico prévio de ITU. Preditores radiográficos incluem lateralidade (unilateral vs. bilateral), razão do diâmetro ureteral distal (relativa à distância entre os corpos vertebrais L1-L3),41,42,43,44,45 volume vesical no início do refluxo (normalizado como porcentagem da capacidade vesical prevista para a idade),46 pressão vesical no início do refluxo, se o refluxo ocorre na fase de enchimento ou fase miccional, e presença de cicatrizes renais.38,47
Para neonatos, um índice de refluxo vesicoureteral (RVU) de seis pontos utilizando sexo, grau do RVU, anomalias anatômicas ureterais e o momento do refluxo durante a cistouretrografia miccional (VCUG) mostrou-se preditivo de resolução do RVU, tempo até a melhora e infecção do trato urinário (ITU) de escape.48,49 De modo semelhante, foi criada uma rede neural de fácil utilização empregando informações demográficas, grau do RVU, lateralidade, volume vesical no início do RVU, histórico de ITU, disfunção vesical ou intestinal e presença de ITUs febris de escape para prever a probabilidade de resolução do RVU, e está disponível em http://pedsurocomp.lab.uiowa.edu.50 A consideração de múltiplos fatores de risco melhora a predição de desfechos clínicos e permite um manejo mais individualizado de cada paciente.
Disfunção intestinal e vesical
Tem-se demonstrado de forma consistente que crianças com disfunção intestinal ou vesical apresentam maior incidência de ITUs de escape, mais cicatrizes renais, menor taxa de resolução espontânea do VUR e maior taxa de falha após tratamento cirúrgico do que crianças com hábitos de eliminação “normais”.1,51 Esses achados devem ser levados em consideração ao determinar as opções de manejo para crianças já treinadas para o toalete com VUR.
Nefropatia por refluxo/Cicatriz renal
Crianças com cicatrizes renais têm maior probabilidade de desenvolver ITUs subsequentes e cicatrizes adicionais do que crianças sem cicatrizes renais.34,52,53 Um estudo retrospectivo com 120 pacientes demonstrou uma chance significativamente maior de desenvolver uma infecção do trato urinário de escape naqueles com refluxo graus III-V e uma anormalidade na cintilografia renal com DMSA basal (60%) em comparação com aqueles sem anormalidade (6%), e outro estudo mostrou um risco relativo de ITU de escape de 5.1 em pacientes com cicatrizes renais.54,55 Em um estudo com seguimento médio de 12 anos após uma cirurgia antirrefluxo, crianças com cicatrizes renais unilaterais tinham 11% de chance de desenvolver hipertensão e 18.5% se tinham cicatrizes renais bilaterais.56 Outros sugeriram que a incidência de hipertensão em crianças com cicatrizes renais bilaterais é de cerca de 20%.57 Crianças com cicatrizes renais bilaterais graves têm probabilidade significativamente maior de desenvolver proteinúria, insuficiência renal crônica e falência renal do que aquelas com cicatrizes unilaterais ou rins sem cicatrizes.58,59 Esses dados sugerem fortemente que crianças com cicatrizes estão em maior risco para desenvolvimento adicional de cicatrizes e sequelas clínicas a longo prazo.
Diagnóstico e Avaliação
Cistouretrografia miccional e cistograma nuclear
Os únicos exames que rotineiramente e de forma confiável detectam refluxo são a cistouretrografia miccional (VCUG) e a cistografia nuclear. Uma VCUG é realizada instilando contraste de forma retrógrada, por meio de um cateter uretral, na bexiga e obtendo imagens fluoroscópicas do trato urinário superior e inferior durante o enchimento e a micção. Um cistograma nuclear é realizado utilizando uma técnica de cintilografia com radioisótopos. A VCUG é um exame inicial apropriado, pois fornece melhores detalhes anatômicos, incluindo a presença ou ausência de divertículos periureterais, duplicação ureteral e anormalidades vesicais ou uretrais. Também permite uma graduação mais precisa do refluxo. Além disso, permite a mensuração do diâmetro ureteral distal, a qual se mostrou mais objetiva e confiável do que a graduação e com valor preditivo igual ou maior em termos de resolução e desfechos clínicos.41,42,43,44,45
A cistografia radionuclídica é benéfica porque reduz a dose de radiação em comparação com a VCUG. A cistografia radionuclídica detecta de forma confiável todos os graus de refluxo vesicoureteral e pode ser mais sensível para a detecção de VUR intermitente (Figura 5)60,61
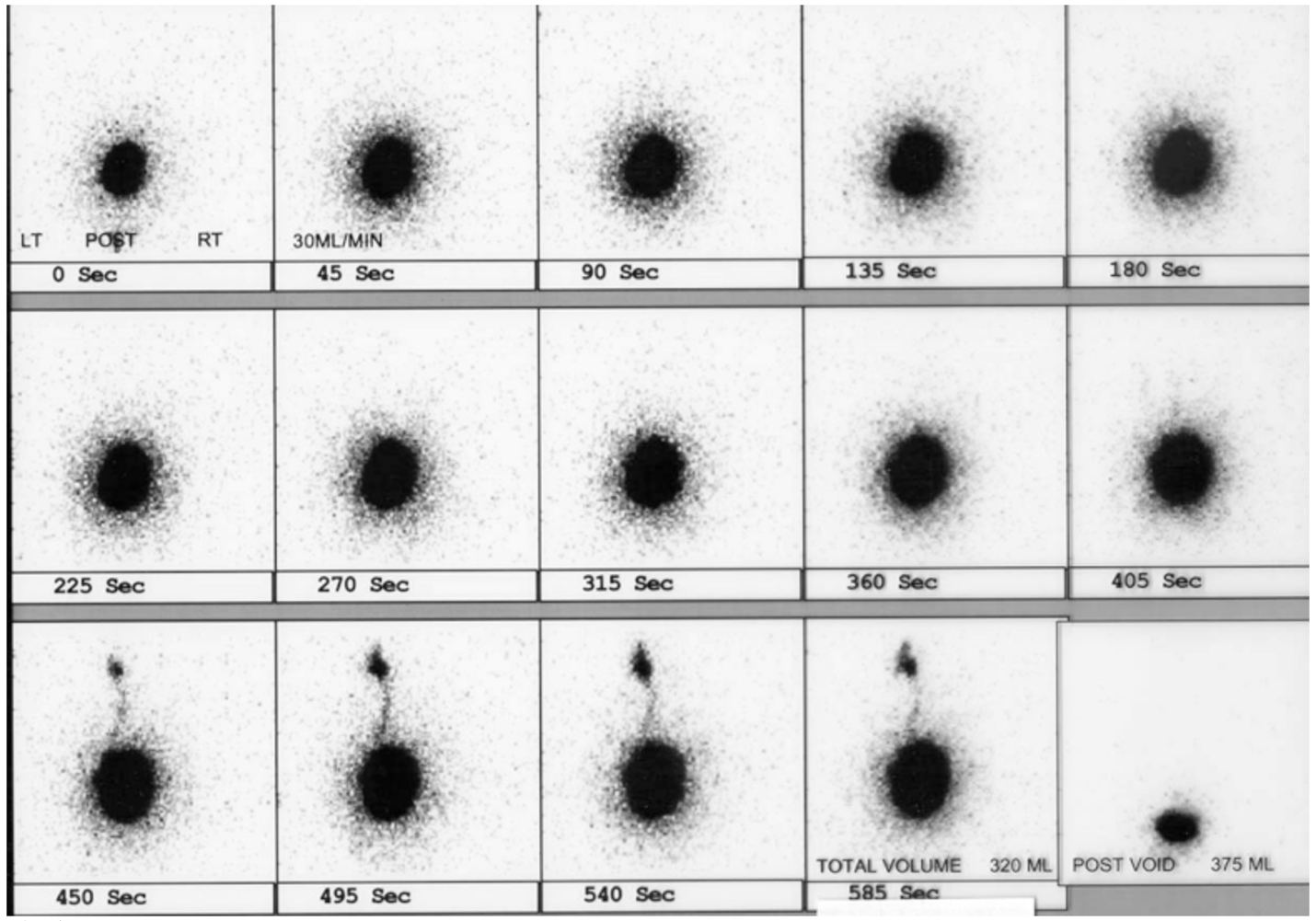
Figura 5 RVU à esquerda no cistograma nuclear
Se uma VCUG não demonstrar alterações anatômicas significativas, a cistografia nuclear pode ser realizada em estudos de seguimento para limitar a exposição à radiação. Embora a cistografia nuclear seja frequentemente considerada um teste mais sensível, o profissional que solicita o exame deve estar ciente de que cada tipo de cistografia tem limitações quanto à sua capacidade de detectar refluxo em uma determinada população.62
As Seções de Urologia e Radiologia da Academia Americana de Pediatria criaram, em 2016, um protocolo padrão para a realização de VCUG a fim de maximizar a segurança do paciente e garantir resultados precisos que afetam diretamente o manejo do paciente.63 As recomendações-chave incluíam observar os princípios ALARA,64 preencher a bexiga por gravidade a 100 cm acima da mesa de exame, obter imagens da uretra durante a fase miccional, realizar um estudo cíclico (múltiplos ciclos de enchimento), estimar a capacidade vesical máxima, registrar o volume vesical no momento em que ocorre o VUR, registrar o resíduo pós-miccional, registrar anormalidades da bexiga ou da uretra (por exemplo, divertículos vesicais ou válvula de uretra posterior), e classificar o refluxo de acordo com o International Reflux Study.
Além da exposição à radiação, a cateterização pode ser uma experiência traumática para uma criança pequena. Esforços para diminuir a natureza traumática da VCUG incluem o uso de lubrificantes contendo anestésicos locais, o envolvimento de especialistas em Child Life e sedação consciente. Historicamente, cistografias eram repetidas anualmente; porém, com a melhora na capacidade de prever o tempo de resolução, tem sido sugerido que, em crianças com menor probabilidade de resolução do VUR, o intervalo entre as cistografias seja prolongado para reduzir a exposição à radiação, o número de exames traumáticos e o custo.50,65,66,67
Uma modalidade de imagem relativamente recentemente adotada em alguns centros é a urosonografia miccional com contraste (ceVUS), que em vários estudos mostrou ser segura e comparável à VCUG na detecção de VUR de grau 2 ou superior, na detecção de refluxo intrarrenal e com boa confiabilidade interobservador (Figura 6) Isso permite evitar completamente a radiação ionizante, mas ainda exige cateterização e instilação intravesical do meio de contraste. Agentes de contraste ultrassonográficos de segunda geração não estavam amplamente disponíveis até recentemente, quando foram aprovados pela FDA nos Estados Unidos.68,69 A VCUG permanece o padrão-ouro para o diagnóstico de VUR até que pesquisas adicionais possam demonstrar sensibilidade e especificidade equivalentes de outros métodos de exame.
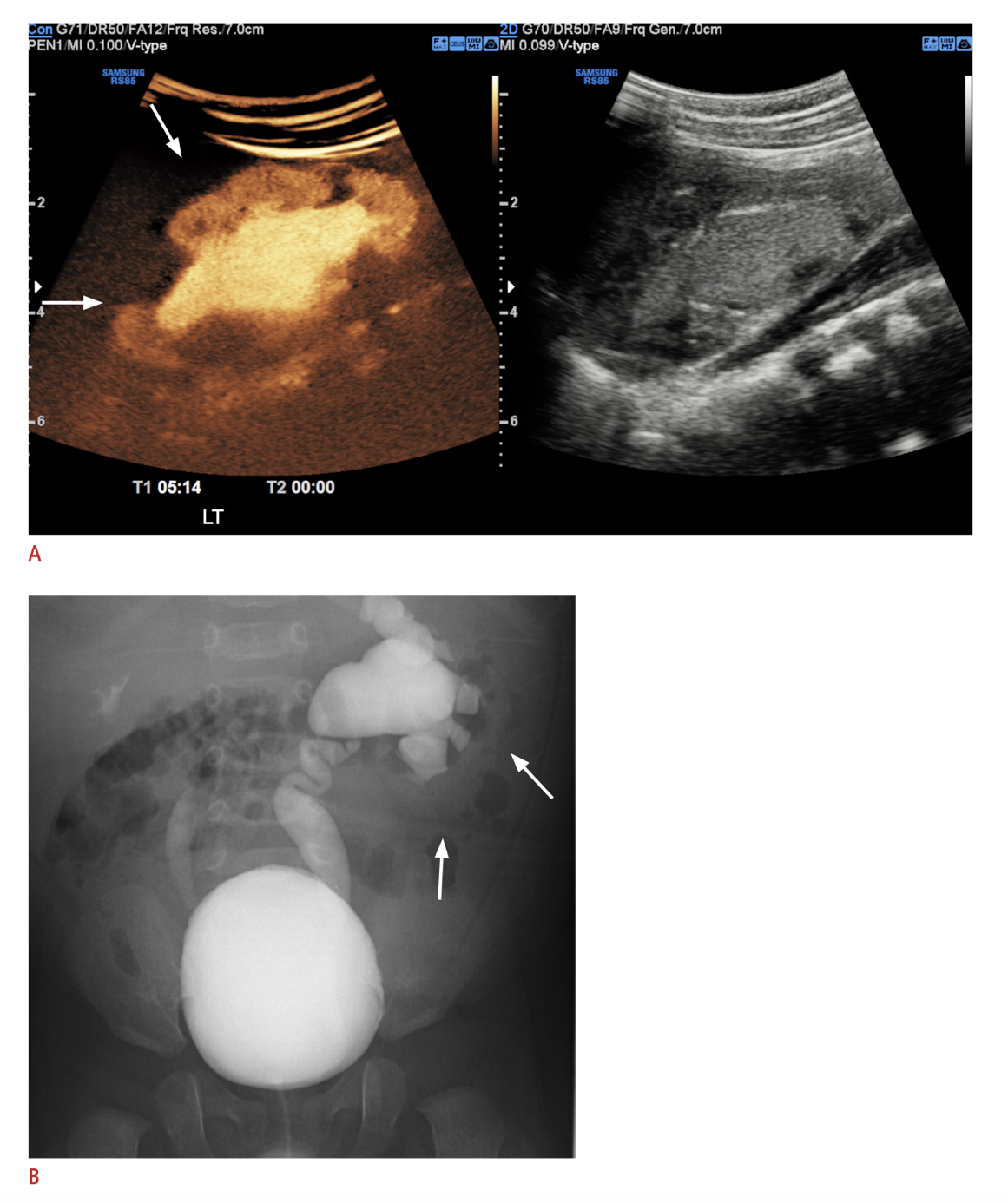
Figura 6 A. Imagem de ultrassonografia com contraste do rim esquerdo com refluxo intrarrenal comparada com B. VCUG mostrando VUR grau V à esquerda e VUR grau III à direita. Imagem reproduzida sob os termos da licença Creative Commons Atribuição-Não Comercial. Imagem reimpressa de. Direitos autorais 2021 Korean Society of Ultrasound in Medicine.
Cintilografia Nuclear (DMSA, MAG3)
A cintilografia com DMSA, na qual o agente radioativo se liga aos túbulos proximais, mostrou-se um estudo mais sensível do que a pielografia intravenosa (IVP) para a detecção de nefropatia por refluxo.70 O exame fornece informações sobre a função renal diferencial e também pode detectar alterações de pielonefrite aguda com maior sensibilidade e especificidade do que a tomografia computadorizada, a ressonância magnética ou a ultrassonografia.71(Figura 7)
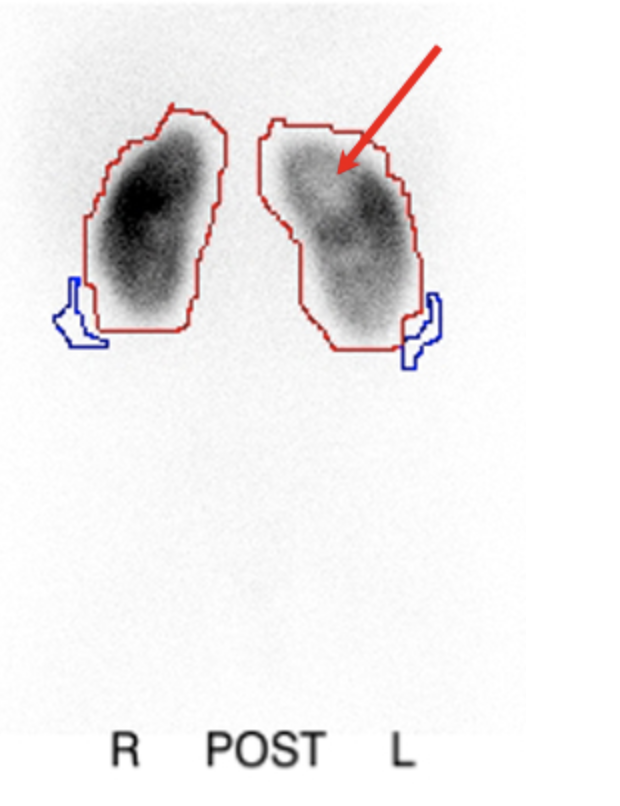
Figura 7 Cintilografia com DMSA após pielonefrite mostrando defeitos fotopênicos no rim esquerdo
A associação de cicatrizes renais com graus mais elevados de refluxo e risco de cicatrizes subsequentes, bem como menores taxas de resolução, levam alguns a concluir que a avaliação inicial padrão de uma criança com ITU febril deve começar com uma cintilografia renal e não com uma VCUG (a abordagem “de cima para baixo”). Usando essa abordagem, somente nas crianças com cintilografia anormal deve-se obter uma VCUG. O benefício de tal abordagem seria a redução do número de crianças submetidas à VCUG e a identificação de refluxo em um grupo de maior risco; em teoria, pacientes com refluxo, mas sem anormalidades renais estruturais ou funcionais, podem permanecer sem diagnóstico, mas a ausência de tais anormalidades renais sugere que o refluxo provavelmente não é clinicamente significativo. O uso de ultrassonografia como alternativa à cintilografia renal não foi aceito devido à sensibilidade reduzida. Um estudo observou que até 25% dos pacientes com defeitos corticais na DMSA tinham ultrassonografia normal, fornecendo dados adicionais sobre a utilidade das cintilografias renais na avaliação de crianças com ITUs febris.72
A cintilografia com mercaptoacetiltriglicina (MAG3) também apresenta capacidade aprimorada de detectar cicatrizes renais em comparação ao IVP. Embora a cintilografia com DMSA seja considerada por muitos o teste mais sensível para detecção de cicatriz renal; a taxa de sensibilidade relatada do MAG3 em comparação ao DMSA varia de 88% até igual ou ligeiramente superior à de uma cintilografia com DMSA.73,74,75 As vantagens do MAG3 incluem menor exposição à radiação, custo e tempo necessários, bem como visualização do sistema coletor, o que pode melhorar a especificidade em comparação ao DMSA naqueles com dilatação significativa do sistema coletor.73 A cintilografia nuclear geralmente é adiada até 4-6 semanas de vida para garantir desenvolvimento renal adequado e resultados precisos.
Indicações para exames diagnósticos
O diagnóstico de refluxo vesicoureteral geralmente é feito após uma ou mais UTIs ou quando suspeitado com base em achados anormais de imagem renal. O rastreamento para VUR tem sido tradicionalmente recomendado em pacientes com dilatação do trato urinário (UTD) diagnosticada no pré-natal, porque o refluxo foi relatado em até 31% dos lactentes com UTD pré-natal; contudo, a UTD pré-natal correlaciona-se mal com a gravidade do VUR.76,77,78,79 O risco de VUR em pacientes com sistema coletor não dilatado ou discretamente dilatado pode ser de até 25%.77,80,81 Felizmente, o VUR associado à UTD detectada no pré-natal apresenta alta incidência de resolução espontânea.81,82 Estudos que avaliaram se pacientes com UTD e VUR apresentam ou não risco aumentado de UTI (em comparação à UTD na ausência de VUR) mostram resultados conflitantes.83,84,85,86,87,88,89,90 A realização criteriosa de VCUG deve ser considerada com base nos fatores de risco para VUR clinicamente significativo.
A utilidade do rastreamento de irmãos para refluxo também é controversa.17,91 há um risco aumentado de anormalidades corticais renais em irmãos rastreados com histórico de ITU, assim como de diagnóstico final de RVU de alto grau.92 Um estudo utilizando dados de sinistros de seguro de saúde não encontrou diferença significativa na taxa de ITU entre irmãos rastreados e não rastreados.93
Ainda não foi demonstrado se a detecção e o manejo do VUR em um irmão assintomático submetido a rastreamento resultarão em diminuição significativa de sequelas adversas; portanto, atualmente não existe consenso quanto à prática de rastreamento de irmãos assintomáticos para VUR. A recomendação das Diretrizes Clínicas da AUA para o Manejo do Refluxo Vesicoureteral Primário em Crianças é que os irmãos sejam rastreados com ultrassonografia renal e vesical (RBUS), reservando-se a VCUG para aqueles em que a RBUS for anormal.94
O momento da avaliação para VUR em pacientes com histórico de ITU febril também permanece controverso. O Subcomitê de Infecção do Trato Urinário da AAP publicou diretrizes clínicas em 2011 e as reafirmou em 2016, que recomendavam adiar a profilaxia antibiótica e a VCUG após a primeira ITU febril, na ausência de uma ultrassonografia renal anormal, em crianças de 2 a 24 meses.95 O ensaio Intervenção Randomizada em Crianças com Refluxo Vesicoureteral (RIVUR) estudou 607 crianças pequenas (2-72 meses) com VUR graus I-IV após uma primeira ou segunda ITU febril ou sintomática, e as randomizou para placebo versus profilaxia antibiótica. A profilaxia com trimetoprim/sulfametoxazol reduziu a ocorrência de ITU em 50%, mas não houve diferença significativa em cicatrizes renais entre os grupos, embora o estudo não tivesse poder para avaliar cicatrizes renais.96 Uma análise post hoc do ensaio RIVUR e de outro ensaio prospectivo multicêntrico (CUTIE) mostrou que a incidência de cicatriz renal após uma ITU febril foi de 2,8%, 25,7% após duas ITUs febris e 28,6% após três ou mais ITUs febris, reforçando a utilidade do rastreamento de VUR após a ITU febril inicial.97
Manejo clínico
Não existe um manejo ideal universal para crianças com RVU. Como observado anteriormente, múltiplas variáveis anatômicas e fisiológicas influenciam a probabilidade de resolução espontânea do RVU e o risco de infecções do trato urinário febris, enquanto fatores extrínsecos, como preferências do paciente e da família, adesão ao tratamento, situações sociais e risco de taxas de infecções do trato urinário, também devem ser considerados. Tendo em mente que o manejo do RVU deve ser individualizado para cada criança após a consideração dos múltiplos fatores intrínsecos e extrínsecos que influenciam o desfecho, discutimos abaixo as várias opções de tratamento.
Manejo não operatório
A administração diária de antibióticos em baixa dose (~ ¼ da dose de tratamento) baseia-se no conhecimento de que as taxas de resolução espontânea do RVU primário são muito altas (mesmo para RVU grave em populações selecionadas) e de que a cicatrização renal associada ao refluxo no período pós-natal parece ocorrer exclusivamente na presença de urina infectada, particularmente nos polos dos rins, onde o sistema coletor intrarrenal é mais propenso a apresentar cálices compostos.98 Assim, manter a urina estéril até a resolução espontânea do refluxo pode evitar a morbidade da cirurgia e a cicatrização renal. Diversos estudos randomizados tentaram avaliar a eficácia e os efeitos adversos da profilaxia antibiótica em crianças com RVU.4,99 De modo geral, esses estudos não conseguiram demonstrar uma redução significativa de pielonefrite aguda ou de cicatrizes renais em crianças com RVU tratadas com profilaxia antibiótica. Alguns estudos, na verdade, relataram um aumento de ITUs em crianças em uso de antibióticos, assim como um aumento de bactérias resistentes a antibióticos causando as ITUs.4,99,100 Por análise de subgrupos, outros estudos identificaram idade menor e graus mais elevados de refluxo como fatores de risco para ITUs febris recorrentes.99,101 O ensaio multicêntrico RIVUR demonstrou redução de 50% na recorrência de ITU com profilaxia antibiótica vs. placebo, mas sem diferença na taxa de cicatrização renal.102
Muitos questionam a necessidade de profilaxia antibiótica, sugerindo que, em indivíduos selecionados, a chance de pielonefrite e de lesão renal sem antibióticos profiláticos é pequena.103,104,105,106 Entre 30% e 50% das crianças com histórico de uma ITU sofrerão infecções recorrentes e, como o diagnóstico de refluxo frequentemente se segue a uma infecção do trato urinário, isso leva muitos indivíduos à suposição errônea de que o refluxo é responsável pela infecção. No entanto, em geral o refluxo não predispõe de forma significativa a infecções do trato urinário, a menos que seja de grau mais elevado.104,107 Mais frequentemente, as ITUs devem-se a condições predisponentes, como antecedente de infecções do trato urinário, sexo feminino, constipação, micções infrequentes, esvaziamento vesical incompleto ou imunidade comprometida. Vários estudos agora demonstram que crianças em profilaxia antibiótica, sem infecções de escape ou evidência de lesão renal, podem ser acompanhadas com segurança sem profilaxia antibiótica ou correção do VUR.103,104 especialmente após a disfunção intestinal e vesical ter sido otimizada.108
De modo geral, a profilaxia antibiótica diária parece ser segura e bem tolerada, mas acarreta custos e riscos potenciais. Ela tem sido associada a um risco 24 vezes maior de Escherichia coli resistente à trimetoprim-sulfametoxazol.109 Outros estudos demonstraram o surgimento de outras bactérias com altas taxas de resistência em crianças que recebem antibióticos profiláticos.110 Além da resistência, há outras preocupações quanto aos potenciais efeitos adversos do uso prolongado de antibióticos sobre o microbioma intestinal e urinário, bem como sobre o crescimento.111,112,113,114 Além disso, a adesão ao tratamento medicamentoso deve ser considerada. Um estudo de 2010 sugeriu que a taxa de adesão para apenas obter o medicamento prescrito foi de apenas 40%, sugerindo que muitos pacientes colocados em profilaxia antibiótica nunca chegam a receber o medicamento.115
O reconhecimento e o tratamento da disfunção vesical têm um papel importante no manejo conservador do RVU, seja isoladamente ou com profilaxia antibiótica. Atualmente, reconhece-se que o RVU secundário é mais adequadamente manejado ao se abordar a disfunção do trato urinário inferior.116
Vários grandes estudos prospectivos tentaram abordar a eficácia da intervenção cirúrgica versus profilaxia antibiótica. Esses estudos, em geral, não mostraram diferença significativa na função renal ou no crescimento, na progressão ou no desenvolvimento de novas cicatrizes, ou nas ITUs.23,36,107,117,118 Entretanto, sintomas de pielonefrite, incluindo ITUs febris, tenderam a ser mais comuns nos grupos tratados clinicamente.18,105,119 Em geral, as crianças que, por fim, foram submetidas à intervenção cirúrgica tenderam a desenvolver cicatrizes renais em idade mais precoce, mas, com seguimento mais prolongado, não ocorreu diferença significativa global quanto a novas cicatrizes renais entre aqueles tratados com antibióticos em comparação aos submetidos a cirurgia.24,120 Essas observações sugeriram que um benefício potencial poderia ser a redução de pielonefrite decorrente das cirurgias antirrefluxo para alguns pacientes; no entanto, outros pesquisadores sugeriram que, uma vez ocorrida a cicatrização renal, a doença tende a seguir seu curso e o tratamento cirúrgico tem pouco benefício.27,121 Uma revisão concluiu que seriam necessárias nove cirurgias de reimplante ureteral para prevenir uma ITU febril, sem redução no número de crianças que desenvolvem lesão renal,24 reforçando, mais uma vez, a necessidade de definir melhor quais crianças com VUR podem se beneficiar de intervenção. A intervenção cirúrgica é geralmente reservada para crianças com ITU de escape enquanto em profilaxia antibiótica, com piora da função renal, ou para aquelas em que outras considerações favorecem uma intervenção definitiva em vez da administração diária de antibióticos.
Manejo cirúrgico
Tratamento Endoscópico
Desde a aprovação pela FDA do uso do copolímero de dextranômero/ácido hialurônico (Dx/HA) (Deflux®, Q-Med, Uppsala, Suécia) em 2001 para o tratamento do RVU primário, os profissionais passaram a utilizar cada vez mais a injeção endoscópica como alternativa ao uso prolongado de antibióticos.122 O Dx/HA é o único tratamento injetável disponível comercialmente aprovado pela FDA para refluxo nos Estados Unidos. Trata-se de uma mistura sintética de microesferas de dextrano em um gel de ácido hialurônico que é injetada, utilizando diversas técnicas, na região dos óstios ureterais. O tamanho das partículas de dextranômero impede a migração linfática.123
A correção endoscópica do RVU oferece um procedimento minimamente invasivo, ambulatorial e com baixo risco de complicações. Embora seja um procedimento aparentemente simples, vários estudos demonstraram uma curva de aprendizado, com melhores resultados obtidos com o aumento da experiência.124,125,126 Outros fatores associados ao sucesso da correção endoscópica incluem menor grau de refluxo, menor UDR, ausência de disfunção intestinal e vesical, maior volume de Dx/HA injetado, avaliação visual da configuração do abaulamento após a injeção e a técnica cirúrgica.126,127,128,129 Estudos sobre técnica cirúrgica mostraram que a técnica de implantação com hidrodistensão dupla (HIT) permite taxas de sucesso mais altas do que outras técnicas, incluindo a técnica STING, aproximando-se das do reimplante ureteral.130
No curto prazo, as taxas de resolução do RVU em um único ureter tratado com Dx/HA variam de 59% a 95%.126,131 Se os pacientes forem submetidos a uma segunda injeção por RVU persistente, a taxa de sucesso melhora, mas uma terceira injeção raramente é curativa.122,124,132 Desfechos de longo prazo de pacientes com >5 anos de seguimento mostram taxas de resolução do RVU variando de 59-100%, influenciadas significativamente pelo grau do RVU, com taxas de ITU febril após a injeção variando de 4-25%.130 A VCUG de rotina para confirmar a resolução do RVU é controversa e não é considerada um requisito por alguns, a menos que o paciente seja considerado de alto risco para recorrência (RVU de alto grau, presença de ITU febril após a injeção, idade < 2 anos) ou se for preferência da família ou do cirurgião.133 Outros defendem realizar VCUG de forma seletiva apenas se um montículo não for visualizado à ultrassonografia. A ultrassonografia deve ser realizada no pós-operatório para descartar obstrução ureteral.134
Além da falha do tratamento, a calcificação do implante secundária a uma reação a corpo estranho foi recentemente relatada como outro potencial fator a longo prazo. A calcificação do montículo não é exclusiva do Dx/HA e foi descrita com muitos agentes injetados endoscopicamente.135,136 A calcificação pode ser confundida com ureterolitíase, e os profissionais de saúde devem manter um alto grau de suspeição para essa entidade a fim de evitar exames diagnósticos e intervenções cirúrgicas desnecessários.137 A obstrução ureteral após Dx/HA é raramente relatada (< 1%) e pode ocorrer logo após a cirurgia, mas também foi descrita até cinco anos no pós-operatório, ressaltando a importância do seguimento radiográfico contínuo dos pacientes após Deflux. A obstrução pode ser assintomática, apresentar-se com cólica renal ou infecção do trato urinário.138,139 Tipicamente, a obstrução requer reimplante ureteral com excisão do segmento afetado.139,140,141
Reimplante Ureteral
O tratamento cirúrgico do refluxo vesicoureteral evoluiu ao longo das últimas cinco décadas. Utiliza-se tipicamente uma incisão transversa no abdome inferior para a técnica aberta, deixando uma pequena cicatriz na prega cutânea, pouco perceptível. Numerosas técnicas cirúrgicas para reimplante ureteral têm sido utilizadas; as principais diferenças incluem abordagem intravesical (Figura 8) vs. extravesical. Não há documentação clara de que qualquer técnica específica seja superior,23 e a escolha de uma determinada técnica é tipicamente individualizada para a criança, a critério do cirurgião.
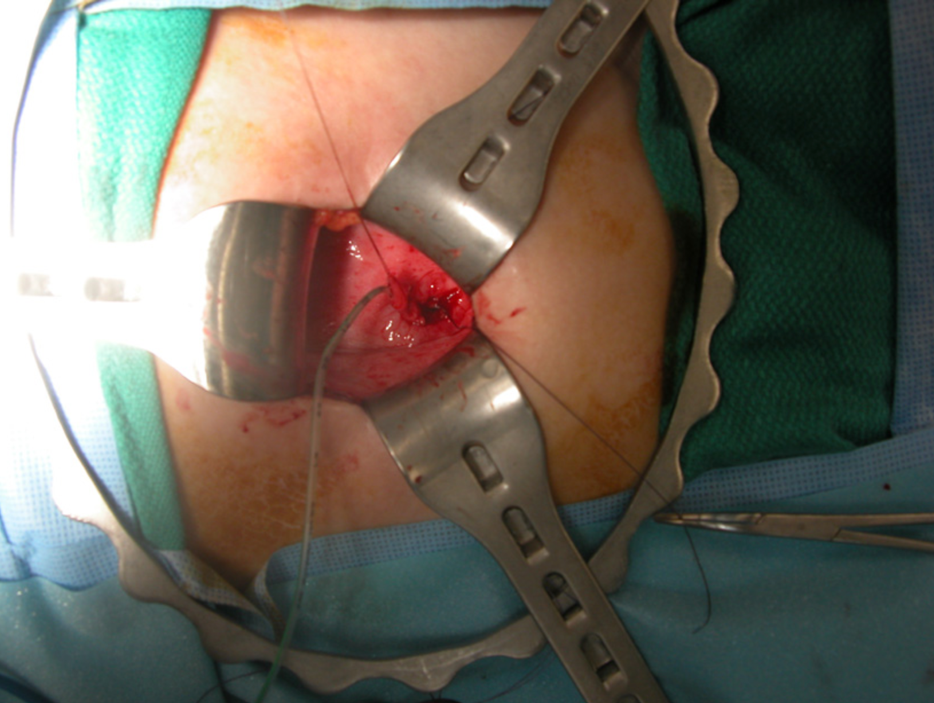
Figura 8 Reimplante ureteral intravesical
Avanços em analgesia, técnicas cirúrgicas e a compreensão de que crianças submetidas à reimplantação ureteral por RVU primária raramente necessitam de stents ureterais ou de drenagem vesical prolongada reduziram o tempo de permanência hospitalar e a morbidade do procedimento.142 Várias séries relatam pacientes submetidos tanto à reimplantação ureteral intravesical quanto extravesical em regime ambulatorial.143,144,145 Resultados de múltiplas séries documentam taxas de sucesso com a reimplantação ureteral aberta superiores a 95% e próximas de 100% para os graus mais baixos de refluxo.146,147,148 Os procedimentos de fato acarretam riscos anestésicos e potenciais complicações, incluindo obstrução ureteral, refluxo persistente, infecção e hemorragia.23 Princípios gerais da reimplantação ureteral incluem minimizar a manipulação do ureter, a excisão do segmento ureteral intravesical, a confecção de um túnel com pelo menos cinco vezes o diâmetro do lúmen ureteral e a criação de uma anastomose sem tensão. Em ureteres de grande calibre, pode ser necessário o afunilamento por meio de excisão ou plicatura para facilitar a obtenção de um túnel intravesical adequado.
Nos últimos anos, o reimplante ureteral extravesical laparoscópico assistido por robô tem sido cada vez mais utilizado, com benefícios citados de diminuição da dor e menor duração da internação no pós-operatório.149 Um estudo multi-institucional com 260 pacientes mostrou resolução radiográfica do refluxo vesicoureteral (RVU) em 88% dos pacientes, uma taxa global de complicações de 9,6% e uma taxa de 4% de retenção urinária após reimplante bilateral.150 Uma análise de dados em âmbito nacional mostrou maiores taxas de complicações (13% vs. 4,5%) e custos aumentados em comparação com os procedimentos abertos.151 Embora o uso do reimplante ureteral robótico continue em alguns centros, o uso da cirurgia aberta permanece o mais prevalente.152
Em pacientes nos quais se considera intervenção cirúrgica, o momento da cirurgia eletiva permanece tema de debate. A maioria dos estudos que avaliam as taxas de resolução espontânea do RVU acompanhou os pacientes por 5 anos. Embora esse marco temporal esteja presumivelmente baseado no fato de que a probabilidade de nefropatia por refluxo de novo diminui após os cinco anos de idade,153 muitos clínicos e famílias inferem que crianças que não apresentaram resolução do refluxo até essa idade devem ser submetidas a cirurgia corretiva. Entretanto, em crianças sem infecções, o momento da cirurgia pode frequentemente ser adiado; reimplantes ureterais em crianças pós-púberes e adultos têm sido relatados, com modificações na técnica cirúrgica devido às diferenças no biótipo entre adultos e crianças, mas com desfechos geralmente bons.154
Manejo individualizado
Embora o VUR possa ser definido de forma simples, pesquisas mais detalhadas confirmam que o refluxo não é uma condição única, mas sim ocorre com amplas variações de gravidade e impacto. As respostas para muitas questões relativas ao refluxo permanecem desconhecidas; contudo, é claro que o tratamento definitivo e mesmo o diagnóstico do VUR têm benefício clínico questionável para muitos pacientes. Atualmente, as decisões relativas ao tratamento baseiam-se na avaliação do médico e dos pais quanto aos riscos e benefícios. Embora a decisão de realizar cirurgia tenha sido tradicionalmente baseada predominantemente no grau do refluxo, uma decisão verdadeiramente informada deve considerar várias outras variáveis, como idade do paciente, sexo, histórico de ITU, estado funcional renal, probabilidade e momento da resolução espontânea e risco de ITU febril subsequente. Vários fatores prognósticos relativos à probabilidade de resolução espontânea do refluxo em crianças foram definidos.38,47,50,65 A situação social do paciente e as preferências dos pais, bem como a disposição para aderir tanto ao tratamento conservador quanto aos cuidados pós-operatórios, também devem ser levadas em consideração.
Tentar determinar a probabilidade e o momento da resolução espontânea do refluxo vesicoureteral (RVU) em uma criança em particular, levando em conta múltiplas variáveis prognósticas como idade, sexo, grau do RVU, razão do diâmetro ureteral (UDR), volume vesical no início do refluxo, presença de disfunção miccional, histórico de infecções do trato urinário (ITUs), presença de cicatrizes renais, lateralidade e duplicação é extremamente complexo. Para esse fim, uma rede neural de fácil utilização que incorpora muitos desses fatores preditivos está disponível para uso em http://pedsurocomp.lab.uiowa.edu (Figura 9)155
Figura 9 Rede neural que incorpora fatores preditivos para resolução do RVU
O uso e a acurácia deste modelo foram validados internacionalmente em um grupo de crianças japonesas.66 Para crianças que realizaram uma cintilografia renal, foi gerado um segundo modelo computacional incorporando os dados adicionais da cintilografia renal para melhorar a acurácia prognóstica e está disponível no mesmo site (http://pedsurocomp.lab.uiowa.edu).50
Perspectivas Futuras
Embora a maior precisão quanto à probabilidade e ao momento da resolução espontânea do RVU permita melhores decisões de manejo, são necessários dados adicionais. São necessários mais estudos para definir o risco individual de uma criança de desenvolver pielonefrite subsequente, lesão renal e, em última análise, sequelas clínicas. A continuidade da coleta de dados provenientes de grandes registros prospectivos multi-institucionais pode permitir uma melhor compreensão da história natural do RVU. Além disso, biomarcadores para detecção de refluxo vesicoureteral clinicamente significativo podem permitir determinar melhor aqueles que mais se beneficiam do tratamento ativo.
Pontos-chave
- Embora o Sistema Internacional de Classificação do Refluxo seja preditivo da resolução espontânea do RVU e da presença de cicatriz renal, ele apresenta baixa confiabilidade interobservador. Medidas radiográficas mais objetivas, além do grau, como a relação do diâmetro ureteral distal e o volume vesical no início do RVU, são preditivas de resolução espontânea e do risco de IVU de escape.
- Vários fatores clínicos e radiográficos que se mostraram preditivos dos desfechos clínicos do RVU são usados em diversas combinações em calculadoras de risco e redes neurais de fácil utilização, como http://pedsurocomp.lab.uiowa.edu, para permitir uma avaliação de risco individualizada mais precisa, a fim de otimizar o manejo dos pacientes.
- Crianças com cicatriz renal associada ao RVU têm maior probabilidade de desenvolver hipertensão, proteinúria e DRC e devem ser submetidas à vigilância rotineira da pressão arterial, exames de função renal e urinálise para proteinúria ao longo da vida adulta.
- CUM baseada apenas na presença de dilatação do trato urinário pré-natal frequentemente não é clinicamente útil e recomenda-se uma abordagem de decisão compartilhada com os pais que incorpore o risco de IVU com base em fatores clínicos e sonográficos adicionais (isto é, gravidade da hidronefrose, presença de hidroureter) para determinar se a criança deve ser submetida à CUM
- O controle adequado da disfunção intestinal e vesical desempenha um papel crucial no manejo conservador do refluxo vesicoureteral, com ou sem o uso de profilaxia antibiótica, e pode, em alguns casos, tornar desnecessária a intervenção cirúrgica.
- Além do desenvolvimento de bactérias resistentes a antibióticos, a profilaxia antibiótica crônica pode ter efeitos colaterais de longo prazo, incluindo impactos adversos sobre o microbioma intestinal e urinário normal, que podem influenciar o crescimento e o desenvolvimento na infância.
Referências
- Mathews R, Carpenter M, Chesney R. Controversies in the management of vesicoureteral reflux: the rationale for the RIVUR study. J Pediatr Urol 2009; 5 (5): 336–341. DOI: 10.1016/J.JPUROL.2009.05.010.
- Kaefer M, Curran M, Treves ST. Sibling vesicoureteral reflux in multiple gestation births. Pediatrics 2000; 105 (4 Pt 1): 800–804. DOI: 10.1542/PEDS.105.4.800.
- Smellie JM, Poulton A, Prescod NP. Retrospective study of children with renal scarring associated with reflux and urinary infection. 1994; 308 (6938): 1193–1196. DOI: 10.1136/bmj.308.6938.1193.
- Garin EH, Olavarria F, Nieto VG. Clinical significance of primary vesicoureteral reflux and urinary antibiotic prophylaxis after acute pyelonephritis: a multicenter, randomized, controlled study. Pediatrics 2006; 117 (3): 626–632. DOI: 10.1542/PEDS.2005-1362.
- Cooper CS, Austin JC. Vesicoureteral reflux: who benefits from surgery? Urol Clin North Am 2004; 31 (3): 535–541. DOI: 10.1016/j.ucl.2004.04.006.
- Mattoo TK. Vesicoureteral reflux and reflux nephropathy. Adv Chronic Kidney Dis 2011; 18 (5): 348–354. DOI: 10.1053/j.ackd.2011.07.006.
- Cornwell LB, Riddell JV, Mason MD. New-onset ESRD secondary to reflux nephropathy has decreased in incidence in the United States. J Pediatr Urol 2020; 16 (5). DOI: 10.1016/j.jpurol.2020.06.023.
- Zhang Y, Bailey RR. A long term follow up of adults with reflux nephropathy. N Z Med J 1995; 108 (998): 7761049.
- Hutch JA. Vesico-ureteral reflux in the paraplegic: cause and correction. J Urol 1952; 68 (2): 457–469. DOI: 10.1016/s0022-5347(05)65331-1.
- Hodson CJ. The radiological diagnosis of pyelonephritis. Proc R Soc Med 1959; 52 (8): 669–672.
- Kalayeh K, Fowlkes JB, Schultz WW. Ureterovesical junction deformation during urine storage in the bladder and the effect on vesicoureteral reflux. Journal of Biomechanics 2020. DOI: 10.1016/J.JBIOMECH.2020.110123.
- Paquin AJ. Ureterovesical anastomosis: the description and evaluation of a technique. J Urol 1959; 82 (5): 573–583. DOI: 10.1016/S0022-5347(17)65934-2.
- Koff SA. Relationship between dysfunctional voiding and reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37007-6.
- AM E, K D, E R. Genes in the ureteric budding pathway: association study on vesico-ureteral reflux patients. PLoS ONE 2012; 7 (4). DOI: 10.1371/journal.pone.0031327.
- Noe HN. The long-term results of prospective sibling reflux screening. J Urol 1992. DOI: 10.1016/s0022-5347(17)37017-9.
- Wan J, Greenfield SP, Ng M. Sibling reflux: a dual center retrospective study. J Urol 1996; 156 (2 Pt 2): 8683758. DOI: 10.1016/s0022-5347(01)65782-3.
- Noe HN. The relationship of sibling reflux to index patient dysfunctional voiding. J Urol 1988; 140 (1): 3379674. DOI: 10.1016/s0022-5347(17)41502-3.
- Weiss R, Duckett J, Spitzer A. Results of a randomized clinical trial of medical versus surgical management of infants and children with grades III and IV primary vesicoureteral reflux (United States. The International Reflux Study in Children J Urol 1992. DOI: 10.1016/s0022-5347(17)36998-7.
- Smellie JM. Reflections on 30 years of treating children with urinary tract infections. J Urol 1991; 146 (2 ( Pt 2): 10 1016 0022–5347 17 37889–37888. DOI: 10.1016/s0022-5347(17)37889-8.
- Nguyen HT, Bauer SB, Peters CA. 99m Technetium dimercapto-succinic acid renal scintigraphy abnormalities in infants with sterile high grade vesicoureteral reflux. J Urol 2000; 164 (5): 10 1016 0022–5347 05 67081–67084. DOI: 10.1097/00005392-200011000-00076.
- Patterson LT, Strife CF. Acquired versus congenital renal scarring after childhood urinary tract infection. J Pediatr 2000; 136 (1): 2–4. DOI: 10.1016/s0022-3476(00)90038-6.
- Bailey RR, Lynn KL, Smith AH. Long-term followup of infants with gross vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37010-6.
- Elder JS, Peters CA, Arant BS Jr.. Pediatric Vesicoureteral Reflux Guidelines Panel summary report on the management of primary vesicoureteral reflux in children. J Urol 1997; 157 (5): 9112544. DOI: 10.1097/00005392-199705000-00093.
- Hodson EM, Wheeler DM, Vimalchandra D. Interventions for primary vesicoureteric reflux. Cochrane Database Syst Rev 2007 (3). DOI: 10.1002/14651858.CD001532.pub3.
- Baker R, Maxted W, Maylath J. Relation of age, sex, and infection to reflux: Data indicating high spontaneous cure rate in pediatric patients. J Urol 1966; 95 (1): 10 1016 0022–5347 17 63403–63407. DOI: 10.1016/s0022-5347(17)63403-7.
- Ransley PG, Risdon RA. Reflux nephropathy: effects of antimicrobial therapy on the evolution of the early pyelonephritic scar. Kidney International 1981; 20 (6): 733–742. DOI: 10.1038/KI.1981.204.
- Winberg J. Management of primary vesico-ureteric reflux in children\–operation ineffective in preventing progressive renal damage. Infection 1994; 22 Suppl 1:S4-7. DOI: 10.1007/bf01716025.
- Sukamoto E, Itoh K, Morita K. Reappraisal of Tc-99m DMSA scintigraphy for follow up in children with vesicoureteral reflux. Ann Nucl Med 1999; 13 (6): 401–406. DOI: 10.1007/bf03164934.
- Naseer S SR, G.F.. New renal scars in children with urinary tract infections, vesicoureteral reflux and voiding dysfunction: a prospective evaluation. J Urol 1997; 158 (2): 9224361. DOI: 10.1016/s0022-5347(01)64552-x.
- Gordon I, Barkovics M, Pindoria S. Primary vesicoureteric reflux as a predictor of renal damage in children hospitalized with urinary tract infection: a systematic review and meta-analysis. J Am Soc Nephrol 2003; 14 (3): 739–744. DOI: 10.1097/01.asn.0000053416.93518.63.
- Lebowitz RL, Olbing H, Parkkulainen KV. International system of radiographic grading of vesicoureteric reflux. International Reflux Study in Children Pediatr Radiol 1985; 15 (2): 105–109. DOI: 10.1007/bf02388714.
- Schwab CW Jr., Wu HY, Selman H. Spontaneous resolution of vesicoureteral reflux: a 15-year perspective. J Urol 2002; 168 (6): 2594–2599. DOI: 10.1016/S0022-5347(05)64225-5.
- Hoberman A, Charron M, Hickey RW. Imaging Studies after a First Febrile Urinary Tract Infection in Young Children. New Engl J Med 2003; 348 (3): 195–202. DOI: 10.1056/NEJMoa021698.
- Ylinen E, Ala-Houhala M, Wikström S. Risk of renal scarring in vesicoureteral reflux detected either antenatally or during the neonatal period. Urology 2003; 61 (6): 1242–1243. DOI: 10.1016/s0090-4295(03)00229-2.
- Rolleston GL, Shannon FT, Utley WL. Relationship of infantile vesicoureteric reflux to renal damage. Br Med J 1970; 1 (5694): 460–463. DOI: 10.1136/bmj.1.5694.460.
- Duckett JW, Walker RD, Weiss R. Surgical results: International Reflux Study in Children\–United States branch. J Urol 1992. DOI: 10.1016/s0022-5347(17)36999-9.
- Berg UB. Long-term followup of renal morphology and function in children with recurrent pyelonephritis. J Urol 1992. DOI: 10.1016/s0022-5347(17)37012-x.
- Nepple KG, Knudson MJ, Austin JC. Abnormal renal scans and decreased early resolution of low grade vesicoureteral reflux. Suppl):1643-7; Discussion 1647 2008; 180(4. DOI: 10.1016/j.juro.2008.03.102.
- Metcalfe CB, Macneily AE, Afshar K. Reliability assessment of international grading system for vesicoureteral reflux. J Urol 2012; 188(4. DOI: 10.1016/j.juro.2012.02.015.
- Greenfield SP, Carpenter MA, Chesney RW. The RIVUR voiding cystourethrogram pilot study: experience with radiologic reading concordance. J Urol 2012; 188(4. DOI: 10.1016/j.juro.2012.06.032.
- Cooper CS, Alexander SE, Kieran K. Utility of the distal ureteral diameter on VCUG for grading VUR. J Pediatr Urol 2015; 11 (4). DOI: 10.1016/j.jpurol.2015.04.009.
- Arlen AM, Leong T, Guidos PJ. Distal Ureteral Diameter Ratio is Predictive of Breakthrough Febrile Urinary Tract Infection. J Urol 2017; 198 (6): 1418–1423. DOI: 10.1016/j.juro.2017.06.095.
- Cooper CS, Birusingh KK, Austin JC. Distal ureteral diameter measurement objectively predicts vesicoureteral reflux outcome. J Pediatr Urol 2013; 9 (1): 99–103. DOI: 10.1016/j.jpurol.2011.12.011.
- Arlen AM, Kirsch AJ, Leong T. Validation of the ureteral diameter ratio for predicting early spontaneous resolution of primary vesicoureteral reflux. J Pediatr Urol 2017; 13 (4). DOI: 10.1016/j.jpurol.2017.01.012.
- Troesch VL, Wald M, Bonnett MA. The additive impact of the distal ureteral diameter ratio in predicting early breakthrough urinary tract infections in children with vesicoureteral reflux. J Pediatr Urol 2021; 17 (2). DOI: 10.1016/j.jpurol.2021.01.003.
- Alexander SE, Arlen AM, Storm DW. Bladder volume at onset of vesicoureteral reflux is an independent risk factor for breakthrough febrile urinary tract infection. J Urol 2015; 193 (4): 1342–1346. DOI: 10.1016/j.juro.2014.10.002.
- McMillan ZM, Austin JC, Knudson MJ. Bladder volume at onset of reflux on initial cystogram predicts spontaneous resolution. J Urol 2006. DOI: 10.1016/s0022-5347(06)00619-7.
- Nepple KG, Knudson MJ, Austin JC. Adding renal scan data improves the accuracy of a computational model to predict vesicoureteral reflux resolution. Suppl):1648-52; Discussion 1652 DOI: 101016/Jjuro200803109 PMID 2008; 180(4: 1648–1652. DOI: 10.1016/j.juro.2008.03.109.
- Knudson MJ, Austin JC, Wald M. Computational model for predicting the chance of early resolution in children with vesicoureteral reflux. Pt 2):1824-7 DOI: 101016/Jjuro200705093 PMID 2007; 178: 1824–1827. DOI: 10.1016/j.juro.2007.05.093.
- Knudson MJ, Austin JC, McMillan ZM. Predictive factors of early spontaneous resolution in children with primary vesicoureteral reflux. J Urol 2007; 178(4. DOI: 10.1016/j.juro.2007.03.161.
- KJ A, MT M, JC A. Nuclear cystometrogram-determined bladder pressure at onset of vesicoureteral reflux predicts spontaneous resolution. Urology 2007; 69 (4): 767–770. DOI: 10.1016/j.urology.2007.01.048.
- Cooper CS, Madsen MT, Austin JC. Bladder pressure at the onset of vesicoureteral reflux determined by nuclear cystometrogram. J Urol 2003; 170: 1537–1540. DOI: 10.1097/01.ju.0000083638.36182.5e.
- Arsanjani A, Alagiri M. Identification of filling versus voiding reflux as predictor of clinical outcome. Urology 2007; 70 (2): 351–354. DOI: 10.1016/j.urology.2007.03.031.
- Garcia-Roig M, Ridley DE, McCracken C. Vesicoureteral Reflux Index: Predicting Primary Vesicoureteral Reflux Resolution in Children Diagnosed after Age 24 Months. J Urol 2017; 197 (4): 1150–1157. DOI: 10.1016/j.juro.2016.12.008.
- Arlen AM, Leong T, Wu CQ. Predicting Breakthrough Urinary Tract Infection: Comparative Analysis of Vesicoureteral Reflux Index, Reflux Grade and Ureteral Diameter Ratio. J Urol 2020; 204 (3): 572–577. DOI: 10.1097/JU.0000000000001035.
- Keren R, Shaikh N, Pohl H. Risk Factors for Recurrent Urinary Tract Infection and Renal Scarring. Pediatrics 2015; 136 (1). DOI: 10.1542/peds.2015-0409.
- Lenaghan D, Whitaker JG, Jensen F. The natural history of reflux and long-term effects of reflux on the kidney. J Urol 1976; 115 (6): 10 1016 0022–5347 17 59352–59350. DOI: 10.1016/s0022-5347(17)59352-0.
- Olbing H, Claësson I, Ebel KD. Renal scars and parenchymal thinning in children with vesicoureteral reflux: a 5-year report of the International Reflux Study in Children (European branch. J Urol 1992. DOI: 10.1016/s0022-5347(17)36995-1.
- Mingin GC, Nguyen HT, Baskin LS. Abnormal dimercapto-succinic acid scans predict an increased risk of breakthrough infection in children with vesicoureteral reflux. J Urol 2004; 172 (3): 1075–1077. DOI: 10.1097/01.ju.0000135750.17348.e4.
- Loukogeorgakis SP, Burnand K, MacDonald A. Renal scarring is the most significant predictor of breakthrough febrile urinary tract infection in patients with simplex and duplex primary vesico-ureteral reflux. J Pediatr Urol 2020; 16 (2). DOI: 10.1016/j.jpurol.2019.11.018.
- Wallace DM, Rothwell DL, Williams DI. The long-term follow-up of surgically treated vesicoureteric reflux. Br J Urol 1978; 50 (7): 10 1111 1464–1410 1978 06195. DOI: 10.1111/j.1464-410x.1978.tb06195.x.
- Edwards D, Normand IC, Prescod N. Disappearance of vesicoureteric reflux during long-term prophylaxis of urinary tract infection in children. Br Med J 1977; 2 (6082): 285–288. DOI: 10.1136/bmj.2.6082.285.
- Jodal U, Lindberg U. Guidelines for management of children with urinary tract infection and vesico-ureteric reflux. Recommendations from a Swedish state-of-the-art conference. Swedish Medical Research Council Acta Paediatr Suppl 1999; 88 (431): 87–89. DOI: 10.1111/j.1651-2227.1999.tb01323.x.
- Mor Y, Leibovitch I, Zalts R. Analysis of the long-term outcome of surgically corrected vesico-ureteric reflux. BJU Int 2003; 92 (1): 10 1046 1464–1410 2003 04264. DOI: 10.1046/j.1464-410x.2003.04264.x.
- Lebowitz RL. The detection and characterization of vesicoureteral reflux in the child. J Urol 1992. DOI: 10.1016/s0022-5347(17)36991-4.
- Dalirani R, Mahyar A, Sharifian M. The value of direct radionuclide cystography in the detection of vesicoureteral reflux in children with normal voiding cystourethrography. Pediatr Nephrol 2014; 29 (12): 10 1007 00467–00014–2871–. DOI: 10.1007/s00467-014-2871-y.
- McLaren CJ, Simpson ET. Direct comparison of radiology and nuclear medicine cystograms in young infants with vesico-ureteric reflux. BJU Int 2001; 87 (1): 10 1046 1464–1410 2001 00997. DOI: 10.1046/j.1464-410x.2001.00997.x.
- Frimberger D, Mercado-Deane MG, McKenna PH. Establishing a Standard Protocol for the Voiding Cystourethrography. Pediatrics 2016; 138 (5): 10 1542 2016–2590. DOI: 10.1542/9781610021494-part05-establishing_a_stand.
- Strauss KJ, Kaste SC. The ALARA (as low as reasonably achievable) concept in pediatric interventional and fluoroscopic imaging: striving to keep radiation doses as low as possible during fluoroscopy of pediatric patients\–a white paper executive summary. Radiology 2006; 240 (3): 621–622. DOI: 10.1148/radiol.2403060698.
- Arant BS Jr. Vesicoureteral reflux and evidence-based management. J Pediatr 2001; 139 (5): 620–621. DOI: 10.1067/mpd.2001.119451.
- Shiraishi K, Matsuyama H, Nepple KG. Validation of a prognostic calculator for prediction of early vesicoureteral reflux resolution in children. J Urol 2009; 182 (2): 690–691. DOI: 10.1016/j.juro.2009.04.036.
- Kim D, Choi YH, Choi G. Contrast-enhanced voiding urosonography for the diagnosis of vesicoureteral reflux and intrarenal reflux: a comparison of diagnostic performance with fluoroscopic voiding cystourethrography. Ultrasonography 2021; 40 (4): 530–537. DOI: 10.14366/usg.20157.
- Ntoulia A, Back SJ, Shellikeri S. Contrast-enhanced voiding urosonography (ceVUS) with the intravesical administration of the ultrasound contrast agent OptisonTM for vesicoureteral reflux detection in children: a prospective clinical trial. Pediatr Radiol 2018; 48 (2): 10 1007 00247–00017–4026–4023. DOI: 10.1007/s00247-017-4026-3.
- Elison BS, Taylor D, Wall H. Comparison of DMSA scintigraphy with intravenous urography for the detection of renal scarring and its correlation with vesicoureteric reflux. Br J Urol 1992; 69 (3): 10 1111 1464–1410 1992 15532. DOI: 10.1111/j.1464-410x.1992.tb15532.x.
- Majd M, Nussbaum Blask AR, Markle BM. Acute pyelonephritis: comparison of diagnosis with 99mTc-DMSA, SPECT, spiral CT, MR imaging, and power Doppler US in an experimental pig model. Radiology 2001; 218 (1): 101–108. DOI: 10.1148/radiology.218.1.r01ja37101.
- Hamoui N, Hagerty JA, Maizels M. Ultrasound fails to delineate significant renal pathology in children with urinary tract infections: a case for dimercapto-succinic acid scintigraphy. Suppl):1639-42; Discussion 1642 2008; 180(4. DOI: 10.1016/j.juro.2008.03.119.
- Smokvina A, Grbac-Ivanković S, Girotto N. The renal parenchyma evaluation: MAG3 vs. DMSA Coll Antropol 2005; 29 (2): 649–654.
- Sfakianakis GN, Cavagnaro F, Zilleruelo G. Diuretic MAG3 scintigraphy (F0) in acute pyelonephritis: regional parenchymal dysfunction and comparison with DMSA. J Nucl Med 2000; 41 (12): 1955–1963.
- Gordon I, Anderson PJ, Lythgoe MF. Can technetium-99m-mercaptoacetyltriglycine replace technetium-99m-dimercaptosuccinic acid in the exclusion of a focal renal defect? J Nucl Med 1992; 33 (12): 1334134.
- Lee RS, Cendron M, Kinnamon DD. Antenatal hydronephrosis as a predictor of postnatal outcome: a meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/PEDS.2006-0120.
- Herndon CDA, McKenna PH, Kolon TF. A multicenter outcomes analysis of patients with neonatal reflux presenting with prenatal hydronephrosis. J Urol 1999; 162 (3 Pt 2): 1203–1208. DOI: 10.1097/00005392-199909000-00096.
- Nguyen HT, Herndon CDA, Cooper C. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. J Pediatr Urol 2010; 6 (3): 212–231. DOI: 10.1016/J.JPUROL.2010.02.205.
- Upadhyay J, McLorie GA, Bolduc S. Natural history of neonatal reflux associated with prenatal hydronephrosis: Long-term results of a prospective study. J Urol 2003; 169 (5): 1837–1841. DOI: 10.1097/01.ju.0000062440.92454.cf.
- Berrocal T, Pinilla I, Gutiérrez J. Mild hydronephrosis in newborns and infants: can ultrasound predict the presence of vesicoureteral reflux. Pediatr Nephrol 2007; 22 (1): 91–96. DOI: 10.1007/S00467-006-0285-1.
- Farhat W, McLorie G, Geary D. The natural history of neonatal vesicoureteral reflux associated with antenatal hydronephrosis. J Urol 2000; 164 (3 Pt 2): 1057–1060. DOI: 10.1097/00005392-200009020-00033.
- M A, K W-L, BK V. Society for fetal urology recommendations for postnatal evaluation of prenatal hydronephrosis\–will fewer voiding cystourethrograms lead to more urinary tract infections? J Urol 2013. DOI: 10.1016/J.JURO.2013.03.038.
- Braga LH, Farrokhyar F, DĆruz J. Risk factors for febrile urinary tract infection in children with prenatal hydronephrosis: a prospective study. J Urol 2015. DOI: 10.1016/J.JURO.2014.10.091.
- Zee RS, Herndon CDA, Cooper CS. Time to resolution: A prospective evaluation from the Society for Fetal Urology hydronephrosis registry. J Pediatr Urol 2017; 13 (3). DOI: 10.1016/J.JPUROL.2016.12.012.
- Silay MS, Undre S, Nambiar AK. Role of antibiotic prophylaxis in antenatal hydronephrosis: A systematic review from the European Association of Urology/European Society for Paediatric Urology Guidelines Panel. J Pediatr Urol 2017; 13 (3): 306–315. DOI: 10.1016/J.JPUROL.2017.02.023.
- Braga LH, Mijovic H, Farrokhyar F. Antibiotic prophylaxis for urinary tract infections in antenatal hydronephrosis. Pediatrics 2013; 131 (1): 10 1542 2012–1870. DOI: 10.1542/peds.2012-1870.
- Easterbrook B, Capolicchio JP, Braga LH. Antibiotic prophylaxis for prevention of urinary tract infections in prenatal hydronephrosis: An updated systematic review. Can Urol Assoc J 2017; 11 (1-2Suppl1). DOI: 10.5489/CUAJ.4384.
- Zareba P, Lorenzo AJ, Braga LH. Risk factors for febrile urinary tract infection in infants with prenatal hydronephrosis: comprehensive single center analysis. J Urol 2014. DOI: 10.1016/J.JURO.2013.10.035.
- Coelho GM, Bouzada MCF, Pereira AK. Outcome of isolated antenatal hydronephrosis: a prospective cohort study. Pediatr Nephrology 2007; 22 (10): 1727–1734. DOI: 10.1007/S00467-007-0539-6.
- Szymanski KM, Al-Said AN, Pippi Salle JL. Do infants with mild prenatal hydronephrosis benefit from screening for vesicoureteral reflux? J Urol 2012; 188 (2): 576–581. DOI: 10.1016/J.JURO.2012.04.017.
- Routh JC, Grant FD, Kokorowski P. Costs and consequences of universal sibling screening for vesicoureteral reflux: decision analysis. Pediatrics 2010; 126 (5): 10 1542 2010–0744. DOI: 10.1542/peds.2010-0744d.
- Hunziker M, Colhoun E, Puri P. Renal cortical abnormalities in siblings of index patients with vesicoureteral reflux. Pediatrics 2014; 133 (4): 10 1542 2013–3498. DOI: 10.1542/peds.2013-3498d.
- Nelson CP, Finkelstein JA, Logvinenko T. Incidence of Urinary Tract Infection Among Siblings of Children With Vesicoureteral Reflux. Acad Pediatr 2016; 16 (5): 489–495. DOI: 10.1016/j.acap.2015.11.003.
- Skoog SJ, Peters CA, Arant BS Jr.. Pediatric Vesicoureteral Reflux Guidelines Panel Summary Report: Clinical Practice Guidelines for Screening Siblings of Children With Vesicoureteral Reflux and Neonates/Infants With Prenatal Hydronephrosis. J Urol 2010; 184 (3): 1145–1151. DOI: 10.1016/j.juro.2010.05.066.
- Urinary Tract Infection SCoQI S, Management RKB. Urinary Tract Infection: Clinical Practice Guideline for the Diagnosis and Management of the Initial UTI in Febrile Infants and Children 2 to 24 Months. Pediatrics 2011; 128 (3): 595–610. DOI: 10.1542/peds.2011-1330.
- Mattoo TK, Carpenter MA, Moxey-Mims M. The RIVUR trial: a factual interpretation of our data. Pediatr Nephrol 2015; 30 (5): 10 1007 00467–00014–3022–3021. DOI: 10.1007/s00467-014-3022-1.
- Shaikh N, Haralam MA, Kurs-Lasky M. Association of Renal Scarring With Number of Febrile Urinary Tract Infections in Children. JAMA Pediatrics 2019; 173 (10): 949–952. DOI: 10.1001/JAMAPediatrics.2019.2504.
- Coulthard MG, Flecknell P, Orr H. Renal scarring caused by vesicoureteric reflux and urinary infection: a study in pigs. Pediatr Nephrol 2002; 17 (7): 10 1007 00467–00002–0878–0872. DOI: 10.1007/s00467-002-0878-2.
- Montini G, Rigon L, Zucchetta P. Prophylaxis after first febrile urinary tract infection in children? A multicenter, randomized, controlled, noninferiority trial. Pediatrics 2008; 122 (5): 1064–1071. DOI: 10.1542/peds.2007-3770.
- Pennesi M, Travan L, Peratoner L. Is antibiotic prophylaxis in children with vesicoureteral reflux effective in preventing pyelonephritis and renal scars? A randomized, controlled trial. Pediatrics 2008; 121 (6): 10 1542 2007–2652. DOI: 10.1542/peds.2008-2339.
- Roussey-Kesler G, Gadjos V, Idres N. Antibiotic prophylaxis for the prevention of recurrent urinary tract infection in children with low grade vesicoureteral reflux: Results from a prospective randomized study. J Urol 2008; 179 (2): 674–679. DOI: 10.1016/J.JURO.2007.09.090.
- Conway PH, Cnaan A, Zaoutis T. Recurrent urinary tract infections in children: risk factors and association with prophylactic antimicrobials. JAMA 2007; 298 (2): 179–186. DOI: 10.1001/jama.298.2.179.
- Investigators RT, Hoberman A, Greenfield SP. Antimicrobial Prophylaxis for Children with Vesicoureteral Reflux. New Engl J Med 2014; 370 (25): 2367–2376. DOI: 10.1056/NEJMoa1401811.
- Cooper CS, Chung BI, Kirsch AJ. The outcome of stopping prophylactic antibiotics in older children with vesicoureteral reflux. J Urol 2000; 163 (1): 269–273. DOI: 10.1016/S0022-5347(05)68034-2.
- Thompson RH, Chen JJ, Pugach J. Cessation of prophylactic antibiotics for managing persistent vesicoureteral reflux. J Urol 2001; 166 (4): 1465–1469. DOI: 10.1097/00005392-200110000-00072.
- Jodal U, Koskimies O, Hanson E. Infection pattern in children with vesicoureteral reflux randomly allocated to operation or long-term antibacterial prophylaxis. The International Reflux Study in Children. J Urol 1992. DOI: 10.1016/s0022-5347(17)36994-x.
- Bailey RR. Commentary: the management of grades I and II (nondilating) vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37004-0.
- A prospective trial of operative versus non-operative treatment of severe vesico-ureteric reflux: 2 years\’observation in 96 children. The Birmingham Reflux Study Group. Contrib Nephrol 1984; 39 (169-85): 6744870. DOI: 10.1136/bmj.295.6592.237.
- Leslie B, Moore K, Salle JL. Outcome of antibiotic prophylaxis discontinuation in patients with persistent vesicoureteral reflux initially presenting with febrile urinary tract infection: time to event analysis. J Urol 2010; 184 (3): 1093–1098. DOI: 10.1016/j.juro.2010.05.013.
- Allen UD, MacDonald N, Fuite L. Risk factors for resistance to f́irst-line\’antimicrobials among urinary tract isolates of Escherichia coli in children. CMAJ 1999; 160 (10): 1436–1440.
- Cheng CH, Tsai MH, Huang YC. Antibiotic Resistance Patterns of Community-Acquired Urinary Tract Infections in Children With Vesicoureteral Reflux Receiving Prophylactic Antibiotic Therapy. Pediatrics 2008; 122 (6): 1212–1217. DOI: 10.1542/peds.2007-2926.
- Cooper CS. Fat, demented and stupid: An unrecognized legacy of pediatric urology? J Pediatr Urol 2017; 13 (4): 341–344. DOI: 10.1016/J.JPUROL.2017.04.027.
- Guidos PJ, Arlen AM, Leong T. Impact of continuous low-dose antibiotic prophylaxis on growth in children with vesicoureteral reflux. J Pediatr Urol 2018; 14 (4). DOI: 10.1016/J.JPUROL.2018.07.007.
- Gaither TW, Cooper CS, Kornberg Z. Predictors of becoming overweight among pediatric patients at risk for urinary tract infections. J Pediatr Urol 2019; 15 (1). DOI: 10.1016/J.JPUROL.2018.09.002.
- Akagawa Y, Kimata T, Akagawa S. Impact of Long-Term Low Dose Antibiotic Prophylaxis on Gut Microbiota in Children. J Urol 2020; 204 (6): 1320–1325. DOI: 10.1097/JU.0000000000001227.
- Copp HL, Nelson CP, Shortliffe LD. Compliance with antibiotic prophylaxis in children with vesicoureteral reflux: results from a national pharmacy claims database. J Urol 2010; 183 (5): 1994–2000. DOI: 10.1016/J.JURO.2010.01.036.
- Fast AM, Nees SN, Batavia JP. Outcomes of targeted treatment for vesicoureteral reflux in children with nonneurogenic lower urinary tract dysfunction. J Urol 2013; 190 (3): 1028–1032. DOI: 10.1016/j.juro.2013.03.005.
- Smellie JM. Commentary: management of children with severe vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37000-3.
- J BM, editor. Prospective trial of operative versus non-operative treatment of severe vesicoureteric reflux in children: five years\’observation. Birmingham Reflux Study Group. 1987; 295 (6592): 237–241. DOI: 10.1136/bmj.295.6592.237.
- Elo J, Tallgren LG, Alfthan O. Character of urinary tract infections and pyelonephritic renal scarring after antireflux surgery. J Urol 1983; 129 (2): 6834504. DOI: 10.1016/s0022-5347(17)52089-3.
- Belman AB. Vesicoureteral reflux. Pediatr Clin North Am 1997; 44 (5): 9326957. DOI: 10.53347/rid-12076.
- Ransley PG, Risdon RA. The pathogenesis of reflux nephropathy. Contrib Nephrol 1979; 16: 90–97. DOI: 10.1159/000402880.
- Molitierno JA, Scherz HC, Kirsch AJ. Endoscopic treatment of vesicoureteral reflux using dextranomer hyaluronic acid copolymer. J Pediatr Urol 2008; 4 (3): 221–228. DOI: 10.1016/j.jpurol.2007.11.015.
- Stenberg AM, Sundin A, Larsson BS. Lack of distant migration after injection of a 125iodine labeled dextranomer based implant into the rabbit bladder. J Urol 1997; 158 (5): 10 1016 0022–5347 01 64185–64185. DOI: 10.1016/s0022-5347(01)64185-5.
- Läckgren G, Wåhlin N, Sköldenberg E. Long-term followup of children treated with dextranomer/hyaluronic acid copolymer for vesicoureteral reflux. J Urol 2001; 166 (5): 10 1016 0022–5347 05 65713–65718. DOI: 10.1097/00005392-200111000-00076.
- Kirsch AJ, Perez-Brayfield MR, Scherz HC. Minimally invasive treatment of vesicoureteral reflux with endoscopic injection of dextranomer/hyaluronic acid copolymer: the Childrenś Hospitals of Atlanta experience. J Urol 2003; 170 (1): 211–215. DOI: 10.1097/01.ju.0000072523.43060.a0.
- Dave S, Lorenzo AJ, Khoury AE. Learning from the learning curve: factors associated with successful endoscopic correction of vesicoureteral reflux using dextranomer/hyaluronic acid copolymer. J Urol 2008; 180(4: 1594–1599. DOI: 10.1016/j.juro.2008.03.084.
- Kirsch AJ, Perez-Brayfield M, Smith EA. The modified sting procedure to correct vesicoureteral reflux: improved results with submucosal implantation within the intramural ureter. J Urol 2004; 171 (6 Pt 1): 2413–2416. DOI: 10.1097/01.ju.0000127754.79866.7f.
- McMann LP, Scherz HC, Kirsch AJ. Long-term preservation of dextranomer/hyaluronic acid copolymer implants after endoscopic treatment of vesicoureteral reflux in children: a sonographic volumetric analysis. J Urol 2007; 177 (1): 320. DOI: 10.1016/j.juro.2006.08.144.
- Baydilli N, Selvi I, Pinarbasi AS. Additional VCUG-related parameters for predicting the success of endoscopic injection in children with primary vesicoureteral reflux. J Pediatr Urol 2021; 17 (1). DOI: 10.1016/j.jpurol.2020.11.018.
- Kirsch AJ, Cooper CS, Läckgren G. Non-Animal Stabilized Hyaluronic Acid/Dextranomer Gel (NASHA/Dx, Deflux) for Endoscopic Treatment of Vesicoureteral Reflux: What Have We Learned Over the Last 20 Years? Urology 2021; 157: 15–28. DOI: 10.1016/j.urology.2021.07.032.
- Routh JC, Inman BA, Reinberg Y. Dextranomer/hyaluronic acid for pediatric vesicoureteral reflux: systematic review. Pediatrics 2010; 125 (5): 10 1542 2009–2225. DOI: 10.1016/j.yped.2011.04.057.
- Elder JS, Diaz M, Caldamone AA. Endoscopic therapy for vesicoureteral reflux: a meta-analysis. I. Reflux resolution and urinary tract infection. J Urol 2006; 175 (2): 10 1016 0022–5347 05 00210–00217. DOI: 10.1016/s0084-4071(08)70406-8.
- Arlen AM, Scherz HC, Filimon E. Is routine voiding cystourethrogram necessary following double hit for primary vesicoureteral reflux? J Pediatr Urol 2015; 11 (1). DOI: 10.1016/j.jpurol.2014.11.011.
- Wang PZT, Abdelhalim A, Walia A. Avoiding routine postoperative voiding cystourethrogram: Predicting radiologic success for endoscopically treated vesicoureteral reflux. Can Urol Assoc J 2019; 13 (5). DOI: 10.5489/cuaj.5589.
- Knudson MJ, Cooper CS, Block CA. Calcification of glutaraldehyde cross-linked collagen in bladder neck injections in children with incontinence: a long-term complication. J Urol 2006; 176 (3): 1143–1146. DOI: 10.1016/j.juro.2006.04.059.
- Gargollo PC, Paltiel HJ, Rosoklija I. Mound calcification after endoscopic treatment of vesicoureteral reflux with autologous chondrocytes\–a normal variant of mound appearance? J Urol 2009; 181 (6): 2707–2708. DOI: 10.1016/j.juro.2009.02.053.
- Noe HN. Calcification in a Deflux bleb thought to be a ureteral calculus in a child. J Pediatr Urol 2008; 4 (1): 88–89. DOI: 10.1016/j.jpurol.2007.02.005.
- Vandersteen DR, Routh JC, Kirsch AJ. Postoperative ureteral obstruction after subureteral injection of dextranomer/hyaluronic Acid copolymer. J Urol 2006; 176(4. DOI: 10.1016/j.juro.2006.06.101.
- Papagiannopoulos D, Rosoklija I, Cheng E. Delayed Obstruction With Asymptomatic Loss of Renal Function After Dextranomer/Hyaluronic Acid Copolymer (Deflux) Injection for Vesicoureteral Reflux: A Close Look at a Disturbing Outcome. Urology 2017; 101: 63–66. DOI: 10.1016/j.urology.2016.09.013.
- Romain J, Fourcade L, Centi J. Delayed-onset Ureteral Obstruction and Calcification Masquerading as Renal Colic Following Deflux Injection. Urology 2016; 94: 218–220. DOI: 10.1016/j.urology.2016.03.001.
- Christen S, Mendoza M, Gobet R. Late ureteral obstruction after injection of dextranomer/hyaluronic acid copolymer. Urology 2014; 83 (4): 920–922. DOI: 10.1016/j.urology.2013.10.053.
- Austin JC, Cooper CS. Vesicoureteral reflux: surgical approaches. Urol Clin North Am 2004; 31 (3): 543–557. DOI: 10.1016/j.ucl.2004.04.018.
- Sprunger JK, Reese CT, Decter RM. Can standard open pediatric urological procedures be performed on an outpatient basis? J Urol 2001; 166 (3): 1062–1064. DOI: 10.1097/00005392-200109000-00083.
- Marotte JB, Smith DP. Extravesical ureteral reimplantations for the correction of primary reflux can be done as outpatient procedures. J Urol 2001; 165 (6 Pt 2): 10 1097 00005392–200106001–00003. DOI: 10.1016/s0022-5347(05)66171-x.
- Palmer JS. Bilateral extravesical ureteral reimplantation in toilet-trained children: short-stay procedure without urinary retention. Urology 2009; 73 (2): 285–288. DOI: 10.1016/j.urology.2008.07.046.
- Barrieras D, Lapointe S, Reddy PP. Are postoperative studies justified after extravescial ureteral reimplantation? J Urol 2000; 164(3. DOI: 10.1097/00005392-200009020-00035.
- Bisignani G, Decter RM. Voiding cystourethrography after uncomplicated ureteral reimplantation in children: is it necessary? J Urol 1997; 158(3. DOI: 10.1016/s0022-5347(01)64437-9.
- El-Ghoneimi A, Odet E, Lamer S. Cystography after the Cohen ureterovesical reimplantation: is it necessary at a training center? J Urol 1999; 162(3. DOI: 10.1016/s0022-5347(01)68133-3.
- Harel M, Herbst KW, Silvis R. Objective pain assessment after ureteral reimplantation: comparison of open versus robotic approach. J Pediatr Urol 2015; 11 (2). DOI: 10.1016/j.jpurol.2014.12.007.
- Boysen WR, Ellison JS, Kim C. Multi-Institutional Review of Outcomes and Complications of Robot-Assisted Laparoscopic Extravesical Ureteral Reimplantation for Treatment of Primary Vesicoureteral Reflux in Children. J Urol 2017; 197 (6): 1555–1561. DOI: 10.1016/j.juro.2017.01.062.
- Kurtz MP, Leow JJ, Varda BK. Robotic versus open pediatric ureteral reimplantation: Costs and complications from a nationwide sample. J Pediatr Urol 2016; 12 (6). DOI: 10.1016/j.jpurol.2016.06.016.
- Bowen DK, Faasse MA, Liu DB. Use of Pediatric Open, Laparoscopic and Robot-Assisted Laparoscopic Ureteral Reimplantation in the United States: 2000 to 2012. J Urol 2016; 196 (1): 207–212. DOI: 10.1016/j.juro.2016.02.065.
- Rolleston GL, Maling TM, Hodson CJ. Intrarenal reflux and the scarred kidney. Arch Dis Child 1974; 49 (7): 531–539. DOI: 10.1136/adc.49.7.531.
- Austin JC. Treatment of vesicoureteral reflux after puberty. Adv Urol 2008; 2008 (590185). DOI: 10.1155/2008/590185.
Ultima atualização: 2025-09-21 13:35