6: Considerações sobre Anestesia Geral em Crianças
Este capítulo levará aproximadamente 29 minutos para ler.
Introdução
Os procedimentos de urologia pediátrica abrangem uma ampla variedade de tipos de pacientes, abordagens cirúrgicas e um amplo espectro de requisitos e abordagens anestésicas. Os planos anestésicos podem variar, incluindo anestesia para procedimentos cirúrgicos ambulatoriais no mesmo dia em pacientes saudáveis com uma condição urológica isolada ou podem ser mais extensos e complexos.
A anestesia em pacientes com condições médicas complexas ou em casos que envolvam múltiplas etapas de intervenção cirúrgica pode incluir analgesia multimodal, diversas técnicas de bloqueio anestésico neuraxial ou regional, além da anestesia geral, e pode exigir internação hospitalar, onde podem ser oferecidos serviços de dor aguda no pós-operatório. Pacientes com condições médicas complexas podem se beneficiar de uma consulta no ambulatório de pré-anestesia ou no de otimização pré-operatória para garantir que todas as informações de acompanhamento estejam atualizadas (por exemplo, ecocardiograma e liberação cardiológica em pacientes com cardiopatia congênita) e para permitir a conclusão, em tempo hábil, de quaisquer exames laboratoriais ou de imagem necessários.
Uma boa comunicação pré-operatória entre as equipes cirúrgica e de anestesia é ideal e pode incluir quaisquer necessidades perioperatórias especiais, admissão pós-operatória prevista ou questões relacionadas à dor.
Os pais podem ter acessado informações sobre anestesia online ou podem ter perguntas para o urologista sobre anestésicos. Esses pais geralmente podem ser tranquilizados de que conversarão com um profissional de anestesia no dia da cirurgia, ou podem receber as informações de contato do grupo de anestesia para outras dúvidas.
Avaliação Pré-operatória
Ansiólise
A ansiedade pré-operatória em crianças pode resultar em morbidade significativa e alterações comportamentais pós-operatórias. Dados dos EUA e da Europa mostraram que até 54% dos pacientes apresentarão ansiedade geral, pesadelos, choro noturno, enurese, ansiedade de separação e crises de birra por 2 semanas após o procedimento cirúrgico. Algumas crianças continuam a apresentar alterações comportamentais desadaptativas de 6 meses a 1 ano após o procedimento. A qualidade da experiência médica é crucial para limitar as alterações comportamentais pós-operatórias e reduzir a ansiedade em visitas subsequentes. Vários métodos estão disponíveis para ajudar a diminuir a ansiedade pré-operatória dos pacientes e melhorar sua experiência perioperatória.1
Tanto os agentes farmacológicos quanto as tecnologias de distração podem ser eficazes em crianças ansiosas.2 A ansiedade de separação começa por volta de 1 ano de idade. A ansiedade situacional atinge o pico na criança em idade pré-escolar. Portanto, administramos um ansiolítico oral (como solução oral de midazolam, 0,5–0,75 mg/kg) na área de espera pré-operatória 15–30 minutos antes da indução da anestesia inalatória para otimizar o momento do efeito da medicação. A administração intranasal e intramuscular de agentes farmacológicos constituem outras opções para a administração de ansiolíticos.
Crianças com desenvolvimento normal geralmente conseguem permanecer sentadas para a colocação de um cateter intravenoso (IV) na área de espera pré-operatória em nossa instituição após os 7 anos de idade, portanto é mais comum oferecer indução intravenosa para crianças mais velhas, embora a indução inalatória ainda possa ser mais viável em determinados pacientes. Especialistas em Child Life (profissionais treinados para oferecer distração e tranquilização a crianças durante atendimentos médicos) estão disponíveis para ensinar estratégias de enfrentamento, oferecer atividades lúdicas, descrever o processo de indução e auxiliar na colocação do IV. Podem ser utilizados dispositivos adicionais, como lidocaína tamponada administrada por jato (cria uma pápula de pele anestesiada usando lidocaína sob pressão e sem agulha) através da qual o cateter IV pode ser inserido, causando dor mínima. Anestésicos tópicos também podem ser aplicados na pele, se o tempo permitir, para reduzir a dor da colocação do IV.3
A presença dos pais durante a indução anestésica também pode ajudar a reduzir a ansiedade e aumentar a satisfação dos pais. Alguns pais podem preferir estar presentes independentemente da idade da criança. Determinadas populações de pacientes, como aquelas com diagnóstico de transtorno do espectro do autismo, às vezes se saem melhor quando pessoas familiares, como pais ou cuidadores, estão presentes. Embora a presença dos pais durante a indução anestésica possa ser apropriada, estudos demonstraram que a pré-medicação farmacológica para tratar a ansiedade é superior à presença dos pais durante a indução anestésica. Um pai ou mãe muito ansioso(a) ou com comportamentos disruptivos pode dificultar o processo de indução anestésica. Além disso, a presença dos pais durante a indução anestésica não afeta as alterações de comportamento no pós-operatório, ao passo que o midazolam oral demonstrou reduzir desfechos comportamentais negativos imediatos no pós-operatório em crianças pequenas. A decisão final de convidar os pais a retornar ao centro cirúrgico deve ser tomada pela equipe de anestesia após a entrevista pré-operatória e a discussão do plano anestésico. Em geral, a presença dos pais durante a indução anestésica tem sido desencorajada durante a pandemia atual, exceto em circunstâncias muito especiais.1
Doenças Agudas
Doenças transmissíveis
- Adiar procedimentos eletivos para evitar infectar outras pessoas com doenças transmissíveis.
- Catapora: deixa de ser transmissível quando todas as lesões cutâneas tiverem formado crostas.4,5
- Doença mão-pé-boca: deixa de ser transmissível 3 semanas após a resolução do exantema.5,6
Infecções Respiratórias
Um dilema comum na prática de anestesia pediátrica é anestesiar a criança saudável versus a criança doente. Certos patógenos e a subsequente reatividade da mucosa das vias aéreas podem levar a complicações com a anestesia. Após um resfriado com tosse, ou uma infecção de vias aéreas superiores (IVAS) não complicada, a reatividade das vias aéreas pode permanecer elevada por semanas. É nossa política adiar procedimentos eletivos até quatro semanas após a resolução completa dos sintomas de IVAS, ou 6 semanas após os sintomas de uma infecção de vias aéreas inferiores (IVAI), como vírus sincicial respiratório (VSR), influenza ou pneumonia. Isso permite que a reatividade das vias aéreas retorne ao basal e reduz o risco de complicações anestésicas intraoperatórias, como broncoespasmo, laringoespasmo, hipóxia e internação pós-operatória não planejada.7,8
Em geral, os sintomas de IVAS e IVAI são identificados durante o telefonema de triagem pré-operatória e os casos podem ser cancelados com tempo hábil para preencher a lacuna na agenda cirúrgica. Mas o que deve ser feito com o paciente que está comparecendo para seu procedimento na área de pré-operatório e que “acabou de” desenvolver coriza, febre, tosse ou um conjunto de novos sintomas? Certos aspectos de uma IVAS, como secreção nasal esverdeada, sibilos à ausculta pulmonar ou febre nas últimas 48 horas, aumentam o risco relativo de eventos de via aérea o suficiente para tornar o cancelamento no dia da cirurgia uma decisão fácil.9 No entanto, o caso nem sempre é tão claro, com sintomas de rinorreia clara isolada e tosse seca ocasional, por exemplo. O paciente pode ter realizado exames pré-operatórios; os pais podem ter tirado o dia de folga do trabalho; a criança pode estar em jejum adequado; e cancelamentos no dia da cirurgia são inconvenientes para todos os envolvidos. Nossa prática é avaliar cada criança caso a caso, tendo a segurança como objetivo principal, descartando sinais de doença manifesta, como febre ativa, e levando em conta a urgência do procedimento cirúrgico e quaisquer circunstâncias atenuantes, como quando houve um grande deslocamento, ou quando a criança adoece com frequência a ponto de ser quase impossível encontrar um período de quatro semanas de recuperação sem sintomas, ou quando há licença laboral limitada dos pais para cuidar da criança, o que pode tornar o reagendamento do caso particularmente difícil. Também incluímos os pais no processo de tomada de decisão, informando-os de que, embora o risco absoluto geral seja baixo, a anestesia no contexto de uma infecção de vias aéreas superiores ativa pode apresentar mais risco do que em uma criança saudável. A estratificação de risco pelo tipo e duração dos sintomas e por fatores de risco do paciente, como exposição ao fumo passivo, idade e asma, é respaldada na literatura, com recomendações gerais de prosseguir em casos de sintomas leves em pacientes de baixo risco e reagendar quando houver sintomas significativos naqueles com maior risco.1
SARS-CoV-2
Um estudo de coorte retrospectivo em um grande hospital pediátrico acadêmico revelou que cada criança com teste positivo para SARS-CoV-2 nos 10 dias anteriores a um procedimento apresentou uma incidência muito maior de complicações respiratórias (11,8% vs 1,0%, IC 95% 1,6-19,8%, p = 0,003) quando comparada a controles pareados. Dado o risco adicional de infectividade para outros pacientes próximos e para os profissionais de saúde, é nossa recomendação testar eletivamente todos os pacientes no pré-operatório para SARS-CoV-2 e remarcar casos eletivos quando houver um novo resultado positivo para COVID-19.10
Asma
Cirurgias eletivas devem ser adiadas até que a terapia para pacientes com controle inadequado dos sintomas tenha sido otimizada. Procedimentos para aqueles com exacerbações agudas de asma devem ser adiados por 4 semanas após a resolução e o retorno ao estado basal. Os pacientes devem usar de forma consistente seus medicamentos preventivos para asma nas semanas e dias que antecedem a anestesia.11,12
Comorbidades Médicas
Dependendo da apresentação clínica da doença (aguda, subaguda, crônica) e da urgência de um procedimento cirúrgico, o paciente de urologia pediátrica pode apresentar-se em perfeito estado de saúde ou com um espectro de alterações hemodinâmicas, desequilíbrios eletrolíticos e disfunção orgânica.
Pacientes com comorbidades médicas complexas devem ser avaliados na clínica pré-operatória para garantir que as condições médicas estejam adequadamente controladas antes da cirurgia. O encaminhamento precoce para a clínica pré-operatória permite tempo suficiente para iniciar de forma eficaz um programa de otimização e para manejar riscos modificáveis. Pacientes que recebem medicamentos de manutenção para suas condições médicas crônicas devem continuar esses medicamentos no período perioperatório.13,14
Diretrizes de Jejum Pré-operatório
Existem diretrizes para reduzir o risco de aspiração pulmonar em pacientes que recebem medicamentos que reduzem os reflexos protetores das vias aéreas. A Sociedade Americana de Anestesiologistas recomenda que os pacientes jejuem de alimentos sólidos ricos em gordura por 8 horas antes da cirurgia. As recomendações de jejum para refeições leves, qualquer bebida não clara, leite não humano e nutrição enteral artificial são de 6 horas. O leite materno deve ser suspenso 4 horas antes da anestesia, e os líquidos claros 2 horas antes da anestesia.15 A Sociedade Canadense de Anestesiologistas tem diretrizes semelhantes, mas a Sociedade Canadense de Anestesia Pediátrica agora incentiva que as crianças consumam líquidos claros até uma hora antes da cirurgia.16 As diretrizes de jejum da Sociedade Europeia de Anestesiologia proíbem a ingestão de alimentos sólidos 6 horas antes da cirurgia e incentivam que os pacientes adultos ingiram líquidos claros até 2 horas e os pacientes pediátricos até 1 hora antes da cirurgia.17
Tem havido preocupações de que as diretrizes sobre líquidos claros possam ser rígidas demais e contribuir para desfechos desfavoráveis. Devido à imprevisibilidade dos centros cirúrgicos, um jejum de líquidos claros de 2 horas, na prática, se traduz em um período de jejum muito mais longo. O jejum prolongado pode aumentar o desconforto e resultar em efeitos fisiológicos e metabólicos prejudiciais. Também é difícil fazer cumprir as diretrizes de jejum em crianças pequenas. Defensores da ultrassonografia gástrica sugeriram que a mensuração do conteúdo gástrico pode ser mais confiável do que as instruções de jejum isoladamente. Uma ultrassonografia gástrica deve ser realizada antes do cancelamento ou adiamento de um caso por violação do NPO.
Considerações Anestésicas
Anestesia geral versus raquianestesia
Aplicação da Anestesia Raquidiana
A anestesia raquidiana é uma boa opção anestésica para pacientes submetidos a procedimentos infraumbilicais.18 Do ponto de vista técnico, não há limite etário para a anestesia raquidiana. No entanto, fora do período neonatal e da fase de lactente, uma anestesia raquidiana isolada é improvável que seja bem-sucedida sem ansiolíticos ou sedação, dado o desenvolvimento cognitivo dos pacientes e a incapacidade de cooperar com a realização da anestesia raquidiana e com o procedimento cirúrgico. Lactentes ex-prematuros frequentemente têm história de apneia da prematuridade, displasia broncopulmonar e doença pulmonar crônica. O risco de apneia pós-operatória nesses pacientes é ainda maior em comparação com lactentes nascidos a termo.19 Quando viável, a anestesia raquidiana ajudaria a diminuir os riscos potenciais associados à anestesia geral, como neurotoxicidade, apneia e eventos cardiopulmonares adversos. A anestesia raquidiana deve ser considerada para pacientes em que a anestesia geral possa representar risco aumentado, como aqueles com dismorfia facial, via aérea difícil, distrofia muscular ou história familiar de hipertermia maligna.
As alterações hemodinâmicas secundárias à simpatectomia devida à anestesia raquidiana ou epidural, comuns em adultos, não são observadas em crianças pequenas. As crianças têm sistemas nervosos simpáticos relativamente imaturos e são menos dependentes do tônus vasomotor para manter a pressão arterial. Além disso, apresentam menor capacitância venosa nos membros inferiores e, assim, menor acúmulo de sangue.
Contraindicações para anestesia raquidiana
A raquianestesia é limitada a cirurgias com duração de 90 minutos ou menos. Crianças têm maior volume de líquido cefalorraquidiano (LCR) e renovação do LCR mais rápida em comparação com adultos. Dada essa diferença, a raquianestesia geralmente dura mais em crianças maiores e adultos do que em neonatos e lactentes. Uma raquianestesia com injeção única geralmente dura 60-90 minutos e pode ser prolongada para 120 minutos se realizada em combinação com um bloqueio caudal.
Contraindicações incluem coagulopatias, infecção sistêmica ou infecção local no local da punção, hipovolemia não corrigida, recusa dos pais e paciente não cooperativo. Anormalidades neurológicas, como espinha bífida e pressão intracraniana aumentada, também são contraindicações para anestesia raquidiana.
Complicações
Complicações após a raquianestesia incluem punção traumática levando a sangramento, dor e lesão das estruturas ao redor do local de punção. Com técnicas assépticas cuidadosas, a incidência de complicações infecciosas graves, como meningite, é muito baixa.20 Insuficiência respiratória e cardiovascular podem resultar de uma raquianestesia alta. Lesão neurológica e toxicidade por anestésico local podem resultar da injeção de solução incorreta ou de dose incorreta de anestésico local, respectivamente. A cefaleia pós-punção dural é outra complicação da raquianestesia. No entanto, a incidência de PDPH é desconhecida em crianças mais jovens devido à dificuldade em avaliar cefaleias nessa população.
Considerações laparoscópicas e robóticas
As abordagens urológicas robóticas e laparoscópicas estão aumentando.21 Essas abordagens acarretam alterações únicas na ventilação, no retorno venoso, na hemodinâmica e na perfusão dos órgãos abdominopélvicos durante o procedimento. É necessária anestesia geral com intubação endotraqueal para esses tipos de casos, pois pacientes acordados não toleram a insuflação do peritônio. Além disso, os procedimentos laparoscópicos tipicamente requerem relaxamento muscular para otimizar as condições cirúrgicas. O pneumoperitônio frequentemente contribui para oligúria ou anúria reversíveis e alterações hemodinâmicas e respiratórias semelhantes às observadas na laparoscopia em adultos.
Tabela 1 Alterações fisiológicas em resposta à laparoscopia. CVP: pressão venosa central; CO: débito cardíaco; MAP: pressão arterial média; SVR: resistência vascular sistêmica; FRC, capacidade residual funcional; TLV, volume pulmonar total; VTE, tromboembolismo venoso. Fonte: Miller RD et al. Miller’s Anesthesia 7ª ed. Cap.: Anestesia para Cirurgia Laparoscópica (Cap. 68) páginas 2185-2193.22
| Sistema orgânico | Intervenção | Efeitos | Tratamento |
|---|---|---|---|
| Cardiovascular | Posição com a cabeça para baixo | Aumento da PVC, aumento do DC | Reduzir a inclinação |
| Posição com a cabeça para cima | Diminuição da PVC, PAM | Reduzir a inclinação | |
| Insuflação | Reflexo barorreceptor → bradicardia reflexa ou assistolia | Reduzir ou cessar a insuflação, tratar a frequência cardíaca | |
| Aumento da RVS | Reduzir a inclinação com a cabeça elevada, uso de vasodilatadores, aprofundar a anestesia | ||
| Respiratório | Insuflação, posicionamento com a cabeça para baixo | Atelectasia → redução da CRF, TLV, complacência pulmonar → hipoxemia, hipercarbia | Aumentar os parâmetros ventilatórios, reduzir as pressões de insuflação, reduzir a inclinação com a cabeça para baixo |
| Neurológico | Posicionamento com a cabeça para baixo | Pressões cerebral e intraocular elevadas em pacientes com baixa complacência intracraniana | Reduzir a inclinação para baixo |
| Renal | Insuflação | Oligúria, anúria | Tipicamente reversível e transitória após a liberação da insuflação |
| Endócrino | Insuflação | Catecolaminas elevadas, hormônios do estresse | Aprofundar a anestesia, tratar adequadamente os estímulos dolorosos |
| Vascular | Posicionamento (especialmente litotomia) e insuflação | Estase venosa nas pernas → risco aumentado de TEV | Uso de dispositivos anti-TEV, mudanças periódicas no posicionamento |
Anestesia Regional
Injeções epidurais de dose única
A anestesia caudal é uma técnica bem estabelecida com um longo histórico de segurança (Polaner et al—estudo PRAN). Os benefícios da anestesia caudal incluem a diminuição da necessidade de analgésicos intraoperatórios e pós-operatórios, a redução da resposta hormonal ao estresse e o aumento da satisfação geral do paciente e dos pais.23
Os bloqueios caudais são uma injeção de anestésico local no espaço epidural, acessado através do hiato sacral. Os pontos de referência ósseos do hiato são geralmente palpáveis em pacientes pediátricos jovens ou visualizados por meio de ultrassonografia.
Figura 1 Abordagem anatômica para bloqueio caudal usando palpação de marcos ósseos. Palpação dos marcos ósseos ao utilizar uma abordagem anatômica. Anatomia externa: cornos sacrais e hiato sacral.
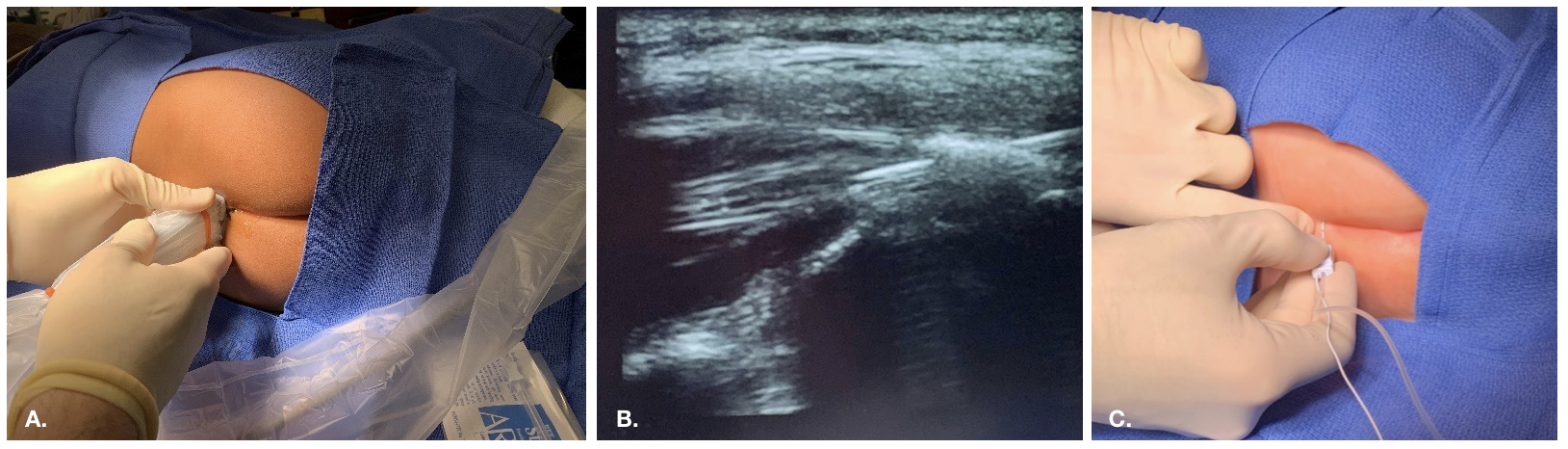
Figura 2 Abordagem guiada por ultrassom para bloqueio caudal
Figura 3 Colocação epidural guiada por fluoroscopia em um paciente com alterações anatômicas e pós-cirúrgicas desafiadoras
Contraindicações ao Bloqueio Caudal
Contraindicações incluem disrafismo espinhal (p. ex., medula presa), infecção no local da injeção ou cisto pilonidal, recusa do paciente e aumento (relativo) do risco de sangramento.
Bloqueios caudais, embora geralmente simples, sem complicações e bem-sucedidos, estão associados a uma certa taxa de falha, mesmo em mãos experientes. A falha ocorre com mais frequência devido à localização anatômica inadequada da solução injetada (por exemplo, subcutânea, intravascular), que pode inicialmente passar despercebida.
Complicações do Bloqueio Caudal
Os riscos incluem hemorragia, infecção, lesão nervosa, punção dural inadvertida e cefaleia pós-punção dural, reação alérgica e toxicidade do anestésico local. O evento adverso mais comum é a incapacidade de realizar o bloqueio ou falha do bloqueio.20
Limite de idade
Embora alguns centros limitem os bloqueios caudais a populações não deambulantes (lactentes), os bloqueios caudais também podem ser seguros e eficazes em crianças mais velhas. Em nossa prática pediátrica, costumamos realizar bloqueios caudais em crianças mais velhas, dependendo do biótipo, para cirurgias nas quais é desejável um nível sacral de controle da dor (por exemplo, circuncisão). Em crianças maiores (acima de 50 kg) ou mais velhas, uma epidural lombar de dose única ao nível da cirurgia é geralmente simples, mas pode apresentar poupança sacral devido às raízes nervosas sacras relativamente volumosas, sendo, assim, mais adequada para uma analgesia de nível lombar (por exemplo, para uma incisão de Pfannenstiel).2,24 Estudos em adultos sugerem uma taxa de injeção intravascular acidental superior ao esperado quando se realiza epidurografia caudal confirmatória.25 Alterações do biótipo corporal, ossificação da membrana sacrococcígea e alterações no espaço epidural também podem levar à preferência por um ponto de acesso na coluna lombar ou torácica para bloqueios neuraxiais em crianças mais velhas e maiores e em adultos.
Taxa de complicações da hipospádia
A correção da hipospádia é um procedimento urológico comum em meninos. Relatos publicados têm se concentrado principalmente no impacto das técnicas cirúrgicas e da gravidade dos defeitos sobre a incidência de complicações cirúrgicas. Nos últimos anos, têm sido publicados relatos controversos sobre o efeito da técnica anestésica na taxa de complicações pós-operatórias, tais como fístula uretrocutânea ou deiscência glandular.
Em um estudo randomizado comparando a eficácia do bloqueio peniano e da anestesia caudal para correções de hipospádia, Kundra et al observaram incidentalmente um aumento da incidência de fístula uretrocutânea em pacientes que receberam bloqueio caudal.26 É importante notar o pequeno N de 54, e que as crianças neste estudo tinham entre 4 e 12 anos; mais velhas do que a idade atualmente recomendada para a correção de hipospádia. Alguns estudos identificaram idade mais avançada do paciente como fator de risco para complicações.27,28 Além disso, a cirurgia foi realizada tanto por urologistas quanto por cirurgiões plásticos e as técnicas cirúrgicas foram diferentes no grupo com bloqueio caudal em comparação ao grupo com bloqueio peniano.
Taicher et al., em uma revisão de correções primárias de hipospádia realizadas por um único cirurgião de 2001 a 2014, constataram que as complicações estavam associadas a bloqueios caudais, hipospádia proximal, maior duração cirúrgica e aos anos mais precoces da prática do cirurgião.29 Após o ajuste para fatores de confusão por meio de análise de regressão logística multivariada, concluíram que tanto os bloqueios caudais quanto a hipospádia proximal permaneceram fortemente associados a complicações pós-operatórias. Os autores mencionaram o uso rotineiro de lidocaína com epinefrina por seu cirurgião em todos os casos, exceto nos casos glandulares mínimos. No entanto, como as informações sobre o uso de epinefrina subcutânea não foram capturadas de forma consistente em seu banco de dados, eles não podem comentar se isso teve algum papel em seus achados.
Zaidi et al constataram que a localização do meato uretral (corpo peniano proximal > distal) estava fortemente associada ao desenvolvimento de fístula uretrocutânea. Em contraste com Taicher et al., a análise deles de um subgrupo submetido a reparo tubularizado do meato uretral distal não revelou associação entre a formação de fístula e o uso de bloqueios caudais, mas verificou uma associação entre a formação de fístula e o uso de epinefrina subcutânea.29,30 De forma semelhante, Barga et al encontraram apenas uma associação entre hipospádia proximal e formação de fístula após análise multivariada.31
Uma revisão sistemática e meta-análise de estudos observacionais não randomizados não encontrou associação entre bloqueios caudais e complicações pós-operatórias.32 A vantagem de uma meta-análise é sua capacidade de aumentar o número de observações e, portanto, o poder estatístico. Mas devemos ter em mente que a meta-análise é limitada pelos vieses e limitações dos dados de origem.
Os bloqueios caudais, quando comparados ao bloqueio do nervo peniano (PNB), apresentaram uma menor taxa de reoperação por hipospádia, apesar de relatos anteriores sugerirem o contrário.33
O mecanismo pelo qual os bloqueios caudais podem contribuir para complicações pós-operatórias não está claro. Foi levantada a hipótese de que a estase sanguínea secundária à simpatectomia leva a ingurgitamento peniano, edema pós-operatório e cicatrização deficiente.26 Outros argumentam que o aumento do fluxo sanguíneo arterial secundário ao bloqueio caudal reduz a isquemia tecidual.33
Cateter epidural
Para procedimentos dolorosos que exigem internação hospitalar, ou para pacientes selecionados nos quais se deseja uma analgesia neuroaxial de maior duração, um cateter caudal ou epidural é vantajoso por aumentar a duração do controle regional da dor. Na nossa instituição, muitos de nossos pacientes serão “fast tracked” após um reparo programado (por exemplo, alta no primeiro dia pós-operatório), como um reimplante ureteral aberto, e com mais frequência recebem bloqueios caudais de dose única com um adjuvante para prolongar o bloqueio. Pacientes que têm reparos mais complexos e que necessitarão de uma internação pós-operatória mais prolongada, ou aqueles com histórico de problemas no controle da dor, são discutidos entre as equipes de urologia e de dor aguda da anestesia antes da cirurgia e recebem cateteres epidurais. Isso permite a infusão contínua de anestésico local no pós-operatório. A infusão epidural pode ser pausada para determinar se o paciente consegue manejar a dor com um esquema oral antes da alta. Se o teste for bem-sucedido, o cateter pode ser removido, geralmente no dia anterior à alta.
Bloqueios do tronco
O bloqueio do nervo ílioinguinal é uma opção para procedimentos ínguino-escrotais unilaterais quando o bloqueio caudal não é apropriado devido à idade, dificuldades anatômicas ou recusa do paciente. A realização do bloqueio antes da incisão é preferível, pois permitiria reduzir o uso de analgésicos intravenosos intraoperatórios. No entanto, a infiltração com anestésico local pode distorcer a anatomia para o cirurgião.
Medicamentos e Adjuvantes para Bloqueios Regionais
Os anestésicos locais mais comuns usados em nossa prática de anestesia regional pediátrica são a ropivacaína e a bupivacaína, ambas usadas a 0,125–0,25%, e administradas mais tipicamente a 1 cc/kg para obter um nível sacral de analgesia. Geralmente, usamos pelo menos epinefrina como adjuvante, que também serve para indicar se ocorreu injeção intravascular inadvertida. A epinefrina, quando administrada intravascularmente como adjuvante, aumenta a frequência cardíaca do paciente e ocasionalmente causa alterações no ECG durante uma “dose-teste” (isto é, uma pequena quantidade do anestésico local contendo epinefrina, que é injetada primeiro, seguida por um curto período de espera para observar quaisquer alterações no ECG ou nos sinais vitais).
Para obter um nível mais elevado de bloqueio, pode-se utilizar um volume adicional da solução a ser injetada, diluindo a concentração do anestésico local (por exemplo, 1 cc/kg de anestésico local mais 0.5 cc/kg de diluente, como solução salina normal sem conservantes).
Os adjuvantes mais comuns aos anestésicos locais utilizados em nossa prática são clonidina (geralmente 1 mcg/kg), fentanil (1 mcg/kg) e hidromorfona (5–10 mcg/kg). Foi observada uma associação entre o uso de opioides por via caudal e aumento de náuseas e vômitos no pós-operatório.34 Não há diferença significativa na duração de ação ou nos eventos adversos ao utilizar clonidina versus morfina (sem conservantes) como adjuvante. Assim, limitamos o uso de opioide como adjuvante (com ou sem clonidina) aos pacientes com menor risco de desenvolvimento de náuseas e vômitos no pós-operatório e que mais se beneficiarão com uma maior duração do bloqueio (por exemplo, incisões maiores, procedimentos mais dolorosos). A clonidina é geralmente evitada na população neonatal devido a preocupações com apneia e bradicardia.
O uso de dexmedetomidina como adjuvante da anestesia caudal tem sido associado a escores de sedação mais elevados e a maior incidência de bradicardia.35
Analgesia Multimodal
A analgesia multimodal combina o uso de bloqueio de nervo, analgésicos opioides e analgésicos não opioides para otimizar o controle da dor.
AINEs
Apesar da falta de evidências robustas e de grande escala quanto à sua eficácia, o cetorolaco provavelmente é seguro e atualmente é amplamente utilizado no período perioperatório.36 O cetorolaco é indicado, apenas para uso de curta duração, em condições de dor aguda. Não é indicado para dor leve e é contraindicado em pacientes com doença renal avançada e naqueles com ressuscitação volêmica inadequada. Seu uso na menor dose eficaz (por exemplo, 0,5 mg/kg IV ou menos) está associado a analgesia equivalente à de doses mais altas, porém com efeitos colaterais mínimos. O cetorolaco também deve ser evitado em pacientes com alto risco de sangramento ou doença ulcerosa gastrointestinal. A prática entre anestesiologistas varia, mas a literatura recente sugere que o uso em neonatos saudáveis (com pelo menos 3 semanas de vida e não prematuros) e lactentes não está associado a aumento de eventos adversos.37,38
Paracetamol
Paracetamol é o analgésico não opioide mais utilizado na população pediátrica para o tratamento da dor de leve a moderada. Está disponível em múltiplas formulações e concentrações e pode ser administrado por via oral, retal e intravenosa. A posologia varia dependendo da via de administração, da idade do paciente e da formulação intravenosa disponível. O paracetamol apresenta baixo risco de efeitos adversos graves. A hepatotoxicidade é o principal efeito adverso grave e está mais frequentemente associada à sobredose, tanto intencional quanto não intencional.39 A administração deve ser evitada em pacientes com vômitos prolongados, jejum prolongado, desidratação e insuficiência hepática.40
Preocupações pós-operatórias
NVPO
Um efeito colateral comum e potencialmente prevenível da cirurgia e da anestesia é a ocorrência de náuseas e vômitos pós-operatórios (NVPO). A NVPO pode resultar em desconforto significativo, bem como em menor satisfação do paciente.41 A terapia combinada é mais eficaz do que a monoterapia. Considerações anestésicas para reduzir o risco de NVPO incluem anestesia regional e analgesia multimodal para reduzir a necessidade de opioides perioperatórios, hidratação pré-operatória adequada por meio da minimização dos tempos de jejum, hidratação intraoperatória adequada, evitar anestésicos voláteis e tratamento profilático com agentes farmacológicos.42,43
Tabela 2 Fatores de risco para náuseas e vômitos pós-operatórios em pacientes pediátricos. Os principais fatores de risco estão em negrito e foi demonstrado que são aditivos.44
| Paciente | Cirúrgico | Anestésico |
|---|---|---|
| Sexo feminino após a puberdade | Correção de estrabismo | Uso de agentes voláteis |
| História de NVPO ou cinetose | Procedimentos otológicos | Uso de óxido nitroso |
| Idade > 3 anos | Amigdalectomia/adenoidectomia | Uso de opioides |
| Orquiopexia | Duração da anestesia > 30 minutos | |
| Correção de hérnia |
Tabela 3 Agentes farmacológicos para a profilaxia de náuseas e vômitos pós-operatórios. Ondansetrona e dexametasona são os dois agentes mais comumente utilizados na população pediátrica.42 O adesivo transdérmico de escopolamina geralmente não é utilizado em crianças com menos de 12 anos. O British National Formulary for Children recomenda o uso de um quarto de um adesivo de 1 mês a 3 anos e de metade de um adesivo de 3–10 anos. A metoclopramida também pode causar discinesia tardia.
| Medicamento | Local de ação | Posologia | Efeitos adversos |
|---|---|---|---|
| Ondansetrona | Antagonista da serotonina 5-HT3 | 0.1–0.15mg/kg IV (máx 4 mg) | Intervalo QT prolongado |
| Dexametasona | Não bem compreendido | 0.15 mg/kg IV | Síndrome de lise tumoral |
| Escopolamina | Antagonista muscarínico M-1 da acetilcolina | 1.5 mg adesivo transdérmico | Boca seca, alterações visuais, sedação |
| Aprepitanto | Antagonista da neurocinina-1 | 1 mg/kg PO (máx 40 mg) | Raro |
| Lorazepam | Agonista do GABA | 0.05 mg/kg IV (máx 2 mg) | Sedação |
| Difenidramina | Antagonista da histamina H-1 | 1 mg/kg IV (máx 50 mg) | Sedação |
| Metoclopramida | Antagonista da dopamina D-2 | 0.1–0.25 mg/kg IV (máx 20 mg) | Intervalo QT prolongado |
Apneia
Verificou-se que ex-prematuros apresentam risco aumentado de apneia pós-operatória. O risco de apneia diminui para pacientes nascidos com maior idade gestacional. Cote et al constataram, em seu estudo fundamental, que a incidência de apneia está fortemente relacionada às idades gestacional e pós-concepcional e que a incidência global fica marcadamente reduzida após 43 semanas de idade pós-concepcional. Em pacientes nascidos com idade gestacional de 35 semanas, a incidência de apneia diminui para menos de 5% após 48 semanas de idade pós-concepcional e para menos de 1% após 54 semanas de idade pós-concepcional. Naqueles que nasceram com 32 semanas, observaram uma diminuição da incidência de apneia para menos de 5% e menos de 1% após idades pós-concepcionais de 50 e 56 semanas, respectivamente.19
A anestesia geral pode revelar alterações do controle ventilatório e, portanto, também uma propensão à apneia anteriormente não observada em um ex-prematuro ou mesmo em um lactente nascido a termo. A anestesia geral reduz o tônus muscular, resultando em obstrução das vias aéreas superiores, o que contribui para apneia; portanto, é razoável inferir que a anestesia raquidiana reduziria o risco de apneia. Davidson et al também identificaram a prematuridade como o preditor mais forte de apneia. Observaram uma redução dos eventos de apneia nos primeiros 30 minutos, uma diminuição no grau de dessaturação e no nível de intervenção necessário para episódios de apneia com anestesia raquidiana em vigília, em comparação com anestesia geral. Não encontraram diferença na incidência de apneia tardia (apneia entre 30 minutos e 12 horas após a anestesia). Ainda assim, o ensaio deles não incluiu lactentes nascidos extremamente prematuros (com menos de 26 semanas de gestação) nem aqueles com comorbidades significativas. É possível que os benefícios da anestesia raquidiana para apneia sejam diferentes nessas populações.45
Dado o exposto, lactentes submetidos a procedimentos que requerem anestesia (sedação, anestesia espinhal e anestesia geral) devem ser internados para observação. A internação deve ser por pelo menos 23 horas após a anestesia e deve incluir oximetria de pulso contínua. Os requisitos de internação variam de instituição para instituição. Nossa instituição tem exigido, de forma conservadora, internação pós-anestésica para lactentes com histórico de prematuridade (nascidos com < 37 semanas de idade gestacional) e que tenham menos de 60 semanas de idade pós-concepcional. Para lactentes a termo, de outro modo saudáveis, a internação após a anestesia não é necessária após 44 semanas de idade pós-concepcional. Crianças com comorbidades significativas devem ser avaliadas caso a caso.
Complicações inesperadas
Os pais devem estar sempre preparados para possíveis internações, especialmente em pacientes com idade pós-concepcional inferior a 60 semanas. Além disso, pacientes com sintomas respiratórios leves recentes ou atuais podem necessitar de internação secundária a vias aéreas hiperreativas.
Atualização sobre Anestesia Pediátrica e Neurotoxicidade
Há preocupações contínuas sobre a neurotoxicidade induzida pela anestesia no cérebro em desenvolvimento. Como equilibrar os potenciais riscos associados à anestesia e o momento ideal das intervenções cirúrgicas? Em modelos animais, incluindo primatas não humanos, a exposição a agentes anestésicos gerais comumente utilizados, como voláteis halogenados, propofol e cetamina, resulta em uma gama de alterações morfológicas e funcionais. Animais expostos apresentaram morte celular neuronal apoptótica, morte de células gliais, neurogênese prejudicada e formação axonal anormal. Em alguns, a exposição na infância tem sido associada a comportamento alterado e prejuízo da aprendizagem e da formação de memória que persiste até o início da idade adulta. A exposição parece ser dependente da dose, da duração da exposição e do sexo. Em comparação com suas contrapartes fêmeas, roedores machos apresentaram prejuízo na aprendizagem e memória contextuais apesar de morte celular neuronal comparável.46 No entanto, é difícil traduzir os resultados de modelos animais para humanos, uma vez que as doses utilizadas nesses estudos são significativamente maiores do que aquelas tipicamente usadas em humanos.47
Há evidências mistas provenientes de estudos de coorte e retrospectivos de que crianças pequenas expostas à anestesia apresentam maior risco de desfechos neurodesenvolvimentais desfavoráveis. Alguns estudos sugeriram um aumento do risco de transtornos do desenvolvimento comportamental com exposições múltiplas, mas não com uma única exposição. DiMaggio et al realizaram uma meta-análise de estudos selecionados publicados de 2008 a 2012 e concluíram que os resultados indicaram um risco modesto, porém aumentado.48
O’Leary et al realizaram um estudo de coorte populacional em Ontário, Canadá, vinculando bases de dados administrativas de saúde provinciais aos desfechos do desenvolvimento infantil medidos pelo Early Development Instrument (EDI). Crianças submetidas à cirurgia antes da conclusão do EDI (idade de 5 a 6 anos) foram pareadas com crianças não expostas. O desfecho primário foi a vulnerabilidade do desenvolvimento precoce, definida como qualquer domínio do EDI no décimo percentil mais baixo da população. Análises de subgrupos foram realizadas com base na idade na primeira cirurgia (menor que 2 anos e maior ou igual a 2 anos) e na frequência de cirurgias. Os autores concluíram que crianças submetidas à cirurgia antes da idade escolar primária apresentaram risco aumentado de vulnerabilidade do desenvolvimento precoce, mas a magnitude da diferença entre crianças expostas e não expostas foi pequena. Idade inferior a 2 anos na primeira exposição e múltiplas exposições à cirurgia não foram fatores de risco para desfechos adversos de desenvolvimento.49
Um estudo de base populacional na Austrália também constatou que, entre crianças sem transtornos do neurodesenvolvimento preexistentes conhecidos, as expostas à anestesia geral antes dos 4 anos de idade apresentaram escores reduzidos em leitura e numeracia (matemática) no 3º ano e tinham maior probabilidade de serem consideradas de alto risco do ponto de vista do desenvolvimento (escores no 10º percentil inferior em dois ou mais domínios) no ingresso escolar. Ao restringir a apenas uma anestesia geral e uma internação, observaram atenuação da associação com desenvolvimento deficitário e escores de leitura baixos, mas o desfecho ruim em numeracia permaneceu. Em contraste com O’Leary et al., eles encontraram uma associação entre o número de exposições e piores desfechos de desenvolvimento.50
O estudo PANDA é um estudo de coorte pareado por irmãos que comparou desfechos do neurodesenvolvimento de 105 crianças que foram expostas à anestesia geral antes dos 36 meses de idade para reparo de hérnia inguinal e seus irmãos não expostos. Testes neuropsicológicos foram realizados entre 8 e 15 anos de idade. Os dados mostraram que não houve diferença estatisticamente significativa entre os escores de QI de crianças saudáveis com uma única exposição anestésica antes dos 36 meses de idade em comparação com seus irmãos saudáveis não expostos.51 Da mesma forma, o estudo de coorte MASK não encontrou evidências de diferença nos escores de testes entre crianças com uma única anestesia antes dos 3 anos de idade em comparação com aquelas sem exposição à anestesia. O estudo, porém, encontrou aumento do risco de déficit na velocidade de processamento e em desfechos de motricidade fina entre aqueles com múltiplas anestesias. Os pais do grupo com múltiplas exposições relataram aumento de problemas relacionados à função executiva, ao comportamento e à leitura.52
O estudo General Anesthesia Compared to Spinal Anesthesia, ou “GAS study”, é um ensaio internacional prospectivo, multicêntrico, randomizado e controlado que investiga o desfecho neurodesenvolvimental aos 2 e 5 anos de idade após reparo de hérnia realizado antes de 60 semanas de idade pós-menstrual. Os lactentes foram estratificados por centro e idade gestacional ao nascimento e randomizados (1:1) para receber anestesia regional com o paciente acordado ou anestesia geral à base de sevoflurano. Lactentes foram excluídos caso tivessem fatores de risco existentes para lesão neurológica. Os resultados mostraram que uma exposição de pouco menos de 1 hora a uma anestesia geral com sevoflurano na infância não aumentou o risco de desfecho neurodesenvolvimental adverso aos 2 anos de idade.53 O ensaio, de modo semelhante, mostrou evidência de equivalência no escore de Quociente de Inteligência de Escala Total da Escala Wechsler Pré-Escolar e Primária de Inteligência, Terceira Edição (WPPSI-III), medido aos 5 anos de idade, nesta população de estudo predominantemente masculina.54
Com base nos dados disponíveis, podemos tranquilizar a nós mesmos e aos pais de que, entre crianças pequenas, de resto saudáveis, uma única exposição breve à anestesia geral não resultará em pior desenvolvimento neurocognitivo. Ainda assim, a anestesia geral não é um processo completamente benigno. Há alguma evidência de um efeito prejudicial após exposições repetidas, mas ainda há dados limitados sobre exposição prolongada e subgrupos vulneráveis. A maioria dos estudos em animais constatou que exposições mais longas (3 horas ou mais; para primatas não humanos, 5 horas ou mais) têm maior probabilidade de causar neurotoxicidade. No entanto, não sabemos qual é a equivalência do tempo de exposição em animais para o dos humanos.55 Além disso, ainda não sabemos o que é pior: múltiplas exposições curtas ou uma única exposição prolongada. Mesmo assim, não sabemos a idade a partir da qual a anestesia geral deixa de representar uma ameaça ao desenvolvimento neurocognitivo de uma criança. Para os pacientes e procedimentos adequados, pode ser sensato oferecer uma técnica anestésica neuraxial para limitar o número de potenciais exposições à anestesia geral. Se a anestesia geral for necessária, uma técnica combinada de anestesia regional e geral seria útil para reduzir a quantidade de agentes intravenosos e inalatórios necessários para manter um bom nível de anestesia para o caso.
Conclusão
A anestesia pediátrica é desafiadora, pois trabalhamos com uma variedade de pacientes não apenas com diferentes comorbidades médicas, mas também em diferentes estágios de desenvolvimento neurocognitivo. Estamos apenas começando a compreender os efeitos dos anestésicos sobre a neuroinflamação, o estresse perioperatório e o neurodesenvolvimento. Atualmente, há evidências sugerindo que uma exposição única e breve à anestesia geral em pacientes jovens saudáveis não resulta em desfechos neurocognitivos adversos. É difícil elucidar se os desfechos adversos em pacientes que necessitam de cirurgias prolongadas e múltiplos procedimentos são consequência dos anestésicos, de alterações associadas ao estresse induzido pela cirurgia, ou se constituem um marcador de fenótipos predispostos à neurotoxicidade. A realidade provavelmente é multifatorial. Uma boa comunicação pré-operatória entre as equipes de urologia e anestesia, quanto às necessidades específicas do paciente e do caso, proporciona uma assistência ao paciente ideal e individualizada.
Pontos-chave
- Pacientes jovens e saudáveis com uma única e breve exposição à anestesia geral não têm risco aumentado de comprometimento do desenvolvimento neurocognitivo.
- Um bloqueio caudal, epidural ou troncular oferece controle da dor seguro e eficaz para cirurgias urológicas ambulatoriais
- Pacientes que precisarão de internação mais prolongada após procedimentos dolorosos podem se beneficiar de um cateter caudal ou epidural para fornecer analgesia de maior duração
- A cirurgia laparoscópica e robótica provoca alterações na fisiologia que geralmente podem ser parcialmente mitigadas pela equipe de anestesia
- Crianças doentes devem ser reagendadas se os procedimentos forem eletivos, mas podem ser avaliadas caso a caso se os sintomas forem mínimos
- Crianças com risco de apneia pós-operatória devem ser internadas para observação
- Uma boa comunicação pré-operatória entre as equipes de urologia e anestesia sobre as necessidades específicas do paciente e do caso leva a um cuidado ideal e individualizado ao paciente
Referências
- Davis PJ, Cladis F. Smith’s Anesthesia for Infants and Children. 2017; 9. DOI: 10.1213/00000539-199009000-00032.
- Sola C, Lefauconnier A, Bringuier S, Raux O, Capdevila X, Dadure C. Childhood preoperative anxiolysis: Is sedation and distraction better than either alone? A prospective randomized study. Paediatr Anaesth 2017; 27 (8): 827–834. DOI: 10.1111/pan.13180.
- Auerbach M, Tunik M, Mojica M. A Randomized, Double-blind Controlled Study of Jet Lidocaine Compared to Jet Placebo for Pain Relief in Children Undergoing Needle Insertion in the Emergency Department. Acad Emerg Med 2009; 16 (5): 388–393. DOI: 10.1111/j.1553-2712.2009.00401.x.
- Disease Control C for, Prevention. Chickenpox (Varicella). 2021. DOI: 10.1016/b978-1-4831-8407-4.50023-7.
- Kimberlin DW, Barnett ED, Lynfield R, Sawyer MH. Red book: report of the Committee on Infectious Diseases. vol. 2021, American Academy of Pediatrics; , DOI: 10.1111/j.1651-2227.2009.01642.x.
- Disease Control C for, Prevention. Hand, Foot, and Mouth Disease (HFMD). 2021. DOI: 10.3329/bjch.v40i2.31567.
- Mallory MD, Travers C, McCracken CE, Hertzog J, Cravero JP. Upper Respiratory Infections and Airway Adverse Events in Pediatric Procedural Sedation. Pediatrics 2017; 140 (1). DOI: 10.1542/peds.2017-0009.
- Lee LK, Bernardo MKL, Grogan TR, Elashoff DA, Ren WHP. Perioperative respiratory adverse event risk assessment in children with upper respiratory tract infection: Validation of the COLDS score. Paediatr Anaesth 2018; 28 (11): 1007–1014. DOI: 10.1111/pan.13491.
- Lema GF, Berhe YW, Gebrezgi AH, Getu AA. Evidence-based perioperative management of a child with upper respiratory tract infections (URTIs) undergoing elective surgery; A systematic review. Int J Surg Open 2018; 12: 17–24. DOI: 10.1016/j.ijso.2018.05.002.
- Saynhalath R, Alex G, Efune PN, Szmuk P, Zhu H, Sanford EL. Anesthetic Complications Associated With Severe Acute Respiratory Syndrome Coronavirus 2 in Pediatric Patients. Anesth Analg 2021; 133 (2): 483–490. DOI: 10.1213/ane.0000000000005606.
- Woods BD, Sladen RN. Perioperative considerations for the patient with asthma and bronchospasm. Br J Anaesth 2009; 103: i57–i65. DOI: 10.1093/bja/aep271.
- Dones F, Foresta G, Russotto V. Update on Perioperative Management of the Child with Asthma. Pediatr Rep 2012; 4 (2): e19. DOI: 10.4081/pr.2012.e19.
- Aronson S, Murray S, Martin G, Blitz J, Crittenden T, Lipkin ME, et al.. Roadmap for Transforming Preoperative Assessment to Preoperative Optimization. Anesth Analg 2020; 130 (4): 811–819. DOI: 10.1213/ane.0000000000004571.
- Shah NN, Vetter TR. Comprehensive Preoperative Assessment and Global Optimization. Anesthesiol Clin 2018; 36 (2): 259–280. DOI: 10.1016/j.anclin.2018.01.006.
- Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures. Anesthesiology 2017; 90 (3): 896–905. DOI: 10.1097/00000542-199903000-00034.
- Dobson G, Chow L, Flexman A. Practice Guidelines for Ophthalmic Anesthesia. Practice Guidelines in Anesthesia-2 2019; 6 (1): 175–175. DOI: 10.5005/jp/books/14207_19.
- Smith I, Kranke P, Murat I, Smith A, OʼSullivan G, Sreide E, et al.. Perioperative fasting in adults and children. Eur J Anaesthesiol 2011; 28 (8): 556–569. DOI: 10.1097/eja.0b013e3283495ba1.
- Dadure C, Sola C, Capdevila X. Preoperative nutrition through a prehabilitation program: A key component of transfusion limitation in paediatric scoliosis surgery. Anaesth Crit Care Pain Med 2015; 34 (6): 311–312. DOI: 10.1016/j.accpm.2015.12.004.
- Cote CJ, Zaslavsky A, Downes JJ, Kurth CD, Welborn LG, Warner LO, et al.. Postoperative Apnea in Former Preterm Infants After Inguinal Herniorrhaphy. Survey of Anesthesiology 1995; 40 (3): 163. DOI: 10.1097/00132586-199606000-00031.
- Polaner DM, Taenzer AH, Walker BJ. Faculty Opinions recommendation of Pediatric Regional Anesthesia Network (PRAN): a multi-institutional study of the use and incidence of complications of pediatric regional anesthesia. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2012; 15 (6): 353–1364. DOI: 10.3410/f.717968230.793467936.
- Sheth KR, Batavia JP, Bowen DK, Koh CJ, Srinivasan AK. Complications in Pediatric Urology Minimally Invasive Surgery. Minimally Invasive and Robotic-Assisted Surgery in Pediatric Urology 2018; 5 (4): 381–404. DOI: 10.1007/978-3-030-57219-8_26.
- Joris JL. Anesthesia for Laparoscopic Surgery. Miller’s Anesthesia. Churchill Livingstone, Philadelphia, 2185-2202. 2010.
- Cyna AM, Middleton P. Caudal epidural block versus other methods of postoperative pain relief for circumcision in boys. Cochrane Database Syst Rev 2008; 2008 (4). DOI: 10.1002/14651858.cd003005.pub2.
- Wiegele M, Marhofer P, Lönnqvist P-A. Caudal epidural blocks in paediatric patients: a review and practical considerations. Br J Anaesth 2019; 122 (4): 509–517. DOI: 10.1016/j.bja.2018.11.030.
- Fukazawa K, Matsuki Y, Ueno H, Hosokawa T, Hirose M. Risk factors related to accidental intravascular injection during caudal anesthesia. J Anesth 2014; 28 (6): 940–943. DOI: 10.1007/s00540-014-1840-8.
- Kundra P, Yuvaraj K, Agrawal K, Krishnappa S, Kumar LT. Surgical outcome in children undergoing hypospadias repair under caudal epidural vs penile block. Paediatr Anaesth 2012; 22 (7): 707–712. DOI: 10.1111/j.1460-9592.2011.03702.x.
- Yildiz T, Tahtali IN, Ates DC, Keles I, Ilce Z. Age of patient is a risk factor for urethrocutaneous fistula in hypospadias surgery. J Pediatr Urol 2013; 9 (6): 900–903. DOI: 10.1016/j.jpurol.2012.12.007.
- Zhang J, Zhu S, Zhang L, Fu W, Hu J, Zhang Z, et al.. The association between caudal block and urethroplasty complications of distal tubularized incised plate repair: experience from a South China National Children’s Medical Center. Transl Androl Urol 2021; 10 (5): 2084–2090. DOI: 10.21037/tau-21-355.
- Taicher BM, Routh JC, Eck JB, Ross SS, Wiener JS, Ross AK. The association between caudal anesthesia and increased risk of postoperative surgical complications in boys undergoing hypospadias repair: Comment on data sparsity. Paediatr Anaesth 2017; 27 (9): 974–974. DOI: 10.1111/pan.13207.
- Zaidi RH, Casanova NF, Haydar B, Voepel-Lewis T, Wan JH. Urethrocutaneous fistula following hypospadias repair: regional anesthesia and other factors. Paediatr Anaesth 2015; 25 (11): 1144–1150. DOI: 10.1111/pan.12719.
- Braga LH, Jegatheeswaran K, McGrath M, Easterbrook B, Rickard M, DeMaria J, et al.. Cause and Effect versus Confounding–Is There a True Association between Caudal Blocks and Tubularized Incised Plate Repair Complications? J Urol 2017; 197 (3 Part 2): 845–851. DOI: 10.1016/j.juro.2016.08.110.
- Zhu C, Wei R, Tong Y, Liu J, Song Z, Zhang S. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Ngoo A, Borzi P, McBride CA, Patel B. Penile nerve block predicts higher revision surgery rate following distal hypospadias repair when compared with caudal epidural block: A consecutive cohort study. J Pediatr Urol 2020; 16 (4): 439.e1–439.e6. DOI: 10.1016/j.jpurol.2020.05.150.
- Goyal S, Sharma A, Goswami D, Kothari N, Goyal A, Vyas V, et al.. Clonidine and Morphine as Adjuvants for Caudal Anaesthesia in Children: A Systematic Review and Meta-Analysis of Randomised Controlled Trials. Turk J Anaesthesiol Reanim 2020; 48 (4): 265–272. DOI: 10.5152/tjar.2020.29863.
- Wang X-xue, Dai J, Dai L, Guo H-jing, Zhou A-guo, Pan D-bo. Caudal dexmedetomidine in pediatric caudal anesthesia. Medicine (Baltimore) 2020; 99 (31): e21397. DOI: 10.1097/md.0000000000021397.
- Rowe E, Cooper TE, McNicol ED. Ketorolac for postoperative pain in children. Cochrane Database Syst Rev 2018; 7:cd012294. DOI: 10.1002/14651858.cd012294.
- Aldrink JH, Ma M, Wang W, Caniano DA, Wispe J, Puthoff T. Safety of ketorolac in surgical neonates and infants 0 to 3 months old. J Pediatr Surg 2011; 46 (6): 1081–1085. DOI: 10.1016/j.jpedsurg.2011.03.031.
- Stone SB. Ketorolac in Postoperative Neonates and Infants: A Systematic Review. J Pediatr Pharmacol Ther 2021; 26 (3): 240–247. DOI: 10.5863/1551-6776-26.3.240.
- Anesthesia BBP. Non-Opioid Analgesic Agents. People’s Medical Publishing House; 2011, DOI: 10.1016/j.mpaic.2007.11.012.
- Drugs C on. Acetaminophen Toxicity in Children. Pediatrics 2001; 108 (4): 1020–1024. DOI: 10.1542/peds.108.4.1020.
- Chandrakantan A. Postoperative Nausea and Vomiting in Children. Case Studies in Pediatric Anesthesia 2014; 7 (3): 24–25. DOI: 10.1017/9781108668736.006.
- Urits I, Orhurhu V, Jones MR. Postoperative nausea and vomiting in paediatric strabismus surgery. Br J Anaesth 2020; 105 (4): 550–551. DOI: 10.1093/bja/aeq219.
- Gan TJ, Diemunsch P, Habib AS, Kovac A, Kranke P, Meyer TA, et al.. Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg 2014; 118 (1): 85–113. DOI: 10.1213/ane.0000000000000002.
- Eberhart LHJ, Geldner G, Kranke P. Development and validation of a risk score to predict the probability of postoperative vomiting in pediatric patients: the VPOP score. Paediatr Anaesth 2004; 25 (3): 330–330. DOI: 10.1111/pan.12596.
- Davidson AJ, Morton NS, Arnup SJ. Faculty Opinions recommendation of Apnea after Awake Regional and General Anesthesia in Infants: The General Anesthesia Compared to Spinal Anesthesia Study–Comparing Apnea and Neurodevelopmental Outcomes, a Randomized Controlled Trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2015; 23 (1): 8–54. DOI: 10.3410/f.725508900.793507986.
- Lee BH, Chan JT, Kraeva E, Peterson K, Sall JW. Isoflurane exposure in newborn rats induces long-term cognitive dysfunction in males but not females. Neuropharmacology 2014; 83: 9–17. DOI: 10.1016/j.neuropharm.2014.03.011.
- Vutskits L, Xie Z. Lasting impact of general anaesthesia on the brain: mechanisms and relevance. Nat Rev Neurosci 2016; 17 (11): 705–717. DOI: 10.1038/nrn.2016.128.
- DiMaggio C, Sun LS, Ing C, Li G. Pediatric Anesthesia and Neurodevelopmental Impairments. J Neurosurg Anesthesiol 2012; 24 (4): 376–381. DOI: 10.1097/ana.0b013e31826a038d.
- O’Leary JD, Janus M, Duku E, Wijeysundera DN, To T, Li P, et al.. A Population-based Study Evaluating the Association Between Surgery in Early Life and Child Development at Primary School Entry. Obstetric Anesthesia Digest 2016; 37 (2): 78–79. DOI: 10.1097/01.aoa.0000515748.52953.0b.
- Schneuer FJ, Bentley JP, Davidson AJ, Holland AJA, Badawi N, Martin AJ, et al.. The impact of general anesthesia on child development and school performance: a population-based study. Paediatr Anaesth 2018; 28 (6): 528–536. DOI: 10.1111/pan.13390.
- Sun LS, Li G, Miller TLK, Salorio C, Byrne MW, Bellinger DC, et al.. Association Between a Single General Anesthesia Exposure Before Age 36 Months and Neurocognitive Outcomes in Later Childhood. Jama 2016; 315 (21): 2312. DOI: 10.1001/jama.2016.6967.
- Warner DO, Zaccariello MJ, Katusic SK. Faculty Opinions recommendation of Neuropsychological and Behavioral Outcomes after Exposure of Young Children to Procedures Requiring General Anesthesia: The Mayo Anesthesia Safety in Kids (MASK) Study. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2018; 29 (1): 9–105. DOI: 10.3410/f.733078932.793559248.
- Davidson AJ, Disma N, Graaff JC de, Withington DE, Dorris L, Bell G, et al.. Neurodevelopmental outcome at 2 years of age after general anaesthesia and awake-regional anaesthesia in infancy (GAS): an international multicentre, randomised controlled trial. Lancet 2016; 387 (10015): 239–250. DOI: 10.1016/s0140-6736(15)00608-x.
- McCann ME, Graaff JC, Dorris L. Faculty Opinions recommendation of Neurodevelopmental outcome at 5 years of age after general anaesthesia or awake-regional anaesthesia in infancy (GAS): an international, multicentre, randomised, controlled equivalence trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2019; 93 (10172): 64–677. DOI: 10.3410/f.735131691.793559701.
- Creeley C, Dikranian K, Dissen G, Martin L, Olney J, Brambrink A. Propofol-induced apoptosis of neurones and oligodendrocytes in fetal and neonatal rhesus macaque brain. Br J Anaesth 2013; 110: i29–i38. DOI: 10.1093/bja/aet173.
Ultima atualização: 2025-09-21 13:35