56: Bourse aiguë
Ce chapitre prendra environ 31 minutes de lecture.
Introduction
Une « bourse aiguë » désigne l’apparition rapide d’une bourse douloureuse et/ou tuméfiée. La torsion testiculaire (TT) est le diagnostic le plus préoccupant au premier plan des préoccupations de tout clinicien et, sans intervention précoce, le testicule risque une nécrose secondaire à une ischémie prolongée. Une fois la TT écartée, d’autres étiologies peuvent être envisagées. De façon générale, le diagnostic différentiel de la bourse aiguë pédiatrique inclut également la torsion de l’appendice testiculaire, l’épididymite, l’orchite, la hernie incarcérée, la vascularite, le traumatisme testiculaire et la cellulite. Dans ce chapitre, nous mettrons en avant l’évaluation de la torsion testiculaire, de la torsion des annexes du testicule ou de l’épididyme, et de l’épididymite. La cause principale de ces diagnostics est liée à l’anatomie du testicule ou de l’épididyme eux-mêmes, tandis que les autres diagnostics ont des causes secondaires d’œdème, de douleur ou d’infection scrotale (p. ex., orchite ourlienne secondaire à un virus de la famille des Paramyxoviridae). Le diagnostic et la prise en charge de ces autres diagnostics du différentiel nécessitent le traitement de la cause primaire et sont discutés ailleurs dans ce manuel.
Anatomie et embryologie
Le scrotum est un sac de peau et de tissu sous-jacent situé au-dessous du phallus, dans lequel sont contenus les testicules et les épididymes. En profondeur par rapport à la peau se trouve le fascia de Dartos, qui est la continuation du fascia de Colles du périnée, du fascia de Dartos du pénis et du fascia de Scarpa de l’abdomen. Le fascia de Dartos est de nature élastique. Il assure la vascularisation de la peau scrotale et, avec le réflexe crémastérien du testicule, aide à réguler la température testiculaire en contractant (l’élevant) ou en relâchant (l’abaissant) le scrotum dans son ensemble. Le scrotum est divisé en compartiments latéraux par le septum scrotal. En interne, le septum est composé d’un fascia de Dartos épaissi. En externe, le septum se manifeste par le raphé scrotal médian.
La tunique vaginale est le revêtement structurel de l’intérieur du scrotum qui entoure les testicules. La tunique vaginale dérive du processus vaginal (ou processus vaginal), un diverticule embryonnaire du péritoine abdominal qui parcourt toute la longueur du canal inguinal jusque dans le scrotum avant son oblitération. Après l’oblitération de la portion inguinale, le sac distal restant entoure le testicule et se compose de deux feuillets : un feuillet viscéral et un feuillet pariétal. Le feuillet viscéral est adhérent à la tunique albuginée, la surface la plus externe du testicule. Le feuillet pariétal se réfléchit sur la face interne du scrotum.
Le testicule est une gonade mâle de forme ovoïde, située dans chaque hémiscrotum, et assurant des fonctions endocrines et reproductives par la production d’hormones (notamment la testostérone) et de spermatozoïdes. Les spermatozoïdes sont produits dans les tubules séminifères du testicule et transitent par le rete testis vers les canalicules efférents, qui se raccordent à la tête de l’épididyme. L’épididyme est un tube enroulé de manière tortueuse qui repose sur l’aspect postéro-latéral du testicule. Il a pour fonction de stocker les spermatozoïdes et d’en assurer la maturation jusqu’à leur libération par le canal déférent en route vers l’ampoule du canal déférent, réservoir des spermatozoïdes matures destinés à l’émission.
Le cordon spermatique est une structure majeure contenue dans le scrotum. Il prend naissance au niveau de l’anneau inguinal profond (interne) de la paroi abdominale, chemine à travers le canal inguinal et traverse l’anneau inguinal superficiel (externe) pour pénétrer dans le scrotum. Le cordon spermatique contient des nerfs, des vaisseaux et des conduits. Il est entouré par trois couches de tissu fascial (de la plus superficielle à la plus profonde) : le fascia spermatique externe (prolongement du fascia de l’oblique externe), le muscle crémaster (prolongement de la musculature de l’oblique interne) et le fascia spermatique spermatique interne (prolongement du fascia transversalis. En plus de ces couches individuelles, le cordon spermatique comprend (Figure 1) :
Vascularisation:
- Artère testiculaire (une branche de l’aorte)
- Artère et veine crémastériques (une branche des vaisseaux épigastriques inférieurs)
- Artère du canal déférent (une branche de l’artère vésicale supérieure)
- Plexus pampiniforme (réseau veineux distal à l’anneau inguinal)
Nerfs:
- Nerf ilio-inguinal (rejoint le cordon spermatique en superficie du fascia spermatique externe depuis le canal inguinal pour assurer la sensibilité de la partie supérieure du scrotum et de la peau du pénis)
- Branche génitale du nerf génitofémoral (fournit l’innervation motrice du muscle crémaster et la sensibilité du scrotum antérieur)
- Nerfs autonomes
Autre:
- Canal déférent
- Vaisseaux lymphatiques
- Processus vaginal
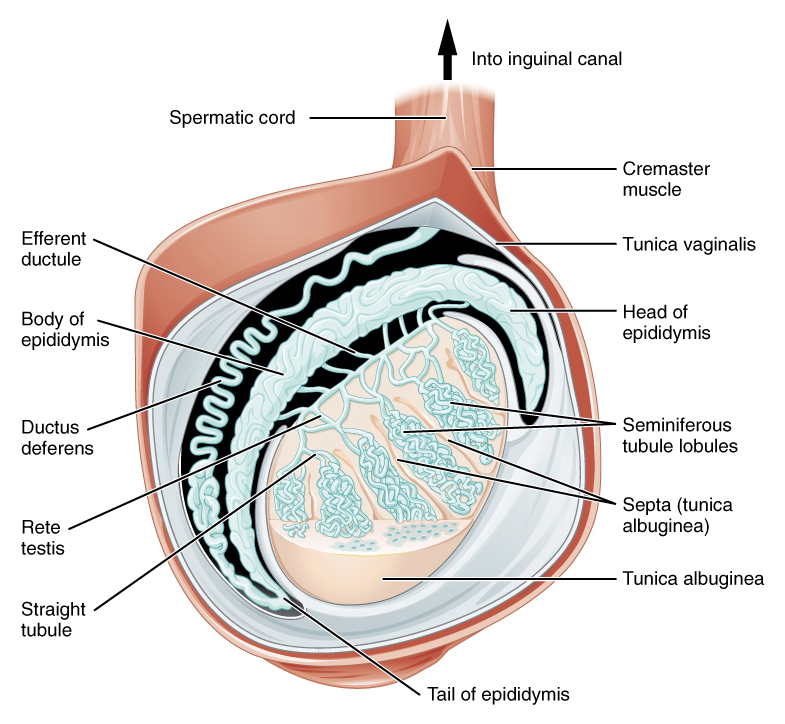
Figure 1 Contenu distal du cordon spermatique et de la tunique vaginale. Attribution : OpenStax College
La différenciation, le développement et la descente des testicules sont décrits dans d’autres chapitres.
Évaluation générale et diagnostic
Chez le patient pédiatrique présentant une douleur testiculaire aiguë et/ou une tuméfaction scrotale, un interrogatoire et un examen clinique soigneux doivent être effectués.
Il convient de recueillir les éléments clés de l’anamnèse du patient, notamment l’âge, la nature du début de la douleur (p. ex., début brutal ou progressif, présence d’un traumatisme), la localisation et l’irradiation de la douleur, ainsi que les symptômes associés (p. ex., douleur abdominale, nausées ou vomissements, hématurie, dysurie, fièvre, constipation). Les symptômes associés peuvent aider à la fois à étayer un diagnostic de TT et à écarter la TT au profit d’autres diagnostics. La TT se manifeste fréquemment par des douleurs abdominales, des nausées et/ou des vomissements. En revanche, la dysurie et la présence de fièvres systémiques évoqueraient une autre étiologie, telle qu’une épididymite.
L’examen physique doit comporter un examen abdominal et un examen génital. L’examen abdominal doit inclure la recherche d’une sensibilité costo-vertébrale témoignant d’une douleur du flanc, laquelle peut correspondre à une colique urétérale avec douleur irradiant vers l’aine. La présence de signes de hernie ou de cellulite dans la région inguinale doit également être notée.1 La présence d’une douleur abdominale isolée doit malgré tout conduire à un examen génital afin d’éliminer un scrotum aigu, en particulier chez les garçons plus jeunes qui ne peuvent pas exprimer correctement leurs besoins, les garçons présentant un retard du développement et ceux dont l’état de conscience est potentiellement altéré.2
L’examen génital comprend l’évaluation du scrotum et des testicules bilatéraux, en commençant par l’inspection puis par la palpation. L’inspection de la peau doit rechercher un érythème évocateur d’une cellulite. Chez les enfants à peau claire, une discrète teinte bleuâtre (signe du « point bleu ») peut être visible sur la peau scrotale latérale chez les enfants présentant une torsion de l’appendice testiculaire ou épididymaire, bien que ce signe clinique ne soit présent que dans une minorité de cas et ne soit pas pertinent chez les enfants à peau plus foncée.3 Une palpation douce peut être réalisée en faisant rouler toute la surface testiculaire entre le pouce et les index. Cet examen est souvent difficile à réaliser dans le contexte de la TT en raison de l’œdème testiculaire et de l’hydrocèle réactive, tendue, associée. Un testicule haut situé par rapport au côté controlatéral doit être noté et évoque une TT (par élévation du testicule lorsque le cordon spermatique se tord et se raccourcit). L’orientation du testicule, verticale ou horizontale, est également à noter. Il est important de noter que la déformation en battant de cloche (« bell clapper ») entraîne une position horizontale et se rencontre chez les sujets de sexe masculin présentant une insertion anormalement haute de la vaginale sur le cordon spermatique. Cette variante anatomique permet une rotation libre du testicule et prédispose le patient à une torsion intravaginale (discutée plus loin). À noter que cette anomalie est difficile à distinguer en situation normale et qu’il est peu probable de pouvoir l’établir en contexte de TT en raison de l’œdème et des modifications cutanées.
Des manœuvres d’examen supplémentaires peuvent permettre d’établir le diagnostic :
- Les masses scrotales doivent être caractérisées par la transillumination (indiquant une hydrocèle) et par la tentative de réduction (indiquant un canal péritonéo-vaginal perméable)
- Le réflexe crémastérien doit être évalué en frottant la cuisse homolatérale du testicule atteint. Ce réflexe provoque normalement une contraction du crémaster et l’ascension du testicule dans le scrotum. L’absence de ce réflexe chez un patient présentant une douleur scrotale aiguë évoque classiquement le diagnostic de TT; ce signe présente une sensibilité de 100 % et une spécificité de 66 %.4 Cependant, chez un jeune enfant, l’arc réflexe peut être insuffisamment développé et absent chez un individu par ailleurs sain.5,6 Il est donc important de rechercher d’abord un réflexe crémastérien du côté controlatéral “normal” afin d’établir un examen de référence.
- L’élévation du contenu scrotal est une manœuvre enseignée pour distinguer l’épididymite de la TT. Le soulagement de la douleur lors de l’élévation scrotale, classiquement appelé signe de Prehn positif, suggère une épididymite et n’est pas reproductible en cas de TT, bien que ce test ne soit pas toujours fiable chez l’enfant.1
Les examens diagnostiques initiaux, qui seront discutés plus en détail, comprennent généralement:
- Analyse d’urine (UA) et culture d’urine. Ces tests sont effectués pour exclure une infection des voies urinaires et une épididymite bactérienne. Les enfants présentant une TT n’auront généralement pas de signes d’infection sur des échantillons d’urine correctement prélevés
- Échographie Doppler couleur (CDUS). Il s’agit d’un test de confirmation identifiant l’absence de flux vasculaire vers un testicule
Torsion testiculaire
Épidémiologie
L’incidence rapportée de la TT peut atteindre 1 sur 4 000 chez les sujets de sexe masculin âgés de 25 ans ou moins7 et descendre jusqu’à 3,8 pour 100 000 chez les sujets de sexe masculin âgés de 18 ans ou moins.8 L’incidence présente une distribution bimodale, avec un pic durant la première année de vie (généralement le premier mois) et la période pubertaire (12 ans). Cette distribution bimodale correspond à la différence de physiopathologie chez le nouveau-né et au cours de la période péripubertaire (torsion extravaginale versus torsion intravaginale du cordon spermatique, respectivement).
Pathogénie
La TT survient lorsque le testicule tourne autour de son cordon spermatique. La torsion du cordon comprime le réseau veineux du testicule, entraînant un œdème testiculaire, une restriction du retour veineux, puis secondairement une occlusion de l’apport artériel. Une ischémie prolongée est délétère et, si elle n’est pas résolue, réduit au minimum les chances de viabilité testiculaire.
Deux types de TT existent : torsion intravaginale et torsion extravaginale.
Torsion extravaginale survient lorsque la tunique vaginale et son contenu, y compris le testicule, tournent en bloc autour de l’axe du cordon spermatique. Ce phénomène est rendu possible par des couches scrotales non fusionnées au cours de la période néonatale, permettant à la tunique vaginale de se mobiliser à l’intérieur du compartiment hémiscrotal tapissé par le fascia de Dartos. La torsion extravaginale survient exclusivement pendant la période néonatale ou en prénatal et a été rapportée jusqu’à 1–3 mois après la naissance.9 La TT néonatale est rare comparée à la torsion intravaginale, avec une incidence de 6.1 pour 100,000.10
Torsion intravaginale survient lorsque le testicule vrille autour du cordon spermatique à l’intérieur de la tunique vaginale. La “déformation en battant de cloche”, dite ainsi, est le principal facteur de risque prédisposant à la torsion intravaginale. Normalement, les feuillets viscéral et pariétal de la tunique vaginale sont fusionnés en arrière et en bas, maintenant le testicule à l’intérieur du compartiment de la tunique vaginale. Chez les hommes présentant une déformation en battant de cloche, la tunique vaginale englobe entièrement le testicule, l’épididyme et la portion distale du cordon spermatique sans points de fusion entre les feuillets viscéral et pariétal.11 Une série d’autopsies a rapporté une incidence de 12 % de la déformation en battant de cloche, ce qui, fait notable, est supérieur à l’incidence de la TT.12 L’incidence élevée de la déformation en battant de cloche bilatérale justifie une orchidopexie préventive du côté controlatéral non atteint.
Il convient de noter que la torsion périnatale (extravaginale) n’est pas considérée comme associée à une déformation en battant de cloche controlatérale et à un risque ultérieur de TT intravaginale. À l’inverse, une torsion intravaginale d’un côté signale probablement la présence d’une déformation en battant de cloche controlatérale et le risque d’une torsion intravaginale controlatérale ultérieure et métachrone. Dans une série opérée par un seul chirurgien portant sur 50 patients consécutifs emmenés au bloc opératoire pour exploration d’un testicule impalpable révélant un moignon testiculaire, un seul patient présentait des signes d’une déformation en battant de cloche controlatérale. Les auteurs ont opposé cela à 27 cas francs de TT chez des garçons plus âgés, dont 21 (78 %) présentaient une déformation en battant de cloche controlatérale.13
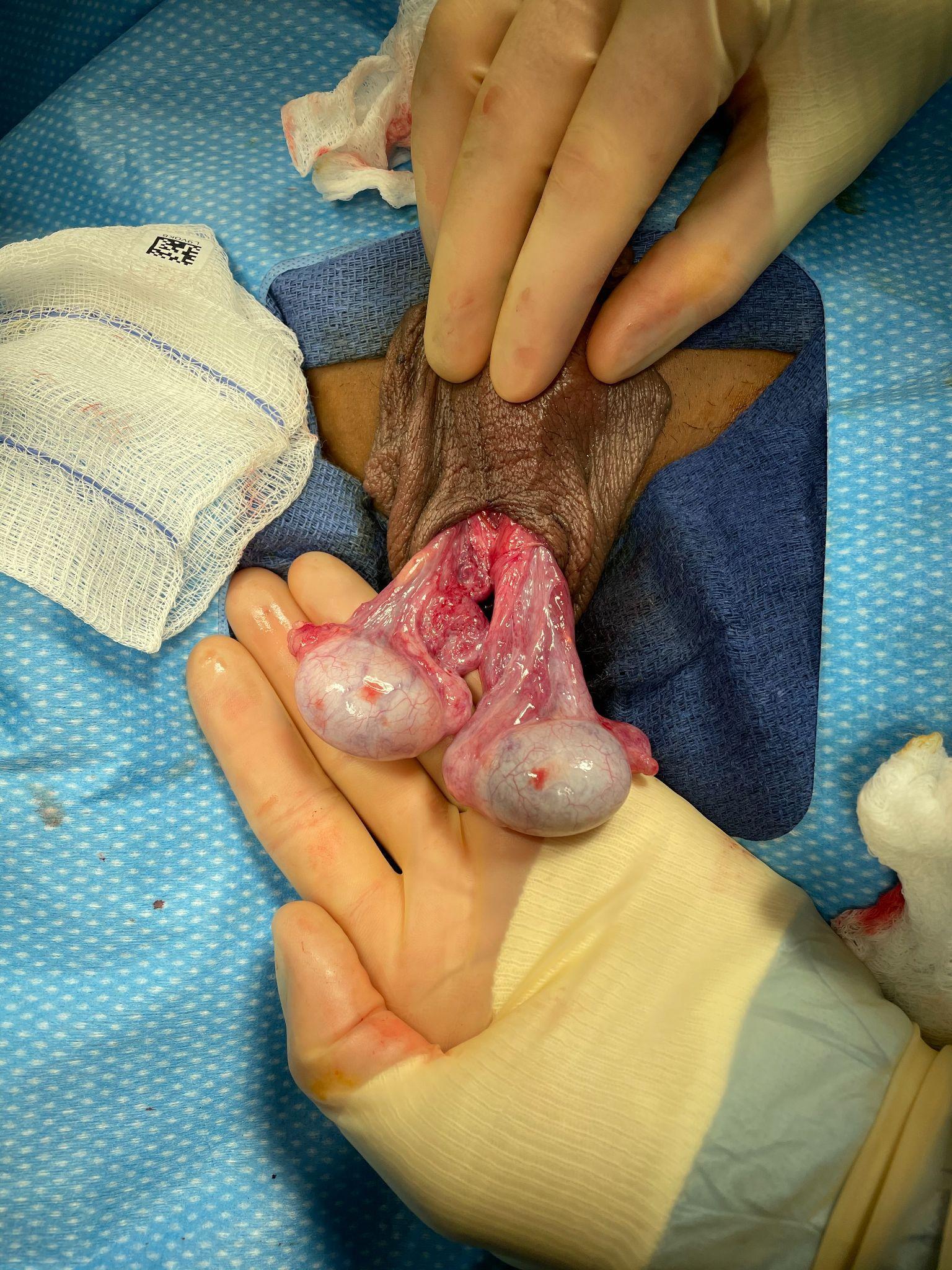
Figure 2 Anomalie en battant de cloche dans un cas de torsion intravaginale (le testicule gauche a subi une détorsion). Aucun des deux testicules ne présente de fusion des feuillets viscéral et pariétal de la tunique vaginale et, par conséquent, la tunique vaginale s’est rétractée haut sur le cordon spermatique et les deux testicules pendent librement, présentant une position transversale par rapport au cordon spermatique. On peut imaginer que si le feuillet pariétal de la tunique vaginale était intact, les testicules pendraient entièrement à l’intérieur de la tunique vaginale, comme le battant d’une cloche.
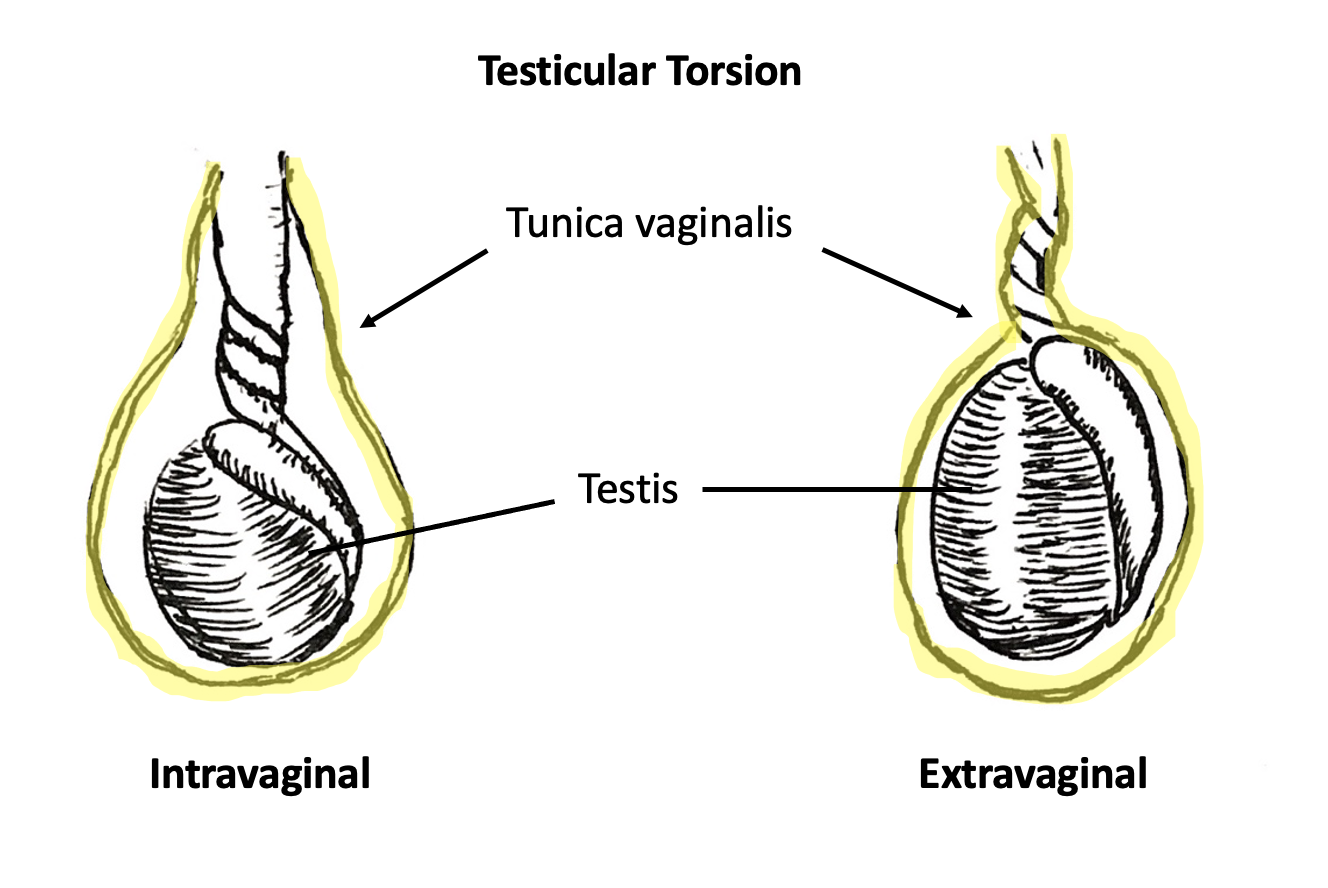
Figure 3 Torsion intravaginale (gauche) et torsion extravaginale (droite). La tunique vaginale est représentée en jaune. En cas de torsion intravaginale, la torsion du cordon spermatique survient séparément et à l’intérieur de la tunique vaginale. En cas de torsion extravaginale, le cordon spermatique et la tunique vaginale tournent comme une seule unité.
Évaluation et diagnostic de la torsion testiculaire chez le nouveau-né
La présentation d’un nouveau-né atteint d’une TT extravaginale est variable, ce qui reflète probablement à la fois le processus pathologique et les circonstances entourant l’accouchement et les soins précoces d’un nouveau-né. Les nouveau-nés peuvent présenter un œdème du périnée au cours du processus d’accouchement, et le scrotum peut paraître particulièrement augmenté de volume et érythémateux dans les premières heures suivant la naissance. Il peut également exister un effet des hormones maternelles. Les hydrocèles congénitales sont fréquentes et peuvent être plus volumineuses immédiatement après la naissance. Pris ensemble, ces changements peuvent rendre difficile, pour les cliniciens, la différenciation, à la seule palpation, des structures anatomiques spécifiques de l’épididyme et du testicule.
La TT extravaginale chez un nouveau-né se présente couramment par un hémiscrotum augmenté de volume et induré. Les équipes d’accouchement et de soins postnatals doivent être attentives aux différences subtiles à l’examen entre les deux hémiscrotums. L’hémiscrotum droit et l’hémiscrotum gauche doivent être inspectés et palpés individuellement, et non comme un ensemble. Une fermeté accrue d’un côté, la perte des rides scrotales ou des modifications cutanées asymétriques doivent être notées et conduire à répéter les examens. Des constatations notables à l’examen initial ou des changements aux examens sériés doivent entraîner une consultation urologique en urgence.
La torsion extravaginale constatée au moment de la naissance est peu susceptible d’être sauvable. Dans une revue de la littérature, plus de 90 % des torsions néonatales considérées comme “prénatales” ou “postnatales” ont fait l’objet d’une orchidectomie unilatérale.14 Plus important que de tenter de sauver le côté le plus manifestement atteint est d’établir un diagnostic en temps opportun ou de prévenir une torsion extravaginale asynchrone. Cela nécessite fréquemment une exploration chirurgicale, car les constatations à l’examen scrotal unilatéral peuvent être si marquées qu’elles masquent celles du côté controlatéral. De plus, le CDUS est techniquement difficile chez un nouveau-né, en particulier dans les centres où les échographistes ne sont pas habitués à réaliser des examens chez les nouveau-nés. L’exploration urgente du scrotum néonatal en cas de suspicion de torsion extravaginale néonatale unilatérale est controversée. La décision d’explorer chirurgicalement le scrotum d’un nouveau-né de sexe masculin dans un contexte d’examen unilatéral évocateur de torsion extravaginale met en balance la faible probabilité de sauvetage du testicule atteint et les risques anesthésiques pour le nouveau-né, face aux conséquences rares mais dévastatrices d’une torsion testiculaire extravaginale asynchrone. Les cas publiés de torsion extravaginale bilatérale asynchrone abondent dans la littérature. Des publications récentes ont tenté de quantifier le risque de torsion asynchrone chez le nouveau-né. Une revue de la littérature englobant 152 études représentant 1336 patients a rapporté que 11.8 % de tous les épisodes de torsion néonatale étaient asynchrones, avec un délai médian jusqu’à la seconde torsion de 1 jour. Les auteurs ont calculé un nombre nécessaire pour traiter (p. ex., explorer chirurgicalement) afin d’éviter une orchidectomie bilatérale de 1.6, et un nombre nécessaire pour traiter pour éviter une atrophie testiculaire isolée de 2.6. Une autre revue de dossiers sur 20 ans, monocentrique, a rapporté un risque de 3 % de torsion périnatale bilatérale asynchrone.15 Compte tenu de l’amélioration de la sécurité de l’anesthésie périnatale au cours des dernières décennies, les auteurs estiment que les bénéfices d’une exploration chirurgicale précoce et urgente devraient être envisagés en cas de torsion périnatale unilatérale.
Évaluation et diagnostic chez l’enfant plus âgé
Pour tout patient présentant une douleur scrotale d’apparition aiguë, un diagnostic de TT doit être rapidement confirmé ou écarté. C’est le diagnostic qui représente la menace la plus urgente pour l’organe. Les cliniciens doivent garder à l’esprit qu’un interrogatoire ciblé et un examen physique constituent les seuls prérequis à l’exploration chirurgicale. Le CDUS peut confirmer le diagnostic suspecté de TT ou exclure une ischémie de l’organe cible. La présence d’un flux vasculaire au CDUS n’exclut pas l’existence d’une ischémie en développement (car le drainage veineux est susceptible d’être réduit avant l’apparition de l’œdème et de la congestion vasculaire qui limitent l’afflux artériel), d’une TT récente ou intermittente, ou d’une torsion incomplète ou partielle. Dans ce dernier contexte, le cordon spermatique peut tourner autour de son axe suffisamment pour entraîner une compromission vasculaire, mais pas suffisamment pour provoquer un arrêt brusque du flux sanguin.
Anamnèse
La présentation classique de la TT intravaginale consiste en une douleur testiculaire d’apparition aiguë chez un garçon péripubère. Les patients ou leurs parents décrivent souvent une apparition brutale d’une douleur intense. La douleur peut débuter au repos, et les patients rapportent fréquemment se réveiller de leur sommeil en raison d’une douleur soudaine. Les patients peuvent rapporter une douleur après un traumatisme du scrotum. Dans ce dernier contexte, on émet l’hypothèse que le traumatisme en lui‑même est peu susceptible d’être la cause de la TT, mais plutôt un événement mal rappelé ou sans lien. En fait, des antécédents de traumatisme génital récent ont été identifiés comme une cause d’erreur diagnostique et, par conséquent, de retard de prise en charge.2
Les symptômes associés fréquents peuvent inclure la douleur abdominale, les nausées et les vomissements.16 Il est important de noter que la douleur abdominale et/ou les nausées, avec ou sans vomissements, peuvent précéder l’apparition de la douleur testiculaire. Cela crée une énigme diagnostique, aux conséquences potentiellement néfastes, pour les cliniciens qui axent leur examen sur l’abdomen et omettent un examen génito-urinaire. Il a été démontré que la douleur abdominale isolée est significativement associée à des présentations retardées (>24 heures) et à des taux plus élevés d’orchidectomie.2
La présence de symptômes associés peut aider à hiérarchiser les diagnostics différentiels, car la torsion de l’appendice testiculaire ou de l’appendice épididymaire, ainsi que l’épididymite ou l’orchite, sont plus susceptibles de se manifester par une douleur scrotale isolée. Les patients rapportent rarement une dysurie ou un début progressif de la douleur. Ces symptômes doivent amener les cliniciens à envisager d’autres diagnostics, tels qu’une épididymite (stérile ou bactérienne), une orchite ou une infection des voies urinaires.
Examen physique
Un examen abdominal et génito-urinaire doit être réalisé. La peau scrotale peut révéler un érythème, une induration ou une chaleur locale. Une hydrocèle tendue avec diminution des plis scrotaux est souvent observée. Chez les patients à peau claire se présentant tardivement, une hydrocèle tendue avec une teinte livide peut traduire un testicule nécrosé et/ou une hématocèle. De telles modifications cutanées se sont avérées prédictives de TT.17
Un réflexe crémastérien anormal suggère une probabilité accrue de TT.17,18 Cependant, la présence d’un réflexe crémastérien normal ne suffit pas à exclure un diagnostic de TT.19 De même, l’absence de réflexe crémastérien n’est pas très spécifique pour le diagnostic. Lors de l’évaluation des réflexes crémastériens, les cliniciens doivent d’abord examiner le côté controlatéral, car l’absence d’un réflexe ipsilatéral n’a de pertinence clinique qu’en présence d’un réflexe controlatéral. Les cliniciens peuvent constater que le testicule atteint présente une position horizontale (déformation en battant de cloche) ou une position “haute” (due au cordon spermatique torsadé qui élève le testicule dans le canal inguinal).
L’utilisation du score TWIST (introduit en 2013 par Barbosa et al) peut permettre aux cliniciens de stratifier le risque des patients en catégories à faible, intermédiaire et haut risque de TT sur la seule base de l’examen clinique. Un score total de 0-7 est calculé après avoir déterminé la présence de 5 signes : testicule dur (2 points), augmentation de volume testiculaire,2 réflexe crémastérien absent,1 nausées/vomissements,1 et testicule haut situé.120 Selon l’algorithme du score, les patients à haut risque (score ≥5) ont une valeur prédictive positive de 100 % pour la TT, ainsi les cliniciens peuvent envisager de procéder directement à une exploration chirurgicale car le bénéfice du CDUS est minime. Les patients à faible risque (≤2) ont une valeur prédictive négative de 100 % pour la TT, ils n’ont donc pas besoin de CDUS pour exclure une torsion. Les patients à risque intermédiaire peuvent bénéficier d’un CDUS pour confirmer le diagnostic. Une étude évaluant l’utilité du score TWIST chez des intervenants non médecins non urologues a déterminé une VPP de 93,5 % et une VPN de 100 % lorsque le haut risque était défini par un score supérieur à 6, le risque intermédiaire comme 1-5, et le faible risque comme 0.21 (Figure 4)
Tableau 1 Le score TWIST et les groupes de stratification du risque. Adapté de Barbosa 2013
| Symptôme | Points attribués |
|---|---|
| Testicule dur | 2 |
| Gonflement testiculaire | 2 |
| Réflexe crémastérien absent | 1 |
| Testicule haut situé | 1 |
| Nausées et/ou vomissements | 1 |
| Total | |
| Risque élevé | ≥5 |
| Risque intermédiaire | 3-4 |
| Risque faible | ≤2 |
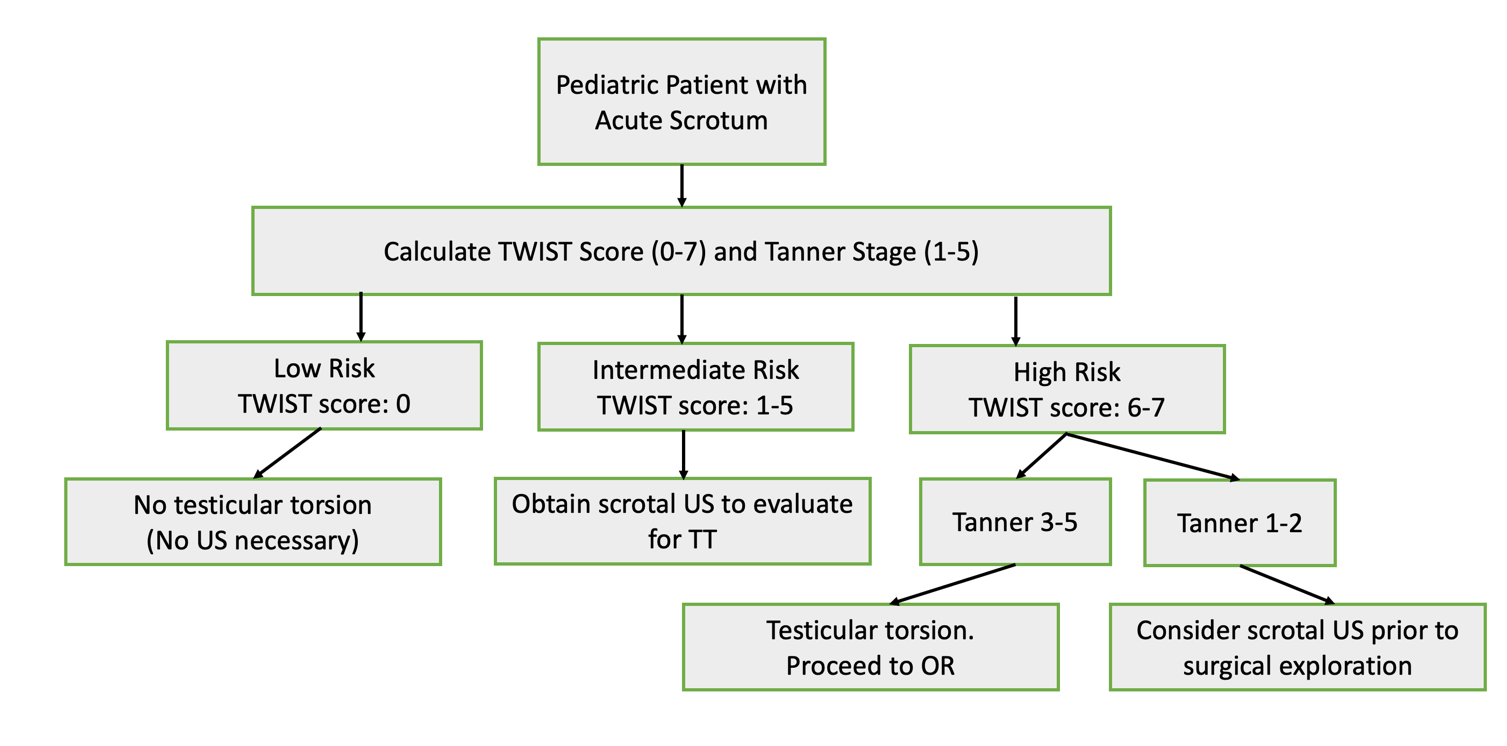
Figure 4 Organigramme de la prise en charge proposée de la torsion testiculaire, adapté de Sheth 2016. Notamment, cette étude a évalué l’utilité du score TWIST auprès de professionnels de santé non médecins et non urologues (afin de refléter le personnel de triage des services d’urgence) et utilise des seuils différents pour les scores à faible, intermédiaire et haut risque par rapport à la description originale de Barbosa et al. 2013
Examens initiaux
L’analyse d’urines (UA) est un test peu coûteux et rapide, utile dans le contexte d’une douleur scrotale aiguë. Elle peut aider à distinguer la TT d’une épididymite bactérienne ou d’une infection urinaire, dans les deux cas, on s’attend à ce que l’UA mette en évidence une pyurie. En cas de TT, l’UA est généralement sans anomalie.
Imagerie
L’utilisation systématique est controversée, et les études évaluant la précision et l’utilité de l’imagerie abondent.22,23,24 Si le diagnostic de TT est équivoque sur la base de l’anamnèse et de l’examen clinique réalisés, alors le recours à l’imagerie peut être envisagé. Toutefois, l’imagerie ne doit pas se substituer à une anamnèse et à un examen clinique adéquats. Des examens d’imagerie inutiles peuvent retarder la chirurgie et augmenter le coût des soins. L’imagerie n’est pas nécessaire pour poser le diagnostic de TT.
Échographie Doppler couleur
Le CDUS est utile pour la visualisation de l’anatomie testiculaire, y compris l’architecture du cordon spermatique, le flux sanguin testiculaire et l’échotexture testiculaire. Une baisse ou une absence du flux sanguin testiculaire à l’US a une spécificité de 99 % et une sensibilité de 63 % pour la TT.24 En règle générale, l’imagerie devrait toujours être comparée au côté controlatéral non atteint. En cas de TT, le testicule atteint peut apparaître œdématié et augmenté de volume. Les cliniciens doivent prêter une attention particulière à la comparaison des volumes testiculaires dans les cas de CDUS équivoque, car cela peut être un indice pour le diagnostic. Une hydrocèle réactionnelle peut également être présente.25 Une échotexture hétérogène en l’absence de signal Doppler indique vraisemblablement le début d’une nécrose de coagulation d’un testicule non viable.
Parfois, un flux artériel normal ou augmenté est visualisé chez un patient présentant une TT, ce qui génère un résultat faussement négatif trompeur. Une étude multicentrique a montré que 24 % de leurs torsions confirmées du cordon spermatique présentaient un flux testiculaire normal ou augmenté à la CDUS préopératoire.26 Sur le plan conceptuel, il a été postulé qu’à mesure que le cordon spermatique se tord, le retour veineux du testicule est probablement affecté avant l’afflux artériel. Ainsi, un flux artériel diminué ou maintenu peut annoncer le début d’une ischémie testiculaire et ne doit pas nécessairement être considéré comme rassurant en cas d’absence ou de diminution du retour veineux. Une diminution du flux sanguin peut évoquer une torsion partielle ou incomplète ainsi qu’une torsion intermittente du cordon spermatique. Il convient de souligner que le Doppler et la mesure des courbes d’onde vasculaires dépendent fortement de l’opérateur et sont nettement plus difficiles à obtenir chez les nourrissons et les jeunes enfants. En cas de discordance entre l’anamnèse, l’examen clinique et les résultats de la CDUS, les cliniciens doivent maintenir un haut degré de suspicion pour une TT partielle ou intermittente.
Échographie à haute résolution
L’échographie haute résolution (HRUS) est une méthode d’imagerie plus sensible (97,3 %) et spécifique (99 %) que le CDUS.26 Elle permet la visualisation directe d’un cordon spermatique en torsion. Des études ont montré que des échographistes et des radiologues bien formés peuvent identifier avec précision la tortuosité du cordon spermatique grâce aux signes dits du cordon spermatique en “forme d’escargot” ou en “tourbillon”. Il existe une controverse dans la littérature quant à l’utilité de l’identification par HRUS des signes de “tourbillon” du cordon spermatique. Lorsqu’elles sont correctement diagnostiquées dans un contexte de flux sanguin testiculaire anormal, ces anomalies du cordon spermatique peuvent constituer une preuve définitive d’une torsion intravaginale en cours. Cependant, une critique fréquente des anomalies du cordon spermatique identifiées à l’HRUS est que la littérature mettant en évidence ces anomalies n’a pas réussi à identifier le dénominateur des cas, c’est-à-dire combien d’enfants présentant une torsion n’ont pas de modifications du cordon spermatique identifiables sur TT. En d’autres termes, l’absence de signes identifiés ou rapportés de tortuosité du cordon spermatique ne doit pas écarter le diagnostic de TT, et les cliniciens ne doivent pas utiliser les seules constatations à l’HRUS du cordon spermatique comme indication d’exploration.
Scintigraphie nucléaire
Ce test utilise du pertechnétate de technétium-99m administré par voie intraveineuse pour évaluer la perfusion testiculaire. Avant la CDUS, la scintigraphie était l’examen d’imagerie de choix en cas de TT suspectée. Des études ont rapporté une sensibilité et une spécificité similaires à celles de la CDUS.27,28 Cependant, l’examen peut prendre plusieurs heures à réaliser, n’est pas toujours facilement disponible et risque d’allonger la durée d’ischémie testiculaire. Pour ces raisons, la scintigraphie est rarement utilisée dans le diagnostic moderne de la TT.
Options de traitement
La TT nécessite une correction chirurgicale urgente. Le délai écoulé depuis le début de la douleur (conceptualisé comme équivalent au temps d’ischémie testiculaire) et le degré de torsion du cordon spermatique influencent directement les taux de sauvetage du testicule.29,30 À titre indicatif, le testicule a le plus de chances d’être viable (>90 % de probabilité) si une exploration scrotale est réalisée dans les 6 premières heures suivant l’apparition des symptômes. Au-delà de cette fenêtre initiale de 6 heures, le testicule peut encore être viable, mais avec des taux qui diminuent de façon abrupte, ce qui souligne l’importance d’une intervention en temps opportun.31 Cependant, même dans ce délai, les patients peuvent présenter un certain degré d’atrophie testiculaire postopératoire due à des lésions ischémiques.
Détorsion manuelle
La détorsion manuelle, ou rotation du testicule dans le scrotum réalisée au chevet, est une option de prise en charge initiale en attendant une consultation urologique et une intervention chirurgicale en urgence ou un transfert vers un autre établissement. La manœuvre peut rétablir partiellement le flux sanguin vers le testicule et améliorer les chances de viabilité du testicule au moment de l’exploration.32,33 La détorsion manuelle ne dispense pas d’une chirurgie et ne doit pas retarder l’intervention chirurgicale.
L’enseignement classique en matière de détorsion manuelle dans la TT est que le testicule se tord autour du cordon spermatique dans une direction latéro-médiale. Les étapes pour réaliser une détorsion manuelle indiquent au clinicien de dérouler le cordon spermatique dans la direction opposée : de médial vers latéral. Le mouvement consistant à faire pivoter le testicule à l’écart de la ligne médiane est communément appelé “ouvrir le livre.” Le clinicien doit saisir le testicule atteint entre le pouce et l’index et faire pivoter délicatement le testicule dans le scrotum vers l’extérieur en direction de la cuisse pour un tour complet de 360 degrés. La réussite de la détorsion manuelle est habituellement suggérée par un soulagement immédiat de la douleur et le retour du flux artériel au CDUS. Plusieurs rotations peuvent être nécessaires selon le nombre de tours que présente le cordon. Dans un scénario idéal, l’échographie au chevet du patient ou le CDUS peuvent être utilisés pour démontrer objectivement une amélioration du flux sanguin. Si le soulagement de la douleur n’est pas obtenu ou s’aggrave lors d’une détorsion manuelle du testicule en l’éloignant de la ligne médiane, une détorsion par rotation vers l’intérieur (médiale) peut être tentée.
Contrairement à cet enseignement classique, des études rétrospectives ont montré qu’au moins un tiers de leurs cas de TT survenaient dans le sens latéral.29,34 Par conséquent, bien que la technique d’« ouverture du livre » soit susceptible de réduire la torsion du cordon spermatique et de rétablir potentiellement le flux sanguin dans la majorité des cas, les cliniciens qui tentent une détorsion manuelle doivent être attentifs à la possibilité soit d’une détorsion incomplète d’un cordon spermatique ayant effectué plusieurs tours, soit d’une augmentation du nombre de degrés de rotation, cette dernière pouvant aggraver le degré d’ischémie. Par conséquent, selon les auteurs, la détorsion manuelle ne devrait pas être tentée si une intervention chirurgicale est rapidement disponible. De plus, la détorsion manuelle ne devrait pas être tentée si le diagnostic est incertain ou si la manœuvre retarde l’intervention chirurgicale définitive. Si les cliniciens qui réalisent la détorsion manuelle ne sont pas ceux qui assureront l’intervention chirurgicale définitive, il est essentiel de communiquer que la manœuvre a été tentée et d’en rapporter le résultat.
Correction chirurgicale
La prise en charge chirurgicale consiste soit en une détorsion et une orchidopexie (fixation du testicule à la paroi scrotale déclive), soit en une orchidectomie du testicule atteint, selon la viabilité de l’organe évaluée en peropératoire. Dans tous les cas, l’orchidopexie du testicule controlatéral constitue le standard de prise en charge, compte tenu de la forte probabilité d’une déformation en « battant de cloche » controlatérale.
Aperçu de la technique chirurgicale:
Les incisions les plus courantes sont l’incision du raphé médian et les incisions horizontales bilatérales. Une incision du raphé médian permet d’explorer chaque hémiscrotum à travers une seule incision.
- Incision scrotale médiane
- Dissection par électrochirurgie à travers le dartos et dans l’hémiscrotum atteint
- Extériorisation de la tunique vaginale à travers l’incision du dartos
- (Inspection de la tunique vaginale et du cordon spermatique à la recherche d’une torsion extravaginale dans les cas de torsion néonatale)
- Incision et éversion de la tunique vaginale pour permettre l’extériorisation et l’inspection du testicule et de l’épididyme atteints. Noter la présence d’une torsion intravaginale du cordon spermatique et la couleur du testicule et de l’épididyme
- Détorsion du cordon spermatique et du testicule, en notant le sens et les degrés de torsion
- Enveloppement du testicule détorsé dans une compresse de gaze tiède
- Effectuer la même dissection par électrochirurgie du dartos sur l’hémiscrotum controlatéral pour exposer la tunique vaginale et le testicule controlatéraux
- Incision et éversion de la tunique vaginale pour permettre l’extériorisation et l’inspection du testicule et de l’épididyme controlatéraux. Noter la présence d’une déformation en battant de cloche
- Revenir au testicule détorsé et répéter l’inspection pour déterminer la viabilité. S’il est manifestement non viable, réaliser une orchidectomie. S’il est viable, réaliser une orchidopexie. Cette évaluation est subjective et varie souvent selon les opérateurs. Si la viabilité paraît indéterminée, les opérateurs peuvent choisir de réaliser une évaluation micro-Doppler du testicule pour rechercher un flux artériel ou d’inciser le testicule par une incision équatoriale afin d’identifier un saignement et des tubules séminifères d’aspect sain secondaires à la levée de la pression du syndrome des loges. Dans le cas où une fasciotomie équatoriale de la tunique vaginale entraîne un saignement de la tunique vaginale, des tubules séminifères d’aspect sain et une amélioration globale de la couleur du testicule, une augmentation de la tunique albuginée par patch de tunique vaginale a été décrite.35 (Vidéo 1)
- Un testicule atteint jugé viable et le testicule controlatéral normal doivent être fixés dans le scrotum pour prévenir une torsion ultérieure. Les testicules doivent être fixés par 3 points de fixation, soit l’un à l’autre (à travers le septum scrotal comme dans une technique de “septopexie”) soit en position déclive dans leur hémiscrotum respectif. Les auteurs utilisent un fil de polypropylène 5-0 (non résorbable)
- Fermer l’incision(s) scrotale(s) de façon classique. Pour les cas où une orchidectomie est réalisée dans le contexte d’une torsion testiculaire de longue date, de présentation tardive, avec œdème important, un drain scrotal peut être laissé pour aider à prévenir une infection, une hématocèle ou la formation d’une hydrocèle
[Vidéo 1](#video-1){:.video-link}. Prise en charge peropératoire de la torsion testiculaire. Dans ce cas, la correction chirurgicale incluait la confection d’un lambeau de la vaginale. Remarque: Cette vidéo a été créée pour et présentée dans la bibliothèque vidéo pédagogique du programme de base de l’American Urological Association.
Suivi suggéré
Les patients qui bénéficient d’une prise en charge chirurgicale pour une torsion testiculaire devraient être revus au moins une fois en consultation externe de suivi afin de vérifier la bonne cicatrisation de la plaie et un examen clinique non préoccupant. Après une tentative de détorsion testiculaire et d’orchidopéxie pour TT, les cliniciens devraient documenter la taille des testicules et la présence ou l’absence d’atrophie du testicule atteint. Le terme “sauvetage testiculaire” devrait être réservé aux testicules atteints qui ont montré un volume conservé lors du suivi.
Au cours du suivi, les auteurs discutent généralement des sujets suivants avec les patients et leurs familles :
- Dans le cadre d’une orchidopexie d’un testicule atteint, l’aspect et le flux vasculaire vers le testicule atteint si le patient devait un jour recevoir une autre CDUS pour une autre raison
- Dans le cadre d’une orchidectomie d’un testicule atteint, une prothèse testiculaire peut être envisagée après l’achèvement de la puberté
- Bien que la torsion testiculaire récidivante soit théoriquement impossible, les patients peuvent ressentir des douleurs ou des anomalies pour d’autres raisons. Les patients peuvent bénéficier d’auto-examens mensuels et doivent alerter immédiatement leurs parents ou leurs médecins s’ils ressentent une douleur ou palpent quelque chose de différent
- Tous les patients, en particulier ceux qui ont subi une orchidectomie pour TT et qui n’ont désormais qu’un testicule, devraient être encouragés à porter une coquille de protection athlétique lors de sports et activités récréatives potentiellement de contact. Il existe des coquilles athlétiques modernes, à profil fin, qui s’insèrent dans des shorts de compression confortables et des pantalons de glissade
Torsion des annexes testiculaires
Le testicule et l’épididyme présentent fréquemment un petit appendice associé au niveau de leur pôle supérieur. L’appendice testiculaire est un reliquat embryologique du canal paramesonéphrique. L’appendice épididymaire est un reliquat embryologique du système du canal mésonéphrique. L’une ou l’autre de ces structures peut se tordre autour de son axe, de la même manière que le cordon spermatique se tord lors d’une TT intravaginale, entraînant une ischémie puis une nécrose. La présentation peut mimer une TT avec début brutal d’une douleur scrotale et d’une augmentation de volume. On relève toutefois certains éléments négatifs pertinents à l’anamnèse et à l’examen physique que les auteurs ont remarqués de manière anecdotique en comparant la torsion des annexes testiculaires avec la TT:
- Les patients présentant une torsion de l’appendice testiculaire sont moins susceptibles de rapporter des nausées et des vomissements. Cela est probablement secondaire à l’absence de sensation viscérale liée à l’ischémie de l’appendice testiculaire par rapport à l’ischémie du testicule
- Les patients présentant une torsion de l’appendice testiculaire sont peu susceptibles de présenter un testicule haut situé dans le scrotum
- Les patients présentant une torsion de l’appendice testiculaire ont souvent un bon flux testiculaire au CDUS avec des constatations caractéristiques d’une petite structure hétérogène et avasculaire adjacente et distincte du testicule36 (Voir Figure 5 pour une image représentative provenant de la collection des auteurs)
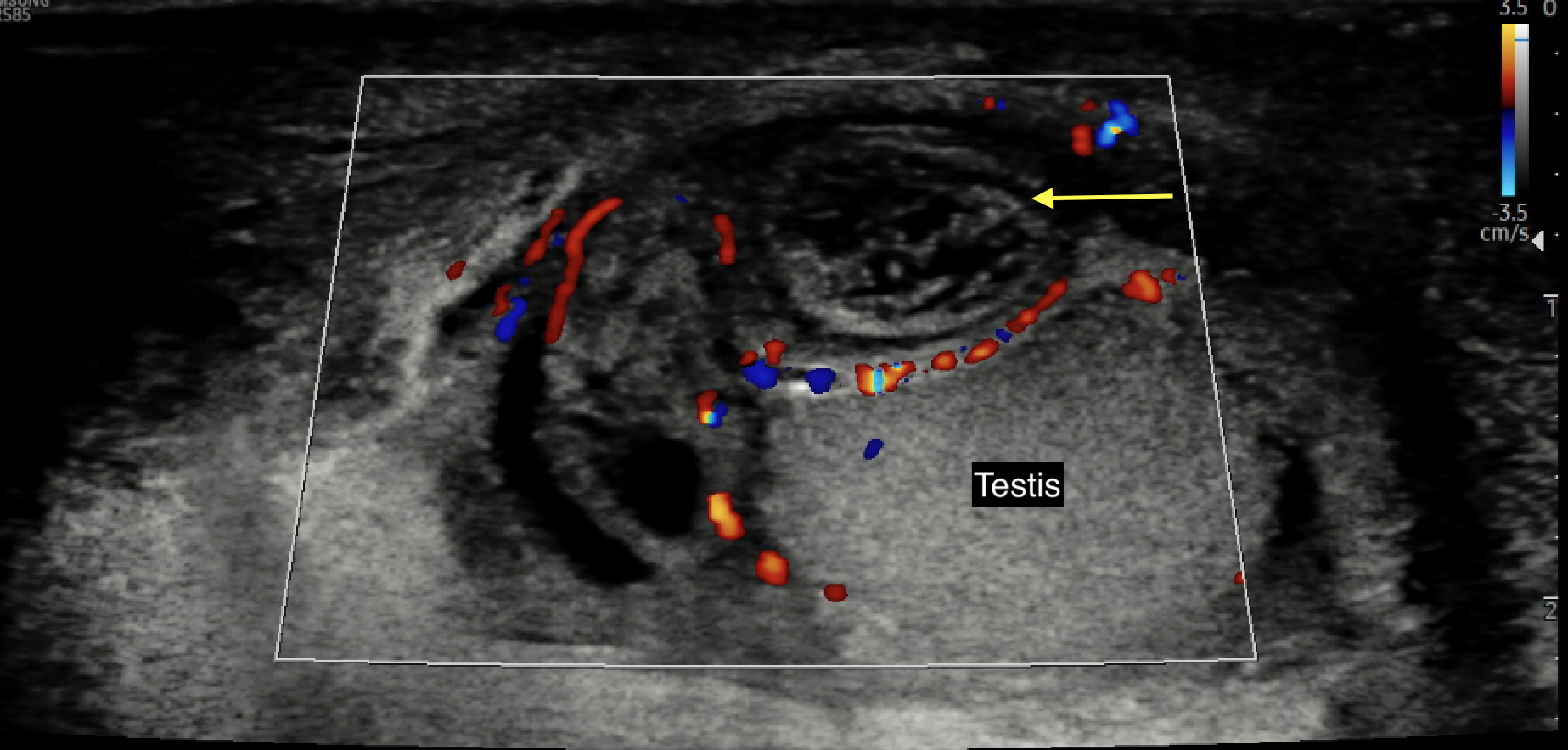
Figure 5 Image d’échographie Doppler couleur d’un appendice testiculaire ou d’un appendice de l’épididyme en torsion, avasculaire, œdémateux et d’aspect hétérogène (flèche jaune)
À l’examen physique, la torsion des annexes testiculaires se manifeste par un hémiscrotum tuméfié et douloureux. Le testicule semblera avoir une position déclive normale. Chez les personnes à peau claire, on peut occasionnellement identifier un signe de “point bleu” sur la paroi scrotale latérale, correspondant à l’aspect de l’appendice testiculaire ischémique à travers une peau scrotale amincie par un sac d’hydrocèle translucide. Chez les patients capables de tolérer un examen approfondi, ce point correspondra à une douleur localisée. À noter que le signe du point bleu n’a été rapporté que dans aussi peu que 10 % des cas de torsion des annexes testiculaires et sera difficile à identifier chez les patients à peau foncée.
Si le diagnostic est incertain ou si une ischémie testiculaire ne peut être écartée, une exploration chirurgicale est recommandée. Lors de l’exploration, le chirurgien trouvera un appendice torsé avec un testicule et un épididyme d’aspect par ailleurs normal (Figure 6 et Figure 7). L’appendice annexiel peut être excisé chirurgicalement et le scrotum refermé. Pour les cas où un bon flux testiculaire est confirmé, que l’anamnèse et les données objectives ne sont pas compatibles avec une TT, et qu’une torsion annexielle est probable, l’exploration chirurgicale peut être différée.
Le traitement de la torsion d’un appendice testiculaire est conservateur et comprend le repos, l’application périodique de glace pendant la phase aiguë, la surélévation du scrotum et des anti-inflammatoires non stéroïdiens (AINS). Les auteurs prescrivent de façon systématique une échographie scrotale de contrôle dans la semaine si la douleur persiste afin de confirmer le diagnostic, puis 4 à 6 semaines après la disparition de la douleur afin de constater que la masse appendicielle observée à l’échographie scrotale initiale a régressé.
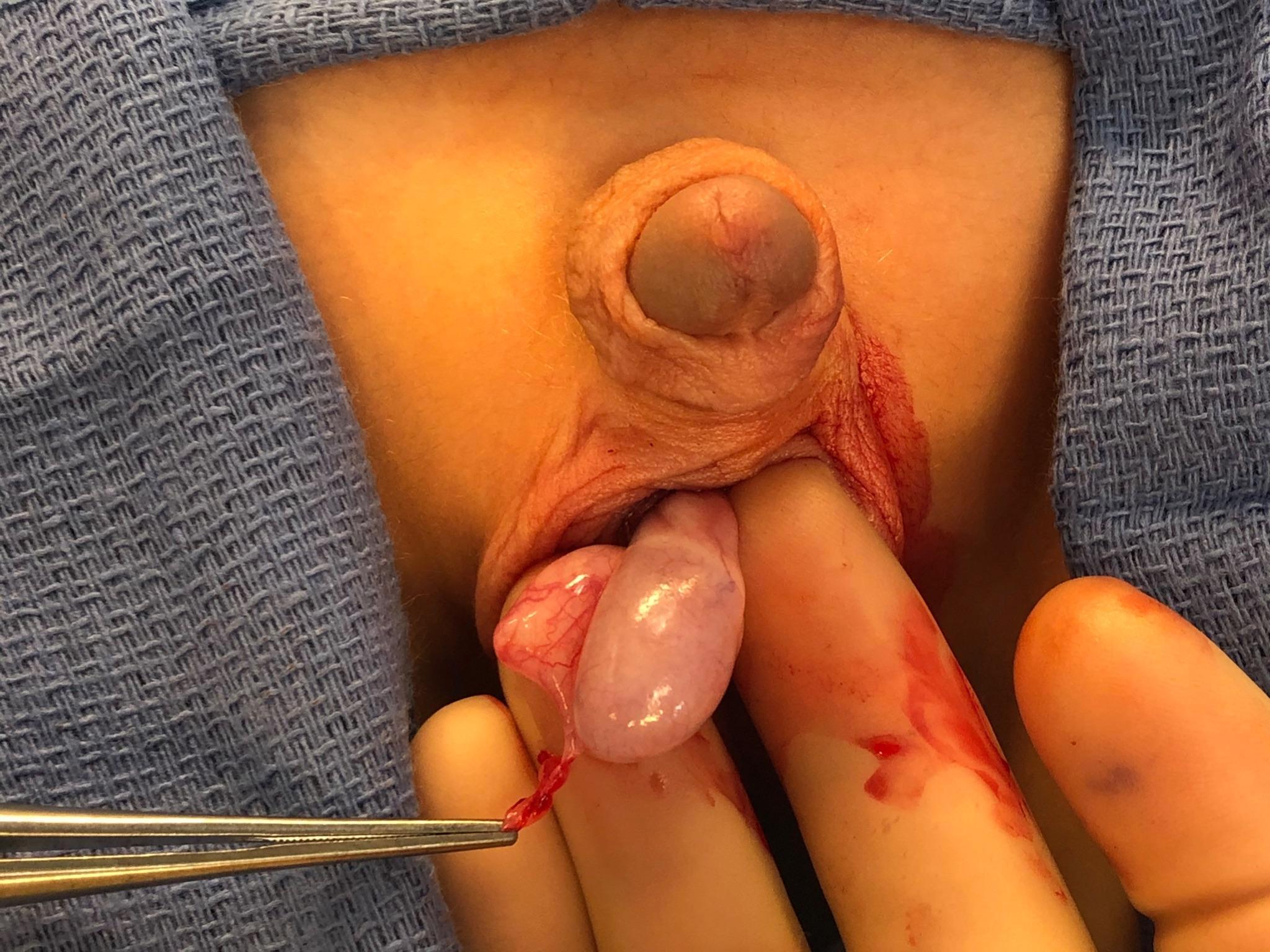
Figure 6 Pince saisissant un appendice de l’épididyme en torsion
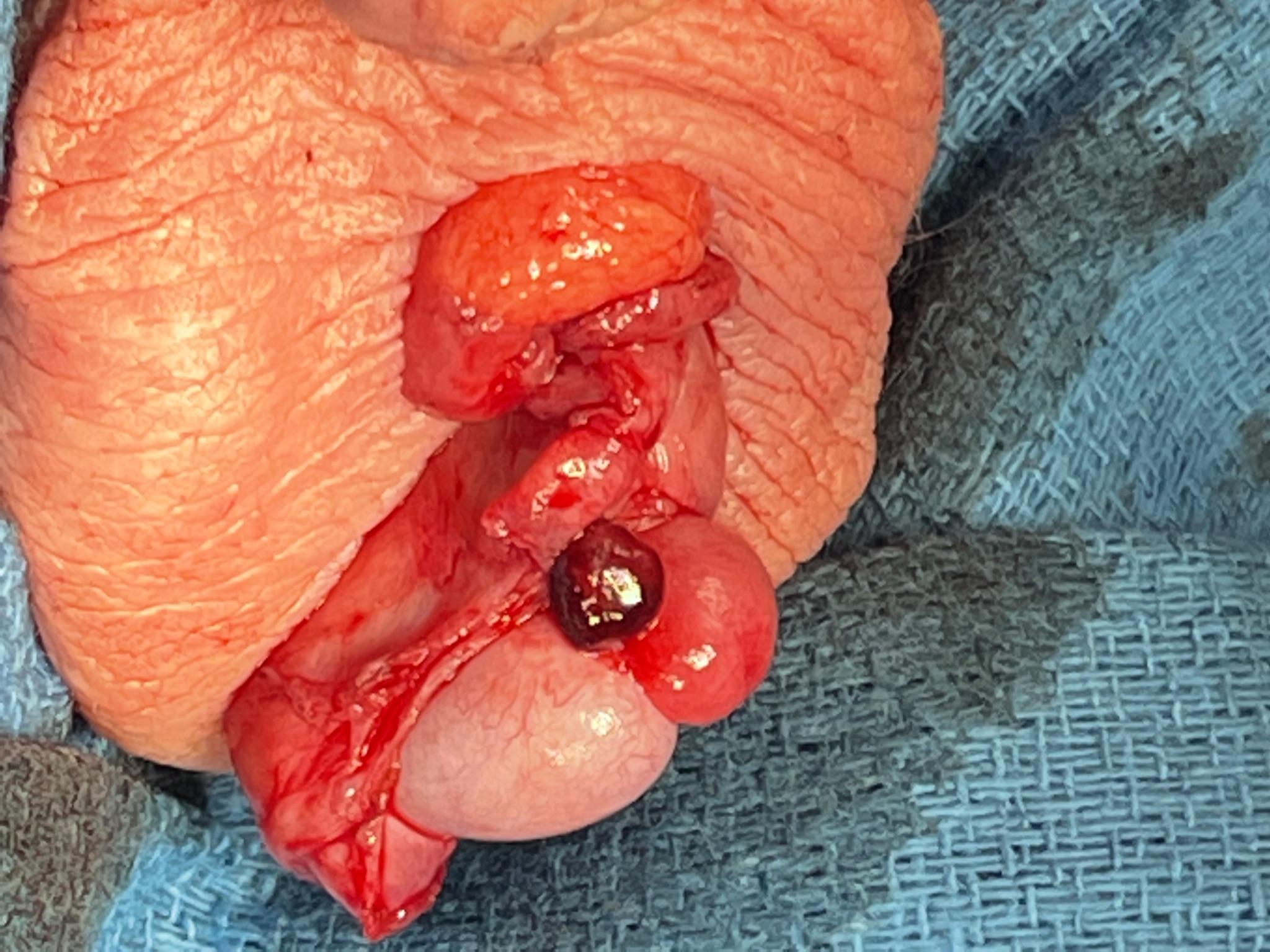
Figure 7 Aspect d’un appendice épididymaire congestionné à l’exploration scrotale dans un contexte d’examen jugé équivoque pour TT
Épididymite
Épidémiologie
L’épididymite est une inflammation de l’épididyme : la structure tubulaire enroulée qui se situe en arrière et au-dessus du testicule de forme ovale. L’épididyme a pour fonction d’assurer le transport et la maturation des spermatozoïdes provenant du testicule. Chez les adolescents, l’épididymite représente 35 à 71 % des cas de douleur scrotale aiguë.37 Bien que l’affection survienne le plus souvent chez les adolescents plus âgés sexuellement actifs, elle peut aussi survenir chez des patients plus jeunes, secondaire à une infection virale ou à une inflammation chimique (due à l’urine).
Pathogénie
Chez les patients plus âgés, l’épididymite survient le plus souvent à la suite d’une infection bactérienne. Typiquement, une infection sexuellement transmissible (IST) en est responsable, en particulier chez les hommes plus jeunes, ce qui entraîne la migration de bactéries de l’urètre vers le canal déférent et l’épididyme. Neisseria gonorrhea et Chlamydia trachomatis sont les agents infectieux les plus fréquents dans cette population. De même, une urine infectée résultant d’une infection des voies urinaires peut refluer dans le canal déférent et provoquer une épididymite. Cela peut être déclenché par le soulèvement de charges lourdes.
Chez les enfants plus jeunes, la cause la plus fréquente d’épididymite est stérile et secondaire à une miction sous pression d’urines « stériles » vers les canaux éjaculateurs et en retour par le canal déférent jusqu’à l’épididyme (dite épididymite « stérile » ou « chimique »). Des étiologies moins fréquentes sont secondaires à des infections virales (p. ex., à des virus identifiés, comme une orchite ourlienne secondaire au virus des Paramyxoviridae, ou à des virus non identifiés), à des traumatismes et à la tuberculose.
Évaluation et diagnostic
Le diagnostic d’épididymite est clinique et constitue souvent un diagnostic d’exclusion. Un patient présentant une installation progressive d’une douleur scrotale, un gonflement scrotal et (éventuellement) de la fièvre doit faire fortement suspecter une épididymite. Ils peuvent également rapporter des symptômes de dysurie, de pollakiurie, d’urgence mictionnelle, d’incontinence urinaire et/ou un écoulement urétral. Chez les jeunes enfants chez qui une épididymite chimique est suspectée, un interrogatoire minutieux sur les mictions et la constipation doit être réalisé. Les parents rapportent souvent que ces enfants retiennent leurs urines pendant de longues périodes, suivies d’une urgence mictionnelle. La constipation peut conduire les garçons à effectuer des mictions et des défécations sous pression; ces deux situations peuvent entraîner un reflux urinaire sous pression dans le canal éjaculateur et le canal déférent.
L’examen physique doit révéler une position verticale normale du testicule, un réflexe crémastérien normal, et un soulagement de la douleur lors de l’élévation du testicule (signe de Prehn). La palpation de l’épididyme sur la face postérieure du testicule déclenchera une douleur.
Le bilan devrait inclure une analyse d’urine et une culture d’urine. Chez les patients plus âgés présentant un interrogatoire ou un examen clinique préoccupants, une échographie Doppler couleur (CDUS) peut être nécessaire pour exclure une torsion testiculaire et d’autres pathologies, allant de la rupture testiculaire aux abcès scrotaux. Chez les enfants plus jeunes chez qui une épididymite chimique est suspectée, 1) une échographie vésicale évaluant la distension vésicale et/ou un résidu post-mictionnel élevé, et 2) une radiographie de l’abdomen sans préparation recherchant une constipation peuvent étayer le diagnostic.
Traitement
Le traitement est variable et dépend de la cause de l’épididymite. Le traitement principal de l’épididymite due à une IST est un traitement antimicrobien approprié. La ceftriaxone et la doxycycline doivent toutes deux être administrées pour traiter N. gonorrhea et C. trachomatis. L’azithromycine peut remplacer la doxycycline chez les patients présentant une allergie ou une contre-indication. Les soins de support supplémentaires comprennent des antalgiques anti-inflammatoires non stéroïdiens et un soutien scrotal. Les partenaires doivent également être évalués et traités par antibiotiques. Le traitement de l’épididymite chimique chez un jeune enfant comprend des soins de support avec des antalgiques anti-inflammatoires non stéroïdiens administrés à heures fixes et des sous-vêtements de maintien. La rétention volontaire urinaire, la miction sous pression et la constipation doivent être prises en charge concomitamment.
Conclusion
En résumé, une “bourse aiguë” est le terme clinique désignant l’apparition rapide d’une bourse douloureuse ou tuméfiée. Le diagnostic différentiel comprend, sans s’y limiter, la torsion testiculaire, la torsion de l’appendice testiculaire et l’épididymite. Une torsion testiculaire doit être écartée avant d’entreprendre le bilan des étiologies alternatives.
Points clés
- L’incidence de la torsion testiculaire (TT) présente une distribution bimodale : la première année de vie (~1 mois d’âge), période où la torsion est plus susceptible d’être extravaginale, et la période pubertaire (~12 ans), où la torsion est plus souvent intravaginale
- La déformation en battant de cloche est le principal facteur de risque prédisposant à la torsion intravaginale
- La TT est un diagnostic clinique : un interrogatoire ciblé et un examen clinique sont les seuls prérequis à l’exploration chirurgicale
- En cas de signes cliniques équivoques, l’échographie Doppler couleur (CDUS) peut être utilisée pour confirmer une ischémie de l’organe cible
- La présence d’un flux vasculaire au CDUS n’exclut pas nécessairement la présence d’une ischémie en développement
- L’imagerie ne doit pas être réalisée si elle retarde de manière significative l’exploration chirurgicale et le traitement définitif
- Se méfier des douleurs abdominales isolées et ne pas oublier de réaliser un examen génito-urinaire. La douleur abdominale isolée comme seul motif de consultation chez un garçon a été associée de manière significative à des présentations tardives (>24 heures) et à des taux plus élevés d’orchidectomie
Références
- Jefferies MT, Cox AC, Gupta A, Proctor A. The management of acute testicular pain in children and adolescents. Bmj 2015; 350 (apr02 5): h1563–h1563. DOI: 10.1136/bmj.h1563.
- Bayne CE, Villanueva J, Davis TD, Pohl HG, Rushton HG. Factors Associated with Delayed Presentation and Misdiagnosis of Testicular Torsion: A Case-Control Study. J Pediatr 2017; 186: 200–204. DOI: 10.1016/j.jpeds.2017.03.037.
- McCombe AW, Scobie WG. Torsion of Scrotal Contents in Children. J Urol 1988; 140 (1): 214–214. DOI: 10.1016/s0022-5347(17)41551-5.
- Kadish HA, Bolte RG. A Retrospective Review of Pediatric Patients With Epididymitis, Testicular Torsion, and Torsion of Testicular Appendages. Pediatrics 1998; 102 (1): 73–76. DOI: 10.1542/peds.102.1.73.
- Caesar RE, Kaplan GW. The Incidence of the Cremasteric Reflex in Normal Boys. J Urol 1994; 152 (2 Part 2): 779–780. DOI: 10.1016/s0022-5347(17)32707-6.
- Bingöl-Koloğlu M, Tanyel FC, Anlar B, Büyükpamukçu N. Cremasteric reflex and retraction of a testis. J Pediatr Surg 2001; 36 (6): 863–867. DOI: 10.1053/jpsu.2001.23956.
- Williamson RCN. Torsion of the testis and allied conditions. Br J Surg 1976; 63 (6): 465–476. DOI: 10.1002/bjs.1800630618.
- Zhao LC, Lautz TB, Meeks JJ, Maizels M. Pediatric Testicular Torsion Epidemiology Using a National Database: Incidence, Risk of Orchiectomy and Possible Measures Toward Improving the Quality of Care. J Urol 2011; 186 (5): 2009–2013. DOI: 10.1016/j.juro.2011.07.024.
- Mano R, Livne PM, Nevo A, Sivan B, Ben-Meir D. Testicular Torsion in the First Year of Life – Characteristics and Treatment Outcome. Urology 2013; 82 (5): 1132–1137. DOI: 10.1016/j.urology.2013.07.018.
- Mathews John C, Kooner G, Mathew DE, Ahmed S, Kenny SE. Neonatal testicular torsion – a lost cause? Acta Paediatr 2008; 97 (4): 502–504. DOI: 10.1111/j.1651-2227.2008.00701.x.
- Taghavi K, Dumble C, Hutson JM, Mushtaq I, Mirjalili SA. The bell-clapper deformity of the testis: The definitive pathological anatomy. J Pediatr Surg 2021; 56 (8): 1405–1410. DOI: 10.1016/j.jpedsurg.2020.06.023.
- Caesar RE, Kaplan GW. Incidence of the bell-clapper deformityin an autopsy series. Urology 1994; 44 (1): 114–116. DOI: 10.1016/s0090-4295(94)80020-0.
- Martin AD, Rushton HG. The Prevalence of Bell Clapper Anomaly in the Solitary Testis in Cases of Prior Perinatal Torsion. J Urol 2014; 191 (5s): 1573–1577. DOI: 10.1016/j.juro.2013.09.013.
- O’Kelly F, Chua M, Erlich T, Patterson K, DeCotiis K, Koyle MA. Delaying Urgent Exploration in Neonatal Testicular Torsion May Have Significant Consequences for the Contralateral Testis: A Critical Literature Review. Urology 2021; 153: 277–284. DOI: 10.1016/j.urology.2020.10.064.
- Erlich T, Ghazzaoui AE, Pokarowski M, O’Kelly F, Lorenzo AJ, Bagli DJ, et al.. Perinatal testicular torsion: The clear cut, the controversial, and the "quiet" scenarios. J Pediatr Surg 2021; 57 (10): 288–297. DOI: 10.1016/j.jpedsurg.2021.10.003.
- Bayne CE, Hsieh MH. Testicular Torsion. In: Cabana MD, editor. The 5-minute Pediatric Consult. 8th. DOI: 10.1016/b978-0-323-47778-9.50163-x.
- Srinivasan A, Cinman N, Feber KM, Gitlin J, Palmer LS. Faculty Opinions recommendation of History and physical examination findings predictive of testicular torsion: an attempt to promote clinical diagnosis by house staff. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2011; 7: 470–474. DOI: 10.3410/f.11135959.12106058.
- Boettcher M, Bergholz R, Krebs TF, Wenke K, Aronson DC. Clinical Predictors of Testicular Torsion in Children. Urology 2012; 79 (3): 670–674. DOI: 10.1016/j.urology.2011.10.041.
- Beni-Israel T, Goldman M, Bar Chaim S, Kozer E. Clinical predictors for testicular torsion as seen in the pediatric ED. Am J Emerg Med 2010; 28 (7): 786–789. DOI: 10.1016/j.ajem.2009.03.025.
- Barbosa JA, Tiseo BC, Barayan GA. Development and Initial Validation of a Scoring System to Diagnose Testicular Torsion in Children. Yearbook of Urology 2013; 2013: 6–7. DOI: 10.1016/j.yuro.2013.06.025.
- Sheth KR, Keays M, Grimsby GM, Granberg CF, Menon VS, DaJusta DG, et al.. Diagnosing Testicular Torsion before Urological Consultation and Imaging: Validation of the TWIST Score. J Urol 2016; 195 (6): 1870–1876. DOI: 10.1016/j.juro.2016.01.101.
- Jefferson RH, Perez LM, Joseph DB. Critical Analysis of the Clinical Presentation of Acute Scrotum: A 9-Year Experience at a Single Institution. J Urol 1997; 158 (3): 1198–1200. DOI: 10.1016/s0022-5347(01)64426-4.
- Friedman N, Pancer Z, Savic R, Tseng F, Lee MS, Mclean L, et al.. Accuracy of point-of-care ultrasound by pediatric emergency physicians for testicular torsion. J Pediatr Urol 2019; 15 (6): 608.e1–608.e6. DOI: 10.1016/j.jpurol.2019.07.003.
- Karmazyn B, Steinberg R, Kornreich L, Freud E, Grozovski S, Schwarz M, et al.. Clinical and sonographic criteria of acute scrotum in children: a retrospective study of 172 boys. Pediatr Radiol 2005; 35 (3): 302–310. DOI: 10.1007/s00247-004-1347-9.
- Bandarkar AN, Blask AR. Testicular torsion with preserved flow: key sonographic features and value-added approach to diagnosis. Pediatr Radiol 2018; 48 (5): 735–744. DOI: 10.1007/s00247-018-4093-0.
- Kalfa N, Veyrac C, Lopez M, Lopez C, Maurel A, Kaselas C, et al.. Multicenter Assessment of Ultrasound of the Spermatic Cord in Children With Acute Scrotum. J Urol 2007; 177 (1): 297–301. DOI: 10.1016/j.juro.2006.08.128.
- NUSSBAUM BLASK ANNAR, BULAS DOROTHY, SHALABY-RANA EGLAL, RUSHTON GIL, SHAO CHENG, MAJD MASSOUD. Color Doppler sonography and scintigraphy of the testis: A prospective, comparative analysis in children with acute scrotal pain. Pediatr Emerg Care 2002; 18 (2): 67–71. DOI: 10.1097/00006565-200204000-00001.
- Paltiel HJ, Connolly LP, Atala A, Paltiel AD, Zurakowski D, Treves ST. Acute Scrotal Symptoms in Boys With an Indeterminate Clinical Presentation: Comparison of Color Doppler Sonography and Scintigraphy. J Urol 1998; 161 (4): 1408–1408. DOI: 10.1016/s0022-5347(01)61728-2.
- SESSIONS ANNETTEE, RABINOWITZ RONALD, HULBERT WILLIAMC, GOLDSTEIN MARTINM, MEVORACH ROBERTA. Testicular Torsion: Direction, Degree, Duration and Disinformation. J Urol 2003; 169: 663–665. DOI: 10.1097/00005392-200302000-00059.
- Castañeda-Sánchez I, Tully B, Shipman M, Hoeft A, Hamby T, Palmer BW. Testicular torsion: A retrospective investigation of predictors of surgical outcomes and of remaining controversies. J Pediatr Urol 2017; 13 (5): 516.e1–516.e4. DOI: 10.1016/j.jpurol.2017.03.030.
- Mellick LB, Sinex JE, Gibson RW, Mears K. A Systematic Review of Testicle Survival Time After a Torsion Event. Pediatr Emerg Care 2019; Publish Ahead of Print: 821–825. DOI: 10.1097/pec.0000000000001287.
- Dias Filho AC, Oliveira Rodrigues R, Riccetto CLZ, Oliveira PG. Improving Organ Salvage in Testicular Torsion: Comparative Study of Patients Undergoing vs Not Undergoing Preoperative Manual Detorsion. J Urol 2017; 197 (3 Part 1): 811–817. DOI: 10.1016/j.juro.2016.09.087.
- Garel L, Dubois J, Azzie G, Filiatrault D, Grignon A, Yazbeck S. Preoperative manual detorsion of the spermatic cord with Doppler ultrasound monitoring in patients with intravaginal acute testicular torsion. Pediatr Radiol 2000; 30 (1): 41–44. DOI: 10.1007/s002470050012.
- Yecies T, Bandari J, Schneck F, Cannon G. Direction of Rotation in Testicular Torsion and Identification of Predictors of Testicular Salvage. Urology 2018; 114: 163–166. DOI: 10.1016/j.urology.2017.11.034.
- Kutikov A, Casale P, White MA, Meyer WA, Chang A, Gosalbez R, et al.. Testicular Compartment Syndrome: A New Approach to Conceptualizing and Managing Testicular Torsion. Urology 2008; 72 (4): 786–789. DOI: 10.1016/j.urology.2008.03.031.
- Lev M, Ramon J, Mor Y, Jacobson JM, Soudack M. Sonographic appearances of torsion of the appendix testis and appendix epididymis in children. J Clin Ultrasound 2015; 43 (8): 485–489. DOI: 10.1002/jcu.22265.
- Lehmann C, Biro FM, Slap GB. Chapter 20 - Testicular and Scrotal Disorders. Adolescent Medicine. Philadelphia: Mosby; 2008.
Dernière mise à jour: 2025-09-22 07:59