33: Hypospadias réopératoire
Ce chapitre prendra environ 17 minutes de lecture.
Introduction
L’hypospadias secondaire est un terme réservé aux patients présentant des complications anatomiques et fonctionnelles persistantes après de multiples réparations correctrices de l’hypospadias. Celles-ci comprennent la formation de sténose, la fistule uréthrocutanée, la déhiscence du gland, la déhiscence urétrale, une chordée persistante et une déformation du gland. L’hypospadias se définit par trois caractéristiques principales : un méat urétral en position ventrale, un degré variable de chordée et un aspect 'capuchonné’ du prépuce dû à l’excès de peau préputiale dorsale, chaque composante présentant un large éventail de sévérité. Ainsi, chez les patients qui consultent pour une chirurgie de reprise après une réparation primaire, il est vital de reconnaître la combinaison des composantes individuelles qui n’a pas permis d’optimiser le résultat lors d’une chirurgie de reprise. On observe également un taux plus élevé de fistulisation récidivante et de sténoses en raison d’une vascularisation tissulaire réduite.
Un autre aspect critique à garder à l’esprit est que la population de patients nécessitant une réparation secondaire tend à être plus âgée, des études mettant en évidence un degré significatif de comorbidité psychologique et de troubles du neurodéveloppement.1,2 La majorité des ‘cripples’ de l’hypospadias auraient en moyenne subi plus de trois tentatives d’urétroplastie infructueuses, et les échecs ont tendance à survenir de nombreuses années après l’obtention d’un résultat initial jugé satisfaisant.3 Anthony Mundy a décrit l’ampleur de ce défi dans la prise en charge de ces cohortes de patients dans son éditorial. Il a souligné qu’il est presque impossible d’écrire un bon article dans une revue sur l’échec de la réparation de l’hypospadias.4 En reconnaissant les complications après une réparation primaire de l’hypospadias, on ne peut adopter une ‘one size fits all approach’ mais il faut une approche individualisée. Ce chapitre présente l’incidence et les facteurs prédisposants et propose un algorithme général de prise en charge pour les enfants nécessitant une chirurgie de reprise de l’hypospadias. En outre, la technique chirurgicale préférentiellement utilisée dans notre institution sera décrite. Ce chapitre passera également en revue des stratégies alternatives pour chacune des complications individuelles courantes qui conduisent secondairement à la nécessité d’une nouvelle intervention.
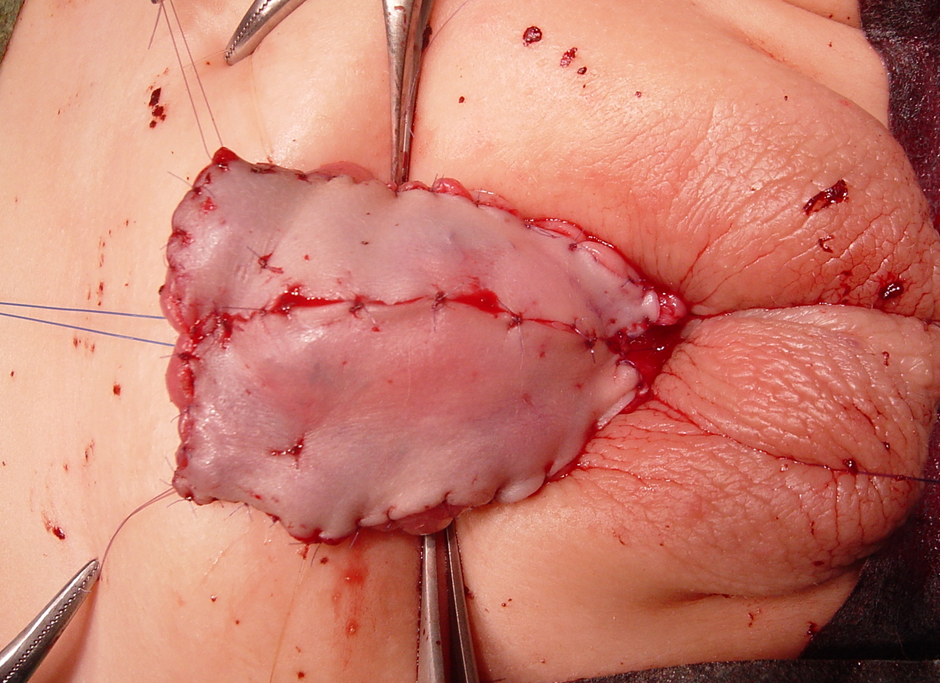
Figure 1 Greffe cutanée préputiale avec sutures de capitonnage au premier temps de la réparation de l’hypospadias. Notez le gland, qui a été fendu et largement écarté.
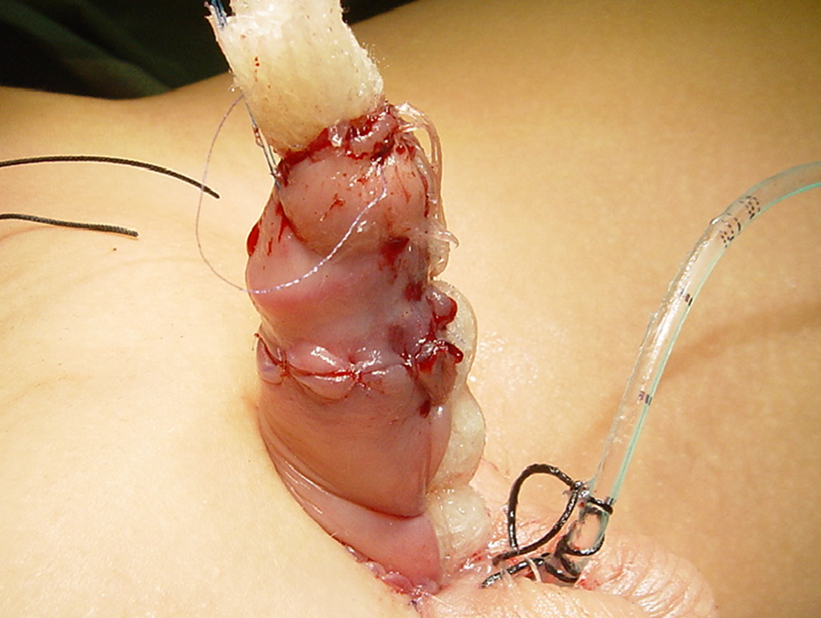
Figure 2 jelonet enroulé fixé pour maintenir l’humidité et immobiliser la greffe cutanée.
Incidence
Les chirurgies de reprise dépendent principalement de deux facteurs déterminants : le volume d’activité de l’établissement et l’expérience technique du chirurgien opérateur. Par conséquent, cette incidence varie largement d’un centre à l’autre. Barbagli et al ont rapporté, dans leur analyse rétrospective d’une seule cohorte d’adolescents, que 50 % des patients présentant une sténose urétrale pénienne avaient des antécédents d’échec de la réparation de l’hypospadias. Au sein de la cohorte, 16,4 % avaient subi une intervention pour un hypospadias distal primaire, et la plupart avaient eu plus d’une intervention pour corriger l’anomalie initiale. Sur le plan démographique, 21,2 % des patients étaient âgés de 1 à 16 ans, et 38,4 % de 17 à 20 ans.5 Ces résultats ont mis en évidence la nécessité d’un suivi à long terme et ont souligné la nécessité d’une transition efficace de la prise en charge.
Facteurs de risque
Les complications de l’urétroplastie sont multipliées par deux chez les personnes subissant une deuxième urétroplastie pour hypospadias par rapport à celles opérées en première intention. Ces risques augmentent jusqu’à 40 % en cas de trois réinterventions ou plus.6 L’étiopathogénie des échecs de réparation de l’hypospadias est multifactorielle. L’infection postopératoire, l’extravasation d’urine, les tissus cicatriciels résiduels, l’hématome et des techniques chirurgicales inadéquates contribuent à altérer la cicatrisation tissulaire du greffon et à provoquer une ischémie. Les tissus ventraux cicatriciels, associés au manque de tissus environnants dans les hypospadias réparés secondairement, prédisposent les patients à une évolution défavorable.7 Théoriquement, le décalage entre la croissance de la néourètre reconstruite et la poussée de croissance des tissus caverneux environnants au début de la puberté peut potentiellement aboutir à un tube court et étroit et se manifester par une sténose. Dans la population pédiatrique, il est reconnu qu’un âge plus avancé au moment de la réparation est associé à un risque plus élevé de complications.8 Selon nous, la réparation secondaire doit être réalisée par un chirurgien expérimenté en hypospadias dans un centre à haut volume d’activité. Des données indiquent que le volume d’activité chirurgicale est positivement corrélé aux résultats des patients, en particulier dans ce groupe de patients.9
Diagnostic
L’évaluation clinique des patients ne diffère pas sensiblement de celle des patients se présentant initialement pour un hypospadias. Les détails opératoires des interventions antérieures sont indispensables lorsque les patients se présentent en provenance d’un autre centre. Lorsqu’une réparation est envisagée, il convient de documenter la localisation du méat, le volume du gland, la longueur pénienne, la chordée récidivante (le cas échéant), la profondeur et la largeur de la plaque urétrale. D’autres considérations tout aussi cruciales sont l’étendue des tissus cicatriciels et la disponibilité de sites donneurs de greffon, dans l’hypothèse où une approche en deux temps serait retenue. Un examen clinique approfondi est obligatoire et doit être consigné de manière détaillée; des examens radiologiques complémentaires sont rarement nécessaires. Les caractéristiques du patient, ainsi que les préférences techniques et l’expérience du chirurgien, influenceront le choix du type de réparation. Enfin, les risques et bénéfices potentiels de la réparation secondaire doivent être discutés avec les parents dans le cadre d’un processus décisionnel partagé.
Planification périopératoire
Entreprendre une chirurgie de reprise pour un hypospadias est techniquement complexe et associée à des taux de complications plus élevés. Le résultat fonctionnel primera toujours sur l’esthétique, ce qui doit être communiqué clairement. La localisation « normale » du méat est largement considérée comme l’extrémité distale du gland. Cependant, il a été rapporté qu’une variation significative de la position du méat permet de préserver la fonction sexuelle et la fonction mictionnelle à l’âge adulte chez des hommes présentant un hypospadias non traité.10 Au-delà du seul site méatal, une enquête a constaté que des hommes atteints d’un hypospadias « plus léger » ou distal non traité rapportent des difficultés lors des rapports sexuels, principalement associées à la courbure pénienne, mais sans problèmes urinaires significatifs par rapport aux hommes normaux.10 Compte tenu de ce résultat d’enquête et appliqué au contexte des reprises chirurgicales, la correction de la chordée serait la considération primordiale. Si une approche chirurgicale en deux temps est envisagée, un intervalle minimal de 6 mois est recommandé entre les procédures pour permettre une cicatrisation adéquate. Des adjuvants destinés à soutenir la cicatrisation tissulaire lors des reprises de chirurgie de l’hypospadias ont été rapportés dans la littérature, en particulier les injections de nitroglycérine et l’oxygénothérapie hyperbare pour augmenter la vascularisation tissulaire et favoriser la cicatrisation.11 Toutefois, ces traitements de soutien ne sont pas encore largement acceptés. Chez les enfants présentant un petit gland pénien et un phallus court, un débat persistant existe au sein de la communauté quant à l’utilisation d’une stimulation androgénique préopératoire. Certains milieux en préconisent l’emploi dans les hypospadias sévères afin d’augmenter la longueur du phallus, la circonférence du gland, la vascularisation pénienne et la robustesse des tissus, éléments essentiels à toute reprise. Cependant, des données contradictoires suggèrent qu’une stimulation hormonale préopératoire est associée à une augmentation des taux de complications dans les hypospadias proximaux, bien que cela ne soit pas statistiquement significatif.12
Antibiotiques
Nous préconisons une couverture antibiotique lors d’une réintervention pour hypospadias afin de minimiser le risque d’infections du site opératoire et des voies urinaires. Une uroculture préopératoire doit être réalisée, et la présence d’une bactériurie doit être traitée en fonction des résultats de la culture et de l’antibiogramme. Malgré des études ne trouvant pas de différence significative des infections du site opératoire et des voies urinaires avec ou sans prophylaxie antibiotique préopératoire,13,14 nous utilisons la co-amoxiclav (amoxicilline/acide clavulanique 30 mg/kg) par voie intraveineuse comme antibiotique de premier choix. Il est ensuite poursuivi par voie orale en période postopératoire pendant une semaine, jusqu’au retrait du cathéter et du pansement. Notre pratique est globalement alignée sur l’étude ayant rapporté que 91 % des urologues pédiatriques prescrivent des antibiotiques postopératoires lorsqu’une sonde urétrale est laissée en place.15 Bien que cela soit débattu, une méta-analyse récente évaluant les effets de la prophylaxie antibiotique postopératoire après réparation de l’hypospadias a trouvé une utilité limitée pour prévenir les infections et les complications de cicatrisation, bien que le risque de biais était élevé dans de nombreuses études.16,17 Soutenir la récupération des patients par une analgésie adéquate est essentiel, car ils requièrent généralement une dissection tissulaire plus étendue avec une reconstruction plus complexe. Le bloc caudal est le choix le plus courant pour le contrôle de la douleur périopératoire. À défaut, des blocs nerveux périphériques (bloc du nerf dorsal du pénis et bloc du nerf pudendal) peuvent également être utilisés. Les données probantes restent non concluantes quant au choix de l’analgésie et à son lien avec l’issue postopératoire dans les réparations de l’hypospadias.18,19
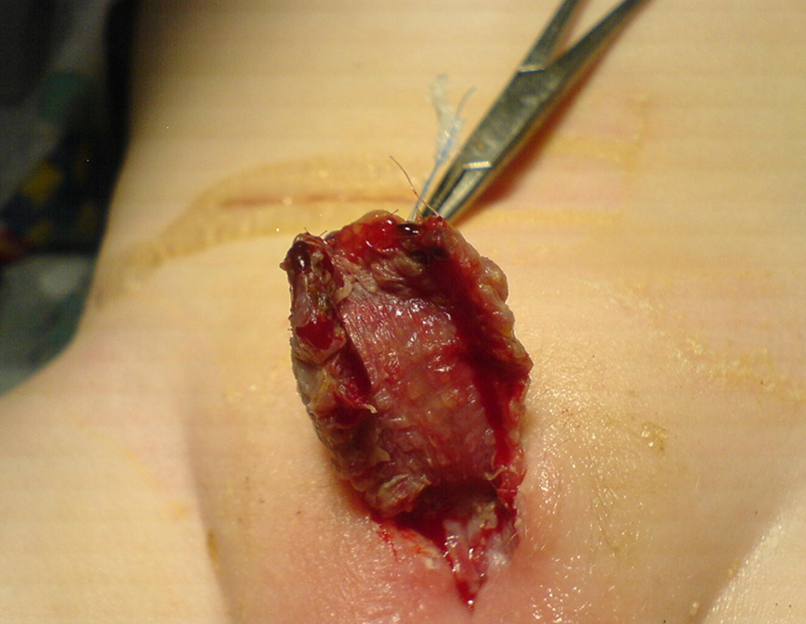
Figure 3 Aspect de la greffe cutanée une semaine après la chirurgie. L’aidant familial doit continuer à masser la greffe avec de la vaseline ou une pommade au beurre de cacao afin d’optimiser la cicatrisation et de prévenir la rétraction de la greffe.
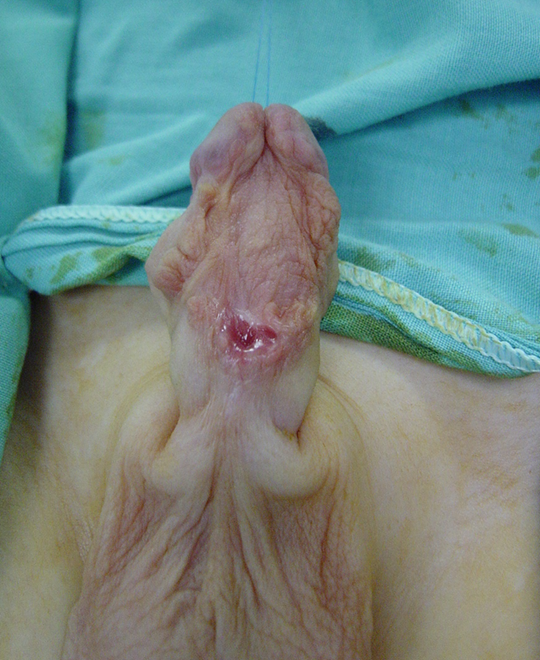
Figure 4 Aspect de la greffe cutanée 6 mois après le 1er temps de la réparation. Bonne cicatrisation sans signe de rétraction de la greffe. Elle est prête pour le 2e temps de la réparation.
Techniques chirurgicales
Différentes approches de techniques de rattrapage ont été rapportées dans les reprises d’hypospadias, notamment l’urétroplastie par plaque incisée tubulée (TIP), la réparation de Mathieu, les lambeaux insulaires tubulisés en onlay (OIF) et les greffons libres, réalisées soit en un temps, soit en deux temps. Quelles que soient les différentes techniques, il convient toujours d’appliquer les principes généraux de la chirurgie et de la réparation. L’utilisation minimale de l’électrocoagulation, des sutures sans tension, de greffons ou tissus environnants bien vascularisés, et de plans multiples avec fermeture étanche permettra de minimiser les complications potentielles habituelles. Une urétroplastie TIP peut être une option dans un cadre de réparation en un temps si la plaque urétrale est présente et suffisamment large. Snodgrass et Lorenzo ont rapporté leur expérience initiale de l’utilisation de l’urétroplastie TIP dans la reprise d’hypospadias. Ils ont eu 15 patients avec un suivi moyen de 5 mois. Ils ont obtenu un méat d’aspect cosmétique normal chez 13 des 15 patients, et les complications comprenaient deux fistules et une désunion glandulaire.6 Shanberg et ses collègues ont rapporté l’urétroplastie TIP dans 13 cas de reprise avec un suivi moyen de 22 mois. Les résultats esthétiques étaient excellents, avec deux complications : un patient présentant une désunion glandulaire et une fistule urétrocutanée, et un deuxième patient qui a développé une sténose du méat.20 Une plaque urétrale très cicatricielle contribuant à une chordée doit être excisée et remplacée par une greffe de muqueuse buccale pour une réparation en deux temps, comme préconisé par Bracka.21
Bracka a popularisé la réparation en deux temps dans la chirurgie de l’hypospadias comme solution potentielle aux taux élevés de complications observés après une approche en un temps. Il a rapporté la série la plus vaste de la littérature avec six cents cas (457 enfants et 143 adultes), dont 34,8 % étaient des réparations secondaires. Au total, 3,7 % ont nécessité une révision du premier temps. Le taux de fistule uréthrocutanée était de 10,5 % pour la chirurgie de rattrapage, tandis que le taux de sténose était de 7 %.22 Hayes et al ont rapporté l’utilisation de greffes buccales dans des réparations en plusieurs temps chez 25 patients (adultes et enfants) ayant déjà eu un échec de réparation d’hypospadias. 22 % ont nécessité une révision du 1er temps, tandis qu’un seul patient (4 %) a développé une fistule uréthrocutanée.23 Barbagli et al ont étudié 60 adultes atteints d’hypospadias secondaire, dont 31 cas ont bénéficié de réparations en plusieurs temps. Les greffes buccales ont abouti à 82 % de succès dans les procédures en un temps et à 82 % dans les procédures en plusieurs temps. Le taux de fistule pour les opérations en un temps et en deux temps était de 10,3 % et 6,5 %, respectivement.5 Kulkarni et al ont mis en évidence l’incidence plus élevée de la rétraction des greffes buccales dans leur série de patients ayant subi une réparation en 2 temps avec des BMG (greffes de muqueuse buccale), ce qui les a conduits à changer de technique pour adopter une approche hybride.24
Au Great Ormond Street Hospital for Children (GOSH), notre réparation en deux temps combine des techniques historiquement décrites par Turner-Warwick, Duplay et Cloutier.25 Lors de la première étape, l’urètre cicatriciel est ouvert ventralement sur la ligne médiane jusqu’à atteindre un tissu sain et saignant. Une incision de circoncision est complétée autour de la couronne du pénis, coïncidant souvent avec l’incision précédente et laissant un manchon de muqueuse proximal au gland. La zone cicatricielle au sein du gland est ensuite excisée, et le gland est ouvert, mis à plat par une incision médiane profonde, puis le tissu glandulaire est décollé de l’apex. L’urètre est prolongé jusqu’à une zone saine avec un tissu de bon calibre avant l’excision de la néourètre distale et du tissu cicatriciel. La néourètre défaillante est excisée partiellement ou totalement jusqu’au tissu sain. La chordée est identifiée par une érection artificielle, à l’aide d’un garrot et d’une injection de sérum physiologique, et est corrigée par une combinaison de libération ventrale de la néourètre cicatricielle et, lorsque indiqué, de plicatures dorsales de l’albuginée. Il est nécessaire de confectionner une large ouverture urétrale proximale, et la peau du fourreau est réappliquée sur le dos du pénis. Cela laisse une zone à vif variable sur la face ventrale, allant de l’ouverture urétrale jusqu’à l’extrémité distale du gland et entre les berges cutanées. Si un excès de peau préputiale saine est disponible, nous l’utilisons de préférence aux autres greffes. Cependant, il est généralement nécessaire de prélever des greffes sur d’autres sites. Il s’agit le plus souvent d’une greffe cutanée rétro-auriculaire (Wolfe), d’une greffe de muqueuse buccale jugale, et de greffes composites (greffe de muqueuse buccale plus prépuce interne). La greffe cutanée choisie est prélevée puis dégraissée avant d’être appliquée sur la zone à vif de la face ventrale du pénis. Les greffes sont habituellement rectangulaires (au moins 2 cm de large), suturées de façon circonférentielle avec du Monocryl 6/0, et nous les fixons aux corps caverneux péniens par des points de capitonnage supplémentaires. Les greffes sont comprimées contre le corps du pénis à l’aide d’un Jelonet roulé (gaze paraffinée) et suturées en place en rapprochant les berges de la peau du fourreau par-dessus. Nous recouvrons ensuite le pénis et appliquons une pression supplémentaire à l’aide d’une mousse et d’un bandage externe en bande d’Elastoplast. Un stent goutte-à-goutte ou un cathéter à drainage continu est utilisé selon l’âge du patient (tous les patients de moins de six ans auront un stent goutte-à-goutte).
Des antibiotiques et des anticholinergiques seront administrés pendant la première semaine. Le pansement est retiré et le greffon est inspecté sous anesthésie générale. Il est demandé aux parents d’appliquer une pommade au chloramphénicol sur le greffon deux fois par jour pendant dix jours. Après un contrôle à trois mois en consultation externe, l’intervention de deuxième étape est planifiée si la greffe est satisfaisante. Dans le cas contraire, une période d’application de pommade à la dihydrotestostérone sera utilisée pour faire mûrir davantage le greffon et stimuler la croissance pénienne. Les interventions de deuxième étape sont réalisées au plus tôt à six mois, et la plupart des cas sont réparés plutôt vers un an. La bandelette urétrale et le gland sont refermés autour d’un cathéter 8-Fr, à l’aide de sutures monocryl 6-0. Un autre pansement en mousse est appliqué avec drainage par cathéter, antibiotiques et anticholinergiques pendant une semaine. Cela est suivi du retrait du pansement par notre personnel infirmier dans le service (sans aucune sédation). Les patients sont revus à 3 et 12 mois en consultation externe.
Fistule urétrocutanée
La fistule uréthrocutanée est l’une des complications les plus fréquentes après une réparation primaire de l’hypospadias, avec une incidence comprise entre 5 % et 15 %. Les risques reconnus comprennent l’âge au moment de la réparation, l’hématome, la nécrose du greffon, l’extravasation urinaire, l’infection de la plaie et l’expérience du chirurgien opérateur. Une étude rétrospective multicentrique portant sur 591 patients, réalisée par Duarsa et al, a conclu que le drainage sus-pubien réduit le risque de fistule uréthrocutanée après réparation de l’hypospadias. Les auteurs ont postulé que la création d’une dérivation urinaire temporaire percutanée réduit l’écoulement urinaire vers le néo-urètre et minimise la réaction tissulaire, la mobilité des points de suture et le risque d’infection.10 Il est également essentiel d’exclure une sténose du néo-méat distal ou une ischémie de la peau ventrale. La prise en charge chirurgicale dépendra de la taille du méat, du nombre de fistules et de l’existence éventuelle de sténoses concomitantes du néo-urètre. Kulkarni et al ont décrit leurs techniques de réparation des fistules, selon lesquelles, en cas de méat étroit associé à une sténose urétrale, l’urètre est incisé ventralement jusqu’à obtenir un urètre de bon calibre. Si la plaque urétrale mesure plus de 8 mm, une urétroplastie d’augmentation en un temps avec greffon en inlay dorsal selon Asopa est réalisée. Si la largeur est inférieure à 8 mm, une approche en deux temps est employée pour tubuliser un néo-urètre. Enfin, si l’urètre est de bon calibre sans obstruction distale, la fistule uréthrocutanée peut être fermée par fermeture primaire.24
Chordée ventrale récidivante
La chordée ventrale (CV) est observée plus fréquemment chez les patients ayant subi une plicature dorsale, contrairement à une procédure d’allongement ventral de la verge. Un autre facteur contributif est la rétraction de la peau ventrale cicatricielle et du tissu fibreux péri-urétral. Flynn et al ont rapporté l’apparition tardive d’une chordée pénienne récidivante après réparation d’hypospadias après la puberté. La plupart de leurs patients ont indiqué que la courbure pénienne était associée à la croissance du phallus à la puberté. Ils ont émis l’hypothèse que la CV récidivante, en particulier chez les adolescents, est due à l’asymétrie de la paroi corporéale, qui peut être secondaire à une croissance disproportionnée de la paroi corporéale ventrale hypoplasique ou de l’urètre reconstruit.26 Un décalage entre un urètre ventral court et les tissus corporéaux est crucial dans la chordée ventrale récidivante.27 Dans la majorité des cas, une ‘légère’ (moins de 30 degrés) chordée peut être corrigée par dissection cutanée ou section de la plaque urétrale. La majorité des reprises d’hypospadias nécessiteront de traiter une disproportion corporéale sous-jacente avec essentiellement deux options possibles : raccourcir le côté long ou allonger le côté court. Chez les patients porteurs d’hypospadias où la longueur est précieuse, il est probablement préférable d’éviter la plicature dorsale. Les corporotomies ventrales transverses sont préférées dans les chordées récidivantes, aboutissant à un degré de correction raisonnable. En cas de courbure supérieure à 30 degrés, une réparation en plusieurs temps débutant par l’excision de l’urètre et la mise en place d’un greffon dermique sur les corps caverneux, avec couverture par un lambeau de dartos et un lambeau cutané local, est une option envisageable.24
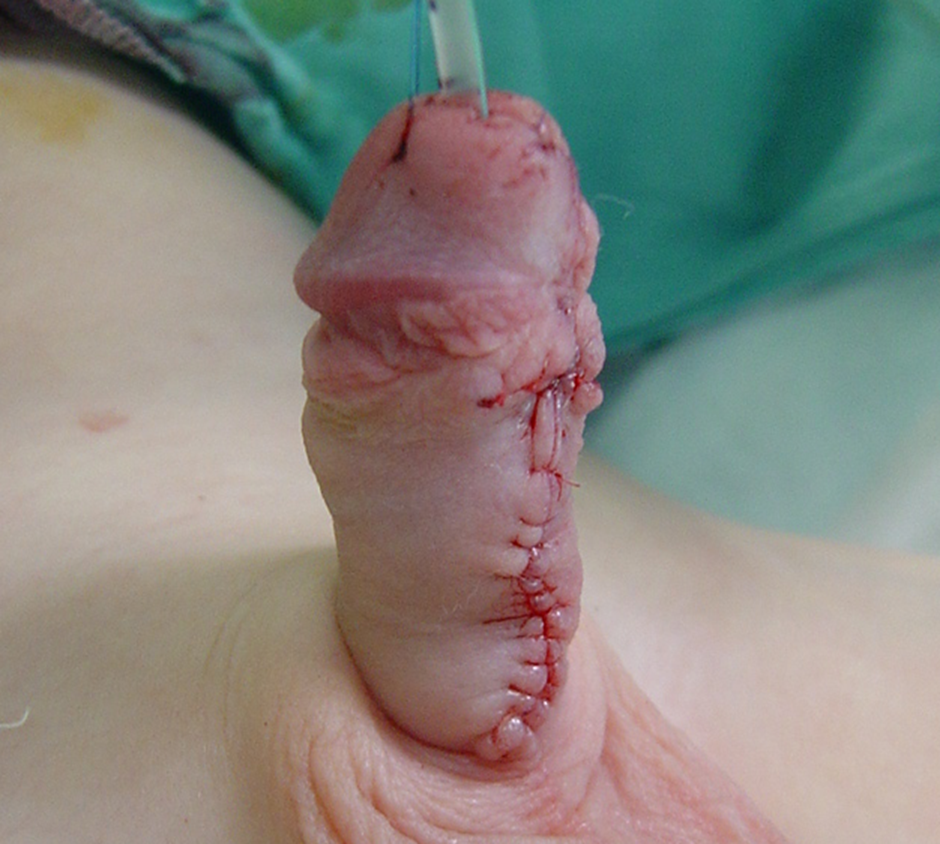
Figure 5 Aspect final après tubulisation, à la fin du 2e temps de la réparation. La sonde sera laissée en place pendant sept jours, suivie du retrait du pansement dans le service.
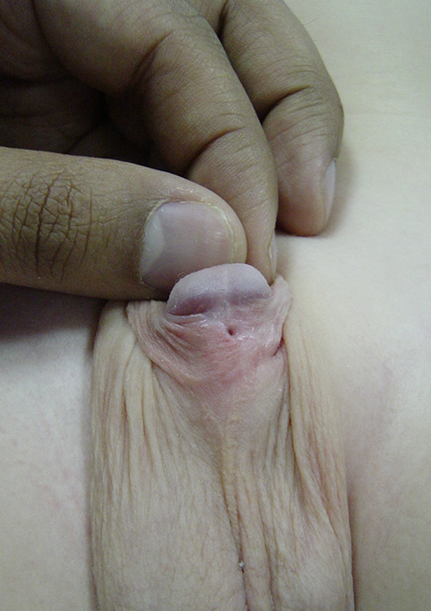
Figure 6 Présence d’une fistule urétrocutanée isolée après réparation de l’hypospadias. Elle peut être traitée par une simple exérèse et fermeture de la fistule
Soins postopératoires
La réparation secondaire de l’hypospadias au GOSH est réalisée dans le cadre d’une hospitalisation de 24 heures, l’enfant sortant le lendemain après une nuit d’observation. Nous sondons tous les garçons à l’aide d’une sonde d’alimentation souple de 8 French, que nous fixons au gland par une suture de maintien en Prolene 4-0, qui reste en place pendant sept jours. Un pansement occlusif enveloppant optimise la cicatrisation postopératoire en favorisant l’immobilisation, la protection du site opératoire, l’adhérence tissulaire et la compression. À l’heure actuelle, il n’existe pas de consensus sur le type de pansement le plus efficace ni même sur l’intérêt d’en poser un. Un essai randomisé n’a montré aucune différence significative des taux de complications ni des résultats cliniques lorsqu’on comparait des patients avec pansement et sans pansement. À noter, on observait une augmentation significative des appels postopératoires effectués par les parents dans le groupe sans pansement.28 Conformément à la technique de pansement décrite précédemment, nous mettons une double couche chez les enfants qui n’ont pas encore acquis la propreté. La sonde et le pansement sont retirés après sept jours, sous anesthésie générale pour les réparations de première étape avec greffe et sous anesthésie locale dans le service après les réparations de deuxième étape. Chez les enfants plus âgés, une sonde de Foley est connectée à une poche de drainage. Nous prescrivons des antibiotiques oraux conformément à notre politique locale de microbiologie et de l’oxybutinine 0.2 g/kg une fois par jour jusqu’au retrait de la sonde afin de prévenir les spasmes vésicaux. Le bloc caudal préopératoire aide à atténuer la douleur postopératoire.29 Un contrôle supplémentaire de la douleur est obtenu avec de faibles doses d’antalgiques AINS (anti-inflammatoires non stéroïdiens).
Conclusion
La reprise de chirurgie de l’hypospadias représente un défi chirurgical à traiter et à gérer pour les chirurgiens s’occupant activement d’enfants atteints d’hypospadias. En raison de son faible taux de complications et de techniques reproductibles, les auteurs préconisent une réparation en deux temps pour une reprise de chirurgie de l’hypospadias. Néanmoins, si tout échoue malgré les meilleurs efforts, une urétrostomie périnéale peut également être envisagée afin de préserver la qualité de vie de ces patients. Les données de haute qualité dans la littérature actuelle examinant les différents aspects de la prise en charge chirurgicale des reprises d’hypospadias sont limitées. Il convient donc d’encourager des efforts de recherche supplémentaires afin d’améliorer les résultats pour les patients. Un aperçu d’un algorithme simple pour la prise en charge chirurgicale des reprises d’hypospadias est présenté ci-dessous.
Figure 7 Algorithme de prise en charge proposé pour les reprises ou les réinterventions de l’hypospadias.
Ressources pour la famille
- Ressources sur l’hypospadias, Children’s Hospital of Philadelphia
- Informations sur l’urologie à l’intention des parents et des visiteurs, Great Ormond Street Hospital for Children
Lectures recommandées
- Shukla AR, Patel RP, Canning DA. Hypospadias. J Pediatr Urol: 103–126. DOI: 10.1385/1-59259-421-2:103.
- Chapter 15: Hypospadia Paediatric Urology WebBook, European Society of Paediatric Urology. 20AD: 227–256.
Références
- Butwicka A, Lichenstein P, Landen M. Hypospadias and increased risk for neurodevelopmental disorders. Child Psychol Psychiatry 2015; 56 (2): 155–161.
- Jin TT, Wu WZ, Shen ML. Hypospadias and Increased Risk for Psychiatric Symptoms in Both Childhood and Adolescence: A Literature Review. Front Psychiatry 2022; 13: 799335. DOI: 10.3389/fpsyt.2022.799335.
- Craig W JR, C B, WO H, JM M, J.B.. Management of adults with prior failed hypospadias surgery. 2014; 3 (2): 196–204.
- Mundy AR. Failed hypospadias repair presenting in adults. Eur Urol 2006 (5): 774–776.
- Barbagli G, Perovic S, Djinovic R, Sansalone S, Lazzeri M. Retrospective descriptive analysis of 1,176 patients with failed hypospadias repair. J Urol 2010 (1): 207–211. DOI: 10.1016/s0084-4071(10)79536-1.
- Snodgrass WT. A Lorenzo Tubularized incised plate for hypospadias reoperation. BJU Int 2002; 89: 98–100. DOI: 10.1097/01.ju.0000125018.90605.a5.
- Al-Sayyad A, Pike JG, Leonard MP. Redo hypospadias repair: experience at a tertiary care children’s hospital. Can Urol Assoc J 2007; 1 (1). DOI: 10.5489/cuaj.39.
- Duarsa GWK, Tirtayasa PMW. Risk factors for urethrocutaneous fistula following hypospadias repair surgery in Indonesia. J Pediatr Urol 2020; 16 (3): 317.e1–317. DOI: 10.1016/j.jpurol.2020.04.011.
- Wilkinson DJ, Green PA, Beglinger S. Hypospadias surgery in England: Higher volume centres have lower complication rates. J Pediatr Urol 2017; 13 (5): 481.e1–481.e6.
- Fichtner J, Filipas D, Mottrie AM, Voges GE, Hohenfellner R. Analysis of Meatal Location in 500 Men: Wide Variation Questions Need for Meatal Advancement in All Pediatric Anterior Hypospadias Cases. J Urol 1995; 154 (2): 833–834. DOI: 10.1016/s0022-5347(01)67177-5.
- Dodds PR, Batter SJ, Shield DE, Serels SR, Garafalo FA, Maloney PK. Adaptation of Adults to Uncorrected Hypospadias. Urology 2008; 71 (4): 682–685. DOI: 10.1016/j.urology.2007.07.078.
- Chang C, White C, Katz A, Hanna MK. Management of ischemic tissues and skin flaps in Re-Operative and complex hypospadias repair using vasodilators and hyperbaric oxygen. J Pediatr Urol 2020; 16 (5): 672.e1–672.e8. DOI: 10.1016/j.jpurol.2020.07.034.
- Wright I, Cole E, Farrokhyar F, Pemberton J, Lorenzo AJ, Braga LH. Effect of Preoperative Hormonal Stimulation on Postoperative Complication Rates After Proximal Hypospadias Repair: A Systematic Review. J Urol 2013; 190 (2): 652–660. DOI: 10.1016/j.juro.2013.02.3234.
- Smith J, Patel A, Zamilpa I. Commentary to ‘Is parenteral antibiotic prophylaxis associated with fewer infectious complications stented, distal hypospadias repair?’ J Pediatr Urol 2017; 18 (6): 764. DOI: 10.1016/j.jpurol.2022.05.024.
- Baillargeon E, Duan K, Brzezinski A, Jednak R, El-Sherbiny M. The role of preoperative prophylactic antibiotics in hypospadias repair. Can Urol Assoc J 2014; 8 (7-8): 236. DOI: 10.5489/cuaj.1838.
- Hsieh MH, Wildenfels P, Gonzales ET. Surgical antibiotic practices among pediatric urologists in the United States. J Pediatr Urol 2011; 7 (2): 192–197. DOI: 10.1016/j.jpurol.2010.05.001.
- Chua ME, Kim JK, Rivera KC. Commentary to ‘The use of postoperative prophylactic antibiotics in stented distal hypospadias repair: a systematic review and meta-analysis.’ J Pediatr Urol 2019; 15 (2): 149. DOI: 10.1016/j.jpurol.2018.10.024.
- Zhu C, Wei R, Tong Y, Liu J, Song Z, Zhang S. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Tanseco PP, Randhawa H, Chua ME, Blankstein U, Kim JK, McGrath M, et al.. Postoperative complications of hypospadias repair in patients receiving caudal block vs. non-caudal anesthesia: A meta-analysis. Can Urol Assoc J 2019; 13 (8): 249–257. DOI: 10.5489/cuaj.5688.
- Retik AB, Borer JG. Primary and Reoperative Hypospadias Repair With the Snodgrass Technique. J Urol 1998; 16 (3): 1561. DOI: 10.1097/00005392-199910000-00122.
- Bracka A. Hypospadias repair: the two-stage alternative. Br J. Br J Urol 1995; 76: 31–41. DOI: 10.1111/j.1464-410x.1995.tb07819.x.
- Bracka A. The role of two-stage repair in modern hypospadiology. Indian J Urol 2008; 24 (2): 210–218.
- Hayes MC, Malone PS. The use of a dorsal buccal mucosal graft with urethral plate incision (Snodgrass) for hypospadias salvage. BJU Int 1999; 83 (4): 508–509. DOI: 10.1046/j.1464-410x.1999.00043.x.
- Kulkarni S, Joglekar O, Alkandari M, Joshi P. Redo hypospadias surgery: current and novel techniques. Res Rep Urol 2018; Volume 10: 117–126. DOI: 10.2147/rru.s142989.
- S JN, T N, K OM, M CP. The two-stage repair for severe primary hypospadias. Eur Urol 2006; 50 (2): 366–371.
- Flynn JT, Johnston SR, Blandy JP. Late Sequelae of Hypospadias Repair. Br J Urol 1980; 52 (6): 555–559. DOI: 10.1111/j.1464-410x.1980.tb03114.x.
- Abosena W, Talab SS. Moneer K Hanna Recurrent chordee in 59 adolescents and young adults following childhood hypospadias repair. J Pediatr Urol 2020; 162 (e1-162.e5). DOI: 10.1016/j.jpurol.2019.11.013.
- Van Savage JG, Palanca LG, Slaughenhoupt BL. A Prospective Randomized Trial Of Dressings Versus No Dressings For Hypospadias Repair. J Urol 2000: 981–983. DOI: 10.1097/00005392-200009020-00015.
- O’Kelly F, Pokarowski M, DeCotiis KN, McDonnell C, Milford K, Koyle MA. Structured opioid-free protocol following outpatient hypospadias repair - A prospective SQUIRE 2.0-compliant quality improvement initiative. J Pediatr Urol 2020; 16 (5): 647.e1–647.e9. DOI: 10.1016/j.jpurol.2020.06.012.
- Shukla AR, Patel RP, Canning DA. Hypospadias. J Pediatr Urol: 103–126. DOI: 10.1385/1-59259-421-2:103.
- Chapter 15: Hypospadia Paediatric Urology WebBook, European Society of Paediatric Urology. 20AD: 227–256.
Dernière mise à jour: 2025-09-22 07:59