29: Hydrocèle congénitale et hernie inguinale
Ce chapitre prendra environ 12 minutes de lecture.
Introduction
Le chapitre suivant tentera de décrire, de manière complète mais concise et synthétique, l’histoire, l’embryologie et le développement, le diagnostic et le traitement de la hernie inguinale congénitale et de l’hydrocèle. Nous mettrons l’accent sur des détails relatifs aux différents aspects du sujet, en offrant au lecteur des conseils utiles pour une approche appropriée de cette pathologie.
Antécédents
La chronologie décrite ci-dessous met en évidence les jalons historiques et les progrès au fil du temps liés à la hernie inguinale congénitale et à l’hydrocèle (Figure 1)
En l’an 25 AC, Celse a fait la première mention de la cure de hernie chez les enfants.
Les progrès de la médecine ainsi que de la prise en charge postopératoire des patients ont, au fil du temps, amélioré les techniques chirurgicales et les résultats opératoires. De nos jours, la procédure chirurgicale est réalisée de manière similaire dans le monde entier, avec des variations minimales selon les préférences du chirurgien et l’approche choisie (laparoscopique vs conventionnelle) pour la réparation.
Figure 1 Chronologie
Embryologie
L’hydrocèle et la hernie inguinale congénitale apparaissent à la suite d’un défaut d’oblitération du processus vaginal (PV), une évagination péritonéale issue de l’épithélium coelomique qui s’oblitère normalement au cours de la première année de vie.
L’hydrocèle peut être définie comme un épanchement liquidien entre les feuillets pariétal et viscéral de la tunique vaginale (TV), formé lorsque le PV reste perméable. On les classe en hydrocèle communicante, non communicante et hydrocèle du cordon spermatique. Si la lumière est suffisamment large, du contenu abdominal peut s’y engager et créer une hernie inguinale.1
À la fin de la vie fœtale, les testicules et les ovaires occuperont une position différente de celle qu’ils avaient à l’état embryonnaire. Le changement de position des testicules est beaucoup plus prononcé que celui des ovaires et comprend leur descente à travers l’épaisseur de la paroi abdominale jusqu’au scrotum.2
Les événements qui régissent le développement testiculaire et la descente ultérieure chez les sujets de sexe masculin sont :
3e semaine
Les cellules germinales primordiales (gamètes extra-embryonnaires), qui se trouvent dans la paroi du sac vitellin, migrent vers les crêtes génitales (Figure 2)
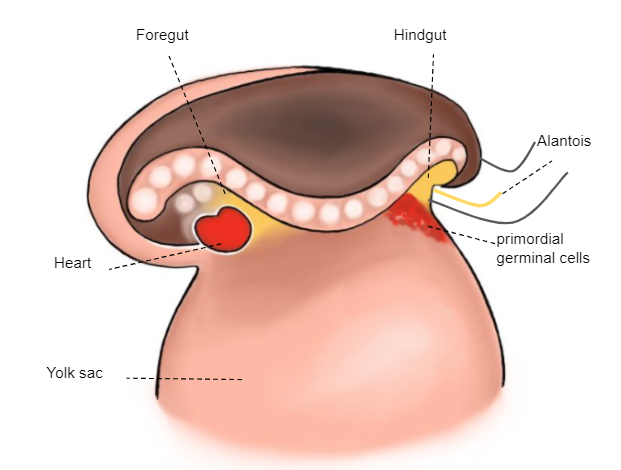
Figure 2 Embryon de la 3e semaine
6e semaine
La gonade indifférenciée est attachée à la paroi postérieure par le mésopéritoine qui, crânialement, forme le ligament diaphragmatique et, caudalement, le ligament inguinal (gubernaculum) (Figure 3)
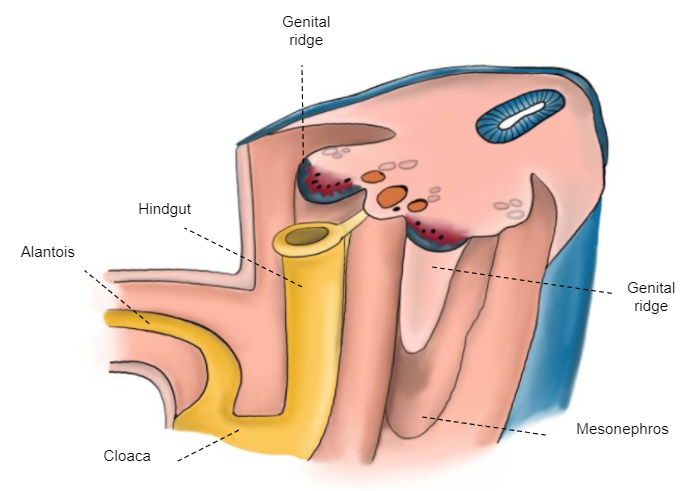
Figure 3 Embryon de la 6e semaine
7e–8e semaine
Les cordons sexuels pénètrent la région médullaire, donnant naissance aux cordons testiculaires, qui atteignent le mésorchium et forment le rete testis (réseau de Haller). Par la suite, ceux-ci se transforment en cordons efférents. (Figure 4)
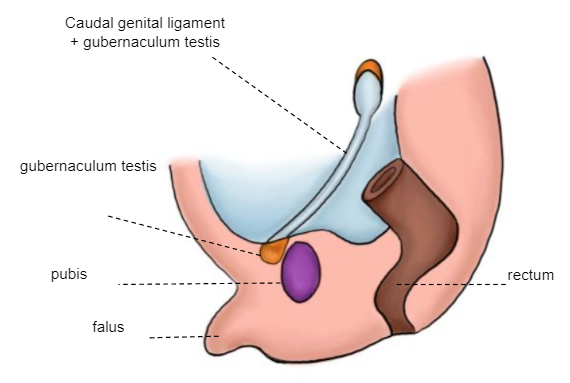
Figure 4 Embryon de la 7e–8e semaine
10e–12e semaine
Le gubernaculum testis est fixé distalement au bourrelet labioscrotal, qui servira d’axe autour duquel le mésoderme se modèle, donnant naissance au canal inguinal. Une évagination péritonéale, le processus vaginal (épithélium coelomique), se forme en suivant le trajet du gubernaculum vers le bourrelet labioscrotal. La première phase de la descente testiculaire a lieu, au cours de laquelle le testicule passe de sa position lombaire au voisinage de l’orifice inguinal externe (Figure 5)
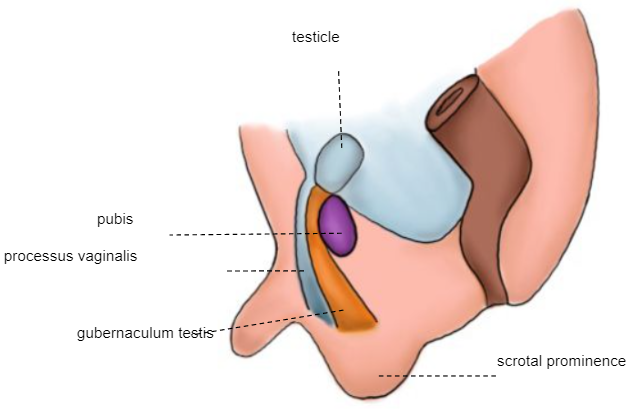
Figure 5 embryon de la 10e à la 12e semaine
28e semaine
Deuxième phase de la descente: le testicule traverse le canal inguinal déjà formé et atteint le scrotum entre les semaines 32 et 35 (Figure 6)
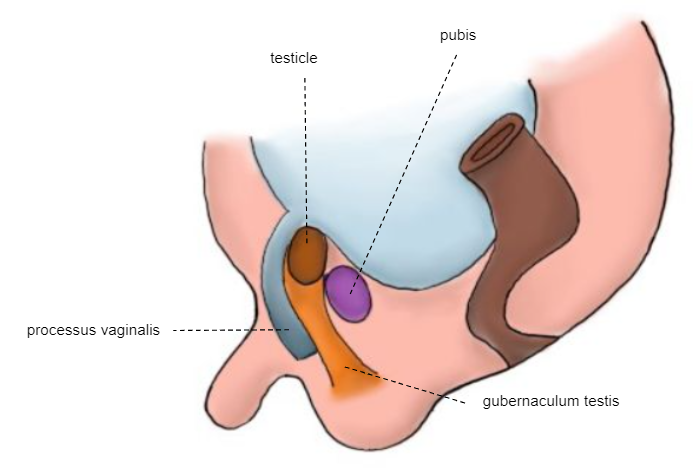
Figure 6 Embryon de la 28e semaine
Nouveau-né à terme
Le testicule est fixé au scrotum (Figure 7)
Les facteurs mécaniques susceptibles de déclencher la descente testiculaire vers le scrotum sont :
- Traction distale générée par le gubernaculum testis.
- Pression intra-abdominale.
D’autres facteurs déterminants possibles comprennent des facteurs hormonaux et neurologiques.2
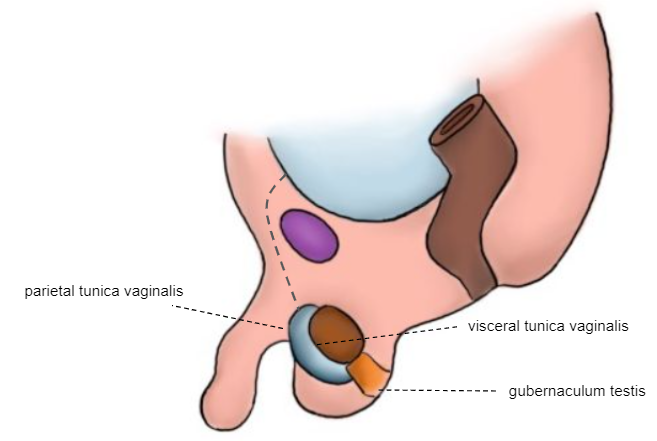
Figure 7 Nouveau-né
Comme le montrent les illustrations embryologiques successives précédentes, le processus vaginal (PV) commence à s’oblitérer peu avant la naissance. La fermeture complète est normalement obtenue au cours de la première année de vie. La tunique vaginale (TV) reste autour du testicule. L’échec du processus d’oblitération du PV est alors associé à une hernie, une hydrocèle et une hydrocèle enkystée du cordon.
Épidémiologie
L’incidence de l’hernie inguinale indirecte congénitale chez les nouveau-nés à terme est de 3,5–5%, tandis que chez les prématurés elle est considérablement plus élevée et varie de 9–11%. Elle approche 60% à mesure que le poids de naissance diminue de 500 à 750 grammes. La plupart des séries rapportent une prépondérance masculine sur les filles allant de 5:1 à 10:1.3
En revanche, les hydrocèles communicantes sont fréquentes chez les nouveau-nés avec une incidence de 2–5 %; 90 % d’entre elles régressent au cours de la première année de vie du fait d’une fermeture spontanée.4
Les hernies inguinales congénitales sont plus fréquentes du côté droit (60 %), 30 % surviennent du côté gauche et 10 % sont bilatérales. Cette répartition ne varie pas selon le sexe, car même chez les filles, une prédominance du côté droit est observée.5
Étiologie / Pathogénie
L’anatomie du canal inguinal varie légèrement avec l’âge. Chez l’adulte et l’enfant, les orifices inguinaux profond et superficiel sont largement séparés, tandis que chez les jeunes nourrissons, ils se chevauchent pratiquement. Chez les filles, l’anatomie est similaire à l’exception de l’absence des éléments spermatiques, qui sont remplacés par le ligament rond.3 Les différents types d’hydrocèles sont illustrés dans l’image ci-dessous (Figure 8)
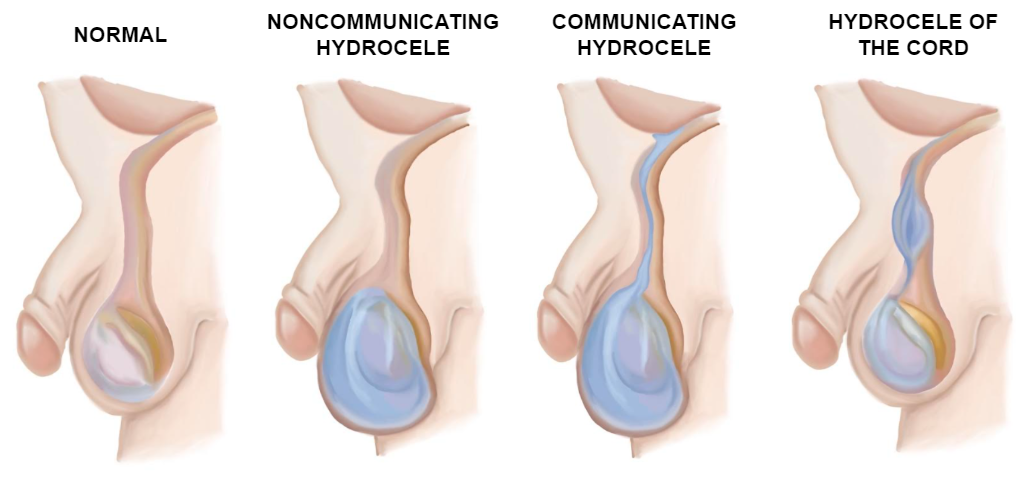
Figure 8 Types d’hydrocèles
La hernie inguinale indirecte congénitale peut se former, comme cela a déjà été mentionné, à partir d’un PV perméable permettant l’extrusion de l’épiploon, d’anses intestinales, de l’appendice ou même des ovaires ou d’une trompe de Fallope chez la femme à travers le canal inguinal. Un sac herniaire peut également s’étendre depuis la cavité abdominale, à travers l’anneau inguinal interne jusqu’à la TV, aboutissant à ce que l’on appelle une hernie inguino-scrotale.
Les hernies inguinales directes sont très rares dans la population pédiatrique, elles sont surtout observées chez l’adulte et sont causées par une faiblesse des muscles abdominaux postérieurs permettant aux intestins de glisser dans l’aine.
Diagnostic et évaluation
Les hernies inguinales et les hydrocèles peuvent être diagnostiquées par examen clinique sans recours systématique à l’imagerie. La présence d’une tuméfaction ferme, réductible et asymptomatique au niveau de l’aine ou du scrotum chez les garçons, ou d’une masse au niveau des grandes lèvres chez les filles, est évocatrice d’une hernie inguinale.
L’incarcération du sac herniaire doit être suspectée chez un patient présentant une douleur intense d’apparition brutale et une tuméfaction inguinale dure, douloureuse et fixe. Si elle n’est pas réduite manuellement, une réduction chirurgicale doit être réalisée.6,7
L’examen clinique doit inclure l’évaluation du patient en décubitus dorsal, en sollicitant, si possible, la manœuvre de Valsalva afin d’identifier des hernies intermittentes ; ainsi que l’évaluation en position debout, au cours de laquelle le médecin doit palper et comparer les deux aines à la recherche d’un épaississement du cordon inguinal ou d’une tuméfaction. Chez les patients de sexe masculin, il convient de vérifier la descente correcte des testicules et la transillumination (source lumineuse appliquée sur le scrotum montrant l’absence de l’ombre testiculaire) peut parfois aider à confirmer une hydrocèle.
Conseils
- Lors de la palpation, il est primordial de sentir le cordon inguinal glisser sous les pulpes des doigts.
- Nous suggérons de palper le cordon inguinal avec la main la plus habile.
- Chez les nouveau-nés, les hernies sont plus souvent réductibles. La réduction doit se faire en comprimant le contenu herniaire vers le haut avec la main la plus habile tout en exerçant une pression vers le bas avec l’autre main afin d’aligner les deux orifices inguinaux et de diriger les éléments herniés dans la cavité abdominale (Figure 9)
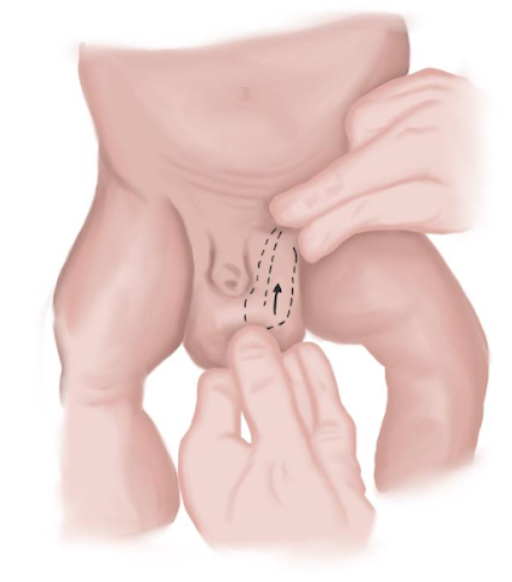
Figure 9 Manœuvre de réduction herniaire chez les nouveau-nés.
Si l’examen physique n’est pas concluant, une échographie inguinale peut apporter des informations supplémentaires au diagnostic suspecté.8 Néanmoins, l’examen physique demeure la méthode diagnostique de référence. La sensibilité de l’échographie dépend principalement des compétences de l’opérateur et de la coopération du patient (immobilité et manœuvre de Valsalva). Le contenu herniaire peut être hyperéchogène en raison de la graisse omentale, anéchogène en présence de liquide, ou d’échogénicité mixte avec des réverbérations, ce qui correspond à la présence d’air dans la lumière des anses intestinales.9 L’échographie pourrait également exclure une hernie inguinale controlatérale, ou un PV qui pourrait être réparé au cours de la même intervention.
Diagnostic différentiel
Le diagnostic différentiel des lésions inguinales est souvent difficile en raison de similitudes sémiologiques à l’examen clinique. Une fois qu’une masse palpable douloureuse est détectée, le médecin doit garder à l’esprit les diagnostics possibles suivants, en recourant à des examens complémentaires si l’examen clinique ne suffit pas :
- Testicule non descendu.
- Hématome / Inflammation.
- Abcès.
- Tumeurs bénignes ou malignes / adénopathie métastatique ou bénigne.
- Varicosités du ligament rond.
- Kyste mésothélial.
Options de traitement
Le traitement de la hernie inguinale est toujours chirurgical, et l’aspect clé du traitement est de réaliser une ligature haute du sac herniaire.
Chez les nourrissons et les tout-petits, l’herniotomie peut être réalisée par l’orifice inguinal externe sans ouvrir l’aponévrose, car les deux orifices sont habituellement superposés. Chez les patients plus âgés, les orifices sont distincts l’un de l’autre. Dans ces cas, il est recommandé d’ouvrir l’aponévrose de l’oblique externe afin de réaliser une ligature haute du sac.3 L’utilisation d’une prothèse pariétale chez les patients pédiatriques est réservée à des cas particuliers.
Pour l’hydrocèle comme pour les hernies inguinales, les principes et les techniques chirurgicales sont très similaires. Lorsqu’une hydrocèle est traitée chirurgicalement, en plus de la ligature haute du sac, sa portion distale doit également être réséquée. Cette étape n’est pas impérative pour les hernies inguinales.
Les hernies inguinales peuvent être abordées soit par une herniorraphie inguinale ouverte (OIH), soit par une réparation herniaire inguinale laparoscopique (LIHR). Les éléments les plus importants de l’intervention consistent à s’assurer que le sac herniaire est vidé et entièrement fermé après l’intervention, tout en préservant l’intégrité du canal déférent, des vaisseaux testiculaires et du nerf ilio-inguinal. Chez les filles, une fixation du ligament rond doit être réalisée afin d’assurer une fixation utérine correcte, prévenant une dyspareunie ultérieure.
Herniorraphie inguinale ouverte
Les principales étapes de l’OIH sont détaillées ci-dessous avec des schémas des manœuvres.
- Incision inguinale transverse suivant le pli cutané naturel au-dessus du cordon spermatique (Figure 10)
- Dissection du tissu cellulaire sous-cutané en incisant le fascia de Scarpa jusqu’à atteindre l’aponévrose musculaire.
- Incision au niveau de l’aponévrose musculaire (pas toujours nécessaire) (Figure 11)
- Extension de l’incision de l’aponévrose vers l’orifice inguinal superficiel.
- Le cordon spermatique est ensuite disséqué sur ses deux côtés et sur la face inférieure avec des manœuvres de dissection mousse. Le cordon est ensuite rétracté à l’aide d’une boucle élastique.z
- Le muscle crémaster est ouvert par dissection mousse sur la face antéromédiale du cordon et écarté pour exposer le péritoine luisant du sac herniaire indirect (Figure 12)
- Le cordon et son contenu (vaisseaux, canal déférent) sont disséqués délicatement, en le séparant du sac qui sera en situation antéromédiale.
- Le contenu du cordon est soigneusement séparé du sac, qui est détaché de ce dernier (Figure 13)
- Le sac herniaire est ouvert et son contenu est réduit dans la cavité abdominale.
- Le sac herniaire est torsadé en s’assurant qu’il ne contient plus de contenu. Un nœud de polyglactine résorbable est noué à sa base et le sac est sectionné puis abandonné dans la cavité abdominale (Figure 14), (Figure 15), et (Figure 16)
- L’aponévrose musculaire est refermée par une suture continue en polyglactine résorbable si elle a été ouverte (Figure 17)
- Des nœuds séparés sont utilisés pour rapprocher le tissu sous-cutané et une suture intradermique est utilisée pour rapprocher le tissu cutané (Figure 18)
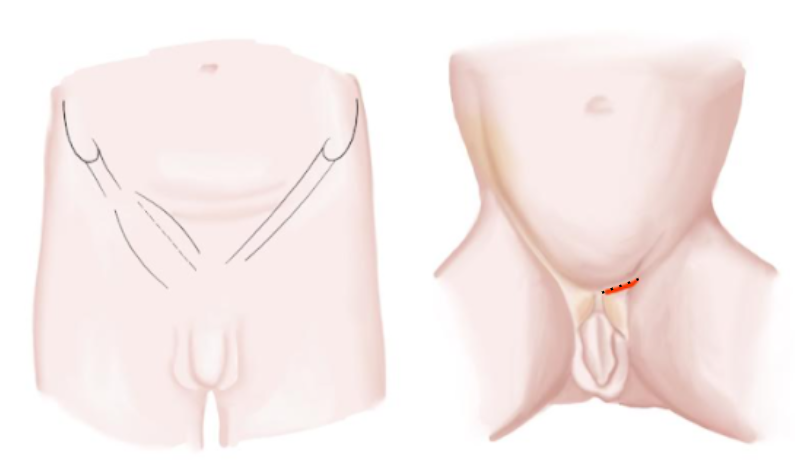
Figure 10 Incision inguinale chez les nourrissons et les adolescents
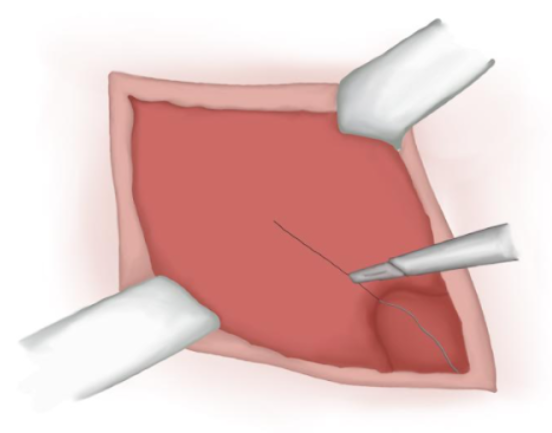
Figure 11 Incision sur l’aponévrose musculaire.
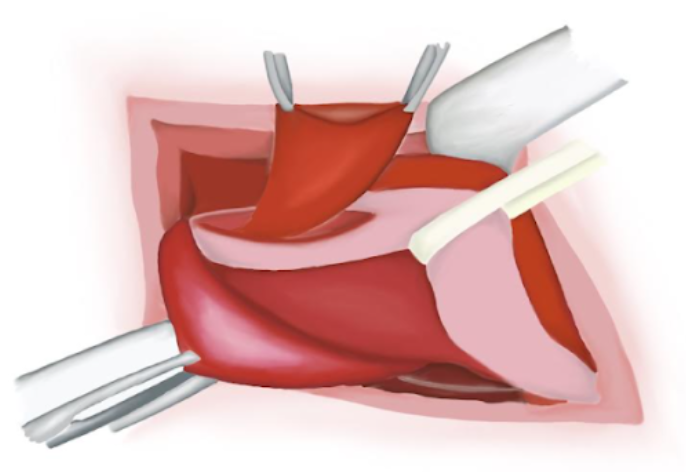
Figure 12 Identification du cordon spermatique. Dissection du sac herniaire.
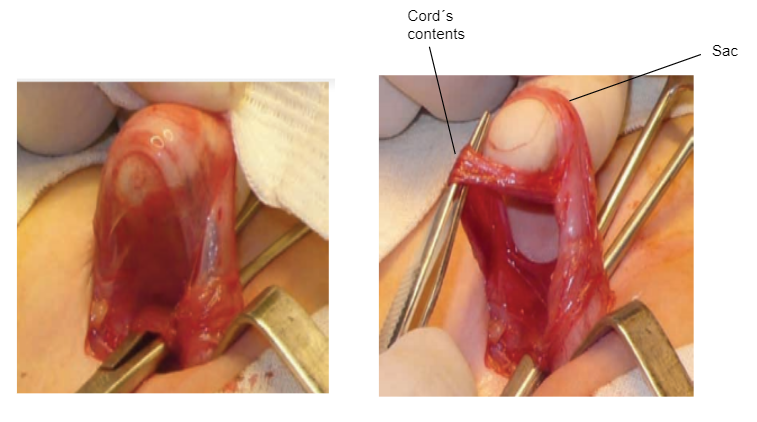
Figure 13 Dissection du sac herniaire.
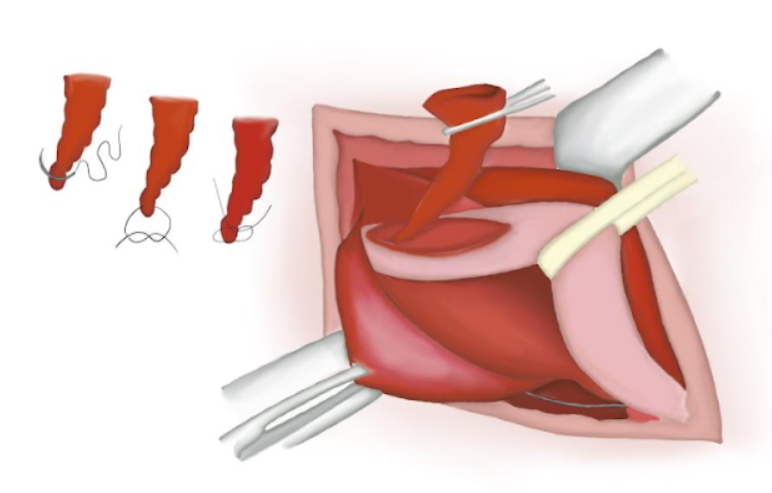
Figure 14 Le sac herniaire est vrillé afin de s’assurer qu’il ne contient rien.
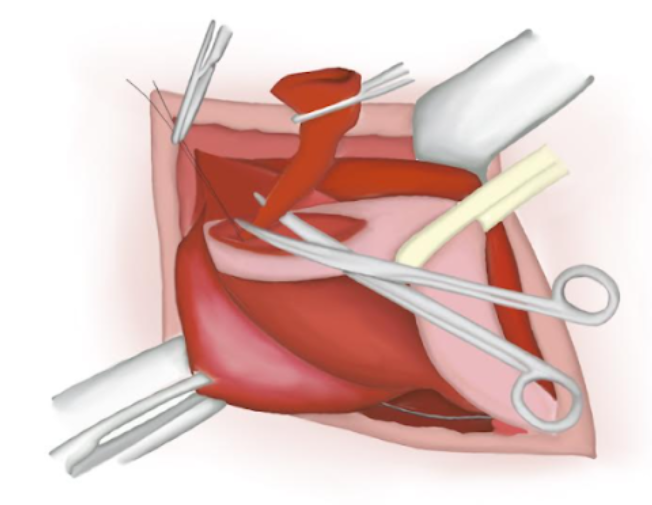
Figure 15 Sac herniaire résecté.
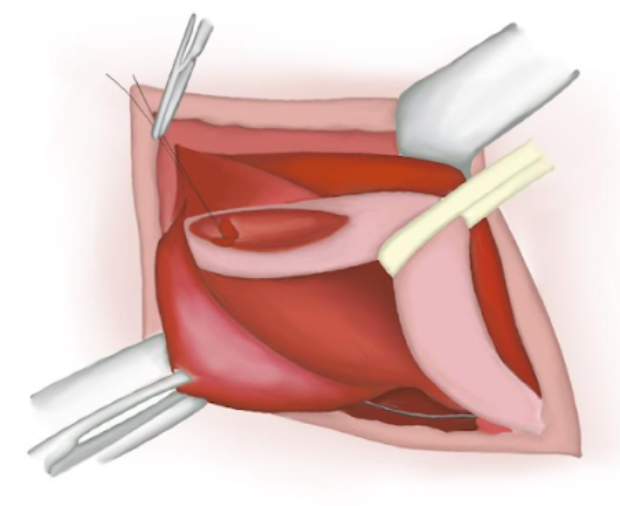
Figure 16 Extrémité proximale suturée perdue dans la cavité abdominale.
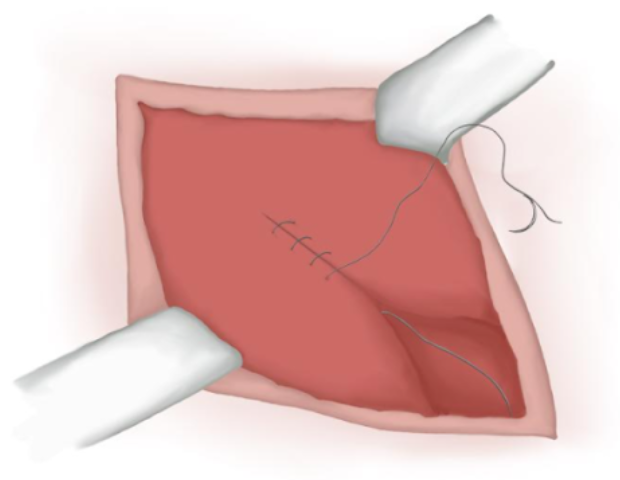
Figure 17 Fermeture de l’aponévrose musculaire.
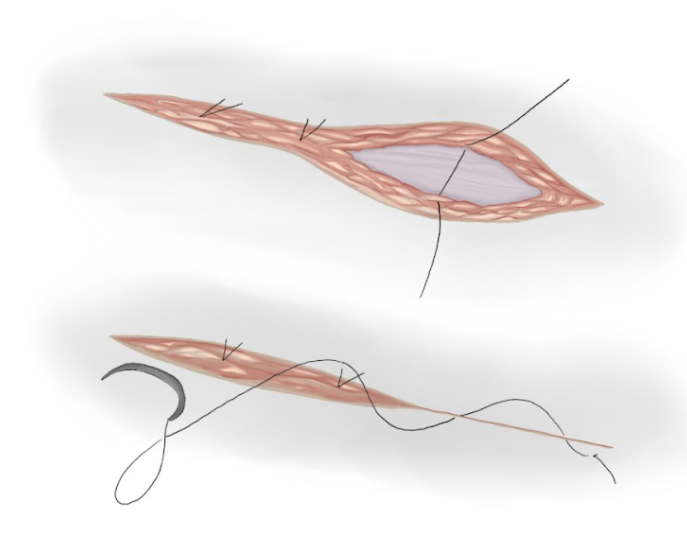
Figure 18 Fermeture sous-cutanée et cutanée.
Conseils
- Les auteurs recommandent une incision cutanée transversale en suivant le pli cutané.
- Repérer l’arcade crurale dans le plan aponévrotique dans les cas plus complexes (filles avec une hernie bilatérale, enfants obèses) afin de localiser l’orifice inguinal superficiel.
- Disséquer le sac herniaire toujours du même côté du cordon de manière réglée
Cure laparoscopique de hernie inguinale
La place de la cure laparoscopique des hernies inguinales n’est pas pleinement établie. Cette approche est critiquée parce qu’elle transforme une intervention extrapéritonéale en une intervention transpéritonéale. Les détracteurs soutiennent que cette technique implique une chirurgie techniquement plus complexe et qu’elle entraîne un taux de récidive plus élevé que l’approche conventionnelle.
En revanche, les partisans de l’approche laparoscopique soulignent que cette technique garantit une moindre invasivité, sans manipulation des structures du cordon spermatique, et qu’elle peut être utile pour le diagnostic précis des hernies directes et fémorales associées. De plus, l’anneau inguinal interne controlatéral peut être clairement visualisé et réparé si nécessaire. Enfin, les partisans mettent en avant l’amélioration du résultat esthétique obtenue après cette chirurgie par rapport à une incision conventionnelle (Tableau 1).10
Tableau 1 Le tableau suivant présente certains avantages et inconvénients concernant la LIHR:
| AVANTAGES | INCONVÉNIENTS |
|---|---|
| Technique simple. | Coûts. |
| Intervention ambulatoire. | La durée de la chirurgie peut être plus longue. |
| Les structures du cordon spermatique restent intactes. | Une anesthésie générale avec intubation endotrachéale est nécessaire. |
| Le type de hernie et l’anneau inguinal controlatéral sont évidents. | Possibilité accrue de lésion des organes intra-abdominaux. |
| Visualisation claire de l’anatomie. | Courbe d’apprentissage plus longue. |
| Inspection des annexes chez les filles. | Possibilité de lésions du cordon spermatique à long terme |
Soins postopératoires et suivi
Comme il s’agit d’une chirurgie ambulatoire, l’alimentation et les boissons peuvent être reprises après le réveil de l’anesthésie. Les nourrissons présentant une dysplasie bronchopulmonaire, une anémie, une prématurité, ou ceux qui ont nécessité une assistance ventilatoire au moment de la naissance, doivent être observés après la réparation chirurgicale pendant au moins 24 heures, avec surveillance des épisodes d’apnée et/ou de bradycardie. Les patients doivent sortir avec des antalgiques par voie orale.
L’activité doit être limitée pendant 48 heures. Reprendre les activités normales dès que l’enfant s’en sent capable. Chez les enfants de plus de 6 ans, les restrictions d’activité doivent être plus strictes, sans activité vigoureuse pendant une période d’un mois. Les bains peuvent être commencés le troisième jour après la chirurgie.
Le suivi doit être réalisé 1 semaine après la chirurgie afin de dépister les complications précoces, suivi de contrôles cliniques à 1 mois, 3 mois et 6 mois après l’intervention, avant la clôture du suivi.
Résultats, complications et prise en charge
Au cours de l’intervention, les complications locales comprennent des hémorragies et des lésions des vaisseaux spermatiques et du canal déférent. L’utilisation de loupes binoculaires lors de la réparation des lésions peropératoires rendra la réparation plus précise, en particulier chez les nouveau-nés.
Les complications précoces après la chirurgie peuvent inclure un œdème local, un hématome et une infection de la plaie.
Les complications tardives observées lors du suivi peuvent inclure la récidive d’hydrocèle ou de hernie, un déplacement iatrogène du testicule et une atrophie testiculaire. Pour éviter l’hydrocèle postopératoire, les parois antérieure et latérale du sac peuvent être partiellement réséquées, ou le sac distal peut être ouvert complètement.
La récidive est plus élevée chez les garçons opérés avant l’âge d’un an et chez ceux traités par voie laparoscopique. La récidive diminue de façon significative lorsque l’intervention est réalisée par un chirurgien pédiatre ou un urologue pédiatrique qualifié et expérimenté, ou lorsqu’il s’agit d’une chirurgie programmée.
La hernie inguinale récidivante chez les enfants peut inclure :
- Un sac herniaire passé inaperçu ou une déchirure péritonéale non reconnue.
- Ligature défectueuse du sac herniaire.
- Absence de réparation d’un large anneau inguinal interne.
- Défaut non reconnu du plancher du canal inguinal (hernie inguinale directe).
- Infection.
- Augmentation de la pression intra-abdominale (patients porteurs de dérivations ventriculo-péritonéales ou sous dialyse péritonéale ambulatoire continue).
- Patients atteints de mucoviscidose et de toux chronique.
- Troubles du tissu conjonctif (c.-à-d., syndrome d’Ehlers-Danlos).
Points clés
- La littérature sur la hernie inguinale s’étend sur plus de 20 siècles. Galien, en 176 apr. J.-C., a décrit pour la première fois la physiopathologie de la hernie inguinale indirecte en décrivant pour la première fois le “Processus Vaginalis Peritonei”.
- L’incidence de la hernie inguinale indirecte congénitale chez les nouveau-nés à terme est de 3.5–5%, tandis que chez les nouveau-nés prématurés elle est de 9–11%.
- Épidémiologie : Observée principalement chez les sujets de sexe masculin, avec un rapport homme:femme allant de 5:1 à 10:1.
- Diagnostic de la hernie inguinale et de l’hydrocèle posé à l’examen clinique et confirmé sans recours systématique à l’imagerie.
- Traitement de la hernie inguinale est toujours chirurgical. On peut la traiter soit par herniorraphie inguinale ouverte (OIH), soit par réparation laparoscopique de la hernie inguinale (LIHR).
- Le traitement chirurgical est habituellement ambulatoire. Les nourrissons présentant une dysplasie broncho-pulmonaire, une anémie, une prématurité, ou ceux ayant nécessité une assistance ventilatoire à la naissance, doivent être surveillés après la réparation opératoire pendant au moins 24 heures.
- Suivi à réaliser 1 semaine après la chirurgie pour dépister les complications précoces, puis des contrôles cliniques à 1 mois, 3 et 6 mois après l’intervention.
- Complications précoces après la chirurgie peuvent inclure un œdème local, un hématome et une infection de la plaie.
- Complications tardives observées en post-opératoire au cours du suivi incluent une récidive d’hydrocèle ou de hernie, un déplacement iatrogène du testicule et une atrophie testiculaire.
Conclusions
La persistance du processus vaginal (PV) entraîne un hydrocèle congénital et une hernie inguinale. Toute masse palpable dans l’aine doit être évaluée pour d’éventuelles affections associées au PV. L’examen physique est la méthode diagnostique de référence pour ces affections. Le traitement de la hernie inguinale et de l’hydrocèle communicante avec hernie associée est toujours chirurgical. Le succès du traitement chirurgical dépend d’une ligature haute du sac ainsi que, pour les hydrocèles, de sa résection distale. Les approches comprennent la herniorraphie inguinale ouverte ainsi que l’approche laparoscopique.
Des complications peuvent être observées pendant l’intervention chirurgicale ou à un stade postopératoire précoce ou tardif, ce qui inclut respectivement un œdème, un hématome ou un hydrocèle récidivant, ou une hernie. Plusieurs stratégies sont décrites par des experts pour les éviter. Un suivi doit être effectué périodiquement pendant au moins 6 mois.
Des controverses persistantes concernant la prise en charge des hernies et des hydrocèles existent toujours, en particulier s’agissant du choix de la technique chirurgicale en fonction des taux de récidive et de complications, avec pour objectif de privilégier des procédures mini-invasives offrant de meilleurs résultats.
Références
- Gearhart JP, Rink RC, Mouriqand PDE, editors. Pediatric Urology. 2nd ed., Philadelphia, PA: Elsevier; 2010, DOI: 10.1097/00042307-200011000-00007.
- Palermo M. Hernias de la pared abdominal - Conceptos clásicos, evidencias y nuevas técnicas. Actualidades Médicas, C.A: AMOLCA; 2012.
- J. T. Chapter 59: Inguinal Hernia. In: Puri P, editor. Newborn Surgery. 2nd ed. Boca Raton, FL: CRC Press; 2003. DOI: 10.5005/jp/books/12263_1.
- Godbole P.P. MNP. Chapter 18: Testis, Hydrocele and Varicocele. In: Wilcox DT, Thomas DFM, editors. Essentials of Pediatric Urology. 2nd ed. Boca Raton, FL: CRC Press; 2021. DOI: 10.1201/9781003182023.
- Rowe MI, Clatworthy HW. The other side of the pediatric inguinal hernia. Surg Clin North Am 1971; 51: 1371. DOI: 10.1016/s0039-6109(16)39592-5.
- Choi KH, Baek HJ. Incarcerated ovarian herniation of the canal of Nuck in a female infant: Ultrasonographic findings and review of literature. Annals of Medicine and Surgery 2016; 9: 38–40. DOI: 10.1016/j.amsu.2016.06.003.
- Stringer MD, Oldham KT, P.D.E. M, editors. Pediatric Surgery and Urology Long-term Outcomes. 2nd ed., Cambridge, UK: Cambridge University Press; 2010.
- Park HR, Park SB, Lee ES, Park HJ. Sonographic evaluation of inguinal lesions. Clinical Imaging 2016; 40 (5): 949–955. DOI: 10.1016/j.clinimag.2016.04.017.
- Yang DM, Kim HC, Lim JW, Jin W, Ryu CW, Kim GY. Sonographic findings of groin masses. J Ultrasound Med 2007; 26: 605–614. DOI: 10.7863/jum.2007.26.5.605.
- Holcomb GW, Georgeson KE, Rothenberg SE, editors. Atlas of Pediatric Laparoscopy and Thoracoscopy. Amsterdam, Netherlands: Elsevier; 2021, DOI: 10.1007/978-3-030-84467-7_61.
Dernière mise à jour: 2025-09-22 07:59