18: Diverticules, anomalies de l'ouraque et utricules
Ce chapitre prendra environ 25 minutes de lecture.
Anomalies de l’ouraque
Embryologie et anatomie
L’ouraque est une structure tubulaire qui relie l’allantoïde au niveau de l’ombilic au dôme de la vessie et est perméable pendant la gestation.1 Sa lumière se ferme normalement vers la douzième semaine de gestation et s’oblitère complètement. Après l’oblitération, il ne subsiste généralement qu’un cordon fibreux s’étendant de la face inférieure de l’ombilic jusqu’au dôme de la vessie. L’ouraque est extrapéritonéal et se visualise facilement lors de la visualisation laparoscopique du pelvis (Figure 1).
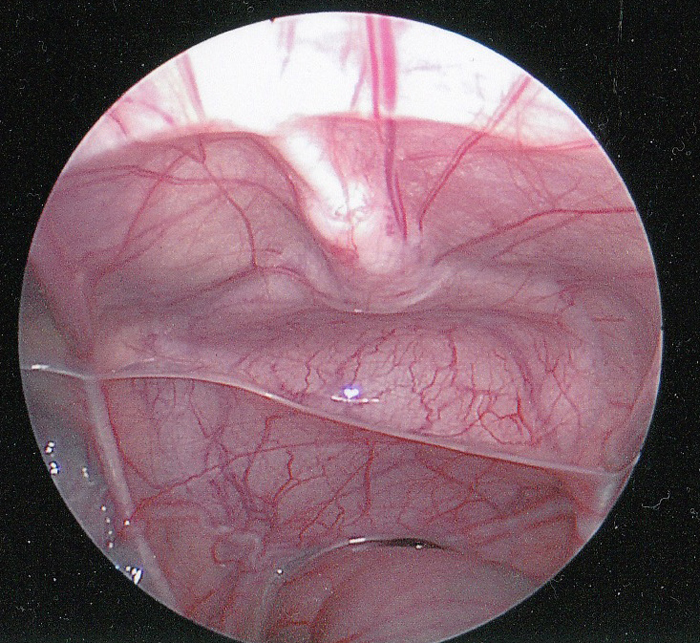
Figure 1 Vue laparoscopique intrapéritonéale de l’ouraque. Le cordon fibreux de l’ouraque (ligament ombilical médian) est visible sur la ligne médiane, s’étendant vers le bas jusqu’au dôme de la vessie. Le rectum est en position inférieure. Le canal déférent est visible s’étendant latéralement juste au-dessus du rectum.
L’ouraque est recouvert par les replis du péritoine pour former le ligament ombilical médian. Rarement, l’ouraque peut présenter des discontinuités du cordon fibreux, voire une oblitération complète du cordon. Il constitue un repère chirurgical important pour marquer le dôme vésical afin d’assurer la mise en place correcte d’une vésicostomie.
Classification des anomalies de l’ouraque
Les anomalies de l’ouraque résultent d’une absence d’oblitération complète de la lumière pendant la gestation.2 Leur classification anatomique repose sur le degré de persistance de la perméabilité de l’ouraque et va de la perméabilité complète avec écoulement libre de l’urine à un petit trajet fistuleux borgne à partir de la peau (Figure 2). Un kyste de l’ouraque peut être présent à n’importe quel endroit le long de l’ouraque, mais il se rencontre le plus souvent près du dôme vésical. Un diverticule de l’ouraque—l’anomalie rapportée la plus rare—correspond à une perméabilité partielle de l’ouraque se drainant dans le dôme de la vessie.
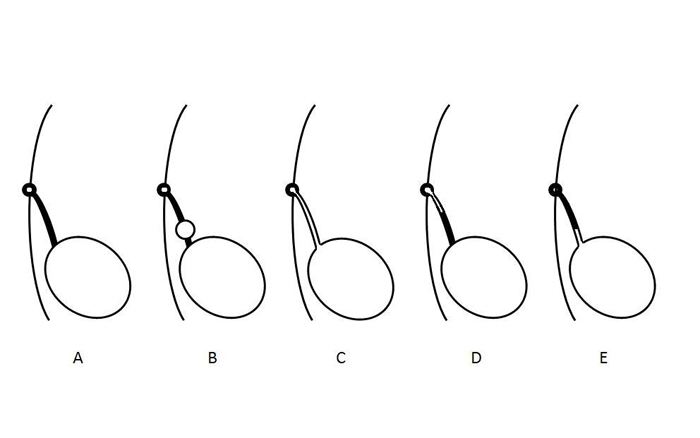
Figure 2 Schéma illustrant les différents types d’anomalies de l’ouraque. A- Oblitération normale de la lumière ourachale. B- Kyste de l’ouraque. C- Persistance de l’ouraque. D- Sinus ourachal. E- Diverticule ourachal. Ces anomalies ne sont pas mutuellement exclusives et peuvent coexister.
L’incidence relative des différents types d’anomalies de l’ouraque d’après plusieurs séries cliniques est présentée dans le Tableau 1.3,4,5,6,7,8,9
Tableau 1 Résumé des types et de l’incidence des anomalies de l’ouraque observées chez l’enfant.
| Auteur | Nb de patients | Kyste | Perméable | Sinus | Diverticule |
|---|---|---|---|---|---|
| Naiditch | 103 | 38 | 21 | 11 | 13 |
| Fox | 66 | 34 | 14 | 7 | 10 |
| Ashley | 46 | 25 | 6 | 14 | 1 |
| Cilento | 45 | 16 | 7 | 22 | 0 |
| Rich | 35 | 12 | 19 | 4 | 0 |
| Yiee | 31 | 19 | 7 | 5 | 0 |
| Copp | 29 | 7 | 3 | 17 | 2 |
| Total | 355 | 151 (43) | 108 (30) | 80 (23) | 26 (7) |
Fait intéressant, il existe un seul rapport de cas d’un ouraque perméable qui s’est spontanément fermé après 2 semaines de drainage par cathéter et a persisté sous forme de diverticule de l’ouraque.10
Présentation clinique
Les symptômes de présentation les plus fréquents chez les enfants présentant des anomalies de l’ouraque sont un écoulement ombilical persistant des semaines après l’accouchement ou une masse et/ou une douleur due à une infection.3,6,8,11 L’écoulement ombilical peut être clair, séreux, purulent ou sanguinolent et constitue un indice quant à sa cause : une fuite persistante de liquide clair (probablement de l’urine) chez un nourrisson évoque un ouraque perméable, tandis qu’un liquide trouble, séreux ou sanguinolent est évocateur d’un sinus ou d’un kyste de l’ouraque. On observe une distribution bimodale des âges, avec une présentation en moyenne entre 1 et 3 mois chez les patients ayant un sinus de l’ouraque ou un ouraque perméable, contre 3 ans chez ceux qui présentent un kyste de l’ouraque.8 Le diagnostic différentiel d’un écoulement ombilical inclut également une omphalite, un reliquat du canal omphalomésentérique ou un granulome ombilical.6
Tableau 2 Symptômes révélateurs chez les enfants présentant des anomalies de l’ouraque.
| Auteur | Nb de patients | Drainage | Masse/Infection | Douleur | Asymptomatique | Autres |
|---|---|---|---|---|---|---|
| Gleason | 721 | 26 | 19 | 17 | 667 | 0 |
| Naiditch | 103 | 60 | 7 | 4 | 18 | 12 |
| Stopak | 85 | 43 | 36 | 0 | 4 | 1 |
| Dethlefs | 68 | 52 | 32 | 0 | 8 | 0 |
| Cilento | 45 | 19 | 15 | 10 | 0 | 1 |
| Yiee | 37 | 20 | 8 | 4 | 2 | 3 |
| Total | 1059 | 220 (21) | 117 (11) | 35 (3) | 699 (66) | 17 (2) |
L’examen clinique peut également être utile. Un ouraque perméable ou un sinus ourachal peuvent se manifester par une fossette ou une dépression à la base de l’ombilic (Figure 3).
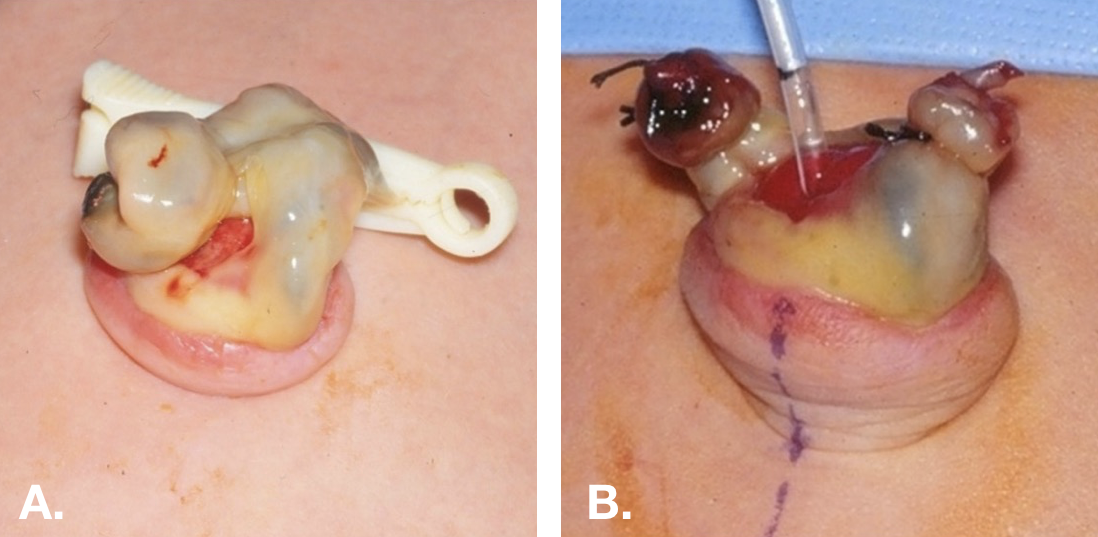
Figure 3 Ouraque perméable chez un nouveau-né. A. Montre l’aspect rouge vif de l’extrémité ombilicale d’un ouraque perméable. B. La peau ombilicale a été éversée et une petite sonde d’alimentation a été passée à travers l’ouraque perméable jusque dans la vessie.
Certaines anomalies de l’ouraque sont découvertes fortuitement lors de l’évaluation radiographique de routine d’autres affections, telles que les infections des voies urinaires ou l’hydronéphrose prénatale. Les kystes de l’ouraque sont susceptibles d’être observés lors de l’échographie de la vessie (Figure 4).
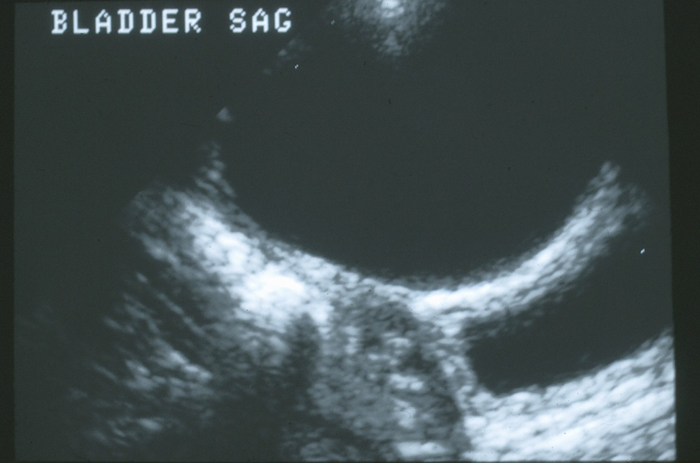
Figure 4 Coupe sagittale du dôme vésical sur la ligne médiane. Présence d’un volumineux kyste anéchogène de l’ouraque en avant de la paroi vésicale.
Carcinome de l’ouraque
Comme le carcinome de l’ouraque n’est pas une maladie signalée chez l’enfant ou l’adolescent, le traitement de cette affection ne sera pas inclus dans ce chapitre.5,12 Comme il sera discuté dans la section sur la prise en charge, le risque qu’une anomalie de l’ouraque asymptomatique développe un carcinome et, par conséquent, la valeur d’une exérèse prophylactique sont inconnus. Les facteurs de risque de carcinome dans une anomalie de l’ouraque comprennent une taille supérieure à 4 cm et un âge > 55 ans. Les calcifications sont une caractéristique fréquente dans le carcinome; cependant, la signification de calcifications dans un reliquat ouraquien bénin asymptomatique est inconnue.5,12 Il semblerait prudent de retirer les lésions comportant des calcifications, étant donné que les calcifications peuvent être associées à une inflammation chronique, laquelle est associée à la carcinogenèse.
Évaluation radiologique
L’imagerie est orientée par les symptômes de présentation et le degré de suspicion clinique.6,8 Un ouraque perméable permettant un écoulement urinaire libre par l’ombilic peut être mis en évidence avec une grande sensibilité par une urétrocystographie mictionnelle (VCUG) ou un sinogramme. Traditionnellement, une VCUG était réalisée pour identifier l’ouraque perméable et également fournir une évaluation anatomique de la vessie et rechercher une obstruction de la voie d’évacuation vésicale ou un reflux vésico-urétéral (Figure 5). Cependant, l’échographie abdominale suffit pour le diagnostic chez la plupart des patients, est plus largement disponible, moins invasive et moins coûteuse ; elle est donc devenue l’examen de référence pour le diagnostic, et la VCUG est réservée aux cas compliqués.3,13 Il est important d’informer l’échographiste de la suspicion clinique d’anomalie de l’ouraque afin que la paroi abdominale médiane soit examinée de manière approfondie. Les kystes ouraquiens infectés se présentent sous forme de volumineuses masses hétérogènes comportant des collections liquidiennes complexes (Figure 6).
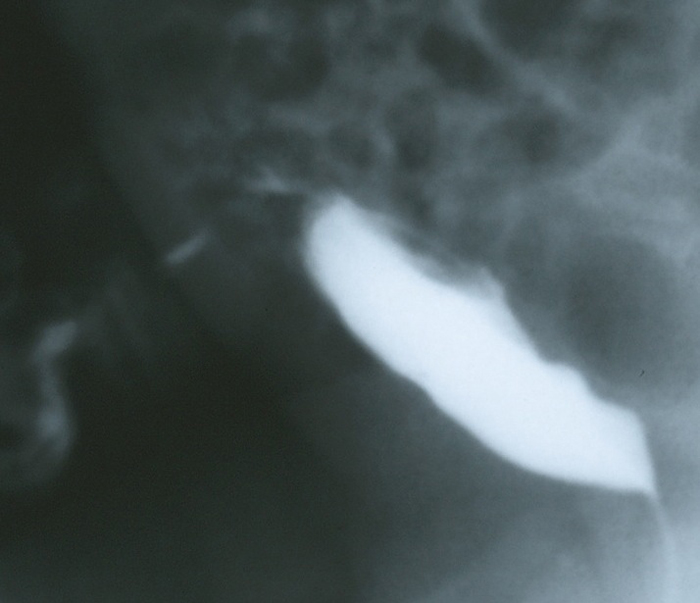
Figure 5 Vue de profil en phase de remplissage lors d’une CUM chez un nourrisson présentant des quantités abondantes de liquide clair s’écoulant de l’ombilic. L’image montre le produit de contraste s’écoulant à travers la paroi abdominale antérieure depuis le dôme de la vessie via un ouraque perméable.
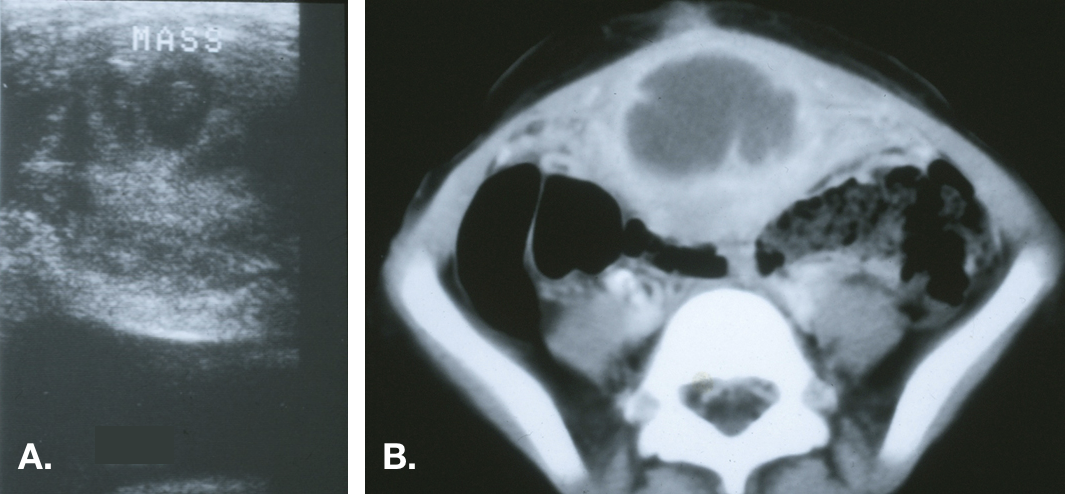
Figure 6 Kyste de l’ouraque infecté. A. Vue transversale du dôme vésical sur la ligne médiane mettant en évidence une masse échogène hétérogène au‑dessus de la vessie. B. TDM montrant la masse médiane avec une densité liquidienne centrale compatible avec un abcès et une infiltration inflammatoire de la paroi abdominale antérieure adjacente.
Les lésions peuvent mesurer plusieurs centimètres de diamètre et peuvent, à l’occasion, s’étendre au-delà de l’espace prépéritonéal et perforer la cavité péritonéale.14,15
La tomodensitométrie (TDM) ne doit pas être considérée comme un élément intégral du bilan diagnostique de routine mais peut détecter des anomalies passées inaperçues à l’échographie et est donc utile en cas de forte suspicion clinique sans diagnostic clair (Figure 7).
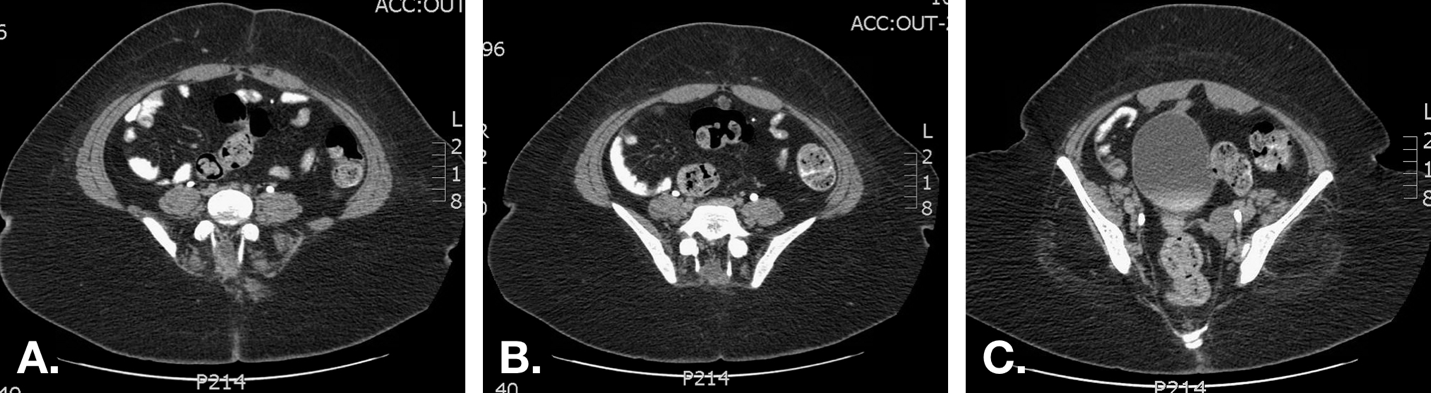
Figure 7 TDM chez un patient présentant un écoulement ombilical sanguinolent récurrent. A. L’image juste au-dessous de l’ombilic montre un ouraque d’aspect normal (cordon fibreux) juste sous les muscles droits de l’abdomen sur la ligne médiane. B. Un kyste ourachal est mis en évidence plus caudalement. C. La proximité entre l’extrémité inférieure du kyste et le dôme vésical est démontrée.
L’évaluation devrait également inclure une échographie rénale pour s’assurer de l’absence d’hydronéphrose ou d’autres anomalies rénales congénitales.6,8,9,16 L’incidence des anomalies rénales concomitantes a été très variable dans les séries publiées, mais compte tenu de l’absence de morbidité et de risque liés à l’échographie, il est prudent d’inclure l’imagerie des reins dans le bilan.4
Traitement
En général, les reliquats ourachaux symptomatiques doivent être traités par exérèse chirurgicale. Cela doit inclure l’exérèse complète de l’ouraque depuis l’ombilic jusqu’au dôme vésical (Figure 8).
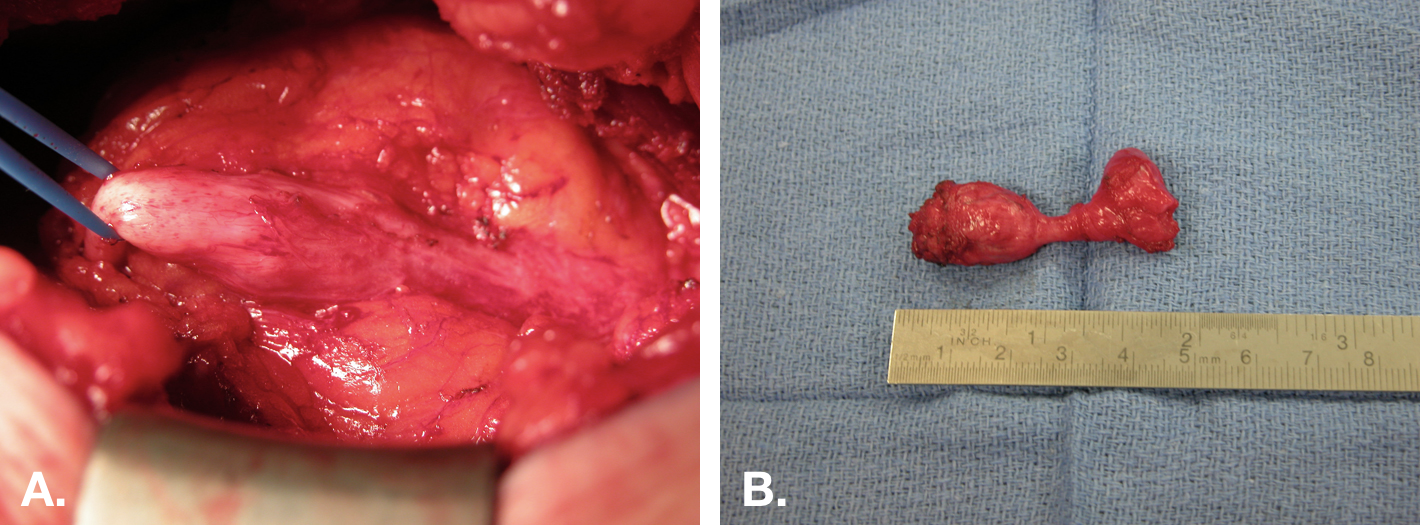
Figure 8 Exérèse ouverte d’un kyste de l’ouraque. A. Vue peropératoire d’une exérèse de kyste de l’ouraque par une incision médiane infra-ombilicale. Le kyste est au centre, avec l’insertion vésicale à droite et le cordon fibreux s’étendant jusqu’à l’ombilic à gauche. B. La pièce opératoire (kyste) après exérèse avec un petit manchon vésical (extrémité droite de la pièce).
La nécessité d’exciser la muqueuse vésicale avec des kystes ou des sinus de l’ouraque qui ne sont pas en continuité avec la paroi vésicale fait débat.2,6,7,17,18 Les kystes ourachaux infectés posent un autre dilemme, car l’augmentation marquée du volume du kyste due à l’infection et à l’inflammation des tissus adjacents rend l’exérèse simple plus difficile et peut augmenter le risque de complications. On peut aborder un kyste ourachal infecté soit en un temps, soit en plusieurs temps.7,17,19 Les avantages et les risques relatifs des deux approches sont discutés plus loin.
L’exérèse chirurgicale du reliquat de l’ouraque est curative et il n’existe pas de séquelles fonctionnelles liées à cette exérèse, puisqu’il s’agit d’un vestige. Le principal dilemme chirurgical se pose chez les patients présentant une lésion asymptomatique découverte fortuitement à l’imagerie.
Prise en charge conservatrice
Les données concernant les séquelles à long terme—à savoir des infections récidivantes et le développement d’un carcinome—des anomalies de l’ouraque laissées in situ sont limitées. Historiquement, l’exérèse était privilégiée compte tenu du risque présumé de transformation maligne. Toutefois, des publications récentes plaident pour une approche conservatrice.10,20 La fermeture de l’ouraque perméable et la régression des kystes ouraquaux—même en contexte d’infection—ont été rapportées.21,22,23 La récidive des symptômes après drainage percutané de kystes infectés semble rare.23 Dans une série, 92 % des nourrissons < 6 mois qui ont été surveillés ont présenté une résolution de l’infection, tandis que 60 % de ceux ayant subi une exérèse ont développé une infection postopératoire, ce qui indique qu’une prise en charge conservatrice jusqu’au moins l’âge de 6 mois peut être judicieuse.21
Pour les kystes de l’ouraque infectés, une uroculture et, si présent, une culture de l’écoulement de plaie doivent être réalisées. Le germe le plus fréquemment isolé à partir des kystes de l’ouraque infectés est Staphylococcus aureus (Tableau 3).5,21,18,20 Si le patient est stable, apyrexique, sans signe de toxicité systémique, sans signes péritonéaux, sans cellulite en extension et sans signes de fasciite, une prise en charge initiale par antibiothérapie seule peut être envisagée.
Tableau 3 Espèces microbiennes isolées à partir de reliquats de l’ouraque infectés. * E Coli-3, Citrobacter, Enterococcus et Proteus.
| Auteur | Nb de patients | S. Aureus | Streptocoque sp | Autres * |
|---|---|---|---|---|
| Stopak | 16 | 9 | 0 | 2 |
| McCollum | 9 | 6 | 1 | 2 |
| Minevich | 9 | 9 | 0 | 0 |
| Ashley | 9 | 6 | 1 | 2 |
| Galati | 5 | 5 | 0 | 0 |
| Newman | 5 | 3 | 0 | 2 |
| Total | 53 | 38 (72) | 2 (4) | 8 (15) |
Chez les patients instables ou ceux qui ne répondent pas à une prise en charge conservatrice, le kyste infecté peut être traité par exérèse chirurgicale complète initiale ou par un drainage percutané (guidé par échographie ou TDM) ou ouvert. Lors d’une exérèse en un temps de l’ouraque infecté, les marges de résection seront plus larges et entraîneront un défaut des tissus mous plus important, et l’étendue de l’inflammation peut s’étendre en intrapéritonéal, ce qui expose les viscères abdominaux à un risque. Il existe un risque faible mais significatif de fistule entérocutanée et un taux plus élevé de complications de plaie après excision primaire d’un kyste ouraquien infecté par rapport au drainage.21,18,19,24 Les drains percutanés peuvent drainer de façon incomplète des collections liquidiennes multiloculées. Traditionnellement, tous les kystes étaient excisés après résolution de l’inflammation, dans le cadre d’une procédure en plusieurs temps. Plusieurs études récentes ont démontré que la récidive infectieuse est peu fréquente et que, par conséquent, une exérèse différée peut ne pas être nécessaire.
Excision laparoscopique de l’ouraque
À l’ère de la chirurgie mini-invasive, plusieurs rapports de résection laparoscopique, et plus récemment de résection laparoscopique assistée par robot, de reliquats ourachaux chez l’enfant ont été publiés.25,26,27 La chirurgie laparoscopique par incision unique a également été rapportée.28 L’avantage principal de la technique robotique est la facilité de réalisation des sutures comparée à la laparoscopie pure.27 La visualisation est excellente avec une approche laparoscopique pour la vessie, mais elle peut être plus difficile au niveau de l’ombilic si les trocarts ne sont pas placés avec soin. L’ouraque doit être réséqué de la base de l’ombilic jusqu’au dôme vésical. Là encore, une controverse persiste quant à savoir si une résection complète nécessite ou non l’excision du dôme vésical.25,26
La mise en place des trocarts est une considération importante.26 Étant donné que l’ouraque prend naissance à l’ombilic, celui-ci ne peut pas être utilisé comme site de trocart. Le site le plus courant pour l’optique est sus-ombilical (généralement 1–2 cm). Cela offre suffisamment d’espace de travail pour visualiser la dissection de l’ombilic jusqu’au dôme de la vessie. Les trocarts de travail doivent être placés latéralement de chaque côté, généralement au niveau de l’ombilic. Une autre option consiste à placer latéralement les trocarts de travail et la caméra (du côté droit ou gauche de l’abdomen), ce qui offre une visualisation latérale de l’ouraque et maintient tous les trocarts en position sous-ombilicale. La configuration latérale des trocarts rendra la suture de la fermeture vésicale plus difficile en raison de l’angulation.

Figure 9 Schéma des emplacements possibles des trocarts pour l’exérèse d’un reliquat de l’ouraque. Contrairement à la configuration habituelle de la plupart des interventions laparoscopiques, l’ombilic ne peut pas être utilisé comme site de trocart, car il est l’origine de l’ouraque et doit être visualisé lors de la dissection.
Exérèse ouverte de l’ouraque
Chez les nourrissons et les jeunes enfants, la résection complète de l’ouraque peut être réalisée aisément par une petite incision. Celle-ci peut être orientée transversalement ou sur la ligne médiane verticale. Chez les nourrissons, une petite incision de 1 à 1,5 cm à mi-distance entre le pubis et l’ombilic donnera accès à l’ouraque et permettra une résection complète de l’ombilic jusqu’au dôme vésical, avec une excellente exposition du dôme vésical pour sa fermeture. Cette petite incision est comparable à la taille de l’incision nécessaire pour le trocart de caméra de 12 mm du robot chirurgical et maintient l’intervention entièrement extrapéritonéale, éliminant les complications intra-abdominales potentielles. Chez les enfants plus âgés ou obèses, ou chez les adolescents, il est prudent de réaliser une incision médiane verticale. En cas de difficulté d’exposition, l’incision peut être prolongée vers le haut en direction de l’ombilic ou vers le bas en direction de la vessie afin de faciliter l’ablation complète de l’ouraque chez ces patients. Les taux de complications de l’exérèse simple sont très faibles et l’intervention peut être réalisée en ambulatoire ou avec une courte hospitalisation si une sonde urinaire est laissée en place. Les fuites d’urine ou les complications de la plaie opératoire sont plus souvent associées à l’exérèse en un temps de kystes infectés et non à l’exérèse simple.18,19
Points clés
- Les anomalies de l’ouraque se manifestent le plus souvent par un écoulement ombilical persistant plusieurs semaines après la naissance ou par une masse ombilicale et/ou une douleur due à une infection.
- Le diagnostic différentiel d’un écoulement ombilical inclut une anomalie de l’ouraque, une omphalite, un reliquat du canal omphalomésentérique, ou un granulome ombilical.
- Le risque absolu de carcinome sur une anomalie de l’ouraque asymptomatique est inconnu. Les facteurs de risque de carcinome dans une anomalie de l’ouraque comprennent une taille supérieure à 4 cm et un âge >55 ans.
- L’échographie abdominale est suffisante pour le diagnostic d’une anomalie de l’ouraque chez la plupart des patients. Le bilan doit inclure une échographie rénale pour évaluer d’éventuelles anomalies rénales congénitales.
- Les reliquats ouraquaux symptomatiques doivent être excisés par voie ouverte, laparoscopique ou robot-assistée. En cas d’approche laparoscopique ou robotique, l’ombilic ne peut pas être utilisé comme site de trocart.
- Les infections non compliquées des kystes de l’ouraque peuvent être traitées de manière conservatrice par antibiotiques ± drainage percutané. L’exérèse immédiate comporte un risque significatif d’infection postopératoire. Une exérèse différée est raisonnable mais peut ne pas être nécessaire, car la fermeture des reliquats/kyste est possible et la récidive infectieuse est rare, en particulier chez les enfants <6 mois.
Utricule prostatique
Embryologie et anatomie
Chez les fœtus mâles, la production de substance inhibitrice müllérienne (MIS) par les cellules de Sertoli entraîne la régression rapide des canaux paramésonéphriques (de Müller)—qui, chez la femme, deviennent les trompes de Fallope, l’oviducte, l’utérus et les 2/3 supérieurs du vagin—au cours des 8-10e semaines de gestation. L’utricule prostatique est un petit vestige des canaux paramésonéphriques qui persiste chez les mâles comme une expansion de l’urètre prostatique.1 L’utricule prend naissance à partir de la ligne médiane de la prostate au niveau du versant crânial du verumontanum.
Présentation clinique
Les utricules prostatiques (PU) n’ont pas de signification clinique, sauf si la régression complète a été compromise et que l’utricule conserve un aspect dilaté, kystique, se comportant comme un diverticule de l’urètre prostatique. L’augmentation de volume de l’utricule est associée à l’hypospadias, à la cryptorchidie, aux troubles du développement sexuel et à l’agénésie rénale unilatérale.29,30,31,32,33,34 Des séries de cas indiquent que la dilatation du PU survient chez 10-33% des patients atteints d’hypospadias proximal, avec une incidence qui augmente avec la sévérité de l’hypospadias.30,32 Dans une série de garçons présentant des organes génitaux externes normaux mais un PU symptomatique, une agénésie rénale unilatérale a été retrouvée dans près d’un tiers des cas.33
Le PU peut être asymptomatique, provoquer des symptômes liés à l’obstruction ou à la stase urinaire—infections urinaires récidivantes, épididymo-orchite, écoulement urétral, rétention urinaire, formation de calculs, ou fuites post-mictionnelles—ou peut se manifester par une douleur abdominale, une hématurie ou une hématospermie.31,33,35 Rarement, une transformation maligne a été rapportée.33,34,36
La dilatation de l’utricule prostatique peut gêner le sondage chez les patients de sexe masculin présentant un hypospadias—un sondage difficile peut être le signe révélateur ou le seul symptôme d’un utricule prostatique chez ces patients. Des utricules volumineux peuvent être palpables sous ou en arrière de la vessie au toucher rectal.31,33,35,37
Le diagnostic différentiel des utricules prostatiques comprend le kyste du canal de Müller (non en continuité avec l’urètre prostatique), le diverticule vésical, le kyste de l’ouraque et le kyste de la vésicule séminale.33,38
Tableau 4 Symptômes révélateurs chez des patients atteints d’utricules prostatiques
| Auteur | Nb de patients | IVU | Symptômes du bas appareil urinaire | Rétention urinaire | Épididymite/ Douleur scrotale | Autres |
|---|---|---|---|---|---|---|
| Desautel | 26 | 6 | 1 | 7 | 2 | 1 |
| Liu | 22 | 8 | 7 | 6 | 3 | 6 |
| Dai | 15 | 6 | 2 | 1 | 7 | 4 |
| Jia | 14 | 8 | 1 | 1 | 5 | 3 |
| Babu | 7 | 3 | 2 | 1 | 3 | 1 |
| Total | 84 | 31 (37) | 13 (15) | 16 (19) | 20 (24) | 5 (6) |
Évaluation radiologique
Le diagnostic est souvent établi par urétrographie rétrograde (RUG) ou cysto-uréthrographie mictionnelle (VCUG), car ces modalités permettent de visualiser l’orifice de l’utricule par rapport à l’urètre et à la vessie. Cependant, l’échographie transabdominale est presque aussi sensible que la RUG et peut suffire à détecter des utricules suffisamment volumineux pour justifier une intervention.30,39 Les utricules peuvent passer inaperçus à l’imagerie en raison d’un remplissage incomplet. Une imagerie en coupes peut être réalisée et peut aider à la planification opératoire, mais elle n’est pas nécessaire au diagnostic. Les utricules peuvent être classés à l’imagerie comme suit:29
- Grade 0 – limité au veru montanum
- Grade 1 – s’étend jusqu’au col vésical ou en dessous de celui-ci (Image 1)
- Grade 2 – s’étend en amont du col vésical (Image 2)
- Grade 3 – s’ouvre en aval du sphincter urétral externe
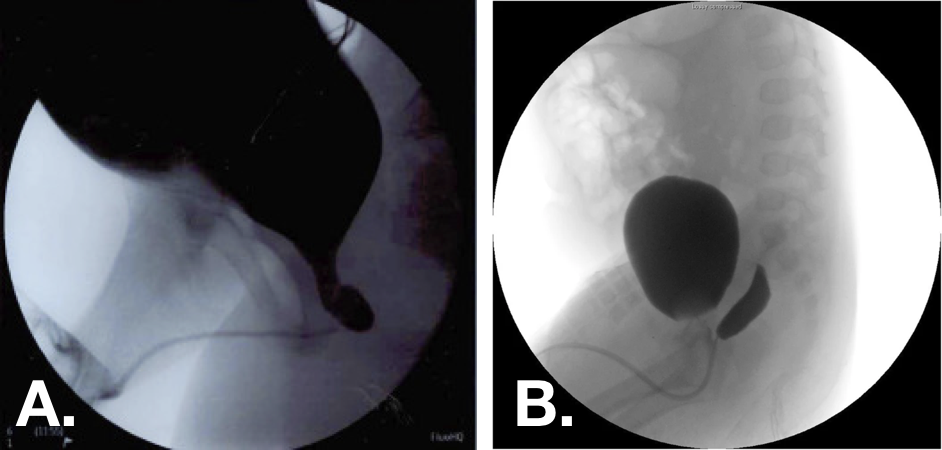
Figure 10 Images d’urétrocystographie mictionnelle (VCUG) montrant des utricules prostatiques de grade 1 (à gauche) et de grade 2 (à droite).30,33
Prise en charge
La prise en charge conservatrice réussie des utricules symptomatiques n’a pas été bien décrite et nécessiterait généralement une antibioprophylaxie fréquente ou au long cours pour des infections récidivantes.33 Diverses approches chirurgicales efficaces ont été décrites, l’exérèse complète de l’utricule offrant une prise en charge définitive. Pour les utricules avec des orifices très petits, l’aspiration guidée par échographie transrectale et le cathétérisme transurétral avec aspiration, l’incision de l’orifice et la fulguration ont toutes été rapportées.31,33,35,40 Ces approches sont mini-invasives mais confèrent une incidence plus élevée de récidive des symptômes que l’exérèse. Des approches d’exérèse ouvertes, laparoscopiques et assistées par robot ont toutes été décrites, et il n’existe pas de consensus concernant l’approche optimale. L’approche robot-assistée peut être avantageuse en raison de la localisation difficile de l’utricule. On peut accéder aux utricules par des voies extrapéritonéales, extravésicales, transvésicales, sagittales postérieures ou périnéales.31,33,35,37,41 Une cystoscopie concomitante peut aider à définir les limites de la dissection dans les interventions laparoscopiques.37,41 Les conversions rapportées d’une approche laparoscopique à une approche ouverte pour l’exérèse de l’utricule sont peu fréquentes.
Les principes clés de l’exérèse, quelle que soit la voie d’abord, sont une dissection adéquate, l’exérèse et une fermeture étanche de l’orifice de l’utricule, ainsi que la préservation des nerfs pelviens, du canal déférent, des vésicules séminales, des colliculi séminaux et du rectum.
Tableau 5 Approches chirurgicales de l’exérèse de l’utricule prostatique et récidive postopératoire des symptômes inauguraux
| Approche | Endoscopique | Endoscopique | Ouverte | Ouverte | Laparoscopique | Laparoscopique |
|---|---|---|---|---|---|---|
| Auteur | Cas | Récidives | Cas | Récidives | Cas | Récidives |
| Liu | 3 | 0 | 11 | 0 | 4 | 0 |
| Desautel | 2 | 1 | 13 | 0 | – | – |
| Dai | 13 | 5 | – | – | 4 | 0 |
| Jia | – | – | 8 | 2 | 6 | 0 |
| Babu | 7 | 2 | 2 | 2 | 1 | 1 |
| Yeung | – | – | – | – | 4 | 0 |
| Bayne | – | – | – | – | 4 | 0 |
| Total | 25 | 8 (32) | 34 | 4 (12) | 23 | 1 (4) |
Points clés
- L’utricule prostatique est un petit vestige des canaux paramésonéphriques qui persiste chez le sujet masculin sous forme d’une extension de l’urètre prostatique.
- L’augmentation de taille de l’utricule est associée à l’hypospadias, à la cryptorchidie, aux troubles de la différenciation sexuelle et à l’agénésie rénale unilatérale.
- Les utricules prostatiques peuvent être asymptomatiques, provoquer des symptômes liés à une obstruction ou à une stase urinaire, ou se manifester par des douleurs abdominales, une hématurie ou une hématospermie.
- La dilatation de l’utricule prostatique peut entraver le cathétérisme chez les patients présentant un hypospadias.
- Les utricules prostatiques symptomatiques peuvent être excisés par voie ouverte, laparoscopique ou assistée par robot.
Diverticules vésicaux
Les diverticules vésicaux sont rares dans la population pédiatrique, survenant chez 1,7 % des patients.42 Les diverticules peuvent être congénitaux ou acquis ; les diverticules vésicaux congénitaux sont beaucoup plus fréquents dans la population pédiatrique.43
Diverticules congénitaux
On pense que les diverticules congénitaux résultent d’un défaut du muscle détrusor. Quatre-vingt-dix pour cent se développent autour de la gaine de Waldeyer, qui contient l’uretère, et sont appelés diverticules de Hutch.44 Ils peuvent être classés en périurétéraux (diverticule proche mais n’impliquant pas l’orifice urétéral) ou paraurétéraux (orifice urétéral impliqué dans le diverticule).44 La distorsion de la paroi vésicale et du tunnel musculaire de l’uretère prédisposent les enfants présentant ces diverticules au reflux vésico-urétéral. Les diverticules congénitaux non associés à l’uretère se développent dans les régions postéro-latérales de la vessie.43
Les diverticules vésicaux congénitaux sont associés à des syndromes génétiques qui affectent le développement du tissu conjonctif : Ehlers-Danlos types IV, V, IX ; syndrome de Menkes ; syndrome de Williams-Beuren, et syndrome d’alcoolisation fœtale.41,44,45 Contrairement aux diverticules acquis, les diverticules congénitaux se rencontrent dans des vessies à paroi lisse qui présentent généralement une mécanique mictionnelle normale, constituent des anomalies isolées et ne sont pas associés à un risque accru de malignité.43 Les diverticules congénitaux surviennent plus souvent chez les sujets de sexe masculin et sont généralement plus volumineux que ceux acquis du fait d’une dysfonction vésicale neurogène.43
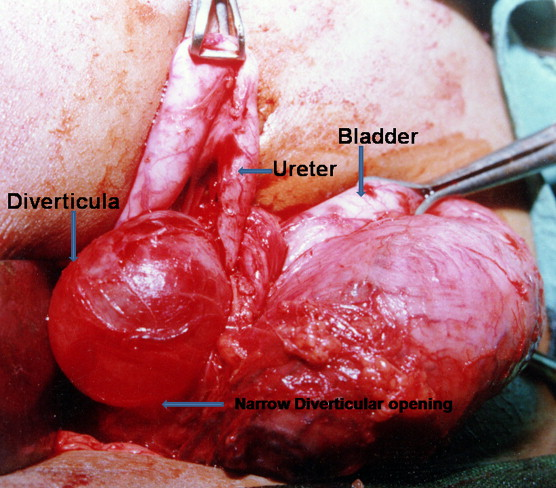
Figure 11 Démonstration peropératoire d’un grand diverticule vésical para-urétéral avec dilatation proximale et déplacement médial de l’uretère.46
Diverticules acquis
Les diverticules acquis ou secondaires se développent en raison d’une pathologie neurogène ou obstructive des voies urinaires basses. Bien que constituant le type de diverticule le plus fréquent chez l’adulte, les diverticules secondaires sont rares chez les patients pédiatriques et traduisent un dysfonctionnement sévère des voies urinaires basses.43 Ils sont plus susceptibles d’être retrouvés près du dôme vésical, peuvent être multiples, et sont plus fréquemment observés dans une vessie trabéculée. Les diverticules acquis, en général, sont associés à la vessie neurologique et à l’obstruction sous-vésicale, et chez les patients pédiatriques peuvent s’observer avec des valves urétrales postérieures & le syndrome de Prune Belly.42,43
Présentation clinique
Les diverticules vésicaux chez l’enfant se présentent le plus souvent par une infection urinaire secondaire à une stase urinaire au sein du diverticule ou sont découverts lors du bilan d’une hydronéphrose ou d’une infection urinaire fébrile avec suspicion de reflux vésico-urétéral.44,46 Des anomalies des voies urinaires supérieures peuvent être retrouvées dans 16 à 30 % des cas.44 Des symptômes de présentation moins fréquents comprennent des symptômes mictionnels irritatifs, une hématurie, une distension et des douleurs abdominales, une énurésie, des calculs vésicaux et une obstruction de la voie d’évacuation vésicale due à une déformation du col vésical.46,47,48 Plus rarement, les diverticules vésicaux peuvent se manifester par une obstruction urétérale complète ou une perforation intra- ou extrapéritonéale.49,50,51,52,53,54
La plupart des patients présentant des diverticules vésicaux congénitaux sont asymptomatiques, et—bien que beaucoup moins fréquemment que les diverticules acquis—peuvent être diagnostiqués fortuitement chez l’adulte.
Compte tenu de l’association avec diverses affections génétiques, de la fréquence des anomalies des voies urinaires supérieures et de la possibilité d’une pathologie sous-jacente neurogène ou obstructive, certains ont proposé que tous les enfants porteurs de diverticules vésicaux soient testés pour des anomalies chromosomiques.42 Un dépistage génétique systématique n’est actuellement pas recommandé chez les patients présentant un diverticule vésical congénital isolé.44
Tableau 6 Symptômes révélateurs et constatations associées chez les enfants présentant des diverticules vésicaux
| Auteurs | # Pts | IVU | SBAU | Rétention | Autres | RVU | Hydronéphrose |
|---|---|---|---|---|---|---|---|
| Alexander | 47 | 26 | 2 | 0 | 2 | 32 | 19 |
| Evangilidis | 21 | 19 | 12 | 0 | – | – | – |
| Marte | 16 | 15 | 9 | 0 | 6 | 7 | – |
| Bhat | 12 | 5 | – | 12 | 4 | 9 | 5 |
| Macedo | 10 | 5 | 3 | 1 | – | – | 4 |
| Total | 106 | 70 (66) | 26 (25) | 13 (12) | 12 (11) | 48 (45) | 28 (26) |
Évaluation radiologique
Les diverticules vésicaux sont souvent détectés initialement à l’échographie vésicale sous la forme d’un kyste hypoéchogène naissant de la paroi vésicale postérolatérale. Le diagnostic différentiel d’un diverticule suspecté en imagerie comprend le kyste de l’ouraque, l’urétérocèle éversée, l’uretère ectopique, la herniation vésicale dans une hernie inguinale et la duplication vésicale.44 La cysto-urétrographie mictionnelle avec incidences latérales et obliques est la référence pour établir le diagnostic de diverticule vésical et permet une évaluation simultanée du RVU.43 En particulier en l’absence de RVU, une urographie intraveineuse ou une urographie par scanner (uro-scanner) ou par IRM (uro-IRM) peut être utilisée pour préciser la relation anatomique entre le diverticule et l’uretère.44 Les voies urinaires supérieures des enfants présentant des diverticules vésicaux doivent être évaluées à la recherche d’une hydrouréteronéphrose.
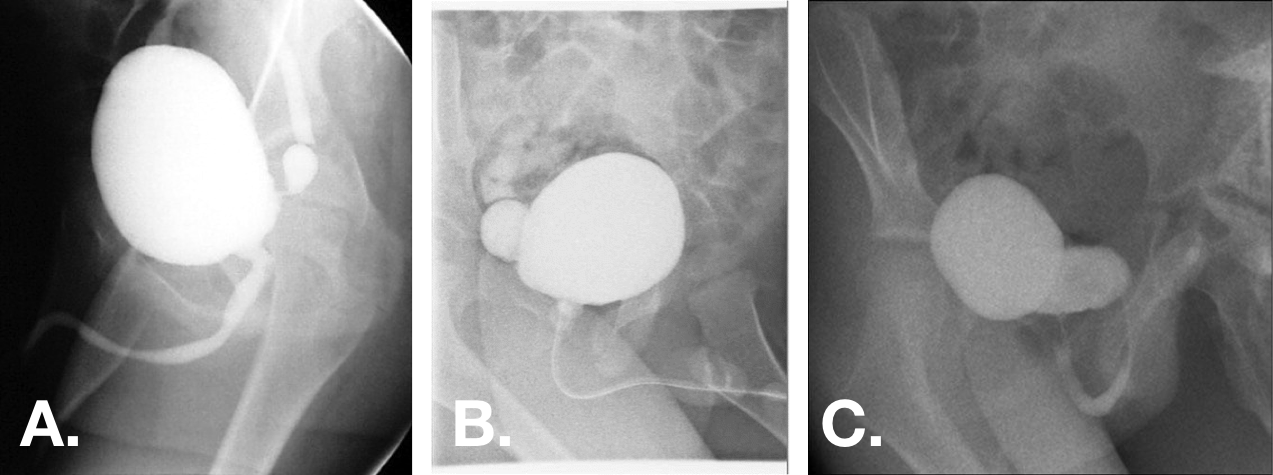
Figure 12 Diverticules vésicaux congénitaux vus sur des incidences obliques de VCUG. Les diverticules peuvent varier de petits diverticules à col très étroit à des diverticules plus grands que la vessie, avec des orifices à large base.44,47,55
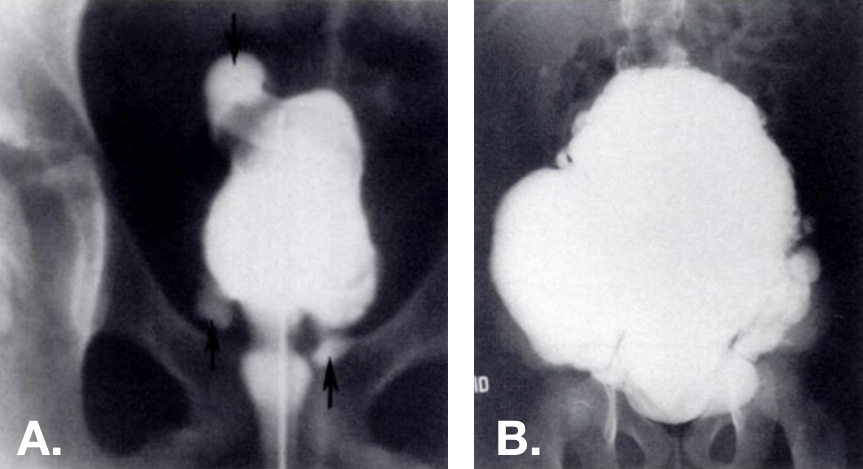
Figure 13 Diverticules acquis observés à la VCUG. Diverticules multiples présents à divers endroits—y compris au dôme vésical—dans des vessies trabéculées. La photo de droite provient d’un patient atteint du syndrome d’Ehlers-Danlos.42
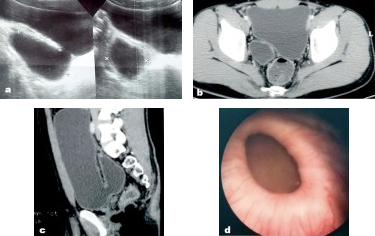
Figure 14 Diverticule vésical congénital tel qu’observé à l’échographie, à la TDM pelvienne et à la cystoscopie.56
Les examens urodynamiques peuvent être envisagés chez les patients présentant des diverticules vésicaux si une dysfonction sous-jacente du bas appareil urinaire est suspectée ou si la présence d’un diverticule n’explique pas de manière adéquate les symptômes présentés par le patient. Une hyperactivité détrusorienne est observée chez environ la moitié de ces patients, possiblement secondaire à une hypotonie au sein et autour du diverticule et à une stase urinaire chronique.44,48 Les diverticules compliquent l’interprétation du cystométrogramme, car ils abaissent la pression intravésicale. La stase d’urine au sein du diverticule et le VUR associé peuvent également compliquer les résultats.44
L’évaluation endoscopique peut aider à clarifier l’anatomie et est recommandée pendant l’intervention chirurgicale, mais elle n’est pas nécessaire pour le diagnostic d’un diverticule vésical.
Indications de réparation
Bien que les diverticules vésicaux ne régressent pas spontanément, tous les patients ne nécessitent pas une intervention chirurgicale. Un traitement adéquat de l’infection des voies urinaires (IVU) et des troubles mictionnels peut faire disparaître les symptômes chez les patients présentant de petits diverticules non compliqués.44 Chez les patients présentant des symptômes réfractaires ou des diverticules compliqués, l’exérèse chirurgicale est généralement curative, et une réimplantation urétérale peut être réalisée simultanément si nécessaire. Les indications généralement admises pour la chirurgie comprennent les suivantes :43,44
- Symptômes mictionnels réfractaires au traitement médical
- Diverticule > 3cm
- Infections urinaires fréquentes
- RVU compliqué
- Rétention urinaire
- Obstruction ou détérioration des voies urinaires supérieures
- Calculs vésicaux
- Rupture de diverticule
Contrairement aux adultes, la dégénérescence maligne de l’épithélium associée aux diverticules vésicaux chez l’enfant est généralement absente; cependant, toute suspicion de malignité nécessiterait une intervention chirurgicale.43
Avant toute intervention chirurgicale, la dysfonction mictionnelle doit être évaluée et prise en charge afin d’isoler les symptômes liés au diverticule et leur évolution en postopératoire. Les pathologies associées, telles que l’hypoactivité détrusorienne, l’obstruction de la voie d’évacuation vésicale ou le dysraphisme médullaire, doivent être prises en charge avant la diverticulectomie.
L’intervention chirurgicale doit être envisagée avec prudence chez les patients présentant des troubles du tissu conjonctif sous-jacents, car la récidive est probable dans cette population.44,53
Approches opératoires
La diverticulectomie vésicale peut être réalisée par voie endoscopique ou par des abords ouverts ou mini-invasifs transvésicaux ou extravésicaux. Les abords transvésicaux et extravésicaux reproduisent ceux utilisés pour la réimplantation urétérale, et la réimplantation peut être réalisée dans le cadre de l’intervention si nécessaire en raison de la localisation du diverticule ou si elle est indiquée en raison d’un RVU sévère associé. Il est recommandé d’effectuer, dans le cadre de la planification opératoire, une évaluation cystoscopique de l’orifice diverticulaire par rapport à l’orifice urétéral. Plusieurs séries de cas ont rapporté une résolution complète des symptômes—ou une réduction marquée des symptômes de dysfonction mictionnelle—ainsi que du RVU après exérèse diverticulaire, quel que soit l’abord.57,55 L’occlusion de l’orifice diverticulaire para-urétéral par injection sous-urétérale d’agents volumateurs a été rapportée, bien que les données sur l’efficacité à long terme soient limitées.58,59 Une comparaison des abords endoscopique, intravésical et extravésical a montré une résolution du RVU dans 79 %, 91 % et 80 % des cas, respectivement.59
Les considérations chirurgicales importantes, quelle que soit la voie d’abord, sont une prophylaxie antimicrobienne périopératoire guidée par les résultats des cultures, l’évitement des lésions ou de la dévascularisation de l’uretère ou du canal déférent, l’évitement des lésions rectales lors de la réparation de diverticules postérieurs volumineux, et une décompression vésicale postopératoire.44
Points clés
- Les diverticules vésicaux chez l’enfant peuvent être congénitaux—dus à un défaut du muscle détrusor, le plus souvent autour de la gaine de Waldeyer (diverticules de Hutch)—ou acquis en raison d’une pathologie neurogène ou obstructive du bas appareil urinaire.
- La déformation de la paroi vésicale et du tunnel musculaire de l’uretère par les diverticules de Hutch prédispose les enfants au reflux vésico-urétéral.
- Les diverticules vésicaux chez l’enfant se présentent le plus souvent par une IU secondaire à la stase urinaire au sein du diverticule ou sont découverts lors du bilan d’une hydronéphrose ou d’une IU fébrile avec suspicion de reflux vésico-urétéral. La majorité des diverticules sont asymptomatiques.
- La cysto-urétrographie mictionnelle avec incidences de profil et obliques est l’examen de référence pour établir le diagnostic de diverticule vésical et permet une évaluation simultanée du reflux vésico-urétéral.
- Chez les patients présentant des symptômes réfractaires ou des diverticules compliqués, une exérèse chirurgicale peut être réalisée par voie transvésicale ou extravésicale. Une réimplantation urétérale peut être effectuée simultanément si nécessaire.
- Avant toute intervention, les troubles mictionnels doivent être évalués et pris en charge.
Résumé
Les anomalies de l’ouraque se présentent sous diverses formes et entraînent le plus souvent un écoulement ombilical ou une infection. Ces anomalies peuvent être prises en charge de façon conservatrice et peuvent se résorber spontanément. Les kystes infectés peuvent être drainés par voie percutanée, et toute anomalie symptomatique peut être excisée par voie ouverte ou laparoscopique. Le risque de transformation maligne des anomalies de l’ouraque asymptomatiques chez l’enfant est inconnu.
La dilatation de l’utricule prostatique est associée à l’hypospadias et à d’autres anomalies génito-urinaires et peut être asymptomatique ou provoquer des symptômes liés à un obstacle à l’écoulement urinaire et à une stase urinaire. Les utricules peuvent être diagnostiqués par RUG, VCUG ou US. Chez les patients symptomatiques, l’exérèse peut être réalisée par voie endoscopique, ouverte ou laparoscopique, la prise en charge endoscopique conférant un risque plus élevé de récidive.
Les diverticules vésicaux chez l’enfant peuvent être congénitaux ou acquis. Les diverticules congénitaux sont dus à des défauts du détrusor près de la gaine urétérale et sont associés au RVU ainsi qu’aux maladies du tissu conjonctif. Les diverticules sont souvent asymptomatiques mais peuvent provoquer une infection, des symptômes mictionnels irritatifs, une rétention urinaire, ou des douleurs abdominales et sont souvent associés à une hyperactivité détrusorienne. Les diverticules acquis sont secondaires à une obstruction des voies urinaires basses ou à une vessie neurologique. Les indications d’une réparation chirurgicale comprennent des symptômes réfractaires ou sévères, une taille >3cm, et une dysfonction des voies urinaires associée. L’intervention doit être précédée par la prise en charge de toute autre pathologie des voies urinaires basses. Il n’existe pas de consensus quant à l’approche opératoire, et une réimplantation urétérale est souvent réalisée simultanément.
Références
- Jm P. Embryology of the genitourinary tract. Elsevier: Philadelphia; 2016, DOI: 10.1201/b13795-15.
- MacNeily AE, Koleilat N, Kiruluta HG, Homsy YL. Urachal abscesses: Protean manifestations, their recognition, and management. Urology 1992; 40 (6): 530–535. DOI: 10.1016/0090-4295(92)90409-p.
- Naiditch JA, Radhakrishnan J, Chin AC. Current diagnosis and management of urachal remnants. J Pediatr Surg 2013; 48 (10): 2148–2152. DOI: 10.1016/j.jpedsurg.2013.02.069.
- Fox JA, M.S. R, JC G, CF A, RA H, JC V, et al.. Vesicoureteral reflux in children with urachal anomalies. J Pediatr Urol 2011; 7 (6): 632–635. DOI: 10.1016/j.jpurol.2011.04.001.
- Ashley RA, Inman BA, Routh JC, Rohlinger AL, Husmann DA, Kramer SA. Urachal Anomalies: A Longitudinal Study of Urachal Remnants in Children and Adults. J Urol 2007; 178 (4s): 1615–1618. DOI: 10.1016/j.juro.2007.03.194.
- Cilento BG, Bauer SB, Retik AB, Peters CA, Atala A. Urachal anomalies: defining the best diagnostic modality. Urology 1998; 52 (1): 120–122. DOI: 10.1016/s0090-4295(98)00161-7.
- Rich RH, Hardy BE, Filler RM. Surgery for Anomalies of the Urachus. J Urol 1983; 131 (3): 616–616. DOI: 10.1016/s0022-5347(17)50535-2.
- Yiee JH, Garcia N, Baker LA, Barber R, Snodgrass WT, Wilcox DT. A diagnostic algorithm for urachal anomalies. J Pediatr Urol 2007; 3 (6): 500–504. DOI: 10.1016/j.jpurol.2007.07.010.
- Copp HL, Wong IY, Krishnan C, Malhotra S, Kennedy WA. Clinical Presentation and Urachal Remnant Pathology: Implications for Treatment. J Urol 2009; 182 (4s): 1921–1924. DOI: 10.1016/j.juro.2009.03.026.
- Cuda SP, Vanasupa BP, Sutherland RS. Nonoperative management of a patent urachus. Urology 2005; 66 (6): 1320.e7–1320.e9. DOI: 10.1016/j.urology.2005.06.121.
- Gleason JM, Bowlin PR, Bagli DJ, Lorenzo AJ, Hassouna T, Koyle MA, et al.. A Comprehensive Review of Pediatric Urachal Anomalies and Predictive Analysis for Adult Urachal Adenocarcinoma. J Urol 2015; 193 (2): 632–636. DOI: 10.1016/j.juro.2014.09.004.
- Stopak JK, Azarow KS, Abdessalam SF, Raynor SC, Perry DA, Cusick RA. Trends in surgical management of urachal anomalies. J Pediatr Surg 2015; 50 (8): 1334–1337. DOI: 10.1016/j.jpedsurg.2015.04.020.
- Dethlefs CR, Abdessalam SF, Raynor SC, Perry DA, Allbery SM, Lyden ER, et al.. Conservative management of urachal anomalies. J Pediatr Surg 2019; 54 (5): 1054–1058. DOI: 10.1016/j.jpedsurg.2019.01.039.
- Sheldon CA, Clayman RV, Gonzalez R, Williams RD, Fraley EE. Malignant Urachal Lesions. J Urol 1984; 131 (1): 1–8. DOI: 10.1016/s0022-5347(17)50167-6.
- Oestreich AE. Urachal anomalies in children: the vanishing relevance of the preoperative voiding cystourethrogram. Yearbook of Diagnostic Radiology 2005; 2007 (12): 174–175. DOI: 10.1016/s0098-1672(08)70123-1.
- Lewis JB, Morse JW, Eyolfson MF, Schwartz SL. Spontaneous Rupture of a Vesicourachal Diverticulum Manifesting as Acute Abdominal Pain. Acad Emerg Med 1996; 3 (12): 1140–1143. DOI: 10.1111/j.1553-2712.1996.tb03375.x.
- OGBEVOEN JUSTINO, JAFFE DAVIDM, LANGER JACOBC. Intraperitoneal rupture of an infected urachal cyst: A rare cause of peritonitis in children. Pediatr Emerg Care 1996; 12 (1): 41–43. DOI: 10.1097/00006565-199602000-00012.
- GONZ??LEZ RICARDO, De FILIPPO ROGER, JEDNAK ROMAN, BARTHOLD JULIASPENCER. Urethral Atresia: Long-term Outcome In 6 Children Who Survived The Neonatal Period. J Urol 2001: 2241–2244. DOI: 10.1097/00005392-200106001-00006.
- Mesrobian H-GO, Zacharias A, Balcom AH, Cohen RD. Ten Years of Experience With Isolated Urachal Anomalies in Children. J Urol 1997; 158: 1316–1318. DOI: 10.1097/00005392-199709000-00173.
- McCollum MO, MacNeily AE, Blair GK. Surgical implications of urachal remnants: Presentation and management. J Pediatr Surg 2003; 38 (5): 798–803. DOI: 10.1016/jpsu.2003.50170.
- Minevich E, W.J. L, A.G.. The infected urachal cyst: Primary excision versus a staged approach. J Pediatr Surg 1997; 33 (1): 147. DOI: 10.1016/s0022-3468(98)90408-0.
- Newman BM, Karp MP, Jewett TC, Cooney DR. Advances in the management of infected urachal cysts. J Pediatr Surg 1986; 21 (12): 1051–1054. DOI: 10.1016/0022-3468(86)90006-0.
- Yoo KH, Lee S-J, Chang S-G. Treatment of Infected Urachal Cysts. Yonsei Med J 2006; 47 (3): 423. DOI: 10.3349/ymj.2006.47.3.423.
- Galati VG, D.B. R, F.. Management of Urachal Remnants in Early Childhood. Yearbook of Diagnostic Radiology 2008; 2009: 154–155. DOI: 10.1016/s0098-1672(09)79312-9.
- Nogueras-Ocaña M, Rodríguez-Belmonte R, Uberos-Fernández J, Jiménez-Pacheco A, Merino-Salas S, Zuluaga-Gómez A. Urachal anomalies in children: Surgical or conservative treatment? J Pediatr Urol 2014; 10 (3): 522–526. DOI: 10.1016/j.jpurol.2013.11.010.
- Lipskar AM, Glick RD, Rosen NG, Layliev J, Hong AR, Dolgin SE, et al.. Nonoperative management of symptomatic urachal anomalies. J Pediatr Surg 2010; 45 (5): 1016–1019. DOI: 10.1016/j.jpedsurg.2010.02.031.
- Stone NM, Garden RJ, Webert H. Laparoscopic excision of a urachal cyst. Urology 1995; 45 (1): 161–164. DOI: 10.1016/s0090-4295(95)97824-0.
- OKEGAWA TAKATSUGU, ODAGANE AKIHIRO, NUTAHARA KIKUO, HIGASHIHARA EIJI. Laparoscopic management of urachal remnants in adulthood. Int J Urol 2005; 13 (12): 1466–1469. DOI: 10.1111/j.1442-2042.2006.01613.x.
- Yamzon J, K.P. DF, RE C, AY H, BE K, C.J.. V1710 Pediatric Robotic-assisted Laparoscopic Urachal Cyst And Bladder Cuff Excision. J Urol 2008; 185 (4s): 2385–2388. DOI: 10.1016/j.juro.2011.02.2035.
- Patrzyk M, Glitsch A, Schreiber A, Bernstorff W von, Heidecke C-D. Single-incision laparoscopic surgery as an option for the laparoscopic resection of an urachal fistula: first description of the surgical technique. Surg Endosc 2010; 24 (9): 2339–2342. DOI: 10.1007/s00464-010-0922-4.
- IKOMA F, SHIMA H, YABUMOTO H. Classification of Enlarged Prostatic Utricle in Patients with Hypospadias. Br J Urol 1985; 57 (3): 334–337. DOI: 10.1111/j.1464-410x.1985.tb06356.x.
- Aktuğ T, Ekberli\. G. Re: The prostatic utricle: an under-recognized condition resulting in significant morbidity in boys with both hypospadias and normal external genitalia. J Pediatr Urol 2017; 15 (4): 425. DOI: 10.1016/j.jpurol.2019.03.030.
- Dai L-N, He R, Wu S-F, Zhao H-T, Sun J. Surgical treatment for prostatic utricle cyst in children: A single-center report of 15 patients. Int J Urol 2021; 28 (6): 689–694. DOI: 10.1111/iju.14543.
- Devine CJ, Gonzalez-Serva L, Stecker JF, Devine PC, Horton CE. Utricular Configuration in Hypospadias and Intersex. J Urol 1980; 123 (3): 407–411. DOI: 10.1016/s0022-5347(17)55959-5.
- Liu B, He D, Zhang D, Liu X, Lin T, Wei G. Prostatic utricles without external genital anomalies in children: our experience, literature review, and pooling analysis. BMC Urol 2019; 19 (1): 21. DOI: 10.1186/s12894-019-0450-z.
- Farikullah J, Ehtisham S, Nappo S, Patel L, Hennayake S. Persistent Müllerian duct syndrome: lessons learned from managing a series of eight patients over a 10-year period and review of literature regarding malignant risk from the Müllerian remnants. BJU Int 2012; 110 (11c): E1084–e1089. DOI: 10.1111/j.1464-410x.2012.11184.x.
- Desautel MG, Stock J, Hanna MK, REMNANTS MULLERIANDUCT. Müllerian Duct Remnants. J Urol 1999; 162 (3, Part 2): 1014. DOI: 10.1097/00005392-199909000-00013.
- Jia W, L.G. Z, L W, Y F, W H, J X, et al.. Comparison of laparoscopic excision versus open transvesical excision for symptomatic prostatic utricle in children J Pediatr Surg. 2016; 51 (10): 1597–1601. DOI: 10.1016/j.jpedsurg.2016.06.004.
- Babu R, Chandrasekharam VVS. Cystoscopic Management of Prostatic Utricles. Urology 2021; 149: e52–e55. DOI: 10.1016/j.urology.2020.09.005.
- Nallabothula AK, Yatam LS, Ayapati T, Bodagala VD. Large Prostatic Utricle With Transitional Cell Carcinoma in an Adult. Urology 2017; 102: e5–e6. DOI: 10.1016/j.urology.2016.12.048.
- Yeung CK, Sihoe JDY, Tam YH, Lee KH. Laparoscopic excision of prostatic utricles in children. BJU Int 2001; 87 (6): 505–508. DOI: 10.1046/j.1464-410x.2001.00132.x.
- Johnson D, Parikh K, Schey W, Mar W. MRI in Diagnosis of a Giant Prostatic Utricle. Case Rep Radiol 2014; 2014: 1–3. DOI: 10.1155/2014/217563.
- Kojima Y, Hayashi Y, Maruyama T, Sasaki S, Kohri K. Comparison between ultrasonography and retrograde urethrography for detection of prostatic utricle associated with hypospadias. Urology 2001; 57 (6): 1151–1155. DOI: 10.1016/s0090-4295(01)00954-2.
- Bayne AP, Austin JC, Seideman CA. Robotic assisted retrovesical approach to prostatic utricle excision and other complex pelvic pathology in children is safe and feasible. J Pediatr Urol 2021; 17 (5): 710–715. DOI: 10.1016/j.jpurol.2021.08.004.
- Blane CE, Zerin JM, Bloom DA. Bladder diverticula in children. Radiology 1994; 190 (3): 695–697. DOI: 10.1148/radiology.190.3.8115613.
- Es R. Bladder and female urethral diverticula. Elsevier: Philadelphia; 2017, DOI: 10.1016/b978-1-4160-6911-9.00078-5.
- Psutka SP, Cendron M. Bladder diverticula in children. J Pediatr Urol 2013; 9 (2): 129–138. DOI: 10.1016/j.jpurol.2012.02.013.
- Sammour Z, Gomes C, Bessa J, Pinheiro M, Kim C, Sacomani C, et al.. 1622 Congenital Genitourinary Abnormalities In Children With Williams-beuren Syndrome. J Urol 2014; 187 (4s): 804–809. DOI: 10.1016/j.juro.2012.02.1417.
- Bhat A, Bothra R, Bhat MP, Chaudhary GR, Saran RK, Saxena G. Congenital bladder diverticulum presenting as bladder outlet obstruction in infants and children. J Pediatr Urol 2012; 8 (4): 348–353. DOI: 10.1016/j.jpurol.2011.07.001.
- Alexander RE, Kum JB, Idrees M. Bladder Diverticulum: Clinicopathologic Spectrum in Pediatric Patients. Pediatr Dev Pathol 2012; 15 (4): 281–285. DOI: 10.2350/12-02-1154-oa.1.
- Evangelidis A, Castle EP, Ostlie DJ, Snyder CL, Gatti JM, Murphy JP. Surgical management of primary bladder diverticula in children. J Pediatr Surg 2005; 40 (4): 701–703. DOI: 10.1016/j.jpedsurg.2005.01.003.
- Marte A, Cavaiuolo S, Esposito M, Pintozzi L. Vesicoscopic Treatment of Symptomatic Congenital Bladder Diverticula in Children: A 7-Year Experience. Eur J Pediatr Surg 2015; 26 (03): 240–244. DOI: 10.1055/s-0035-1551564.
- Cruz ML da, Macedo A, Garrone G, Ottoni SL, Oliveira DE, Rosário Souza GRM do. Primary congenital bladder diverticula: Where does the ureter drain? Afr J Paediatr Surg 2015; 12 (4): 280. DOI: 10.4103/0189-6725.172574.
- Livne PM, Gonzales ET. Congenital bladder diverticula causing ureteral obstruction. Urology 1985; 25 (3): 273–276. DOI: 10.1016/0090-4295(85)90327-9.
- Stein RJ, Matoka DJ, Noh PH, Docimo SG. Spontaneous perforation of congenital bladder diverticulum. Urology 2005; 66 (4): 881.e5–881.e6. DOI: 10.1016/j.urology.2005.04.004.
- Britto MM, Yao HHI, Campbell N. Delayed diagnosis of spontaneous rupture of a congenital bladder diverticulum as a rare cause of an acute abdomen. ANZ J Surg 2019; 89 (9): 385–387. DOI: 10.1111/ans.14559.
- Jorion JL, Michel M. Spontaneous rupture of bladder diverticula in a girl with Ehlers-Danlos syndrome. J Pediatr Surg 1999; 34 (3): 483–484. DOI: 10.1016/s0022-3468(99)90506-7.
- Temiz A, Akcora B, Atik E. An atypical bladder diverticulum presented with recurrent peritonitis: case report. Ulus Travma Acil Cerrahi Derg 2011; 17 (4): 365–367. DOI: 10.5505/tjtes.2011.81542.
- Christman MS, Casale P. Robot-Assisted Bladder Diverticulectomy in the Pediatric Population. J Endourol 2012; 26 (10): 1296–1300. DOI: 10.1089/end.2012.0051.
- Nerli RB, Ghagane SC, Musale A, Deole S, Hiremath MB, Dixit NS, et al.. Congenital bladder diverticulum in a child: Surgical steps of extra-vesical excision. Urol Case Rep 2019; 22: 42–43. DOI: 10.1016/j.eucr.2018.10.009.
- Cerwinka WH, Scherz HC, Kirsch AJ. Endoscopic Treatment of Vesicoureteral Reflux with Dextranomer/Hyaluronic Acid in Children. Adv Urol 2008; 2008: 1–7. DOI: 10.1155/2008/513854.
- Aydogdu O, Burgu B, Soygur T. Predictors of Surgical Outcome in Children With Vesicoureteral Reflux Associated With Paraureteral Diverticula. Urology 2010; 76 (1): 209–214. DOI: 10.1016/j.urology.2009.11.052.
Dernière mise à jour: 2025-09-22 07:59