4: Bilan urodynamique pédiatrique
Ce chapitre prendra environ 22 minutes de lecture.
Introduction
L’évaluation urodynamique de la fonction des voies urinaires inférieures (LUT) comprend le recours à des méthodes d’évaluation appropriées pendant les phases de remplissage vésical et de miction. Une instrumentation adéquate des examens permet de comprendre la physiopathologie des entités urologiques susceptibles d’affecter les enfants et les adolescents, dans le but d’optimiser leur prise en charge thérapeutique.
L’urodynamique pédiatrique exige un personnel formé qui doit mettre en œuvre une méthodologie appropriée dans un cadre adapté à l’univers pédiatrique afin de gérer correctement les situations de stress et d’obtenir autant de données urologiques cliniques que possible.
L’étude urodynamique des VUB peut être réalisée de manière invasive ou non invasive. En général, la tendance actuelle consiste à prendre en charge les affections des VUB au moyen d’une évaluation urodynamique non invasive et à réserver les méthodes invasives aux cas de dysfonction neuro-urologique ou de malformations urologiques complexes.
Évaluation urodynamique non invasive
Les affections du bas appareil urinaire (LUT) chez l’enfant regroupent un ensemble d’entités aux symptômes urinaires qui se recoupent. Ces affections résultent de troubles de la phase de remplissage, de la phase mictionnelle, ou d’une combinaison des deux, avec des degrés d’atteinte variables. Des symptômes du bas appareil urinaire (LUT) peuvent être observés chez jusqu’à 20 % des enfants d’âge scolaire.1
L’évaluation appropriée est déterminée par le pédiatre, et d’autres spécialistes poursuivent cette évaluation. Cette démarche est initiée lorsque l’enfant a environ 4 ans, et elle sera d’autant plus complète si les données suivantes peuvent être obtenues :
- Journal mictionnel (2-3 jours).2
- Échelle de Bristol / critères de Rome IV / troubles fonctionnels gastro-intestinaux.3,4
- Questionnaires (facultatifs) : habitudes mictionnelles et d’évacuation intestinale, apport hydrique, qualité de vie.5
- Examen physique des organes génitaux, de la région lombo-sacrée, de la région fessière, du périnée, des membres inférieurs, des réflexes.
- Analyse d’urines / uroculture : protéinurie / glycosurie.
- Débitmétrie urinaire / mesure du résidu post-mictionnel (PVR).
- Électromyographie (EMG) du plancher pelvien avec électrodes de surface (patchs)
- Échographie des voies urinaires supérieures, caractéristiques vésicales, signes de constipation.
- Examens urodynamiques / vidéo-urodynamiques (non requis sauf si les patients sont réfractaires au traitement initial).
- Urétrocystographie mictionnelle (VCUG) pour détecter le reflux vésico-urétéral
Il existe une variété de questionnaires pour l’évaluation et la mesure des troubles vésico-intestinaux, de la qualité de vie et des comorbidités comportementales, comprenant les indications et les difficultés possibles. L’outil le plus utile sera choisi par le médecin en fonction de l’évaluation clinique, du temps disponible et de la population de patients étudiée.5
Les troubles fonctionnels gastro-intestinaux chez l’enfant se manifestent de différentes manières et peuvent être présents dès l’âge de 3 ou 4 ans et être ensuite associés à une dysfonction vésicale et à des infections urinaires.6,7
Débitmétrie urinaire
La débitmétrie mictionnelle (avec mesure du résidu post-mictionnel) peut être associée à une électromyographie (EMG) du plancher pelvien pour confirmer une miction dysfonctionnelle avec absence de coordination entre le détrusor et le sphincter urinaire. Les explorations urodynamiques sont réservées aux patients réfractaires au traitement initial.8,9
L’uroflowmétrie est une procédure non invasive utilisée pour mesurer le débit urinaire et elle est définie comme le volume d’urine qui passe à travers l’urètre par unité de temps, exprimé en mL/s. Les variables évaluées sont le débit maximal (Qmax), le débit moyen (Qavg), le volume uriné total et la durée totale de la miction. Cette méthode montre également la morphologie de la courbe obtenue pendant la miction. Un débit normal se présente sous la forme d’une courbe en cloche (Figure 1). Il s’agit de l’un des examens initiaux utilisés pour évaluer la vidange vésicale, puisqu’il fournit des informations sur la contractilité du détrusor et la sortie vésicale. Avec cette technique, il est possible d’éviter des examens invasifs et de surveiller les réponses thérapeutiques.
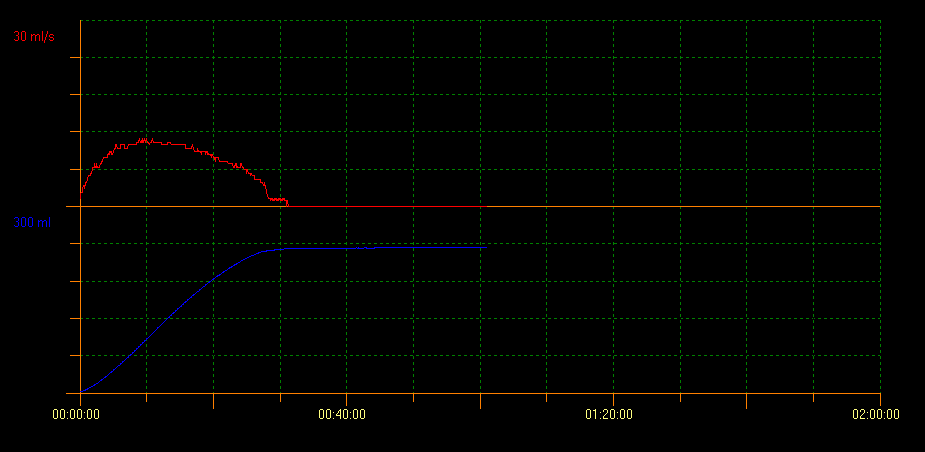
Figure 1 Débit normal montrant une courbe en cloche
L’uroflowmétrie avec mesure du RPM par échographie évalue la capacité de vidange vésicale. Avec cette méthode, plusieurs types de courbes indiquant différents troubles peuvent être identifiés. Un profil de courbe en tour est évocateur d’une vessie hyperactive; un profil en staccato montre une miction dysfonctionnelle, et un profil de flux interrompu peut évoquer une vessie hypoactive. Un profil de courbe en plateau est généralement observé chez les patients présentant une obstruction vésicale anatomique (Figure 2, Figure 3, et Figure 4).10
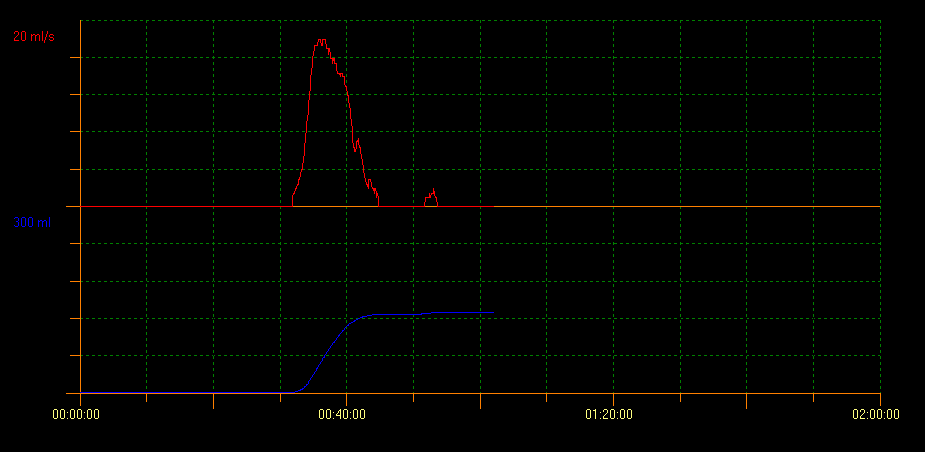
Figure 2 Courbe en tour
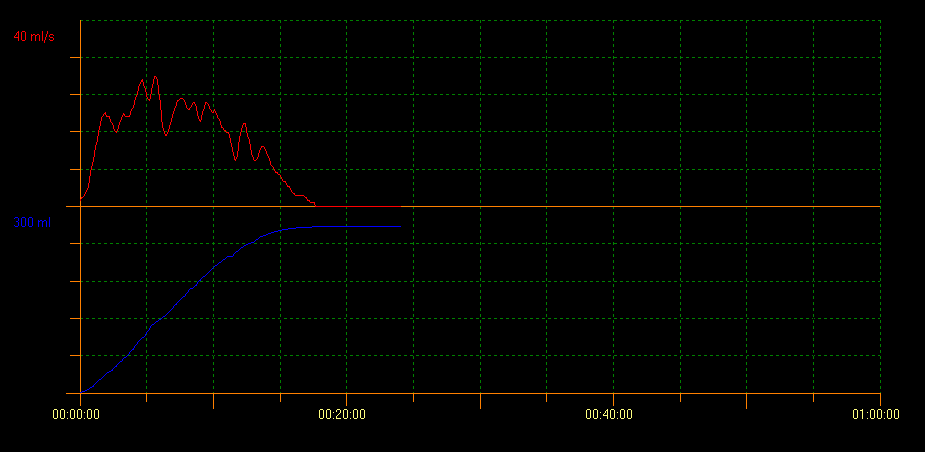
Figure 3 Profil de courbe staccato
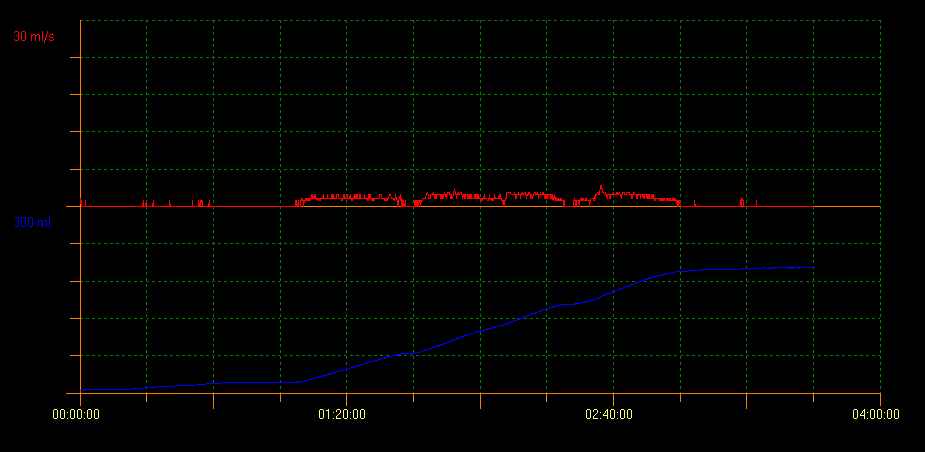
Figure 4 Tracé de courbe en plateau
Il existe une variété considérable de résultats interobservateurs, en particulier dans le cas de tests d’urofluxmétrie anormaux, et c’est l’une des principales limites de cet outil. Franco et al ont développé le concept d’indice de débit (FI). Le FI a été créé comme une mesure du débit réel par rapport au débit attendu : AQavg/EQavg ou AQmax/EQmax) afin d’obtenir une évaluation quantitative de l’évacuation vésicale. Ainsi, le FI peut aider à prédire de manière fiable le débit estimé pour un volume urinaire donné dans des paramètres raisonnables ; il aide à comparer les débits réels aux débits idéaux et apporte donc davantage d’objectivité à l’analyse des courbes.11 Un FI plus élevé est indicatif d’une miction efficace et d’une courbe en « tour », tandis qu’un FI plus faible traduit une miction dysfonctionnelle et une courbe en « plateau ».
Débitmétrie mictionnelle et EMG du plancher pelvien
Bien que l’uroflow « staccato » soit le schéma le plus fréquemment observé chez les enfants ayant un diagnostic de dysfonction mictionnelle, comme l’atteste une uroflowmétrie/EMG positive pendant la miction, près d’un tiers de la population pédiatrique présente, en cas de dysfonction mictionnelle, un profil d’uroflow interrompu ou mixte. Par conséquent, il est important d’intégrer des électrodes d’EMG de surface à l’étude d’uroflowmétrie, en particulier lorsqu’il existe une suspicion de dysfonction mictionnelle due à une dyssynergie détrusor-sphinctérienne.12 L’uroflowmétrie associée à une EMG du plancher pelvien n’est pas seulement utile pour diagnostiquer des affections spécifiques du bas appareil urinaire, mais aussi pour suivre de manière objective l’efficacité du traitement.13 Cela est illustré dans la Figure 5.
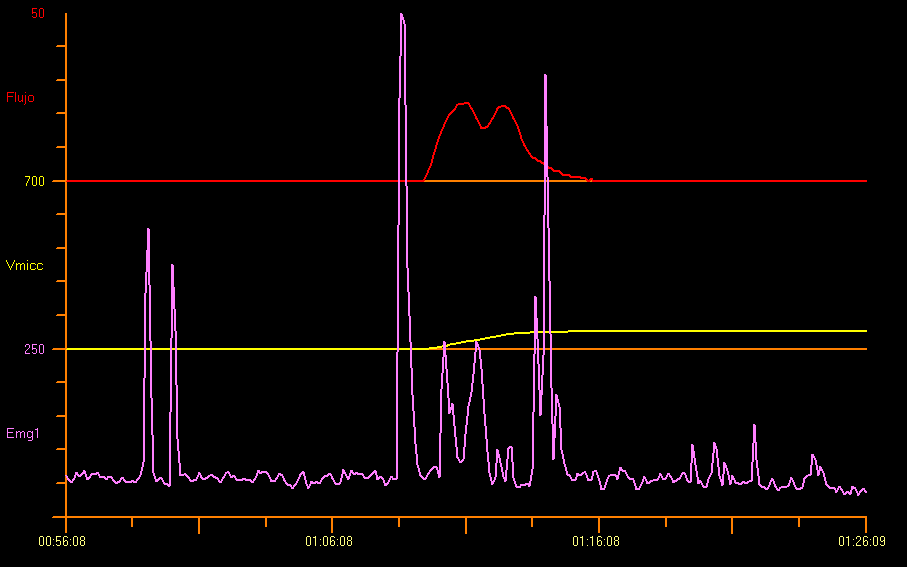
Figure 5 Uroflowmétrie et électromyographie périnéale (EMG)
Le temps de latence EMG du plancher pelvien est défini comme l’intervalle entre le début de la relaxation du plancher pelvien et le début de la courbe de débit urinaire. Cette mesure non invasive, exprimée en secondes, n’est pas utile pour le dépistage d’affections telles que la dysfonction primaire du col vésical, entre autres.13,14 Voir la Figure 6 pour une explication graphique du temps de latence.
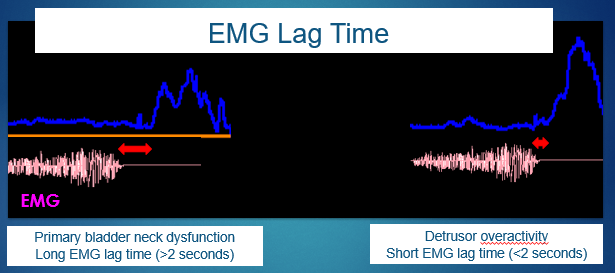
Figure 6 Temps de latence de l’électromyographie (EMG).
Néanmoins, même en tenant compte des limites de l’utilisation de l’EMG avec des électrodes de surface, il est possible de corréler le FI et le temps de latence de l’EMG pour définir le diagnostic spécifique des affections du LUT. Un temps de latence proche de 0 seconde est associé à un FI plus élevé, ce qui traduit une hyperactivité, couramment observée dans la courbe de débit en tour. Cependant, les enfants présentant un temps de latence supérieur à 6 secondes, ou même des valeurs de temps de latence négatives inférieures à 4 secondes, présentaient un FI plus faible, ce qui implique une miction hypo-efficace et une courbe de débit en plateau.15
Résidu post-mictionnel à l’échographie
Les mesures du résidu post-mictionnel chez les enfants neurologiquement intacts sont très variables. Chez les enfants de 4–6 ans, une PVR > 30 ml ou > 21% de la capacité vésicale (BC), où la BC est déterminée comme le volume mictionnel (VV) + PVR et exprimée en pourcentage de la capacité vésicale attendue (EBC = [âge (ans)+1] × 30 mL), il est recommandé d’effectuer une PVR répétée avec deux mesures, et une PVR répétée > 20 mL ou > 10% de BC est considérée comme significativement élevée. Chez les enfants de 7–12 ans, une PVR unique > 20 ml ou 15% de BC, ou une PVR répétée > 10 ml ou 6% de BC est considérée comme élevée. Des conditions standard doivent être appliquées pour la mesure de la PVR : la vessie ne doit pas être sous-distendue (< 50%) ni surdistendue (> 115%) par rapport à l’EBC, et la PVR doit être obtenue immédiatement après la miction (< 5 min).16
En cas d’affection du bas appareil urinaire, une échographie des voies urinaires supérieures est indiquée afin d’écarter d’autres anomalies, telles que l’hydronéphrose et les systèmes collecteurs duplex. Des altérations de la paroi vésicale, comme un épaississement, une trabéculation ou des diverticules, peuvent être des marqueurs d’un dysfonctionnement chronique du bas appareil urinaire.
Évaluation urodynamique invasive—Cystométrie
Les études urodynamiques ne sont généralement pas utilisées pour évaluer les symptômes du bas appareil urinaire chez les enfants neurologiquement intacts, et elles apportent rarement des informations supplémentaires pouvant en justifier l’utilisation. Ces études sont utilisées lorsqu’il existe des constatations pathologiques aux examens non invasifs, si les traitements ne sont pas efficaces et lorsque des symptômes tels que l’incontinence ou les infections urinaires s’aggravent.17
Néanmoins, les examens urodynamiques invasifs sont couramment utilisés lors de l’évaluation initiale, dans le suivi des enfants présentant une vessie neurologique secondaire à un spina bifida, lorsqu’il existe une suspicion de dysfonction détrusor-sphinctérienne d’origine neurologique (dysraphisme spinal occulte), d’obstruction (par valves urétrales postérieures), d’anomalies génito-urinaires (exstrophie, épispadias), de dysfonction vésicale non neurogène ou de résidu post-mictionnel significatif d’étiologie inconnue.9
Au cours de la cystométrie, la relation pression/volume intravésicale est mesurée afin de documenter la fonction de stockage et de vidange. Dans la première phase de l’étude, les données suivantes sont recueillies : stabilité du détrusor, pressions au point de fuite, sensations vésicales et capacité vésicale. Dans la phase mictionnelle, d’autres paramètres sont mesurés : pression mictionnelle ; pression d’ouverture du col vésical et du sphincter urinaire ; efficacité de la contraction détrusorienne et son maintien ; profil d’uroflux, et synergie électromyographique. Au moyen d’une sonde rectale à ballonnet, les variations de la pression abdominale et leur influence sur la pression vésicale sont évaluées.
La standardisation et la nomenclature définies par les recommandations de l’International Children’s Continence Society (ICCS) ont été utilisées.9 La pression intravésicale est mesurée à l’aide d’un cathéter à double lumière de 6 French placé par voie urétrale. La pression intra-abdominale a été mesurée à l’aide d’un cathéter de 8 French et d’un cathéter à ballonnet en vinyle placés dans le rectum. La vessie a été remplie avec une solution saline à 0,9 % à 37,5° Celsius à un débit de 5–10% de la capacité vésicale théorique ou attendue de l’enfant par minute, avec un débit maximal de 10 mL/min.
Les variables urodynamiques suivantes sont évaluées : capacité cystométrique maximale (MCC en mL) ; pression détrusorienne de fin de remplissage (Pdet en cm d’eau) et pression de fuite du détrusor (DLPP en cm d’eau). Nous avons calculé la capacité vésicale attendue (EBC) selon la formule : 30 × (âge en années + 1) mL. Une capacité vésicale réduite était définie comme < 65% de l’EBC.7 Nous définissons la capacité cystométrique maximale lorsque nous arrêtons le remplissage pour les raisons suivantes : contraction détrusorienne avec un volume important de fuites ; fuites qui dépassent le débit de remplissage (> 10 ml / sec) ; pressions à risque (> 40 cm d’eau) reflux vésico-urétéral de haut grade dans les études vidéo-urodynamiques, et dilatation des voies urinaires. L’hyperactivité détrusorienne était définie par la présence de deux contractions détrusoriennes supplémentaires supérieures à 15 cm d’eau.18 Une vidange vésicale inefficace est définie par une hypoactivité détrusorienne ou un détrusor neurogène acontractile.7
Phase préalable aux explorations urodynamiques
Il est important d’expliquer en détail les procédures aux parents et aux patients et de leur montrer l’unité d’urodynamique et le matériel à utiliser. L’établissement devrait être adapté aux patients pédiatriques et disposer d’un personnel formé capable de prendre en charge des enfants éveillés. Le cadre idéal comprendrait des distractions disponibles, telles que des jeux, des tablettes, une télévision et des jeux vidéo adaptés à l’âge. En outre, il convient de souligner l’importance d’obtenir un rectum vide, en particulier chez les enfants constipés.
Il est recommandé de débuter la procédure avec une culture d’urine négative, réalisée au plus tard 15 jours avant. Chez les enfants qui vont commencer le cathétérisme intermittent propre (CIP), la culture d’urine peut ne pas être requise, car en cas de bactériurie asymptomatique, celle-ci n’est pas considérée comme un facteur de risque supplémentaire et, en général, elle ne nécessite pas de prophylaxie antibiotique. L’incidence globale des infections urinaires (IU) survenant après les explorations urodynamiques est faible (0,7 %). Les patients sans culture d’urine préalable aux explorations urodynamiques ne présentent pas d’augmentation significative des IU.19
Si le patient contrôle ses sphincters, ne suit pas de programme de cathétérisme intermittent propre et a la vessie pleine, une débitmétrie mictionnelle libre est réalisée après instrumentation préalable. Ces données viendraient compléter le rapport final concernant ce patient.
La sédation par midazolam administrée par l’une des trois voies, orale, nasale ou rectale, est une méthode sûre et efficace et une option pratique pendant la cystométrie, en particulier chez les jeunes patients qui peuvent se sentir effrayés et stressés face à la procédure à réaliser. La plupart des patients sont satisfaits de la sédation, comme l’a rapporté Özmert. Dans ce rapport, le groupe bénéficiant d’une instauration plus rapide de la sédation et des doses les plus faibles administrées par voie nasale a présenté des résultats plus favorables, malgré des picotements nasaux, par rapport au groupe ayant reçu une sédation orale. Un autre avantage de la sédation était que la cystométrie était réalisée en un temps plus court chez les patients sous sédation par rapport au groupe témoin, et la cystométrie n’était pas altérée par le midazolam.20 L’hydrate de chloral, en tant que sédatif, est largement utilisé chez l’enfant lors de procédures diagnostiques ou thérapeutiques. La solution orale est une alternative efficace et appropriée pour la sédation chez l’enfant.21
Instrumentation urodynamique
De manière générale, un cathéter transurétral à double lumière de calibre 6 French est inséré après application de xylocaïne comme anesthésique. Dans certains cas, comme chez les enfants non coopérants, ceux présentant des difficultés de compréhension ou une sensibilité urétrale conservée, ou en cas de suspicion d’obstruction urétrale (valves urétrales postérieures), la mise en place d’un cathéter sus-pubien à double lumière 24 heures avant l’examen permet de mieux réaliser l’examen.22 Il est également possible de placer un cathéter à double lumière dans une vésicostomie ou une urétérostomie, puis de fermer la stomie à l’aide d’un cathéter à ballonnet de Foley en silicone.
Les cathéters transurétraux et rectaux doivent être fixés avec du ruban adhésif à l’orifice cutané et, au moyen de tubes de raccordement, reliés aux transducteurs de pression externes puis mis à niveau à la hauteur de la symphyse pubienne. Avant d’installer le patient en position assise et après nettoyage de la peau du périnée, deux électrodes EMG de surface sont connectées de façon symétrique, de part et d’autre de la région périanale, afin d’enregistrer l’activité des muscles du plancher pelvien. De plus, une troisième électrode de référence est placée sur une saillie osseuse. La cystométrie de remplissage est généralement réalisée en position assise ; toutefois, la position en décubitus dorsal ou le fait que l’enfant soit tenu dans les bras de sa mère sont également acceptables.23 Voir Figure 7 pour un exemple de position.
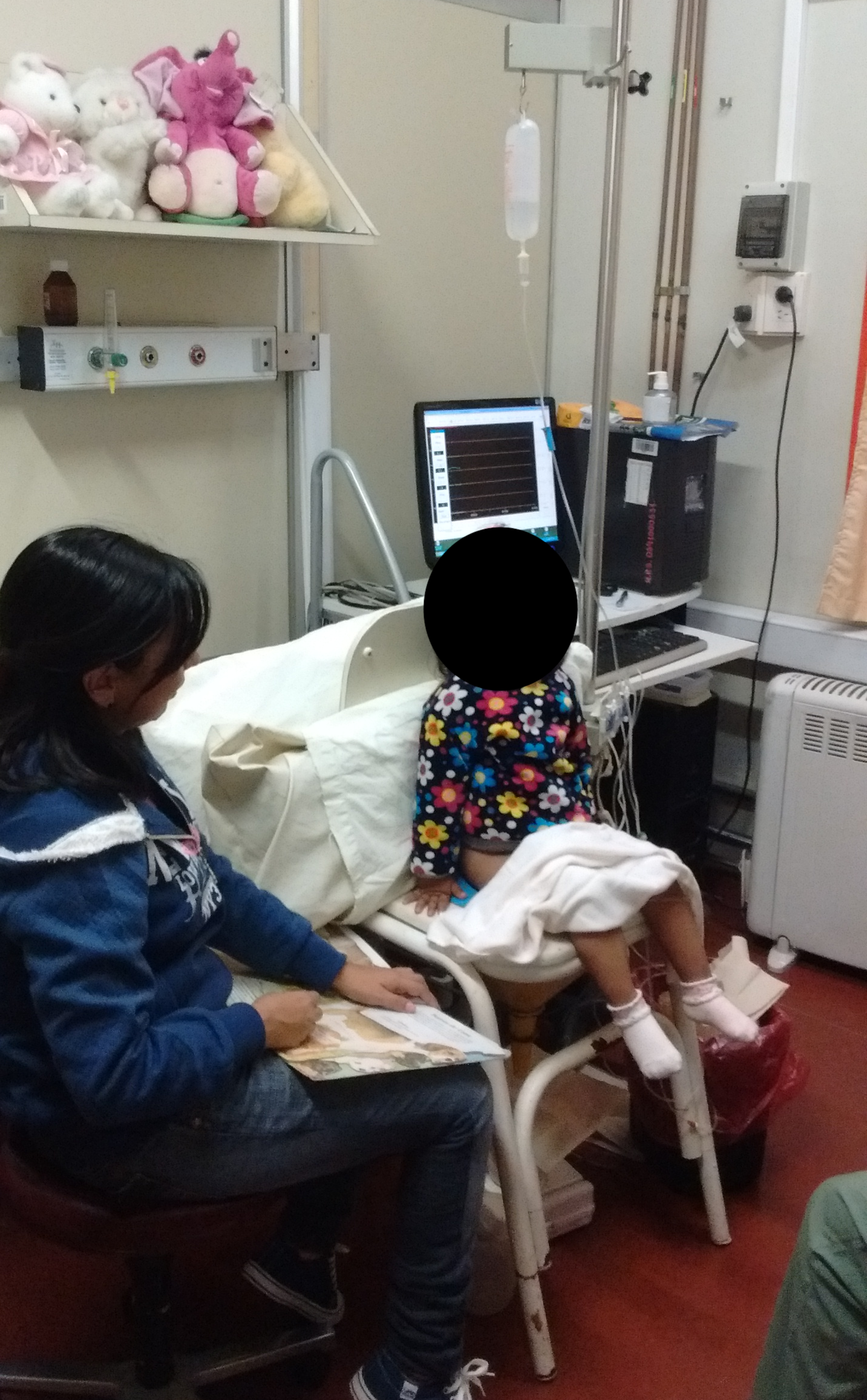
Figure 7 Position du patient
Chez les enfants neurologiquement indemnes et suffisamment âgés pour répondre, la sensation de remplissage doit être déterminée selon la séquence standard définie par l’ICS (Société internationale de la continence) : “première sensation de remplissage”, “premier désir de miction” et “désir de miction fort”. Après la fin du cycle mictionnel et en fonction de la qualité de la courbe, il convient de se demander s’il est nécessaire de répéter l’examen. Une fois les cathéters et les électrodes d’EMG retirés, les patients reçoivent pour consigne d’augmenter leur apport hydrique afin de diminuer le risque d’infection urinaire,23 et, en cas d’inconfort, de recourir à un traitement antalgique.
Interprétation des résultats urodynamiques
Il est essentiel de savoir qu’une grande partie du temps de l’étude est consacrée à la phase de remplissage et qu’une proportion plus faible du temps l’est à la phase de vidange. Cycle vésical dans la Figure 8.
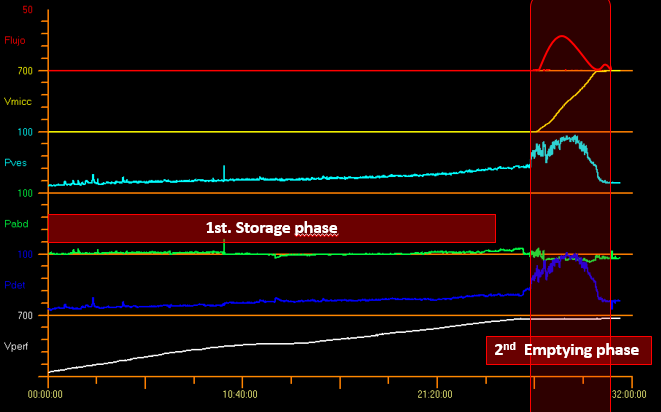
Figure 8 Cycle vésical.
Phase de remplissage
La sensation vésicale peut n’être un paramètre pertinent que chez les enfants capables de mictionner volontairement. À partir de l’âge de 4 ans, les données suivantes peuvent être consignées : “première envie d’uriner” et “forte envie d’uriner”. L’enfant exprime habituellement une envie normale d’uriner lorsqu’il/elle recroqueville les orteils. De plus, la sensation vésicale peut être classée comme normale, augmentée (hypersensible), diminuée (hyposensible) ou absente.
Les paramètres mesurés pendant la phase de remplissage comprennent : la pression intravésicale (Pves), la pression abdominale (Pabd) et la pression détrusorienne (Pdet) où Pdet = Pves - Pabd (Figure 8).
La pression détrusorienne de remplissage (Pdet fill) est la pression détrusorienne pendant la phase de remplissage, et la pression détrusorienne atteinte en fin de remplissage est appelée pression détrusorienne maximale (Pdet fill max). L’élasticité de la paroi vésicale, ou compliance pariétale, augmente normalement de façon progressive durant la phase de remplissage et peut être calculée à partir des points initial et final de la phase de remplissage (en tenant compte de la pression de repos en cas d’hyperactivité). Ainsi, la compliance vésicale est définie comme la relation entre la variation du volume vésical et la variation de la pression détrusorienne (C= ΔV/ΔP; valeur normale : > 10 mL/cm H2O).24 Le volume instillé ne tient pas compte de la quantité de diurèse réellement produite pendant l’examen. Pour intégrer ce volume, la capacité cystométrique maximale (MCC) est calculée avec le volume mictionnel et le volume résiduel post-mictionnel. La variabilité de la compliance dépend de plusieurs facteurs tels que : la section de la courbe utilisée pour le calcul ; la forme, l’épaisseur et les propriétés mécaniques/viscoélastiques de la paroi vésicale ; la capacité du détrusor à se relâcher, sa contractilité et le degré de résistance de la sortie vésicale.25
En outre, la forme de la courbe de remplissage doit être prise en compte car elle fournit des informations sur la laxité vésicale. Normalement, la pression détrusorienne reste relativement stable pendant le remplissage vésical, ce qui se traduit par une courbe linéaire. En conditions pathologiques, la courbe de remplissage est “non linéaire”, avec une augmentation de la pression détrusorienne, et ces changements doivent être documentés.7 En général, il y a peu ou pas de variation de pression pendant la phase de remplissage, lorsque la compliance est assurée, mais il n’existe pas de valeurs seuils pour définir une compliance pathologique. Chez les enfants sans lésion neuropathique, la compliance ne devrait pas dépasser d’une valeur de 0,05 Y mL/cm H2O la pression vésicale de base (Y= capacité cystométrique [mL] selon l’âge). Il n’existe aucun rapport dans la littérature sur la relation entre la capacité vésicale attendue (EBC) et la capacité vésicale cystométrique. Néanmoins, certains auteurs suggèrent que Pdet ne devrait pas dépasser 30 cm H2O à l’EBC.26 Dans notre centre, nous considérons pathologiques les pressions à partir de 20 cm d’eau à la capacité vésicale attendue (Figure 9).
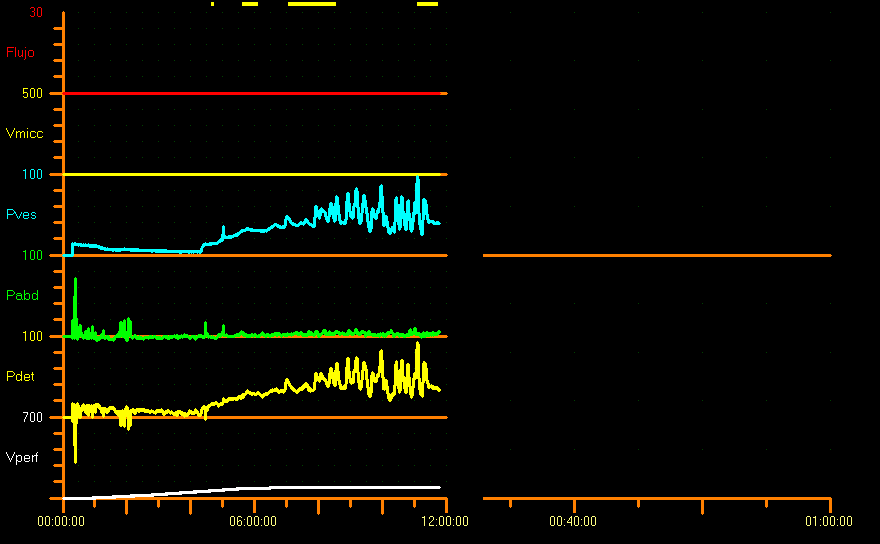
Figure 9 Profil de compliance réduite
En raison de cette limitation, nous pouvons extrapoler et utiliser la pression détrusorienne atteinte à la capacité vésicale attendue et la Pdet fill max. Tarcan et al ont étudié les pressions vésicales chez des enfants atteints de myéloméningocèle à l’âge de 3 ans et ont conclu qu’une valeur seuil de DLPP de 20 cm H2O présentait une sensibilité plus élevée pour la prédiction des lésions des voies urinaires supérieures, alors qu’une DLPP entre 20 et 40 cm H2O n’était pas fiable pour prédire les lésions. Ainsi, dans l’étude de Tarcan, 57.1% des enfants avec une DLPP entre 20 et 40 cm H2O, et 62.2% des enfants avec une DLPP supérieure à 40 cm H2O avaient des voies urinaires supérieures normales. Par conséquent, l’utilisation de la valeur seuil de DLPP comme paramètre unique pour prédire les lésions des voies urinaires chez les enfants atteints de myéloméningocèle n’est ni fiable ni précise. D’autres facteurs de risque sont susceptibles de coexister, tels qu’une faible capacité vésicale, une faible compliance de la paroi vésicale, une pression de remplissage élevée, une dyssynergie détrusor-sphinctérienne et l’observance du cathétérisme vésical, entre autres.27
Toute augmentation phasique de la pression détrusorienne au cours de la cystométrie de remplissage est définie comme une hyperactivité détrusorienne. Cette hyperactivité implique la présence d’au moins deux contractions détrusoriennes supérieures à 15 cm H2O18 et peut survenir spontanément ou être provoquée par la toux ou la manœuvre de Credé. Cet accroissement ou cette hyperactivité détrusorienne peut être neurogène ou idiopathique comme dans la Figure 10.28,29
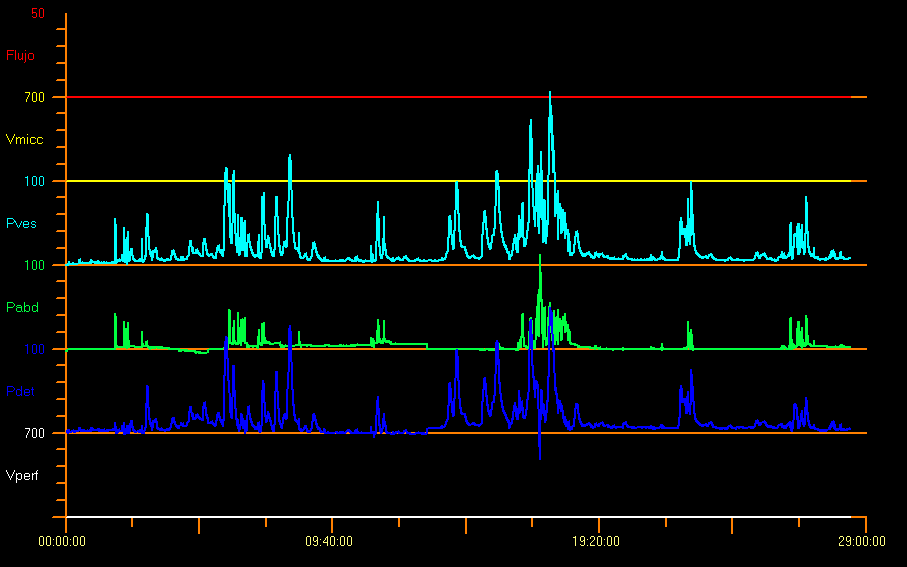
Figure 10 Profil hyperactif
Il est également probable que l’enfant ne parvienne pas à supprimer complètement ces contractions et qu’une augmentation de l’activité EMG du plancher pelvien puisse être observée, comme réflexe protecteur. Certains facteurs déclenchants, tels que la toux, le rire, la marche ou le saut, peuvent provoquer une suractivité du détrusor. Cependant, la présence de ces contractions n’implique pas nécessairement un trouble neurologique. Chez les nourrissons indemnes de toute maladie, 10 % présentent des contractions détrusoriennes. Lorsqu’il existe une contraction détrusorienne avec peu d’effort ou sans fin de remplissage (lorsque le remplissage atteint 150 % de l’EBC), le muscle détrusor devient hypoactif.9
La pression de fuite du détrusor (DLPP) correspond à la plus basse pression détrusorienne à laquelle une fuite d’urine survient en l’absence d’une augmentation de la pression abdominale ou d’une contraction détrusorienne. La pression de fuite abdominale (ALPP) correspond à la plus faible valeur de pression intravésicale augmentée intentionnellement (par exemple, lors de la toux) qui provoque une fuite urinaire en l’absence de contraction détrusorienne. Une DLPP élevée (> 40 cm H2O) est souvent due à la diminution de la laxité de la paroi vésicale. Une DLPP basse traduit une incompétence sphinctérienne.7 L’incontinence d’effort est présente chez les adolescents physiquement actifs, lorsque l’ALPP est supérieure à la pression urétrale.30
Malgré les stimulations, il est probablement nécessaire de retirer la sonde pour que l’enfant puisse uriner. Si le volume mictionnel est faible, nous sommes confrontés à une hypoactivité détrusorienne due à une obstruction chronique de la voie d’évacuation vésicale ou à une lésion neuropathique évoluant vers une détérioration de la miction.7
Phase mictionnelle
La miction normale est effectuée par le déclenchement volontaire d’une contraction du détrusor; elle est soutenue et ne peut pas être facilement inhibée une fois qu’elle a commencé. Pendant la miction, le détrusor peut être classé comme normal, hypoactif ou acontractile, c.-à-d. qu’il ne montre aucune activité pendant la miction. Si l’absence de contractilité a une cause neurologique, on parle d’aréflexie détrusorienne. Cela se caractérise par l’absence complète d’une contraction coordonnée par des mécanismes de contrôle nerveux. Lorsque la contraction détrusorienne est insuffisante en amplitude et en durée pour vider efficacement la vessie, on est en présence d’une hypoactivité détrusorienne pendant la miction.9
Certains auteurs ont rapporté des pressions bien supérieures à la normale chez des enfants neurologiquement sains âgés d’un mois, avec une pression détrusorienne pendant la miction de 127 cm H2O chez les garçons et de 72 cm H2O chez les filles.31 Figure 11 montre un exemple d’étude avec obstruction de la voie d’évacuation vésicale. Ceci est probablement dû à une activité sphinctérienne importante et à un effet lié au cathéter. Chez les enfants ayant peur d’uriner, il peut y avoir des pressions mictionnelles élevées, un débit urinaire interrompu ou un PVR important.9
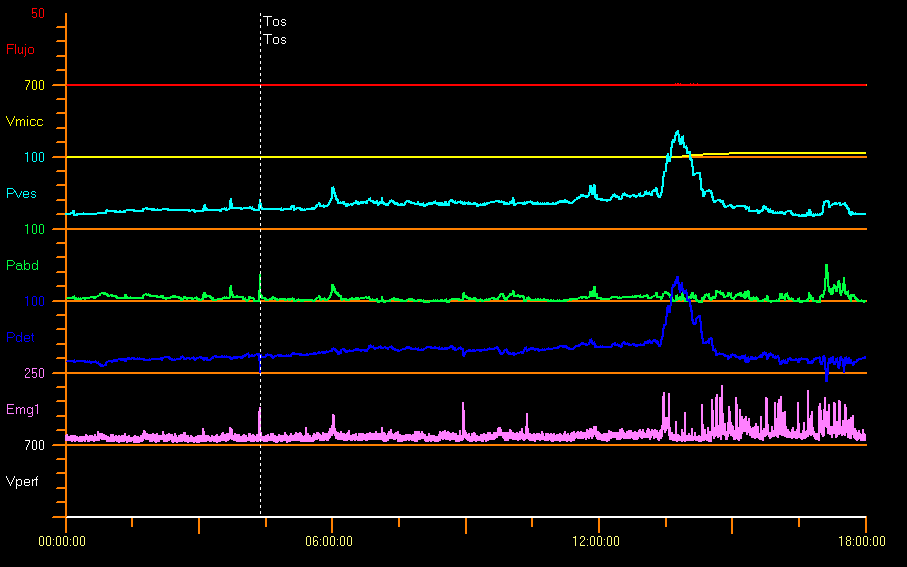
Figure 11 Obstruction infravésicale
Lorsqu’il existe une obstruction urétrale anatomique (valves urétrales postérieures, sténose urétrale, urétérocèle ectopique), on observe une courbe d’urofluxmétrie en plateau, avec un Qmax faible et constant, malgré une pression détrusorienne élevée et une relaxation complète du sphincter urétral externe. Voir la section Urofluxmétrie.
L’obstruction fonctionnelle est due à la contraction du sphincter urétral externe (constante ou intermittente) pendant la miction, qui crée un segment urétral étroit. Il est possible de documenter l’activité du plancher pelvien au moyen d’enregistrements pression/débit simultanés et d’un EMG du plancher pelvien, en utilisant des électrodes de surface.12,15
Urodynamique vidéo
Les études vidéo-urodynamiques combinent les avantages de la cystouréthrographie fluoroscopique et de l’urodynamique conventionnelle au moyen d’un dispositif unique, ce qui permet de réaliser simultanément l’évaluation anatomique et fonctionnelle des voies urinaires. Figure 12 illustre la vidéo-urodynamique.
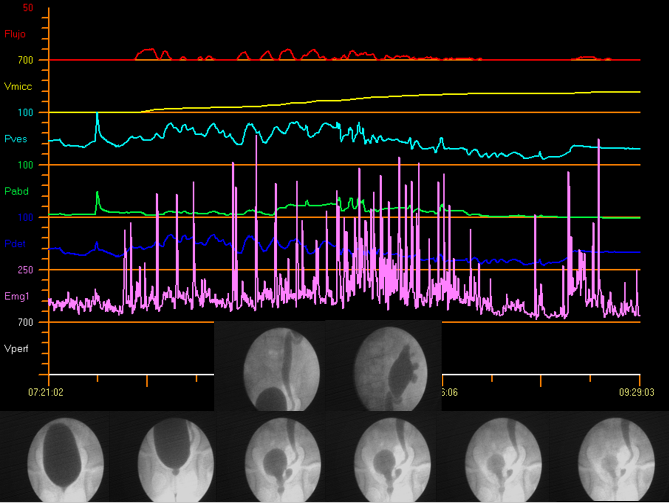
Figure 12 Vidéo-urodynamique
La radiologie adjuvante est devenue un outil utile dans le diagnostic différentiel. En outre, elle facilite l’analyse des images grâce à la technologie numérique.32
Indications de réalisation des examens vidéo-urodynamiques
Les explorations urodynamiques vidéo sont indiquées lorsque le diagnostic reste incertain après des examens plus simples, ou chez des patients présentant des situations cliniques complexes telles que :
- Infections urinaires récidivantes : suspicion de reflux vésico-urétéral, et symptômes urinaires tels que l’incontinence urinaire.
- Malformations congénitales de l’appareil urinaire : valve urétrale postérieure; syndrome de prune-belly.
- Diverticules vésicaux multiples; interventions chirurgicales antérieures des voies urinaires.
- Antécédents de traitement dans la région pelvienne : résection de tumeurs, chimiothérapie ou radiothérapie.
- Suspicion ou antécédents d’obstruction vésicale.
- Suspicion de dyssynergie détrusor-sphinctérienne (comme à l’EMG).32
- Spina bifida; dysraphisme spinal occulte.
- Paralysie cérébrale; malformation anorectale et myélopathies.
- Malformations rachidiennes; scoliose sévère; agénésie sacrée.
- Autres entités immunologiques et neurologiques.
- Évaluation rénale pré-transplantation et suivi des anomalies congénitales du rein et des voies urinaires (CAKUT).
Lors de notre évaluation initiale des patients atteints de myéloméningocèle (n:60), nous avons pu réaliser des examens urodynamiques vidéo chez tous les patients, en moyenne dans les 8 premiers mois de vie, et nous avons constaté que 20% des enfants avaient un reflux vésico-urétéral, 55% une hyperactivité détrusorienne, 13% une hypertonie de la paroi vésicale et 98% un PVR élevé.33
Les informations supplémentaires fournies par la vidéourodynamique ont un coût : les enfants sont exposés aux rayonnements ionisants. Le poids du patient et la capacité vésicale sont des prédicteurs indépendants de l’exposition totale aux rayonnements ionisants. La prise de conscience de cette exposition peut aider le médecin à utiliser la fluoroscopie avec prudence et à mieux conseiller les parents au sujet de l’exposition aux rayonnements ionisants.34
Urodynamique non conventionnelle
En 1996, De Gennaro a montré qu’il est possible de réaliser une surveillance urodynamique continue chez les enfants et qu’elle présente des avantages par rapport à la cystométrie standard dans l’exploration des enfants atteints de vessie neurogène, même si elle n’est réalisée que sur une courte durée (6 heures).35
Lorsqu’il n’y a pas de corrélation entre les volumes du journal mictionnel (dans les troubles du bas appareil urinaire) ou du journal des sondages vésicaux (en cas de vessie neurologique) et les résultats urodynamiques conventionnels, il existe une méthode optionnelle : l’urodynamique à remplissage spontané. Avec cette modalité, il n’est pas nécessaire de procéder à un remplissage vésical par liquide, mais le patient doit rester plus longtemps à l’hôpital, relié au matériel urodynamique pour être surveillé. Même si, une fois hospitalisé, le patient doit commencer l’hydratation, la durée de l’examen est variable et, en général, il se termine lorsqu’une fuite urinaire survient. Pendant la miction, les pressions continuent d’être mesurées de façon alternée (mesure de pression et vidange), puis elles sont corrélées aux volumes à l’inverse de l’urodynamique standard, jusqu’à la fin de la miction.
Urodynamique ambulatoire versus urodynamique conventionnelle
L’urodynamique conventionnelle consiste en une évaluation hautement standardisée. Cependant, lors de l’évaluation des enfants, la fiabilité des mesures peut être influencée par les effets du développement et la variabilité des données, ainsi que par un environnement clinique peu familier. L’urodynamique ambulatoire offre une alternative à ces limites : elle nécessite un remplissage physiologique, elle est mesurée sur une période prolongée et elle est réalisée dans un environnement adapté aux enfants.
Lu et al ont identifié différents schémas mictionnels lors d’examens urodynamiques ambulatoires, en comparaison avec des examens urodynamiques standard, avec un manque de constance du schéma mictionnel identifié par chaque méthode.36 Le fait de prendre également en compte la dernière selle, la quantité de liquide ingérée auparavant et l’heure de la journée à laquelle l’examen est réalisé pourrait expliquer pourquoi des schémas mictionnels moins constants ont été observés lors des études urodynamiques ambulatoires.
Considérations finales
La plupart des affections du bas appareil urinaire peuvent être évaluées à l’aide d’outils urodynamiques non invasifs et prises en charge par un traitement adapté et un suivi approprié.
Pour certains enfants, les explorations urodynamiques invasives sont vécues comme une situation stressante dans un environnement peu accueillant. Pour contrecarrer ce scénario et tirer parti de tous les bénéfices d’une pratique invasive, il est essentiel de pouvoir compter sur un personnel professionnel formé, doté d’une patience suffisante pour accompagner les enfants et leurs familles.
Il est fondamental que l’équipe d’urodynamique et tous les autres professionnels impliqués soient au fait des standardisations et des nomenclatures actualisées des entités ainsi que des bonnes pratiques urodynamiques, afin de communiquer et de rapporter les résultats dans un langage commun. De cette manière, la recherche fournira des résultats plus robustes.
Références
- Linde JM, Nijman RJM, Trzpis M, Broens PMA. Prevalence of urinary incontinence and other lower urinary tract symptoms in children in the Netherlands. J Pediatr Urol 2019; 15 (2): 164.e1–164.e7. DOI: 10.1016/j.jpurol.2018.10.027.
- Lopes I, Veiga ML, Braga AANM, Brasil CA, Hoffmann A, Barroso U. A two-day bladder diary for children: Is it enough? J Pediatr Urol 2015; 11 (6): 348.e1–348.e4. DOI: 10.1016/j.jpurol.2015.04.032.
- Burgers RE, Mugie SM, Chase J, Cooper CS, Gontard A von, Rittig CS, et al.. Management of Functional Constipation in Children with Lower Urinary Tract Symptoms: Report from the Standardization Committee of the International Children’s Continence Society. J Urol 2013; 190 (1): 29–36. DOI: 10.1016/j.juro.2013.01.001.
- Robin SG, Keller C, Zwiener R, Hyman PE, Nurko S, Saps M, et al.. Prevalence of Pediatric Functional Gastrointestinal Disorders Utilizing the Rome IV Criteria. J Pediatr 2018; 195: 134–139. DOI: 10.1016/j.jpeds.2017.12.012.
- Chase J, Bower W, Gibb S, Schaeffer A, Gontard A von. Diagnostic scores, questionnaires, quality of life, and outcome measures in pediatric continence: A review of available tools from the International Children’s Continence Society. J Pediatr Urol 2018; 14 (2): 98–107. DOI: 10.1016/j.jpurol.2017.12.003.
- Lee LC, Koyle MA. The Role of Bladder and Bowel Dysfunction (BBD) in Pediatric Urinary Tract Infections. Curr Bladder Dysfunct Rep 2014; 9 (3): 188–196. DOI: 10.1007/s11884-014-0240-0.
- Austin PF, Bauer SB, Bower W, Chase J, Franco I, Hoebeke P, et al.. Faculty Opinions recommendation of The standardization of terminology of lower urinary tract function in children and adolescents: update report from the Standardization Committee of the International Children’s Continence Society. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2016; 35: 471–481. DOI: 10.3410/f.718270635.793500042.
- Schewe J, Brands FH, Pannek J. Voiding Dysfunction in Children: Role of Urodynamic Studies. Urol Int 2002; 69 (4): 297–301. DOI: 10.1159/000066129.
- Bauer SB, Nijman RJ, Drzewiecki BA, Sillen U. Faculty Opinions recommendation of International Children’s Continence Society standardization report on urodynamic studies of the lower urinary tract in children. Neurourol Urodyn 2015; 34 (7): 640–647. DOI: 10.3410/f.725510393.793507237.
- Tekgul S, Stein R, Bogaert G, Undre S, Nijman RJM, Quaedackers J, et al.. EAU-ESPU guidelines recommendations for daytime lower urinary tract conditions in children. Eur J Pediatr 2020; 179 (7): 1069–1077. DOI: 10.1007/s00431-020-03681-w.
- Franco I, Shei-Dei Yang S, Chang S-J, Nussenblatt B, Franco JA. A quantitative approach to the interpretation of uroflowmetry in children. Neurourol Urodyn 2016; 35 (7): 836–846. DOI: 10.1002/nau.22813.
- Wenske S, Van Batavia JP, Combs AJ, Glassberg KI. Analysis of uroflow patterns in children with dysfunctional voiding. J Pediatr Urol 2014; 10 (2): 250–254. DOI: 10.1016/j.jpurol.2013.10.010.
- Van Batavia JP, Combs AJ, Fast AM, Glassberg KI. Use of non-invasive uroflowmetry with simultaneous electromyography to monitor patient response to treatment for lower urinary tract conditions. J Pediatr Urol 2014; 10 (3): 532–537. DOI: 10.1016/j.jpurol.2013.11.015.
- Combs AJ, Grafstein N, Horowitz M, Glassberg KI. Primary Bladder Neck Dysfunction In Children And Adolescents I: Pelvic Floor Electromyography Lag Time–a New Noninvasive Method To Screen For And Monitor Therapeutic Response. J Urol 2005; 173 (1): 207–211. DOI: 10.1097/01.ju.0000147269.93699.5a.
- Ha JS, Lee YS, Han SW, Kim SW. The relationship among flow index, uroflowmetry curve shape, and EMG lag time in children. Neurourol Urodyn 2020; 39 (5): 1387–1393. DOI: 10.1002/nau.24349.
- Chang S-J, Chiang I-N, Hsieh C-H, Lin C-D, Yang SS-D. Age- and gender-specific nomograms for single and dual post-void residual urine in healthy children. Neurourol Urodyn 2013; 32 (7): 1014–1018. DOI: 10.1002/nau.22342.
- Bauer SB, Austin PF, Rawashdeh YF, Jong TP de, Franco I, Siggard C, et al.. International children’s continence society’s recommendations for initial diagnostic evaluation and follow-up in congenital neuropathic bladder and bowel dysfunction in children. Neurourol Urodyn 2012; 31 (5): 610–614. DOI: 10.1002/nau.22247.
- Tanaka ST, Yerkes EB, Routh JC, Tu DD, Austin JC, Wiener JS, et al.. Urodynamic characteristics of neurogenic bladder in newborns with myelomeningocele and refinement of the definition of bladder hostility: Findings from the UMPIRE multi-center study. J Pediatr Urol 2021; 17 (5): 726–732. DOI: 10.1016/j.jpurol.2021.04.019.
- Lopez Imizcoz F, Burek CM, Sager C, Vasquez Patiño M, Gomez YR, Szklarz MT, et al.. Pediatric Urodynamic Study Without a Preprocedural Urine Culture, Is It Safe in Clinical Practice? Urology 2020; 145: 224–228. DOI: 10.1016/j.urology.2020.07.054.
- Özmert S, Sever F, Tiryaki HT. Evaluation of the effects of sedation administered via three different routes on the procedure, child and parent satisfaction during cystometry. Springerplus 2016; 5 (1): 10 1186 40064–40016–3164–3167. DOI: 10.1186/s40064-016-3164-7.
- Chen Z, Lin M, Huang Z, Zeng L, Huang L, Yu D, et al.. Efficacy of Chloral Hydrate Oral Solution for Sedation in Pediatrics: a Systematic Review and Meta-Analysis [Corrigendum]. Drug Des Devel Ther 2022; Volume 16 (13): 3491–3492. DOI: 10.2147/dddt.s392339.
- Wagner AA, Godley ML, Duffy PG, Ransley PG. A Novel, Inexpensive, Double Lumen Suprapubic Catheter for Urodynamics. J Urol 2004; 171 (3): 1277–1279. DOI: 10.1097/01.ju.0000110761.60356.44.
- Wen JG, Djurhuus JC, Rosier PFWM, Bauer SB. ICS educational module: Cystometry in children. Neurourol Urodyn 2018; 37 (8): 2306–2310. DOI: 10.1002/nau.23729.
- Gilmour RF, Churchill BM, Steckler RE, Houle A-M, Khoury AE, McLorie GA. A New Technique for Dynamic Analysis of Bladder Compliance. J Urol 1993; 150 (4): 1200–1203. DOI: 10.1016/s0022-5347(17)35727-0.
- Chin-Peuckert L, Komlos M, Rennick JE, Jednak R, Capolicchio J-P, Salle JLP. What is the Variability Between 2 Consecutive Cystometries in the Same Child? J Urol 2003; 170 (4 Part 2): 1614–1617. DOI: 10.1097/01.ju.0000084298.49645.27.
- Landau EH, Churchill BM, Jayanthi VR. The sensitivity of pressure specific bladder volume versus total bladder capacity as a measure of bladder storage dysfunction. J Pediatr Surg 1994; 30 (5): 761. DOI: 10.1016/0022-3468(95)90736-x.
- Tarcan T, Sekerci CA, Akbal C, Tinay I, Tanidir Y, Sahan A, et al.. Is 40 cm H2O detrusor leak point pressure cut-off reliable for upper urinary tract protection in children with myelodysplasia? Neurourol Urodyn 2017; 36 (3): 759–763. DOI: 10.1002/nau.23017.
- Rosier PFWM, Schaefer W, Lose G, Goldman HB, Guralnick M, Eustice S, et al.. International Continence Society Good Urodynamic Practices and Terms 2016: Urodynamics, uroflowmetry, cystometry, and pressure-flow study. Neurourol Urodyn 2017; 36 (5): 1243–1260. DOI: 10.1002/nau.23124.
- Abrams P. Describing bladder storage function: overactive bladder syndrome and detrusor overactivity. Urology 2003; 62 (5): 28–37. DOI: 10.1016/j.urology.2003.09.050.
- Bauer SB, Vasquez E, Cendron M, Wakamatsu MM, Chow JS. Pelvic floor laxity: A not so rare but unrecognized form of daytime urinary incontinence in peripubertal and adolescent girls. J Pediatr Urol 2018; 14 (6): 544.e1–544.e7. DOI: 10.1016/j.jpurol.2018.04.030.
- Bachelard M, Sillén U, Hansson S, Hermansson G, Jodal U, Jacobsson B. Urodynamic Pattern In Asymptomatic Infants: Siblings Of Children With Vesicoureteral Reflux. J Urol 1999; 162 (5): 1733–1738. DOI: 10.1016/s0022-5347(05)68226-2.
- Marks BK, Goldman HB. Videourodynamics. Urol Clin North Am 2014; 41 (3): 383–391. DOI: 10.1016/j.ucl.2014.04.008.
- Sager C, Burek C, Corbetta JP, Weller S, Ruiz J, Perea R, et al.. Initial urological evaluation and management of children with neurogenic bladder due to myelomeningocele. J Pediatr Urol 2017; 13 (3): 271.e1–271.e5. DOI: 10.1016/j.jpurol.2016.12.024.
- Ngo TC, Clark CJ, Wynne C, Kennedy WA. Radiation Exposure During Pediatric Videourodynamics. J Urol 2011; 186 (4s): 1672–1677. DOI: 10.1016/j.juro.2011.04.014.
- De Gennaro M, Capitanucci M, Silveri M, Mosiello G, Broggi M, Pesce F. Continuous (6 Hour) Urodynamic Monitoring in Children with Neuropathic Bladder. Eur J Pediatr Surg 1996; 6 (S 1): 21–24. DOI: 10.1055/s-2008-1071032.
- Lu YT, Jakobsen LK, Djurhuus JC, Bjerrum SN, Wen JG, Olsen LH. What is a representative voiding pattern in children with lower urinary tract symptoms? Lack of consistent findings in ambulatory and conventional urodynamic tests. J Pediatr Urol 2016; 12 (3): 154.e1–154.e7. DOI: 10.1016/j.jpurol.2016.02.006.
Dernière mise à jour: 2025-09-22 07:59