2: Imagerie des voies urinaires
Ce chapitre prendra environ 24 minutes de lecture.
Introduction
L’imagerie diagnostique est un outil puissant pour comprendre l’histoire naturelle de nombreuses affections touchant l’appareil génito-urinaire (GU), tant sur le plan anatomique que fonctionnel. Lorsqu’elle est utilisée de manière optimale, l’imagerie diagnostique améliore les résultats cliniques tout en minimisant le risque pour le patient. De multiples modalités permettent d’imager le corps humain en détail, notamment l’échographie (US), l’imagerie par résonance magnétique (MRI), la tomodensitométrie (CT), la scintigraphie nucléaire et la fluoroscopie/ radiographie. Les avancées technologiques dans ces modalités se poursuivent.
Dans le contexte pédiatrique, les indications de l’imagerie diagnostique dépendent non seulement de la présentation clinique, mais aussi de l’âge (ou du niveau de développement) du patient. Plus d’une technique d’imagerie peut être nécessaire pour évaluer pleinement l’anatomie et la physiologie de l’appareil génito-urinaire. Bien que la présentation clinique soit primordiale et permette souvent une approche algorithmique de l’imagerie, la meilleure approche chez un adolescent peut différer de celle chez un nourrisson ou un tout-petit.
Considérations relatives aux rayonnements
Au cours des vingt à trente dernières années, les cliniciens comme les profanes se sont montrés plus préoccupés par l’exposition aux rayonnements liée à l’imagerie médicale et ses dangers potentiels, en particulier chez les patients pédiatriques. Le risque de cancers ultérieurs peut être plus élevé chez les enfants en raison de plusieurs facteurs. Tout d’abord, les jeunes enfants sont plus petits que les adultes, ce qui se traduit, pour une même exposition, par une énergie cinétique par unité de masse plus élevée. Les enfants présentent également des taux de prolifération cellulaire plus élevés, augmentant la radiosensibilité. Enfin, les enfants ont une espérance de vie plus longue à compter du moment de l’exposition aux rayonnements, ce qui laisse le temps aux mutations chromosomiques induites par les rayonnements de devenir cliniquement pertinentes.1
Dans de nombreux cas, la question clinique peut trouver une réponse sans recourir aux rayonnements ionisants. Il convient toutefois de peser les risques et les bénéfices d’une procédure. En cas de traumatisme, le standard de référence reste une TDM de l’abdomen et du pelvis avec injection de produit de contraste.2 Il devrait rassurer le clinicien prescripteur de savoir que vingt années d’améliorations de la technologie de TDM ont permis des doses de dix à cent (ou davantage) fois inférieures à celles du tournant du millénaire.3 À l’inverse, nombreux sont les cliniciens qui ignorent qu’une simple radiographie abdominale (KUB) n’épargne pas beaucoup d’irradiation par rapport à une TDM moderne de l’abdomen.4
Bien que l’IRM puisse sembler préférable à la TDM du point de vue de l’exposition aux rayonnements, la sédation pour l’IRM demeure nécessaire chez la plupart des enfants âgés de moins d’environ 8 ans. Les risques de la sédation (en particulier des sédations répétées) chez les enfants ne sont pas encore clairement établis. Des temps d’acquisition plus rapides, des interfaces de réalité virtuelle et des programmes d’accompagnement pédiatrique sont prometteurs pour minimiser les besoins en sédation.5
Les questions à se poser lors du choix d’une exploration sont :
- Cet examen permettra-t-il de répondre à la question clinique?
- Existe-t-il un examen antérieur qui permettrait de répondre à la question clinique actuelle?
- Existe-t-il une alternative plus sûre (en tenant compte de l’irradiation ou de la nécessité d’une sédation)?
- Quel est le niveau de développement de mon patient?
S’il y a le moindre doute, il est conseillé d’en discuter avec votre radiologue.
Produits de contraste en imagerie des voies urinaires
Produits de contraste iodés
Le produit de contraste iodé est utilisé pour le scanner (CT) et la cysto-urétrographie mictionnelle (VCUG). Lorsqu’il prescrit un examen impliquant l’injection de produit de contraste, le clinicien doit être conscient des risques potentiels. Le premier est le risque de réaction allergique ou pseudo-allergique sévère. Ces événements indésirables sont hautement improbables avec les agents de contraste modernes. On estime le taux de réactions de type allergique à 0,6 %, dont la plupart sont bénignes et spontanément résolutives. Pour les réactions sévères, l’estimation est de 0,04 %. Des antécédents de réaction de type allergique à un produit de contraste iodé constituent le facteur de risque le plus clair et le plus important d’une réaction ultérieure. Chez les patients présentant de tels antécédents, le risque doit être soigneusement mis en balance avec le bénéfice d’un scanner (CT) ultérieur. Les données disponibles restent non concluantes quant au bénéfice de la prémédication.6
Le deuxième risque que le médecin prescripteur doit prendre en compte est le risque d’insuffisance rénale aiguë induite par le produit de contraste (CI-AKI), définie comme une détérioration soudaine de la fonction rénale due à l’administration intravasculaire de produit de contraste iodé. Malheureusement, le risque réel de cette entité est inconnu, même chez l’adulte. Comme pour les réactions de type allergique, un facteur de risque est généralement admis, selon les bonnes pratiques, comme prédisposant un patient à la CI-AKI ; ce facteur de risque est une insuffisance rénale préexistante. Aucun seuil clair d’eGFR n’a été établi (au-dessus duquel le risque peut être ignoré). Cependant, l’American College of Radiology (ACR) recommande un seuil d’eGFR de 30 mL/min/1.73 m.26
Le calcul du DFGe chez l’enfant nécessite de connaître la taille du patient et la créatininémie. Le DFGe approximatif est alors donné par l’équation de Schwartz au lit du malade:6
DFG (mL/min/1,73 m2) = 0,41 × taille / créatinine sérique
Il existe des formules plus récentes qui fournissent des estimations plus précises de la fonction rénale à partir de la créatinine sérique ou de la cystatine C, y compris les équations CKiD-U25, qui sont ajustées selon l’âge, le sexe et la taille.7 Un calculateur est disponible ici. Il est important de noter que les patients atteints d’une maladie rénale chronique dépendants de la dialyse peuvent recevoir un produit de contraste iodé sans risque d’IRA, car leurs reins ne fonctionnent pas.
Agents de contraste en IRM
Pour l’IRM avec injection de contraste, un chélate de gadolinium est utilisé. Les réactions allergiques à ces agents sont encore moins probables que celles aux produits de contraste iodés, avec un taux d’environ 0,05 %. La prise en charge des réactions allergiques au gadolinium est la même que pour les agents de contraste iodés, et cela sera discuté ci‑dessous. Un risque propre aux agents au gadolinium est la fibrose systémique néphrogénique (FSN), une maladie ressemblant à la sclérodermie qui peut entraîner des rétractions articulaires et une défaillance d’organe et peut occasionnellement être mortelle.6 Cette entité reste mal comprise, mais elle est heureusement assez rare. Les patients présentant une insuffisance rénale aiguë, une maladie rénale chronique de stade 4 ou 5, ou ceux sous dialyse peuvent avoir un risque allant jusqu’à 7 % de développer une FSN avec certains agents au gadolinium (types I ou possiblement III). L’utilisation du gadolinium chez ces patients peut néanmoins être appropriée dans de rares cas où le bénéfice potentiel d’une IRM avec contraste est très élevé. Cependant, dans cette situation, obtenir un consentement éclairé constitue une bonne pratique. Dans la mesure du possible, un agent au gadolinium à plus faible risque (groupe II) devrait être utilisé dans cette population.6
Agents de contraste ultrasonores
Les agents de contraste ultrasonores sont constitués de microsphères de phospholipides ou de protéines contenant un gaz inerte échogène. Ces agents améliorent transitoirement la résolution de contraste en échographie et sont approuvés pour une utilisation intraveineuse et endoluminale. Un logiciel d’échographie dédié est requis. Les agents de contraste ultrasonores sont très sûrs, les réactions sévères survenant dans environ 0,01 % des cas. Aucune toxicité rénale n’est connue aux doses approuvées.6
Prise en charge des réactions de type allergique
Les recommandations actuelles du Manuel de l’American College of Radiology sur les produits de contraste concernant la prise en charge des réactions allergiques recommandent l’administration rapide d’épinéphrine en présence des éléments suivants:
- Bronchospasme sévère
- Érythème diffus avec hypotension profonde
- Œdème laryngé
- Hypotension avec tachycardie
Le schéma posologique actuel est résumé dans le tableau ci-dessous (Tableau 1).8
Tableau 1 Posologie de l’épinéphrine pour les réactions aux agents de contraste.
| Voie | Dose | Remarques | Répéter | Dose maximale |
|---|---|---|---|---|
| intraveineuse | 0.01 mg/kg | lentement dans une perfusion IV de solutés en cours | Toutes les 5-15 minutes | 1 mg |
| intramusculaire | 0.01 mg/kg | Toutes les 5-15 minutes | 1 mg | |
| Auto-injecteur 15–30 kg | 0.15 mg | Utiliser la voie IV (ci-dessus) si moins de 15 kg | ||
| Auto-injecteur > 30 kg | 0.3 mg |
Critères d’adéquation de l’ACR
Les critères de pertinence de l’American College of Radiology (ACR) sont des recommandations consensuelles librement disponibles en ligne pour le clinicien à la recherche de l’examen d’imagerie approprié dans diverses situations. Ces recommandations sont élaborées par des groupes d’experts et sont fréquemment mises à jour.
Tableau 2 Recommandations pour l’échographie rénale selon les critères de pertinence de l’ACR.
| Indication | Remarques |
|---|---|
| Nouveau-né avec UTD prénatale, échographie post-natale initiale | Idéalement âgé d’au moins 72 heures |
| Nouveau-né avec UTD prénatale et échographie post-natale normale | Suivi entre 1–6 mois à la discrétion du clinicien |
| Nouveau-né avec UTD prénatale et grade SFU 1-2 ou APRPD inférieur à 15 mm à l’échographie post-natale | Envisager une cystographie mictionnelle comme examen complémentaire |
| Nouveau-né avec UTD prénatale et grade SFU 3-4 ou APRPD supérieur à 15 mm à l’échographie post-natale | Cystographie mictionnelle et scintigraphie du système collecteur également recommandées |
| Hématurie atraumatique | Lorsqu’elle est macroscopique ou associée à une protéinurie |
| Urolithiase suspectée | |
| Infection urinaire fébrile | Chez l’enfant de moins de 2 mois |
| Infections urinaires fébriles récidivantes ou réponse insuffisante aux antibiotiques |
Modalités d’imagerie
Échographie
Chez l’enfant, l’échographie (US) est une modalité de routine. Elle constitue presque toujours l’examen de première intention en cas de suspicion d’anomalies rénales (le traumatisme étant l’exception notable). L’US est peu coûteuse, non ionisante et largement disponible. Son inconvénient est d’être opérateur-dépendante. En particulier lorsque l’interprétation se fait à distance, le radiologue s’appuie fortement sur l’échographiste.
Pour les indications ci-dessous, l’échographie est recommandée comme modalité d’imagerie de première intention.8,9
Anatomie du rein
Les dimensions rénales en fonction de l’âge sont bien établies et une croissance appropriée peut être aisément mise en évidence à l’échographie. Il existe une marge d’erreur d’environ ± 7 mm selon les plans d’imagerie ou les mouvements du patient (la TDM faisant office de référence), ce qui signifie que la comparaison entre plusieurs échographies antérieures fournira une indication plus fiable de la croissance rénale (ou de son absence). Les reins peuvent être lobulés ou présenter des colonnes de Bertin proéminentes comme variantes normales.
La différenciation cortico-médullaire est normalement très marquée chez les nouveau-nés. À mesure que les glomérules corticaux subissent un élagage physiologique avec la maturation de l’enfant, le cortex devient habituellement plus hypoéchogène. Ainsi, le rein normal chez un enfant plus âgé ou un adolescent se rapproche de l’aspect de l’adulte, avec une quasi-isoéchogénicité du cortex et de la médullaire contrastant nettement avec le sinus rénal hyperéchogène. La connaissance de l’aspect normal du rein aux différents âges est essentielle pour le radiologue pédiatrique et permet le diagnostic d’anomalies subtiles.
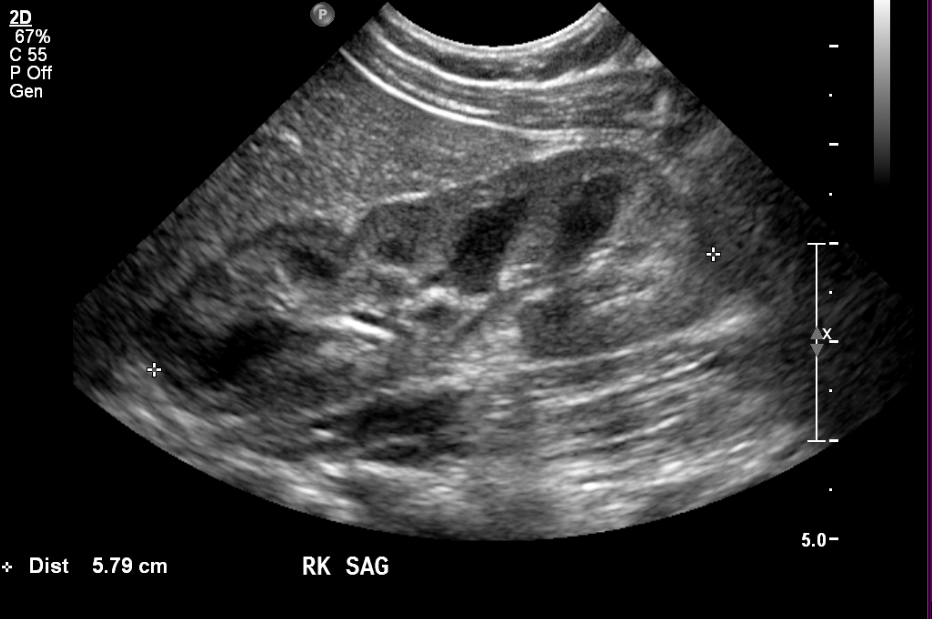
Figure 1 Rein normal chez un nourrisson de quatre mois.
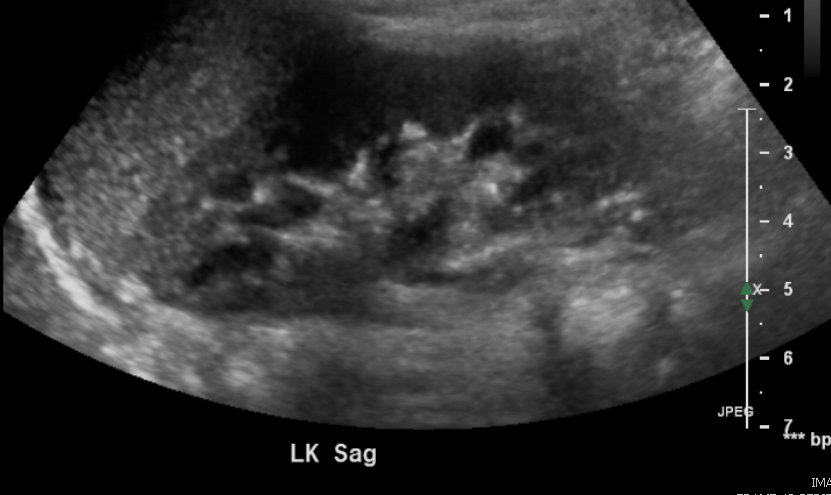
Figure 2 Rein normal chez un enfant de 3 ans.
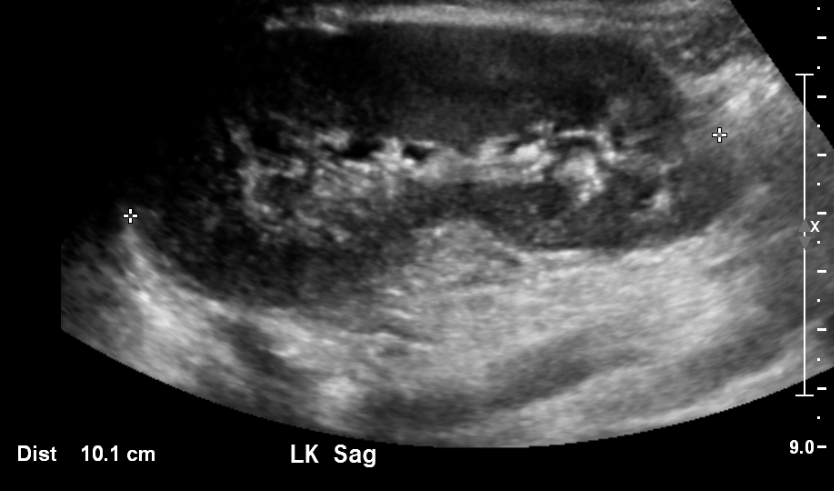
Figure 3 Rein normal chez un enfant de 11 ans.
Suivi de la dilatation anténatale des voies urinaires
C’est l’indication la plus fréquente d’une échographie rénale pédiatrique en ambulatoire. L’architecture du système collecteur dilaté est généralement bien caractérisée à l’échographie et peut fournir des indices quant à l’étiologie. Malgré de nombreux efforts de standardisation (entamés en 1988 et toujours en cours), la terminologie descriptive a malheureusement été incohérente. Cette incohérence a entravé les efforts visant à corréler les résultats urologiques avec le degré de dilatation prénatale du système collecteur. Bien que les critères de pertinence de l’ACR reposent sur le système de classification SFU de 1988, la plupart des hôpitaux pédiatriques ont désormais adopté le système de classification UTD. Ce système de classification a été élaboré en 2014. UTD a introduit une terminologie descriptive unifiée pour l’échographie pré- et postnatale afin de faciliter une évaluation périnatale standardisée. Il est vivement conseillé au clinicien de se familiariser avec la terminologie en usage au sein de son service de radiologie de rattachement et d’encourager la standardisation lorsque cela est possible.
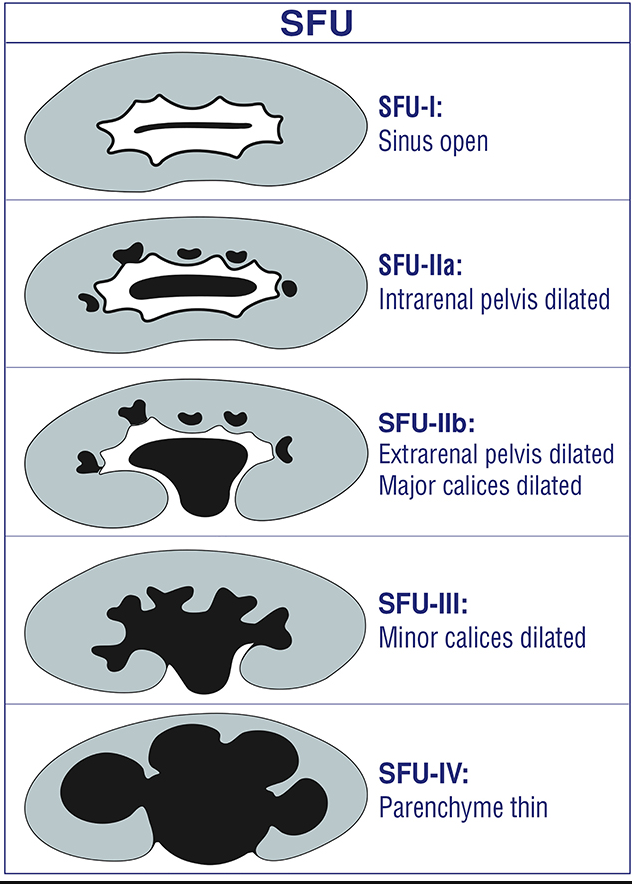
Figure 4 Classification SFU de la dilatation du système collecteur
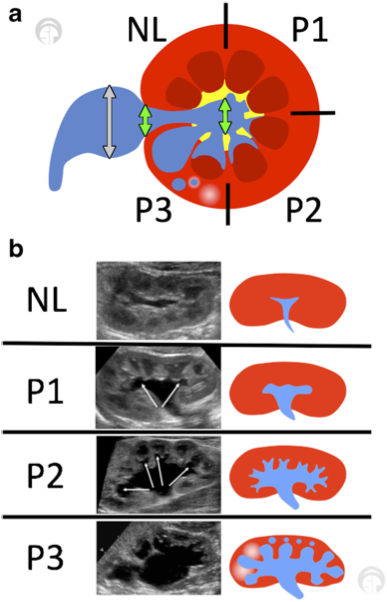
Figure 5 (a) La classification de la dilatation des voies urinaires (UTD) montre une vue transversale du rein au niveau médio/interpolaire. Les flèches vertes indiquent le diamètre antéro-postérieur (utiliser la mesure la plus grande). Le bassinet extrarénal ne doit pas être inclus (flèches grises). (b) Vues longitudinales des différents grades dans le système de classification UTD. Adapté de Chow et al 2017.10
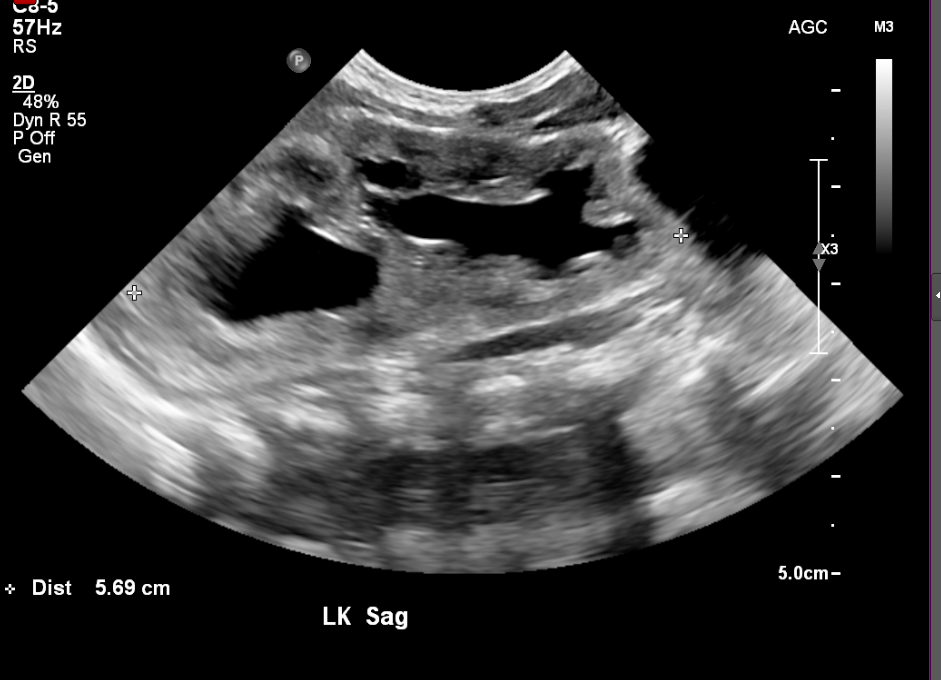
Figure 6 Duplication des voies excrétrices chez un nouveau-né
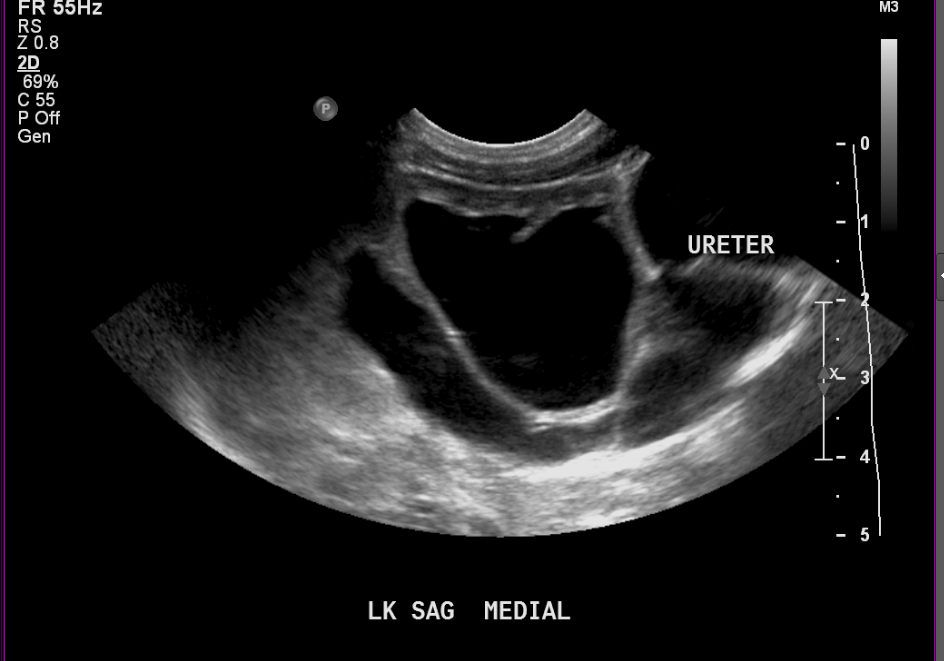
Figure 7 Même patient que (Figure 6) à l’âge de deux semaines montrant une dilatation plus marquée
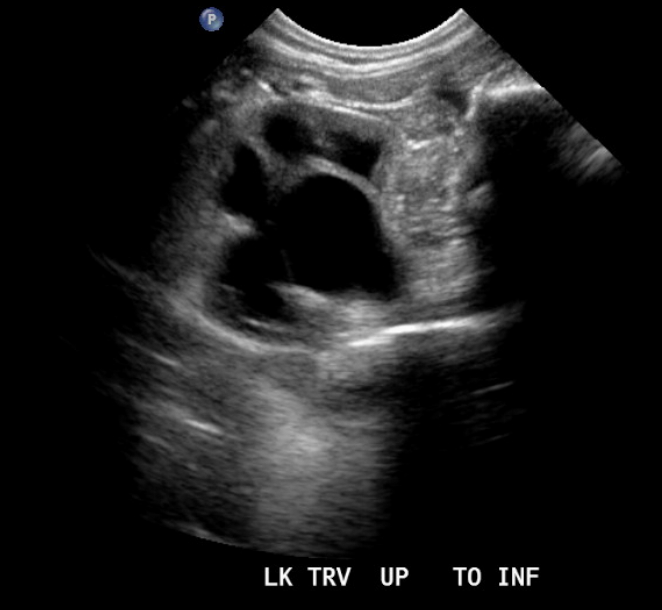
Figure 8 Obstruction de la jonction pyélo-urétérale
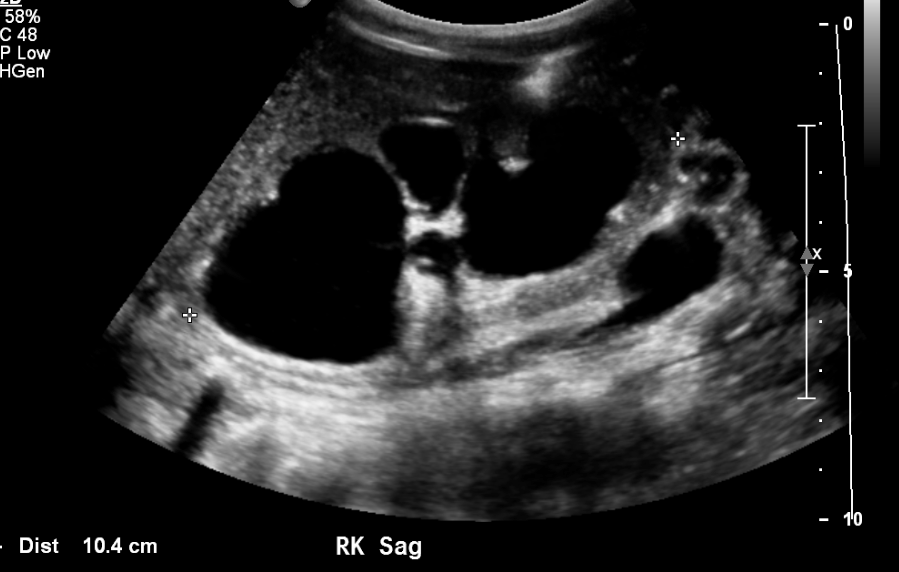
Figure 9 Calicectasie sévère et amincissement cortical chez un patient porteur de valves urétrales postérieures
Dépistage tumoral dans des affections génétiques prédisposantes telles que Beckwith-Wiedemann ou WAGR
L’échographie peut détecter des masses solides subtiles chez les jeunes enfants, comme l’illustre l’exemple ci-dessous. La fréquence du dépistage et la tranche d’âge varient selon l’affection prédisposante spécifique.11
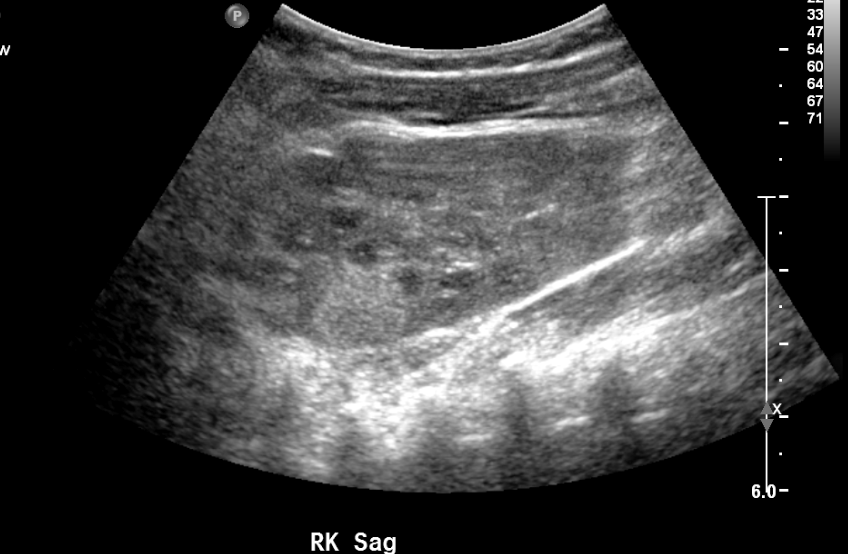
Figure 10 Masse rénale échogène à l’échographie de dépistage chez un patient atteint du syndrome WAGR.
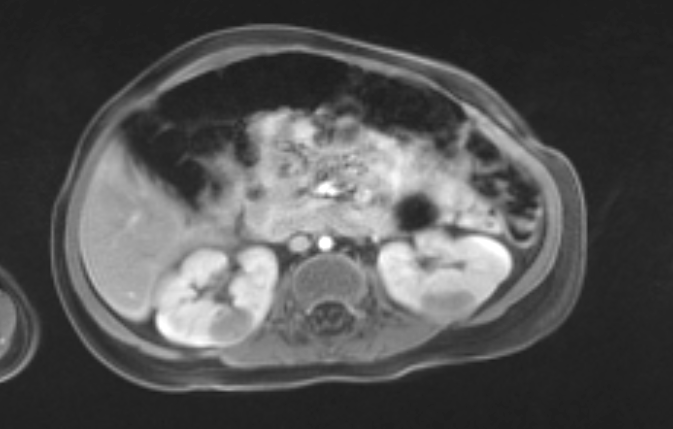
Figure 11 L’IRM a confirmé la présence de masses multiples (même patient que la Figure 10).
Débit sanguin rénal
L’échographie fournit des informations précieuses en cas de suspicion de sténose de l’artère rénale.
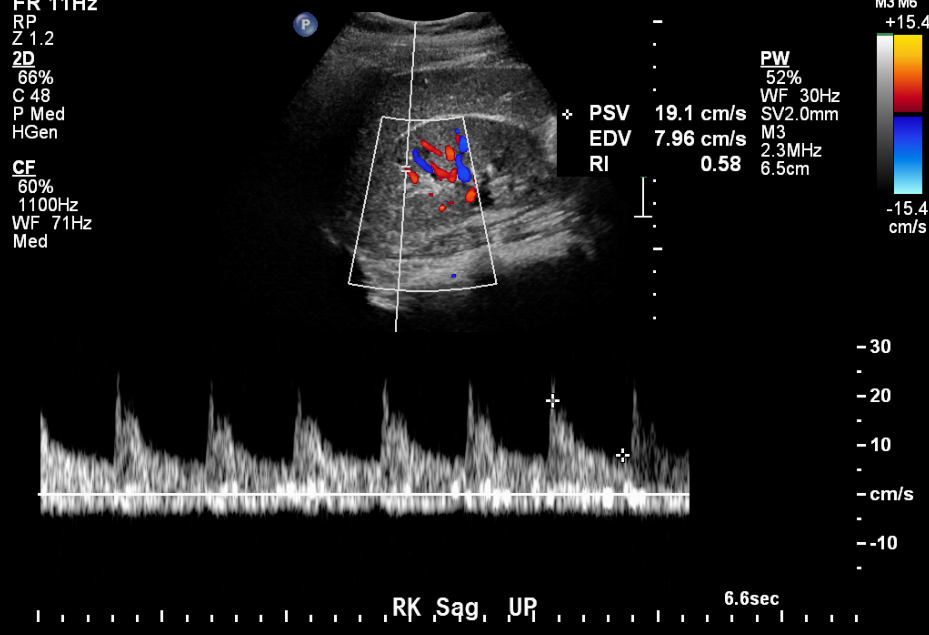
Figure 12 Tracé artériel normal chez un enfant de 11 ans présentant une hypertension artérielle.
Calculs rénaux
Les calculs obstructifs peuvent être directement visibles à l’échographie ou être déduits de la présence d’un système collecteur dilaté du côté symptomatique. L’artéfact de scintillement peut être exploité pour détecter les calculs.
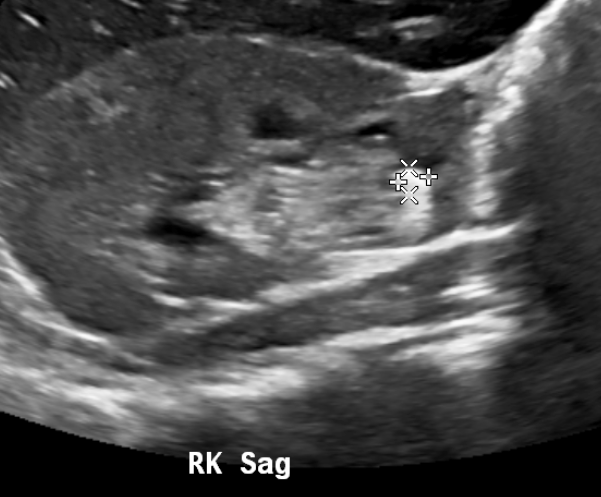
Figure 13 Calcul au pôle inférieur du rein droit.
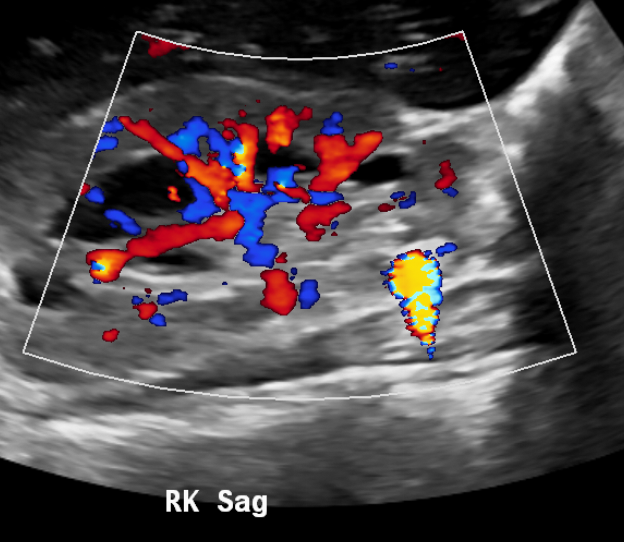
Figure 14 L’artéfact de scintillement améliore la conspicuité des calculs.
Anomalies de la vessie
Une vessie correctement distendue peut être évaluée à la recherche d’un épaississement pariétal, d’une trabéculation, de débris ou de calculs. Des masses vésicales peuvent être découvertes fortuitement. Les images post-mictionnelles sont utiles chez les patients chez lesquels une dysfonction mictionnelle est suspectée.
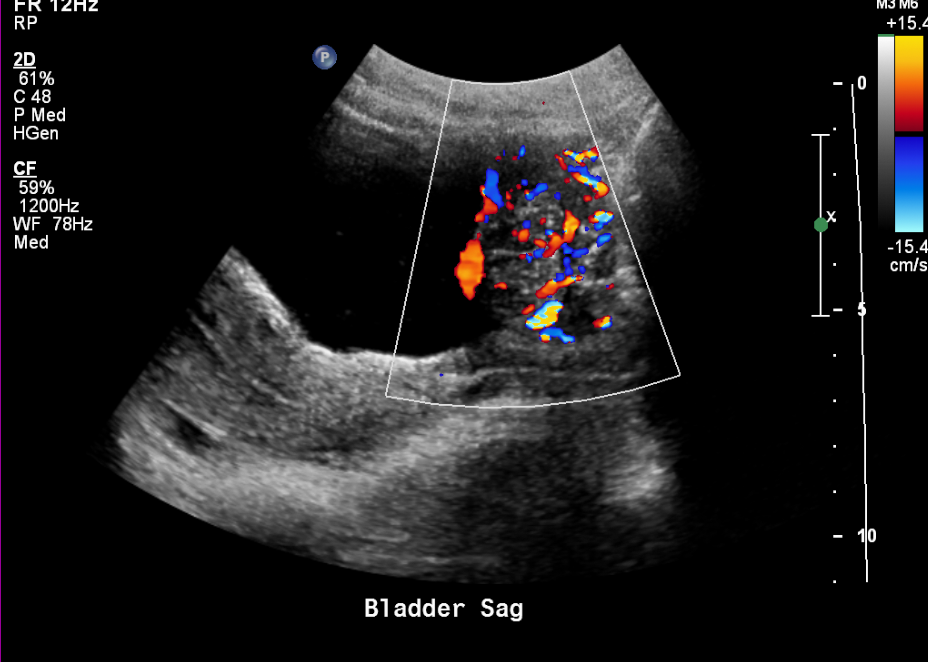
Figure 15 Masse vésicale très vascularisée chez un adolescent.
Technique:
- Vessie pleine (chez un enfant ayant acquis la propreté).
- Vessie examinée en premier avant le reste de l’abdomen afin d’éviter une vidange précoce de la vessie.
- Vues sagittales des reins ; meilleures pour la mesure de la longueur. Idéalement, l’échographiste devrait revoir les échographies antérieures pour se faire une idée de la longueur rénale attendue.
- Vue transverse au niveau du pôle supérieur, de la région interpolaire et du pôle inférieur ; idéale pour évaluer la dilatation du système collecteur intrarénal. Un bassinet extrarénal observé en plan sagittal peut mimer une dilatation légère du système collecteur intrarénal.
Échographie scrotale
L’échographie est l’examen de choix pour évaluer le scrotum en cas de douleur ou d’anomalie palpable.12
Technique:
- Images des testicules selon le plus grand axe, en deux plans, avec mesures
- Images de la tête de l’épididyme (garçons plus âgés) avec mesures
- Doppler couleur montrant les deux testicules
- Doppler spectral montrant le flux artériel dans les deux testicules
- Vues des cordons spermatiques (idéalement boucles ciné)
- Documenter une hydrocèle ou une varicocèle si présente
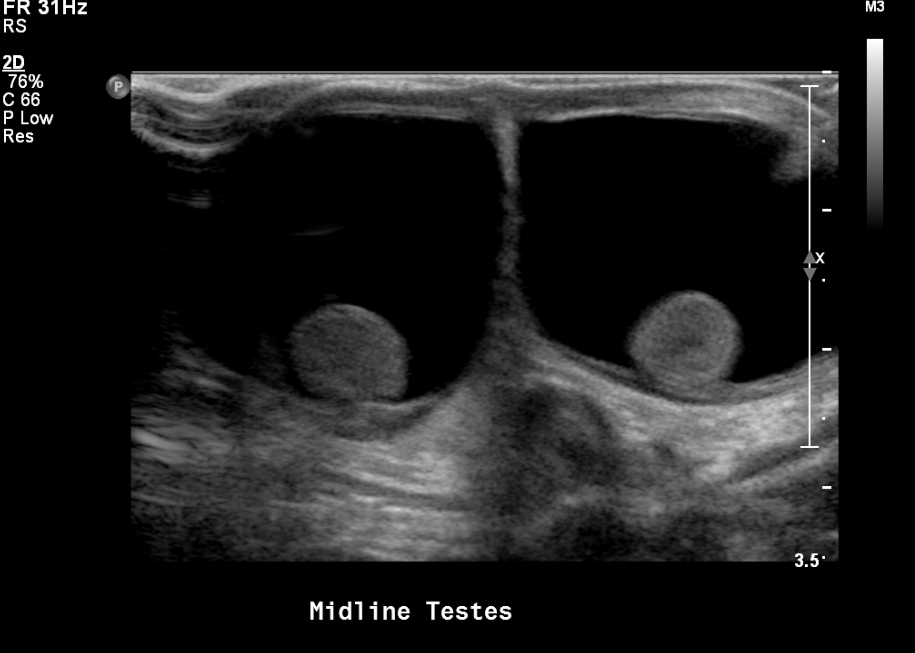
Figure 16 Hydrocèles bilatérales chez un nouveau-né
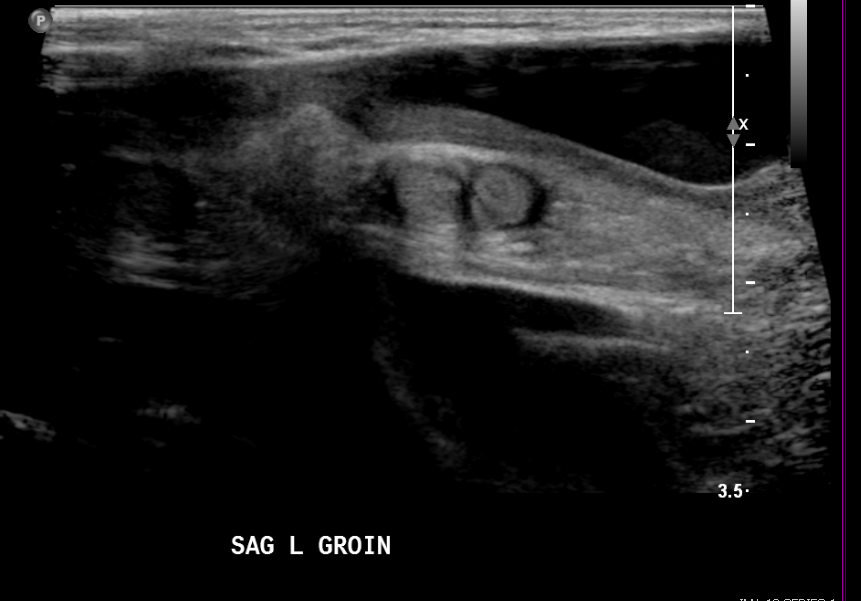
Figure 17 Hydrocèle non communicante chez un nouveau-né
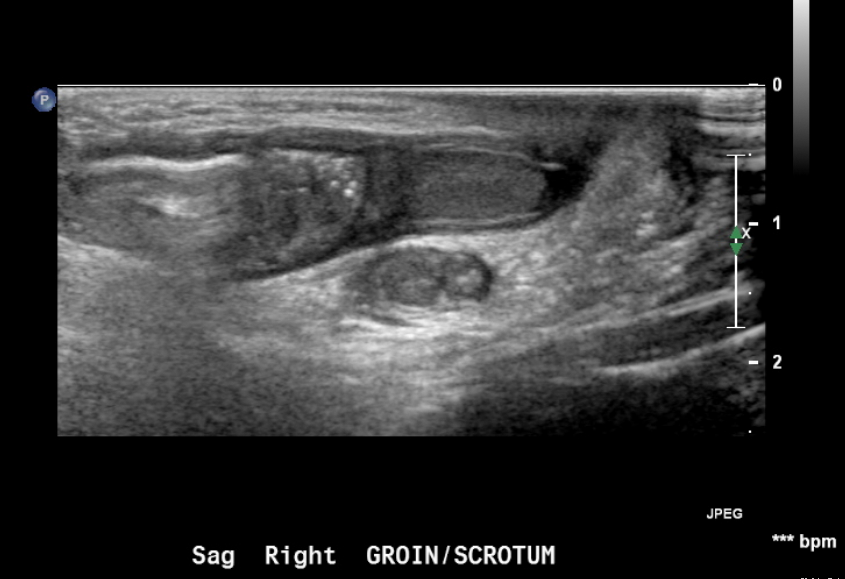
Figure 18 Hernie inguinale chez un nouveau-né
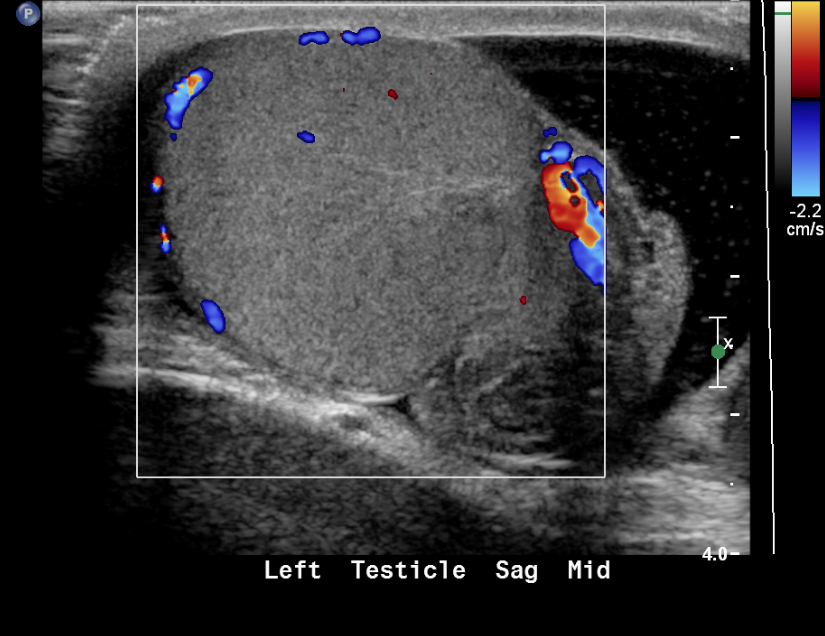
Figure 19 Testicule torsadé avec absence de flux au Doppler couleur
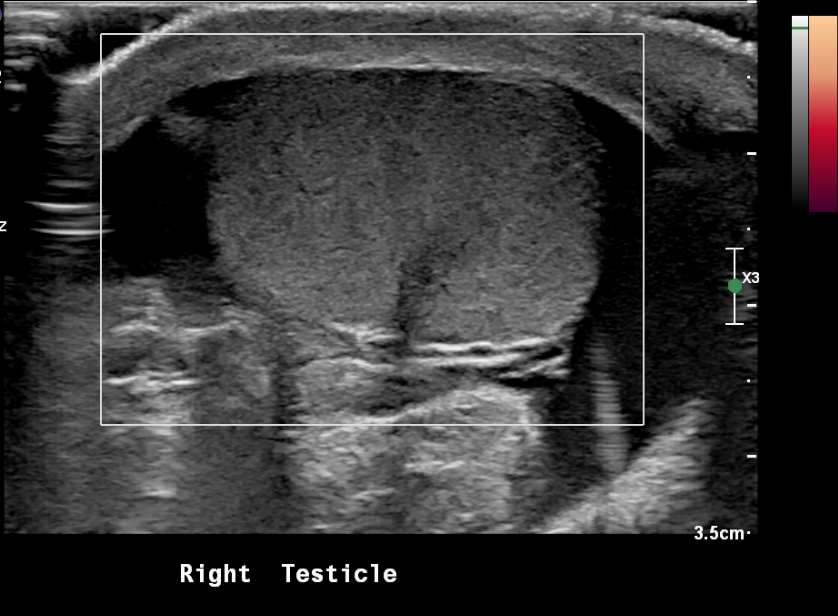
Figure 20 Testicule en torsion avec absence de flux sanguin au Doppler puissance
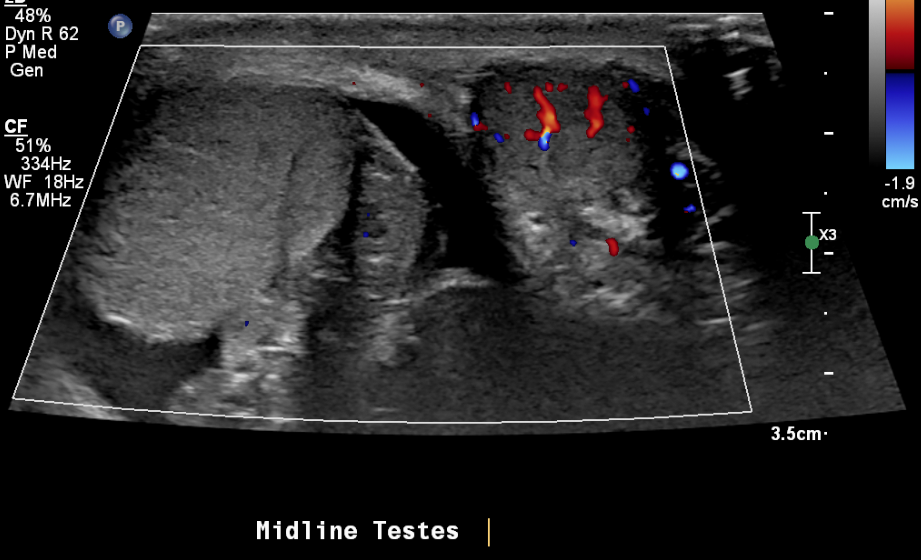
Figure 21 Testicule droit en torsion et flux sanguin normal du testicule gauche
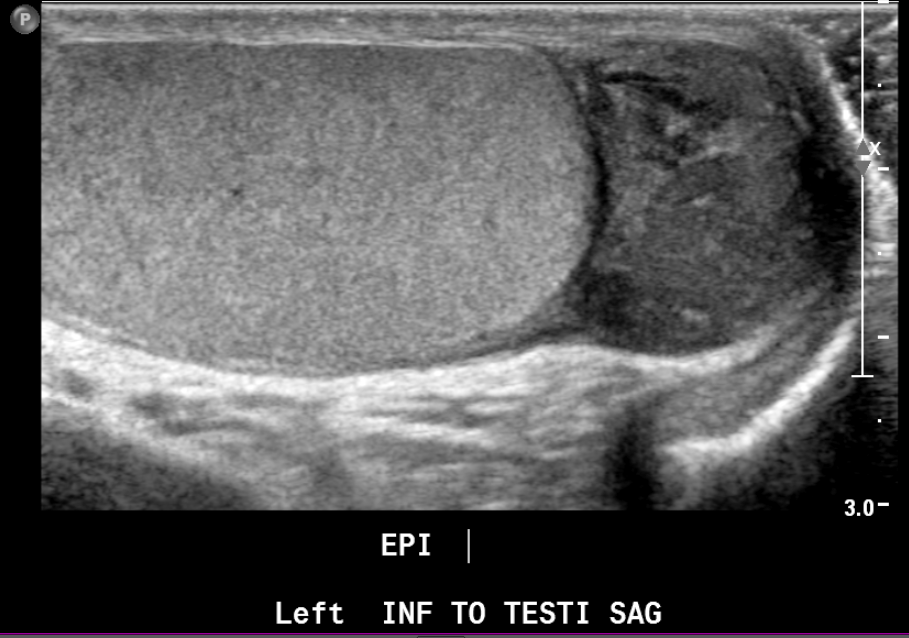
Figure 22 Rhabdomyosarcome paratesticulaire chez un adolescent présentant une masse palpable indolore
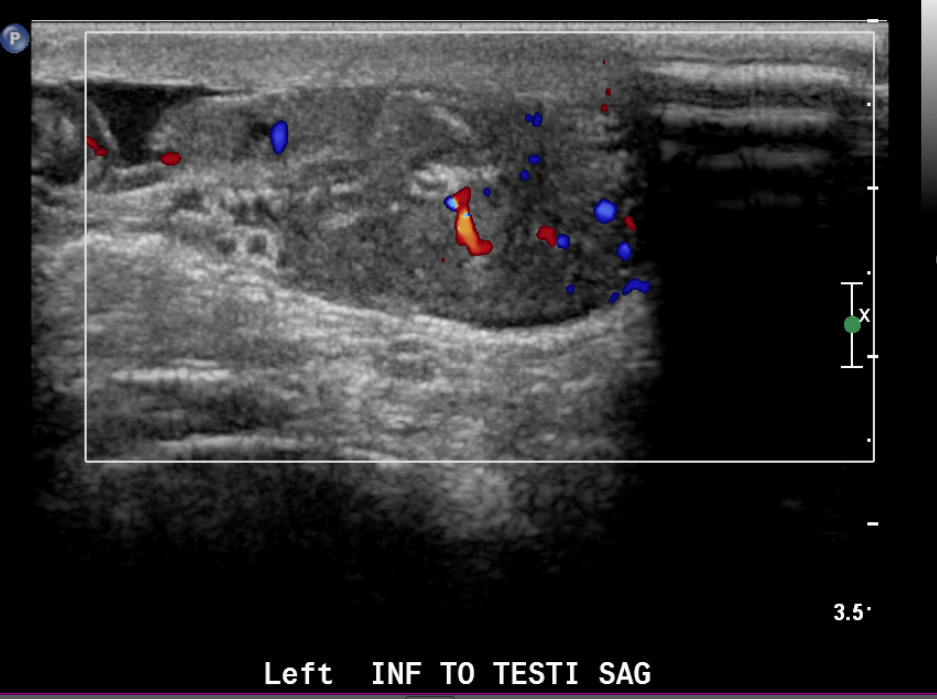
Figure 23 Image en couleur d’un rhabdomyosarcome paratesticulaire
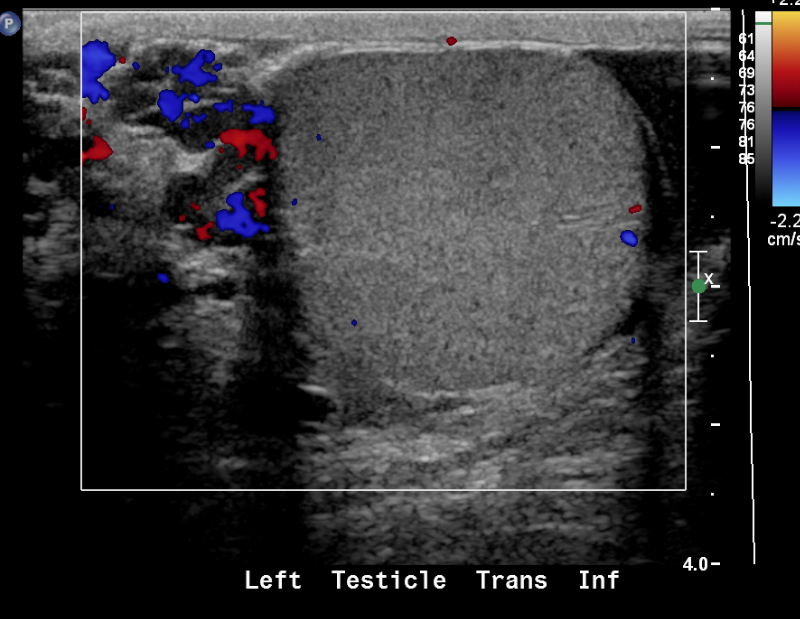
Figure 24 Varicocèle
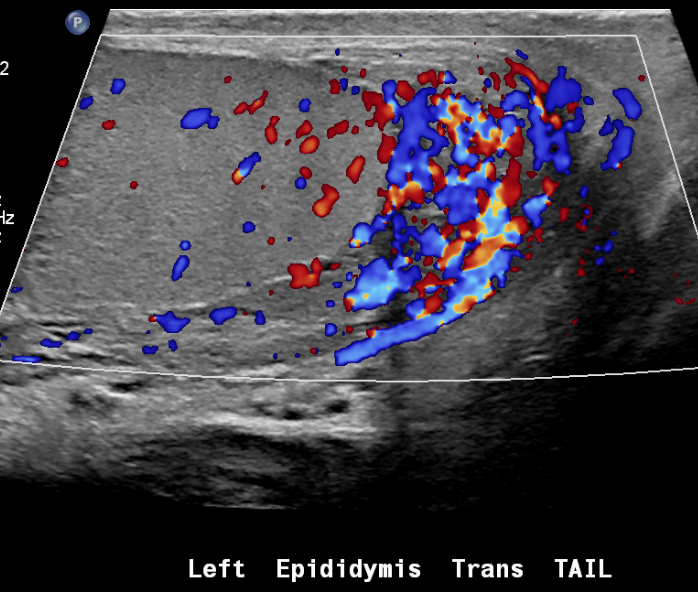
Figure 25 Épididymite
Radiographie
Les radiographies utilisent la différence de densité radiographique des différentes parties du corps pour créer une image (air, graisse, liquide, os et métal). Les radiographies modernes sont stockées à l’aide d’un système d’archivage et de communication d’images (PACS), qui est un système d’imagerie numérique. Les avantages du PACS comprennent une meilleure résolution des images et la possibilité de partager l’accès instantanément et à distance.
Les radiographies abdominales sont souvent réalisées en contexte aigu (douleur abdominale aiguë) pour évaluer la répartition des gaz intestinaux et exclure la présence d’air libre (deux incidences sont habituellement nécessaires pour ce dernier).
Autres constatations possibles:
- Calcifications des tissus mous
- Masses abdominales volumineuses
- Organomégalie
- Anomalies osseuses
- Positionnement des dispositifs de support (p. ex., stents urétéraux)
Une seule radiographie abdominale en décubitus dorsal est également couramment réalisée par les urologues pédiatriques en consultation externe en cas de constipation connue ou suspectée. Selon un consensus d’experts, cela n’est pas indiqué chez les enfants présentant une grande quantité de selles à l’examen rectal.13 Cette pratique peut être indiquée dans les cas où un examen rectal n’est pas possible (par exemple en cas d’antécédents traumatiques). Le praticien doit garder à l’esprit que les radiographies abdominales peuvent entraîner, au fil du temps, une dose d’irradiation non négligeable.
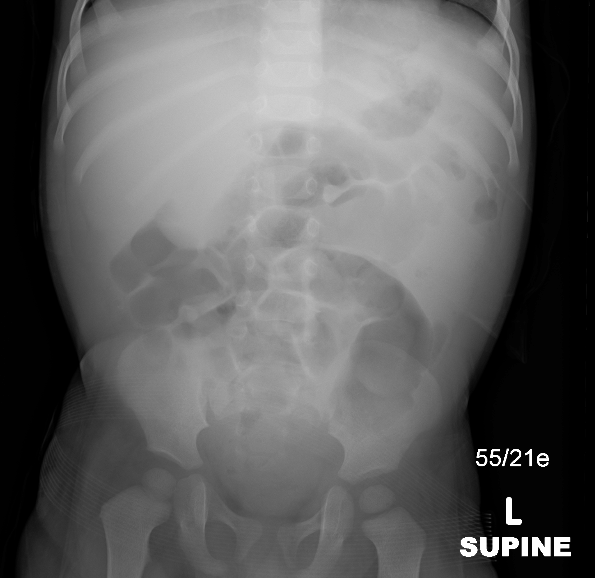
Figure 26 Radiographie abdominale montrant un effet de masse dans le quadrant supérieur droit
Urétrocystographie mictionnelle et urosonographie mictionnelle
La VCUG est un examen radiologique spécialisé principalement utilisé pour évaluer la présence d’un reflux vésico-urétéral (VUR) et la morphologie urétrale. La justification a été le lien présumé entre le reflux et les cicatrices post-infectieuses. Malgré trente années d’étude depuis le début de la prophylaxie antibiotique systématique du reflux, des questions subsistent. Les cystographies sont moins souvent réalisées qu’auparavant, et l’abstention-surveillance est souvent préférée à la prophylaxie antibiotique.14 Les explorations mictionnelles ont traditionnellement été réalisées sous fluoroscopie. Une transition est en cours aux États-Unis vers l’utilisation de l’échographie avec agent de contraste (ceUS). En Europe, l’échographie avec agent de contraste est pratiquée depuis les années 1990 et est largement disponible depuis le début des années 2000. Cependant, les agents de contraste ultrasonores n’ont été approuvés pour une utilisation aux États-Unis qu’en 2016. Il demeure un débat quant à la sensibilité de la ceVUS pour les anomalies urétrales chez le nourrisson de sexe masculin. À la date de rédaction, les critères de pertinence de l’ACR recommandent encore la VCUG plutôt que la ceVUS dans ce contexte, malgré l’existence d’articles de revue montrant une excellente visualisation de l’anatomie urétrale par ceVUS.8,15,16
La fluoroscopie est encore fréquemment utilisée, y compris dans l’établissement de cet auteur, même si elle expose le patient à des rayonnements ionisants. Un autre inconvénient de la fluoroscopie traditionnelle est qu’elle nécessite que le patient soit allongé à plat pour uriner ; cela est souvent difficile pour les patients déjà éduqués à la propreté.
Un cathétérisme vésical aseptique est nécessaire pour les deux types de test et constitue souvent la partie la plus difficile de l’examen pour le patient. Une petite sonde d’alimentation (de 5 Fr à 10 Fr selon la taille et l’âge du patient) est introduite par l’urètre jusque dans la vessie. Le recours à la sédation chez les enfants d’environ deux à six ans est controversé. Les risques potentiels de la sédation doivent être mis en balance avec les préjudices liés au stress psychologique. L’utilisation d’une planche octogonale ou d’un dispositif similaire pour immobiliser le patient est également controversée. Certains radiologues pédiatriques préfèrent utiliser cette planche chez les grands nourrissons ou les jeunes tout-petits. Un professionnel Child Life est un atout précieux pendant ces examens et peut être une présence réconfortante tant pour le patient que pour le parent accompagnateur.
Une fois le cathéter en place et la vessie vidée, le produit de contraste est instillé sous contrôle fluoroscopique (ou échographique). L’examen échographique peut utiliser un brassard de pression artérielle pour instiller le contraste à faible pression. Pour le VCUG, le contraste est instillé par gravité. Les images standard obtenues pour le VCUG et la ceVUS sont essentiellement identiques.
Technique de la cysto-urétrographie mictionnelle:
- Cliché fluoroscopique de l’abdomen (nourrisson) ou au niveau des reins et au niveau de la vessie (enfant plus âgé)
- Cliché spot ou mémorisation de la dernière image de la vessie au remplissage initial (évaluation d’une urétérocèle)
- Vérifications intermittentes pour évaluer la présence d’un reflux
- À l’approche de la capacité vésicale théorique, obtenir des incidences obliques bilatérales en mémorisation de la dernière image ou des clichés spot
- Lors de la première miction, vérifier la présence d’un reflux
- Deuxième cycle (au minimum) chez le nourrisson ou chez un patient présentant une infection urinaire fébrile
- Incidence mictionnelle de profil de l’urètre chez le patient de sexe masculin (idéalement sans sonde)
Les images standard de l’urosonographie mictionnelle seront pour l’essentiel similaires, à l’exception de la vue de repérage initiale. Les vues panoramiques peuvent aider à étendre le champ de vue en échographie. Cependant, le champ de vue plus réduit demeure une limitation de l’échographie.
Il convient de veiller à remplir la vessie de façon adéquate sans la sur-remplir. Une formule utile pour estimer la capacité vésicale (chez les enfants de plus de 12 mois) est l’âge plus 2, multiplié par 30, pour la capacité vésicale prédite (en mL). On peut s’attendre à ce qu’un nouveau-né retienne environ 50 mL. Des clichés fluoroscopiques obliques, ou au minimum une rétention de la dernière image, doivent être obtenus avec une distension vésicale maximale afin d’évaluer un reflux de bas grade (qui peut être masqué en projection AP). Tapoter sur la vessie, pratiquer un massage doux de l’abdomen ou asperger la peau d’eau tiède peuvent aider à inciter les jeunes enfants à uriner. La sédation peut parfois rendre la miction plus difficile pour les patients. Le sur-remplissage (au-delà de deux fois la capacité prédite) est à éviter, car cela peut rendre ce problème plus probable.
- Indications
- Reflux vésico-urétéral
- Étude de l’urètre lors de la miction
- Anomalies vésicales
- Contre-indications
- Infection urinaire aiguë
- Antécédent de réaction sévère au produit de contraste
- Préparation du patient
- Le patient doit uriner avant l’examen (chez les jeunes enfants, la vessie peut être drainée avant le remplissage).
- Couverture antibiotique par triméthoprime 2 mg/kg/dose une fois par jour pendant 3 jours avant l’examen (chez les enfants non sous antibioprophylaxie)
- Note de l’éditeur : Les preuves pour étayer ceci sont limitées et la pratique n’est pas universelle.
- Complications
- Réactions liées au produit de contraste
- Infection urinaire
- Surdistension vésicale et rupture
- Traumatisme lié au cathéter
- Résultats
- Grade I – reflux dans un uretère non dilaté
- Grade II – reflux dans le bassinet et les calices sans dilatation
- Grade III – dilatation légère/modérée de l’uretère, du bassinet et des calices avec émoussement minimal des fornix
- Grade IV – dilatation du bassinet et des calices avec tortuosité urétérale modérée
- Grade V – dilatation majeure de l’uretère, du bassinet et des calices; tortuosité urétérale; effacement des empreintes papillaires
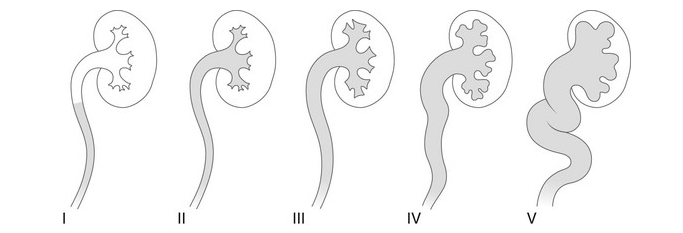
Figure 27 Classification radiologique du reflux vésico-urétéral
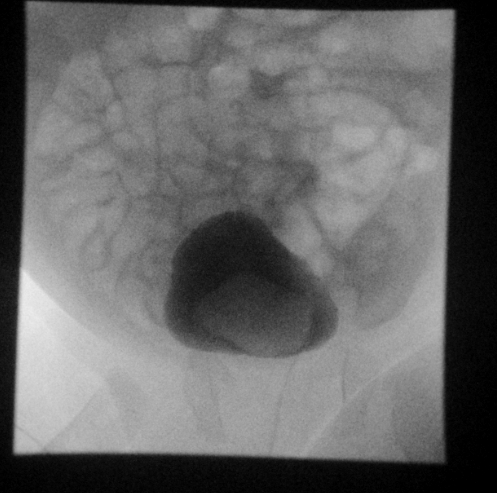
Figure 28 Urétérocèle sur la dernière image mémorisée en fluoroscopie
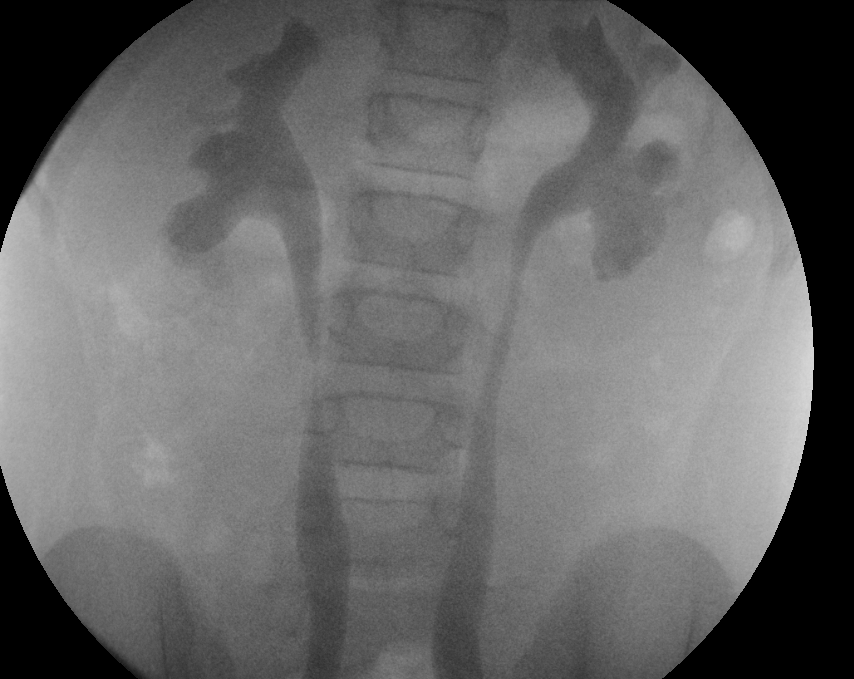
Figure 29 Reflux de grade 3 dans les deux reins
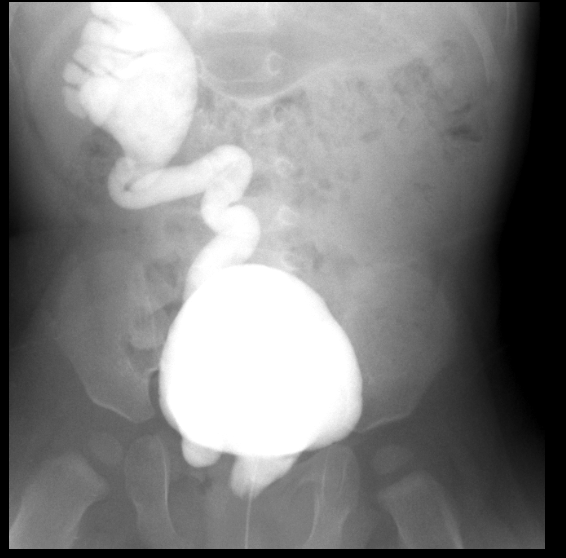
Figure 30 Reflux de grade 5 à droite avec insertion ectopique dans l’urètre
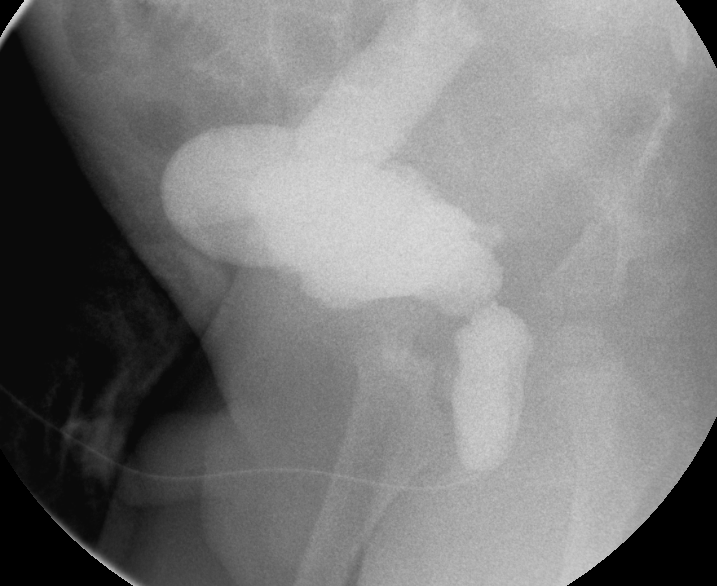
Figure 31 Urètre postérieur dilaté et uretère droit massivement dilaté dans le contexte de valves urétrales postérieures
Études radionucléidiques
DMSA / Scintigraphie rénale statique
L’acide dimercaptosuccinique (DMSA) se lie aux protéines plasmatiques et est retenu par le cortex rénal lors de la clairance rénale, permettant une évaluation fonctionnelle. Les données quantitatives sur la fonction rénale constituent une information cruciale qu’il est impossible d’obtenir par échographie. La scintigraphie à l’acide dimercaptosuccinique (DMSA) au Tc99m est considérée comme l’examen de choix pour l’évaluation des lésions parenchymateuses dues à une pyélonéphrite aiguë ou chronique et fournit des données sur la fonction rénale différentielle. Un cathéter vésical n’est pas nécessaire pour l’examen DMSA, car le radiotraceur n’est pas excrété dans les urines. La tomoscintigraphie (SPECT) DMSA augmente la sensibilité, mais une sédation est nécessaire chez les jeunes enfants afin d’obtenir des images de haute qualité.17 Le DMSA ne fournit pas d’informations sur le système collecteur ni sur l’urodynamique.
- Indications
- Évaluer la fonction rénale
- Exploration d’une infection rénale
- Anomalies rénales congénitales (p. ex., reins en fer à cheval)
- Cicatrices rénales et lésions rénales
- Contre-indications
- Aucune
- Technique
- DMSA injecté par voie intraveineuse et images obtenues par une gamma-caméra 1–6 heures plus tard.
- Informations recueillies
- Fonction rénale relative
- Captation absolue
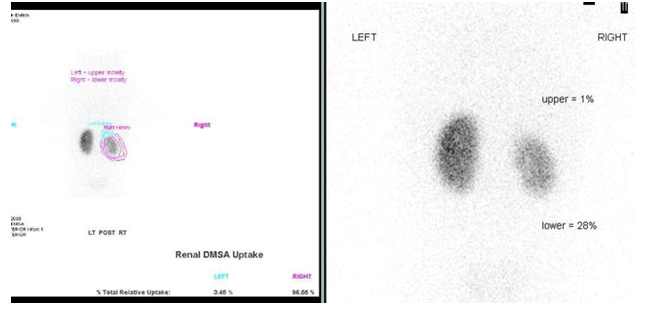
Figure 32 Scintigraphie rénale au DMSA montrant des cicatrices et une fonction diminuée de l’hémirein inférieur du rein droit dupliqué et un hémirein supérieur non fonctionnel
Scintigraphie MAG-3 / Scintigraphie rénale dynamique
Le mercaptoacétyltriglycine (MAG-3) est fortement lié aux protéines plasmatiques, il est donc éliminé par sécrétion tubulaire. La scintigraphie dynamique au MAG-3 apporte des informations sur la fonction et la morphologie rénales. Une sédation est nécessaire chez les jeunes enfants (âgés de moins de 5 ans environ). La phase initiale de l’examen met en évidence la perfusion et la fonction corticale rénales, permettant de distinguer les lésions réversibles des irréversibles. Le système collecteur et la dynamique urinaire sont ensuite caractérisés à l’aide de furosémide. Une scintigraphie MAG-3 rassurante permet à l’urologue pédiatrique de surveiller en toute sécurité un patient présentant une hydronéphrose dans la plupart des cas.18
- Indications
- Système obstrué vs non obstrué
- Sténose de l’artère rénale
- Maladie de reflux
- Traumatisme rénal
- Contre-indications
- Aucune
- Technique
- Hydrater le patient et vider la vessie
- Pose d’un cathéter vésical
- Injection de MAG-3
- Imagerie à 2–3 minutes avec une gamma-caméra pour la phase parenchymateuse
- Imagerie débutant à 18–20 minutes
- Furosémide 1 mg/kg, maximum 40 mg, injection lorsque le bassinet rénal dilaté est plein
- Imagerie séquentielle pendant environ 20 minutes supplémentaires
- Régions d’intérêt tracées autour des reins
- Courbes de vidange générées et t½ (temps nécessaire pour que la moitié du radiotraceur s’élimine) calculé
- Informations recueillies
- Perfusion rénale
- Perfusion corticale (fonction rénale différentielle)
- Temps de transit du parenchyme et du rein entier
- T½ inférieur à 10 minutes est normal
- T½ entre 10 et 20 minutes indéterminé
- T½ supérieur à 20 minutes suggère une obstruction
- Pièges
- Déshydratation entraînant une mauvaise réponse au diurétique
- Mauvaise fonction rénale sous-jacente entraînant une mauvaise réponse au diurétique
- Vessie distendue ou non compliante (poser un cathéter)
- Reflux de haut grade précoce (avant VCUG/ VUS)
- Système collecteur béant retardant la vidange
- Régions d’intérêt incluant la rate ou le foie
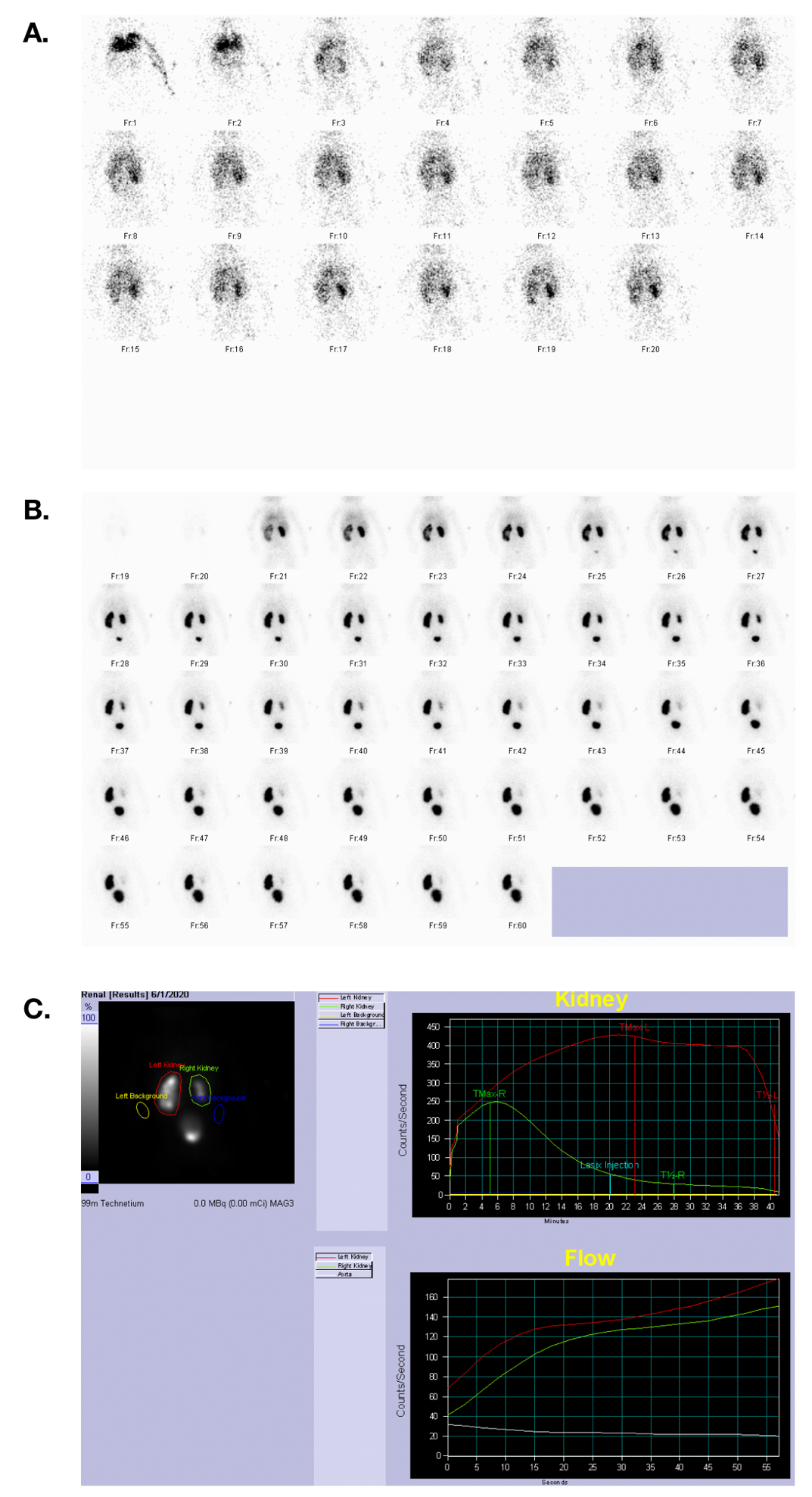
Figure 33 Scintigraphie au MAG 3 montrant la perfusion, la phase excrétrice et les courbes temps-activité chez un patient ayant une fonction rénale symétrique et une obstruction de la jonction pyélo-urétérale gauche.
Tomodensitométrie
La TDM avec injection de produit de contraste intraveineux est le standard de référence chez l’enfant pour l’évaluation d’un traumatisme abdominal fermé. Elle est rapide, largement disponible et permet une surveillance en temps réel par le radiologue. Idéalement, si une lésion du système collecteur rénal est identifiée, une seconde acquisition tardive centrée sur les reins ou la vessie (selon le niveau de lésion suspecté) peut être réalisée. À de rares exceptions près, il s’agit de la seule utilisation appropriée de la TDM multiphasique chez l’enfant. Aux États-Unis, l’IRM a largement remplacé la TDM pour le bilan d’extension des tumeurs de l’abdomen et du pelvis chez l’enfant.
Une TDM sans injection peut parfois être utile en pédiatrie pour le suivi des calculs rénaux et urétéraux, ou pour le diagnostic lorsque l’échographie n’est pas contributive.2 L’échographie peut ne pas mettre en évidence le calcul obstructif, surtout s’il est situé dans la portion moyenne de l’uretère (où les gaz intestinaux générant des ombres bloquent souvent le faisceau ultrasonore). Toutefois, la présence d’un système collecteur dilaté du côté symptomatique peut permettre au clinicien d’inférer la présence d’un calcul. Chez les enfants ayant des calculs connus ou des affections prédisposant à la lithiase, une TDM peut être envisagée. Des doses de rayonnement très faibles peuvent être employées pour évaluer la charge lithiasique ou pour le suivi après une intervention pour calculs.19 Les protocoles d’hématurie (TDM en trois temps avec phases sans injection, avec injection et tardive) ne sont pas appropriés chez les enfants en raison de la charge d’irradiation élevée.2
Aux États-Unis, l’IRM a largement remplacé la TDM pour le bilan d’extension tumoral de l’abdomen et du pelvis pédiatriques.20 Cependant, un angioscanner est parfois demandé par nos chirurgiens pédiatres à des fins de planification. L’angioscanner montre les rapports entre organes et l’anatomie vasculaire avec moins d’artéfacts et une résolution plus élevée que l’IRM, permettant au chirurgien de planifier une approche plus précise dans les cas de tumeur de Wilms, de neuroblastome ou d’autres tumeurs malignes. Étant donné que l’angioscanner nécessite une injection de produit de contraste plus rapide et entraîne une dose d’irradiation plus élevée, ces examens devraient être activement surveillés par un radiologue pédiatrique.
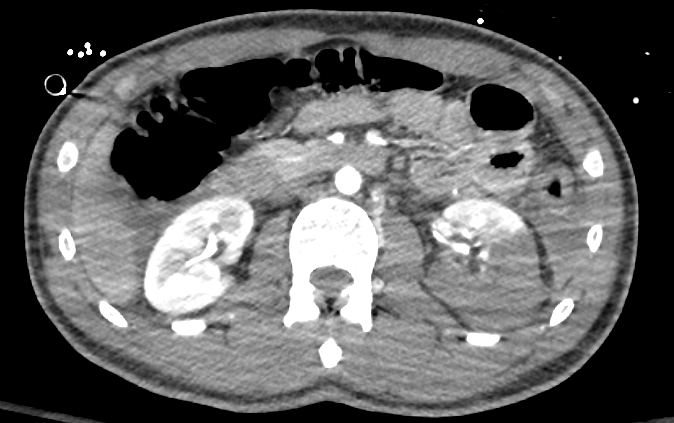
Figure 34 TDM avec injection de produit de contraste montrant une lacération rénale de haut grade du rein gauche.
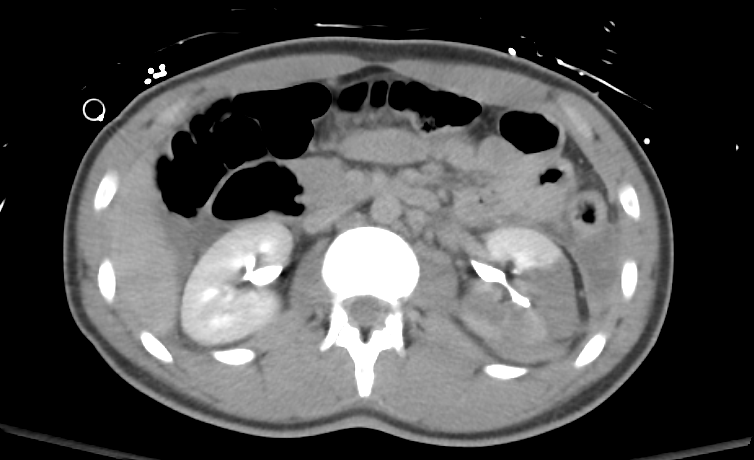
Figure 35 Une vue tardive à travers le rein écarte une rupture du système collecteur.
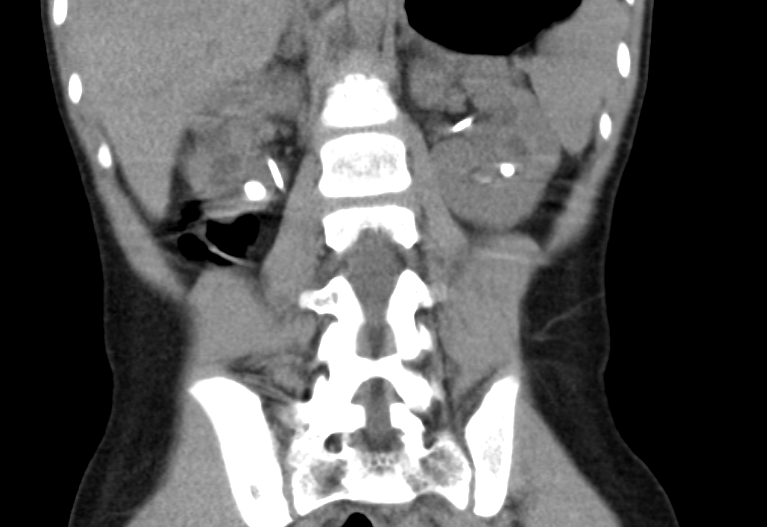
Figure 36 Examen TDM pour calculs chez un patient atteint de cystinurie; noter des stents bilatéraux partiellement visibles.
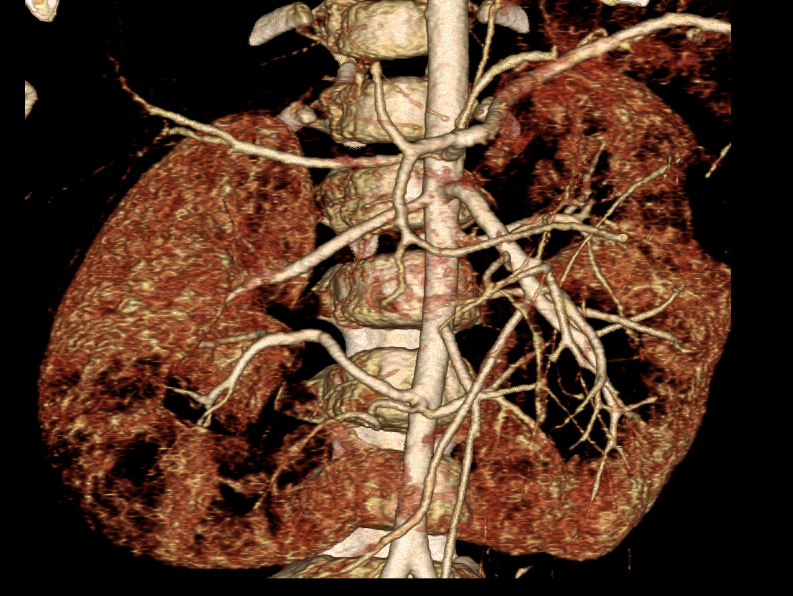
Figure 37 Angioscanner avec reconstruction 3D chez un patient atteint d’un cancer et présentant une anatomie artérielle complexe ; trois artères rénales sont cartographiées pour chaque hémirein
IRM
L’IRM exploite les propriétés magnétiques du noyau d’hydrogène pour produire des informations mathématiques sur les tissus mous du corps humain, qui peuvent ensuite être transformées en une image détaillée. Elle est supérieure à toute autre modalité pour le contraste des tissus mous et n’utilise pas de rayonnements ionisants. Ces avantages en ont fait la modalité de choix pour la stadification de la plupart des cancers de l’abdomen et du pelvis. De nombreuses séquences d’impulsions d’IRM sont disponibles dans le commerce. L’IRM est donc adaptée à la question clinique (davantage que la TDM), ce qui nécessite des protocoles spécifiques.
La résolution de l’IRM reste inférieure à celle de la TDM (étant inférieure d’environ un ordre de grandeur à la TDM à cet égard), et l’évaluation du tissu pulmonaire demeure limitée en pratique clinique. L’IRM est également longue et bruyante, nécessitant une forme de sédation chez la plupart des enfants âgés de moins de huit ans environ. Alors que les patients adultes peuvent (généralement) suivre des consignes d’apnée, cela est difficile voire impossible pour les jeunes enfants. Des logiciels permettant l’acquisition en respiration libre sont essentiels pour l’imagerie IRM du corps chez l’enfant.21 Ces séquences sont généralement plus longues qu’une séquence en apnée, mais peuvent néanmoins être obtenues assez rapidement (en approximativement trois minutes). La durée d’une acquisition IRM peut aller de trente minutes à plus d’une heure selon le protocole spécifique.
L’évaluation des voies urinaires est appelée urographie par résonance magnétique (MRU). La MRU est capable de fournir à la fois des informations anatomiques et fonctionnelles en un seul examen.8 La MRU corrèle bien avec la scintigraphie rénale au Lasix pour l’évaluation de la fonction rénale. Les patients sont hydratés avec du sérum physiologique (environ 10 mL/kg) et le Lasix est administré au début de l’examen, à la dose de 1 mg/kg, jusqu’à un maximum de 20 mg. En cas de suspicion d’obstruction de la jonction pyélo-urétérale, il peut être utile de réaliser l’imagerie du patient en décubitus ventral ou du côté controlatéral à l’obstruction suspectée. Chez les patients sous sédation, une sonde urinaire de Foley peut être posée.8 La MRU chez les patients sous sédation est une démarche collaborative nécessitant une bonne communication entre l’urologue, l’équipe de radiologie et l’équipe de sédation ou d’anesthésie.
L’angiographie par IRM épargne au patient l’exposition aux rayonnements ionisants, mais présente une résolution inférieure et est plus sujette aux artéfacts que l’angioscanner.
Dans le diagnostic fœtal, l’IRM est une modalité complémentaire de l’échographie. Les séquences à acquisition rapide sont essentielles pour l’imagerie fœtale. Bien que l’IRM fœtale soit le plus souvent demandée pour une évaluation plus approfondie d’une anomalie cérébrale, elle peut également fournir des informations supplémentaires sur l’appareil urinaire fœtal. Elle peut être particulièrement utile dans le contexte de la planification chirurgicale d’anomalies urogénitales complexes.22 En général, la qualité d’image en IRM fœtale s’améliore plus tard au cours de la gestation.
- Indications de l’IRM en pédiatrie
- Bilan d’extension des cancers
- Suspicion de masse rénale
- Dépistage des patients à risque de tumeur (p. ex. TS, VHL)
- Peut être appropriée en cas de pyélonéphrite compliquée
- Urographie par IRM
- Méthode
- Urographie sensible au signal liquidien utilisant des techniques d’IRM T2 fortement pondérées
- Urographie excrétrice par IRM utilisant des acquisitions pondérées T1 avec injection de contraste et furosémide
- Indications
- Anatomie du système collecteur
- Déterminer le niveau de l’obstruction des voies rénales (intrinsèque et extrinsèque)
- Anomalies congénitales
- Méthode
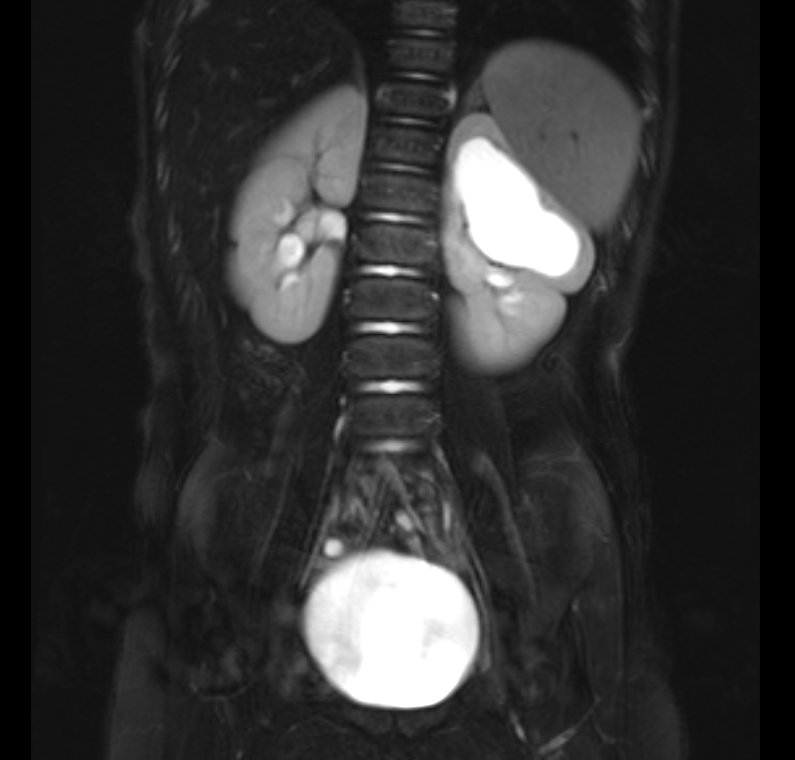
Figure 38 Image IRM sensible aux liquides avec suppression de graisse montrant un pôle supérieur gauche dilaté dans un rein dupliqué.
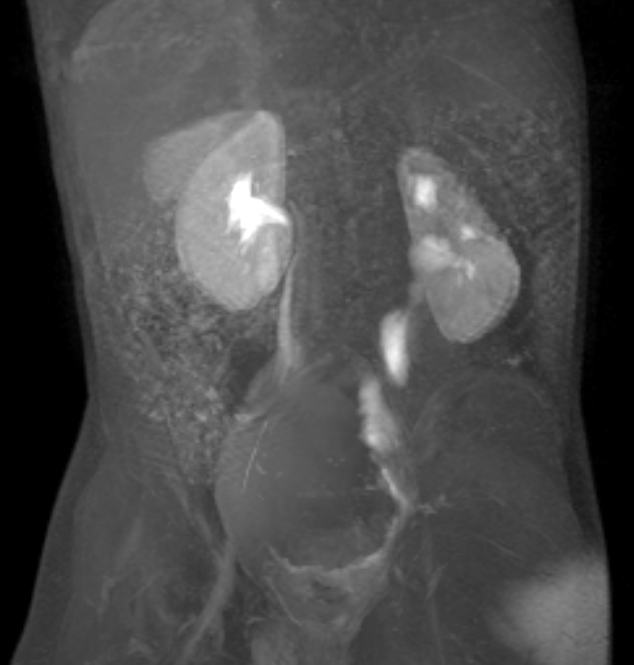
Figure 39 L’image IRM dynamique après injection de produit de contraste met en évidence un mégauretère gauche dilaté mais non obstrué.
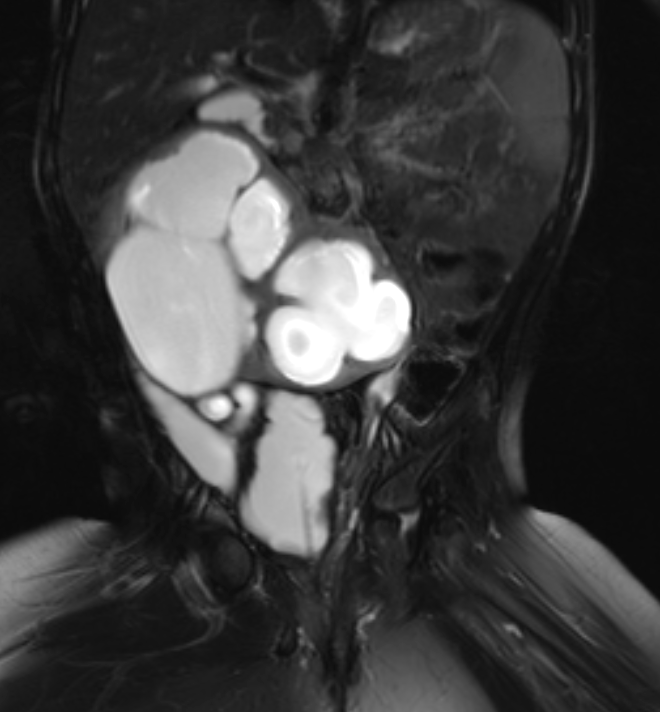
Figure 40 Une image d’IRM sensible aux liquides avec suppression de la graisse montre un rein en fer à cheval hydronéphrotique et une morphologie vésicale de type neurogène.
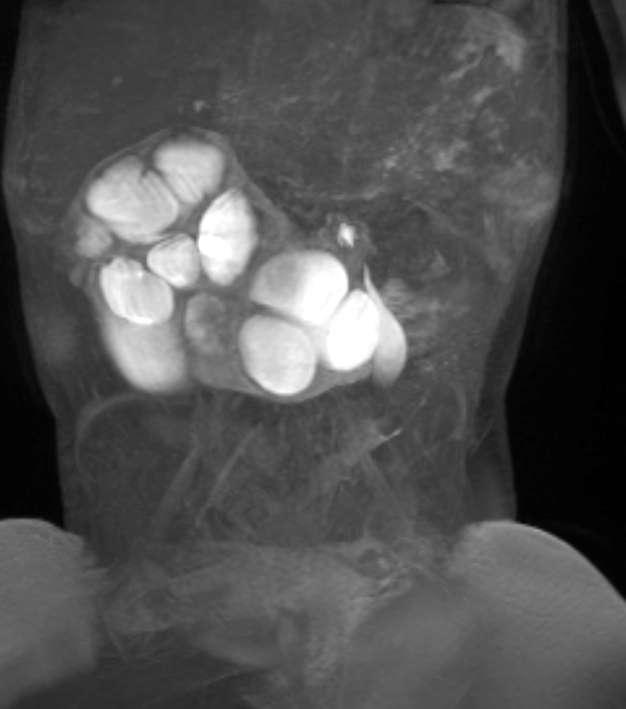
Figure 41 La série d’IRM dynamique après injection de contraste confirme l’obstruction du rein en fer à cheval.
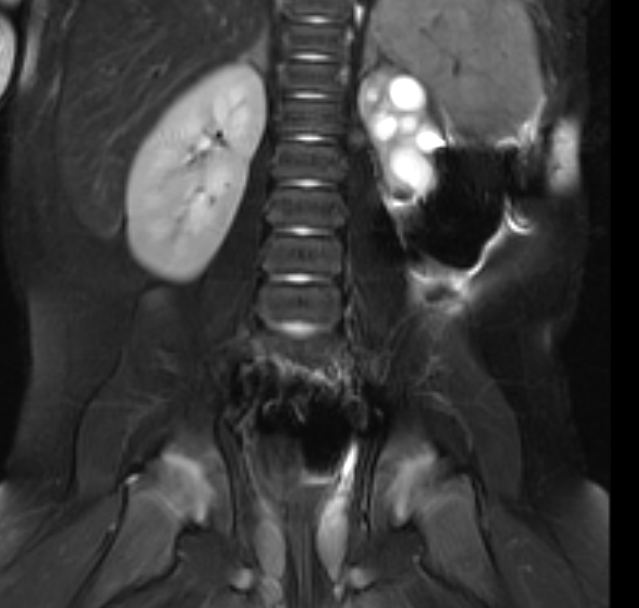
Figure 42 Une image IRM sensible aux liquides avec suppression de la graisse montre un petit rein gauche dysplasique.
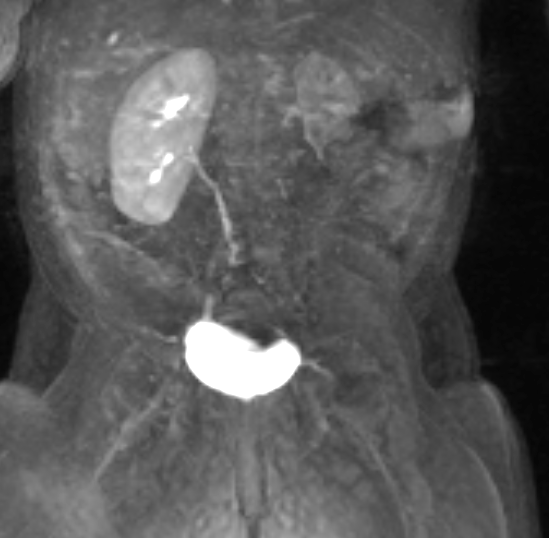
Figure 43 La série d’IRM dynamique post-contraste montre un rehaussement retardé et minimal du rein dysplasique, indiquant une fonction limitée.
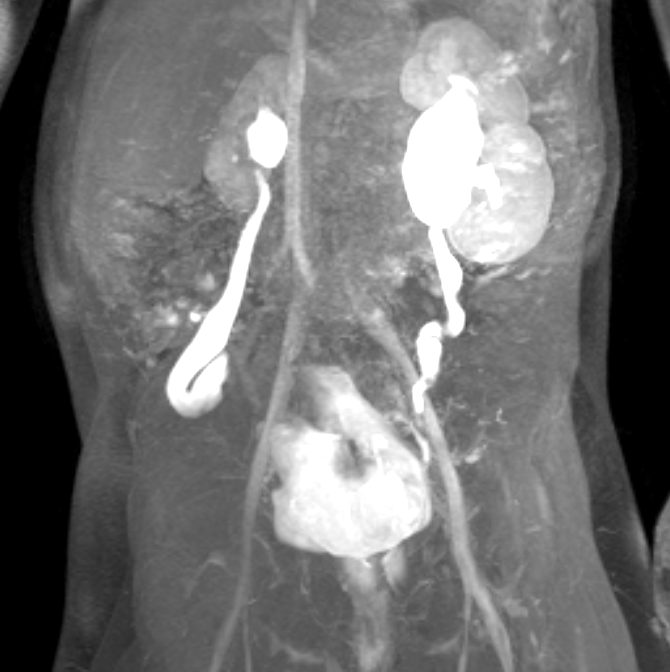
Figure 44 La série d’IRM dynamique après injection de contraste montre un rein droit de petite taille chez un patient présentant un syndrome de prune-belly et un reflux vésico-urétéral bilatéral.
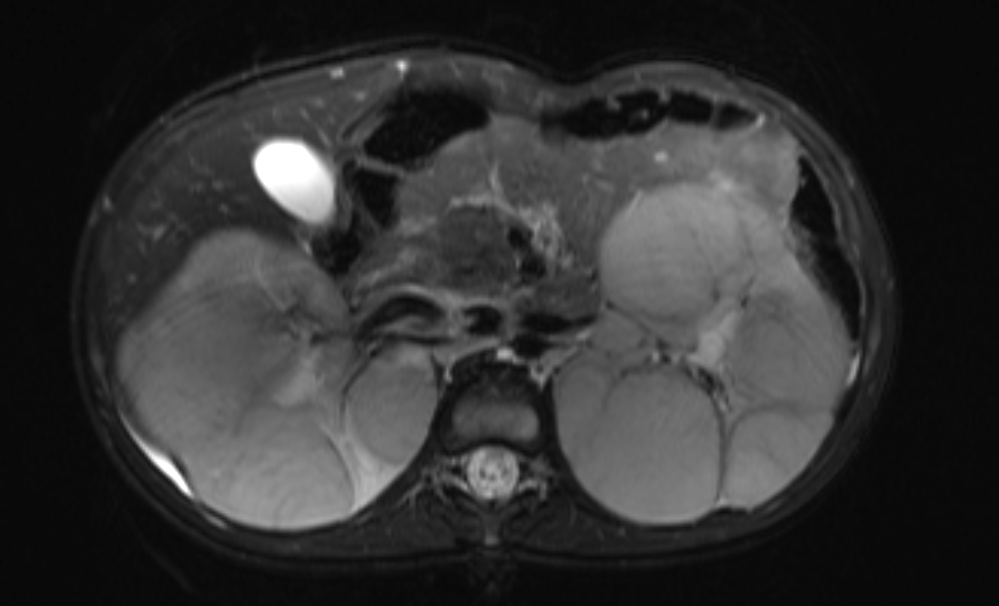
Figure 45 Image d’IRM sensible aux liquides avec suppression du signal de la graisse, montrant le remplacement du parenchyme rénal par de multiples masses chez un patient atteint de néphroblastomatose.
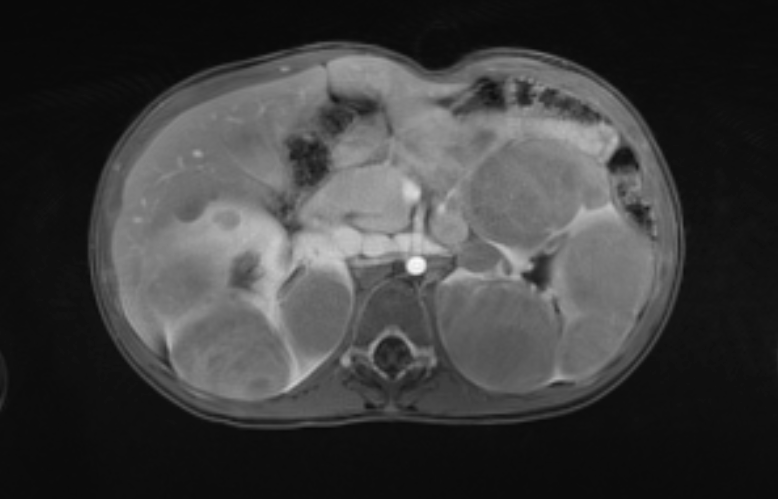
Figure 46 Les images d’IRM après injection de produit de contraste montrent les caractéristiques de rehaussement des masses.
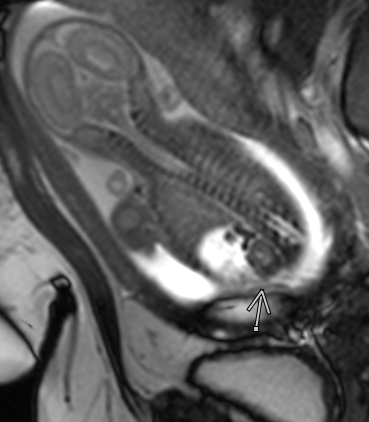
Figure 47 Vue d’un rein normal et d’une glande surrénale chez un fœtus présentant une ascite
Intervention en urologie pédiatrique
Les procédures interventionnelles font partie intégrante de la prise en charge des affections urologiques pédiatriques.23,24 La surspécialité de radiologie interventionnelle pédiatrique est distincte à la fois de la radiologie pédiatrique et de la radiologie interventionnelle de l’adulte, et les praticiens de radiologie interventionnelle pédiatrique restent peu nombreux, malgré une croissance au cours des quinze dernières années.25
Drainage des voies urinaires secondaire à une obstruction/néphrostomies
- Devrait être réservé aux patients chez qui l’approche de drainage rétrograde n’est pas possible
- La préparation pré-procédurale devrait inclure l’évaluation du risque de saignement et d’infection
- Antibioprophylaxie
- Accès au système collecteur rénal sous guidage échographique, fluoroscopique ou tomodensitométrique.
- Complications
- Hémorragie
- Sepsis
- Lésion d’organe
- Lésion thoracique (c.-à-d., pneumothorax)
Néphrolithotomie percutanée
- Réservée aux patients qui ne sont pas candidats à l’urétéroscopie ou à la lithotripsie par ondes de choc
- Procédure en deux temps
- Accès au système collecteur par le radiologue à l’aide de l’échographie/fluoroscopie
- Extraction du calcul par l’urologue
Autres interventions
- Mise en place d’une endoprothèse urétérale
- Dilatation urétérale secondaire à une sténose
- Biopsie des tumeurs rénales
- Embolisation des tumeurs rénales ou des hémorragies rénales
Lectures recommandées
- Brown BP, Simoneaux SF, Dillman JR, Rigsby CK, Iyer RS, Alazraki AL, et al.. ACR Appropriateness Criteria® Antenatal Hydronephrosis–Infant. J Am Coll Radiol 2020; 17 (11): S367–s379. DOI: 10.1016/j.jacr.2020.09.017.
- Chung EM, Soderlund KA, Fagen KE. Imaging of the Pediatric Urinary System. Radiol Clin North Am 2017; 55 (2): 337–357. DOI: 10.1016/j.rcl.2016.10.010.
- Dillman JR, Rigsby CK, Iyer RS, Alazraki AL, Anupindi SA, Brown BP, et al.. ACR Appropriateness Criteria® Hematuria-Child. J Am Coll Radiol 2018; 15 (5): S91–s103. DOI: 10.1016/j.jacr.2018.03.022.
- Dillman JR, Trout AT, Smith EA. MR urography in children and adolescents: techniques and clinical applications. Abdom Radiol (NY) 2016; 41 (6): 1007–1019. DOI: 10.1007/s00261-016-0669-z.
- Duran C, Beltrán VP, González A, Gómez C, Riego Jdel. Contrast-enhanced Voiding Urosonography for Vesicoureteral Reflux Diagnosis in Children. Radiographics 2017; 37 (6): 1854–1869. DOI: 10.1148/rg.2017170024.
- Chow JS, Koning JL, Back SJ, Nguyen HT, Phelps A, Darge K. Classification of pediatric urinary tract dilation: the new language. Pediatric Radiology 2017; 47: 1109–1115.
Références
- Strauss KJ, Goske MJ, Kaste SC, Bulas D, Frush DP, Butler P, et al.. Image Gently: Ten Steps You Can Take to Optimize Image Quality and Lower CT Dose for Pediatric Patients. AJR Am J Roentgenol 1976; 194 (4): 868–873. DOI: 10.2214/ajr.09.4091.
- Dillman JR, Rigsby CK, Iyer RS, Alazraki AL, Anupindi SA, Brown BP, et al.. ACR Appropriateness Criteria® Hematuria-Child. J Am Coll Radiol 2018; 15 (5): S91–s103. DOI: 10.1016/j.jacr.2018.03.022.
- Goodman TR, Mustafa A, Rowe E. Pediatric CT radiation exposure: where we were, and where we are now. Pediatr Radiol 2019; 49 (4): 469–478. DOI: 10.1007/s00247-018-4281-y.
- Kuebker J, Shuman J, Hsi RS, Herrell SD, Miller NL. Radiation From Kidney-Ureter-Bladder Radiographs Is Not Trivial. Urology 2019; 125: 46–49. DOI: 10.1016/j.urology.2018.11.035.
- Dong S-Z, Zhu M, Bulas D. Techniques for minimizing sedation in pediatric MRI. J Magn Reson Imaging 2019; 50 (4): 1047–1054. DOI: 10.1002/jmri.26703.
- Drugs ACRC on, Media C. ACR Manual On Contrast Media. American College of Radiology; 2022.
- Brown BP, Simoneaux SF, Dillman JR, Rigsby CK, Iyer RS, Alazraki AL, et al.. ACR Appropriateness Criteria® Antenatal Hydronephrosis–Infant. J Am Coll Radiol 2020; 17 (11): S367–s379. DOI: 10.1016/j.jacr.2020.09.017.
- Karmazyn BK, Alazraki AL, Anupindi SA, Dempsey ME, Dillman JR, Dorfman SR, et al.. ACR Appropriateness Criteria® Urinary Tract Infection–Child. J Am Coll Radiol 2018; 14 (5): S362–s371. DOI: 10.1016/j.jacr.2017.02.028.
- Kalish JM, Doros L, Helman LJ, Hennekam RC, Kuiper RP, Maas SM, et al.. Surveillance Recommendations for Children with Overgrowth Syndromes and Predisposition to Wilms Tumors and Hepatoblastoma. Clin Cancer Res 2017; 23 (13): e115–e122. DOI: 10.1158/1078-0432.ccr-17-0710.
- Wang CL, Aryal B, Oto A, Allen BC, Akin O, Alexander LF, et al.. ACR Appropriateness Criteria® Acute Onset of Scrotal Pain-Without Trauma, Without Antecedent Mass. J Am Coll Radiol 2019; 16 (5): S38–s43. DOI: 10.1016/j.jacr.2019.02.016.
- Rerksuppaphol S, Barnes G. Guidelines for Evaluation and Treatment of Gastroesophageal Reflux In Infants and Children: Recommendations of the North American Society for Pediatric Gastroenterology and Nutrition. J Pediatr Gastroenterol Nutr 2006; 35 (4): 583. DOI: 10.1097/00005176-200210000-00024.
- Chung EM, Soderlund KA, Fagen KE. Imaging of the Pediatric Urinary System. Radiol Clin North Am 2017; 55 (2): 337–357. DOI: 10.1016/j.rcl.2016.10.010.
- Barnewolt CE, Acharya PT, Aguirre Pascual E, Back SJ, Beltrán Salazar VP, Chan PKJ, et al.. Contrast-enhanced voiding urosonography part 2: urethral imaging. Pediatr Radiol 2021; 51 (12): 2368–2386. DOI: 10.1007/s00247-021-05116-6.
- Duran C, Beltrán VP, González A, Gómez C, Riego Jdel. Contrast-enhanced Voiding Urosonography for Vesicoureteral Reflux Diagnosis in Children. Radiographics 2017; 37 (6): 1854–1869. DOI: 10.1148/rg.2017170024.
- Sheehy N, Tetrault TA, Zurakowski D, Vija AH, Fahey FH, Treves ST. Pediatric 99mTc-DMSA SPECT Performed by Using Iterative Reconstruction with Isotropic Resolution Recovery: Improved Image Quality and Reduced Radiopharmaceutical Activity. Radiology 2009; 251 (2): 511–516. DOI: 10.1148/radiol.2512081440.
- Wood LN, Souders CE, Freedman AL. Is a Reassuring MAG-3 Diuretic Renal Scan Really Reassuring? Curr Urol 2014; 8 (4): 178–182. DOI: 10.1159/000365713.
- Rodger F, Roditi G, Aboumarzouk OM. Diagnostic Accuracy of Low and Ultra-Low Dose CT for Identification of Urinary Tract Stones: A Systematic Review. Urol Int 2018; 100 (4): 375–385. DOI: 10.1159/000488062.
- Voss SD. Staging and following common pediatric malignancies: MRI versus CT versus functional imaging. Pediatr Radiol 2018; 48 (9): 1324–1336. DOI: 10.1007/s00247-018-4162-4.
- Darge K, Anupindi SA, Jaramillo D. MR Imaging of the Abdomen and Pelvis in Infants, Children, and Adolescents. Radiology 2011; 261 (1): 12–29. DOI: 10.1148/radiol.11101922.
- Calvo-Garcia MA, Kline-Fath BM, Levitt MA, Lim F-Y, Linam LE, Patel MN, et al.. Fetal MRI clues to diagnose cloacal malformations. Pediatr Radiol 2011; 41 (9): 1117–1128. DOI: 10.1007/s00247-011-2020-8.
- Hwang JY, Shin JH, Lee YJ, Yoon HM, Cho YA, Kim KS. Percutaneous nephrostomy placement in infants and young children. Diagn Interv Imaging 2018; 99 (3): 157–162. DOI: 10.1016/j.diii.2017.07.002.
- Sweed Y, Singer-Jordan J, Papura S, Loberant N, Yulevich A. Use of angiographic embolization in pediatric abdominal trauma-induced solid organ injuries. Ulus Travma Acil Cerrahi Derg 2016; 8 (11): 65–68. DOI: 10.5505/tjtes.2018.00056.
- Kaufman CS, James CA, Harned RK, Connolly BL, Roebuck DJ, Cahill AM, et al.. Pediatric interventional radiology workforce survey: 10-year follow-up. Pediatr Radiol 2017; 47 (6): 651–656. DOI: 10.1007/s00247-017-3796-y.
- Pierce CB, Muñoz A, Ng DK, Warady BA, Furth SL, Schwartz GJ. Age- and sex-dependent clinical equations to estimate glomerular filtration rates in children and young adults with chronic kidney disease. Kidney Int 2021; 99 (4): 948–956. DOI: 10.1016/j.kint.2020.10.047.
- Dillman JR, Trout AT, Smith EA. MR urography in children and adolescents: techniques and clinical applications. Abdom Radiol (NY) 2016; 41 (6): 1007–1019. DOI: 10.1007/s00261-016-0669-z.
- Chow JS, Koning JL, Back SJ, Nguyen HT, Phelps A, Darge K. Classification of pediatric urinary tract dilation: the new language. Pediatric Radiology 2017; 47: 1109–1115.
Dernière mise à jour: 2025-09-21 21:31