43: Tumores malignos de vejiga
Este capítulo durará aproximadamente 14 minutos para leer.
Introducción
Carcinoma de células uroteliales (CCU) en la población pediátrica es muy raro, con una incidencia de aproximadamente 0.1%-0.4%. Una revisión de 2019 encontró solo 243 casos documentados de CCU en pacientes <18 años de edad, con una edad media de 12.5 años, y existe un predominio masculino (3:1). En general, se considera que la recurrencia del CCU en la población pediátrica es baja (8.6%) y la muerte muy infrecuente, <4%. Dada su rareza, no existen guías publicadas sobre el diagnóstico y el manejo del CCU en la población pediátrica. Este capítulo tiene como objetivo describir la etiología y la patogénesis, la evaluación y el diagnóstico, el manejo y el seguimiento del CCU pediátrico según la literatura publicada actualmente.
Etiología/Patogénesis
Existen factores de riesgo bien definidos para el desarrollo de UCC en adultos, entre ellos el tabaquismo; la exposición a diversos productos químicos ocupacionales, como los tintes de anilina y sustancias de la industria textil; la fenacetina; y la exposición a quimioterapia o radiación. También se han vinculado afecciones genéticas con el desarrollo de UCC vesical en adultos, a saber, el síndrome de Lynch, la enfermedad de Cowden y la presencia de UCC en un familiar de primer grado. En niños, los factores de riesgo genéticos y ambientales no están bien estudiados y se extrapolan a partir de los de adultos. La exposición temprana al tabaco, los síndromes de predisposición al cáncer (p. ej., síndrome de Costello), el desarrollo vesical anómalo, la exposición a radiación, la exposición a ciclofosfamida y las infecciones parasitarias se han considerado factores de riesgo atribuibles para el desarrollo de UCC en niños. No obstante, a pesar de esto, en casi el 87% de los pacientes pediátricos con UCC no se identifican factores de riesgo conocidos evidentes.
Los factores de riesgo de recidiva y de muerte relacionada con el cáncer de vejiga en la población pediátrica incluyen antecedentes familiares de UCC, histología de alto grado y tumores de mayor tamaño al diagnóstico. La recidiva y la muerte son poco frecuentes, por lo que, nuevamente, estos factores se extrapolan en general de la literatura en adultos.
Evaluación y diagnóstico
Presentación del paciente
Al igual que en los adultos, los pacientes pediátricos suelen presentarse con hematuria macroscópica indolora (90%), aunque los síntomas miccionales irritativos, como disuria, polaquiuria y urgencia miccional, también pueden ser frecuentes. Se ha informado un retraso en el diagnóstico de al menos 1 año en hasta el 26% de los pacientes, dada la rareza de este diagnóstico en niños y el carácter generalmente benigno de los diagnósticos diferenciales de hematuria macroscópica en un niño (p. ej., uretrorragia benigna, traumatismos, infecciones del tracto urinario, anomalías urológicas congénitas, enfermedad renal intrínseca, disfunción miccional, etc.).
El UCC suele presentarse como un tumor vesical solitario en niños en comparación con la multifocalidad en adultos (94% vs. 6%). El 93.4% de los tumores son de bajo grado (pTa o pT1), y por lo general no hay evidencia de afectación ganglionar ni de metástasis. Tabla 1 describe la estadificación del cáncer de vejiga según el Comité Conjunto Estadounidense sobre el Cáncer (AJCC).
Tabla 1 Estadificación del carcinoma urotelial según la AJCC
| Estadio T | Descripción |
|---|---|
| Ta | Carcinoma papilar no invasivo |
| Tis | Carcinoma in situ (CIS) |
| T1 | Tumor invade la lámina propia |
| T2 | Tumor invade la muscular propia |
| T2a | Tumor invade la muscular propia superficial (mitad interna) |
| T2b | Tumor invade la muscular propia profunda (mitad externa) |
| T3 | Tumor invade el tejido/grasa perivesical |
| T3a | Tumor invade el tejido/grasa perivesical microscópicamente |
| T3b | Tumor invade el tejido graso perivesical macroscópicamente (masa extravesical) |
| T4 | Tumor invade la próstata, el útero, la vagina, la pared pélvica o la pared abdominal |
| T4a | Tumor invade órganos adyacentes (útero, ovarios, estroma prostático) |
| T4b | Tumor invade la pared pélvica y/o la pared abdominal |
Evaluación inicial
Las guías de la AUA de 2020 sobre carcinoma urotelial no músculo invasivo (UCC) establecen recomendaciones claras para la evaluación de pacientes adultos con hematuria macroscópica, que incluyen cistoscopia, estudios de imagen del tracto urinario superior con urografía por TC o RM y, ocasionalmente, el uso de citología urinaria. Dada la evolución natural del UCC en pacientes pediátricos, es decir, tumores generalmente de bajo grado que no recurren, el estudio inicial de un paciente pediátrico con hematuria macroscópica suele abordarse de manera menos agresiva.
La evaluación debe comenzar con una historia clínica y un examen físico. Las pruebas diagnósticas adicionales en la primera visita incluyen análisis de orina (con especial atención a la presencia y cantidad de hematíes y a indicadores de infección como la esterasa leucocitaria, los nitritos y las bacterias), urocultivo y ecografía renal y vesical.
El análisis de orina puede confirmar la hematuria microscópica en curso y ayudar a descartar otras causas potenciales de hematuria, incluidas la enfermedad renal médica o la infección. El urocultivo confirmaría la ausencia de infección. La ecografía vesicorrenal puede determinar la anatomía del tracto urinario superior e inferior y evaluar posibles causas de hematuria macroscópica. Dado el menor tamaño corporal de los niños, esta modalidad puede ser muy sensible para detectar tumores luminales pequeños.
Imágenes, cistoscopia y citología
En la población adulta, la cistoscopia es el estándar de referencia para la detección de tumores vesicales y la evaluación de las vías urinarias superiores mediante urografía por TC o por RM es el método estándar para obtener imágenes de las vías urinarias superiores. En la población pediátrica hay consideraciones que deben sopesarse, incluida la necesidad de anestesia general para la cistoscopia, sedación para estudios con TC o RM y la exposición a la radiación con la TC.
Se han realizado algunos estudios que evalúan la sensibilidad y la especificidad de la ecografía en la evaluación del tracto urinario superior e inferior para la detección de masas en niños. La ecografía vesical ha demostrado una sensibilidad del 83-93% para detectar tumores vesicales, con una especificidad del 93-100%, y ha detectado lesiones vesicales tan pequeñas como 5mm. Al considerar la dosis de radiación acumulada que un paciente pediátrico puede recibir por la vigilancia de UCC a lo largo de muchos años, la ecografía se convierte en una modalidad atractiva tanto como prueba de cribado inicial al presentarse con hematuria macroscópica como también para la vigilancia de la recurrencia de masa tras la resección.
La cistoscopia está indicada para pacientes en los que se detectó una lesión vesical en la ecografía o para aquellos con hematuria persistente sin otra explicación. En pacientes pediátricos, los tumores suelen ser solitarios, no invasivos y aproximadamente el 52% se encuentran en las paredes laterales (Figura 1) La cistoscopia en niños requiere anestesia, por lo tanto, la cistoscopia suele realizarse junto con la resección transuretral del tumor vesical (TURBT) como parte prevista del procedimiento. Se requiere tejido para establecer un diagnóstico y la profundidad de invasión (estadio T). Este también es el tratamiento inicial para extirpar todo el tumor.
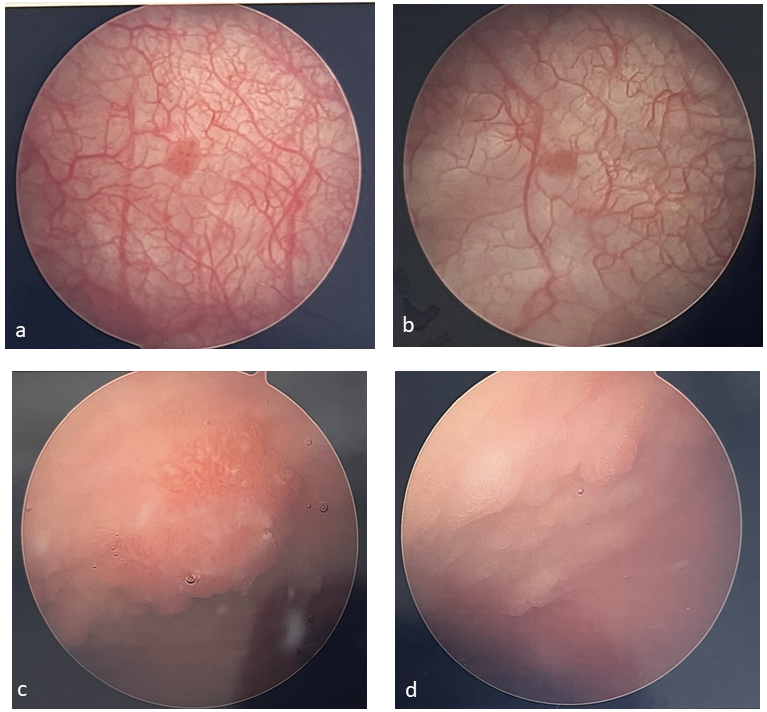 Figura 1 Ejemplos de tumores vesicales. Los tumores vesicales suelen ser solitarios y papilares (a, b) y pueden ser más difíciles de identificar en pacientes que han sido sometidos a aumento vesical (c, d).
Figura 1 Ejemplos de tumores vesicales. Los tumores vesicales suelen ser solitarios y papilares (a, b) y pueden ser más difíciles de identificar en pacientes que han sido sometidos a aumento vesical (c, d).
La citología urinaria tiene un papel mínimo en los pacientes pediátricos, ya que estos tumores vesicales suelen ser de bajo grado y la sensibilidad de la citología para los tumores de bajo grado es bastante baja.
Manejo
La recurrencia del cáncer de vejiga en la población pediátrica es baja y las tasas de supervivencia a 5 años son favorables, del 97,3%. Debido a estas diferencias, el manejo difiere significativamente del de los adultos. Sin embargo, existen algunas similitudes entre ambas poblaciones y, por lo tanto, hay algunos aspectos del manejo que se comparten.
Resección transuretral de tumor vesical (TURBT)
Al igual que en los adultos, la resección transuretral es a la vez diagnóstica y terapéutica. Esto requiere la resección de todo tumor macroscópicamente evidente, con una profundidad suficiente para obtener muestras del músculo detrusor subyacente. Esto es necesario para reducir el riesgo de recurrencia y también para una estadificación adecuada. Las TURBT que requieren un resectoscopio pueden ser inviables en pacientes pequeños, ya que las asas del resectoscopio pueden ser muy difíciles de manejar en endoscopios de menor calibre. Algunos niños pueden requerir biopsia con pinza de copa fría y fulguración de la base del tumor, aunque se debe tener cuidado de obtener biopsias de tejido profundo para muestreo del detrusor. También debe realizarse el examen bimanual de la vejiga en el momento de la TURBT para completar la estadificación.
Terapia intravesical
En general, la instilación de quimioterapia perioperatoria no se utiliza en pacientes pediátricos. Los pacientes pediátricos que presentan tumores de mayor grado y estadio probablemente se comporten de manera más similar al UCC en adultos y, por lo tanto, puede ser mejor tratarlos como tales, aunque no existen estudios prospectivos de este escenario poco frecuente. Estos pacientes pueden requerir quimioterapia intravesical y protocolos de vigilancia como los de adultos descritos por las organizaciones AUA y NCCN. Existen algunos informes sobre el uso pos-TURBT de instilación intravesical de BCG, mitomicina o epirrubicina en pacientes pediátricos con cáncer de vejiga. En general, las dosis y los esquemas han sido los descritos en adultos, con pocos eventos adversos graves. La terapia intravesical suele reservarse para pacientes con enfermedad de alto grado o recurrente, pero los datos se limitan a reportes de casos, por lo que no hay datos claros para establecer un papel bien definido en este momento.
Seguimiento y vigilancia
Las guías para adultos tienen regímenes agresivos, claros y establecidos para la vigilancia y el manejo de las recurrencias, ya que esto es habitual. Sin embargo, en niños no existen recomendaciones claras debido a la rareza de este tumor y a que la recurrencia es aún más infrecuente. Una revisión de 2019 reportó una tasa de recurrencia de solo 8.6%, una diferencia significativa con respecto a los adultos.
En general, el tipo y la programación de la vigilancia deben adaptarse según el riesgo de recaída del niño. Deben considerarse el número de lesiones, el estadio y el grado patológicos, el tamaño tumoral, los antecedentes de recurrencia y la edad. La vigilancia periódica con ecografía es una opción razonable para los niños con cáncer de vejiga diagnosticado debido a su alta sensibilidad y naturaleza no invasiva. La cistoscopia puede realizarse posteriormente si se detecta una lesión. Puede requerirse cistoscopia de vigilancia rutinaria a pesar de ecografías normales en pacientes pediátricos de mayor riesgo (p. ej., lesiones múltiples, lesiones de alto grado, recurrencia, mayor edad, etc.). Al igual que en el momento del diagnóstico, es poco probable que la citología urinaria aporte mucho beneficio dado que los niños suelen tener tumores de bajo grado y bien diferenciados.
A diferencia de los protocolos para adultos, no existen datos que orienten la duración del seguimiento en niños con UCC. Una amplia revisión de la literatura encontró que, si llegara a presentarse una recurrencia o un fallecimiento relacionados con UCC de bajo grado/estadio, lo más probable es que ocurra en el primer año tras el diagnóstico inicial. Se determinó que el tiempo promedio hasta la recurrencia o el fallecimiento fue de 8.6 meses.
Tabla 2 Cronograma de vigilancia para UCC vesical de bajo grado y bajo estadio en pacientes pediátricos (adaptado por Rezaee et al)1
| 0-12 meses | 18-24 meses | 36-48 meses | >60 meses | |
|---|---|---|---|---|
| Ecografía | Cada 3 meses | Cada 6 meses | Anualmente | A discreción del proveedor |
| Análisis de orina | Cada 3 meses | Cada 6 meses | Anualmente | A discreción del proveedor |
| Cistoscopia | Cada 3 meses | Cada 6 meses | +/- Anualmente | A discreción del proveedor |
| Citología | — | — | — | — |
Además, es muy improbable que ocurra una recidiva o un fallecimiento más allá de tres años después del diagnóstico y tratamiento iniciales. La recidiva más remota publicada se presentó a los 32 meses tras el diagnóstico inicial. Rezaee et al. describieron un posible programa de vigilancia para UCC de bajo grado y bajo estadio basado en una cohorte de una revisión de la literatura de 2019, y esto se resume en la Tabla 2. Es importante señalar que este programa de vigilancia no ha sido estudiado rigurosamente mediante un estudio prospectivo aleatorizado que demuestre su seguridad y se presenta únicamente como punto de partida para la enfermedad de bajo grado/estadio.
Tumores vesicales en la población con vejiga neurógena
El seguimiento a largo plazo de pacientes con vejiga neurogénica congénita (es decir, espina bífida, extrofia vesical, etc.) ha identificado que esta población presenta un riesgo particularmente elevado de desarrollar cáncer de vejiga (incidencia estimada de aproximadamente el 4%). A diferencia del cáncer de vejiga en la población con vejiga no neurogénica, esta cohorte suele diagnosticarse de forma incidental y presenta una mayor incidencia de adenocarcinoma (50%). La gran mayoría de los pacientes se presenta con enfermedad localmente avanzada o diseminada (>70%) y la supervivencia es pobre. El diagnóstico a menudo se realiza en estadios avanzados de la enfermedad y los desenlaces son desfavorables.
La hipótesis inicial para este mayor riesgo de cáncer de vejiga se centraba en la cistoplastia de aumento como factor de riesgo. Si bien los segmentos gástricos ciertamente aumentan el riesgo posterior de malignidad, el aumento con otros segmentos intestinales no parece aumentar el riesgo de malignidad. A través de varios estudios retrospectivos, ahora parece que el riesgo de malignidad se debe a la propia vejiga congénita más que al aumento.
Cuando se publicaron por primera vez descripciones iniciales de neoplasias malignas avanzadas y mortales en esta población, se sugirieron y luego se estudiaron diversas medidas con el objetivo de detectar más precozmente estos tumores. Lamentablemente, ninguna ha demostrado ser beneficiosa. La cistoscopia anual tiene un bajo rendimiento diagnóstico y, incluso en pacientes con un cribado normal, sí se desarrolló cáncer vesical avanzado. Se sugirió que, si la cistoscopia pudiera detectar todas las neoplasias malignas, habría que realizar 980 para diagnosticar un solo caso de cáncer a lo largo de 10 años de seguimiento. La citología urinaria tiene poco valor en esta población debido a la piuria crónica, las cateterizaciones intermitentes y la descamación esperada de células entéricas, y además presenta una alta tasa de falsos positivos. Al incluir la efectividad de las medidas de cribado anteriores, parece que el aumento en la esperanza de vida fue de solo 2.3 meses y el costo de por vida fue de >$55,000 per cápita. Esto se debe principalmente a las bajas tasas de malignidad y al gran número de pruebas de cribado necesarias para detectar un solo caso de malignidad, independientemente del estadio al diagnóstico.
El protocolo de Husmann se ha adoptado ampliamente para guiar el seguimiento de los pacientes con vejiga neurógena, tanto para la detección de malignidad como para la evaluación rutinaria de pacientes con o sin reconstrucción vesical (Figura 2) Esto implica una evaluación anual de infecciones del tracto urinario, hematuria, dolor vesical/pélvico/en el flanco y nueva incontinencia. Si hay alguna anomalía o cambios con respecto a la situación basal, se deben considerar cultivo de orina, cistoscopia y tomografía computarizada (TC) ± estudios urodinámicos. Todos los pacientes deben contar con determinación anual de creatinina/cistatina C, electrolitos, nivel sérico de vitamina B12 y análisis de orina. De igual manera, si hay <50 eritrocitos/hpf, se debe solicitar una ecografía renal/vesical. Si la ecografía es anormal, si hay hematuria macroscópica o ≥50 eritrocitos/hpf, entonces se deben considerar cultivo de orina, cistoscopia, tomografía computarizada (TC) ± estudios urodinámicos. Para los pacientes con segmentos de colon, la cistoscopia de rutina para el cribado de cáncer de colon debe iniciarse a los 50 años.
Figura 2 Protocolo de Husmann para la vigilancia del cáncer de vejiga en pacientes con cistoplastia de aumento.2
Puntos clave
- El cáncer de vejiga en pacientes pediátricos es poco frecuente
- Actualmente no existen factores de riesgo bien definidos para el desarrollo del cáncer de vejiga pediátrico, pero los factores de riesgo de los adultos se extrapolan y a menudo se aplican a esta población
- La mayoría de los pacientes pediátricos con cáncer de vejiga se presentan con hematuria macroscópica indolora o síntomas miccionales irritativos
- La mayoría de los carcinomas uroteliales pediátricos son de bajo grado, de estadio bajo y no recurren
- La evaluación inicial debe comenzar con anamnesis y examen físico, análisis de orina, urocultivo y ecografía vesical/renal
- La ecografía vesical tiene excelente sensibilidad y especificidad para la detección de tumores vesicales y debe considerarse como modalidad de cribado
- No hay indicación para la citología urinaria, ya que la mayoría de los carcinomas uroteliales pediátricos son de bajo grado
- Si se identifica una lesión en la ecografía, debe realizarse cistoscopia con resección transuretral de tumor vesical (RTU-V)
- La resección transuretral de tumor vesical debe incluir toma de muestra del detrusor para una estadificación adecuada
- El papel de la quimioterapia intravesical no está claro, pero es una consideración razonable en pacientes con enfermedad de estadio alto, de alto grado o recurrente
- Los pacientes pediátricos con carcinoma urotelial deben someterse a vigilancia al menos durante los primeros 3 años tras el diagnóstico, pero la vigilancia más allá de este periodo puede ser innecesaria
- Los pacientes con vejiga neurógena congénita (VNC) tienen mayor riesgo de cáncer de vejiga y este riesgo no se asocia con la ampliación vesical, salvo cuando se emplean segmentos gástricos; la histología suele ser adenocarcinoma
- Los pacientes con VNC suelen presentarse de forma incidental con tumores de estadio más alto y localmente avanzados, con mala supervivencia
- El cribado rutinario con cistoscopia y citología urinaria no es beneficioso y no se recomienda
- Se recomienda el protocolo de Husmann para el seguimiento de los pacientes con VNC, con el objetivo de identificar de manera dirigida a los pacientes con mayor riesgo de malignidad (hematuria, aumento de infecciones del tracto urinario, dolor, nueva incontinencia, anomalías en laboratorio/imágenes)
Conclusión
El cáncer de vejiga en pacientes pediátricos es poco frecuente y, en general, conlleva un buen pronóstico. La mayoría de los tumores son solitarios, de bajo grado y no recidivan. El estudio debe iniciarse con historia clínica y examen físico, análisis de orina, urocultivo y ecografía vesical/renal, con cistoscopia posterior y TURBT de la lesión vesical. La quimioterapia intravesical a menudo puede evitarse dada la patología de bajo grado. En tumores de alto grado o de estadio más avanzado, o en tumores recurrentes, puede considerarse la quimioterapia intravesical; sin embargo, actualmente no existen guías basadas en la evidencia sobre su uso en niños. Los pacientes deben mantenerse en seguimiento durante al menos 3 años con una combinación de análisis de orina periódicos, ecografías vesicales/renales y cistoscopia. La vigilancia más allá de 3 años puede no ser necesaria, pero debe utilizarse la toma de decisiones compartida para determinar esta duración.
Videos recomendados
Referencias
- Karatzas A, Tzortzis V. Lower urinary tract symptoms and bladder cancer in children: The hidden scenario. Urol Ann 2019; 11 (1): 102–104. DOI: 10.4103/UA.UA_60_18.
- Rezaee ME, Dunaway CM, Baker ML, Penna FJ, Chavez DR. Urothelial cell carcinoma of the bladder in pediatric patients: a systematic review and data analysis of the world literature. Journal of Pediatric Urology 2019; 15 (4): 309–314. DOI: 10.1016/j.jpurol.2019.06.013.
- Lerena J, Krauel L, García-Aparicio L, Vallasciani S, Suñol M, Rodó J. Transitional cell carcinoma of the bladder in children and adolescents: Six-case series and review of the literature. Journal of Pediatric Urology 2010; 6 (5): 481–485. DOI: 10.1016/j.jpurol.2009.11.006.
- Egbers L, Grotenhuis AJ, Aben KK, Alfred Witjes J, Kiemeney LA, Vermeulen SH. The prognostic value of family history among patients with urinary bladder cancer. Int J Cancer 2015; 136 (5): 1117–1124. DOI: 10.1002/ijc.29062.
- Wild P, Giedl J, Stoehr R. Genomic aberrations are rare in urothelial neoplasms of patients 19 years or younger. The Journal of Pathology 2007; 211 (1): 18–25. DOI: 10.1002/path.2075.
- Fine SW, Humphrey PA, Dehner LP, Amin MB, Epstein JI. Urothelial Neoplasms In Patients 20 Years or Younger: A Clinicopathological Analysis Using The World Health Organization 2004 Bladder Consensus Classification. Journal of Urology 2005; 174 (5): 1976–1980. DOI: 10.1097/01.ju.0000176801.16827.82.
- Paner GP, Zehnder P, Amin AM, Husain AN, Desai MM. Urothelial Neoplasms of the Urinary Bladder Occurring in Young Adult and Pediatric Patients: A Comprehensive Review of Literature With Implications for Patient Management. Adv Ant Pathol 18 (1): 79–89.
- Bladder Cancer: Non-Muscle Invasive Guideline - American Urological Association. .
- Gharibvand MM, Kazemi M, Motamedfar A, Sametzadeh M, Sahraeizadeh A. The role of ultrasound in diagnosis and evaluation of bladder tumors. J Family Med Prim Care 2017; 6 (4): 840–843. DOI: 10.4103/jfmpc.jfmpc_186_17.
- Berretini A, Castagnetti M, Salerno A. Bladder urothelial neoplasms in pediatric age: Experience at three tertiary centers. Journal of Pediatric Urology 2015; 11: 26 1–26 5. DOI: 10.1016/j.jpurol.2014.08.008.
- D DC, A F, K P. Management and follow-up of urothelial neoplasms of the bladder in children: A report from the TREP project. Pediatric Blood & Cancer 2015; 62 (6): 1000–1003. DOI: 10.1002/pbc.25380.
- ElSharnoby O, Fraser N, Williams A, Scriven S, Shenoy M. Bladder urothelial cell carcinoma as a rare cause of haematuria in children: Our experience and review of current literature. Journal of Pediatric Surgery Published Online September 2021; 17. DOI: 10.1016/j.jpedsurg.2021.09.007.
- Saltsman JA, Malek MM, Reuter VE. Urothelial neoplasms in pediatric and young adult patients: A large single-center series. Journal of Pediatric Surgery 2018; 53 (2): 306–309. DOI: 10.1016/j.jpedsurg.2017.11.024.
- Rague JT, High-grade LRSM. Nonmuscle Invasive Urothelial Carcinoma in a Prepubertal Patient With TURBT and Intravesical BCG. Urology 2019; 124: 257–259. DOI: 10.1016/j.urology.2018.10.028.
- Peard L, Stark T, Ziada A, Saltzman AF. Recurrent Bladder Cancer in a Teenage Male. Urology 2020; 141: 135–138. DOI: 10.1016/j.urology.2020.04.031.
- Soergel TM, Cain MP, Misseri R, Gardner TA, Koch MO, Rink RC. TRANSITIONAL CELL CARCINOMA OF THE BLADDER FOLLOWING AUGMENTATION CYSTOPLASTY FOR THE NEUROPATHIC BLADDER. The Journal of Urology 2004; 172 (4, Supplement): 1649–1652. DOI: 10.1097/01.ju.0000140194.87974.56.
- Austin JC, Elliott S, Cooper CS. Patients With Spina Bifida and Bladder Cancer: Atypical Presentation, Advanced Stage and Poor Survival. The Journal of Urology 2007; 178 (3): 798–801. DOI: 10.1016/j.juro.2007.05.055.
- Rove K, Higuchi T. Monitoring and malignancy concerns in patients with congenital bladder anomalies. Current Opinion in Urology 2016; 26 (4): 344–350. DOI: 10.1097/MOU.0000000000000297.
- Husmann D, Fox J, Higuchi T. Malignancy following bladder augmentation:recommendations for long-term follow-up and cancer screening. AUA Update Ser 2011; 30 (24): 222–227.
- Higuchi TT, Fox JA, Husmann DA. Annual Endoscopy and Urine Cytology for the Surveillance of Bladder Tumors After Enterocystoplasty for Congenital Bladder Anomalies. The Journal of Urology 2011; 186 (5): 1791–1795. DOI: 10.1016/j.juro.2011.07.028.
- Hamid R, Greenwell TJ, Nethercliffe JM, Freeman A, Venn SN, Woodhouse CRJ. Routine surveillance cystoscopy for patients with augmentation and substitution cystoplasty for benign urological conditions: is it necessary? BJU International 2009; 104 (3): 392–395. DOI: 10.1111/j.1464-410X.2009.08401.x.
- Kokorowski PJ, Routh JC, Borer JG, Estrada CR, Bauer SB, Nelson CP. Screening for Malignancy After Augmentation Cystoplasty in Children With Spina Bifida: A Decision Analysis. The Journal of Urology 2011; 186 (4): 1437–1443. DOI: 10.1016/j.juro.2011.05.065.
Última actualización: 2025-09-21 13:35