38: Anomalía cloacal
Este capítulo durará aproximadamente 28 minutos para leer.
Introducción
Las anomalías anorrectales comprenden un espectro de malformaciones congénitas que afectan al recto y al ano. A los niños con malformaciones anorrectales (ARM) a menudo se les diagnostica “ano imperforado” porque no hay una abertura donde debería estar la abertura anal normal. Esto simplifica en exceso la patología subyacente, que con frecuencia afecta al sistema urogenital, la columna vertebral y la musculatura del suelo pélvico. En un extremo del espectro se encuentran anomalías leves en las que el canal anal está presente, pero el ano está desplazado anteriormente o cubierto por piel perineal. Con malformaciones más graves, el recto no llega al periné y en su lugar se conecta al tracto genitourinario.
La manifestación más grave de la malformación anorrectal en niñas es una malformación cloacal en la que el recto, la uretra y la vagina se unen para formar un único canal confluente que se abre al periné. Clásicamente, el orificio perineal en una cloaca se localiza anteriormente en el periné, en el sitio donde normalmente se abre la uretra. Las anomalías cloacales posteriores son una variante poco frecuente en la que el orificio está desviado posteriormente, con el seno urogenital que se inserta en o inmediatamente anterior a un recto ortotópico.1,2
Embriología y Epidemiología
La malformación cloacal ocurre en aproximadamente 1 de cada 25,000–50,000 nacidos vivos. La causa embriológica no se comprende por completo, pero implica la división fallida de la cloaca primitiva por el tabique urorectal y los pliegues de Rathke durante la gestación temprana.3 La septación cloacal anómala se asocia con el desarrollo anormal de otros sistemas orgánicos que se forman en estrecha proximidad temporal y espacial, incluidos las vértebras, los uréteres, los riñones y los derivados del conducto de Müller. Cuando un niño nace con una ARM, existe un riesgo del 1% de que los futuros hermanos presenten una ARM.4
En la malformación cloacal, la vagina, el recto y la uretra se combinan en un único conducto común. Puede desarrollarse hidrocolpos cuando la vagina se llena de orina y moco, y la cavidad vaginal distendida puede causar obstrucción del tracto urinario mediante compresión externa de los uréteres o de la salida vesical. Las pacientes con un conducto común largo (> 3 cm) tienen más probabilidades de presentar displasia sacra y anomalías congénitas adicionales, una musculatura esfinteriana rectal y urinaria deficiente, y es más probable que requieran una reconstrucción quirúrgica más compleja, incluida la reconstrucción vaginal.
Patogénesis y anomalías asociadas
Las anomalías urológicas en pacientes con malformaciones anorrectales son frecuentes y están ampliamente infravaloradas. Son particularmente prevalentes en las niñas con malformación cloacal. Los pediatras, los cirujanos pediátricos y los urólogos deben ser conscientes de la alta incidencia de comorbilidad urológica en estos pacientes, y todos los pacientes deben ser sometidos a un cribado de anomalías genitourinarias. Las tasas reportadas de anomalías genitourinarias asociadas en pacientes con ARM varían ampliamente, del 18 al 85%.5 Esta variabilidad puede atribuirse en gran medida a diferencias en la exhaustividad del cribado. La mayoría de las series con protocolos de cribado activos informan una prevalencia de alrededor del 50% en todos los tipos de ARM, con tasas crecientes de anomalías urológicas en los subtipos de ARM más graves.6 Las malformaciones cloacales son el subtipo más grave de malformación anorrectal femenina, y la gran mayoría de estas pacientes presentará comorbilidades genitourinarias (Tabla 1). Esto subraya la importancia de incluir a los urólogos como miembros fundamentales del equipo multidisciplinario necesario para la atención de pacientes con malformaciones anorrectales.5,7
Tabla 1 Prevalencia de anomalías urológicas en 712 niños con malformaciones anorrectales (ARM) tratados en el Nationwide Children’s Hospital, Columbus, Ohio. La prevalencia de la mayoría de las anomalías urológicas notificadas aumenta con la creciente gravedad de la ARM. Entre corchetes se informan los rangos de prevalencia, que van desde ARM leves (perineales) hasta ARM graves (cloaca de canal largo en mujeres, fístula del cuello vesical en varones). Las anomalías sin diferencias entre los tipos de ARM se indican con un asterisco y no se informa ningún rango. La disfunción del tracto urinario inferior y las anomalías müllerianas no se incluyeron en este análisis. Adaptado de Fuchs et al 2021.6
| Anomalía urológica | Cloaca < 3 cm (n=55) |
Cloaca > 3 cm (n=60) |
|---|---|---|
| >1 diagnóstico urológico | 72.7% | 93.9% |
| >2 diagnósticos urológicos | 36.4% | 71.7% |
| Hidronefrosis | 47.3% | 76.7% |
| Reflujo vesicoureteral | 21.8% | 31.8% |
| Riñón único | 12.7% | 25.0% |
| Anomalía de fusión renal | 7.3% | 11.7% |
| Riñón dúplex | 5.5% | 8.3% |
Anomalías del tracto urinario superior
Las anomalías anatómicas coexistentes del tracto urinario superior e inferior ocurren en el 50–60% de los pacientes con malformaciones anorrectales. Las anomalías observadas con mayor frecuencia incluyen hidronefrosis, reflujo vesicoureteral, displasia renal, agenesia, duplicación y variantes ectópicas que incluyen ectopia renal simple, ectopia cruzada fusionada, riñones en herradura y ectopia ureteral. El patrón de anomalías del tracto urinario superior (junto con anomalías genitales masculinas) de un estudio reciente y sólido de una sola serie se resume en Tabla 1.6
Además de las anomalías estructurales, se ha informado que casi el 50% de las niñas con anomalías cloacales desarrollan un deterioro grave de la función renal. En consecuencia, la detección temprana del deterioro de la función renal es fundamental, al igual que el seguimiento y el manejo proactivos del tracto urinario inferior.8
Disfunción del tracto urinario inferior
La disfunción vesical es frecuente entre todos los pacientes con ARM. Esto suele asociarse a una anomalía espinal coexistente; sin embargo, algunos niños presentarán disfunción vesical innata con un sacro óseo y una médula espinal normales.9,10 En particular, en la malformación cloacal, la disfunción vesical adquirida puede resultar de daño neuromuscular durante la reparación quirúrgica de la malformación anorrectal.11,12 Si bien es prudente una técnica quirúrgica meticulosa y la minimización del electrocauterio monopolar, cierto daño neuromuscular puede ser inevitable debido a la localización más en la línea media del plexo autonómico pélvico en los pacientes con ARM.13 Si bien el tamizaje con uroflujometría probablemente sea adecuado para los pacientes con ARM leves y con imágenes espinales normales, recomendamos que todas las niñas con anomalías cloacales se sometan a una evaluación urodinámica.
Anomalías genitales
Las anomalías del tracto genital femenino son menos evidentes en el examen externo; sin embargo, las anomalías müllerianas son muy comunes entre las niñas con ARM.14 Las malformaciones cloacales se asocian con tasas muy altas de anomalías de los genitales internos, con cifras reportadas que van del 53 al 67%.15 Es frecuente observar algún grado de duplicación mülleriana, que va desde septos vaginales hasta duplicación uterina y vaginal completa. Las estructuras müllerianas también pueden estar hipoplásicas, y es común la asimetría en los tractos reproductivos duplicados. Delimitar la anatomía mülleriana en niñas con ARM es fundamental. El hidrocolpos es frecuente y puede provocar dolor, uropatía obstructiva, infección e infertilidad. Los clínicos deben evaluar y tratar el hidrocolpos en los recién nacidos, en quienes el líquido vaginal es principalmente orina que se acumula en el tracto reproductor, y nuevamente en pacientes en la pubertad después de la menarquia, en quienes los productos menstruales pueden acumularse en la(s) vagina(s). Se han reportado tasas de obstrucción menstrual en torno al 40%.8 En estas pacientes, la obstrucción vaginal puede ser congénita o deberse a estenosis vaginal, lo cual es común tras la anorrecto-vagino-uretroplastia sagital posterior (PSARVUP).14,16
Anomalías espinales
Aproximadamente de una cuarta parte a un tercio de los pacientes con ARM presentarán patología vertebral o medular asociada.17,18,19 Entre los pacientes con malformación cloacal específicamente, series pequeñas sugieren tasas mucho más altas de anomalías espinales (más del 70%), aunque una revisión retrospectiva grande reciente informa que el 42% de estos pacientes tiene patología espinal.20,21 Las anomalías frecuentes incluyen anclaje de la médula espinal, hipoplasia sacra, hemisacro (que se asocia con una masa presacra. Las patologías espinales pueden provocar complicaciones urológicas, neurológicas y ortopédicas.17 La obtención rutinaria de imágenes espinales es el estándar de atención, y los niños con patologías espinales deben ser vigilados para detectar vejiga neurógena.
Asociación VACTERL
Se han descrito múltiples síndromes y trastornos genéticos que incluyen malformaciones anorrectales como una manifestación. La más significativa de ellas es la asociación VACTERL, aunque se han descrito muchas otras. VACTERL es un acrónimo de anomalías vertebrales, anomalías anorrectales, anomalías cardíacas, fístula traqueoesofágica, anomalías renales y anomalías de las extremidades. La mayoría de los casos son esporádicos y no hereditarios. No todos los componentes de la asociación VACTERL se expresan en todos los pacientes. Las más frecuentes son las anomalías vertebrales, anorrectales y renales. Para diagnosticar la asociación VACTERL/síndrome VACTER, deben estar presentes al menos 3 de los defectos.22 Otros síndromes que pueden estar comúnmente asociados con las ARM incluyen MURCS (aplasia del conducto de Müller, aplasia renal y displasia de somitas cervicotorácicos), OEIS (onfalocele, extrofia, ano imperforado y defectos de la columna vertebral).23
Evaluación y diagnóstico
Prenatal
La malformación cloacal puede diagnosticarse de forma prenatal debido a la mayor incidencia de anomalías concomitantes y de hidrocolpos. La ventaja del diagnóstico prenatal es doble; se puede asesorar a los padres y se pueden realizar arreglos para que el parto tenga lugar en un centro familiarizado con el manejo neonatal de las malformaciones anorrectales. Los hallazgos en la ecografía prenatal incluyen asas intestinales dilatadas, meconio calcificado, ausencia de meconio en el recto, hidrocolpos (que suele identificarse como una estructura quística pélvica y una vejiga de difícil visualización), anomalías renales, defectos del tubo neural y ausencia del radio, entre otras. Las anomalías de múltiples sistemas pueden reforzar la sospecha de VACTERL u otro síndrome con anomalías anorrectales. Algunos centros han recurrido a la RM prenatal con la esperanza de confirmar el diagnóstico, aunque esto también es imperfecto y no constituye el estándar de atención actual.24,25
Examen físico
Si bien el diagnóstico prenatal de la malformación cloacal puede sospecharse en las imágenes prenatales, la confirmación del diagnóstico se basa en el examen físico posnatal. Al realizar el examen perineal y genital, los urólogos deben evaluar el número y la ubicación de los orificios perineales, así como el surco interglúteo. En las niñas, deben existir tres orificios perineales separados (uretra, vagina, ano), con el orificio anal centrado dentro del complejo del esfínter anal y separado de la vagina por el cuerpo perineal. Un único orificio perineal en una niña es patognomónico de cloaca y típicamente se encuentra en la ubicación esperada de la uretra. Puede haber una amplia variabilidad en el aspecto del periné, pero el orificio único es el hallazgo crítico en el examen (Figura 1). Una variante menos frecuente de la malformación cloacal, llamada variante cloacal posterior, presenta un orificio perineal más posterior, donde se localizarían la vagina o el ano (Figura 2). En ocasiones, una piel prepucial prominente puede dar la apariencia de clitoromegalia. En ausencia de cuerpos cavernosos palpablemente aumentados, esto no debe motivar una evaluación endocrinológica de rutina por trastornos intersexuales.26
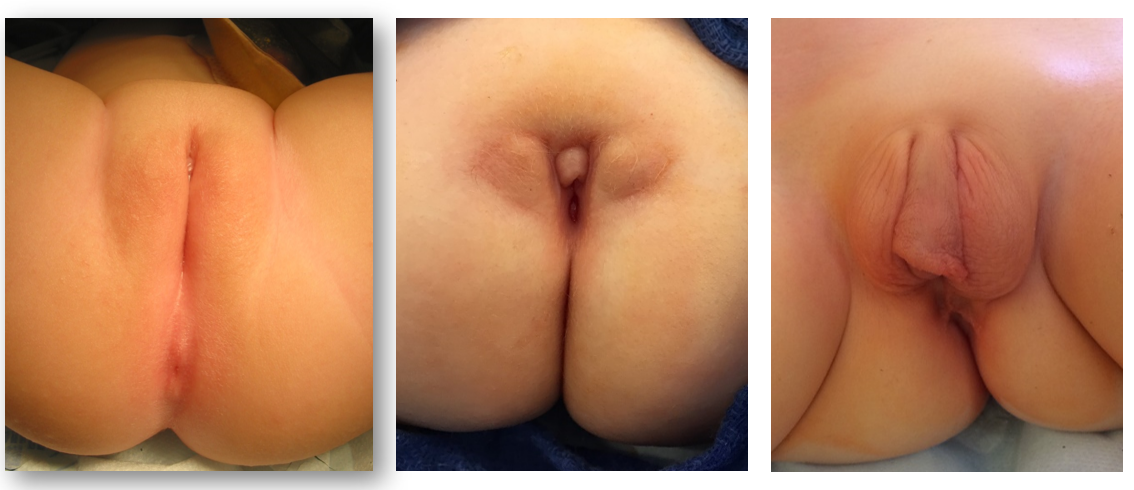
Figura 1 Fotografías perineales de niñas con malformación cloacal. El orificio anal está ausente, y el único orificio perineal se localiza por detrás del clítoris, cerca de la ubicación esperada de la uretra. Es frecuente el tejido prepucial redundante.
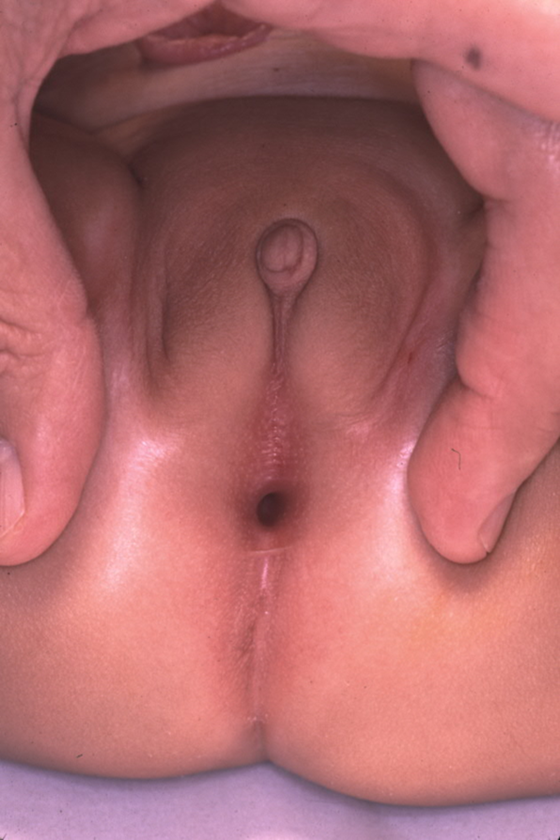
Figura 2 Anomalía cloacal posterior, con el único orificio perineal desplazado posteriormente hacia la ubicación esperada del ano.
Pruebas de laboratorio e imágenes
El estudio diagnóstico posterior se centra en evaluar posibles anomalías asociadas.
Ecocardiograma
Esto es necesario para evaluar anomalías cardíacas estructurales, particularmente previo a la anestesia.
Ecografía abdominal completa
Evaluar anomalías renales, obstrucción del tracto urinario, hidrocolpos y duplicación mülleriana.
Estudios de imagen de la columna vertebral
Se debe obtener una ecografía espinal, principalmente para evaluar la presencia de médula anclada. La radiografía simple es útil para evaluar el sacro tras la osificación del cóccix. Las radiografías sacras anteroposteriores y laterales pueden mostrar anomalías sacras como un hemisacro y hemivértebras sacras, y permiten valorar el grado de hipoplasia sacra. En general, una hipoplasia más grave presagia peores resultados de continencia.27 Se ha propuesto la medición del “índice sacro” como indicador pronóstico de la continencia fecal, pero no ha demostrado ser fiable como predictor de la continencia urinaria, del desarrollo de vejiga neurógena o de la necesidad de cateterismo intermitente.28
Para los pacientes con anomalías espinales, se debe realizar evaluación neuroquirúrgica y resonancia magnética de la columna vertebral, y estos pacientes necesitan seguimiento urológico continuo por vejiga neurógena. Los niños que se presenten después de los 3–4 meses de edad necesitarán una resonancia magnética de la columna vertebral, ya que la osificación de los arcos vertebrales oscurece la ventana ecográfica.
Pruebas de función renal
Solicite creatinina sérica para evaluar la función renal basal. Tenga en cuenta que la evaluación de la función renal en niños es imperfecta y que la inmadurez renal en los neonatos puede dar lugar a una subestimación de la función renal, en particular en los bebés prematuros. La cistatina C se utiliza cada vez más como correlato de la creatinina sérica.
Se suelen realizar estudios de imagen adicionales según la indicación clínica. En el contexto de hidronefrosis debida a hidrocolpos o distensión vesical, debe realizarse una ecografía renal de control tras el drenaje del hidrocolpos para confirmar la mejoría de la hidronefrosis. La gammagrafía renal o la urografía por resonancia magnética (RM) pueden considerarse si hay preocupación por un drenaje renal deficiente o para establecer la función renal relativa. La cistouretrografía miccional (VCUG) puede servir para detectar reflujo vesicoureteral, aunque es debatible el papel de realizar de forma rutinaria una cistouretrografía miccional preoperatoria y puede ser difícil cateterizar la vejiga a ciegas. Por último, aunque existe una alta incidencia de hallazgos urodinámicos anormales, no es necesario realizar estudios urodinámicos hasta después de la reconstrucción quirúrgica.
Planificación preoperatoria
El resto del estudio diagnóstico se dedica a definir la anatomía en preparación para la reconstrucción quirúrgica.
Colostograma
Un colostograma distal de alta presión definirá el nivel de la fístula rectal, evaluará la longitud del colon distal disponible para el descenso (pull-through) y definirá la relación del recto con el sacro y el cóccix. Tras la creación de la colostomía, se introduce un catéter Foley en la fístula mucosa y se infla suavemente el balón para evitar fugas. Luego se instila contraste a través del catéter para opacificar el colon distal. La presión del contraste instilado debe ser suficiente para vencer el tono de los músculos elevadores del ano, y el contraste debe ser hidrosoluble e isosmótico debido al raro riesgo de perforación del colon. Alternativamente, puede utilizarse un “invertograma” para investigar la extensión del defecto en la atresia anal o rectal. El ano se marca con un marcador radiopaco, se invierte al bebé de modo que el aire en el recto ascienda al punto más alto, y se toma una radiografía lateral. La distancia entre el aire y el marcador radiopaco indica la distancia desde el recto hasta la piel perineal.
Endoscopia
La cistoscopia y la vaginoscopia son esenciales para la planificación preoperatoria de la reparación de una cloaca o de un seno urogenital. Esto puede coordinarse con una colostomía derivativa u otro procedimiento para evitar exposición anestésica innecesaria. La endoscopia definirá la longitud del canal común y la distancia desde el cuello vesical hasta la confluencia, caracterizará el cuello vesical y el complejo esfinteriano, y evaluará la vejiga y los uréteres. La ausencia de orificios ureterales ortotópicos debe hacer sospechar un uréter ectópico. La vaginoscopia revelará la presencia de un tabique vaginal, duplicación vaginal y el tamaño de la(s) vagina(s) para una reconstrucción futura.
Es particularmente importante establecer la ubicación de la confluencia vaginal en relación con el cuello vesical.29 Esta distancia representa la longitud uretral y tiene implicaciones para la reparación quirúrgica y los resultados de continencia.30 Una longitud uretral más corta indica una malformación más grave.29
Genitografía
Los genitogramas fluoroscópicos se utilizan comúnmente para delimitar las estructuras urológicas, ginecológicas y rectales. Se introduce un catéter Foley en el orificio perineal y se instila contraste. Los estudios fluoroscópicos bidimensionales convencionales están sujetos a la superposición de estructuras opacificadas y, por lo tanto, presentan limitaciones para definir relaciones tridimensionales y obtener mediciones precisas, lo que pone de relieve la necesidad de una evaluación endoscópica. Actualmente muchos centros emplean tomografía computarizada tridimensional o resonancia magnética para delimitar la anatomía en malformaciones complejas (Figura 3).31,32
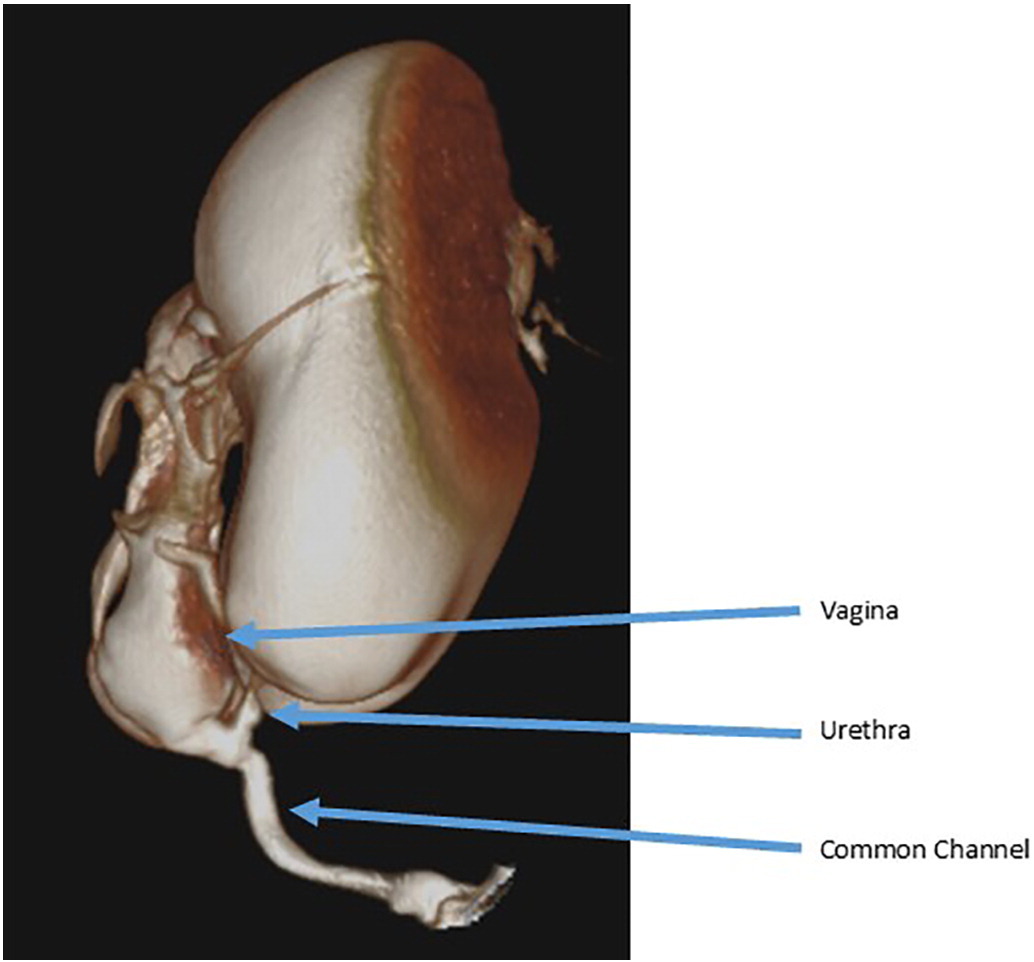
Figura 3 Ejemplo de un cloacograma tridimensional que muestra un conducto común largo con una confluencia vaginal alta y una uretra corta.
Un cloacograma tridimensional (o resonancia magnética pélvica estándar) también es útil para delinear la anatomía mülleriana y la ectopia ureteral. Los urólogos deben conocer una entidad conocida como hemivagina obstruida y anomalía renal ipsilateral (OHVIRA), en la cual una hemivagina está obstruida; por lo tanto, la vaginoscopia mostrará una sola vagina y un solo cuello uterino. La sospecha de anomalías müllerianas en la ecografía que sean discordantes con la endoscopia debe investigarse más a fondo, y los genitales internos deben inspeccionarse de manera directa cuando exista la oportunidad, como en el momento de la colostomía derivativa inicial.16
Opciones de tratamiento, resultados y complicaciones
Periodo neonatal
Es fundamental en el periodo neonatal asegurar una reanimación adecuada del recién nacido y la descompresión de los sistemas de órganos obstruidos. El manejo inicial debe incluir una colostomía y una fístula mucosa en el periodo neonatal, típicamente dentro de las primeras 24–48 horas de vida. Esto permite la descompresión del colon y la separación del tránsito fecal del tracto urinario.
Manejo del hidrocolpos
El hidrocolpos y una vejiga distendida con líquido son frecuentes en niñas con malformación cloacal y se desarrollan cuando la orina refluye hacia la vagina como resultado de una obstrucción urinaria distal. La dilatación vaginal puede ser lo suficientemente grave como para causar obstrucción del tracto urinario superior y la orina puede refluir a través de las trompas de Falopio, provocando ascitis urinaria. No hay consenso sobre el manejo del hidrocolpos en el periodo neonatal, pero sí requiere drenaje si existe uropatía obstructiva. Tradicionalmente, el drenaje se ha logrado con descompresión quirúrgica mediante una vaginostomía, un tubo de vaginostomía percutáneo o una vesicostomía. Más recientemente, se ha utilizado la opción menos invasiva del cateterismo intermitente limpio del canal común.33 Cuando se cateteriza el canal común, el catéter suele entrar preferentemente en la vagina en lugar de la vejiga. En una comparación de los dos métodos de descompresión, quirúrgico y CIC, no hubo diferencia en la tendencia de la creatinina, lo que aporta buena evidencia de que el CIC es una buena opción inicial no invasiva para la descompresión del hidrocolpos.33 Si hay un tabique vaginal, una vaginostomía puede drenar solo un lado de la vagina y descomprimir el sistema de forma inadecuada. En este caso, una vaginostomía en el otro lado de la vagina o la incisión del tabique vaginal pueden permitir un mejor drenaje.
Un principio importante de todos los métodos de descompresión del hidrocolpos es el seguimiento para confirmar el drenaje satisfactorio. Después de iniciar el cateterismo intermitente limpio (CIC) para hidrocolpos, la ecografía debe confirmar la descompresión de la vagina y la resolución de la dilatación del tracto urinario. Si no tiene éxito, debe considerarse una opción más invasiva. Si la hidronefrosis persiste a pesar de la descompresión de la vagina, debe completarse el estudio de otras causas de hidroureteronefrosis y debe sospecharse vejiga neurógena.
Manejo vesical
Muchas niñas con malformación cloacal no necesitarán ninguna intervención para el vaciamiento vesical. Si se identifica una vejiga hostil o de alta presión con vaciamiento incompleto, se puede crear una vesicostomía cutánea para permitir una descompresión adecuada del tracto urinario. El cateterismo intermitente limpio generalmente no es posible porque, como se mencionó arriba, el catéter entra de forma preferente en la vagina debido a que el origen de la uretra suele ser anterior. La vesicostomía también puede estar indicada en niñas con reflujo vesicoureteral de alto grado o infecciones recurrentes. Nuevamente, el drenaje y la descompresión del tracto urinario deben confirmarse mediante ecografía.
Reparación quirúrgica de la malformación cloacal
Momento de la reparación
Una vez descomprimidos los sistemas orgánicos obstruidos, no es necesario realizar de inmediato la reparación quirúrgica primaria de la malformación cloacal. Este retraso permite un adecuado periodo de vinculación entre la familia y el niño, pero también brinda tiempo para reunir al equipo multidisciplinario involucrado en la atención del niño. Este periodo también permite optimizar la nutrición y la fuerza. No existe consenso sobre la edad óptima de la reparación, pero se ha demostrado que la reparación < 6 meses después del nacimiento se asocia a una mayor tasa de complicaciones postoperatorias, específicamente dehiscencia de la herida, y la mayoría coincide en que 6–12 meses de edad parecen ser la edad ideal para la reparación primaria.34
Técnicas quirúrgicas
El abordaje quirúrgico está determinado por la anatomía observada en el cloacograma y la cistovaginoscopia. Existen dos técnicas quirúrgicas utilizadas para la reparación: la movilización urogenital total y la separación urogenital. Los principios de la reparación quirúrgica son movilizar la uretra, la vagina y el recto hasta el periné para que existan tres orificios separados. Esto se realiza mediante una incisión sagital posterior y puede efectuarse en combinación con una laparotomía si es necesario. El abordaje sagital posterior con el bebé en decúbito prono es el abordaje inicial. Este posicionamiento permite una mejor visualización de la anatomía en comparación con la posición de litotomía. Primero, se identifica el recto que entra en el canal común y se moviliza cranealmente hasta la reflexión peritoneal. En este punto de la operación, se realiza una movilización urogenital total o una separación urogenital.
Separación urogenital
La separación urogenital fue la técnica inicial descrita para la reparación de la malformación cloacal y fue el abordaje estándar popularizado por Hendren (Figura 4, Figura 5, Figura 6, Figura 7, Figura 8, Figura 9, Figura 10).35 Sigue siendo el abordaje de elección para niñas con un canal común > 3 cm de longitud. En la separación urogenital, el recto, la vagina y la uretra se separan y se llevan individualmente al periné. Tras movilizar el recto del canal común, la vagina se diseca cuidadosamente separándola de la pared posterior de la uretra, el cuello vesical y la vejiga. El defecto en la uretra en el sitio donde se movilizó la vagina se cierra de forma primaria sobre un catéter. Esta disección puede ser difícil y se debe tener cuidado de no desvascularizar ni denervar el tracto urinario. La vagina debe movilizarse superiormente tanto como sea posible para permitir que alcance la piel perineal sin tensión. Si la vagina no alcanza, puede ser necesario un abordaje abdominal para maximizar la movilización. Una vez que la vagina alcanza la piel, se lleva hasta la piel perineal, se fija por detrás de la uretra y luego hacia los lados para crear el neo-introito. Luego se recrea el cuerpo perineal y se coloca el recto dentro del complejo muscular. Si la vagina aún no alcanza después de la movilización, se han descrito técnicas adicionales de vaginoplastia como la técnica de cambio vaginal, un injerto de interposición intestinal o incluso descender la vagina nativa bajo tensión con la expectativa de que pueda cicatrizarse y requerir una introitoplastia o una vaginoplastia con mucosa bucal al inicio de la pubertad. La decisión sobre la técnica de vaginoplastia es una discusión multidisciplinaria entre ginecología, cirugía colorrectal y urológica y debe involucrar una discusión preoperatoria con la familia.
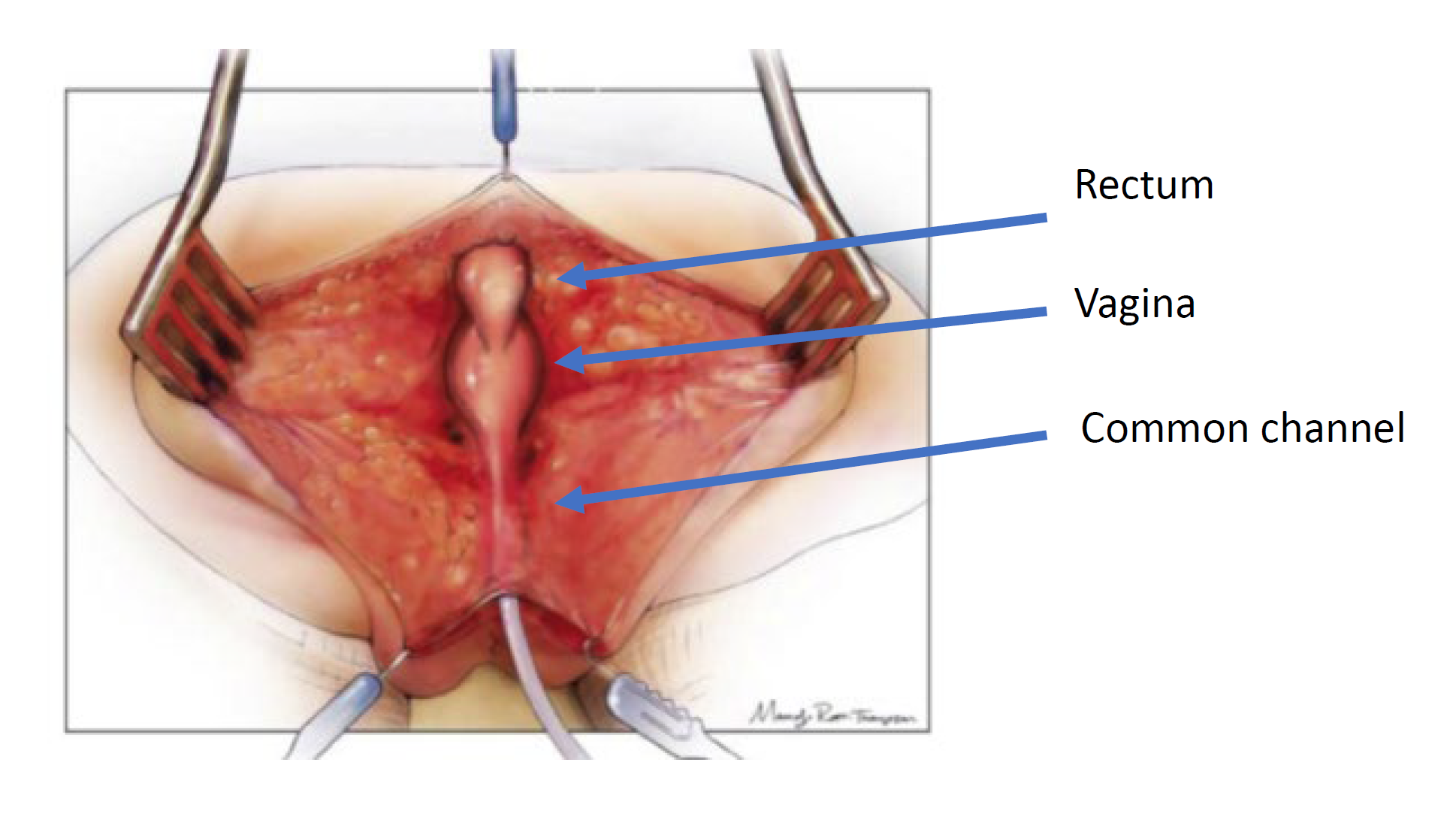
Figura 4 Ilustración de una separación urogenital. La paciente está en decúbito prono y se ha realizado una incisión sagital posterior, exponiendo las superficies posteriores del recto, la vagina y el canal común. (continúa en Figura 5)
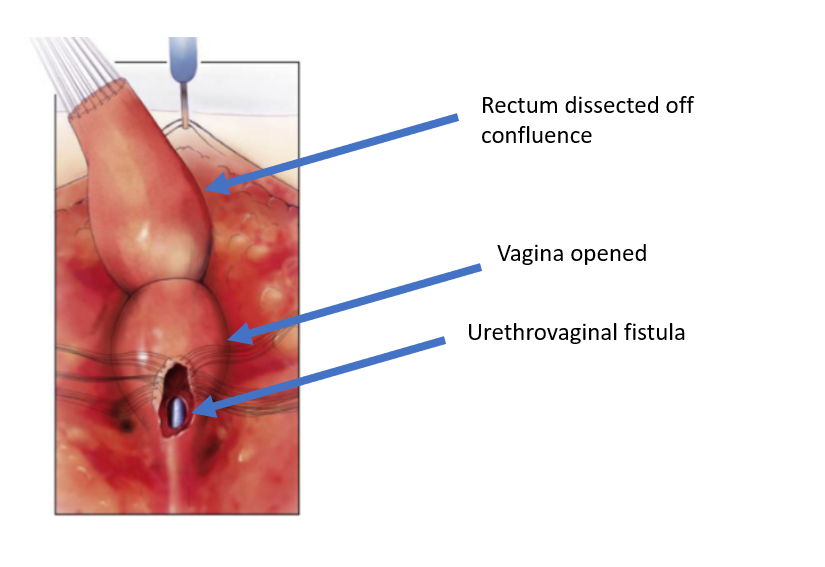
Figura 5 El recto ha sido disecado de la confluencia vaginal, dejando una abertura en la vagina. (continuación de Figura 4, continúa en Figura 6)
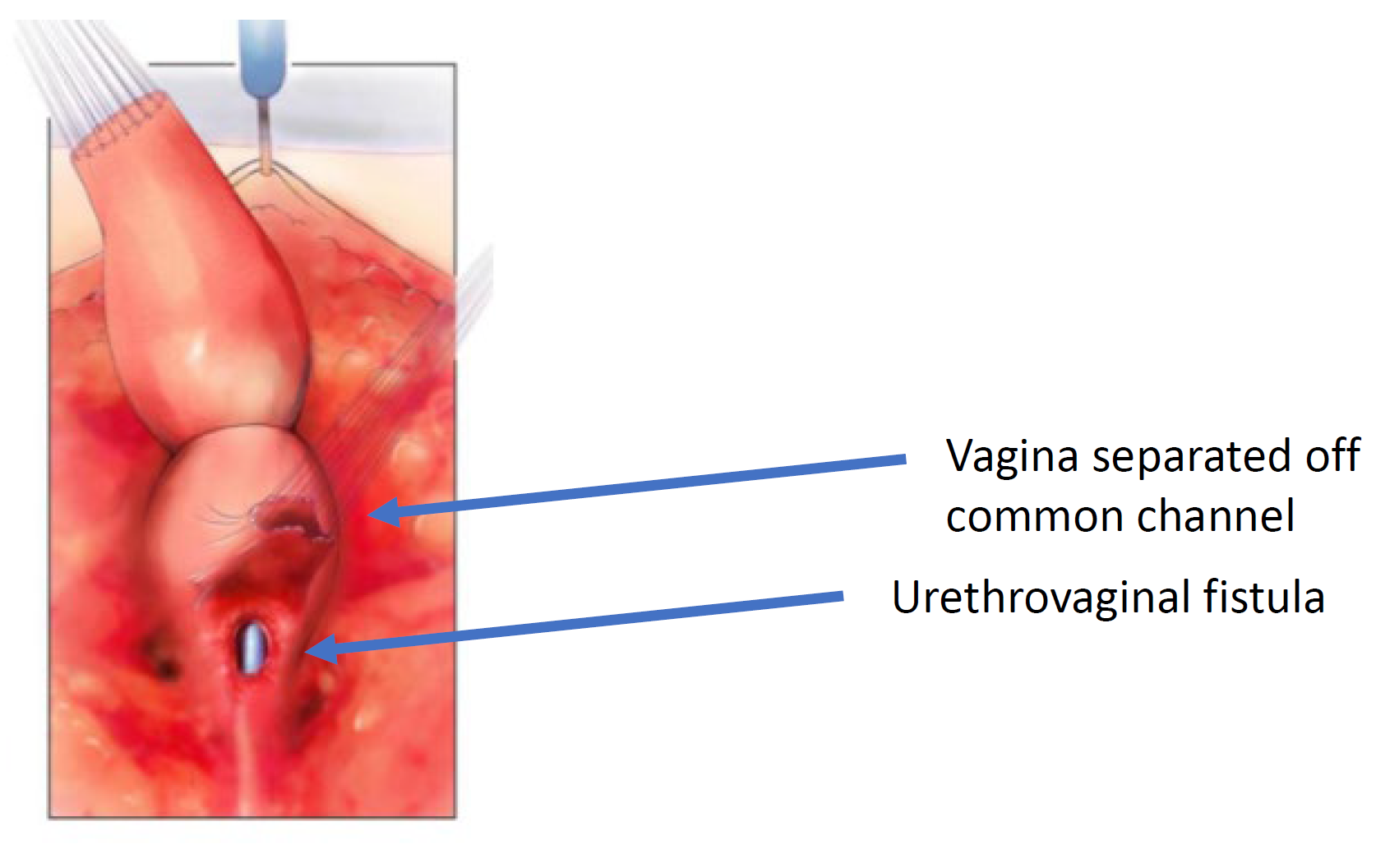
Figura 6 La vagina ha sido disecada del canal común en su confluencia con la uretra. El orificio a través del cual se observa el catéter es la fístula uretrovaginal. (continuación de Figura 5, continúa en Figura 7)
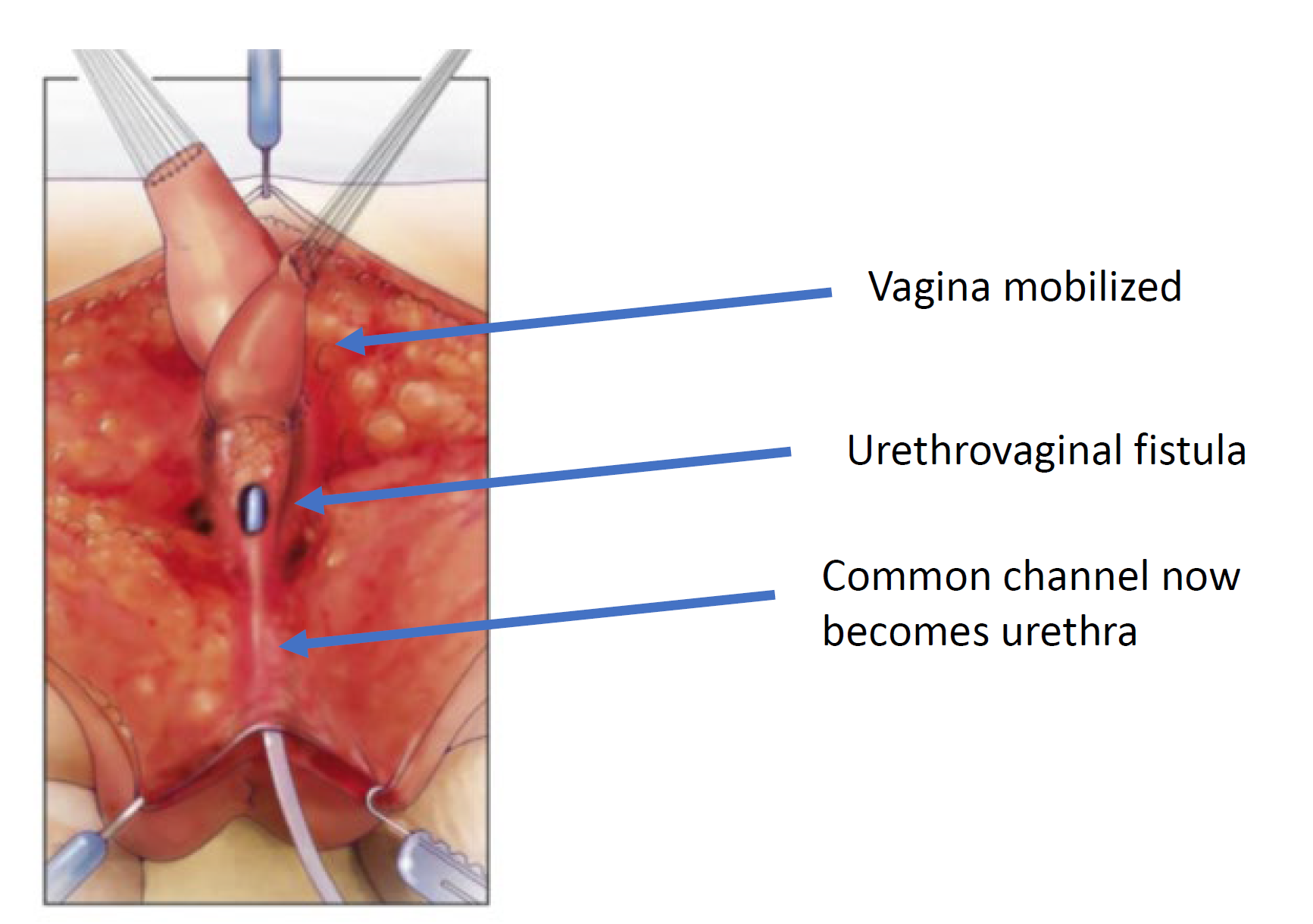
Figura 7 La vagina se moviliza proximalmente para ganar longitud y elasticidad de modo que pueda alcanzar el periné. (continuación de Figura 6, continuación en Figura 8)
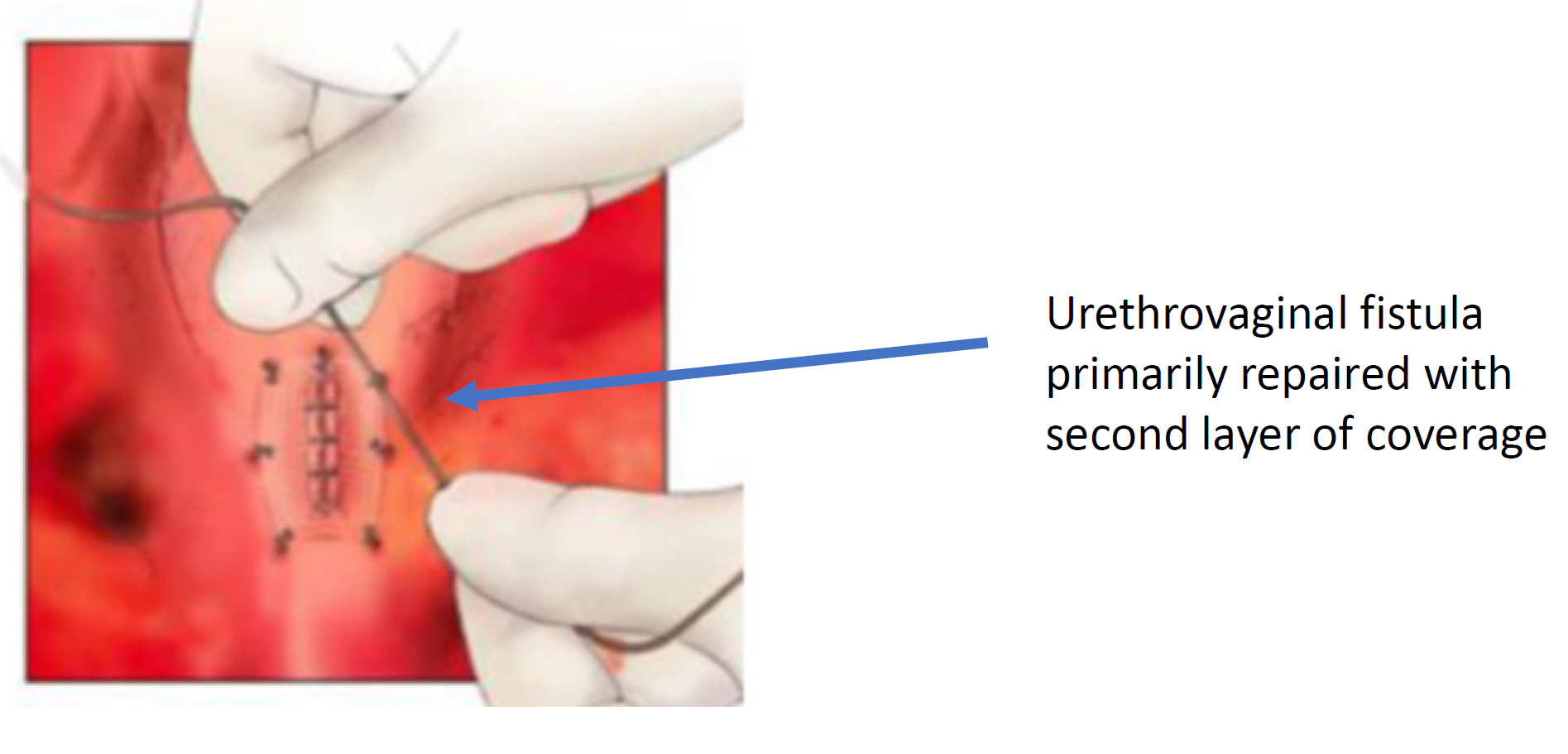
Figura 8 La fístula uretrovaginal está cerrada. (continuación de Figura 7)
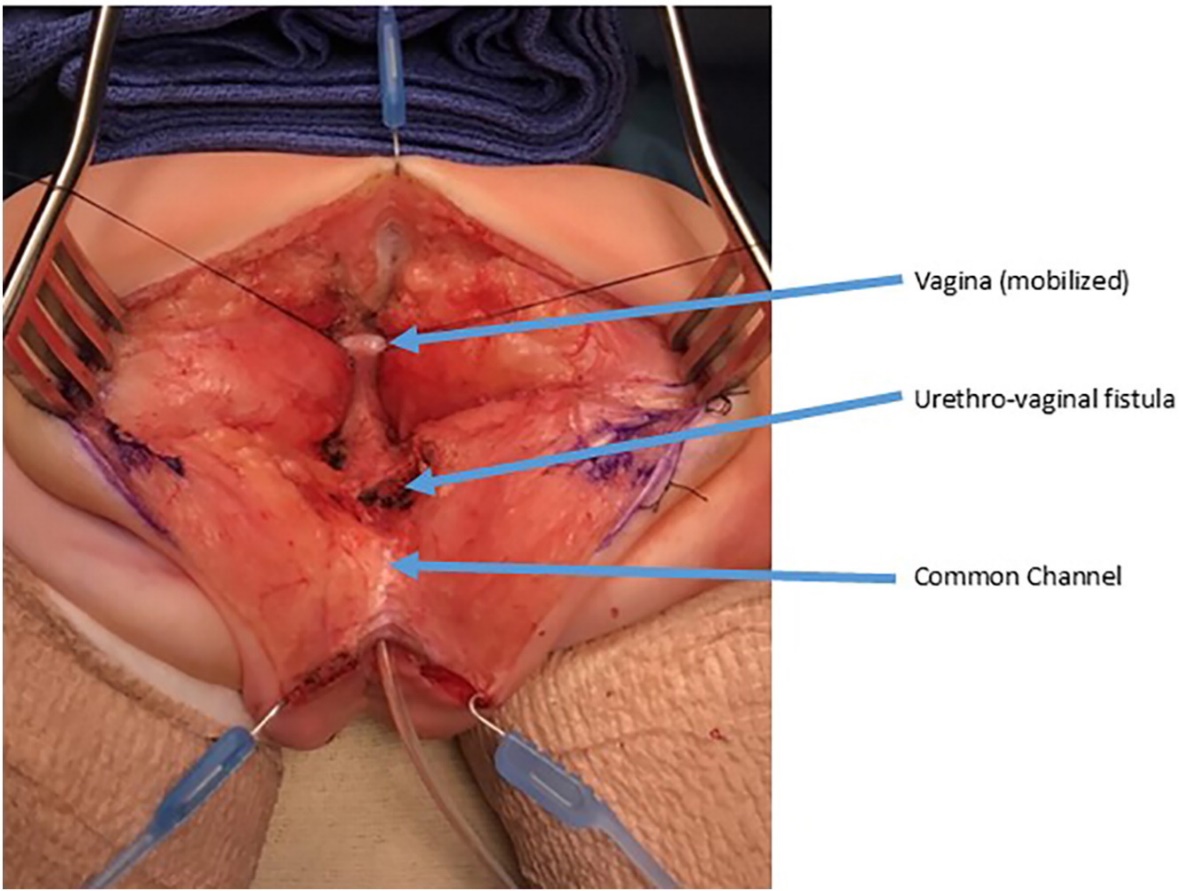
Figura 9 Fotografías intraoperatorias de una separación urogenital. Se ha realizado una incisión sagital posterior. Hay un catéter en el canal común. La vagina se mantiene con suturas de tracción. La confluencia de la vagina y la uretra está etiquetada como fístula uretrovaginal, que se cerrará después de separar la vagina de la uretra. (continuación en Figura 10)
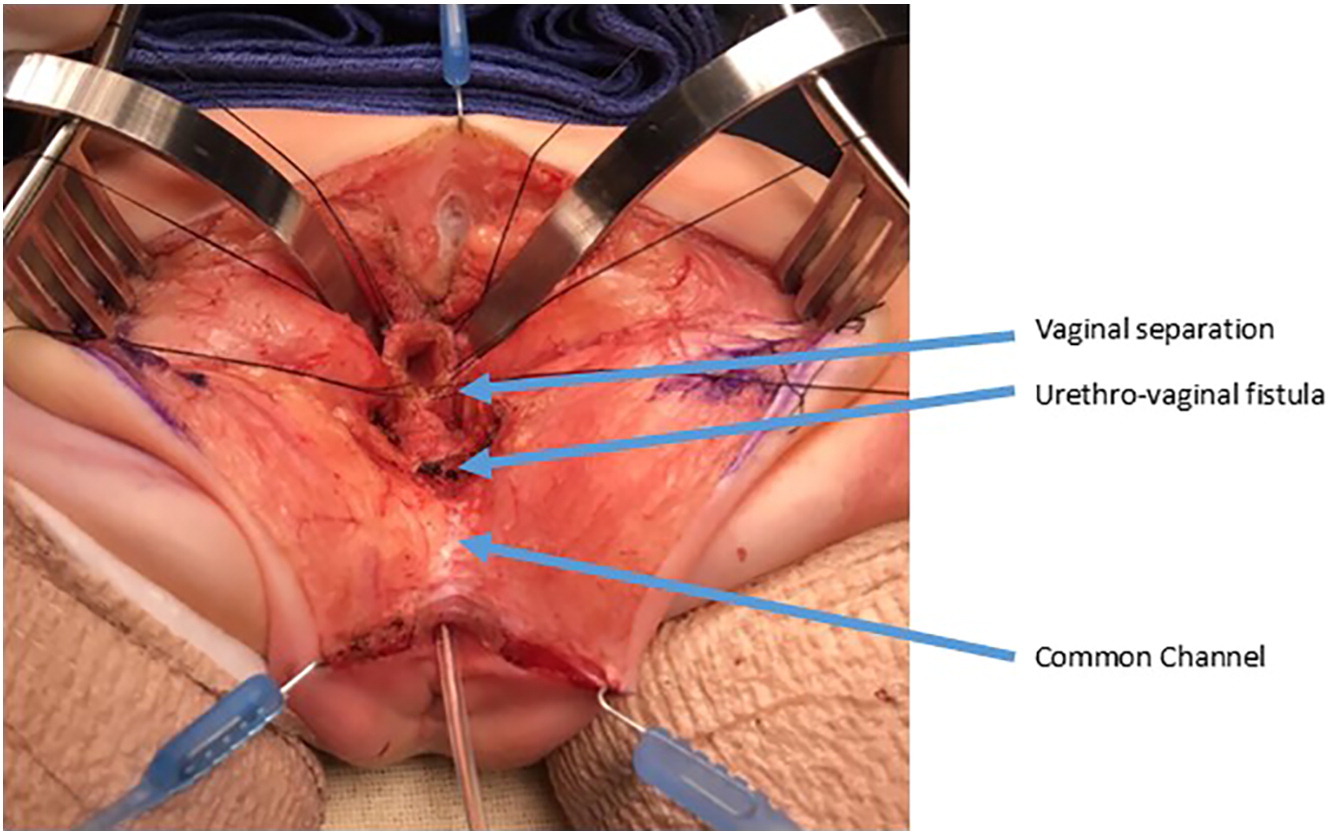
Figura 10 Fotografías intraoperatorias de una separación urogenital. La vagina ha sido abierta y separada de la uretra. A continuación, la vagina se movilizará proximalmente para ganar longitud y alcanzar el periné. La fístula uretrovaginal está nuevamente marcada y se cerrará por planos de manera primaria sobre un catéter. (continuación de Figura 9)
Movilización urogenital total
La movilización urogenital total fue introducida por primera vez para la reparación cloacal por Peña en 1997 y se consideró un “enfoque más sencillo de la cloaca” porque no requiere separar la vagina del tracto urinario (Figura 11, Figura 12, Figura 13).36 Más bien, es una técnica de pull-through en la que el seno urogenital se moviliza hasta que la confluencia alcanza el periné, donde la uretra y la vagina se separan y se anastomosan al periné. Peña propuso que esta técnica reduciría la fístula uretrovaginal y la devascularización del tracto urinario. Debido a que el tracto urinario no puede movilizarse tan extensamente como la vagina, existen limitaciones respecto a cuánto puede movilizarse el conducto común con esta técnica; se utiliza mejor en malformaciones cloacales con conducto común corto (< 3 cm). Una vez que el recto se moviliza del conducto común, el conducto común se diseca circunferencialmente desde el periné y se abre hasta que la confluencia de la uretra y la vagina alcanza la piel perineal sin tensión. El conducto común se divide y se utiliza para una labioplastia. La uretra se anastomosa al borde anterior del introito, justo posterior al tejido del clítoris. La uretra y el introito vaginal se anastomosan a la piel sin tensión. Se recrea el cuerpo perineal y el recto se lleva a la piel dentro del complejo muscular esfinteriano.
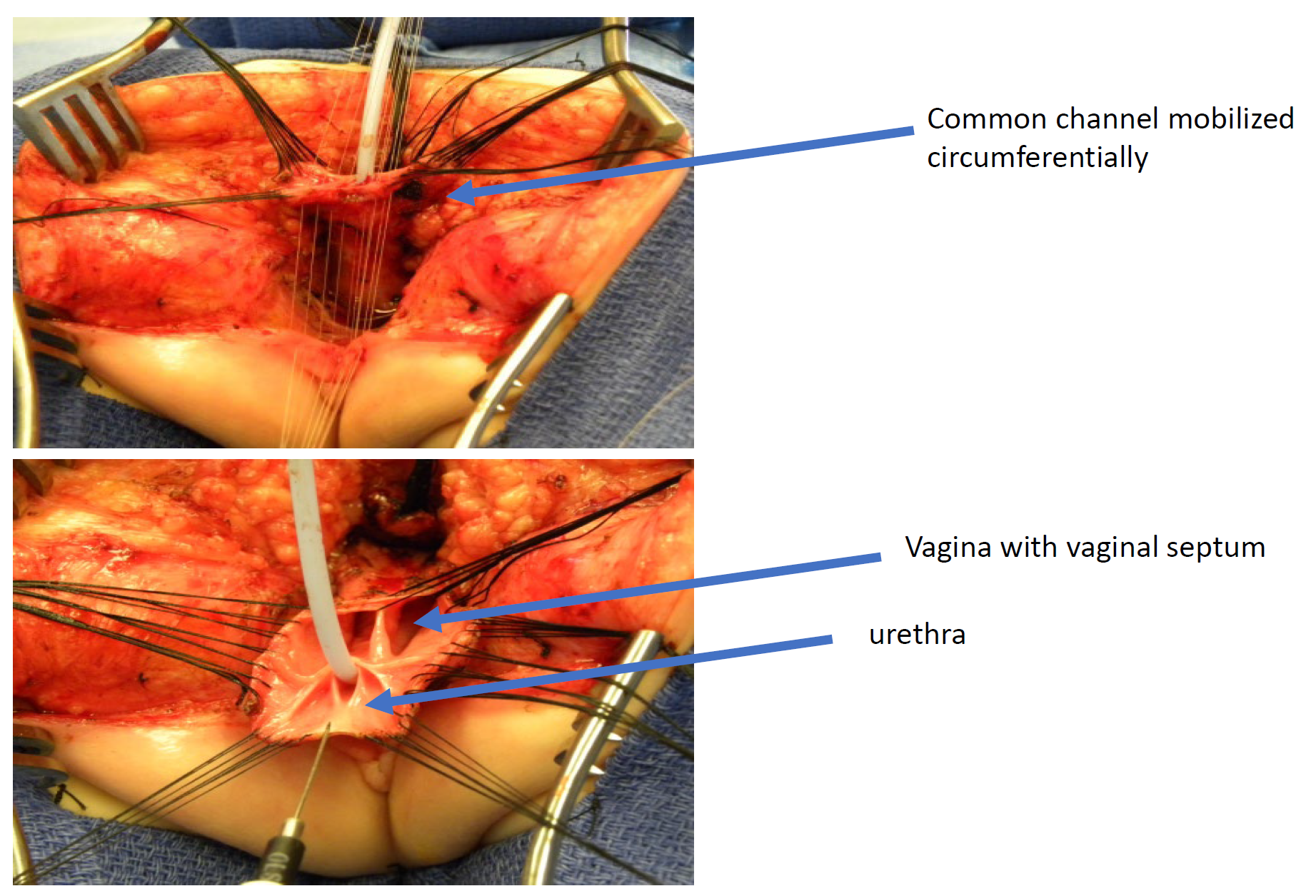
Figura 11 Fotografías intraoperatorias de una reparación cloacal con movilización urogenital total (TUM). Se ha realizado una incisión sagital posterior, y el canal común y las vaginas se han movilizado en conjunto hacia el periné. En esta fotografía, el recto ya ha sido separado.
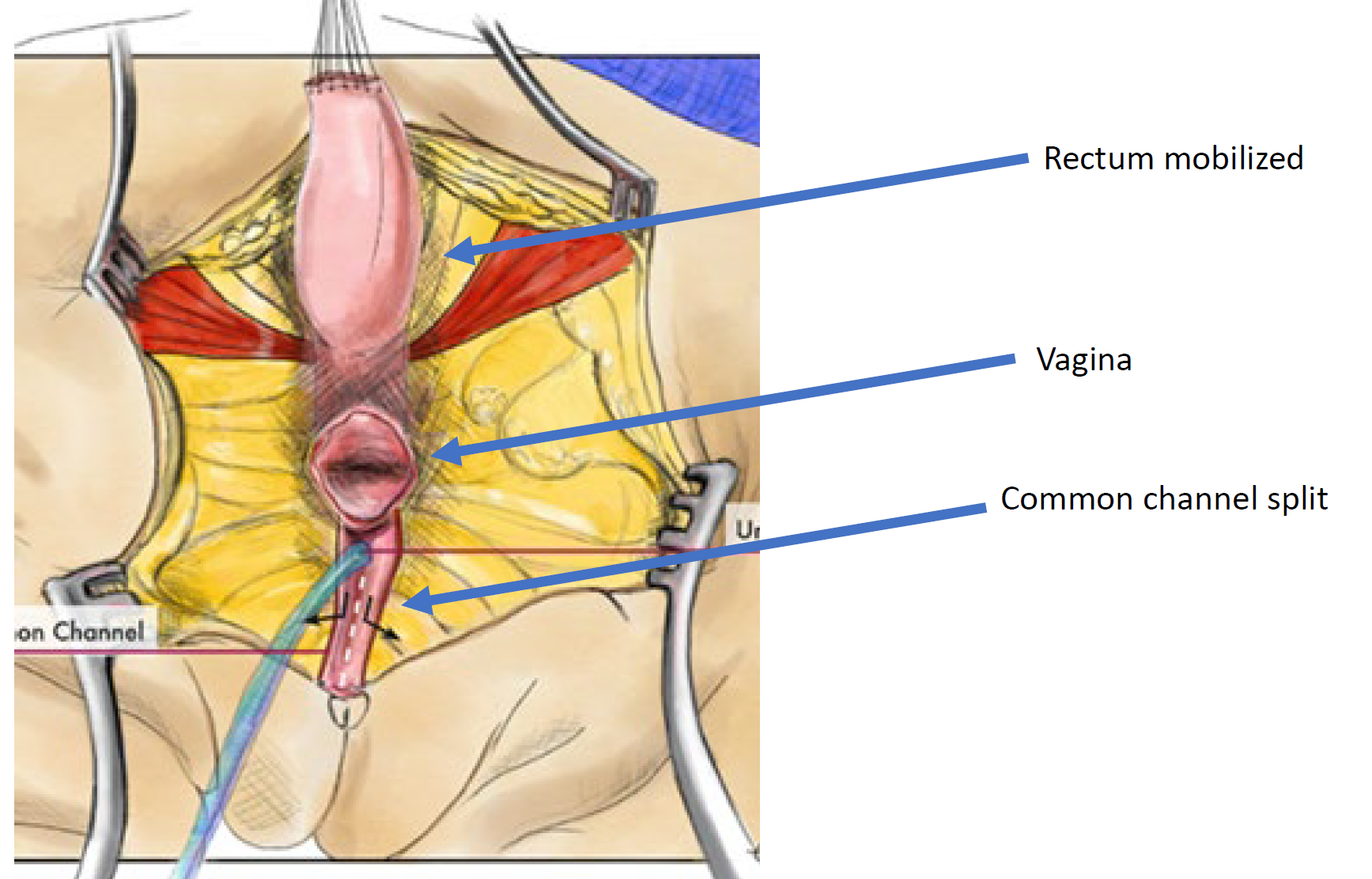
Figura 12 Ilustración de una reparación cloacal mediante movilización urogenital total (TUM). La movilización es completa una vez que la confluencia alcanza el periné y la uretra, la vagina y el recto pueden anastomosarse por separado al periné. El canal común se divide y el tejido redundante se rota para revestir el orificio introital. (continuación en Figura 13)
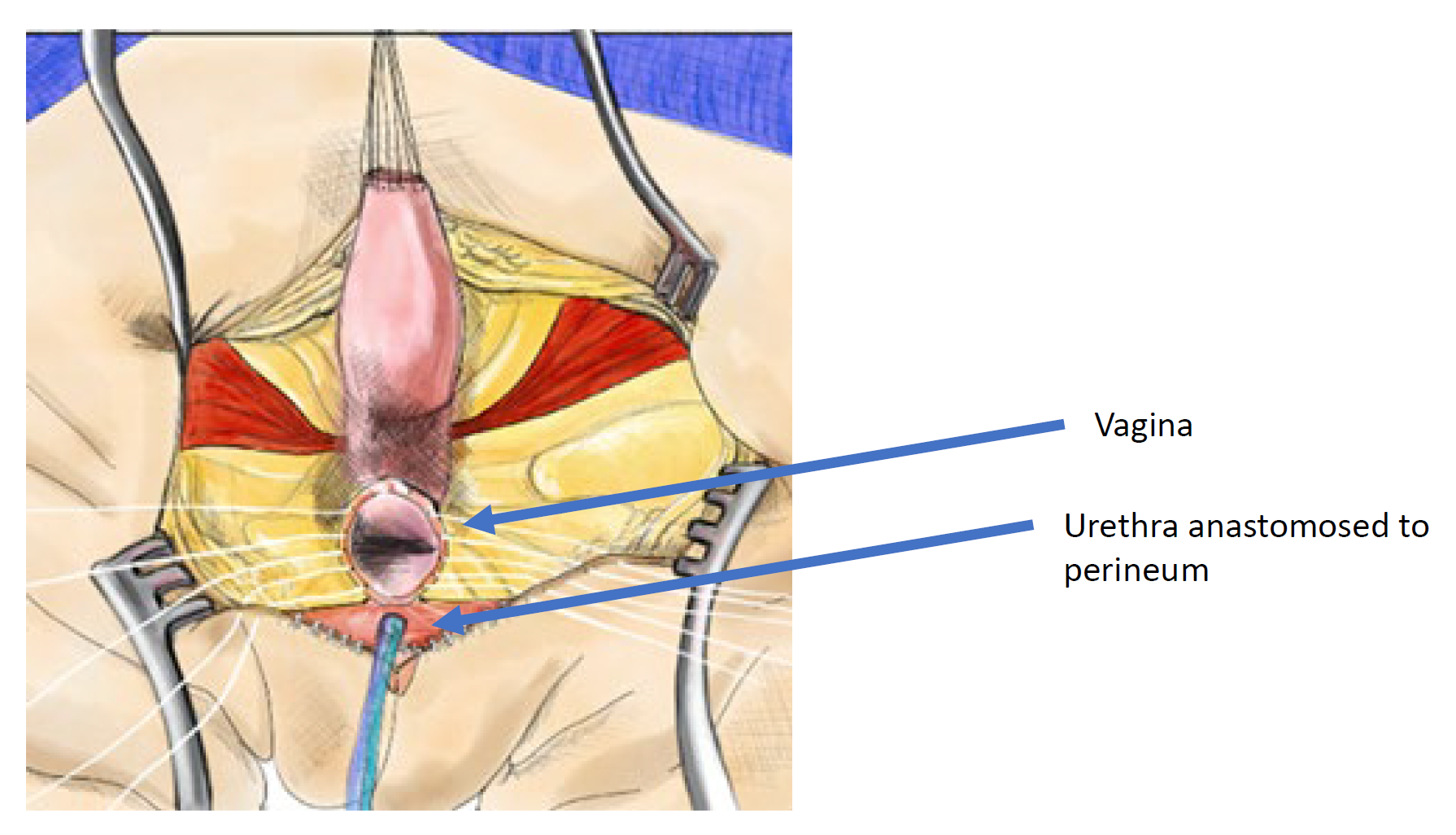
Figura 13 Ilustración de una reparación cloacal mediante movilización urogenital total (TUM). La movilización está completa una vez que la confluencia alcanza el periné y es posible anastomosar por separado la uretra, la vagina y el recto al periné. El conducto común se divide y el tejido redundante se rota para revestir el orificio introital. (continuación de la Figura 12)
Determinación de la técnica quirúrgica
Perspectiva histórica
La separación urogenital fue la técnica principal para la reparación cloacal y a menudo requería una incisión sagital posterior junto con una laparotomía. Esta técnica es exigente desde el punto de vista técnico y consume mucho tiempo. Informes tempranos de un cirujano de alto volumen comunicaron resultados razonables, con 58.8% miccionando espontáneamente, 28.4% que realizan CIC y 2.8% con derivación urinaria.35 Este estudio informa “control urinario” pero no se aportan detalles sobre accidentes urinarios, vaciamiento o función renal. La descripción de Peña de la movilización urogenital total introdujo un abordaje más sencillo para la malformación cloacal. Tras un gran número de procedimientos de TUM, reportó tiempos operatorios y hospitalización más cortos y mejoría de la continencia urinaria (74%) y de las evacuaciones intestinales voluntarias.37 Sin embargo, informó que en los casos de cloaca con canales comunes largos (> 3 cm), existía una alta complejidad en la toma de decisiones intraoperatoria y, a menudo, después de que el canal común se movilizaba completamente y este no alcanzaba, se separaba la vagina del canal común movilizado, dejando la uretra y el cuello vesical movilizados circunferencialmente con vascularidad comprometida y probable denervación. Esto pone a la uretra en riesgo de desvascularización y necrosis.
Estas dos experiencias importantes de finales de la década de 1990 dieron lugar a un algoritmo quirúrgico basado en la medición del conducto común. Un conducto común corto (< 3 cm) se beneficiaría más de una movilización urogenital total, mientras que un conducto común largo (> 3 cm) se recomendaría para una separación urogenital con o sin laparotomía o laparoscopia y un injerto de interposición intestinal si la vagina no alcanzaba la piel. Este algoritmo depende en gran medida de una medición precisa del conducto común. La medición puede realizarse endoscópicamente bajo visión, o en un cloacograma reconstruido bidimensional o tridimensional (Figura 14). No obstante, se ha demostrado que el cloacograma reconstruido tridimensional es la medición más precisa del conducto común y permite que cirujanos con menos experiencia y médicos en formación comprendan esta anatomía compleja al mismo nivel que los cirujanos sénior, mejorando la preparación para el procedimiento quirúrgico.38,39
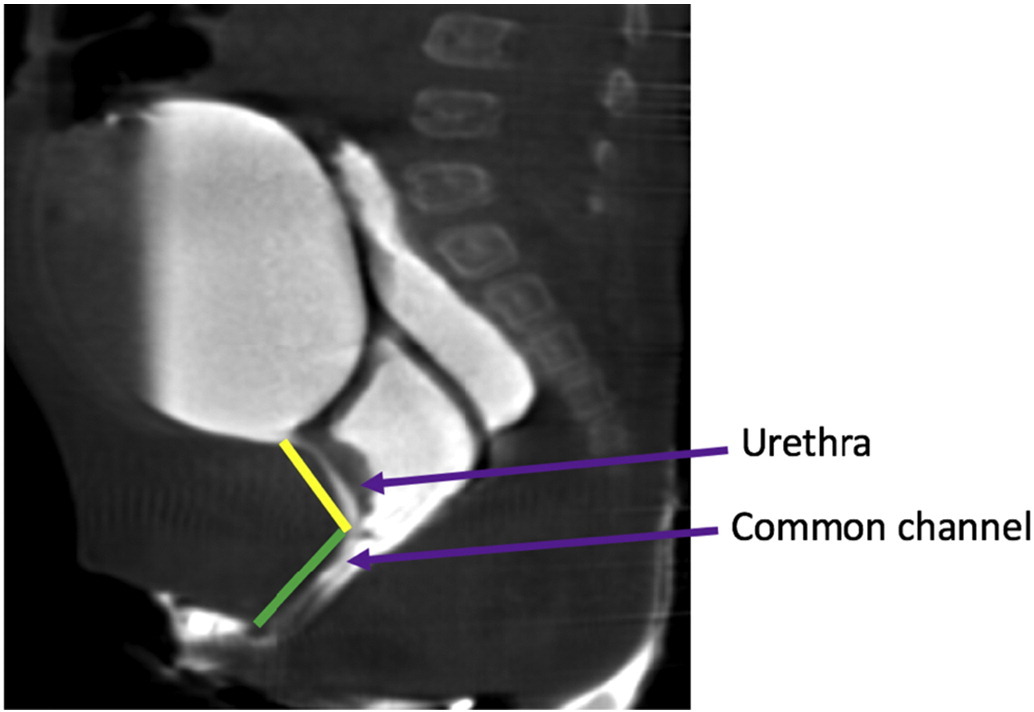
Figura 14 Imágenes de RM T2 en plano sagital de la malformación cloacal que delimitan la uretra y las longitudes del canal común.
Desarrollo del algoritmo quirúrgico actual
Durante casi 2 décadas, la toma de decisiones quirúrgicas basada únicamente en la longitud del canal común fue el estándar de atención. Sin embargo, a medida que la atención multidisciplinaria se hizo más prevalente y los urólogos participaron más estrechamente en la atención de estas pacientes junto con la cirugía pediátrica, se observó que, aunque la mayoría de las niñas con canales comunes cortos tenían uretras más largas, existe un subtipo inusual de niñas con canales comunes cortos que tienen uretras muy cortas. En este subgrupo de pacientes, si se realizara una TUM, daría como resultado una uretra muy corta y el cuello vesical situado justo en el periné, con un potencial de continencia muy pobre. Como resultado de esta observación, se desarrolló un algoritmo actualizado que incorpora tanto la longitud del canal común como la longitud de la uretra para determinar el abordaje quirúrgico Figura 15.13 En este algoritmo, si un canal común es > 3 cm, independientemente de la longitud uretral, se realiza una separación urogenital. Si un canal común es < 3 cm y la uretra es > 1.5 cm, entonces la TUM es el abordaje quirúrgico de elección. En la variante inusual que presenta un canal común < 3 cm y una uretra < 1.5 cm, este nuevo algoritmo indicaría que la niña debería someterse a una separación urogenital, manteniendo así la posición anatómica de la vejiga y el cuello vesical dentro de la pelvis y evitando movilizarlos hacia abajo y por debajo del diafragma pélvico. Este algoritmo quirúrgico supuso la primera ocasión, en más de 20 años desde la descripción de la TUM por Peña, en que se proponía una nueva técnica quirúrgica, y ha sido bien aceptado en centros de alto volumen. Los resultados de este algoritmo han sido excelentes en cuanto a la reducción de la complejidad en la toma de decisiones y de los cambios de plan intraoperatorios. Con una evaluación preoperatoria precisa de las mediciones de la uretra y del canal común, puede evitarse una comorbilidad urológica significativa y se obtiene una uretra permeable y cateterizable en el 97% de las pacientes.40
Figura 15 Algoritmo quirúrgico sugerido para la malformación cloacal.13
Manejo posoperatorio
El manejo de la herida y el drenaje con sonda son primordiales tras la reparación cloacal sagital posterior. No hay consenso sobre la duración del sondaje uretral después de la reparación cloacal, pero típicamente varía de 1–2 semanas en TUM y hasta 4 semanas en UG separation. Algunos abogan por el drenaje vesical mediante vesicostomía, pero no es necesario. Las incisiones sagitales posteriores e introitales están en riesgo de dehiscencia, por lo que es fundamental evitar cualquier postura a horcajadas o hacer el “split” durante la cicatrización. También se recomienda evitar la presión perineal, y que no se sujete a los niños por el periné ni se sienten en saltadores o juguetes de montar a horcajadas. La anatomía posoperatoria se evalúa habitualmente con un examen clínico minucioso o mediante cistoscopia y examen bajo anestesia en el quirófano.
Manejo vesical posoperatorio
Tras la reparación quirúrgica de la malformación cloacal, es importante asegurar un vaciamiento vesical adecuado. La movilización quirúrgica y la disfunción vesical subyacente pueden conducir a retención urinaria o vaciamiento incompleto. Esto puede manejarse indicando a todos los niños realizar cateterismo intermitente tras retirar el catéter y ajustando el horario del cateterismo en función de los volúmenes urinarios. Otros utilizan la evaluación urodinámica preoperatoria para ayudar en la toma de decisiones sobre el CIC. No hay consenso sobre el manejo vesical posoperatorio con cateterismo. En un informe reciente de 18 niñas sometidas a reparación cloacal, el 44.4% requirió vaciamiento vesical asistido (CIC o vesicostomía) mientras que el resto se manejó con pañales.41 Los factores asociados con la necesidad de CIC después de la reparación fueron una mayor longitud del canal común, la separación UG y la necesidad de vaciamiento vesical asistido antes de la reparación quirúrgica. Es importante destacar que el manejo con pañales en el período preoperatorio no garantizó que pudiera evitarse el vaciamiento vesical asistido en el posoperatorio.
Manejo vaginal posoperatorio
La permeabilidad posoperatoria del introito vaginal se evalúa comúnmente mediante un examen exhaustivo en el consultorio o un examen bajo anestesia. Si el introito vaginal presenta estenosis a temprana edad en la infancia, puede observarse hasta que sea mayor y comience la pubertad. Si la estenosis es lo suficientemente grave como para impedir la salida del flujo menstrual, debe tratarse antes de la menarquia. Se recomienda la vigilancia ecográfica del tracto reproductivo comenzando 6–9 meses después del desarrollo del botón mamario y continuando cada 6–9 meses hasta la menarquia, evaluando el grosor endometrial en cada cuerpo uterino.15 Si se detecta obstrucción del flujo menstrual, debe consultarse a ginecología o endocrinología para iniciar supresión hormonal y temporizar hasta la intervención quirúrgica. Las técnicas quirúrgicas preferidas para la estenosis introital o vaginal incluyen la introitoplastia simple o la vaginoplastia con mucosa bucal.42 Muchos centros cuentan con especialistas en ginecología pediátrica y del adolescente que realizan el seguimiento de esto, aunque los urólogos pueden asumir esta atención donde no haya ginecólogos pediátricos disponibles.
Resultados a largo plazo
Función vesical
La continencia urinaria es difícil de evaluar debido a la complejidad y heterogeneidad de la población. Hendren informó ~60% de micción espontánea con “control urinario” y Peña informó de manera similar 54% de continencia y 46% que requerían cateterismo intermitente limpio (CIC). Sin embargo, ninguno de estos estudios informa definiciones de continencia ni presenta tasas de reconstrucción vesical.35,36 Más recientemente, se realizó una revisión de los resultados a largo plazo en 50 pacientes mayores de 3 años con malformación cloacal reparada. Este grupo informa que el 80% de las niñas logra “continencia social”, de las cuales 22% miccionan espontáneamente mientras que el resto realiza CIC.43 Este mismo grupo presentó un 46% que requirió un número medio de 4.7 procedimientos quirúrgicos para lograr la continencia. De nuevo, la definición de continencia no está bien definida y muchos de los que son “socialmente continentes” se sometieron a cirugía reconstructiva. Existe una gran necesidad de seguimiento a largo plazo en esta población para determinar los factores asociados con lograr la continencia y tasas de continencia fiables.
Función renal
La insuficiencia renal es una preocupación constante en las niñas con malformación cloacal. La serie más grande, de 64 pacientes, informa que más del 50% tienen TFG < 80 mL/min/1.73 m2 con 17% con enfermedad renal terminal, 6% que requirieron trasplante y 6% fallecidas por insuficiencia renal.44 Este mismo grupo destaca que el deterioro renal parece adquirirse con el tiempo, ya que el 66% de las niñas que progresaron a insuficiencia renal crónica tenían una creatinina sérica nadir normal. Otras series más pequeñas reportan resultados mucho más favorables, que van del 66–100% de niñas con función renal normal en un seguimiento de 5–9 años.45,46,47 Curiosamente, estas series son más recientes y provienen de instituciones con equipos multidisciplinarios que atienden a estas niñas. Nuevamente, el seguimiento a largo plazo por parte de centros de alto volumen que evalúen la función renal en estas pacientes es sumamente necesario.
Puntos clave
- La malformación cloacal representa la malformación anorrectal femenina más grave
- Las comorbilidades urológicas y sistémicas son frecuentes, incluidas las anomalías del tracto urinario superior, las anomalías müllerianas y la disfunción vesical. La evaluación urológica integral y la atención multidisciplinaria son fundamentales.
- El manejo inicial prioriza el drenaje temprano del hidrocolpos y la colostomía derivativa
- La cirugía para reparar la malformación cloacal se denomina anorrectovaginorrectoplastia sagital posterior (PSARVUP). Existen dos enfoques quirúrgicos principales: movilización urogenital total (para malformaciones menos graves) y separación urogenital (para anomalías más graves)
- Muchas niñas requieren cateterismo vesical. Faltan datos a largo plazo sobre los resultados de continencia y la función renal
Lecturas recomendadas
- Levitt MA, Peña A. Pitfalls in the management of newborn cloacas. Pediatr Surg Int 2005; 21: 264–269. DOI: 10.1007/s00383-005-1380-2.
- Harris KT, Kong L, Vargas M, Hou V, Pyrzanowski JL, Desanto K, et al.. Considerations and outcomes for adolescents and young adults with cloacal anomalies: a scoping review of urologic, colorectal, gynecologic and psychosocial concerns. Urology 2023. DOI: 10.1016/j.urology.2023.08.047.
Referencias
- AbouZeid AA, Mohammad SA, Shokry SS, El-Naggar O. Posterior cloaca: A urogenital rather than anorectal anomaly. J Pediatr Urol 2021; 17 (3): 410.e1–410.e7. DOI: 10.1016/j.jpurol.2021.01.014.
- Peña A, Bischoff A, Breech L, Louden E, Levitt MA. Posterior cloaca–further experience and guidelines for the treatment of an unusual anorectal malformation. J Pediatr Surg 2010; 45 (6): 1234–1240. DOI: 10.1016/j.jpedsurg.2010.02.095.
- Thomas DFM. The embryology of persistent cloaca and urogenital sinus malformations. Asian J Androl 2019; 22 (2): 124. DOI: 10.4103/aja.aja_72_19.
- Falcone RA, Levitt MA, Peña A, Bates M. Increased heritability of certain types of anorectal malformations. J Pediatr Surg 2007; 42 (1): 124–128. DOI: 10.1016/j.jpedsurg.2006.09.012.
- Skerritt C, DaJusta DG, Fuchs ME, Pohl H, Gomez-Lobo V, Hewitt G. Long-term urologic and gynecologic follow-up and the importance of collaboration for patients with anorectal malformations. Semin Pediatr Surg 2020; 29 (6): 150987. DOI: 10.1016/j.sempedsurg.2020.150987.
- Fuchs ME, Halleran DR, Bourgeois T, Sebastião Y, Weaver L, Farrell N, et al.. Correlation of anorectal malformation complexity and associated urologic abnormalities. J Pediatr Surg 2021; 56 (11): 1988–1992. DOI: 10.1016/j.jpedsurg.2021.02.051.
- Vilanova-Sanchez A, Halleran DR, Reck-Burneo CA. Re: A Descriptive Model for a Multidisciplinary Unit for Colorectal and Pelvic Malformations. J Urol 2019; 203 (4): 651–651. DOI: 10.1097/ju.0000000000000723.04.
- Warne SA, Wilcox DT, Creighton S, Ransley PG. Long-Term Gynecological Outcome of Patients with Persistent Cloaca. J Urol 2003; 170 (4 Part 2): 1493–1496. DOI: 10.1097/01.ju.0000086702.87930.c2.
- Mosiello GIOVANNI, Capitanucci MARIALUISA, Gatti CLAUDIA, Adorisio OTTAVIO, Lucchetti MARIACHIARA, Silveri MASSIMILIANO, et al.. How to Investigate Neurovesical Dysfunction in Children With Anorectal Malformations. J Urol 2003; 170 (4 Part 2): 1610–1613. DOI: 10.1097/01.ju.0000083883.16836.91.
- Goossens WJH, Blaauw I de, Wijnen MH, Gier RPE de, Kortmann B, Feitz WFJ. Urological anomalies in anorectal malformations in The Netherlands: effects of screening all patients on long-term outcome. Pediatr Surg Int 2011; 27 (10): 1091–1097. DOI: 10.1007/s00383-011-2959-4.
- Jindal B, Grover V, Bhatnagar V. The Assessment of Lower Urinary Tract Function in Children with Anorectal Malformations before and after PSARP. Eur J Pediatr Surg 2009; 19 (01): 34–37. DOI: 10.1055/s-2008-1039027.
- Warne STEPHANIEA, Godley MARGARETL, Wilcox DUNCANT. Surgical Reconstruction Of Cloacal Malformation Can Alter Bladder Function: A Comparative Study With Anorectal Anomalies. J Urol 2004; 172 (6 Part 1): 2377–2381. DOI: 10.1097/01.ju.0000145201.94571.67.
- Davies MRQ. Anatomy of the nerve supply of the rectum, bladder, and internal genitalia in anorectal dysgenesis in the male. J Pediatr Surg 1997; 32 (4): 536–541. DOI: 10.1016/s0022-3468(97)90702-8.
- Cardamone S, Creighton S. A gynaecologic perspective on cloacal malformations. Curr Opin Obstet Gynecol 2015; 27 (5): 345–352. DOI: 10.1097/gco.0000000000000205.
- Breech L. Gynecologic concerns in patients with anorectal malformations. Semin Pediatr Surg 2010; 19 (2): 139–145. DOI: 10.1053/j.sempedsurg.2009.11.019.
- Breech L. Gynecologic concerns in patients with cloacal anomaly. Semin Pediatr Surg 2016; 25 (2): 90–95. DOI: 10.1053/j.sempedsurg.2015.11.006.
- Levitt MA, Patel M, Rodriguez G, Gaylin DS, Pena A. Tethered Spinal Cord in Patients with Anorectal Malformations. Anorectal Malformations in Children 1997; 2 (3): 281–286. DOI: 10.1007/978-3-540-31751-7_18.
- Kim SM, Chang HK, Lee MJ. Re: Spinal Dysraphism With Anorectal Malformation: Lumbosacral Magnetic Resonance Imaging Evaluation of 120 Patients. J Urol 2010; 185 (3): 1094–1094. DOI: 10.1016/s0022-5347(11)60163-8.
- Beaufort CMC de, Groenveld JC, Mackay TM, Slot KM, Beer SA de, Jong JR de, et al.. Spinal cord anomalies in children with anorectal malformations: a retrospective cohort study. Pediatr Surg Int 2023; 39 (1): 281–286. DOI: 10.1007/s00383-023-05440-y.
- Muller CO, Crétolle C, Blanc T, Alova I, Jais J-P, Lortat-Jacob S, et al.. Impact of spinal dysraphism on urinary and faecal prognosis in 25 cases of cloacal malformation. J Pediatr Urol 2014; 10 (6): 1199–1205. DOI: 10.1016/j.jpurol.2014.05.012.
- Garvey EM, Fuller M, Frischer J, Calkins CM, Rentea RM, Ralls M, et al.. Multi-Institutional Review From the Pediatric Colorectal and Pelvic Learning Consortium of Minor Spinal Cord Dysraphism in the Setting of Anorectal Malformations: Diagnosis, Treatment, and Outcomes. J Pediatr Surg 2023; 58 (8): 1582–1587. DOI: 10.1016/j.jpedsurg.2023.04.009.
- Inserm. VACTERL/VATER association. Definitions 2011; 6 (56). DOI: 10.32388/m8pjt5.
- Levitt MA, Peña A. Anorectal malformations. Pediatr Surg Int 2007; 3-3 (2-3). DOI: 10.1007/bf00182758.
- Jacobs SE, Tiusaba L, Al-Shamaileh T, Bokova E, Russell TL, Ho CP, et al.. Fetal and Newborn Management of Cloacal Malformations. Children (Basel) 2022; 9 (6): 888. DOI: 10.3390/children9060888.
- Dannull KA, Browne LP, Meyers MZ. The spectrum of cloacal malformations: how to differentiate each entity prenatally with fetal MRI. Pediatr Radiol 2019; 49 (3): 387–398. DOI: 10.1007/s00247-018-4302-x.
- Bischoff A, Trecartin A, Alaniz V, Hecht S, Wilcox DT, Peña A. A cloacal anomaly is not a disorder of sex development. Pediatr Surg Int 2019; 35 (9): 985–987. DOI: 10.1007/s00383-019-04511-3.
- Vilanova-Sanchez A, Reck CA, Sebastião YV, Fuchs M, Halleran DR, Weaver L, et al.. Can sacral development as a marker for caudal regression help identify associated urologic anomalies in patients with anorectal malformation? J Pediatr Surg 2018; 53 (11): 2178–2182. DOI: 10.1016/j.jpedsurg.2018.03.018.
- VanderBrink BA, Reddy PP. Early urologic considerations in patients with persistent cloaca. Semin Pediatr Surg 2016; 25 (2): 82–89. DOI: 10.1053/j.sempedsurg.2015.11.005.
- Rink RC, Adams MC, Misseri R. A New Classification for Genital Ambiguity and Urogenital Sinus Anomalies. J Urol 2005; 175 (4): 1500–1501. DOI: 10.1016/s0022-5347(05)00847-5.
- Wood RJ, Reck-Burneo CA, Dajusta D. Re: Cloaca Reconstruction: A New Algorithm Which Considers the Role of Urethral Length in Determining Surgical Planning. J Urol 2018; 204 (6): 1368–1368. DOI: 10.1097/ju.0000000000001276.02.
- Patel MN, Racadio JM, Levitt MA, Bischoff A, Racadio JM, Peña A. Complex cloacal malformations: use of rotational fluoroscopy and 3-D reconstruction in diagnosis and surgical planning. Pediatr Radiol 2012; 42 (3): 355–363. DOI: 10.1007/s00247-011-2282-1.
- Halleran DR, Smith CA, Fuller MK, Durhm MM, Dickie B, Avansino JR, et al.. Measure twice and cut once: Comparing endoscopy and 3D cloacagram for the common channel and urethral measurements in patients with cloacal malformations. J Pediatr Surg 2020; 55 (2): 257–260. DOI: 10.1016/j.jpedsurg.2019.10.045.
- Chalmers DJ, Rove KO, Wiedel CA, Tong S, Siparsky GL, Wilcox DT. Clean intermittent catheterization as an initial management strategy provides for adequate preservation of renal function in newborns with persistent cloaca. J Pediatr Urol 2015; 11 (4): 211.e1–211.e4. DOI: 10.1016/j.jpurol.2015.05.014.
- Versteegh HP, Sutcliffe JR, Sloots CEJ, Wijnen RMH, Blaauw I de. Postoperative complications after reconstructive surgery for cloacal malformations: a systematic review. Tech Coloproctol 2015; 19 (4): 201–207. DOI: 10.1007/s10151-015-1265-x.
- Hendren WH. Cloaca, The Most Severe Degree of Imperforate Anus. Ann Surg 1998; 228 (3): 331–346. DOI: 10.1097/00000658-199809000-00006.
- Peña A. Total urogenital mobilization–An easier way to repair cloacas. J Pediatr Surg 1997; 32 (2): 263–268. DOI: 10.1016/s0022-3468(97)90191-3.
- Levitt MA, Peña A. Cloacal malformations: lessons learned from 490 cases. Semin Pediatr Surg 2010; 19 (2): 128–138. DOI: 10.1053/j.sempedsurg.2009.11.012.
- Reck-Burneo CA, Lane V, Bates DG. Re: The Use of Rotational Fluoroscopy and 3-D Reconstruction in the Diagnosis and Surgical Planning for Complex Cloacal Malformations. J Urol 2019; 204 (6): 1367–1368. DOI: 10.1097/ju.0000000000001276.01.
- Gasior AC, Reck C, Lane V, Wood RJ, Patterson J, Strouse R, et al.. Transcending Dimensions: a Comparative Analysis of Cloaca Imaging in Advancing the Surgeon’s Understanding of Complex Anatomy. J Digit Imaging 2019; 32 (5): 761–765. DOI: 10.1007/s10278-018-0139-y.
- Skerritt C, Wood RJ, Jayanthi VR, Levitt MA, Ching CB, DaJusta DG, et al.. Does a standardized operative approach in cloacal reconstruction allow for preservation of a patent urethra? J Pediatr Surg 2021; 56 (12): 2295–2298. DOI: 10.1016/j.jpedsurg.2021.01.011.
- Davis M, Mohan S, Russell T, Feng C, Badillo A, Levitt M, et al.. A prospective cohort study of assisted bladder emptying following primary cloacal repair: The Children’s National experience. J Pediatr Urol 2023; 19 (4): 371.e1–371.e11. DOI: 10.1016/j.jpurol.2023.03.017.
- Leeuwen K van, Baker L, Grimsby G. Autologous buccal mucosa graft for primary and secondary reconstruction of vaginal anomalies. Semin Pediatr Surg 2019; 28 (5): 150843. DOI: 10.1016/j.sempedsurg.2019.150843.
- Warne SA, Wilcox DT, Ransley PG. Long-term Urological Outcome of Patients Presenting with Persistent Cloaca. J Urol 2002; 168(4: 1859–1862. DOI: 10.1097/00005392-200210020-00048.
- Warne SA, Wilcox DT, Ledermann SE, Ransley PG. Renal Outcome in Patients With Cloaca. J Urol 2002; 67 (6): 2548–2551. DOI: 10.1097/00005392-200206000-00055.
- Braga LHP, Lorenzo AJ, Dave S, Del-Valle MH, Khoury AE, Pippi-Salle JL. Long-term renal function and continence status in patients with. Can Urol Assoc J 2007; 1 (4): 371. DOI: 10.5489/cuaj.442.
- DeFoor WR, Bischoff A, Reddy P, VanderBrink B, Minevich E, Schulte M, et al.. Chronic Kidney Disease Stage Progression in Patients Undergoing Repair of Persistent Cloaca. J Urol 2015; 194 (1): 190–194. DOI: 10.1016/j.juro.2015.01.080.
- Rink RC, Herndon CDA, Cain MP, Kaefer M, Dussinger AM, King SJ, et al.. Upper and lower urinary tract outcome after surgical repair of cloacal malformations: a three-decade experience. BJU Int 2005; 96 (1): 131–134. DOI: 10.1111/j.1464-410x.2005.05581.x.
- Levitt MA, Peña A. Pitfalls in the management of newborn cloacas. Pediatr Surg Int 2005; 21: 264–269. DOI: 10.1007/s00383-005-1380-2.
- Harris KT, Kong L, Vargas M, Hou V, Pyrzanowski JL, Desanto K, et al.. Considerations and outcomes for adolescents and young adults with cloacal anomalies: a scoping review of urologic, colorectal, gynecologic and psychosocial concerns. Urology 2023. DOI: 10.1016/j.urology.2023.08.047.
Última actualización: 2025-09-25 12:10