31: Hipospadias distal
Este capítulo durará aproximadamente 23 minutos para leer.
Introducción
En la literatura griega antigua, Aristóteles fue el primero en describir la disfunción urinaria resultante de una malformación peniana.1 Al médico griego Galeno se le atribuye haber acuñado el término hipospadias en el siglo II d. C.1 Al igual que sus primeros descriptores, la etimología del término hipospadias es griega, y deriva de las raíces hypo (debajo) y spadon (desgarro, fisura).
El hipospadias es una de las anomalías congénitas más frecuentes en los recién nacidos varones. Se caracteriza por la ubicación ventral del orificio uretral con detención del desarrollo de la porción ventral del pene, la uretra y el prepucio.2 Debido a esta detención del desarrollo, se produce una tubulización uretral incompleta, lo que resulta en un orificio uretral ectópico en la cara ventral del pene. Según la gravedad, el hipospadias suele asociarse con chordee ventral (curvatura peneana) y deficiencia del prepucio ventral, lo que da lugar a un prepucio en “capucha dorsal”. La localización anatómica del orificio uretral se utiliza habitualmente para la clasificación del hipospadias. El meato hipospádico puede localizarse en cualquier sitio desde el glande hasta el periné. Aproximadamente el 50% de los hipospadias son distales (glande, coronal y subcoronal), el 30% son medios (cuerpo del pene) y el 20% son proximales (penoescrotal, escrotal y perineal) (Figura 1).3,4 Este capítulo se centrará en la embriología, epidemiología, etiología, diagnóstico, evaluación, reparación, seguimiento y complicaciones del hipospadias distal. El hipospadias proximal se considera una presentación más grave y se tratará en otro capítulo.
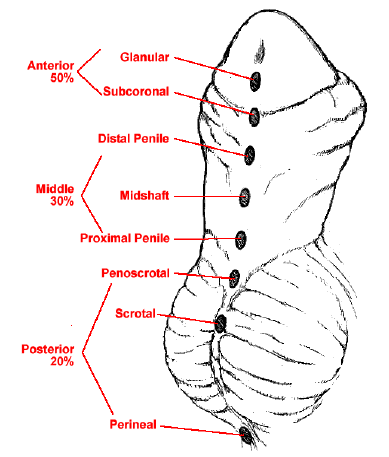
Figura 1 Espectro de presentaciones del hipospadias.4
Embriología
El desarrollo de los genitales externos masculinos comienza en una etapa ambisexual durante la quinta semana gestacional.5 Hasta las semanas séptima y octava, el tubérculo genital, el pliegue urogenital y los pliegues labioscrotales son idénticos.5,6 La diferenciación sexual comienza durante las semanas gestacionales 8 y 9, cuando la expresión del gen SRY inicia la diferenciación gonadal masculina y, por ende, la producción de andrógenos.5 Sin embargo, el desarrollo peneano ocurre mediante procesos tanto independientes de andrógenos como dependientes de andrógenos.7,8 Los procesos independientes de andrógenos son comunes tanto a varones como a mujeres e incluyen la formación del tubérculo genital, la placa uretral, el surco uretral, el glande, el prepucio y el cuerpo cavernoso.7 Los procesos dependientes de andrógenos incluyen la tubularización uretral, el desarrollo circunferencial del prepucio y la elongación peneana.6,7,8
La uretra masculina se desarrolla mediante un mecanismo de “doble cremallera” que comienza en la semana 8 de la gestación.9,10 En este proceso, la cremallera inicial de apertura implica la canalización distal de la placa uretral para formar el surco uretral. Le sigue una cremallera de cierre en sentido proximal a distal, a medida que los bordes mediales de los pliegues uretrales endodérmicos se fusionan para formar una uretra tubular. La cremallera continúa avanzando distalmente hasta que el meato uretral se sitúa en la punta del glande. Este proceso, junto con el desarrollo circunferencial del prepucio, está impulsado por la estimulación androgénica y suele completarse hacia la semana 17 de la gestación.7,8
La alteración de este proceso embriológico provoca un fallo en la adecuada fusión de los pliegues uretrales, lo que da lugar a un meato uretral en la cara ventral del pene.11 Además, una alteración impide que el prepucio se desarrolle circunferencialmente, lo que se manifiesta como un prepucio en capucha dorsal en la hipospadias.12
Epidemiología
El hipospadias es una de las anomalías congénitas más comunes en varones, presentándose en aproximadamente 1:200-300 nacidos vivos en los EE. UU., 1:500 en toda Europa y 1:2,000-3,000 en toda Asia.5,10,13 Aunque la incidencia de hipospadias varía en todo el mundo, varios estudios de bases de datos han mostrado un aumento drástico de la incidencia en la historia reciente. Hubo una duplicación de la tasa (de 0.2 a 0.4 por ciento) en los EE. UU. durante las décadas de 1970 y 1980.14 Es poco probable que este aumento se deba a mejoras en la detección, ya que hubo un incremento desproporcionado de los casos graves en comparación con los más leves. Más bien, influencias multifactoriales como la disrupción endocrina, exposiciones ambientales y la predisposición genética pueden contribuir a esta mayor tasa.11,15 Otras encuestas poblacionales también encontraron aumentos drásticos en la incidencia de hipospadias a finales del siglo XX, incluidos estudios de Canadá, Australia, Inglaterra, Noruega, Dinamarca, Finlandia, Japón e Italia, entre otros.3,16 Un estudio de base de datos de Washington encontró que la edad materna avanzada (>40 años), la diabetes materna preexistente y la raza blanca se asociaron de manera independiente cada una con un mayor riesgo de tener un recién nacido con hipospadias.15
Etiología/Patogénesis
La patogénesis de la hipospadias probablemente se deba a la alteración del metabolismo y de la respuesta a los andrógenos durante la gestación, ya que la estimulación androgénica es responsable de procesos clave en el desarrollo del pene.6,7,8 Estas alteraciones probablemente sean multifactoriales, con origen tanto en la predisposición genética como en las exposiciones ambientales.17
Genética
La evidencia que respalda una predisposición genética proviene del agrupamiento familiar reportado en hipospadias, ya que alrededor del 7% de los pacientes afectados tienen a otro familiar de primer, segundo o tercer grado también afectado, especialmente con el tipo “anterior” o distal.18 También se informó un antecedente familiar positivo de hipospadias en casi una cuarta parte de los niños con hipospadias.19 Se observó antecedente paterno de hipospadias en aproximadamente el 31% de los niños afectados.19
Los genes que se han asociado con un mayor riesgo de hipospadias están relacionados con defectos en el equilibrio hormonal androgénico durante el desarrollo. En concreto, genes que afectan a las enzimas metabolizadoras de andrógenos, a los receptores de andrógenos y a los receptores de estrógenos.20,21,22,23,24,25,26 Por ejemplo, la expresión de los receptores de andrógenos y de la 5 alfa-reductasa tipo 2 se ha localizado en el epitelio uretral ventral y el estroma, respectivamente, durante el desarrollo.26 Los defectos en su actividad pueden conducir a una remodelación uretral anómala y dar lugar a hipospadias.26 Algunos síndromes de anomalías congénitas que también pueden presentarse con hipospadias incluyen los síndromes WAGR, Denys-Drash, Smith-Lemli-Opitz, Opitz G y Frasier, entre casi 200 más.5,18,27
Ambiental
Existe una hipótesis de los dos golpes respecto del desarrollo del hipospadias, en la que la exposición ambiental a disruptores endocrinos puede potenciar los efectos de la predisposición genética al hipospadias.17 Algunas de las exposiciones identificadas que pueden aumentar el riesgo de hipospadias incluyen la ingesta materna de progestágenos relacionada con el embarazo, éteres difenílicos polibromados (retardantes de llama), tabaquismo materno, uso paterno de medicamentos con receta, exposición materna al dietilestilbestrol, suplementación materna con hierro y exposición paterna a pesticidas.28,29,30 De estas, solo la ingesta materna de progestágenos, los éteres difenílicos polibromados, el tabaquismo materno y el uso paterno de medicamentos con receta han demostrado ser estadísticamente significativos en los estudios.
Diagnóstico y evaluación
El hipospadias debe diagnosticarse al nacer durante un minucioso examen físico neonatal. Realizar una circuncisión neonatal está contraindicado en estos pacientes porque el prepucio a menudo se interpone durante la reconstrucción uretral, ya sea como colgajo vascularizado o injerto libre. Por lo tanto, establecer el diagnóstico durante el período neonatal es esencial para evitar extirpar el tejido prepucial disponible y útil mediante una circuncisión. Una exploración genitourinaria minuciosa de un paciente con hipospadias mostraría dos orificios uretrales: 1) una fosita uretral ciega en la localización glandar normal y 2) un orificio del verdadero meato uretral en la cara ventral del pene (Figura 2). Otros rasgos clásicos asociados con el hipospadias que pueden o no estar presentes incluyen un prepucio en capucha dorsal como resultado de la deficiencia de piel prepucial ventral y chordee ventral, o curvatura peneana. Una vez establecido el diagnóstico, el médico debe evaluar además al paciente en busca de otras anomalías congénitas asociadas relacionadas con causas sindrómicas.31 Sin embargo, aproximadamente el 90% de los casos son hipospadias aislados.31 La presencia simultánea de criptorquidia bilateral e hipospadias es sugestiva de un trastorno del desarrollo sexual (DSD), aunque se considera más frecuente en niños con hipospadias proximal.32 En cualquier caso, todo paciente con hipospadias y criptorquidia bilateral debe ser evaluado con un cariotipo, ecografía pélvica y electrolitos séricos para detectar pérdida salina secundaria a hiperplasia suprarrenal congénita (HSC).
Durante la consulta urológica, deben considerarse varios factores al contemplar la reparación. Debe realizarse un examen genitourinario exhaustivo por un urólogo pediátrico con experiencia para determinar la localización del meato uretral, el volumen del glande, la longitud del pene, el grado de curvatura peneana, la presencia de transposición penoescrotal y la profundidad y anchura de la placa uretral. La realización de estudios de imagen del aparato urinario no está indicada ni es necesaria en el hipospadias aislado.31 Estas características operatorias, además de la preferencia y experiencia del cirujano, desempeñan un papel en la planificación de la reparación. Por último, se deben discutir a fondo con los padres los riesgos y beneficios de la cirugía para permitir una toma de decisiones compartida.
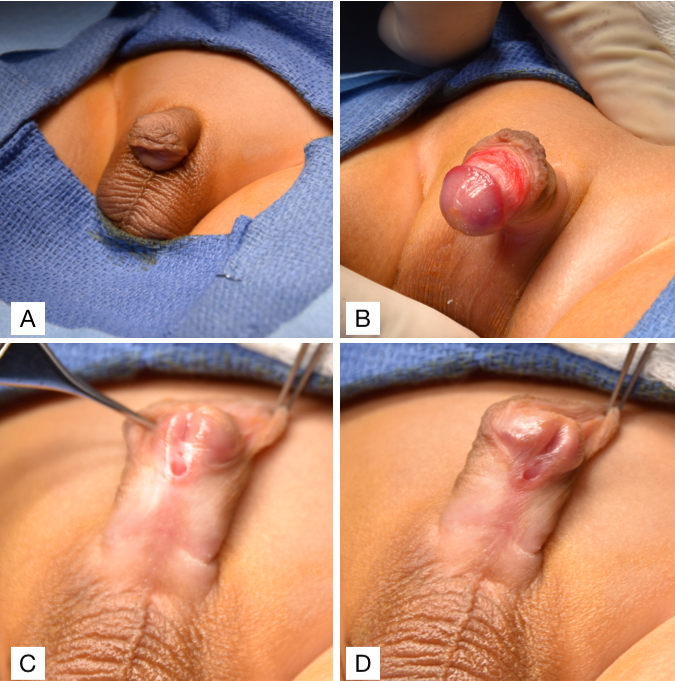
Figura 2 (A) Curvatura ventral del pene con prepucio en capucha dorsal. (B) Curvatura ventral del pene. (C y D) Hipospadias subcoronal con prepucio en capucha dorsal.
Planificación y manejo preoperatorios
Para la mayoría de los hipospadias distales, no se requiere reparación quirúrgica, especialmente en el hipospadias glandular en el que el chorro urinario es recto. Muchos de estos niños presentan micción normal y función sexual futura de su pene. La ubicación “normal” del meato se considera ampliamente como la punta distal del glande. Se ha informado una gran variación en la ubicación del meato con preservación de la función sexual y miccional durante la edad adulta en hombres con hipospadias no tratado.33,34 Una encuesta encontró que los hombres con hipospadias “más leves” o distales no tratados reportan dificultades con las relaciones sexuales asociadas a la curvatura, pero no problemas urinarios significativos en comparación con los hombres normales.35 Esto sugiere que la reparación del hipospadias distal debe centrarse en la corrección de la curvatura (chordee) y evitar la uretroplastia y sus complicaciones asociadas.43 Además, la infertilidad se considera un problema en el hipospadias proximal, no en el distal.34 Sin embargo, los pacientes con hipospadias coronal y medio peneano pueden presentar rociado o desviación del chorro urinario que los lleva a sentarse para orinar, o problemas estéticos que ocasionan futuras implicaciones psicosexuales. Por ello, muchos padres optan por la reparación quirúrgica del hipospadias distal de su hijo.
En cuanto al momento de la cirugía, la mayoría de los urólogos pediátricos coinciden en que la reparación puede realizarse a partir de los 6 meses de edad. Esto coincide con las guías de 1996 del comité de acción de la Sección de Urología de la Academia Americana de Pediatría, que señalan 6–12 meses como una edad aceptable para la reparación del hipospadias.44 Al optar por procedimientos en múltiples etapas, aunque esto es poco frecuente en el hipospadias distal, se recomiendan 6 meses entre procedimientos para permitir una adecuada cicatrización de la herida. Cabe destacar que deben hacerse esfuerzos para limitar el tiempo de anestesia en el niño, ya que la literatura emergente expresa preocupación por el efecto de la anestesia prolongada sobre el desarrollo cerebral en niños menores de 3 años.36
Existe debate entre los urólogos pediátricos sobre el uso de la estimulación androgénica preoperatoria en niños con hipospadias. Muchos urólogos abogan por su uso en niños con hipospadias grave con el fin de aumentar la longitud del falo, la circunferencia del glande, la vascularización peniana y la robustez de los tejidos para optimizar las características del pene para la reparación. Sin embargo, una revisión sistemática sugiere que la estimulación hormonal preoperatoria se asocia con una mayor tasa de complicaciones posoperatorias en pacientes con hipospadias proximal, aunque no alcanzó significación estadística.37 Cuando se considera necesario, utilizamos dos dosis de 25 mg de depo-testosterone por vía intramuscular, con un intervalo de seis semanas entre dosis.
Profilaxis antibiótica y analgésica
La profilaxis antibiótica es de uso común entre los urólogos pediátricos con el fin de minimizar el riesgo de infecciones del sitio quirúrgico y del tracto urinario, especialmente en reparaciones con stent.38 Sin embargo, las preocupaciones por el aumento de las tasas de resistencia a los antibióticos han planteado interrogantes sobre la eficacia de la profilaxis antibiótica. Estudios retrospectivos no han encontrado diferencias significativas en infecciones del sitio quirúrgico y del tracto urinario con y sin el uso de profilaxis antibiótica preoperatoria en la reparación del hipospadias.39,40 No obstante, estudios adicionales con tamaños de muestra mayores serían útiles para clarificar mejor la eficacia de esta práctica. En nuestra institución, utilizamos cefazolina (30 mg/kg) por vía intravenosa como profilaxis antibiótica preoperatoria al momento de la inducción anestésica. En cuanto a la profilaxis antibiótica posoperatoria, se ha informado que el 91% de los urólogos pediátricos prescriben antibióticos posoperatorios cuando se deja un catéter uretral colocado.38 Sin embargo, un metanálisis reciente que evaluó los efectos de la profilaxis antibiótica posoperatoria tras la reparación del hipospadias encontró una utilidad limitada para prevenir complicaciones infecciosas y de cicatrización de la herida, aunque el riesgo de sesgo fue alto en muchos de los estudios.41 Actualmente está en curso un ensayo clínico aleatorizado, internacional y multiinstitucional que evalúa la profilaxis posoperatoria.42 En nuestra institución, indicamos TMP-SMX por vía oral 2 mg/kg diarios durante el tiempo que permanezca el catéter.
Proporcionar a los pacientes una analgesia adecuada es especialmente importante en esta población, ya que muchos niños que se someten a reparación de hipospadias son demasiado pequeños para comunicarse verbalmente. Se emplean diversas técnicas analgésicas en la reparación del hipospadias, entre ellas el bloqueo caudal y los bloqueos de nervios periféricos (bloqueo del nervio dorsal del pene y bloqueo del nervio pudendo). Existe un debate continuo sobre la eficacia de estas diferentes técnicas y sus efectos en los desenlaces posoperatorios. Un metanálisis de ensayos controlados aleatorizados y estudios observacionales que comparó el bloqueo caudal frente a los bloqueos de nervios periféricos no encontró diferencias significativas en el uso de analgésicos adicionales dentro de las 24 horas posteriores a la cirugía, pero sí puntuaciones de dolor más bajas a las 24 horas tras la cirugía con un bloqueo caudal.43 Los autores también informan que los bloqueos caudales no conllevan un riesgo adicional de complicaciones posoperatorias.43 Por el contrario, otro metanálisis encontró una asociación significativa entre la analgesia con bloqueo caudal y las complicaciones posoperatorias tras la reparación del hipospadias, aunque es probable que estos datos estuvieran confundidos por la gravedad del hipospadias.44 Se necesitan datos aclaratorios adicionales para determinar la técnica analgésica más eficaz y segura. En nuestra institución, el cirujano prefiere un bloqueo caudal preoperatorio para el control del dolor.
Reparación de hipospadias distal
La reparación del hipospadias debe orientarse a lograr los siguientes tres objetivos principales: capacidad de orinar cómodamente en posición de pie, un chorro miccional adecuado y un aspecto y una función del pene “normales”.45 Aunque existe variación normal en el aspecto del pene, el objetivo típico es crear un meato vertical, en hendidura, en la punta glandar distal.46 La mayoría, si no todas, de las reparaciones de hipospadias distales pueden lograr estos objetivos cuando se utiliza la técnica de placa incisa tubularizada (TIP).47,48 La técnica de reparación original de Thiersch-Duplay fue complementada y popularizada por la técnica TIP, descrita por primera vez por Snodgrass en 1994.47,49 Su modificación consistió en una incisión longitudinal profunda en la línea media de la porción dorsal de la placa uretral, lo que permite el ensanchamiento de la placa uretral para facilitar la tubularización. Estos son los pasos que realizamos en nuestra institución, que constituye una variación de la técnica TIP (Video recomendado, (Figura 3), y (Figura 4)50,51
- Insertar una sonda de alimentación de 5 Fr a través del meato hipospádico, colocar puntos de tracción a ambos lados del futuro meato distal y colocar el torniquete peneano.
- Realizar incisiones verticales en cada borde de la placa uretral y luego una incisión transversal proximal al meato que conecte ambas.
- Separar el colgajo del glande y realizar una incisión media dorsal de la placa uretral.
- Se realiza la uretroplastia utilizando sutura PDS 6-0 para un cierre subepitelial de una sola capa con puntos continuos sobre la sonda de alimentación de 5 Fr.
- Se obtiene un colgajo lateral de dartos y se utiliza para cubrir la línea de sutura.
- La glanuloplastia se completa reaproximando ventralmente los colgajos del glande.
- Desenfundar el pene hasta la base.
- Circuncidar el exceso de piel prepucial y medir el grado de curvatura peneana.
- Reaproximar la piel ventral del eje peneano.
- Fijar la sonda de alimentación al glande y aplicar una película hidrocoloide delgada, compresiva, impermeable y estéril, seguida de un vendaje adhesivo transparente, delgado, impermeable y estéril en envoltura para mantener el pene elevado (Figura 3)
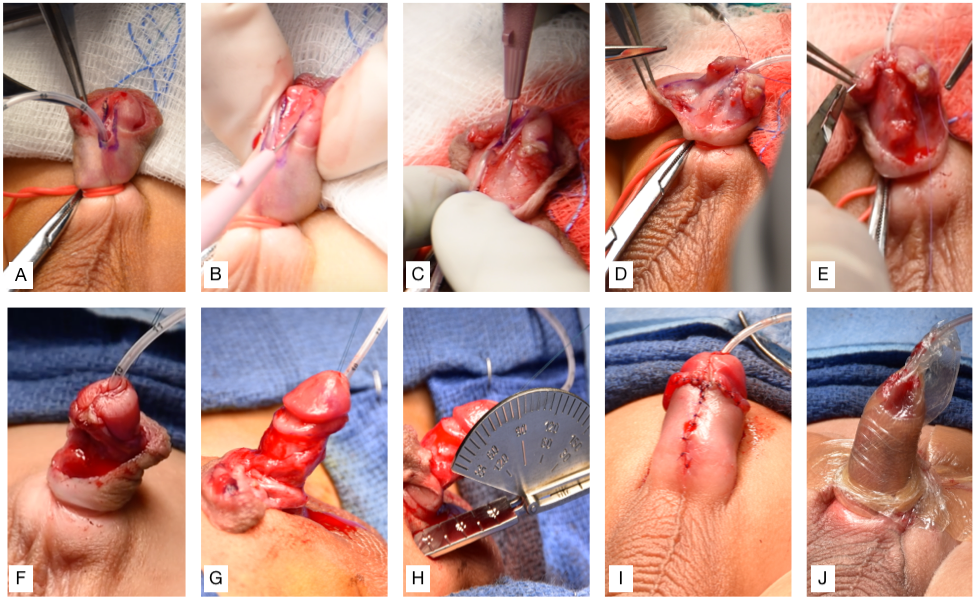
Figura 3 (A) Inserción de una sonda de alimentación de 5 Fr a través del meato hipospádico, colocación de suturas de tracción a ambos lados del futuro meato distal y colocación del torniquete peneano. (B) Incisiones verticales en cada borde de la placa uretral, luego una incisión transversal que conecta ambas. (C) Separación del colgajo del glande e incisión en la línea media de la placa uretral. (D) Uretroplastia. (E) Se utiliza un colgajo de dartos para cubrir la línea de sutura. (F) La glanuloplastia se completa reaproximando el colgajo del glande. (G) Desenfundamiento del pene. (H) Circuncisión y evaluación del grado de curvatura peneana con un goniómetro. (I) Reaproximación de la piel ventral. (J) Fijación de la sonda de alimentación al glande y colocación de un vendaje para mantener el pene elevado.
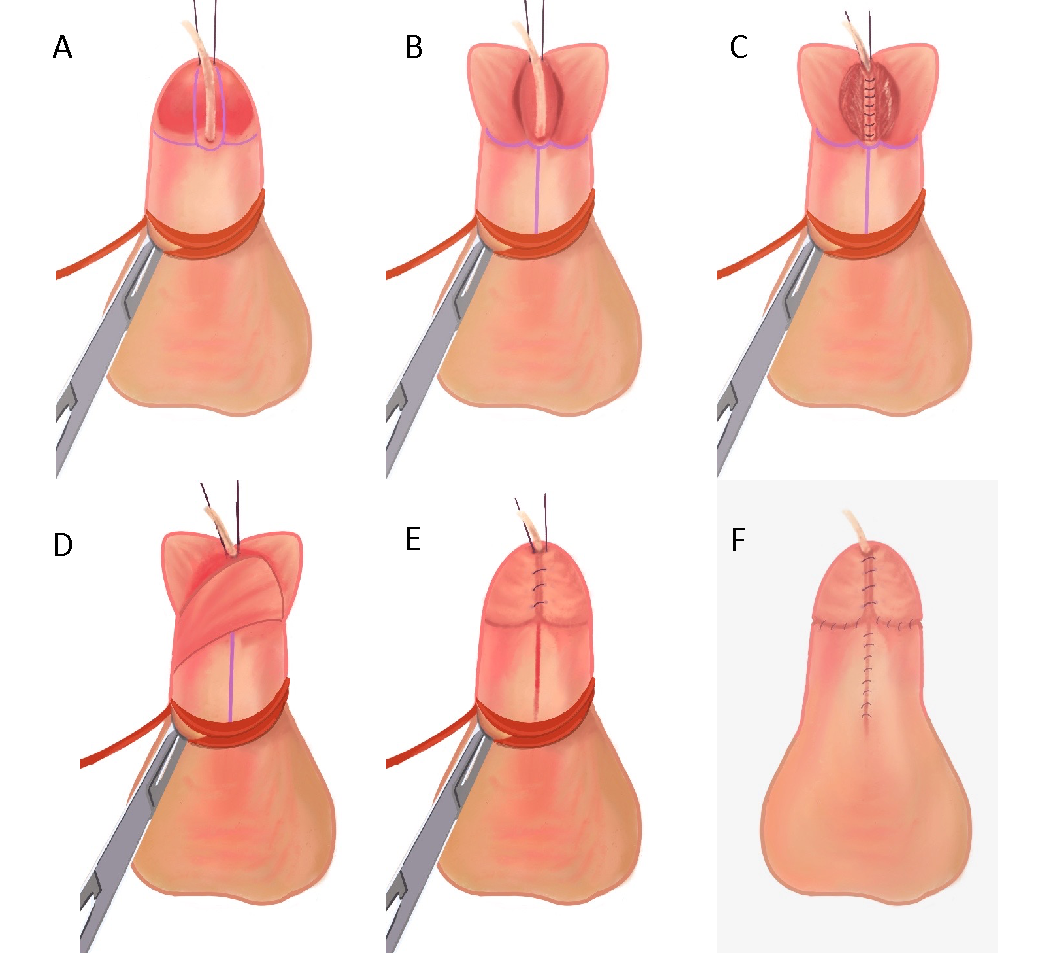
Figura 4 (A) Sonda de alimentación de 5 Fr insertada a través del meato hipospádico, con puntos de tracción colocados a ambos lados del futuro meato distal y torniquete peneano en su lugar. (B) Incisiones verticales en cada borde de la placa uretral, luego una incisión de cruce que conecta ambas. Se separan los colgajos del glande y se incide la placa uretral en la línea media. (C) Se realiza la uretroplastia con sutura PDS 6-0 para un cierre subepitelial de una sola capa con sutura continua sobre la sonda de alimentación de 5 French. (D) Se utiliza un colgajo de dartos para cubrir la línea de sutura. (E) La glanuloplastia se completa reaproximando los colgajos del glande. (F) Reaproximación de la piel ventral tras el desenfundamiento y la circuncisión.
La técnica de placa incisa tubularizada (TIP) es ampliamente aceptada como el método de elección para la reparación del hipospadias distal. Las reparaciones de hipospadias en nuestra institución se realizan utilizando una variación de la técnica TIP, en la que el colgajo de dartos se obtiene de la cara lateral y no de la dorsal del pene, pues este es nuestro método preferido. Otras técnicas, como el procedimiento de Mathieu, la reparación con colgajo en isla onlay de Duckett y la técnica MAGPI, también son opciones. Sin embargo, el abordaje TIP ha mostrado de forma consistente bajas tasas de complicaciones, especialmente entre cirujanos con alto volumen de casos.52,53 Además de las bajas tasas de complicaciones, los resultados estéticos tras la TIP han sido evaluados y calificados como mejores en comparación con el procedimiento de Mathieu y las reparaciones con colgajo en isla onlay de Duckett.46 La favorable estética del abordaje TIP se atribuye a la creación de un orificio uretral en hendidura vertical, a diferencia del orificio uretral circular del procedimiento de Mathieu. También existe variación en las técnicas de sutura de la uretroplastia dentro del procedimiento TIP, que puede realizarse con puntos interrumpidos o sutura continua. Los estudios comparativos de técnicas de uretroplastia con puntos interrumpidos frente a sutura continua en la reparación del hipospadias distal no encontraron diferencias significativas en las tasas de complicaciones, por lo que la elección se deja a la preferencia del cirujano.48,54
Video recomendado
Cuidados postoperatorios y seguimiento
En nuestra institución, la reparación del hipospadias se realiza como un procedimiento ambulatorio y los pacientes son dados de alta el mismo día. Cateterizamos a todos nuestros pacientes con una sonda de alimentación blanda de 5-French y la fijamos al glande con una sutura de fijación, que permanece en su lugar durante 5–7 días. Se cuestiona si la reparación del hipospadias debe realizarse con sonda, como clásicamente se hace para la derivación urinaria, o sin sonda, para prevenir el espasmo vesical y las molestias de la retirada de la sonda. Un metanálisis de ensayos clínicos aleatorizados y estudios de cohortes comparó las tasas de complicaciones precoces (espasmo vesical, disuria, ITU, fallo de la sonda, extravasación de orina, sangrado, retención urinaria, etcétera) y tardías (estenosis meatal, estenosis, fístula, divertículo, dehiscencia del glande y otras tasas de reintervención) tras la reparación distal de hipospadias con técnica TIP con sonda vs sin sonda.55 No hubo diferencias significativas ni en las tasas de complicaciones precoces ni en las tardías entre las reparaciones TIP con sonda y sin sonda en el metanálisis global y en el conjunto de ECA; sin embargo, la evidencia se consideró de calidad baja a moderada. Se necesitan más ECA para determinar realmente su impacto en la reparación del hipospadias distal.
Los apósitos se utilizan con frecuencia para optimizar la cicatrización posoperatoria al promover la inmovilización, la protección del sitio quirúrgico, la adherencia tisular y la compresión.56 En la actualidad, no hay consenso sobre el tipo de apósito más eficaz, o siquiera sobre si aplicar un apósito aporta algún beneficio. Un ensayo aleatorizado no encontró diferencias significativas en las tasas de complicaciones ni en los resultados clínicos al comparar pacientes con y sin vendaje tras la reparación de hipospadias.56 Cabe señalar que hubo un aumento significativo de llamadas posoperatorias de los padres en el grupo sin vendaje. Aplicamos un apósito hidrocoloide compresivo seguido de un vendaje adhesivo que mantiene el pene elevado para minimizar el edema. En el caso de los pacientes que aún no tienen control de esfínteres, recomendamos doble pañal mientras el catéter esté colocado. Hacemos un orificio en el pañal interior para permitir el paso del catéter y su drenaje hacia el pañal exterior. El catéter y el apósito se retiran en la primera visita de seguimiento posoperatorio del paciente a los 5–7 días. Si el paciente tiene control de esfínteres, o bien mantenemos la sonda de alimentación y drenamos hacia pañales de entrenamiento, o utilizamos un catéter suprapúbico para el drenaje urinario, pero nunca colocamos una sonda Foley. Prescribimos TMP-SMX oral 2 mg/kg al día durante el tiempo que el catéter esté colocado. También prescribimos oxibutinina 0.2 mg/kg dos veces al día hasta retirar el catéter para prevenir espasmos vesicales.
El bloqueo caudal preoperatorio ayuda a aliviar el dolor posoperatorio. El control adicional del dolor se logra generalmente con dosis bajas de analgésicos antiinflamatorios no esteroideos (AINE). Si bien existe variación en la prescripción de opioides para niños tras la reparación de hipospadias, los urólogos pediátricos están tendiendo a abandonar esta práctica. Una iniciativa de mejora de la calidad que empleó educación y un régimen analgésico no opioide predeterminado logró reducir las prescripciones de opioides tras la reparación de hipospadias.57 Encontraron resultados equivalentes en dolor y función utilizando la alternancia de acetaminofén e ibuprofeno, lo que sugiere que los opioides pueden omitirse de forma segura y aun así lograr un control posoperatorio del dolor adecuado.57 Ninguno de nuestros pacientes recibe opioides, ya que procuramos minimizar la exposición a opioides en los niños.
Nuestro cronograma de seguimiento posoperatorio consiste en regresar a consulta a la semana (para la retirada del apósito), y luego nuevamente al mes, a los tres, seis y doce meses También se programa a los pacientes para regresar a consulta al menos una vez después del entrenamiento para el control de esfínteres. Enfatizamos a los padres la importancia del seguimiento posoperatorio para optimizar los resultados y la satisfacción del paciente, especialmente porque las complicaciones pueden presentarse muchos años después de la reparación.58
Complicaciones
La mayoría de los pacientes que se someten a reparación de hipospadias distal tienen resultados quirúrgicos exitosos. Sin embargo, algunos pacientes pueden desarrollar complicaciones posoperatorias que ameritan reintervención. Las complicaciones tempranas que pueden ocurrir incluyen sangrado, infección, dehiscencia, desplazamiento del catéter y obstrucción urinaria. Las complicaciones tardías que pueden desarrollarse son fístula uretrocutánea, estenosis meatal, dehiscencia del glande, estenosis de la neouretra, divertículo uretral y balanitis xerótica obliterante (BXO).50
Una revisión sistemática que comprendió 1872 pacientes sometidos a reparación de hipospadias distal mediante la técnica TIP en 15 series de casos encontró una tasa de fístula uretrocutánea del 3,8%, una tasa de estenosis meatal del 3,1% y una tasa de estenosis de la neouretra del 0%.59 Otra revisión sistemática de 624 pacientes sometidos a reparación de hipospadias distal mediante la técnica TIP en 16 estudios encontró una tasa de fístula uretrocutánea del 11,1%, una tasa de estenosis meatal del 6,7% y una tasa de dehiscencia del 4,2%.60 Complicaciones como estas a menudo requieren una reintervención quirúrgica para prevenir el empeoramiento de la gravedad del problema. Es notable que las reparaciones distales primarias tienen tasas más bajas de reoperación en comparación con las reparaciones secundarias y las reparaciones proximales primarias.61 Al planificar una reoperación, es importante esperar al menos 6 meses desde la operación inicial para permitir una adecuada cicatrización de los tejidos.
Puntos clave
- El hipospadias es una de las anomalías congénitas más frecuentes en varones recién nacidos, presentándose en aproximadamente 1 por cada 200-300 nacidos vivos.
- La alteración de la fusión de los pliegues uretrales da lugar a que el orificio uretral se ubique en la cara ventral del pene.
- Hipótesis de los dos golpes: la exposición ambiental a disruptores endocrinos potencia los efectos de la predisposición genética a la hipospadias.
- Dos orificios uretrales en el examen: 1) una fosita uretral de terminación ciega en la localización normal del glande y 2) un orificio del meato uretral verdadero en la cara ventral del pene.
- Otros rasgos clásicos asociados con la hipospadias incluyen un prepucio en capucha dorsal y curvatura ventral del pene (chordee).
- La reparación de la hipospadias puede realizarse a partir de los 6 meses de edad.
- La técnica de placa uretral incisa tubularizada (TIP) es ampliamente aceptada como el método de elección para la reparación de la hipospadias distal.
- Las complicaciones más frecuentes de la reparación de la hipospadias incluyen fístula uretrocutánea, estenosis meatal, dehiscencia del glande y estenosis de la neouretra, aunque las tasas son bajas para la reparación distal.
Conclusión
La hipospadias es una de las anomalías congénitas más comunes en los recién nacidos varones. Se debe a una detención del desarrollo peniano que resulta en un fracaso de la adecuada fusión de los pliegues uretrales. La hipospadias se atribuye a una etiología multifactorial que deriva de la predisposición genética y de exposiciones ambientales. Deben realizarse una anamnesis y un examen físico exhaustivos para establecer adecuadamente el diagnóstico de hipospadias y evaluar las características de riesgo del paciente. La corrección quirúrgica puede realizarse desde los 6 meses de edad y suele llevarse a cabo mediante la técnica de placa incisa tubularizada. Aunque la reparación de la hipospadias distal se ha informado de manera consistente con resultados excelentes, es necesario un seguimiento a largo plazo para monitorizar la aparición de complicaciones y garantizar la satisfacción del paciente.
Recursos para pacientes
Lecturas recomendadas
- HJR H, LL W. Hypospadias, all there is to know. Eur J Pediatr 2017; 176 (4): 435–441. DOI: 10.1007/s00431-017-2864-5.
- Baskin L. What Is Hypospadias? Clin Pediatr (Phila. 2017; 56 (5): 409–418.
- Snodgrass WT, Bush NC, Wein AJ, Kavoussi LR, Partin AW, Peters C. Chapter 147. Hypospadias. Eleventh, Philadelphia, PA: Elsevier; 2016.
Referencias
- Laios K, Karamanou M, Androutsos G. A unique representation of hypospadias in ancient Greek art. Can Urol Assoc J 2012; 6 (1). DOI: 10.5489/cuaj.382.
- Baskin LS, Ebbers MB. Hypospadias: anatomy, etiology, and technique. Journal of Pediatric Surgery 2006; 41 (3): 463–472. DOI: 10.1016/j.jpedsurg.2005.11.059.
- Schneuer FJ, Holland AJA, Pereira G, Bower C, Nassar N. Prevalence, repairs and complications of hypospadias: an Australian population-based study. Arch Dis Child 2015; 100 (11): 1038–1043. DOI: 10.1136/archdischild-2015-308809.
- Newborn Clinical Guideline - Hypospadias [Internet. .
- Blaschko SD, Cunha GR, Baskin LS. Molecular Mechanisms of External Genitalia Development. Differentiation 2012; 84 (3): 261–268. DOI: 10.1016/j.diff.2012.06.003.
- Baskin L, Shen J, Sinclair A. Development of the Human Penis and Clitoris. Differentiation 2018; 103: 74–85. DOI: 10.1016/j.diff.2018.08.001.
- Cunha GR, Liu G, Sinclair A. Androgen-independent events in penile development in humans and animals. Differentiation 2020; 111: 98–114. DOI: 10.1016/j.diff.2019.07.005.
- Liu X, Liu G, Shen J. Human Glans and Preputial Development. Differentiation 2018; 103: 86–99. DOI: 10.1016/j.diff.2018.08.002.
- Li Y, Sinclair A, Cao M. Canalization of the Urethral Plate Precedes Fusion of the Urethral Folds during Male Penile Urethral Development: The Double Zipper Hypothesis. J Urol 2015; 193 (4): 1353–1360. DOI: 10.1016/j.juro.2014.09.108.
- Baskin LS, Erol A, Jegatheesan P, Li Y, Liu W, Cunha GR. Urethral seam formation and hypospadias. Cell Tissue Res 2001; 305 (3): 379–387. DOI: 10.1007/s004410000345.
- Baskin LS, Himes K, Colborn T. Hypospadias and endocrine disruption: is there a connection? Environ Health Perspect 2001; 109 (11): 1175–1183. DOI: 10.1289/ehp.011091175.
- Baskin L. What Is Hypospadias? Clin Pediatr (Phila. 2017; 56 (5): 409–418.
- Bergman J, Loane M, Vrijheid M. Epidemiology of hypospadias in Europe: a registry-based study. World Journal of Urology 2015; 33. DOI: 10.1007/s00345-015-1507-6.
- Li Y, Mao M, Dai L. Time trends and geographic variations in the prevalence of hypospadias in China. Birth Defects Research Part A: Clinical And Molecular Teratology 2012; 94 (1): 36–41. DOI: 10.1002/bdra.22854.
- S CK, S KK, Y PH. Trends in the incidence of cryptorchidism and hypospadias of registry-based data in Korea: a comparison between industrialized areas of petrochemical estates and a non-industrialized area. Asian J Androl 2011; 13 (5): 715–718. DOI: 10.1038/aja.2010.53.
- Springer A, Heijkant M, Baumann S. Worldwide prevalence of hypospadias. Journal of Pediatric Urology 2016; 12 (3). DOI: 10.1016/j.jpurol.2015.12.002.
- Paulozzi LJ, Erickson JD, Jackson RJ. Hypospadias Trends in Two US Surveillance Systems. Pediatrics 1997; 100 (5): 831–834. DOI: 10.1016/s0022-5347(01)63643-7.
- Porter MP, Faizan MK, Grady RW, Mueller BA. Hypospadias in Washington State: maternal risk factors and prevalence trends. Pediatrics 2005; 115 (4). DOI: 10.1542/peds.2004-1552.
- Brouwers MM, Feitz WFJ, Roelofs LAJ, Kiemeney LALM, Gier RPE, Roeleveld N. Risk factors for hypospadias. Eur J Pediatr 2007; 166 (7): 671–678. DOI: 10.1007/s00431-006-0304-z.
- Carmichael SL, Shaw GM, Laurent C, Croughan MS, Olney RS, Lammer EJ. Maternal progestin intake and risk of hypospadias. Arch Pediatr Adolesc Med 2005; 159 (10): 957–962. DOI: 10.1016/s0084-4071(08)70428-7.
- Baskin LS. Can we prevent hypospadias? Journal of Pediatric Urology 2007; 3 (6): 420–425. DOI: 10.1016/j.fertnstert.2007.12.024.
- Carmichael SL, Ma C, Choudhry S, Lammer EJ, Witte JS, Shaw GM. Hypospadias and genes related to genital tubercle and early urethral development. J Urol 2013; 190 (5): 1884–1892. DOI: 10.1016/j.juro.2013.05.061.
- Ollivier M, Paris F, Philibert P. Family History is Underestimated in Children with Isolated Hypospadias: A French Multicenter Report of 88 Families. J Urol 2018; 200 (4): 890–894. DOI: 10.1016/j.juro.2018.04.072.
- LFM Z, LM, WFJ F, B F, M KNV, N R. Aetiology of hypospadias: a systematic review of genes and environment. Hum Reprod Update 2012; 18 (3): 260–283. DOI: 10.1093/humupd/dms002.
- HJR H, LL W. Hypospadias, all there is to know. Eur J Pediatr 2017; 176 (4): 435–441. DOI: 10.1007/s00431-017-2864-5.
- Paulozzi LJ. International trends in rates of hypospadias and cryptorchidism. Environ Health Perspect 1999; 107 (4): 297–302. DOI: 10.1289/ehp.99107297.
- Lund L, Engebjerg MC, Pedersen L, Ehrenstein V, Nørgaard M, Sørensen HT. Prevalence of hypospadias in Danish boys: a longitudinal study, 1977-2005. Eur Urol 2009; 55 (5): 1022–1026. DOI: 10.1016/s8756-5005(09)79126-7.
- Abdullah NA, Pearce MS, Parker L, Wilkinson J JR, B MN, R.J.Q.. Birth prevalence of cryptorchidism and hypospadias in northern England, 1993-2000. Arch Dis Child 2007; 92 (7): 576–579. DOI: 10.1136/adc.2006.102913.
- Nassar N, Bower C, Barker A. Increasing prevalence of hypospadias in Western Australia, 1980-2000. Arch Dis Child 2007; 92 (7): 580–584. DOI: 10.1136/adc.2006.112862.
- Choudhry S, Baskin LS, Lammer EJ. Genetic polymorphisms in ESR1 and ESR2 genes, and risk of hypospadias in a multiethnic study population. J Urol 2015; 193 (5): 1625–1631. DOI: 10.1016/j.juro.2014.11.087.
- Kalfa N, Liu B, Klein O, Wang M-H, Cao M, Baskin LS. Genomic variants of ATF3 in patients with hypospadias. J Urol 2008; 180 (5): 2188.
- Liu B, Wang Z, Lin G. Activating transcription factor 3 is up-regulated in patients with hypospadias. Pediatr Res 2005; 58 (6): 1280–1283. DOI: 10.1203/01.pdr.0000187796.28007.2d.
- Wang Z, Liu BC, Lin GT. Up-Regulation of Estrogen Responsive Genes in Hypospadias: Microarray Analysis. The Journal of Urology 2007; 177 (5): 1939–1946. DOI: 10.1016/j.juro.2007.01.014.
- Qiao L, Tasian GE, Zhang H. Androgen receptor is overexpressed in boys with severe hypospadias, and ZEB1 regulates androgen receptor expression in human foreskin cells. Pediatr Res 2012; 71 (4 Pt 1): 393–398. DOI: 10.1016/j.yuro.2012.07.021.
- Kojima Y, Koguchi T, Mizuno K. Single Nucleotide Polymorphisms of HAAO and IRX6 Genes as Risk Factors for Hypospadias. J Urol 2019; 201 (2): 386–392.
- Kim K, Liu W, Cunha GR. Expression of the androgen receptor and 5α-reductase type 2 in the developing human fetal penis and urethra. Cell Tissue Res 2002; 307 (2): 145–153. DOI: 10.1007/s004410100464.
- Edery P. Genetics of hypospadias. Dialogues Pediatr Urol 2007; 28: 3–6. DOI: 10.1016/j.jpurol.2007.01.087.
- Poon S, Koren G, Carnevale A. Association of In Utero Exposure to Polybrominated Diphenyl Ethers With the Risk of Hypospadias. JAMA Pediatr 2018; 172 (9): 851–856. DOI: 10.1001/jamapediatrics.2018.1492.
- Snodgrass WT, Bush NC, Wein AJ, Kavoussi LR, Partin AW, Peters C. Chapter 147. Hypospadias. Eleventh, Philadelphia, PA: Elsevier; 2016.
- Tasian GE, Zaid H, Cabana MD, Baskin LS. Proximal hypospadias and risk of acquired cryptorchidism. J Urol 2010; 184 (2): 715–720. DOI: 10.1016/j.juro.2010.03.056.
- Fichtner J, Filipas D, Mottrie AM, Voges GE, Hohenfellner R. Analysis of meatal location in 500 men: wide variation questions need for meatal advancement in all pediatric anterior hypospadias cases. J Urol 1995; 154 (2 Pt 2): 833–834. DOI: 10.1016/s0022-5347(01)67177-5.
- Dodds PR, Batter SJ, Shield DE, Serels G SR, FA M, P.K.. Adaptation of Adults to Uncorrected Hypospadias. Urology 2008; 71 (4): 682–685. DOI: 10.1016/j.urology.2007.07.078.
- Schlomer B, Breyer B, Copp H, Baskin L, DiSandro M. Do adult men with untreated hypospadias have adverse outcomes? A pilot study using a social media advertised survey. J Pediatr Urol 2014; 10 (4): 672–679. DOI: 10.1016/j.jpurol.2014.01.024.
- Timing of elective surgery on the genitalia of male children with particular reference to the risks, benefits, and psychological effects of surgery and anesthesia. American Academy of Pediatrics; 1996, DOI: 10.1542/peds.97.4.590.
- Adler AC, Chandrakantan A, Sawires Y. Analysis of 1478 Cases of Hypospadias Repair. The Incidence of Requiring Repeated Anesthetic Exposure as Well as Exploration of the Involvement of Trainees on Case Duration. Anesth Analg 2019.
- Wright I, Cole E, Farrokhyar F, Pemberton J, Lorenzo AJ, Braga LH. Effect of preoperative hormonal stimulation on postoperative complication rates after proximal hypospadias repair: a systematic review. J Urol 2013; 190 (2): 652–659. DOI: 10.1016/j.juro.2013.02.3234.
- Hsieh MH, Wildenfels P, Gonzales ET. Surgical antibiotic practices among pediatric urologists in the United States. Journal of Pediatric Urology 2011; 7 (2): 192–197. DOI: 10.1016/j.jpurol.2010.05.001.
- Smith J, Patel A, Zamilpa I. Analysis of preoperative antibiotic prophylaxis in stented, distal hypospadias repair. Can J Urol 2017; 24 (2): 8765–8769.
- Baillargeon E, Duan K, Brzezinski A. The role of preoperative prophylactic antibiotics in hypospadias repair. Can Urol Assoc J 2014; 8 (7-8): 236–240. DOI: 10.5489/cuaj.1838.
- Chua ME, Kim JK, Rivera KC. The use of postoperative prophylactic antibiotics in stented distal hypospadias repair: a systematic review and meta-analysis. Journal of Pediatric Urology 2019; 15 (2): 138–148. DOI: 10.1016/j.jpurol.2018.10.012.
- Cheng EY, Faasse MA. Trimethoprim-sulfamethoxazole vs. Placebo After Hypospadias Repair: a Multicenter, Double-blind. Randomized Trial [Internet] Clinicaltrialsgov 2018.
- Zhu C, Wei R, Tong Y. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Tanseco PP, Randhawa H, Chua ME. Postoperative complications of hypospadias repair in patients receiving caudal block vs. non-caudal anesthesia: A meta-analysis. Can Urol Assoc J 2019; 13 (8). DOI: 10.5489/cuaj.5688.
- Deibert CM, Hensle TW. The psychosexual aspects of hypospadias repair: A review. Arab J Urol 2011; 9 (4): 279–282. DOI: 10.1016/j.aju.2011.10.004.
- Ververidis M, Dickson AP, Gough DCS. An objective assessment of the results of hypospadias surgery. BJU Int 2005; 96 (1): 135–139. DOI: 10.1111/j.1464-410x.2005.05582.x.
- Snodgrass W. Tubularized, incised plate urethroplasty for distal hypospadias. J Urol 1994; 151 (2): 464–465. DOI: 10.1016/s0022-5347(17)34991-1.
- Snodgrass WT, Bush N, Cost N. Tubularized incised plate hypospadias repair for distal hypospadias. Journal of Pediatric Urology 2010; 6 (4): 408–413. DOI: 10.1016/j.jpurol.2009.09.010.
- Snodgrass WT. Snodgrass technique for hypospadias repair. BJU Int 2005; 95 (4): 683–693. DOI: 10.1111/j.1464-410x.2005.05384.x.
- Barashi NS, Gundeti MS. Chapter 15. Surgical Reconstructions of Distal Hypospadias: The University of Chicago Experience. Gundeti MS. Surgical Techniques in Pediatric and Adolescent Urology. Jaypee Brothers,Medical Publishers Pvt. Limited; 2019.
- Herrera O, Mostafa S, Lomba T. A 10-step procedure for distal hypospadias repair with 50% resident involvement is safe and effective. Urology Video Journal 2021; 11 (100094). DOI: 10.1016/j.urolvj.2021.100094.
- Nguyen MT, Snodgrass WT, Zaontz MR. Effect of urethral plate characteristics on tubularized incised plate urethroplasty. J Urol 1262; 2004;171(3):1260-2. DOI: 10.1097/01.ju.0000110426.32005.91.
- Braga LHP, Lorenzo AJ, Salle JLP. Tubularized incised plate urethroplasty for distal hypospadias: A literature review. Indian J Urol 2008; 24 (2): 219–225. DOI: 10.4103/0970-1591.40619.
- Gupta A, Gupta R, Srivastav P. Comparison of interrupted- and continuous-suture urethroplasty in tubularised incised-plate hypospadias repair: A prospective study. Arab J Urol 2017; 15 (4): 312–318. DOI: 10.1016/j.aju.2017.10.004.
- Chua M, Welsh C, Amir B. Non-stented versus stented urethroplasty for distal hypospadias repair: A systematic review and meta-analysis. Journal of Pediatric Urology 2018; 14 (3): 212–219. DOI: 10.1016/j.jpurol.2017.11.023.
- JG S, LG P, BL S. A prospective randomized trial of dressings versus no dressings for hypospadias repair. Journal of Urology 2000; 164 (3 Part 2): 981–983. DOI: 10.1016/s0022-5347(05)67231-x.
- O’Kelly F, Pokarowski M, DeCotiis KN. Structured opioid-free protocol following outpatient hypospadias repair - A prospective SQUIRE 2.0-compliant quality improvement initiative. Journal of Pediatric Urology 2020; 16 (5). DOI: 10.1016/j.jpurol.2020.06.012.
- Lucas J, Hightower T, Weiss DA. Time to Complication Detection after Primary Pediatric Hypospadias Repair: A Large, Single Center, Retrospective Cohort Analysis. J Urol 2020; 204 (2): 338–344. DOI: 10.1097/ju.0000000000000762.
- Wilkinson DJ, Farrelly P, Kenny SE. Outcomes in distal hypospadias: A systematic review of the Mathieu and tubularized incised plate repairs. Journal of Pediatric Urology 2012; 8 (3): 307–312. DOI: 10.1016/j.jpurol.2010.11.008.
- Zhang Y, Shen Z, Zhou X. Comparison of meatal-based flap (Mathieu) and tubularized incised-plate (TIP) urethroplasties for primary distal hypospadias: A systematic review and meta-analysis. Journal of Pediatric Surgery 2020. DOI: 10.1016/j.jpedsurg.2020.03.013.
- Pfistermuller KLM, McArdle AJ, Cuckow PM. Meta-analysis of complication rates of the tubularized incised plate (TIP) repair. J Pediatr Urol 2015; 11 (2): 54–59. DOI: 10.1016/j.jpurol.2014.12.006.
Última actualización: 2025-09-21 13:35