28: Testículo no descendido
Este capítulo durará aproximadamente 19 minutos para leer.
Introducción
El testículo no descendido (TND) se refiere a la situación en la que el testículo no se encuentra en el escroto sino en una localización anómala, como en la cavidad abdominal o en la ingle (Figura 1) Los testículos se forman y permanecen en la cavidad abdominal durante un tiempo de la vida fetal, luego descienden gradualmente y se desplazan hacia el escroto. La criptorquidia incluye los testículos no descendidos ubicados en cualquier punto del trayecto normal del proceso de descenso y los testículos ectópicos, que no siguen el trayecto habitual del descenso testicular. El testículo no descendido debe diferenciarse del testículo retráctil. Un testículo retráctil es un testículo situado por debajo del anillo inguinal externo, pero que puede manipularse hasta la porción superior del escroto y tiende a ascender a su posición original y/o es un testículo que ha completado su proceso normal de descenso y puede permanecer en el escroto, pero se desplaza fácilmente de ida y vuelta entre el escroto y la ingle (Video 1).
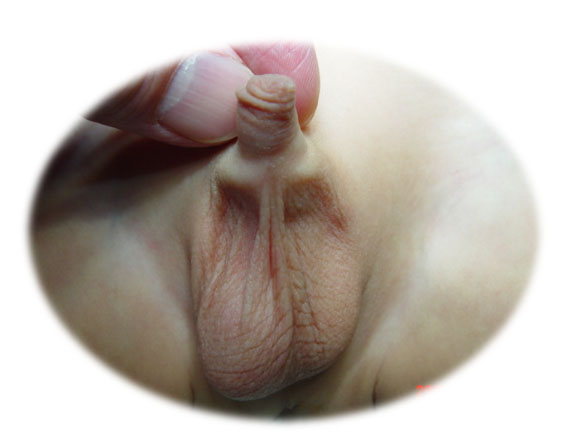
Figura 1 Escroto vacío en el lado izquierdo en un paciente con testículo no descendido.
Vídeo 1 Demostración de un testículo retráctil.
Epidemiología
El testículo no descendido es una de las anomalías congénitas más frecuentes del recién nacido varón. El riesgo de testículos no descendidos es 3,5 veces mayor en varones con un hermano con testículos no descendidos y 2,3 veces mayor en varones con un padre con la afección.1 Se ha reportado una incidencia en neonatos a término de 1,0–4,5% y los casos unilaterales son 2 veces más comunes que los bilaterales.2 Aproximadamente el 70% de los testículos criptorquídicos descienden a los 3 meses de edad bajo la influencia de la minipubertad y la incidencia de testículo no descendido disminuye a 0,8-1,2% al año de edad.3,4
Etiología
No hay factores de riesgo claros asociados con (UDT); sin embargo, el tabaquismo materno durante el embarazo, las medidas al nacer, incluido el peso al nacer, y la edad gestacional, los antecedentes familiares de testículo no descendido y variantes genéticas poco frecuentes como las mutaciones de INSL3 se han asociado con el testículo no descendido. El descenso testicular normal depende de un eje hipotálamo-hipófiso-gonadal (HPG) íntegro. Aunque la etiología exacta aún se desconoce, se implican factores genéticos, hormonales (disfunción del eje HPG, hipogonadismo congénito, displasia testicular) y anatómicos (conducto deferente corto y vasos espermáticos cortos). Se han sugerido como factores de riesgo para el testículo no descendido: peso al nacer <2.5 kg, pequeño para la edad gestacional, prematuridad, niveles maternos bajos de estrógenos e insuficiencia placentaria, y disminución de la secreción de gonadotropina coriónica humana (hCG). Además, se ha informado que la exposición a factores ambientales, como la exposición continua a compuestos organoclorados, monoésteres de ftalatos, tabaquismo materno y diabetes materna, constituye un factor de riesgo de trastornos del desarrollo en los varones. Sin embargo, no se ha encontrado que ninguno de estos factores sea por sí solo responsable de la patogénesis del testículo no descendido.
Descenso testicular normal
Los mamíferos pueden separarse en aquellos con escroto y aquellos sin él. La hipótesis general sobre la evolución del escroto en algunos mamíferos es que proporciona un entorno fresco, por debajo de la temperatura corporal central, para una mejor espermatogénesis. Sin embargo, no disponemos de datos para apoyar o refutar la hipótesis de la temperatura porque algunos mamíferos pueden reproducirse con los testículos internos y algunas especies sin escroto tienen mecanismos de enfriamiento testicular.5,6 Una tasa reducida de mutaciones de las células germinales a temperaturas corporales más bajas puede haber sido un factor impulsor del desarrollo del escroto en los mamíferos. En algunos animales cuyos testículos permanecen cerca del riñón en la cavidad abdominal, el epidídimo se extiende hasta una localización subcutánea, lo que puede proporcionar un efecto de enfriamiento durante el almacenamiento y la maduración de los espermatozoides.7 En ese caso, la localización testicular podría haber seguido la del epidídimo. En los humanos, la temperatura escrotal se mantiene a una temperatura óptima para la espermatogénesis, aproximadamente 2.7 ℃ inferior a la temperatura corporal central.8
Aunque los testículos y los ovarios se originan a partir de los mismos tejidos embrionarios adyacentes al riñón, los testículos emprenden el largo trayecto fuera de la cavidad abdominal.9 El descenso testicular normal implica una fase transabdominal y una fase inguinoescrotal, y ambas tienen lugar de forma prenatal en el ser humano. El descenso transabdominal ocurre en la semana 12 de gestación, cuando el testículo desciende hacia el anillo inguinal profundo. Tiene lugar como una combinación de fuerzas de empuje y tracción.10 Antes del inicio del descenso, la gónada en desarrollo está anclada por el ligamento suspensorio craneal y el ligamento genitoinguinal caudal, o gubernáculo.11 El gubernáculo distal aumenta de tamaño durante la fase transabdominal del descenso, haciendo que el gubernáculo masculino sea corto y grueso. Esta reacción de tumefacción ancla el testículo al canal inguinal (Figura 2) Los músculos de la pared inguinal se diferencian alrededor del gubernáculo tumefacto, también llamado el bulbo, para formar el canal inguinal. La hormona similar a la insulina 3 (INSL3) se reconoce como la hormona reguladora de la reacción de tumefacción.12,13,14 Las células de Leydig del testículo secretan INSL3 para estimular la reacción de tumefacción y mantener el testículo cerca de la pared abdominal inguinal a medida que el abdomen fetal se agranda.14 También se ha sugerido que la hormona antimülleriana (AMH), secretada por las células de Sertoli del testículo, desempeña un papel en el descenso testicular. En los niños con mutaciones del gen de la AMH o de su receptor, presentan criptorquidia con persistencia de útero y trompas de Falopio infantiles, conocido como el síndrome de conductos müllerianos persistentes (PMDS).14
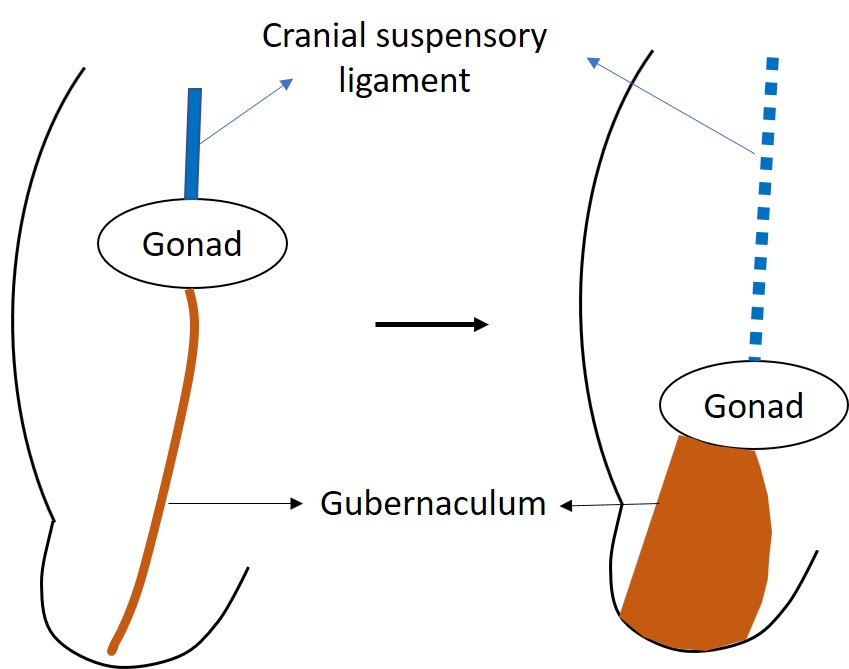
Figura 2 La gónada indiferenciada está inicialmente situada alta en el abdomen, anclada por el ligamento suspensorio craneal. INSL3 provoca la tumefacción y el aumento de tamaño del gubernáculo, que tracciona del testículo en desarrollo hacia la región inguinal.
La fase inguinoescrotal del descenso ocurre entre las semanas 25 y 35. El proceso general es bastante similar en la mayoría de los mamíferos.15 Durante esta etapa, los testículos transitan a través del canal inguinal para finalmente quedar en el escroto. El gubernáculo se alarga en dirección al escroto junto con el proceso vaginal. Después de que el gubernáculo alcanza el escroto, el bulbo se reabsorbe, dejando un remanente fibroso adherido a la cara interna del escroto. El proceso vaginal proximal se cierra para prevenir la hernia inguinal o el hidrocele en el ser humano. Muchos otros mamíferos, como los ratones y las ratas, tienen un proceso vaginal permeable durante toda su vida. En el ser humano, el proceso vaginal finalmente involuciona por completo y permite que el cordón espermático se alargue normalmente después del nacimiento. La fase inguinoescrotal del descenso testicular está bajo el control de los andrógenos. En modelos animales, se encontró que, dependiendo de la acción androgénica, las ramas sensitivas del nervio genitofemoral controlan el desarrollo del gubernáculo, el cual está modulado por el péptido relacionado con el gen de la calcitonina (CGRP).
Clasificación de los testículos no descendidos
En general, los testículos no descendidos se clasifican como palpables o no palpables. El hecho de que los testículos sean palpables o no determina las pruebas diagnósticas y la estrategia de tratamiento, así como el pronóstico. Los testículos son móviles por la contracción del músculo cremáster. Por lo tanto, la localización exacta de los testículos debe determinarse antes de los 6 meses de edad, cuando el reflejo cremastérico es débil, o bajo anestesia general. Aproximadamente el 80% de los testículos no descendidos son palpables en la región inguinal. En caso de que el testículo no sea palpable, puede localizarse en la cavidad abdominal o tratarse de agenesia testicular, testículo atrófico o testículo evanescente.
Patología asociada
Desarrollo anormal de las células germinales
El desarrollo histológico de los testículos criptorquídicos prepuberales se ha estudiado en numerosos estudios observacionales. Estos estudios aportan evidencia sólida de que frecuentemente existe un desarrollo anormal de las células germinales en los testículos criptorquídicos después de la primera infancia. El número de espermatogonias por túbulo se reduce después de la infancia y no aumenta de forma normal con la edad en los testículos criptorquídicos y, en menor grado, en los testículos escrotales contralaterales.16 Se ha comunicado que la transformación de gonocitos a espermatogonias está alterada en los testículos criptorquídicos. La proporción de gonocitos respecto a espermatogonias parece ser normal en los testículos criptorquídicos alrededor de los 1,5 meses de edad; en comparación con los testículos escrotales contralaterales, en los testículos criptorquídicos se observa una desaparición tardía de los gonocitos y la aparición de espermatogonias oscuras adultas. Se informó que el testículo criptorquídico no es significativamente más pequeño al nacer, pero presenta un crecimiento menor que el testículo escrotal.17
Infertilidad
Se sabe bien que los antecedentes de criptorquidia se asocian con subfertilidad. En una serie de estudios de casos y controles bien diseñados sobre fertilidad en la criptorquidia que analizaron una gran cohorte de varones sometidos a orquidopexia y un grupo control de edad similar, el 65% de los pacientes con criptorquidia bilateral previa, el 90% de aquellos con criptorquidia unilateral previa y el 93% de los controles alcanzaron la paternidad.18,19 Según los estudios que reportaron la histología testicular en el momento de la orquidopexia, el potencial de fertilidad fue mayor cuando la orquidopexia se realizó antes del 1 año de edad.20,21,22 Por lo tanto, se recomienda realizar la orquidopexia antes del 1 año de edad.
Riesgo de malignidad
Es bien conocido que el riesgo de tumor de células germinales testiculares en varones con antecedente de criptorquidia está aumentado. El riesgo relativo de transformación maligna en un testículo no descendido es de 2.5 a 8 en general y de 2 a 3 en niños sometidos a orquiopexia prepuberal.23 Aproximadamente el 10% de los hombres que presentan un tumor de células germinales testiculares tienen antecedentes de criptorquidia. En una revisión de la patología tumoral en la criptorquidia tratada versus no tratada, el seminoma se asocia con mayor frecuencia con el testículo persistentemente criptorquídico y los tumores de células germinales no seminomatosos predominan en los testículos escrotales.23 En la actualidad se ha demostrado que esto no está relacionado, se recomienda el autoexamen testicular para la detección del cáncer testicular, y debe enseñarse a todos los pacientes con antecedente de criptorquidia una vez que alcancen la pubertad.
Hernia
Más del 90% de los casos de criptorquidia se asocian a un proceso vaginal permeable y la hernia puede presentarse en el 25%.
Anomalía del epidídimo
Se ha informado que la prevalencia de anomalías epididimarias en la criptorquidia es del 32% al 72%.24 Las anomalías epididimarias pueden ocurrir debido a una involución anormal del conducto mesonéfrico adyacente al testículo normal.25 Se ha informado que las anomalías de fusión epidídimo-testicular están fuertemente asociadas con una posición más proximal del testículo. Las anomalías epididimarias pueden afectar la fertilidad debido a dificultades en el transporte y la maduración de los espermatozoides.26
Diagnóstico del testículo no descendido
Antes del examen físico, es esencial preguntar por parto prematuro, si la madre usa hormonas femeninas o ha estado expuesta a hormonas femeninas, lesiones del sistema nervioso central y antecedentes de cirugía inguinal previa. Debe indagarse sobre antecedentes familiares de otras anomalías congénitas o infertilidad asociadas a la criptorquidia. Dado que la palpabilidad en la criptorquidia es más importante que la localización de los testículos, es esencial un examen físico cuidadoso. En caso de duda, se recomienda repetir la exploración o derivar a un especialista. En particular, en caso de testículo no palpable, es importante comprobar bajo anestesia antes de la cirugía. Para la exploración física, la sala debe estar cálida. Luego, con el paciente en posición de rana, primero comprobar el tamaño, la localización y la superficie del testículo contralateral, y después, con la mano caliente, barrer desde la cresta ilíaca del lado afectado hasta la sínfisis del pubis para determinar la presencia y la localización del testículo. Si el testículo es palpable, también debe comprobarse que descienda al escroto.27 Si es difícil palpar, como en un lactante rollizo o un niño obeso, hacer que se siente con las piernas cruzadas o se ponga en cuclillas para examinarlo y aplicar gel lubricante en las manos para una mejor palpación de los testículos. En ausencia de un testículo, puede observarse hipertrofia compensatoria del testículo contralateral. Una vez que los testículos son palpables, no es necesario realizar estudios adicionales, porque la precisión diagnóstica de la ecografía, la tomografía computarizada o la resonancia magnética (RM) no es tan alta como la de urólogos expertos, y el tratamiento rara vez difiere según los resultados de las pruebas de imagen. Los estudios de imagen no pueden verificar con certeza si un testículo está presente o no.28 En la práctica clínica, la ecografía o la RM solo se recomiendan en casos seleccionados de pacientes con sospecha de DSD.29
Para testículos no palpables que no pueden confirmarse mediante examen físico y examen radiológico, se realiza una laparoscopia diagnóstica o una cirugía exploratoria a través de una incisión inguinal o escrotal. De manera convencional, si se encontraba un testículo o un remanente testicular mediante la exploración inguinal, se procedía a una orquiopexia u orquiectomía. Con la llegada de la laparoscopia, se ha hecho posible comprobar la presencia o ausencia de testículos, su localización y el estado del conducto deferente y de los vasos gonadales. Según los hallazgos laparoscópicos, si los vasos testiculares terminan ciegamente, puede diagnosticarse testículo evanescente y no es necesario ningún manejo adicional. Si se observa que los vasos espermáticos ingresan al anillo inguinal interno, debe realizarse una exploración inguinal o escrotal.
En caso de testículos no palpables bilaterales con cualquier signo de DSD, como ambigüedad genital o hipospadias grave, es obligatoria una evaluación endocrinológica y genética adicional.30 En niños menores de 3 meses de edad, se miden la hormona luteinizante (LH), la hormona foliculoestimulante (FSH) y la testosterona. En niños de 3 meses o más, se recomienda la prueba de estimulación con hCG. Si la testosterona es apenas detectable y la LH y la FSH están elevadas, puede considerarse una anorquia. En la prueba de estimulación con hCG, tras la inyección intramuscular de 2,000 UI de hCG durante 3 días, la testosterona sérica se mide al quinto día. Sin embargo, dado que existe la posibilidad de un falso negativo, es necesaria la confirmación quirúrgica en todos los niños cuyos niveles de gonadotropinas están dentro del rango normal en quienes no se palpan ambos testículos, independientemente de si respondan o no a la prueba de estimulación con hCG.
Tratamiento del testículo no descendido
La meta del tratamiento de los testículos no descendidos es reducir el riesgo de infertilidad al minimizar la degeneración histológica de los testículos colocando los testículos en el escroto en una etapa temprana y facilitar la detección del cáncer testicular, que presenta una incidencia mayor que en los testículos descendidos normalmente. Además, el objetivo secundario es corregir las lesiones asociadas, prevenir complicaciones como la torsión testicular, aliviar el impacto psicológico del paciente y mejorar el resultado estético. Hasta ahora se ha reconocido que la orquidopexia no puede prevenir el cáncer testicular, pero recientemente se ha informado que la cirugía temprana puede disminuir el riesgo de cáncer testicular. El momento del tratamiento de los testículos no descendidos es importante. La orquidopexia debe realizarse después de los 6 meses de edad y dentro del año siguiente, y a más tardar a los dieciocho meses de edad.31 La justificación de una cirugía tan temprana es que el descenso espontáneo de los testículos después de los 6 meses de edad es poco probable, no existe una diferencia significativa en los riesgos de la anestesia general ni en la técnica quirúrgica, y la posibilidad de daño histológico de los testículos aumenta después de esta edad.31,32 Y también existen preocupaciones para los niños mayores de 18 meses que podrían presentar alta ansiedad por separación y temor a la castración debido a la cirugía, lo cual puede afectar la salud mental de los niños.
El tratamiento quirúrgico, la orquidopexia, es el tratamiento estándar para los testículos no descendidos, y la terapia hormonal puede utilizarse de forma selectiva según la localización y el estado de los testículos no descendidos. Cuando los testículos degeneran o desaparecen y solo son visibles remanentes o un muñón testicular, o cuando los testículos no descendidos en adultos son anatómica y morfológicamente anormales, o cuando la fijación testicular es imposible, se extirpan los testículos. La orquiectomía debe decidirse con cautela solo cuando el testículo contralateral es normal, y se realiza simultáneamente la orquidopexia contralateral para prevenir la torsión testicular. Dado que el testículo retráctil es una variante normal, se recomienda un seguimiento anual hasta la pubertad o hasta que los testículos dejen de ascender.
Terapia hormonal para el descenso testicular
La terapia hormonal para el descenso testicular es un tema debatible. Sin embargo, se utilizan principalmente hCG, agonistas de la hormona liberadora de luteinizante (LHRH) o agonistas de la hormona liberadora de gonadotropinas (GnRH). La justificación de la terapia hormonal se basa en los resultados experimentales que muestran que los testículos no descendidos resultan de una anomalía en el eje hipotálamo-hipófiso-gonadal, que el descenso testicular está regulado por andrógenos masculinos y que altas concentraciones de metabolitos activos sintetizados en los testículos están implicadas en la patogenia de la criptorquidia. La hCG actúa directamente sobre las células de Leydig, de modo similar a la LH proveniente de la hipófisis, mientras que la GnRH aumenta la producción de testosterona en el testículo al propiciar la secreción de LH mediante la estimulación hipotalámica. Se presume que la hormona afecta el cordón espermático y el músculo cremáster para inducir el descenso natural de los testículos y mejorar la fertilidad. Sin embargo, la tasa de éxito de la terapia hormonal con hCG o GnRH es solo del 20% y casi el 20% de estos testículos descendidos puede reascender posteriormente.33,34
Terapia hormonal para la fertilidad
La terapia hormonal puede mejorar los parámetros de fertilidad y puede servir como complemento a la orquidopexia.35,36 Se informó que los hombres que fueron tratados con GnRH en la infancia presentaron mejores resultados en el análisis seminal en comparación con los hombres que se sometieron solo a orquidopexia o a tratamiento con placebo.35 Por el contrario, se ha informado que la terapia con hCG puede ser perjudicial para la espermatogénesis futura al aumentar la apoptosis de las células germinales, provocar cambios inflamatorios en los testículos y reducir el volumen testicular en la edad adulta.37 Aún falta evidencia sobre el efecto a largo plazo del tratamiento hormonal para la criptorquidia y es difícil seleccionar al mejor candidato con testículo no descendido que pueda beneficiarse de la terapia hormonal.
Tratamiento quirúrgico
Testículo palpable
En la mayoría de los casos de testículos no descendidos palpables, la orquidopexia se realiza mediante una incisión inguinal. El punto más importante en la orquidopexia es conseguir suficiente longitud para descender el testículo al escroto sin tensión. La operación consta de los siguientes cuatro pasos. En primer lugar, el testículo y el cordón espermático se separan de los tejidos circundantes para asegurar su movilidad. En segundo lugar, se realiza la ligadura alta para cerrar el conducto peritoneo-vaginal. Y en tercer lugar, para descender el testículo hasta el fondo del escroto sin tensión, a veces es necesaria una mayor disección retroperitoneal para separar el conducto deferente. Por último, se confecciona una bolsa subdártica poco profunda en el escroto ipsilateral, y los testículos se introducen y se fijan. Si la longitud del cordón espermático no es suficiente con estas técnicas básicas, se requiere el método de Prentiss para reducir la distancia al escroto cortando el vaso epigástrico inferior en el fondo del conducto inguinal o pasando el cordón espermático por debajo de él. No es típico para el testículo no descendido palpable, pero se ha descrito el autotrasplante del testículo utilizando una técnica microquirúrgica para anastomosar la arteria testicular a la arteria epigástrica (véase más abajo).
Testículo no palpable
Dado que la presencia y el estado de los testículos son importantes en la operación de testículos no palpables, los testículos deben examinarse nuevamente bajo anestesia. Si siguen sin palparse, se realiza una exploración inguinal abierta o una laparoscopia diagnóstica. Los hallazgos laparoscópicos de testículos no palpables son: primero, que el vaso testicular desciende a través del anillo inguinal interno. En este caso, se realiza una incisión en la piel inguinal o escrotal para explorar la presencia del testículo. Si los testículos se encuentran normales, se realiza una orquidopexia. El segundo escenario es que el vaso testicular termina en fondo de saco ciego en la cavidad abdominal cerca del anillo inguinal interno, lo que sugiere un testículo evanescente, por lo que se detiene la operación sin cirugía adicional. Finalmente, cuando se encuentra un testículo en la cavidad abdominal, la decisión quirúrgica se toma en función del tamaño del testículo, su localización en la cavidad abdominal, la longitud del cordón espermático, la edad del paciente, el testículo contralateral y la experiencia del cirujano. Se sabe que la tasa global de éxito quirúrgico es del 67-84%.
La orquidopexia se puede realizar de tres maneras
Orquiopexia de Fowler-Stephens
Este es un procedimiento que asegura la longitud del cordón espermático mediante la resección de los vasos espermáticos internos que incluyen la arteria testicular, y la supervivencia del testículo depende del aporte sanguíneo de la arteria cremastérica y de la arteria deferencial. La técnica en un tiempo consiste en la resección de los vasos espermáticos internos y la fijación de los testículos al mismo tiempo. En la orquiopexia de Fowler-Stephens en dos tiempos, los vasos espermáticos internos se ligan como operación primaria, se incrementa durante al menos 6 meses el aporte de vasos colaterales desde la cavidad abdominal a los testículos, y luego los testículos se descienden al escroto mediante una operación secundaria. La orquiopexia de Fowler-Stephens en uno o dos tiempos puede realizarse por vía laparoscópica.
Orquiopexia laparoscópica
Dado que la cirugía laparoscópica se realiza con un campo de visión ampliado, tiene la ventaja de poder minimizar el daño a los vasos sanguíneos durante una disección amplia, y de asegurar la distancia más corta para la movilización testicular (Figura 3) y (Video 1). La orquidopexia laparoscópica incluye un método en el que el testículo se desciende al escroto preservando los vasos espermáticos internos y los métodos de Fowler-Stephens (Video 2). Con la ayuda de la laparoscopia, puede realizarse un autotrasplante microquirúrgico.
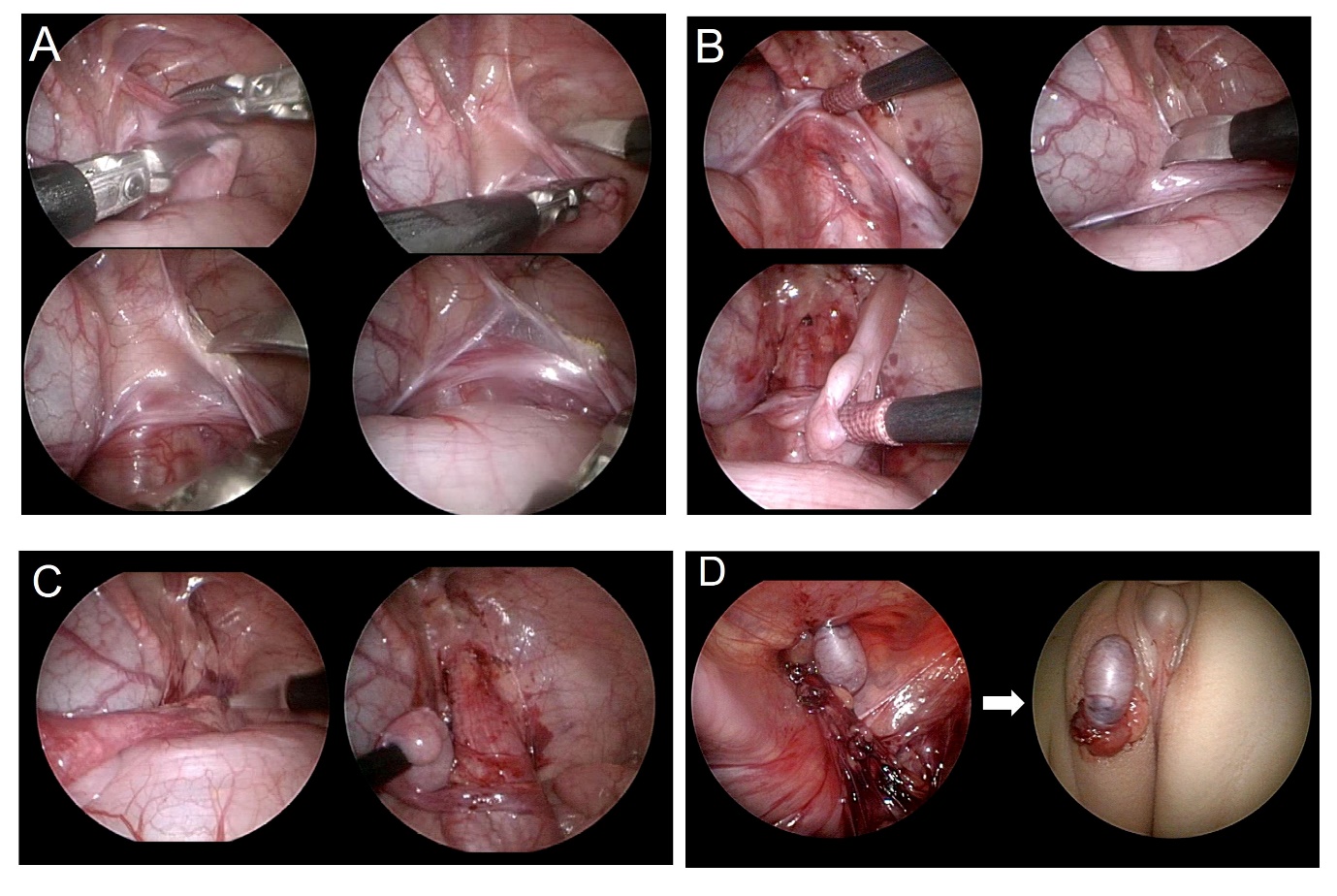
Figura 3 Imágenes explicativas paso a paso de la orquidopexia laparoscópica. (A) sección del gubernáculo, (B) disección del peritoneo paralela al conducto deferente, (C) incisión del peritoneo paralela al vaso espermático interno, (D) formación de un neo-hiato y exteriorización del testículo fuera del abdomen hacia la localización escrotal.
Vídeo 2 Demostración de la orquidopexia de Fowler-Stephens.
Autotrasplante mediante microcirugía
Esto se realiza en casos especiales en los que los testículos están situados profundamente en la cavidad abdominal. Primero, los testículos y los cordones espermáticos se extirpan, se fijan en el escroto y luego los vasos sanguíneos testiculares se conectan a los vasos sanguíneos de la pared abdominal inferior mediante microcirugía para restablecer el flujo sanguíneo. Aunque la tasa de éxito es relativamente alta, no es un método de elección sencillo porque requiere un alto nivel de habilidad y esfuerzo para la conexión vascular mediante microcirugía y requiere un tratamiento posoperatorio cuidadoso.
Orquiectomía
La orquiectomía se realiza cuando no cabe esperar función testicular debido a una atrofia testicular grave o a anomalías morfológicas.
Complicaciones de la orquiopexia y reoperación
Las complicaciones de la orquiopexia incluyen retracción testicular, hematoma, lesión del nervio ilioinguinal, torsión del cordón espermático, lesión del conducto deferente o atrofia testicular. La atrofia testicular es la complicación más grave y ocurre tras una disección excesiva del cordón espermático o el uso excesivo de electrocauterio, la torsión de los vasos espermáticos, o una orquiopexia de Fowler Stephens cuando se fuerza el descenso del testículo con tensión, lo que afecta la irrigación sanguínea. La retracción testicular suele deberse a una disección retroperitoneal insuficiente, y el testículo es traccionado hacia arriba por encima del escroto bajo el anillo inguinal externo o cerca del tubérculo púbico. Para la reoperación, debe tenerse cuidado de evitar el sitio quirúrgico previo y realizar una incisión, abordar el tejido cicatricial desde el tejido normal y extirpar el tejido cicatricial duro, incluyendo tejido normal, de manera que no se dañen los vasos espermáticos, y luego realizar la fijación testicular.
Puntos clave
- Guía de la AUA para la criptorquidia establece que la cirugía para el testículo no descendido (TND) es mejor realizarla antes de 1 año de edad
- La campaña Choosing Wisely en cooperación con la AUA decidió enfatizar que la realización de estudios de imagen para TND no debe hacerse de forma rutinaria, ya que la confirmación de la posición testicular se realiza mejor mediante el examen físico o, si es necesario en caso de testículo no palpable, mediante laparoscopia
- La orquidopexia inguinal o escrotal tiene una alta tasa de éxito con una baja tasa de complicaciones
- La orquidopexia laparoscópica se asocia con tasas más altas de atrofia testicular
Referencias
- Hutson JM, Balic A, T N. Cryptorchidism. Semin Pediatr Surg 2010; 19: 215. DOI: 10.1002/bjs.1800760203.
- Ashley RA, JS B, Kolon TF. Cryptorchidism: pathogenesis, diagnosis, treatment and prognosis. Urol Clin North Am 2010; 37: 183. DOI: 10.1016/j.ucl.2010.03.002.
- Elder JS. The undescended testis. Hormonal and Surgical Management Surg Clin North Am 1988; 68: 983. DOI: 10.1515/iupac.88.1460.
- Sijstermans K, Hack WW, RW M. The frequency of undescended testis from birth to adulthood: a review. Int J Androl 2008; 31: 1. DOI: 10.1111/j.1365-2605.2008.00883.x.
- Werdelin L, Nilsonne A. The evolution of the scrotum and testicular descent in mammals: a phylogenetic view. J Theor Biol 1999; 196: 61. DOI: 10.1006/jtbi.1998.0821.
- Lovegrove BG. Cool sperm. why some placental mammals have a scrotum. J Evol Biol 2014; 27: 801. DOI: 10.1111/jeb.12373.
- Bedford JM. Anatomical evidence for the epididymis as the prime mover in the evolution of the scrotum. Am J Anat 1978; 152: 483. DOI: 10.1002/aja.1001520404.
- Momen MN, Ananian FB, IM F. Effect of high environmental temperature on semen parameters among fertile men. Fertil Steril 2010; 93: 1884. DOI: 10.1016/j.fertnstert.2008.12.065.
- Hutson JM, S H, Heyns CF. Anatomical and functional aspects of testicular descent and cryptorchidism. Endocr Rev 1997; 18: 259. DOI: 10.1210/er.18.2.259.
- Costa WS, Sampaio FJ, LA F. Testicular migration: remodeling of connective tissue and muscle cells in human gubernaculum testis. J Urol 2002; 167: 2171. DOI: 10.1097/00005392-200205000-00065.
- P S, W E. Perinatal development of gubernacular cones in rats and rabbits: effect of exposure to anti-androgens. Anat Rec 1993; 236: 399. DOI: 10.1002/ar.1092360214.
- Nef S, Parada LF. Cryptorchidism in mice mutant for Insl3. Nat Genet 1999; 22: 295. DOI: 10.1038/10364.
- Zimmermann S, Steding G, JM E. Targeted disruption of the Insl3 gene causes bilateral cryptorchidism. Mol Endocrinol 1999; 13: 681. DOI: 10.1210/mend.13.5.0272.
- Hutson JM, Li R, BR S. Regulation of testicular descent. Pediatr Surg Int 2015; 31: 317. DOI: 10.1007/s00383-015-3673-4.
- Hutson JM, Baskin LS, G R. The power and perils of animal models with urogenital anomalies: handle with care. J Pediatr Urol 2014; 10: 699. DOI: 10.1016/j.jpurol.2014.03.003.
- Gracia J, Sanchez Zalabardo J, J SG. Clinical, physical, sperm and hormonal data in 251 adults operated on for cryptorchidism in childhood. BJU Int 2000; 85: 1100. DOI: 10.1046/j.1464-410x.2000.00662.x.
- Kollin C, Hesser U, EM R. Testicular growth from birth to two years of age, and the effect of orchidopexy at age nine months: a randomized, controlled study. Acta Paediatr 2006; 95: 318. DOI: 10.1080/08035250500423812.
- Miller KD, MT C, Lee PA. Fertility after unilateral cryptorchidism. Paternity, time to conception, pretreatment testicular location and size, hormone and sperm parameters. Horm Res 2001; 55: 249.
- Lee PA, Coughlin MT. Fertility after bilateral cryptorchidism. Evaluation by paternity, hormone, and semen data. Horm Res 2001; 55: 28.
- Park KH, Lee JH, JJ H. Histological evidences suggest recommending orchiopexy within the first year of life for children with unilateral inguinal cryptorchid testis. Int J Urol 2007; 14: 616. DOI: 10.1111/j.1442-2042.2007.01788.x.
- Kogan SJ, Tennenbaum S, B G. Efficacy of orchiopexy by patient age 1 year for cryptorchidism. J Urol 1990; 144: 508. DOI: 10.1016/s0022-5347(17)39505-8.
- Tasian GE, Hittelman AB, GE K. Age at orchiopexy and testis palpability predict germ and Leydig cell loss: clinical predictors of adverse histological features of cryptorchidism. J Urol 2009; 182: 704. DOI: 10.1590/s1677-55382009000500033.
- Wood HM, Elder JS. Cryptorchidism and testicular cancer: separating fact from fiction. J Urol 2009; 181: 452. DOI: 10.1016/s0084-4071(09)79277-2.
- Caterino S, Lorenzon L, M C. Epididymal-testicular fusion anomalies in cryptorchidism are associated with proximal location of the undescended testis and with a widely patent processus vaginalis. J Anat 2014; 225: 473. DOI: 10.1111/joa.12222.
- Mollaeian M, V M, Elahi B. Significance of epididymal and ductal anomalies associated with undescended testis: study in 652 cases. Urology 1994; 43: 857. DOI: 10.1016/0090-4295(94)90152-x.
- Kim SO, Na SW, HS Y. Epididymal anomalies in boys with undescended testis or hydrocele: Significance of testicular location. BMC Urol 2015; 15: 108. DOI: 10.1186/s12894-015-0099-1.
- Cendron M, Huff DS, MA K. Anatomical, morphological and volumetric analysis: a review of 759 cases of testicular maldescent. J Urol 1993; 149: 570. DOI: 10.1016/s0022-5347(17)36151-7.
- Hrebinko RL, Bellinger MF. The limited role of imaging techniques in managing children with undescended testes. J Urol 1993; 150: 458. DOI: 10.1016/s0022-5347(17)35510-6.
- Tasian GE, Copp HL. Diagnostic performance of ultrasound in nonpalpable cryptorchidism: a systematic review and meta-analysis. Pediatrics 2011; 127: 119. DOI: 10.1016/j.yuro.2011.05.011.
- Elert A, Jahn K, A H. Population-based investigation of familial undescended testis and its association with other urogenital anomalies. J Pediatr Urol 2005; 1: 403. DOI: 10.1016/j.jpurol.2005.04.005.
- Engeler DS, Hosli PO, H J. Early orchiopexy: prepubertal intratubular germ cell neoplasia and fertility outcome. Urology 2000; 56: 144. DOI: 10.1016/s0090-4295(00)00560-4.
- Wenzler DL, DA B, Park JM. What is the rate of spontaneous testicular descent in infants with cryptorchidism? J Urol 2004; 171: 849. DOI: 10.1097/01.ju.0000106100.21225.d7.
- Pyorala S, NP H, Uhari M. A review and meta-analysis of hormonal treatment of cryptorchidism. J Clin Endocrinol Metab 1995; 80: 2795. DOI: 10.1210/jc.80.9.2795.
- Rajfer J, Walsh PC. The incidence of intersexuality in patients with hypospadias and cryptorchidism. J Urol 1976; 116: 769. DOI: 10.1016/0022-3468(77)90475-4.
- Hagberg S, Westphal O. Treatment of undescended testes with intranasal application of synthetic LH-RH. Eur J Pediatr 1982; 139: 285. DOI: 10.1007/bf00442181.
- Hadziselimovic F, Herzog B. Treatment with a luteinizing hormone-releasing hormone analogue after successful orchiopexy markedly improves the chance of fertility later in life. J Urol 1997; 158: 1193. DOI: 10.1097/00005392-199709000-00132.
- Cortes D, J T, Visfeldt J. Hormonal treatment may harm the germ cells in 1 to 3-year-old boys with cryptorchidism. J Urol 2000; 163: 1290. DOI: 10.1097/00005392-200004000-00070.
Última actualización: 2025-09-21 13:35