24: Válvulas uretrales posteriores y obstrucción infravesical
Este capítulo durará aproximadamente 31 minutos para leer.
Introducción
Las válvulas uretrales posteriores (PUV) siguen siendo la causa congénita más frecuente de obstrucción del tracto de salida vesical en los neonatos varones. Es la causa principal de enfermedad renal terminal (ESRD) en los niños varones.1 En la actualidad, la gran mayoría de los casos se sospechan prenatalmente y se derivan a centros especializados tras el nacimiento. Además, existe un umbral bajo para investigar a un niño varón con una infección del tracto urinario y, por lo tanto, el diagnóstico oportuno suele ser la norma. El espectro de la disfunción renal y los posteriores resultados funcionales varían ampliamente en los niños con esta afección. Las PUV y sus consecuencias, incluida la displasia renal, la dilatación del tracto urinario superior, el reflujo vesicoureteral, la infección del tracto urinario y la disfunción vesical, representan el 25–30% de los trasplantes renales pediátricos en el Reino Unido (UK Transplant Registry).
Este capítulo pretende ofrecer una visión general actualizada sobre las válvulas uretrales posteriores y cómo se manejan en nuestro centro.
Embriología
Existen dos teorías distintas para explicar el origen de las PUV. La primera teoría postula una inserción anómala del conducto mesonéfrico en el seno urogenital, lo que impide la migración normal de estos conductos y su fusión anterior. La otra teoría sugiere que las válvulas representan una membrana urogenital persistente.2 La clasificación inicial de las PUV fue realizada por Hugh Hampton Young en 1919, y describía los tipos I-III basándose en estudios de disección post mortem. Estudios posteriores sugirieron un aspecto más uniforme de la membrana uretral posterior obstructiva, y la evaluación prospectiva de uretras no instrumentadas realizada por Dewan et al. encontró apariencias similares en todos los casos estudiados.3 Su evaluación endoscópica reveló que la membrana se insertaba posteriormente, justo distal al verumontanum. La membrana se extendía en sentido anterior y oblicuo más allá del esfínter externo, con un orificio de tamaño variable situado dentro de ella, a nivel del verumontanum, y describieron la afección como membrana uretral posterior obstructiva congénita (COPUM).
Incidencia y aspectos genéticos
La incidencia reportada comúnmente de PUV es de 1 por cada 5000 nacidos vivos, con un 50% que progresa a ERT en un plazo de 10 años.4 Se ha observado cierta variación, con una incidencia de 1:7800 en Australia y de 1 por cada 3800 en el Reino Unido e Irlanda.5,6 La comprensión de la base genética, o de los posibles factores ambientales o maternos de esta anomalía, continúa evolucionando. Chiraramonte et al han propuesto un papel específico del brazo corto del cromosoma 11.7 Las anomalías asociadas estarán presentes en alrededor del 40% de estos niños, principalmente del sistema cardiovascular, del sistema gastrointestinal y otras afecciones urológicas como hipospadias, microfalo/macrofalo y válvulas uretrales anteriores.8,9,10 Se han comunicado casos de ausencia de meato auditivo externo y de agénesis suprarrenal bilateral en niños con válvulas PUV.
Diagnóstico prenatal
El número de casos de PUV diagnosticados prenatalmente ha aumentado con el mayor uso y la mayor sensibilidad de la ecografía para el cribado de anomalías prenatales. En el Reino Unido, se realizan al menos dos ecografías a las mujeres embarazadas. La primera es una ecografía de datación realizada alrededor de las 10–12 semanas de gestación. La segunda es una ecografía de anomalías más detallada alrededor de las 20 semanas de gestación. Aproximadamente entre la mitad y dos tercios de los niños varones con PUV se sospecharán prenatalmente. Los hallazgos prenatales en la ecografía en los casos sospechosos pueden incluir una vejiga de pared engrosada, el signo de ‘ojo de cerradura’ con vejiga y uretra posterior dilatadas, hidroureteronefrosis unilateral o bilateral, riñones hiperecogénicos y oligohidramnios. El diagnóstico diferencial incluye el síndrome de abdomen en ciruela pasa (prune belly), atresia uretral, reflujo vesicoureteral bilateral y, con menor frecuencia, el trastorno de hipoperistalsis intestinal megacistis-microcolon. La reciente auditoría nacional BAPS CASS identificó el 35% de los casos de PUV de forma prenatal y alrededor del 40% en el primer año de vida.6 Esta auditoría también ha mostrado una relación estadísticamente significativa entre el momento del diagnóstico y un mayor riesgo de deterioro renal.
Intervención prenatal
Las intervenciones prenatales para las válvulas uretrales posteriores incluyen la aspiración vesical, la colocación de una derivación vesicoamniótica y la ablación endoscópica fetal de las válvulas. El fundamento es que la descompresión precoz del tracto urinario fetal permitirá mejorar la supervivencia con preservación de la función renal, reduciendo el compromiso respiratorio y las anomalías de las extremidades que se observan en asociación con oligohidramnios grave. Sin embargo, un volumen normal de líquido amniótico no garantiza una buena función renal posnatal. Un estudio de la North American Fetal Therapy Network analizó los resultados de 32 embarazos consecutivos con obstrucción del tracto urinario inferior (LUTO) y un volumen de líquido amniótico normal a mitad de la gestación.11 La supervivencia perinatal fue del 97 %. Según el análisis univariado, la terapia de reemplazo renal (TRR) fue necesaria cuando se presentaron oligohidramnios y/o anhidramnios, quistes renales corticales, PUV, prematuridad y una estancia prolongada en la unidad de cuidados intensivos neonatales. En el análisis multivariado, el único predictor de TRR fue el parto pretérmino.
Históricamente, el algoritmo introducido por Johnson en 1994 se ha utilizado para seleccionar fetos para la intervención prenatal.12 Los criterios incluyen un cariotipo masculino normal en ausencia de otras anomalías fetales que afectarían negativamente el pronóstico, y oligo/anhidramnios materno o disminución de los volúmenes de líquido amniótico. podría beneficiarse de la intervención. En los últimos años, Ruano et al. propusieron un modelo de selección de pacientes basado en 4 estadios de obstrucción. No se recomienda la intervención fetal para los estadios III-IV.13
Tabla 1 Sistema de estadificación de Ruano
| Ecografía fetal | Bioquímica fetal 18-30 semanas | Posibles terapias | |
|---|---|---|---|
| Etapa 1 | ILA normal Sin quistes renales ni displasia | Favorable tras muestreo secuencial | Seguimiento por ecografía semanal |
| Etapa 2 | Oligoamnios Hidronefrosis bilateral grave Ausencia de quistes o displasia | Favorable tras un máximo de 3 muestreos secuenciales | Cistoscopia o derivación vesicoamniótica |
| Etapa 3 | Anhidramnios u oligoamnios Riñones hiperecogénicos Quistes renales y/o displasia | Desfavorable tras muestreo secuencial | VAS con posible amnioinfusión |
| Etapa 4 | Anhidramnios y anuria tras monitorización de la tasa de llenado vesical. Displasia renal y riñones hiperecogénicos | Bioquímica desfavorable y anuria documentada tras la monitorización del rellenado | Amnioinfusión |
Bioquímica favorable: sodio <100 mEq/L, cloruro <90 mEq/L, osmolalidad <200 mOsm/L, y β-2 microglobulina <6 mg/L.
Una revisión sistemática y metanálisis recientes de 10 artículos sobre la intervención antenatal para LUTO que incluyó a 355 fetos estableció que la supervivencia global fue mayor en el grupo VAS en comparación con el grupo conservador.14 Poco más de la mitad (57%) sobrevivió en el grupo VAS frente al control. Cinco estudios mostraron que la función renal posnatal fue mayor en el grupo VAS en comparación con el grupo conservador. Dos estudios que involucraron a 45 fetos sometidos a cistoscopia fetal demostraron que la supervivencia perinatal fue mayor en el grupo de cistoscopia en comparación con el grupo de manejo conservador. Se observó función renal normal en 13/34 fetos en el grupo de cistoscopia frente a 12/61 en el grupo de manejo conservador a los 6 meses de seguimiento.
Más recientemente, se intentó abordar la cuestión del beneficio de la intervención prenatal en forma de derivación vesicoamniótica en casos de sospecha de obstrucción de la salida vesical. El ensayo PLUTO se diseñó como un ensayo multicéntrico paneuropeo.15 El ingreso a este ensayo se basó en el principio de incertidumbre. En caso de duda sobre el beneficio de la intervención, se asignó aleatoriamente a los pacientes a derivación vesicoamniótica o a no recibir tratamiento. Las variables de resultado incluyeron la mortalidad posnatal, la función renal evaluada mediante creatinina sérica a la edad de 1 año y cualquier morbilidad asociada o complicaciones del procedimiento. El ensayo se llevó a cabo durante 5 años, pero no logró reclutar el número requerido de pacientes y actualmente está cerrado. Lamentablemente, debido al pequeño número de pacientes reclutados, no pudo determinar si la intervención prenatal aporta un beneficio significativo en el tratamiento de casos con sospecha de obstrucción de la salida vesical.
Manejo neonatal
En los neonatos con sospecha prenatal de VUP, sin preocupaciones respecto al volumen del líquido amniótico, el parto puede llevarse a cabo fuera de centros especializados en urología pediátrica. La prioridad es drenar la vejiga utilizando una sonda uretral sin balón de calibre 6/8 Fr. Debe iniciarse profilaxis antibiótica, p. ej., trimetoprim 2 mg/kg. Una sonda sin balón es más segura que una sonda con balón, especialmente en manos inexpertas. Existe la posibilidad de provocar un traumatismo uretral al inflar el balón en la uretra posterior en lugar de en la vejiga.
En aquellos neonatos en los que no es posible cateterizar por vía uretral, generalmente debido a la no disponibilidad de un catéter de 6 Fr o a un cuello vesical muy alto que impide una cateterización exitosa, se hace necesario un catéter suprapúbico. Tras lograr un drenaje vesical satisfactorio, debe prestarse estrecha atención a la diuresis y a las mediciones de electrolitos, ya que estos pacientes pueden desarrollar diuresis posobstructiva que ocasione alteraciones en los niveles de sodio, potasio y bicarbonato. La creatinina debe monitorizarse a diario hasta alcanzar un nadir de creatinina. En los pacientes con disfunción renal significativa y alteraciones electrolíticas, debe involucrarse desde etapas tempranas a un colega de nefrología para optimizar la función renal y la homeostasis.
En los niños varones nacidos con antecedente de oligohidramnios y hipoplasia pulmonar significativa, la prioridad del manejo es el soporte respiratorio y el drenaje vesical. Un catéter uretral o suprapúbico es suficiente para optimizar el drenaje urinario mientras se logra la homeostasis y la estabilidad respiratoria.
Neonatos y lactantes en quienes no se sospechó prenatalmente VUP pueden presentarse con urosepsis, síntomas miccionales obstructivos, una vejiga distendida o riñones palpables y los principios del manejo son los mismos. Aunque un chorro urinario débil es sugestivo de una obstrucción del tracto de salida vesical, la observación de un chorro urinario normal no excluye el diagnóstico.
Confirmación del diagnóstico en el período neonatal
Una vez que el neonato se ha estabilizado, debe confirmarse el diagnóstico. La ecografía renal (USS) proporcionará información sobre el tamaño y la calidad del parénquima renal, el grado de hidroureteronefrosis y la evaluación del grosor de la pared vesical. También puede mostrar una uretra posterior dilatada.
La cistouretrografía miccional (MCUG) confirmará el diagnóstico y debe incluir proyecciones con el catéter retirado para demostrar el calibre de la uretra posterior (Figura 1) Se indica una pauta de antibióticos de 3 días para reducir el riesgo de infección y urosepsis.
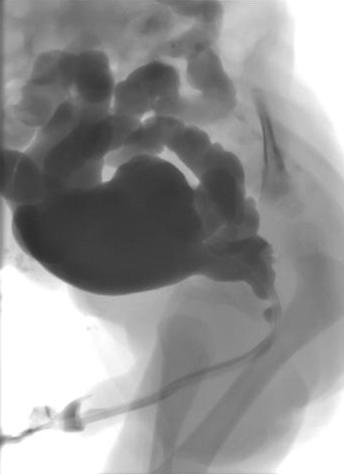
Figura 1 MCUG que muestra uretra posterior dilatada, vejiga irregular y reflujo vesicoureteral bilateral.
Información adicional obtenida a partir de la MCUG incluye el tamaño vesical, la irregularidad vesical por engrosamiento, la trabeculación y la formación de divertículos, el reflujo vesicoureteral (RVU) y la configuración del cuello vesical. Aproximadamente el 50% de los neonatos con VUP presentarán RVU. Si el RVU ha sido de alto grado y unilateral, un “pop-off” podría haber permitido la disipación selectiva de la presión retrógrada derivada de la obstrucción uretral.
El síndrome VURD (válvulas, reflujo unilateral, displasia) descrito por Hoover y Duckett da lugar a una función muy deficiente o nula del riñón del lado con reflujo, con una preservación relativa de la función renal en el lado contralateral, sin reflujo.16 Estos autores también postularon que este mecanismo de ‘pop-off’ da como resultado una función renal normal a largo plazo, puesto que el riñón contralateral está preservado y es normal. Esta hipótesis fue posteriormente cuestionada por Cuckow et al, quienes demostraron con mediciones de creatinina sérica y de TFG que la función renal estaba deteriorada en los casos con VURD, lo que implica que la protección ofrecida por el mecanismo de ‘pop-off’ no era completa.17
Resección primaria de la válvula
El procedimiento de elección para la PUV es la ablación primaria de las válvulas, que se realiza una vez que el bebé está estable desde el punto de vista médico. En la inducción de la anestesia se administra una dosis de antibiótico intravenoso, p. ej., co-amoxiclav 30 mg/kg. Se coloca al bebé en posición de litotomía y se realiza una cistoscopia diagnóstica utilizando un cistoscopio neonatal de 0° 6/8 Fr. Se debe inspeccionar cuidadosamente la uretra posterior y registrar la configuración de las válvulas. También se deben anotar la configuración del cuello vesical y la apariencia de la vejiga y de los orificios ureterales. Se ensambla el resectoscopio de 11 Fr con la cuchilla fría/en hoz o el electrodo de Bugbee y la resección de las válvulas suele realizarse a las 5, 7 y 12 horas (Figura 2)
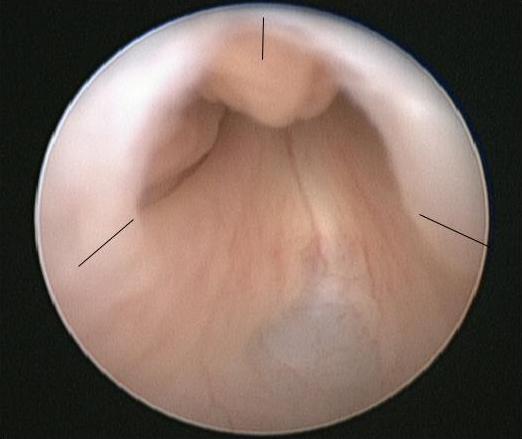
Figura 2 Vista endoscópica de PUV con los sitios para la incisión de la válvula marcados.
Se coloca un catéter uretral al final del procedimiento y se retira 24-48 horas después. Debe comprobarse la creatinina tras la retirada del catéter y se deben pesar los pañales para documentar la diuresis. La profilaxis antibiótica y los suplementos renales deben continuarse hasta nueva revisión.
Las complicaciones de la ablación primaria de las válvulas incluyen hemorragia, resección incompleta de las válvulas, estenosis uretral o lesión inadvertida del esfínter externo. La elección de la técnica está determinada por los instrumentos disponibles, el calibre de la uretra neonatal y el tamaño y la madurez del neonato.
En neonatos prematuros o muy pequeños, la resección endoscópica se retrasa debido a las dificultades derivadas del pequeño calibre de la uretra y a las posibles complicaciones de utilizar instrumentos relativamente más grandes. Estos niños pueden manejarse con un catéter uretral o suprapúbico hasta que sean lo suficientemente grandes para el procedimiento. Como guía aproximada, un peso corporal de 2,5 kg debería permitir una resección de VUP segura y precisa con instrumentos endoscópicos estándar.
En algunos neonatos pequeños puede haber problemas recurrentes con catéteres uretrales o suprapúbicos que se salen, se obstruyen o se desplazan, o que no drenan adecuadamente y, en estas circunstancias, la realización de una vesicostomía puede considerarse la opción más segura para garantizar un drenaje vesical adecuado y continuo.
Recomendamos que todos los niños se sometan a una cistoscopia de seguimiento dentro de los 3 meses posteriores al procedimiento inicial para asegurar la ablación completa de las válvulas. Esto se debe a la escasa correlación de la MCUG repetida para diagnosticar valvas residuales y la valoración cistoscópica de valvas residuales que requieren resección adicional; valor predictivo positivo del 56%.18 Sin embargo, algunos centros optarían por realizar una MCUG repetida en esta etapa y proceder a la cistoscopia solo si la MCUG sugiere una obstrucción uretral persistente. Otra ventaja de proceder directamente a una cistoscopia de control es que brinda la oportunidad de realizar la circuncisión, la cual ha demostrado reducir la tasa de infección del tracto urinario en al menos un 83% en niños con válvulas uretrales posteriores.19 Esto ha sido validado por un ensayo clínico aleatorizado multicéntrico reciente, el estudio CIRCUP. En la población del estudio de 91 niños, la probabilidad de presentar una ITU febril fue del 20% en el grupo de antibióticos frente al 3% en el grupo de circuncisión + antibióticos.20
Presentación, diagnóstico y manejo en el niño mayor
Un número menor de pacientes con PUV no se presentará como neonatos o lactantes, sino que acudirán a consulta en la infancia o en la adolescencia temprana con síntomas de enuresis diurna, goteo urinario o chorro urinario débil, infección o, menos comúnmente, hematuria. Una historia miccional cuidadosa puede sugerir el diagnóstico y los estudios no invasivos, como las tasas de flujo y la medición de los volúmenes residuales posmiccionales, también pueden señalar la anomalía. El cateterismo uretral en el niño mayor es invasivo y conlleva dificultades; por lo tanto, nuestra preferencia es omitir la MCUG y, en su lugar, proceder directamente a una cistoscopia diagnóstica y a la ablación valvular primaria si se confirma el diagnóstico. El seguimiento después de una ablación valvular completa y exitosa es como se detalla a continuación, con una mayor sospecha de disfunción vesical persistente en quienes se presentan tardíamente.
Seguimiento
Cada institución tendrá un protocolo de seguimiento propio para los niños con válvulas uretrales posteriores. Sin embargo, los objetivos del seguimiento son:
- Optimizar la función renal
- Minimizar las infecciones urinarias y la cicatrización renal
- Evaluación y manejo de la disfunción miccional con el objetivo de alcanzar la continencia urinaria total
- Transición a los servicios para adolescentes y adultos
La participación de la nefrología pediátrica es imprescindible para maximizar los resultados y garantizar el manejo médico adecuado de estos niños.
Tabla 2 Ejemplo de protocolo de seguimiento de pacientes con PUV utilizado en el Great Ormond Street Hospital, Reino Unido. FBC=hemograma completo, GFR=tasa de filtración glomerular, US=ecografía del tracto renal, MCUG=cistouretrografía miccional, MSU=muestra de orina de chorro medio que incluya prueba de proteinuria, BFA=evaluación de la función vesical. Definido por edad; en lactantes, alarmas de pañal y mediciones del residuo posmiccional; en niños mayores, gráficos de frecuencia-volumen, estudios de flujo y mediciones del residuo posmiccional, SPC=catéter suprapúbico.
| Creatinina y electrolitos | Hemograma completo | TFG corregida | Ecografía | Cistouretrografía miccional | MAG3 | Cistoscopia/ablación de válvulas | Muestra de orina de chorro medio | Evaluación de la función vesical | Video-urodinámica a través de catéter suprapúbico | |
|---|---|---|---|---|---|---|---|---|---|---|
| Nacimiento | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 3 meses | ✓ | ✓ | ✓ | ✓ | +/- circuncisión | ✓ | ||||
| 1 año | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 2 años | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 3 años | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 4 años | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 5 años | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | |||
| 6 años | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 7 años | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 8 años | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ||||
| 9 años | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| 10 años | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | ✓ | |||
| 11-14 años Anual | ✓ | ✓ | ✓ | ✓ | ✓ | |||||
| >15 años | ✓ | ✓ | ✓ | ✓ | +/- | ✓ | ✓ | Derivación a clínica de adolescentes |
Derivación urinaria precoz
Existe un pequeño grupo de niños varones en quienes las medidas estándar descritas anteriormente no producen el resultado deseado y su función renal se mantiene frágil o se deteriora, o presentan infecciones urinarias recurrentes o hay un deterioro significativo en el aspecto de las vías urinarias superiores o el vaciamiento vesical es incompleto en ecografías seriadas. El objetivo en estos niños es maximizar su potencial renal y retrasar o evitar el reemplazo renal. La derivación urinaria temprana, ya sea mediante vesicostomía o ureterostomía bilateral o pielostomía, tiene como objetivo proteger las vías urinarias superiores y minimizar los riesgos de infección.
Chua et al realizaron una revisión retrospectiva de 40 niños varones con ablación valvular aislada o ablación + vesicostomía/derivación supravesical. Observaron que la derivación urinaria tras la ablación valvular en niños con enfermedad renal crónica estadio 3 asociada a válvulas uretrales posteriores puede retrasar temporalmente la progresión a la enfermedad renal terminal. Por lo tanto, esto puede no aportar beneficios a largo plazo y es más bien una medida temporizadora.21 Esto reitera los hallazgos de trabajos previos de Tietjen y Lopez-Pereira at al.22,23
El concepto de una ureterostomía refluyente como forma de derivación urinaria ha mostrado cierta promesa. Esta es una técnica elegante que permite que continúe el ciclo vesical y, al mismo tiempo, disipa las altas presiones de almacenamiento y de micción que están presentes en la vejiga valvular a esta edad. El requisito principal es un uréter con reflujo libre y el procedimiento se realiza mediante una incisión en el pliegue cutáneo inguinal bajo. El uréter se identifica y se aísla de forma extravesical en el retroperitoneo. Luego se confecciona una ureterostomía refluyente en asa, que drenará hacia el pañal. A diferencia de la ureterostomía terminal, la reversión es relativamente sencilla. Una vez que el procedimiento ha cumplido su propósito o deja de ser refluyente, la ureterostomía se cierra simplemente y el uréter se devuelve al espacio retroperitoneal. La ureterostomía refluyente es particularmente útil en varones con función renal frágil, ya que minimizará los posibles efectos perjudiciales de la vejiga de alta presión que está presente en el periodo inicial tras la ablación de las válvulas. Esto es crítico en el manejo de estos neonatos, ya que la terapia de reemplazo renal en la infancia es extremadamente precaria y difícil de mantener.
Se han planteado preocupaciones legítimas de que derivar la vejiga o mantenerla continuamente vacía pueda afectar negativamente la función vesical futura. Además, no hay pruebas convincentes de que la derivación urinaria mejore la función renal a largo plazo.
Al comparar la ablación primaria de las válvulas con la vesicostomía primaria, Godbole et al. no encontraron diferencias significativas en la creatinina sérica y la tasa de filtración glomerular (TFG) a la edad de 1 año entre los dos grupos.24 El grupo que tuvo la formación de una vesicostomía como procedimiento primario había estado derivado durante una mediana de 18 meses y, en 7 niños que posteriormente se sometieron a estudios urodinámicos, se demostró una capacidad vesical normal. Jaureguizar et al. compararon los resultados de la función vesical en niños tratados con derivación supravesical frente a la ablación primaria de válvulas sola.25 El tiempo medio durante el cual la derivación supravesical estuvo presente fue de 13 meses y todos fueron derivados en los primeros 2 meses de vida. Realizaron estudios urodinámicos invasivos a la edad de 9–10 años y encontraron proporciones muy similares de vejigas normales, de baja complacencia, inestables y descompensadas en ambos grupos.
Resultados vesicales más favorables, mayor capacidad, menor presión del detrusor al final del llenado en la capacidad vesical esperada y menor frecuencia de inestabilidad del detrusor se han demostrado en 8 pacientes tratados con ablación valvular primaria en comparación con 11 niños tratados con ureterostomía en asa alta y baja.26 Los estudios urodinámicos se realizaron en estos niños a una edad media mínima de 11 años y la duración de la derivación fue en promedio de 57 meses.
Así, el papel de la derivación urinaria precoz en el manejo de los niños con PUV es limitado. Tiene el potencial de mejorar la función renal a corto plazo, lo cual es muy importante en niños con función renal frágil, y puede posponer el reemplazo renal a una etapa posterior. No hay evidencia convincente que respalde su papel como medio para mejorar la función renal a largo plazo y no hay consenso respecto a su efecto sobre la función vesical a largo plazo. Por lo tanto, la derivación urinaria debe considerarse en casos seleccionados, con objetivos y criterios de valoración claros, y tiene un papel en el manejo de los niños con PUV.
Resultados a largo plazo: vías urinarias superiores
La producción de orina comienza a las 8-9 semanas de gestación y el sistema colector se forma al final del primer trimestre. La vejiga fetal puede visualizarse poco después en la ecografía prenatal. La presencia de obstrucción al flujo de salida vesical transmite una presión intraluminal elevada al parénquima renal en desarrollo y, una vez alcanzado un nivel crítico, provoca apoptosis, diferenciación celular anómala y cambios glomerulares que ocurren dentro del riñón. Estos cambios tempranos determinan el potencial funcional renal en etapas posteriores de la vida. En los casos en que la obstrucción es menos grave o se manifiesta más tarde en el embarazo, los efectos de la obstrucción tienden a afectar más a la vejiga y los efectos renales se limitan a la dilatación del sistema colector con mínima alteración de la nefrogénesis normal. Una teoría alternativa o quizá complementaria para explicar la displasia renal observada en asociación con las válvulas uretrales posteriores se relaciona con la posición anómala del brote ureteral y su implantación en el blastema metanéfrico.27 Así, la disfunción renal parece ser el resultado de grados variables de displasia intrínseca y de los efectos de la obstrucción al flujo de salida vesical. En la vida posnatal, estos efectos pueden exacerbarse aún más por infecciones del tracto urinario, RVU y disfunción vesical
Cuando hay una pérdida significativa de nefronas, se produce hiperfiltración de las nefronas funcionales existentes mediante vasodilatación de las arteriolas aferentes. La hipertensión capilar glomerular resultante permite mantener temporalmente una función renal normal. Con el tiempo, este mecanismo compensatorio se descompensa, sobreviene la glomeruloesclerosis, con la consiguiente proteinuria, hipertensión y una reducción de la tasa de filtración glomerular. El daño al nefrón distal deteriora la capacidad de concentración del riñón, lo que da lugar a poliuria y polidipsia (diabetes insípida nefrogénica), que puede empeorar la función vesical y, de este modo, poner aún más en riesgo la función del tracto urinario superior.
El artículo de Parkhouse et al se cita con frecuencia y describe los resultados a largo plazo de 98 varones diagnosticados de válvulas uretrales posteriores que se presentaron entre 1966-1975, antes de la era del diagnóstico prenatal.28 El periodo de seguimiento de este estudio osciló entre 11 y 22 años. El 66% de la cohorte se presentó en el primer año de vida y la mitad de los pacientes de la cohorte fueron tratados con ablación primaria de las válvulas, y el resto fueron derivados. El 32% (31 pacientes) tuvieron un ‘mal desenlace renal a largo plazo;’ 10 pacientes murieron por insuficiencia renal aguda, 15 evolucionaron a enfermedad renal terminal y 6 presentaban insuficiencia renal crónica establecida durante el periodo de seguimiento. La presentación antes del año de edad (p<0.05), la presencia de reflujo vesicoureteral bilateral (p<0.0010), una urea plasmática al alta inicial de >10 mmol/litro y, a los 5 años, la presencia de proteinuria (p<0.001) junto con incontinencia urinaria persistente, todas ellas se asociaron con un mal desenlace renal.
Series más recientes informan resultados bastante similares. Kousidis y col. presentaron una serie de 42 pacientes con válvulas uretrales posteriores diagnosticadas prenatal y posnatalmente entre 1984–1996.29 El período de seguimiento fue de 10-23 años. Hubo 3 (7%) muertes (2 en el período neonatal y 1 paciente de 3 años tras un trasplante fallido), 11 pacientes (26 %) habían progresado a insuficiencia renal terminal, uno de estos se produjo únicamente en la adolescencia tardía.
En un grupo de 65 pacientes con PUV que se presentaron entre 1987–2004 y fueron seguidos durante un periodo de tiempo más corto (rango 1–14.3 años; mediana de seguimiento 6.8 años), Sarhan et al encontraron una tasa global de deterioro renal del 17%, de los cuales el 9% había progresado a enfermedad renal terminal (ERT).30 La edad gestacional temprana al diagnóstico (<24 semanas; p=0.003) y el oligohidramnios o anhidramnios prenatales (p=0.02) se asociaron con un mal pronóstico. No hubo muertes en este grupo, pero durante el mismo periodo de estudio hubo 14 fetos con un diagnóstico prenatal en los que se interrumpió el embarazo. Se había realizado análisis de orina fetal en todos los casos y los hallazgos post mortem confirmaron cambios histológicos renales graves. Esto sugiere que la incidencia global de insuficiencia renal, teniendo en cuenta los fetos cuya gestación fue interrumpida, es similar a la de los otros estudios mencionados anteriormente.
El grupo más grande de DeFoor, de 119 pacientes con PUV seguidos durante un tiempo similar, (rango 3–24 años; media de seguimiento 7.2 años), halló que el 13% había desarrollado insuficiencia renal terminal a una mediana de edad de 8.2 años (rango 7 días–17.5 años).31 En este estudio, la disfunción vesical, que requiere cateterismo intermitente limpio y/o uso de medicación anticolinérgica, se asoció con un mayor riesgo de ERT. La creatinina sérica nadir > 1.0 mg/dl también se asoció con un mayor riesgo de ERT (OR 71, IC 10–482) y esto se ha corroborado en varios estudios previos y posteriores, en los que una creatinina sérica <1.0 mg/dl al año de edad confiere un buen pronóstico renal a largo plazo.
Heikkila et al han evaluado una cohorte más grande de pacientes (n=193) con válvulas uretrales posteriores a lo largo de un periodo de tiempo mucho más prolongado (rango 6–69 años; mediana de seguimiento 31 años).32 La tasa de progresión a insuficiencia renal terminal fue del 22.8%, con un 68% que la desarrolló antes de los 17 años y el resto después de los 17 años. El deterioro de la función renal alrededor de la época de la pubertad en niños con riñones displásicos es bien reconocido, y una explicación probable es que representa cambios dentro del riñón en respuesta al crecimiento, al aumento de la masa corporal y al aumento de la presión arterial.33 Sin embargo, este deterioro tardío de la función renal después de la pubertad, destacado por este artículo, destaca la necesidad de un seguimiento de estos pacientes hasta la edad adulta y más allá.
Pereira et al en su serie de 77 casos de PUV, diagnosticados < 6 meses de edad y seguidos durante un promedio de 11.7 años, observaron que 27 (35.1%) tenían IRC, 14 de los cuales estaban en ERT. De estos 27 niños con IRC, 22 progresaron a IRC en los primeros 3 años de vida: 4 entre los 15-16 años y 1 a los 20 años de edad.34
El inicio de la enfermedad renal terminal (ERT) sigue siendo impredecible. La proteinuria puede indicar el inicio del deterioro de la función renal y debe ser monitorizada. La poliuria puede aumentar los volúmenes residuales posmiccionales, causando uropatía progresiva y un deterioro de la capacidad de concentración de la médula renal que agrava aún más la poliuria, creando un ciclo de deterioro. Un buen vaciamiento vesical es vital; en casos extremos, el drenaje vesical nocturno puede retrasar el deterioro renal y mejorar el sueño de los pacientes con poliuria.35
Reflujo vesicoureteral
Al momento de la presentación, aproximadamente el 50% de los pacientes tienen reflujo vesicoureteral (RVU) en la MCUG inicial. Se cree que esto es secundario a la obstrucción del tracto de salida vesical y a la disfunción vesical coexistente. Aproximadamente el 15% de los pacientes presentarán RVU unilateral de alto grado con ausencia de función del riñón ipsilateral. Tras la ablación de las válvulas, la gravedad del RVU puede disminuir o resolverse por completo en el 25-50% de los casos, y esta mejoría es más probable en quienes se presentan como neonatos o durante la infancia. El RVU persistente, especialmente de alto grado y bilateral, tras una ablación valvular exitosa se asocia con un mal resultado renal a largo plazo y es uno de los indicadores pronósticos desfavorables identificados por Parkhouse et al.28 Ya no existe la tendencia a realizar procedimientos antirreflujo en niños con PUV, ya que las tasas de fracaso asociadas con este enfoque son altas. En los casos en que el grado de reflujo es alto y se asocia con mala función del riñón ipsilateral, el uréter dilatado se ha utilizado para ampliar la vejiga en asociación con la extirpación del riñón no funcionante. Otras estrategias innovadoras incluyen la creación de una ureterostomía con reflujo, como se discutió previamente, y ocasionalmente se ha utilizado el uréter distal como un conducto de Mitrofanoff con o sin un procedimiento antirreflujo asociado. Los grados persistentes más altos de reflujo son un factor de riesgo potencial para infección urinaria recurrente y pueden afectar negativamente a los riñones trasplantados y, por lo tanto, generalmente se tratan quirúrgicamente antes del trasplante renal.
En un ECA reciente, Abdelhalim et al. observaron cierta mejoría del reflujo tras la ablación de válvulas, con oxibutinina. Hubo 24 pacientes en el brazo de oxibutinina y 25 en el brazo de control. Las unidades renales del grupo de oxibutinina tuvieron una mayor probabilidad de mejoría de la hidronefrosis (61.9% vs 34.8%, p=0.011) y de resolución del reflujo vesicoureteral (62.5% vs 25%, p=0.023).36
Hidroureteronefrosis
La mayoría de los recién nacidos que se presentan con válvulas uretrales posteriores mostrarán hidro-ureteronefrosis bilateral. Esto a menudo mejora con la cateterización inicial, pero puede empeorar temporalmente debido a una obstrucción funcional a nivel de la UVJ por la pared vesical engrosada que se colapsa, pinzando los orificios ureterales tras la cateterización y la descompresión. Es importante reconocer este fenómeno y, en ocasiones, esto puede dar lugar a anuria que dura 24-48 horas. La obstrucción se resuelve espontáneamente en 48-72 horas y suele ir seguida de diuresis posobstructiva. Es importante mantener la calma y resistir la tentación de intentar descomprimir las vías superiores mediante la colocación de un catéter doble J interno o de nefrostomías. Tras la ablación primaria de las válvulas, se debe anticipar que el grado de dilatación de las vías superiores mejore gradualmente o se resuelva por completo.37 Esta mejoría estará influida por el RVU persistente, la disfunción vesical, la poliuria y la motilidad ureteral anormal, y todos estos factores deben tenerse en cuenta al evaluar los resultados tras la ablación de las válvulas. La reimplantación ureteral con o sin estrechamiento ya no se realiza en el contexto de empeoramiento de la hidro-ureteronefrosis en casos de VUP, ya que, con la mejor comprensión de la fisiopatología de la obstrucción del tracto de salida vesical, se ha reconocido cada vez más el papel de la vejiga y su disfunción asociada, así como la disfunción tubular renal con la consiguiente poliuria.
Resultados a largo plazo: Tracto urinario inferior
La etiología subyacente del comportamiento vesical en las válvulas uretrales posteriores sigue siendo un tema de mucho debate. Los dos principales mecanismos implicados en la etiología son que la vejiga anómala es el resultado de cambios in útero en respuesta a la obstrucción del flujo de salida y/o que la disfunción vesical es consecuencia de la derivación urinaria. Respecto a la segunda teoría, no hay consenso, ya que en la actualidad la mayoría de los casos no se derivan aunque la incidencia de disfunción vesical sigue siendo alta. Godbole et al. han demostrado que la derivación no es necesariamente perjudicial para la evolución de la función vesical e incluso podría mejorarla.24
Histológicamente, la vejiga obstruida en modelos animales fetales demuestra un aumento de la masa de músculo liso, un aumento del número de receptores muscarínicos y un mayor depósito de colágeno. Pero trabajos más recientes implican un aumento de la fibrosis en la patogénesis de la disfunción vesical.38 Un artículo de uno de los autores de este capítulo ha identificado que el reemplazo del músculo liso por fibrosis es un factor contribuyente importante en la disfunción contráctil en la vejiga PUV hipertónica. Esto abre vías de investigación sobre el potencial de los agentes antifibróticos para restaurar la contractilidad normal.39
Los investigadores también han demostrado la reversibilidad de algunos de estos cambios con el alivio de la obstrucción, aunque la recuperación puede ser parcial, dependiendo del momento del alivio y del grado de daño irreversible que ya haya ocurrido. La presentación temprana resultante del diagnóstico prenatal permite un tratamiento oportuno y, por lo tanto, sería razonable esperar mejores resultados en la función vesical en la población actual de niños con sospecha prenatal de obstrucción del tracto de salida vesical.
El término ‘síndrome de vejiga valvular’ se introdujo como concepto en la década de 1980 para englobar los patrones miccionales anormales y los síntomas de disfunción miccional, una vejiga de pared engrosada persistente, el vaciamiento vesical incompleto y la dilatación del tracto urinario superior asociada observados en muchos niños con válvulas uretrales posteriores tratadas. Peters et al, en su cohorte de 41 niños que fueron evaluados principalmente por incontinencia urinaria persistente y ‘síndrome de vejiga valvular,’ encontraron tres patrones urodinámicos dominantes en las pruebas invasivas; la vejiga hiperactiva y la vejiga con baja complianza o la vejiga acontráctil con cierto solapamiento entre estos patrones.40
En los últimos 30 años, los clínicos han empezado a reconocer y comprender la importancia de la disfunción vesical y su impacto en el desenlace tanto de la continencia urinaria como de la función renal en niños con válvulas uretrales posteriores. Se observan marcadas diferencias en las técnicas urodinámicas, la clasificación de distintos patrones y el momento de realización de los exámenes al revisar la literatura sobre este tema.
Holmdahl et al siguieron a 12 niños con PUV menores de 15 años. Se observó inestabilidad durante el llenado urodinámico en 2/3 de los pacientes a los 5 años de edad, pero para la pubertad esto se había reducido.41 A los 5 años, la capacidad vesical parecía ser normal, pero después de la pubertad se demostró que la capacidad era aproximadamente el doble de la capacidad esperada. El patrón urodinámico cambió con el tiempo, con una disminución de la inestabilidad a favor de un patrón sobredistendido con el aumento de la edad. Este cambio en el comportamiento vesical también fue mostrado por De Gennaro et al, donde el 71% de 48 pacientes estudiados presentaron estudios urodinámicos anormales entre los 10 meses y los 15 años.42 En el grupo de edad <8 años, el 44% presentaron vejigas hipercontráctiles y el 31% hipocontráctiles, y los pacientes >8 años demostraron 28 % hipercontráctiles y 50% hipocontráctiles en los patrones urodinámicos. Misseri et al demostraron una tasa menor (5.9%) de fallo miogénico (acontráctil o incapaz de generar una contracción del detrusor sostenida para un vaciamiento vesical adecuado) en su estudio retrospectivo de 51 niños y concluyeron que el fallo del detrusor se debía al tratamiento anticolinérgico coexistente en su cohorte de casos.43
La disfunción vesical es clave para los resultados de la función renal a largo plazo, como se ilustra en el estudio de seguimiento a largo plazo de Parkhouse et al., en el que el hallazgo de incontinencia a los 5 años en el 44% de los pacientes, definida como no estar seco durante el día, se asoció con un resultado renal desfavorable en el 46% de este grupo (p<0.001).20,24 En el grupo de Ansari de 227 niños varones con válvulas uretrales posteriores, mostraron un riesgo global del 30% de desarrollar enfermedad renal crónica, con un 10% que progresó a insuficiencia renal terminal.1 La disfunción vesical grave, definida como baja complacencia con presión de fin de llenado >40 cm de H20 o volumen residual posmiccional >30% o detrusor hipoactivo o la necesidad de CIC, fue más prevalente en los pacientes que progresaban a IRT (p<0.0001). El estudio de Mazen de 116 pacientes con PUV seguidos durante una media de 10.3 años (rango 18 meses–22 años) encontró que el 42% de los pacientes presentaba IRT o había sido trasplantado. Se observaron anomalías urodinámicas en el 80% del grupo global de pacientes y la inestabilidad vesical y la baja complacencia se correlacionaron con un desenlace funcional renal desfavorable (p=0.04).44
En la cohorte de PUV tratadas prenatalmente, los datos relativos a la disfunción vesical son escasos. Abbo et al. compararon los resultados de 38 niños con diagnóstico prenatal y 31 con diagnóstico posnatal de PUV, sin mostrar diferencias significativas en la incidencia de disfunción miccional (27% vs. 31%) a los 7,2 años de seguimiento.45
La función vesical continúa evolucionando durante la adolescencia y el manejo vesical eficaz debe continuar en la edad adulta. El crecimiento prostático altera la dinámica del tracto de salida vesical, y el patrón cambiante de la dinámica vesical observado en la primera infancia continúa modificándose durante la adolescencia, predominando el aumento de la capacidad vesical y los grandes volúmenes residuales posmiccionales. Algunos varones jóvenes pueden tener que iniciar cateterismo intermitente limpio para abordar este deterioro irreversible de la función vesical.
Trasplante renal
Dado que un número significativo de niños varones con PUV progresa a insuficiencia renal terminal, no se puede sobrestimar la importancia de una evaluación vesical exhaustiva como parte del estudio pretrasplante. Una vejiga de alta presión, de baja distensibilidad y de poca capacidad puede poner en riesgo el riñón trasplantado, y la pérdida del injerto se convierte en una posibilidad real. Las tasas de supervivencia del injerto a cinco años en la población con PUV han mejorado en las últimas dos décadas, del 40% en la década de 1980 al 70% en la de 1990 y a cerca del 90% en la de 2000.46
Para aquellos pacientes que requieren una intervención quirúrgica para lograr una vejiga que se considere un receptáculo ‘seguro’ para el trasplante, existen opiniones divididas sobre si esta cirugía debe realizarse antes o después del trasplante. Realizar una ampliación vesical con/sin un conducto cateterizable antes del trasplante renal permite la cicatrización posoperatoria sin inmunosupresión, pero conlleva el riesgo de una ‘cistoplastia seca’, que debe manejarse mediante ciclado vesical y lavados, especialmente si no hay producción urinaria nativa o esta es mínima. Un riesgo adicional con este enfoque es que esta cirugía mayor puede descompensar la frágil función renal y acelerar la necesidad de terapia de reemplazo renal y de diálisis temporal en el escenario de trasplante renal preemptivo. Con la ampliación vesical antes del trasplante, cualquier procedimiento adicional, incluido el propio trasplante, no debe dañar el pedículo vascular de la ampliación, especialmente cuando hay un intervalo corto entre los procedimientos, y se debe extremar el cuidado para garantizar la seguridad de la vejiga reconstruida. Para aquellos pacientes en los que la cistoplastia de aumento se realiza después del trasplante renal, es importante que los requerimientos de inmunosupresión se hayan estabilizado y que la mejoría de la función renal ofrezca ventajas claras. En este escenario, el uréter del injerto puede reimplantarse en la vejiga nativa o exteriorizarse como una ureterostomía cutánea. Jesus y Pippi Salle concluyeron, tras una revisión de la literatura disponible, que la ampliación aumenta el riesgo de ITU después del trasplante.47 Coincidieron en que la ampliación preemptiva debe confeccionarse solo en casos seleccionados, en los que los riesgos asociados con el aumento de las presiones vesicales superen a los derivados de la propia ampliación y de las ITU. Sabiendo que un número significativo de niños con VUP desarrollarán fallo miogénico, la ampliación puede retrasarse mientras permanezcan bajo estrecha vigilancia. En el contexto de las válvulas uretrales posteriores y el trasplante renal, es crucial que la vigilancia de la función vesical continúe después del trasplante. Riley et al. ofrece una revisión exhaustiva de las diferentes estrategias de manejo de la vejiga en el contexto de la disfunción del tracto urinario inferior y del trasplante renal.48
Fertilidad
Hay pocos estudios que informen sobre los resultados de fertilidad y paternidad en varones con antecedentes de válvulas uretrales posteriores. La dilatación persistente de la uretra posterior, la lesión de los tejidos alrededor del veru montanum o las estenosis uretrales secundarias a cirugías previas influirán todas en la eficacia de la eyaculación. La disfunción eréctil se observa con mayor frecuencia en pacientes con enfermedad renal crónica y en aquellos en diálisis. En 9 pacientes con antecedentes de PUV estudiados por Woodhouse, el análisis seminal se consideró dentro de la normalidad, mientras que en 6 varones que remitieron semen para análisis a Lopez Pereira, 2 pacientes presentaron formas anormales o un alto porcentaje de espermatozoides inmóviles.49,50
Nuevas vías de investigación
El manejo de las válvulas uretrales posteriores ofrece un amplio margen para explorar estrategias novedosas de predicción de resultados y supervivencia. Kwong y cols. han desarrollado recientemente una herramienta de aprendizaje automático para predecir desenlaces clínicamente relevantes. Esto muestra cierto potencial y justifica una validación adicional.51
Puntos clave
- Las válvulas uretrales posteriores siguen siendo la causa más común de obstrucción del tracto de salida vesical neonatal en varones.
- Un número creciente de casos se diagnostica de forma antenatal, pero la intervención prenatal no parece conferir un beneficio en la evolución a largo plazo de la función renal.
- La ablación primaria de las válvulas es el tratamiento de elección recomendado, reservándose la derivación para casos individuales específicos.
- Un número significativo de niños con PUV desarrollará enfermedad renal crónica e insuficiencia renal terminal.
- El seguimiento estructurado tiene como objetivos prevenir el deterioro de las vías urinarias superiores, prevenir la infección del tracto urinario, maximizar el crecimiento y permitir la vigilancia de la disfunción vesical tanto en pacientes con PUV en el período pre como postrasplante.
Referencias
- Ansari MS. Risk factors for progression to end-stage renal disease in children with posterior urethral valves. Journal of Pediatric Urology 6 (ue 3): 261–264. DOI: 10.1590/s1677-55382011000200030.
- Krishnan A, Souza A, Konijeti R, Baskin LS. The anatomy and embryology of posterior urethral valves. J Urol 2006; Apr;175(4):1214-20. DOI: 10.1016/s0022-5347(05)00642-7.
- Dewan PA, Zappala SM, Ransley PG, Duffy PG. Endoscopic reappraisal of the morphology of congenital obstruction of the posterior urethra. J Urol 1992; 70: 439–444. DOI: 10.1111/j.1464-410x.1992.tb15805.x.
- Casella DP, Tomaszewski JJ, Ost MC. Posterior urethral valves: renal failure and prenatal treatment. Int J Nephrol 2012; 2012 (351067). DOI: 10.1155/2012/351067.
- Thakkar D, Deshpande AV, Kennedy SE. Epidemiology and demography of recently diagnosed cases of posterior urethral valves. Pediatr Res 2014; Dec;76(6):560-3. DOI: 10.1038/pr.2014.134.
- Brownlee E, Wragg R, Robb A, Chandran H, Knight M, L. MC, et al.. Current epidemiology and antenatal presentation of posterior urethral valves: Outcome of BAPS CASS National Audit. J Pediatr Surg 2019; Feb;54(2):318-321. DOI: 10.1016/j.jpedsurg.2018.10.091.
- Chiaramonte C, Bommarito D, Zambaiti E, Antona V, Li Voti G. Genetic Basis of Posterior Urethral Valves Inheritance. Urology 2016. DOI: 10.1016/j.urology.2016.05.043.
- A. HS, D. RP, H. PD, L. M-JM, obstruction CWHP. Prenatal sonographic findings and clinical outcome in fourteen cases. Journal of Ultrasound in Medicine 1988; 7 (7). DOI: 10.7863/jum.1988.7.7.371.
- J. C, R M. A case of hypospadias, anterior and posterior urethral valves. Journal of Surgical Case Reports 2013; 2013 (2). DOI: 10.1093/jscr/rjt003.
- L. RK, B. E, P M. Anterior and posterior urethral valves: a rare association. Journal of Pediatric Surgery 2003; 38 (7). DOI: 10.1016/s0022-3468(03)00218-5.
- Johnson MP, Danzer E, Koh J, Polzin W, Harman C, O’Shaughnessy R. Natural history of fetal lower urinary tract obstruction with normal amniotic fluid volume at initial diagnosis. Fetal Diagn Ther 2018; 44 (1): 10–17. DOI: 10.1159/000478011.
- Johnson MP, Bukowski TP, Reitleman C, Isada NB, Pryde PG, Evans MI. In utero surgical treatment of fetal obstructive uropathy: a new comprehensive approach to identify appropriate candidates for vesicoamniotic shunt therapy. Am J Obs Gynecol 1994; 170 (6): 1770–1779. DOI: 10.1016/s0002-9378(12)91847-5.
- Ruano R, Dunn T, Braun MC, Angelo JR, Safdar A. Lower urinary tract obstruction: fetal intervention based on prenatal staging, Pediatr. Nephrol 2017; 32 (10): 1871–1878. DOI: 10.1007/s00467-017-3593-8.
- Saccone G, D’Alessandro P, Escolino M, Esposito R, Arduino B, Vitagliano A. Antenatal intervention for congenital fetal lower urinary tract obstruction (LUTO): a systematic review and meta-analysis. J Matern Fetal Neonatal Med 2020; 33 (15): 2664–2670. DOI: 10.1080/14767058.2018.1555704.
- group PLUTO, M K, K K, K M, J D. PLUTO trial protocol: percutaneous shunting for lower urinary tract obstruction randomised controlled trial. BJOG 2007; 114 (7): 904–905. DOI: 10.1111/j.1471-0528.2007.01382.x.
- Hoover DL, Duckett JJ. Posterior urethral valves, unilateral reflux and renal dysplasia: a syndrome. J Urol 1982; 128 (5): 994–997. DOI: 10.1016/s0022-3468(83)80243-7.
- Cuckow PM, Dineen MD, Risdon RA, PG R. Longterm renal function in posterior urethral valves, unilateral reflux and renal dysplasia syndrome. J Urol 1997; 158(3: 2 1004–1007. DOI: 10.1016/s0022-5347(01)64375-1.
- Smeulders N, Makin E, Desai D, P D. The predictive value of a repeat micturating cystourethrogram for remnant leaflets after primary endoscopic ablation of posterior urethral valves. J Ped Urol 2011; 7 (2): 203–208. DOI: 10.1016/j.jpurol.2010.04.011.
- Mukherjee S, Joshi A, Carroll D, al CH. What is the effect of circumcision on risk of urinary tract infection in boys with posterior urethral valves? J Ped Surg 2009; 44: 417–421. DOI: 10.1016/j.jpedsurg.2008.10.102.
- Harper L, Blanc T, Peycelon M, Michel JL, Leclair MD, Garnier S, et al.. Circumcision and Risk of Febrile Urinary Tract Infection in Boys with Posterior Urethral Valves: Result of the CIRCUP Randomized Trial. Eur Urol 2021; 22:S0302-2838(21)01993-X. DOI: 10.1016/j.eururo.2021.08.024.
- Chua ME, Ming JM, Carter S, El Hout Y, Koyle MA, Noone D, et al.. Impact of Adjuvant Urinary Diversion versus Valve Ablation Alone on Progression from Chronic to End Stage Renal Disease in Posterior Urethral Valves: A Single Institution 15-Year Time-to-Event Analysis. J Urol 2018. DOI: 10.1016/j.juro.2017.10.024.
- Tietjen DN, Gloor JM, Husmann DA. Proximal urinary diversion in the management of posterior urethral valves: is it necessary? J Urol 1997; 158: 1008–1010. DOI: 10.1016/s0022-3468(98)90257-3.
- P LP, L E, MJ MU, R L. Posterior urethral valves: prognostic factors. BJU Int 2003; 91: 687–690. DOI: 10.1016/s0022-5347(05)61251-7.
- Godbole P, Wade A, Mushtaq I, Wilcox D. Vesicostomy vs. primary valve ablation of posterior urethral valves: Always a difference in outcome? J Ped Urol 2007; 3: 273–275. DOI: 10.1016/j.jpurol.2006.11.007.
- Jaureguizar E, Lopez Pereira P, Urrutina MJM, L E. Does neonatal pyeloureterostomy worsen bladder function in children with posterior urethral valves? J Urol 2000; 164: 1031–1034. DOI: 10.1097/00005392-200009020-00027.
- Podesta M, Ruarte A, Garguilo C, R M. Bladder function associated with posterior urethral valves after primary valve ablation or proximal urinary diversion in children and adolescents. J Urol 2002; 168: 1830–1835. DOI: 10.1097/00005392-200210020-00042.
- Henneberry MO, Stephens FD. Renal hypoplasia and dysplasia in infants with posterior urethral valves. J Urol 1980; 123: 912–915. DOI: 10.1016/s0022-5347(17)56190-x.
- Parkhouse HF, Barratt TM, Dillon MJ, al DPG. Long-term otcome of boys with posterior urethral valves. Br J Urol 1988; 62: 59–62. DOI: 10.1111/j.1464-410x.1988.tb04267.x.
- Kousidis G, Thomas DFM, Morgan H, N H. The long-term outcome of prenatally detected posterior urethral valves:10 to 23 year follow-up study. BJU Int 2008; 102: 1020–1024. DOI: 10.1111/j.1464-410x.2008.07745.x.
- Sarhan O, Zaccaria I, Macher M, F M. Long-term outcome of prenatally detected posterior urethral valves: a single centre study of 65 cases managed by primary valve ablation. J Urol 2008; 179 (1): 307–312. DOI: 10.1016/j.juro.2007.08.160.
- DeFoor W, Clark C, Jackson E, P R. Risk factors for end stage renal disease in children with posterior urethral valves. J Urol 2008; 180: 1705–1708. DOI: 10.1016/s0084-3954(09)79530-2.
- Heikkila J, Holmberg C, Kyllonen L, al RR. Long term risk of end stage renal disease in patients with posterior urethral valves. J Urol 2011; 186: 2392–2396. DOI: 10.1016/j.juro.2011.07.109.
- Celedon CG, Bitsori M, Tullus K. Progression of chronic renal failure in children with dysplastic kidneys. Pediatr Nephrol 2007; 22: 1014–1020. DOI: 10.1007/s00467-007-0459-5.
- P LP, MJ MU, L E, E J. Long-term consequences of posterior urethral valves. J Pediatr Urol 2013; Oct;9(5):590-6. DOI: 10.1016/j.jpurol.2013.06.007.
- Nguyen MT, Pavlock CL, Zderic SA, Carr MC, Canning DA. Overnight catheter drainage in children with poorly compliant bladders improves post-obstructive diuresis and urinary incontinence. J Urol 2005; 174 (1633). DOI: 10.1097/01.ju.0000179394.57859.9d.
- Abdelhalim A, El-Hefnawy AS, Dawaba ME, Bazeed MA, Hafez AT. Effect of Early Oxybutynin Treatment on Posterior Urethral Valve Outcomes in Infants: A Randomized Controlled Trial. J Urol 2020; Apr;203(4):826-831. DOI: 10.1097/ju.0000000000000691.
- Farhat W, McLorie G, Capolicchio G, A K. Outcomes of primary valve ablation versus upper tract diversion in patients with posterior urethral valves. Urology 2000; 56 (4): 653–657. DOI: 10.1016/s0090-4295(00)00784-6.
- Metcalfe PD, Wang J, Jiao H, Huang Y, Hori K, Moore RB. Bladder outlet obstruction: progression from inflammation to fibrosis. BJU Int 2010; 106 (1686). DOI: 10.1111/j.1464-410x.2010.09445.x.
- Johal N, Cao K, Arthurs C, Millar M, Thrasivoulou C, Ahmed A, et al.. Contractile function of detrusor smooth muscle from children with posterior urethral valves - The role of fibrosis. J Pediatr Urol 2021; 100 (e1-100.e10). DOI: 10.1016/j.jpurol.2020.11.001.
- Peters CA, Bolkier M, Bauer SB, WH H. The urodynamic consequences of posterior urethral valves. J Urol 1990; 144 (1): 122–126. DOI: 10.1016/s0022-5347(17)39388-6.
- Holmdahl G, Sillen U, Hanson E, G H. Bladder dysfunction in boys with posterior urethral valves before and after puberty. J Urol 1996; 155: 694–698. DOI: 10.1016/s0022-5347(01)66502-9.
- M G, G M, ML C, M S. Early detection of bladder dysfunction following posterior urethral valves ablation. Eur J Pediatr Surg 1996; 6: 163–165. DOI: 10.1055/s-2008-1066497.
- Misseri R, Combs AJ, Hrowitz DJM. Myogenic failure in posterior urethral valve disease: real or imagined? J Urol 2002; 168: 1844–1848. DOI: 10.1097/00005392-200210020-00045.
- Ghanem MA, Wolffenbuttel KP, Vylder A, Nijman RJM. Long-term bladder dysfunction and renal function in boys with posterior urethral valves based on urodynamic findings. J Urol 2004; 171: 2409–2412. DOI: 10.1097/01.ju.0000127762.95045.93.
- Abbo O, Bouali O, Ballouhey Q, Mouttalib S, Lemandat A. Decramer S, et al.\[Is there an outcome difference between posterior urethral valves diagnosed prenatally and postnatally at the time of antenatal screening?\. Prog Urol 2013; 23: 144–149.
- Marchal S, Kalfa N, Iborra F, Badet L, Karam G, Broudeur L, et al.. Long-term Outcome of Renal Transplantation in Patients with Congenital Lower Urinary Tract Malformations: A Multicenter Study. Transplantation 2020; Jan;104(1):165-171. DOI: 10.1097/tp.0000000000002746.
- Jesus LE, Pippi Salle JL. Pre-transplant management of valve bladder: a critical literature review. J Pediatr Urol 2015; Feb;11(1):5-11. DOI: 10.1016/j.jpurol.2014.12.001.
- Riley P, Marks SD, Desai D, I M. Challenges facing renal transplantation in pediatric patients with lower urinary tract dysfunction. Transplantation 2010; 89 (11): 1299–1307. DOI: 10.1097/tp.0b013e3181de5b8c.
- Woodhouse C, Reilly JM, Bahadur G. Sexual function and fertility in patients treated for posterior urethral valves. J Urol 1989; 142 (2 part 2): 586–588. DOI: 10.1016/s0022-5347(17)38824-9.
- P LP, M M, MJ MU, JA M. Long-term bladder function, fertility and sexual function in patients with posterior urethral valves treated in infancy. J Pediatr Urol 2011. DOI: 10.1016/j.jpurol.2011.11.006.
- Wong JC, Khondker A, Kim JK, Chua M, Keefe DT, Dos Santos J, et al.. Posterior Urethral Valves Outcomes Prediction (PUVOP): a machine learning tool to predict clinically relevant outcomes in boys with posterior urethral valves. Pediatr Nephrol 2021. DOI: 10.1007/s00467-021-05321-3.
Última actualización: 2025-09-21 13:35