17: Megauréter
Este capítulo durará aproximadamente 23 minutos para leer.
Introducción
Las anomalías congénitas de la unión ureterovesical (UUV) suelen presentarse con un uréter dilatado o ‘megauréter’ (Figura 1). Existen muchos sinónimos para esta afección, incluidos hidrouréter y megalouréter, pero todos representan un uréter con un diámetro mayor de lo normal con o sin dilatación asociada de la pelvis renal. Smith clasificó los megauréteres en cuatro categorías: obstructivo, refluente, refluente con obstrucción y no refluente/no obstructivo, posteriormente subdivididos en primarios y secundarios por King.1,2 La clasificación de Pfister-Hendren, establecida en 1978, se basó en el aspecto morfológico: el tipo I afectaba al uréter distal sin hidronefrosis asociada; el tipo II se extendía tanto al uréter como a la pelvis; y el tipo III se asociaba a hidroureteronefrosis grave y tortuosidad ureteral.3 Los megauréteres congénitos son el doble de frecuentes en varones y presentan una relación izquierda:derecha de 1.8:1.4 Dado que la anomalía de la UUV con reflujo se analiza en detalle en otra parte, el enfoque de este capítulo serán los megauréteres obstructivos y los no obstructivos sin reflujo.
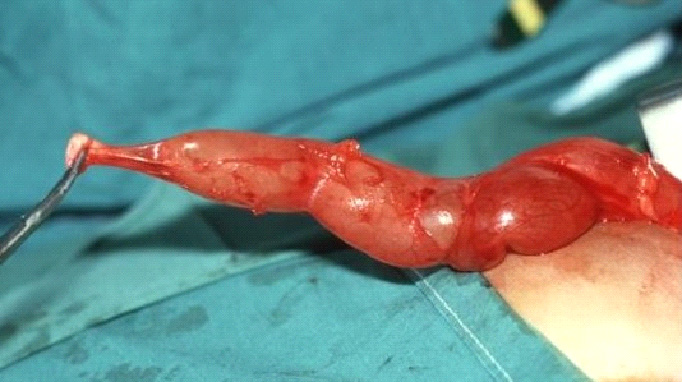
Figura 1 Vista intraoperatoria de megauréter (MU) y de segmento yuxtavesical estrechado, aperistáltico (AS).
La definición de un uréter dilatado no está bien establecida en la literatura. Cussen examinó uréteres de fetos de más de 20 semanas de gestación y de niños hasta los 12 años, y estableció dimensiones ureterales medias para fetos a las 30 semanas de gestación y para lactantes y niños a los 3 meses y a los 3, 6 y 12 años.5 El límite superior del intervalo del diámetro del tercio medio del uréter desde el nacimiento hasta los 12 años fue de 0,5–0,65 cm; por lo tanto, se consideró que el límite superior de la normalidad se aproximaba estrechamente a 0,7 cm. Hellstrom et al aportaron datos radiológicos del diámetro ureteral normal en 194 niños de 0 a 16 años, y también llegaron a la conclusión de que un diámetro ureteral superior a 7 mm era anormal en este grupo etario.6
Embriología y genética de la unión ureterovesical
Las anomalías de la UVJ forman parte de las anomalías congénitas del riñón y del tracto urinario (CAKUT). CAKUT incluye un espectro de anomalías que afectan el desarrollo del tracto urinario, incluyendo agenesia renal, displasia o hipoplasia; obstrucción ureteral proximal o distal (obstrucción de la unión ureteropélvica (UPJ) o de la UVJ); dilatación del uréter (megauréter); reflujo vesicoureteral (VUR) y obstrucción uretral (p. ej., debido a válvulas uretrales posteriores o atresia uretral).7 Desde el punto de vista embriológico, el riñón de los mamíferos deriva de dos componentes: la yema ureteral, un epitelio que se ramifica reiteradamente para formar los conductos colectores, y el mesénquima metanéfrico. La yema ureteral también da origen al epitelio de la pelvis renal y del uréter, conocido como urotelio.
Hasta la fecha, nuestro conocimiento del desarrollo ureteral normal se limita a trabajos en modelos animales, incluidos ratones transgénicos con fenotipos renales/ ureterales anormales. Estos estudios sugieren que varios genes, factores de transcripción, así como proteínas secretadas, contribuyen al desarrollo ureteral normal y que, cuando se alteran, se manifiestan en diversas formas de CAKUT.8 Un elemento clave en el desarrollo ureteral es el eje del factor neurotrófico derivado de la línea celular glial y de la proteína tirosina cinasa transmembrana c-ret (GDNF/c-ret).9 La brotación y ramificación del brote ureteral depende de la interacción entre GDNF y su correceptor 1 anclado a glucosilfosfatidilinositol (Gfrα1), que se unen a c-ret y lo activan. GDNF se expresa principalmente en el mesénquima metanéfrico, la cuña trigonal del uréter distal y el seno urogenital. En c-ret -/-mutantes, se observaron agenesia renal, hipodisplasia grave y uréteres ciegos; los mutantes GDNF -/- y Gfrα1 -/- también presentaron fenotipos similares, lo que sugiere que el eje GDNF-c-ret es necesario para la iniciación del brote ureteral y la morfogénesis temprana de la ramificación.
La expresión de C-ret depende del ácido retinoico (un metabolito de la vitamina A).9 Batourina et al demostraron que la vitamina A y el protooncogén Ret son necesarios para la formación de una conexión adecuada entre la vejiga y el uréter.10 Los ratones mutantes que carecían de Ret o de Rara y Rarb, dos miembros de la familia de los receptores de retinoides, presentaban hidronefrosis y megauréter, ambas asociadas a defectos en etapas tempranas de la maduración del uréter, cuando la remodelación del “conducto nefrítico común” (CND—nombre dado por Batourina et al a la parte del conducto mesonéfrico proximal al origen de la yema ureteral) induce a que los orificios ureterales se separen de los conductos mesonéfricos. Sus estudios sugirieron que la vitamina A y Ret eran necesarios para la expansión del CND en una estructura llamada la cuña, que propusieron como probable precursor del trígono.11,12
El momento de la diferenciación del músculo liso en el uréter distal es desconocido, pero puede ser clave para comprender por qué el VUR o la obstrucción mejoran posnatalmente. Pirker et al estudiaron especímenes de vejiga de fetos porcinos, lechones recién nacidos y de 6 meses de edad.13 Encontraron que a los 60 días, el músculo detrusor vesical estaba bien desarrollado e inervado, mientras que el uréter intra- y extravesical apenas había comenzado a diferenciarse. A los 90 días, el uréter extravesical estaba bien inervado, pero el uréter intravesical no maduró hasta después del nacimiento. Todos los componentes de músculo liso mostraron un llamativo aumento del espesor entre las secciones neonatales y las posteriores. La cronología del desarrollo muscular en este estudio se correlaciona con los hallazgos en humanos, en quienes los fascículos de músculo liso del uréter extramural aparecen por primera vez entre las semanas 17 y 22 de gestación, y el desarrollo del músculo ureteral progresa en dirección craneocaudal.14 Los autores también observaron que el desarrollo de la vaina periureteral precede al desarrollo del músculo liso ureteral, lo cual también se ha reportado en humanos. La vaina periureteral mostró un considerable desarrollo neuromuscular posnatal. Sus fibras musculares crecieron significativamente y casi formaban una capa continua a los 6 meses.13 Tanagho también observó que el uréter distal es la última porción en desarrollar su capa muscular, y que la diferenciación muscular precoz es principalmente de los músculos circulares. Otros estudios han sugerido posibles explicaciones para el desarrollo de la obstrucción de la UVJ.15 Estas incluyen una gruesa vaina muscular alrededor de la porción distal del uréter, un aumento de la deposición de fibras de colágeno y una neuromodulación desregulada en el segmento yuxtavesical de los megauréteres obstruidos.11,16,17
Diagnóstico prenatal
La dilatación ureteral se asocia con hidronefrosis prenatal en el 5–10% de los casos.18 Actualmente, cerca del 79% de los pacientes con hidroureteronefrosis se detectan en la ecografía perinatal (USS), y el resto se presenta tras una infección del tracto urinario febril (ITU).19 La detección de un uréter dilatado in útero por ecografía es una tarea difícil. El feto puede no estar en la orientación adecuada, o el uréter puede estar oculto por estructuras suprayacentes o por gas intestinal materno. Además, es posible que los técnicos no estén formados para buscar específicamente uréteres dilatados en el cribado rutinario. Como resultado, la detección prenatal de uréteres dilatados probablemente sea poco fiable. En un estudio de 101 pacientes con hidroureteronefrosis identificada posnatalmente remitidos al Great Ormond Street Hospital, solo el 20% tenía un uréter dilatado documentado prenatalmente. En 48 (47.5%) lactantes se encontró RVU u otra patología, y en 53 (52.5%) se sospechó una obstrucción de la UVJ.4
Manejo posnatal
Los pacientes con dilatación ureteral superior a 7 mm presentan un mayor riesgo de infección del tracto urinario (ITU), por lo que se recomienda la profilaxis antibiótica continua (CAP).20 Un estudio prospectivo multicéntrico reciente de 237 pacientes con dilatación ureteral concluyó que los pacientes con uréteres de 7 mm o más tenían casi tres veces el riesgo de ITU, tras ajustar por sexo, estado de circuncisión, profilaxis antibiótica y grado de hidronefrosis. El mayor riesgo también estuvo presente en pacientes investigados con una cistouretrografía miccional (VCUG) y en quienes no se encontró reflujo vesicoureteral (VUR). La CAP mostró un efecto protector significativo frente a la ITU.21
Se recomienda una ecografía posnatal (US) entre las 48 horas y las 4 semanas (consenso UTD), cuando la dilatación es unilateral (Figura 2).22 La hidroureteronefrosis bilateral debe investigarse con mayor urgencia, y debe excluirse una obstrucción de la salida vesical antes del alta posnatal. La presencia de un uréter(es) dilatado(s) es una indicación para una VCUG, con el fin de excluir una obstrucción uretral o VUR. La presencia de VUR confirma un megauréter “refluente”. Es importante asegurar el drenaje del tracto urinario superior tras el vaciado vesical en la MCUG. Un drenaje deficiente en la VCUG, especialmente cuando existe una dilatación significativa del tracto superior en la USS, puede generar la sospecha de un megauréter “refluente y obstructivo”.20
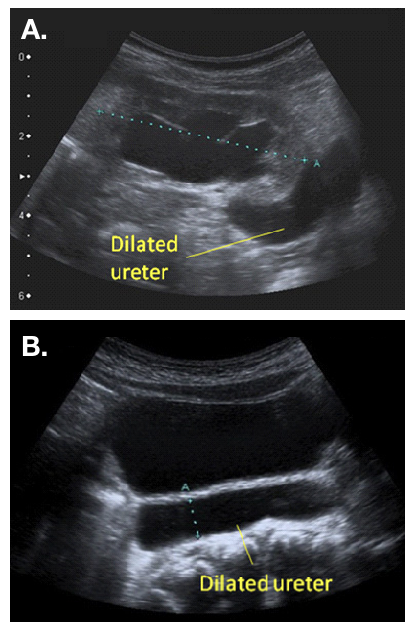
Figura 2 Aspecto ecográfico de un uréter dilatado, observado saliendo de una pelvis renal dilatada (a) y visible por detrás de la vejiga (b)
En ausencia de VUR u obstrucción uretral, se debe realizar un renograma dinámico, como la renografía diurética con 99mTc-MAG-3, y repetir la ecografía después de las 6 semanas de edad. Estas investigaciones ayudarán a diferenciar entre un megauréter “obstructivo” o “no obstructivo-no refluyente”. Los bebés que se presentan posnatalmente (p. ej., con una ITU) también se investigan de forma similar, aunque es mejor esperar la recuperación de la urosepsis antes de realizar una VCUG o un renograma con MAG-3.20
Según las guías de la Asociación Europea de Medicina Nuclear (EANM) para la renografía estándar y diurética en niños, la renografía permite estimar dos aspectos de la función renal.23 El primero es el aclaramiento renal, o función renal diferencial (DRF). La estimación de la DRF se realiza mejor entre uno y dos minutos tras la inyección del trazador. El segundo aspecto es la excreción, o desaparición, del trazador desde el riñón. Tradicionalmente, se sugiere un retraso importante en la excreción por una curva continuamente ascendente y un tránsito demorado, es decir, un Tmax (tiempo para alcanzar el máximo, o pico, de la curva) superior a 20 minutos (Figura 3). Sin embargo, el tránsito demorado puede deberse al aumento de la capacidad que confiere una pelvis renal y un uréter dilatados. Por ello, se administra furosemida para distinguir entre obstrucción y el efecto de un sistema dilatado. Un drenaje deficiente también puede ser evidente porque la vejiga está llena, o porque el efecto de la gravedad sobre el drenaje es incompleto. Por todas estas razones, la interpretación de “drenaje deteriorado” en la renografía diurética es controvertida.24
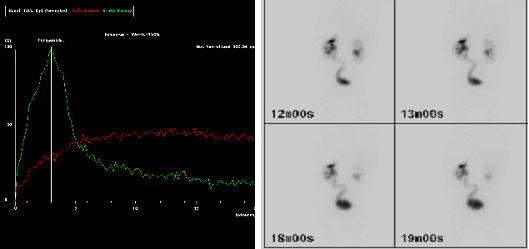
Figura 3 Imágenes MAG-3 que muestran drenaje tardío del trazador (curva roja) a los 20 minutos (a) y uréter izquierdo (L) visible en la imagen tardía (b), lo que sugiere una retención en la UVJ izquierda.
Debe tenerse en cuenta una combinación de hallazgos clínicos y radiológicos al clasificar un megauréter como “obstructivo” o “no obstructivo”. La presencia de síntomas, como ITU febril o dolor, constituye un indicador clínico de posible obstrucción. En el paciente asintomático, la presencia de un DRF por debajo del 40% y/o una dilatación en aumento en ecografías seriadas también sugiere obstrucción y constituye indicación de intervención. Un tránsito demorado en MAG-3 en presencia de una dilatación estable o en mejoría, y un DRF por encima del 40%, en un paciente asintomático, puede manejarse de forma conservadora.20 Liu et al y McLellan et al sugirieron que los niños con un diámetro ureteral retrovesical mayor de 10 mm tenían más probabilidades de requerir intervención quirúrgica.4,25
Es importante tener en cuenta que las obstrucciones ipsilaterales de la UPJ y de la UVJ pueden coexistir. La MAG-3 preoperatoria puede sugerir patología dual cuando el uréter obstruido se llena lentamente y luego no drena. En este escenario, una pielografía retrógrada puede ser útil para establecer el diagnóstico.26
Manejo
El manejo de los megauréteres primarios ha cambiado durante los últimos 30 años. En 1989, Peters et al informaron que el 89% de los pacientes requirieron cirugía antes de los 8 meses de edad.27 Ese mismo año, Keating et al informaron que, cuando la decisión de intervenir se basaba en la función renal absoluta, hasta el 87% de los pacientes podían ser seguidos de forma conservadora.28 Otra publicación de la misma unidad confirmó la estabilidad o la mejoría en el seguimiento a largo plazo del mismo grupo de pacientes que fueron manejados de forma conservadora.29 Liu et al también sugirieron que la mayoría de los megauréteres podrían ser seguidos de forma conservadora, y mostraron que, con un seguimiento medio de 3.1 años, el 34% de los megauréteres primarios se resolvieron espontáneamente. De los casos restantes, el 17% fueron reimplantados debido a infección de escape o deterioro de la función renal, mientras que el 49% presentaron dilatación persistente en el seguimiento y seguían en seguimiento conservador.4
Megauréteres no obstructivos no refluyentes
Los megauréteres asociados con una DRF >40% en un paciente asintomático pueden manejarse de forma conservadora. Se recomiendan un seguimiento estrecho con ecografías seriadas y profilaxis antibiótica, especialmente cuando la dilatación ureteral es mayor de 7mm21 Song et al demostraron que el riesgo de ITU es mayor con la obstrucción de la UVJ que con la de la UPJ, y que las ITU tienden a ocurrir dentro de los primeros seis meses de vida.30 Una vez que se observe que la hidronefrosis está mejorando, las citas de seguimiento pueden reducirse a cada seis meses y luego a anuales, y se puede suspender la profilaxis antibiótica. La resolución de la hidroureteronefrosis puede tardar varios años. McLellan et al demostraron que la hidronefrosis se había resuelto por completo en el 72% de los casos, con una mediana de seguimiento de 25.8 meses.25
Se aconseja un seguimiento a largo plazo cuando la dilatación persiste. Un estudio de seguimiento a largo plazo de Shukla et al informó un deterioro tardío en un niño de 14 años con megauréteres primarios bilaterales, que presentó un aumento de la dilatación y deterioro funcional seis años después de haber sido dado de alta del seguimiento conservador.31 Hemal et al. 30 informaron los resultados de 55 pacientes con megauréteres congénitos que se presentaron por primera vez en la tercera década de la vida, de los cuales en 20 se encontraron cálculos renales. Cinco pacientes con megauréteres bilaterales presentaban insuficiencia renal crónica al diagnóstico, de los cuales dos finalmente fallecieron a causa de la enfermedad.32 Por lo tanto, la resolución temprana tras el manejo conservador no es una garantía de por vida, y se aconseja el seguimiento hasta la edad adulta.
Megauréteres obstructivos
La obstrucción se diagnostica en función de una DRF reducida <40% al diagnóstico, o de un descenso de la DRF >10% en renografías repetidas a intervalos. El aumento de la dilatación en ecografía, y los síntomas (ITU/dolor) también son sugestivos de obstrucción. La elección de la intervención quirúrgica depende de la edad del niño (menor o mayor de 1 año), y de la disponibilidad de equipo y experiencia cuando se considera una opción endoscópica. Las opciones quirúrgicas incluyen:
- Reimplantación ureteral (abierta/ laparoscópica o asistida por robot)
- Colocación temporal de catéter doble J
- Dilatación endoscópica con balón ± endoureterotomía
- Ureterocistotomía con reflujo
- Ureterostomía cutánea
Reimplante ureteral
El objetivo del reimplante ureteral es extirpar el segmento estrecho y aperistáltico de la unión ureterovesical (UVJ) y tunelizar el uréter en la vejiga de manera antirreflujo. El túnel debe medir al menos cinco veces el diámetro ureteral para ser eficaz, datos basados en un estudio de Paquin en 1959.33 Para alcanzar esta relación cuando el diámetro ureteral es superior a 10 mm, puede ser necesario estrechar los 10 cm distales del uréter. También puede requerirse una fijación al psoas (psoas hitch) para asegurar una entrada rectilínea del uréter en la vejiga. Las dos técnicas más populares utilizadas para la conformación del megauréter son la plicatura descrita por Starr y Kalicinski et al., y el estrechamiento según la modificación de Hendren.34,35,36 Kalicinski et al describieron una técnica de plegado mediante la cual la porción lateral, avascular, del uréter se excluía de la luz con una sutura continua longitudinal, y luego se plegaba hacia posterior antes del reimplante. Starr modificó este procedimiento introduciendo numerosas suturas de Lembert interrumpidas que invaginaban la pared ureteral, preservando así su irrigación, pero haciendo más engorrosa la reimplantación posterior. Hendren aconsejó un estrechamiento por resección, en el que se extirpa una franja longitudinal del uréter redundante y el uréter se sutura en dos planos.35,36 Ben-Meir et al compararon los resultados del reimplante de megauréter con y sin conformación, y mostraron que no hubo diferencias significativas en el desenlace (tasa de éxito del 94% en el grupo con conformación y del 96% en el grupo sin conformación).37 Se proporciona un ejemplo de reimplante con estrechamiento en (Figura 4 y Figura 5).
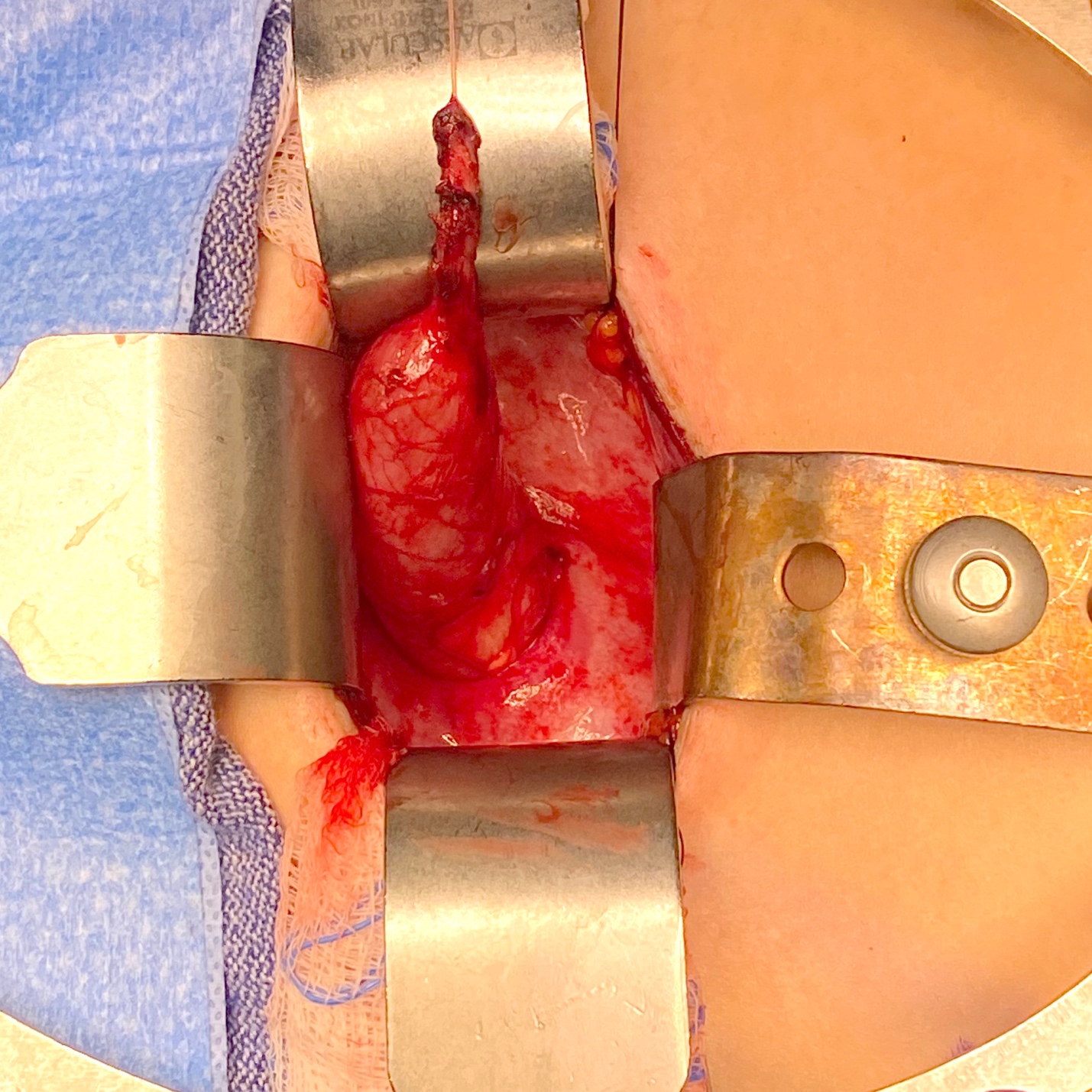
Figura 4 Vista intraoperatoria de un megauréter con segmento aperistáltico y dilatación proximal.
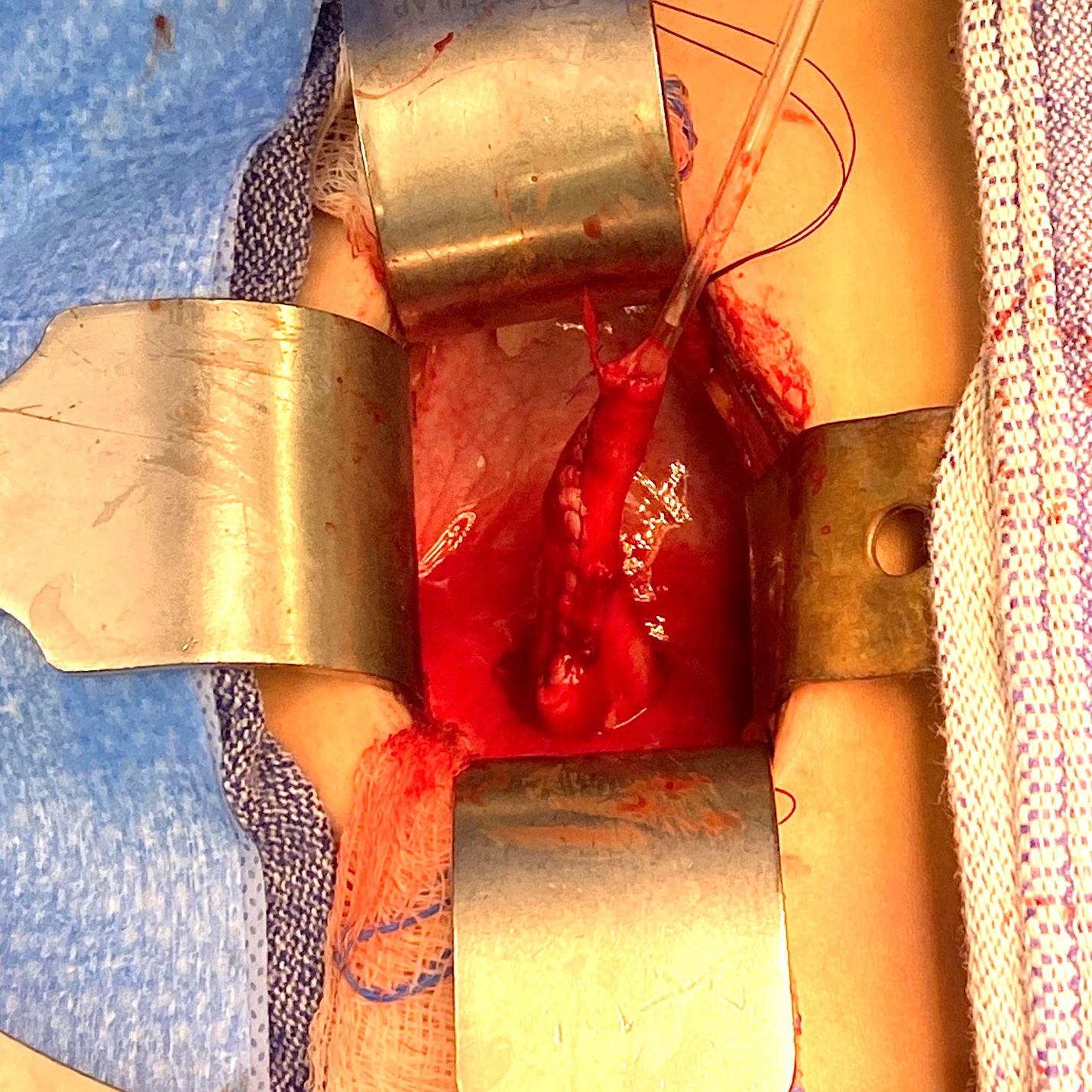
Figura 5 Vista intraoperatoria del mismo uréter de la Figura 4 tras estrecharlo sobre un catéter de 10 Fr. Posteriormente, fue reimplantado mediante la creación de un túnel transtrigonal, pasándolo a través del túnel y fijándolo. Se dejó un stent ureteral en su lugar durante 2 semanas.
Un reimplante extravesical de Lich–Gregoir se prefiere comúnmente cuando se utilizan técnicas laparoscópicas o asistidas por robot (RALUR).38,39,40 El uréter dilatado se identifica por debajo de los vasos ilíacos, y se diseca el peritoneo a lo largo del uréter hasta el nivel del cruce con el conducto deferente. El uréter se moviliza con disección roma para minimizar el riesgo de lesiones nerviosas y de la irrigación sanguínea, y luego se secciona al nivel de la estenosis. El túnel seromuscular se delimita utilizando electrocauterio en gancho y luego las fibras del detrusor se dividen de forma aguda con tijeras hasta que la mucosa vesical protruye libremente. La mucosa vesical se abre al final del túnel y la anastomosis ureterovesical se realiza con suturas interrumpidas. Luego, el uréter se introduce en el túnel, el cual se aproxima con suturas continuas o interrumpidas.
Las tasas de resolución del RVU tras la RALUR extravesical comunicadas en la literatura oscilan entre el 66,7% y el 100% en múltiples series relativamente pequeñas.40 El éxito global al combinar estas series es del 91%. Un estudio retrospectivo multiinstitucional informó resolución radiográfica en el 87,9% de 280 uréteres. Más recientemente, un gran estudio prospectivo multiinstitucional comunicó un 93,8% de resolución en 199 uréteres.40 La RALUR puede realizarse de forma bilateral; sin embargo, existe la preocupación de que la disección bilateral de la pared posterior de la vejiga pueda alterar el plexo nervioso pélvico, dando lugar a tasas más altas de retención urinaria posoperatoria. Se ha propuesto una disección con preservación nerviosa para reducir esta complicación. En 2008, Casale et al comunicaron una tasa de éxito del 97,6% tras RALUR bilateral con preservación nerviosa en 41 pacientes.41 No hubo complicaciones ni casos de retención urinaria. Herz et al informaron una tasa de éxito del 91,7% para la RALUR unilateral, pero solo del 77,8% de los uréteres (72,2% de los niños) en los casos bilaterales. En este estudio, las tasas de complicaciones (incluida la obstrucción ureteral, el reingreso y la retención urinaria) fueron más altas en los casos bilaterales. No se utilizó una técnica de preservación nerviosa.42
La reimplantación ureteral en lactantes menores de un año puede ser un desafío debido a la discrepancia entre el uréter marcadamente dilatado y la pequeña vejiga infantil, y la preocupación por una posible disfunción vesical iatrogénica. De Jong et al investigaron el resultado funcional vesical de 49 recién nacidos y lactantes con megauréteres primarios obstructivos o refluentes, que fueron sometidos a un procedimiento de Politano-Leadbetter, con un seguimiento medio de 7.3 años.43 No se observó aparición de disfunción miccional en el seguimiento, y la capacidad vesical para la edad estaba significativamente aumentada. No se observó obstrucción ureteral posoperatoria. El autor concluyó que las reconstrucciones mayores precoces del tracto urinario inferior no dañan las propiedades urodinámicas de la vejiga y del suelo pélvico, siempre que la cirugía sea realizada por urólogos pediátricos especializados. Otro estudio del mismo grupo 41 comparó los resultados urodinámicos en pacientes sometidos a reimplantación ureteral antes o después del año de edad. No se encontró diferencia significativa en la capacidad vesical, la distensibilidad o la incidencia de inestabilidad.44
Colocación temporal de catéter doble J
En 1999, Shenoy y Rance informaron sobre el uso de catéteres doble J como medida temporal en lactantes con megauréteres obstructivos primarios.45 El procedimiento consiste en la inserción de un catéter doble J, endoscópicamente cuando sea posible. Una obstrucción marcada del UVJ puede impedir la inserción endoscópica, en cuyo caso puede realizarse una inserción abierta mediante cistostomía combinada con la dilatación del orificio ureteral utilizando una sonda lagrimal. Los catéteres están autorizados para permanecer in situ durante seis meses, tras lo cual deben retirarse o reemplazarse. El megauréter debe permanecer con catéter hasta que el bebé tenga más de un año de edad, momento en el cual puede realizarse con seguridad una reimplantación ureteral si la dilatación no se ha resuelto.45 El bebé debe permanecer con antibióticos profilácticos mientras el catéter esté in situ, debido al riesgo de infección del catéter, y debe ser monitorizado mediante ecografía para asegurar la descompresión del sistema y comprobar la posición del catéter.46 Una ecografía y una renografía con MAG-3 realizadas tres meses después de la retirada del catéter orientarán el manejo ulterior. Si hay mejoría de la dilatación y del drenaje y la función está preservada, puede no requerirse más intervención. La dilatación persistente o en empeoramiento tras un periodo con catéter, o nueva infección, es una indicación de reimplantación ureteral. Un estudio de resultados a largo plazo reveló que en el 56% de los casos no se requirió ninguna intervención adicional tras la retirada del catéter. Sin embargo, dos tercios de los pacientes requirieron inserción abierta del catéter y un tercio presentó complicaciones (migración, formación de cálculos e infección).47
Dilatación endoscópica con balón
El manejo endoscópico ha sido aceptado como una opción de tratamiento menos invasiva. Las ventajas del abordaje endoscópico incluyen un enfoque mínimamente invasivo, ausencia de manipulación de la vascularización distal del uréter y la no necesidad de cateterización prolongada.48 Además, si el manejo endoscópico falla, aún puede realizarse la reimplantación ureteral. Sin embargo, la posible necesidad de un segundo acto anestésico para la retirada del stent debe considerarse en las discusiones sobre los riesgos del abordaje endoscópico. El procedimiento se realiza utilizando un cistoscopio rígido pediátrico (8F–10.5F) y se coloca una guía flexible hasta la pelvis renal. Para la dilatación con balón de alta presión (HPBD), se utiliza un catéter con balón (usualmente 3F–5F, longitud del balón de 2–4 cm, diámetro del balón inflado de 3–7 mm) para dilatar la unión ureterovesical, seguida de la colocación de un stent ureteral doble J. Para la ureterotomía incisional, tanto Kajbafzadeh et al como Shirazi y et al realizan incisiones en la posición de las 6 en punto.49,50,51
Doudt et al publicaron una revisión sistemática de los resultados a largo plazo del manejo endoscópico.48 Se analizaron once series de casos retrospectivas y 1 prospectiva, de una sola institución. La edad media en el momento de la cirugía fue de 24,6 meses (intervalo 3–84). Los intentos iniciales de manejo endoscópico no fueron efectivos en el 10,5%, ya fuera por incapacidad para pasar el catéter de forma endoscópica o por dificultad con el avance del cistoscopio pediátrico a través de la uretra. Los abordajes endoscópicos completados de forma efectiva fueron cistoscopia+dilatación con balón de alta presión (HPBD)+ colocación de catéter ureteral doble J en el 49,5%, cistoscopia+ureterotomía incisional+colocación de catéter ureteral doble J en el 27,8%, cistoscopia+colocación de catéter ureteral doble J en el 18,9% y cistoscopia+HPBD+ ureterotomía incisional+colocación de catéter ureteral doble J en el 3,7%. La duración media del catéter fue de 2,3 meses (intervalo 0,25–6). Con un seguimiento medio de 3,2 años, la tasa de éxito inicial fue del 76,7%. Se realizó retratamiento endoscópico en el 15,1% de los casos, con una tasa global de reintervención quirúrgica del 36,7%. Los autores concluyeron que el manejo endoscópico para POM persistente o progresiva en niños >12 meses de edad es una alternativa mínimamente invasiva al reimplante ureteral, con tasas de éxito modestas. En lactantes, puede ser mejor utilizarlo como procedimiento temporal. Aproximadamente un tercio de los pacientes requieren reintervención quirúrgica.48
Reimplante ureteral refluente
Kaefer propuso un enfoque novedoso para el manejo de los megauréteres obstructivos en lactantes, realizado en dos tiempos.52 La primera etapa resuelve la obstrucción sin la preocupación de crear un mecanismo antirreflujo, simplemente seccionando el uréter proximal a la obstrucción y realizando una anastomosis término-lateral refluente a la vejiga; luego, a medida que el tamaño de la vejiga aumenta durante la lactancia, se realiza el segundo tiempo, un reimplante ureteral estándar con adelgazamiento del uréter y creación de un mecanismo valvular antirreflujo.52,53 Alyami et al publicaron su experiencia con el enfoque del reimplante refluente en 32 pacientes con obstrucción ureteral distal diagnosticada prenatalmente.54 La edad media al momento de la cirugía fue de 3.7 meses (rango de 0 a 33) y el seguimiento medio fue de 34.3 meses (rango de 6 a 58). En la mayoría de los varones también se realizó una circuncisión. De 32 pacientes, el 86% mostró una mejoría significativa de la dilatación. Seis pacientes se sometieron a procedimientos adicionales, incluyendo una circuncisión y 2 reimplantes ureterales por infecciones recurrentes. Los autores concluyeron que, a pesar de la contrapartida de aliviar la obstrucción creando reflujo, este procedimiento puede considerarse una intervención potencialmente definitiva en los pacientes que permanecen libres de infecciones. El seguimiento estrecho es fundamental para documentar resultados satisfactorios a largo plazo.54
Ureterostomía cutánea
Una ureterostomía cutánea temporal sigue siendo una opción segura y eficaz, especialmente en presencia de urosepsis o cuando la tecnología endoscópica no está disponible. Shrestha et al publicaron los resultados de 25 pacientes sometidos a una ureterostomía cutánea terminal (ECU) POM a una edad media de 7 meses (intervalo de 23 días a 2,5 años). Tras la derivación, la insuficiencia renal se había resuelto en todos, y uno presentó una infección urinaria febril (ITU) mientras esperaba la reimplantación.55 En este estudio no se notificaron complicaciones del estoma, aunque otros han comunicado complicaciones, incluidas la estenosis del estoma y la pielonefritis.56
Conclusión
Las anomalías de la unión ureterovesical (UUV), asociadas a un megauréter, pueden ser obstructivas, refluentes, no obstructivas y no refluentes, o bien simultáneamente refluentes y obstructivas. Solo el 10-20% de los megauréteres requieren intervención, mientras que el resto puede vigilarse de forma conservadora. Las opciones quirúrgicas incluyen el reimplante ureteral, con o sin modelado ureteral, procedimientos endoscópicos, ureteroneocistostomía refluente o una ureterostomía cutánea. La dilatación persistente en megauréteres no obstructivos y no refluentes está justificada debido al riesgo a largo plazo de formación de cálculos.
Puntos clave
- Tenga en cuenta el megauréter refluente y obstructivo, poco frecuente: tome nota del drenaje del tracto superior tras el vaciamiento vesical cuando se diagnostica VUR de alto grado en la VCUG. En presencia de un drenaje deficiente asociado con dilatación significativa del tracto superior, está indicado un renograma diurético con MAG-3. El reimplante ureteral es la mejor opción en esta situación.
- Las obstrucciones de la UVJ y la UPJ pueden coexistir. Busque discrepancias en la dilatación de la pelvis renal y del uréter, especialmente cuando una parece mejorar mientras la otra no. Inspeccione las imágenes del renograma con MAG-3 para evaluar el drenaje en ambas uniones. Cuando exista sospecha, una pielografía retrógrada puede ayudar al diagnóstico. Una estrategia quirúrgica podría ser una pieloplastia con colocación de un stent doble J en primera instancia; seguida de estudios de imagen adicionales tras la retirada del stent.
- Cuando se opta por el manejo conservador del megauréter no obstructivo y no refluente, la literatura actual recomienda profilaxis antibiótica para dilatación ureteral superior a 7mm; el mayor riesgo de ITU se presenta en el primer año de vida.
- Se recomienda seguimiento a largo plazo en los casos en que la dilatación ureteral no se resuelve en la infancia, debido al riesgo a largo plazo de formación de cálculos o deterioro de la función renal en los casos bilaterales.
Referencias
- Ferenci P, Lockwood A, Mullen K, Tarter R, Weissenborn K, Blei AT. Hepatic encephalopathy-Definition, nomenclature, diagnosis, and quantification: Final report of the Working Party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology 1977; 35 (3): 716–721. DOI: 10.1053/jhep.2002.31250.
- King LR. Megaloureter: Definition, Diagnosis and Management. J Urol 1980; 123 (2): 222–223. DOI: 10.1016/s0022-5347(17)55867-x.
- Pfister RC, Hendren WH. Primary megaureter in children and adults Clinical and pathophysiologic features of 150 ureters. Urology 1978; 12 (2): 160–176. DOI: 10.1016/0090-4295(78)90327-8.
- Liu HYA, Dhillon HK, Yeung CK, Diamond DA, Duffy PG, Ransley PG. Clinical Outcome and Management of Prenatally Diagnosed Primary Megaureters. J Urol 1994; 152 (2 Part 2): 614–617. DOI: 10.1016/s0022-5347(17)32664-2.
- Cussen LJ. Normal Position of the Ureteral Orifice in Infancy and Childhood: A Quantitative Study. J Urol 1967; 121 (5): 646–647. DOI: 10.1016/s0022-5347(17)56920-7.
- Hellström M, Hjälmås K, Jacobsson B, Jodal U, Odén A. Normal Ureteral Diameter in Infancy and Childhood. Acta Radiol Diagn (Stockh) 1985; 26 (4): 433–439. DOI: 10.1177/028418518502600412.
- Stahl DA, Koul HK, Chacko JK, Mingin GC. Congenital anomalies of the kidney and urinary tract (CAKUT): A current review of cell signaling processes in ureteral development. J Pediatr Urol 2006; 2 (1): 2–9. DOI: 10.1016/j.jpurol.2005.04.006.
- Woolf AS. A molecular and genetic view of human renal and urinary tract malformations. Kidney Int 2000; 58 (2): 500–512. DOI: 10.1046/j.1523-1755.2000.00196.x.
- Takahashi M. The GDNF/RET signaling pathway and human diseases. Cytokine Growth Factor Rev 2001; 12 (4): 361–373. DOI: 10.1016/s1359-6101(01)00012-0.
- Batourina E, Choi C, Paragas N, Bello N, Hensle T, Costantini FD. Faculty Opinions recommendation of Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2002; 32. DOI: 10.3410/f.1009006.124259.
- Viana R, Batourina E, Huang H, Dressler GR, Kobayashi A, Behringer RR, et al.. The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134 (20): 3763–3769. DOI: 10.1242/dev.011270.
- Batourina E, Tsai S, Lambert S, Sprenkle P, Viana R, Dutta S. Faculty Opinions recommendation of Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2005; 37. DOI: 10.3410/f.1029077.343528.
- Pirker ME, Rolle U, Shinkai T, Shinkai M, Puri P. Prenatal and Postnatal Neuromuscular Development of the Ureterovesical Junction. J Urol 2007; 177 (4): 1546–1551. DOI: 10.1016/j.juro.2006.11.081.
- Matsuno T, Tokunaka S, Koyanagi T. Muscular Development in the Urinary Tract. J Urol 1984; 132 (1): 148–152. DOI: 10.1016/s0022-5347(17)49508-5.
- Tanagho EA, Meyers FH, Smith DR. The Trigone: Anatomical and Physiological Considerations. 1. In Relation to the Ureterovesical Junction. J Urol 1968; 100 (5): 623–632. DOI: 10.1016/s0022-5347(17)62584-9.
- Tanagho EA. Intrauterine Fetal Ureteral Obstruction. J Urol 1973; 109 (2): 196–203. DOI: 10.1016/s0022-5347(17)60388-4.
- Lee BR, Silver RI, Partin AW, Epstein JI, Gearhart JP. A Quantitative Histologic Analysis of Collagen Subtypes: The Primary Obstructed and Refluxing Megaureter of Childhood. Urology 1998; 51 (5): 820–823. DOI: 10.1016/s0090-4295(98)00013-2.
- Nguyen HT, Herndon CDA, Cooper C, Gatti J, Kirsch A, Kokorowski P. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. Yearbook of Urology 2010; 2010: 209. DOI: 10.1016/s0084-4071(10)79537-3.
- Rubenwolf P, Herrmann-Nuber J, Schreckenberger M, Stein R, Beetz R. Primary non-refluxive megaureter in children: single-center experience and follow-up of 212 patients. Int Urol Nephrol 2016; 48 (11): 1743–1749. DOI: 10.1007/s11255-016-1384-y.
- Farrugia M-K, Hitchcock R, Radford A, Burki T, Robb A, Murphy F. British Association of Paediatric Urologists consensus statement on the management of the primary obstructive megaureter. J Pediatr Urol 2014; 10 (1): 26–33. DOI: 10.1016/j.jpurol.2013.09.018.
- Holzman SA, Braga LH, Zee RS, Herndon CDA, Davis-Dao CA, Kern NG. Correspondence to the article ‘risk of urinary tract infection in patients with hydroureter: an analysis from the society of fetal urology prenatal hydronephrosis registry.’ J Pediatr Urol 2021; 18 (5): 722–723. DOI: 10.1016/j.jpurol.2022.07.031.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 10: 982–998. DOI: 10.3410/f.725257762.793506733.
- Gordon I, Piepsz A, Sixt R. Guidelines for standard and diuretic renogram in children. Eur J Nucl Med Mol Imaging 2011; 38 (6): 1175–1188. DOI: 10.1007/s00259-011-1811-3.
- Gordon I. Diuretic renography in infants with prenatal unilateral hydronephrosis: an explanation for the controversy about poor drainage. BJU Int 2001; 87 (6): 551–555. DOI: 10.1046/j.1464-410x.2001.00081.x.
- McLELLAN DAWNL, RETIK ALANB, BAUER STUARTB, DIAMOND DAVIDA, ATALA ANTHONY, MANDELL JAMES, et al.. Rate and Predictors of Spontaneous Resolution of Prenatally Diagnosed Primary Nonrefluxing Megaureter. J Urol 2002: 2177–2180. DOI: 10.1097/00005392-200211000-00091.
- CAY ALI, IMAMOGLU MUSTAFA, BAHAT ELIF, SARIHAN HALUK. Diagnostic difficulties in children with coexisting pelvi-ureteric and vesico-ureteric junction obstruction. BJU Int 2006; 98 (1): 177–182. DOI: 10.1111/j.1464-410x.2006.06187.x.
- Peters CA, Mandell J, Lebowitz RL, Colodny AH, Bauer SB, Hendren WH. Congenital obstructed megaureters in early infancy: Diagnosis and treatment. J Pediatr Surg 1989; 25 (5): 576. DOI: 10.1016/0022-3468(90)90639-q.
- Keating MA, Escala J, Snyder HMC, Heyman S, Duckett JW. Changing Concepts in Management of Primary Obstructive Megaureter. J Urol 1989; 142 (2 Part 2): 636–640. DOI: 10.1016/s0022-5347(17)38841-9.
- Baskin LS, Zderic SA, Snyder HM, Duckett JW. Primary Dilated Megaureter: Long-Term Followup. J Urol 1994; 152 (2 Part 2): 618–621. DOI: 10.1016/s0022-5347(17)32665-4.
- Song S-H, Lee S-B, Park YS, Kim KS. Is Antibiotic Prophylaxis Necessary in Infants With Obstructive Hydronephrosis? J Urol 2007; 177 (3): 1098–1101. DOI: 10.1016/j.juro.2006.11.002.
- SHUKLA ASEEMR, COOPER JEFFREY, PATEL RAKESHP, CARR MICHAELC, CANNING DOUGLASA, ZDERIC STEPHENA, et al.. Prenatally Detected Primary Megaureter: A Role For Extended Followup. J Urol 2005; 173 (4): 1353–1356. DOI: 10.1097/01.ju.0000152319.72909.52.
- Hemal AK, Ansari MS, Doddamani D, Gupta NP. Symptomatic and complicated adult and adolescent primary obstructive megaureter–indications for surgery: analysis, outcome, and follow-up. Urology 2003; 61 (4): 703–707. DOI: 10.1016/s0090-4295(02)02590-6.
- Paquin AJ. Ureterovesical Anastomosis: the Description and Evaluation of a Technique. J Urol 1959; 82 (5): 573–583. DOI: 10.1016/s0022-5347(17)65934-2.
- Villanueva CA. Extracorporeal ureteral tailoring during HIDES laparoscopic robotic-assisted ureteral reimplantation for megaureter. J Pediatr Urol 1979; 11 (6): 362–363. DOI: 10.1016/j.jpurol.2015.08.006.
- Kaliciński ZH, Kansy J, Kotarbińska B, Joszt WLELA. Surgery of megaureters–Modification of Hendren’s operation. J Pediatr Surg 1977; 12 (2): 183–188. DOI: 10.1016/s0022-3468(77)80005-5.
- Hendren WH. Operative Repair of Megaureter in Children. J Urol 1969; 101 (4): 491–507. DOI: 10.1016/s0022-5347(17)62370-x.
- Ben-Meir D, McMullin N, Kimber C, Gibikote S, Kongola K, Hutson JM. Reimplantation of obstructive megaureters with and without tailoring. J Pediatr Urol 2006; 2 (3): 178–181. DOI: 10.1016/j.jpurol.2005.05.010.
- Stanasel I, Atala A, Hemal A. Robotic Assisted Ureteral Reimplantation: Current Status. Curr Urol Rep 2013; 14 (1): 32–36. DOI: 10.1007/s11934-012-0298-1.
- LEE S, AKBAL C, KAEFER M, Chertin B, Pollack A, Koulikov D. Laparoscopic Ureteral Reimplantation With Extracorporeal Tailoring for Megaureter: A Simple Technical Nuance. J Urol 2006; 176 (6): 2640–2642. DOI: 10.1016/j.juro.2006.08.025.
- Bilgutay AN, Kirsch AJ. Robotic Ureteral Reconstruction in the Pediatric Population. Front Pediatr 2019; 7. DOI: 10.3389/fped.2019.00085.
- Casale P, Patel RP, Kolon TF. Nerve Sparing Robotic Extravesical Ureteral Reimplantation. J Urol 2008; 179 (5): 1987–1990. DOI: 10.1016/j.juro.2008.01.062.
- Herz D, Fuchs M, Todd A, McLeod D, Smith J. Robot-assisted laparoscopic extravesical ureteral reimplant: A critical look at surgical outcomes. J Pediatr Urol 2016; 12 (6): 402.e1–402.e9. DOI: 10.1016/j.jpurol.2016.05.042.
- Nelson CP. Obstructing congenital anomalies of the urinary tract: ureteropelvic junction obstruction, ureterocele, megaureter, and posterior urethral valves. The Brady Urology Manual 1997; 65: 207–220. DOI: 10.1201/9780429194993-21.
- KORT LAETITIAMO de, KLIJN AARTJ, UITERWAAL CUNOSPM, JONG TOMPVM de. Ureteral Reimplantation In Infants And Children: J Urol 2002; 167: 285–287. DOI: 10.1097/00005392-200201000-00084.
- Shenoy, Rance. Is there a place for the insertion of a JJ stent as a temporizing procedure for symptomatic partial congenital vesico-ureteric junction obstruction in infancy? BJU Int 1999; 84 (4): 524–525. DOI: 10.1046/j.1464-410x.1999.00256.x.
- Farrugia M-K, Steinbrecher HA, Malone PS. The utilization of stents in the management of primary obstructive megaureters requiring intervention before 1 year of age. J Pediatr Urol 2011; 7 (2): 198–202. DOI: 10.1016/j.jpurol.2010.04.015.
- Farrugia MK, Steinbrecher HA, Malone PS. Re: The Utilization of Stents in the Management of Primary Obstructive Megaureters Requiring Intervention Before 1 Year of Age. J Urol 2011; 186 (5): 2063–2063. DOI: 10.1016/j.juro.2011.07.142.
- Doudt AD, Pusateri CR, Christman MS. Endoscopic Management of Primary Obstructive Megaureter: A Systematic Review. J Endourol 2018; 32 (6): 482–487. DOI: 10.1089/end.2017.0434.
- Kajbafzadeh A-M, Payabvash S, Salmasi AH, Arshadi H, Hashemi S-M, Arabian S, et al.. Endoureterotomy for Treatment of Primary Obstructive Megaureter in Children. J Endourol 2007; 21 (7): 743–749. DOI: 10.1089/end.2006.0330.
- Tourchi A, Kajbafzadeh AM, Mazaheri T, Raad M. Endoscopic Management of Obstructive Refluxing Megaureter: a Novel Approach. J Pediatr Urol 2010; 6: S62. DOI: 10.1016/j.jpurol.2010.02.110.
- Shirazi M, Natami M, Hekmati P, Farsiani M. Result of Endoureterotomy in the Management of Primary Obstructive Megaureter in the First Year of Life: Preliminary Report. J Endourol 2014; 28 (1): 79–83. DOI: 10.1089/end.2013.0098.
- LEE SANGDON, AKBAL CEM, KAEFER MARTIN. Refluxing Ureteral Reimplant As Temporary Treatment Of Obstructive Megaureter In Neonate And Infant. J Urol 2005; 173 (4): 1357–1360. DOI: 10.1097/01.ju.0000152317.72166.df.
- Kaefer M, Misseri R, Frank E, Rhee A, Lee D. Re: Refluxing Ureteral Reimplantation: A Logical Method for Managing Neonatal UVJ Obstruction. J Urol 2014; 194 (2): 518–518. DOI: 10.1016/j.juro.2015.05.043.
- Alyami FA, Koyle MA, Bowlin PR, Gleason JM, Braga LH, Lorenzo AJ. Side-to-Side Refluxing Nondismembered Ureterocystotomy: A Novel Strategy to Address Obstructed Megaureters in Children. J Urol 2017; 198 (5): 1159–1167. DOI: 10.1016/j.juro.2017.05.078.
- Shrestha AL, Bal HS, Kisku SMC, Sen S. Commentary to “Outcome of end cutaneous ureterostomy (ECU) as a non conservative option in the management of primary obstructive megaureters (POM).” J Pediatr Urol 2018; 15 (3): 294–295. DOI: 10.1016/j.jpurol.2019.02.024.
- Kitchens DM, DeFoor W, Minevich E, Reddy P, Polsky E, McGregor A, et al.. End Cutaneous Ureterostomy for the Management of Severe Hydronephrosis. J Urol 2007; 177 (4): 1501–1504. DOI: 10.1016/j.juro.2006.11.076.
Última actualización: 2025-09-21 13:35