16: Reflujo vesicoureteral
Este capítulo durará aproximadamente 38 minutos para leer.
Introducción
El reflujo vesicoureteral (RVU) es el flujo retrógrado de orina desde la vejiga hacia los uréteres y, a veces, hacia los riñones. El RVU es un factor de riesgo de pielonefritis recurrente, cicatrización renal, insuficiencia renal e hipertensión y se cita como causa de enfermedad renal terminal en niños.1,2,3,4 El manejo del reflujo se orienta principalmente a reducir el desarrollo de estos efectos adversos a largo plazo mediante la prevención de la pielonefritis.
En las últimas décadas se ha producido un cambio de paradigma en la evaluación y el manejo del RVU, y los clínicos deben estar al tanto de las controversias en el manejo del RVU. Al parecer, el tratamiento activo del reflujo ha mejorado los desenlaces en algunos niños de tal forma que la incidencia de nefropatía asociada al reflujo continúa disminuyendo, pero la literatura urológica reciente sugiere que la historia natural del RVU no sigue un curso uniforme. Muchos niños con reflujo no se benefician ni del diagnóstico ni del tratamiento, dado que existe una alta tasa de resolución espontánea sin efectos adversos.5,6 Aclarar cuáles niños sí se benefician del tratamiento es el mayor desafío para el avance del manejo del reflujo vesicoureteral.
Antecedentes, incidencia y fisiopatología
VUR ocurre en aproximadamente 1-3% de los niños, y se ha informado que 2.3% de los pacientes con ESRD de inicio reciente de 0 a 21 años en los Estados Unidos tienen un diagnóstico primario atribuido a la nefropatía por reflujo. La incidencia de ESRD con nefropatía por reflujo como etiología primaria ha disminuido de forma constante en los últimos veinte años.7 Estudios internacionales previos han estimado una mayor prevalencia de alrededor del 10%.5,8
Aunque se hicieron referencias anatómicas al concepto de reflujo ya en el siglo I d. C., estudios fundamentales en la década de 1950 contribuyeron por primera vez a nuestra comprensión de la asociación entre el RVU, la pielonefritis crónica y la cicatrización renal tal como la entendemos hoy.9,10
El VUR puede clasificarse como primario o secundario. El VUR primario se atribuye a una porción intramural anormalmente corta del uréter que discurre a través del músculo detrusor en la unión ureterovesical. En una unión normal, el uréter intramural se comprime pasivamente durante el llenado vesical, creando un mecanismo antirreflujo. Este mecanismo depende de la relación longitud intramural/diámetro y del ángulo de inserción ureterovesical.11
Un túnel intravesical corto se asocia con RVU, y la longitud del túnel es inversamente proporcional a la gravedad del reflujo.12
El RVU secundario se desarrolla cuando la función anormal del tracto urinario inferior y las presiones intravesicales elevadas superan el mecanismo antirreflujo y se asocia con afecciones como la obstrucción de la salida vesical (p. ej., válvula uretral posterior) o la vejiga neurógena. El RVU secundario también puede observarse en niños sin anomalías anatómicas genitourinarias ni neurológicas, pero que presentan disfunción vesical e intestinal.13 La causa más frecuente del reflujo secundario es la disfunción vesical e intestinal no neurógena, que también es uno de los mayores factores de riesgo de ITU de escape.
Herencia
Existe un fuerte patrón de herencia en el VUR primario, con hasta el 80% de los gemelos monocigóticos y el 35% de los gemelos dicigóticos concordantes en cuanto a la presencia de VUR.2 Se han identificado múltiples polimorfismos asociados con anomalías en la yema ureteral en pacientes con VUR primario, aunque no se ha encontrado que predomine un solo gen.14 La probabilidad de que un hermano no gemelo tenga reflujo es de aproximadamente un 25% y las posibilidades de que la descendencia tenga reflujo son de aproximadamente 35-50%.15,16 Curiosamente, esta relación no es tan fuerte en niños con eliminación disfuncional, lo que probablemente habla de la naturaleza secundaria del VUR en esta cohorte.17
Reflujo vesicoureteral, infecciones del tracto urinario y cicatrices renales
El significado clínico del VUR radica en gran medida en su asociación con displasia renal congénita, así como con la lesión parenquimatosa renal que ocurre secundariamente a la pielonefritis recurrente. Al menos un tercio de los pacientes con VUR presentan cicatrices renales.18,19 La presencia de cicatrices implica regiones de daño renal y aumenta el riesgo de secuelas adversas a largo plazo.
Nefropatía por reflujo congénita
En recién nacidos con RVU, se han detectado cicatrices en asociación con reflujo de alto grado antes de la aparición de ITU clínica.20 Estas “cicatrices congénitas” se consideran regiones de displasia o hipoplasia focal que resultan de una nefrogénesis anormal, en contraposición a tejido normal dañado tras una pielonefritis. La displasia renal congénita puede ser indistinguible de las cicatrices renales adquiridas secundarias a infección. Dado que las gammagrafías renales con DMSA no se realizan de forma rutinaria en los neonatos, se desconoce qué proporción de las cicatrices renales atribuidas a daño infeccioso se debe en realidad a anomalías de la embriogénesis.21 Si bien la etiología última sigue siendo incierta, se trata de regiones de función renal disminuida y pueden asociarse a una morbilidad y mortalidad significativas, independientemente del desarrollo de cicatrización renal asociada a la infección.22
Pielonefritis y cicatrización renal
Las infecciones del tracto urinario son frecuentes en la infancia, y afectan a alrededor del 5% de las niñas y a aproximadamente la mitad de esa proporción en los niños.23 Se estima que entre el 30% y el 40% de los niños menores de 5 años que desarrollan infecciones del tracto urinario presentan RVU tras una evaluación adicional.24,25 Se cree que la cicatrización renal ocurre cuando la orina infectada entra en contacto con el parénquima renal, provocando una reacción inflamatoria; se ha asociado con un mayor riesgo de hipertensión, proteinuria e insuficiencia renal.3,26
El VUR como factor predisponente de lesión renal debida a infección se reconoció por primera vez en pacientes con lesión medular. Tras la corrección quirúrgica, estos niños tuvieron menos episodios de pielonefritis y urosepsis.27 Estudios posteriores demostraron una menor tasa de desarrollo de nuevas cicatrices renales en niños con reflujo primario en comparación con aquellos con reflujo secundario por vejiga neurógena o disfunción miccional.28,29
La lesión renal permanente resultante de la pielonefritis puede identificarse como cicatrización renal en la gammagrafía con ácido dimercaptosuccínico (DMSA) marcado con 99mTc. En un metanálisis que examinó la presencia de daño renal en niños hospitalizados por infección del tracto urinario, aproximadamente el 34% de los niños con pielonefritis presentaban RVU y, de aquellos con RVU y pielonefritis, el 72% tenía una gammagrafía DMSA anormal.30
La cicatrización renal en la gammagrafía nuclear puede detectarse durante o poco después de un episodio agudo de pielonefritis. Las secuelas de las cicatrices renales pueden no hacerse evidentes durante muchos años; se han reportado intervalos de hasta 30-40 años entre el primer episodio de pielonefritis con cicatrización renal y el desarrollo de hipertensión o enfermedad renal terminal.27 El prolongado tiempo entre la aparente lesión renal inicial y los efectos clínicamente manifiestos subraya la necesidad de un seguimiento a largo plazo de los pacientes con RVU.
Clasificación del reflujo y otros predictores de resultados
Debido a que existe una alta tasa de resolución espontánea del RVU en la mayoría de los niños, pero secuelas clínicas potencialmente devastadoras en otros, identificar a aquellos con mayor riesgo es un objetivo principal del manejo del RVU. El Estudio Internacional del Reflujo clasificó el RVU en una escala de 5 puntos definida por el grado de flujo retrógrado de orina y la distorsión acompañante del sistema pielocalicial (Figura 1)31 Los grados más altos se asocian con tasas disminuidas de resolución espontánea y una mayor prevalencia de cicatrices renales.23,32
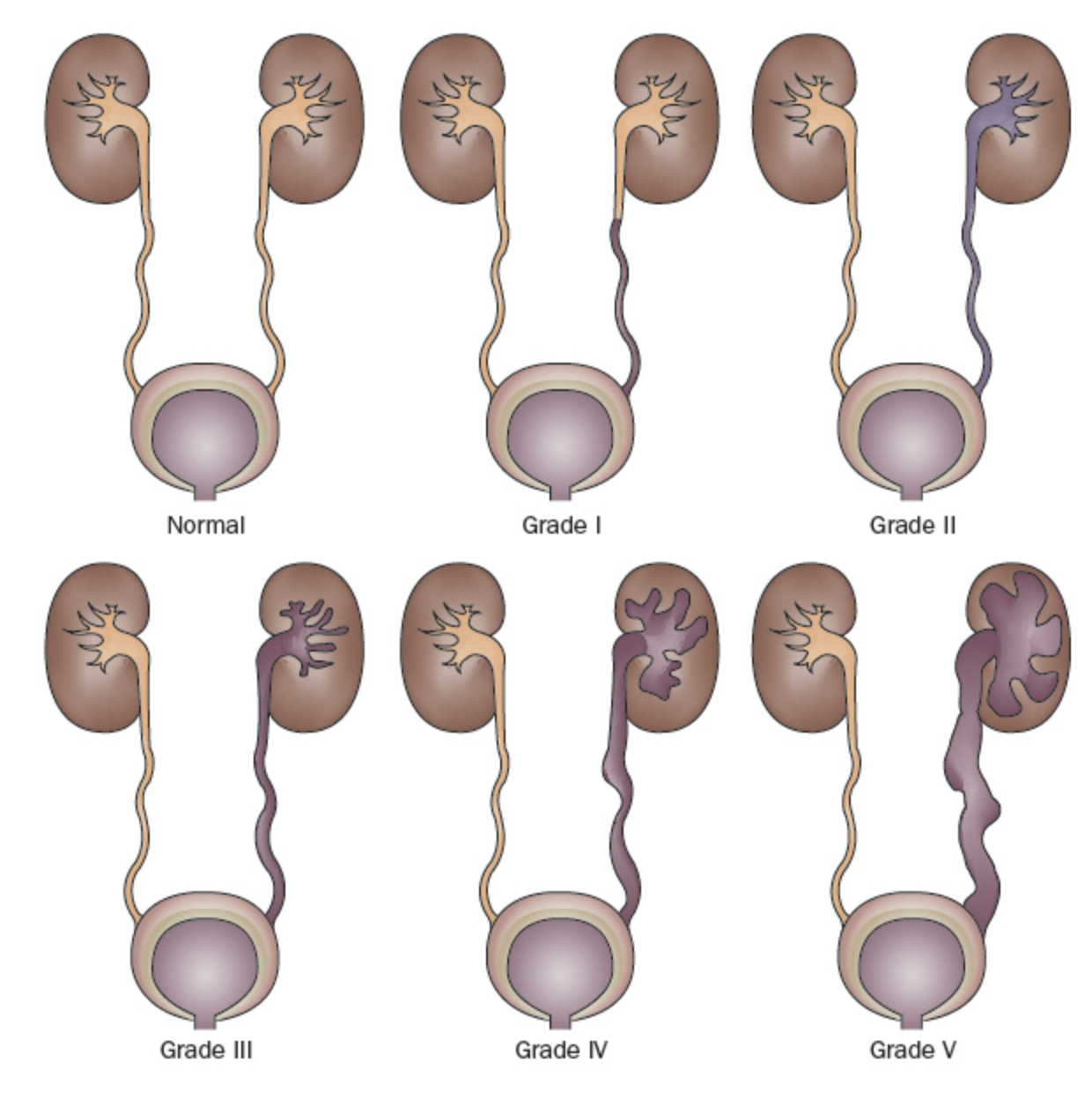
Figura 1 Sistema internacional de clasificación del reflujo.31
- Grado I: reflujo únicamente hacia el uréter
- Grado II: reflujo hacia un sistema pielocalicial no dilatado
- Grado III: dilatación del sistema colector (Figura 2)
- Grado IV: dilatación más extensa con embotamiento de los cálices y tortuosidad del uréter (Figura 3)
- Grado V: dilatación masiva del sistema colector y tortuosidad severa del uréter (Figura 4)
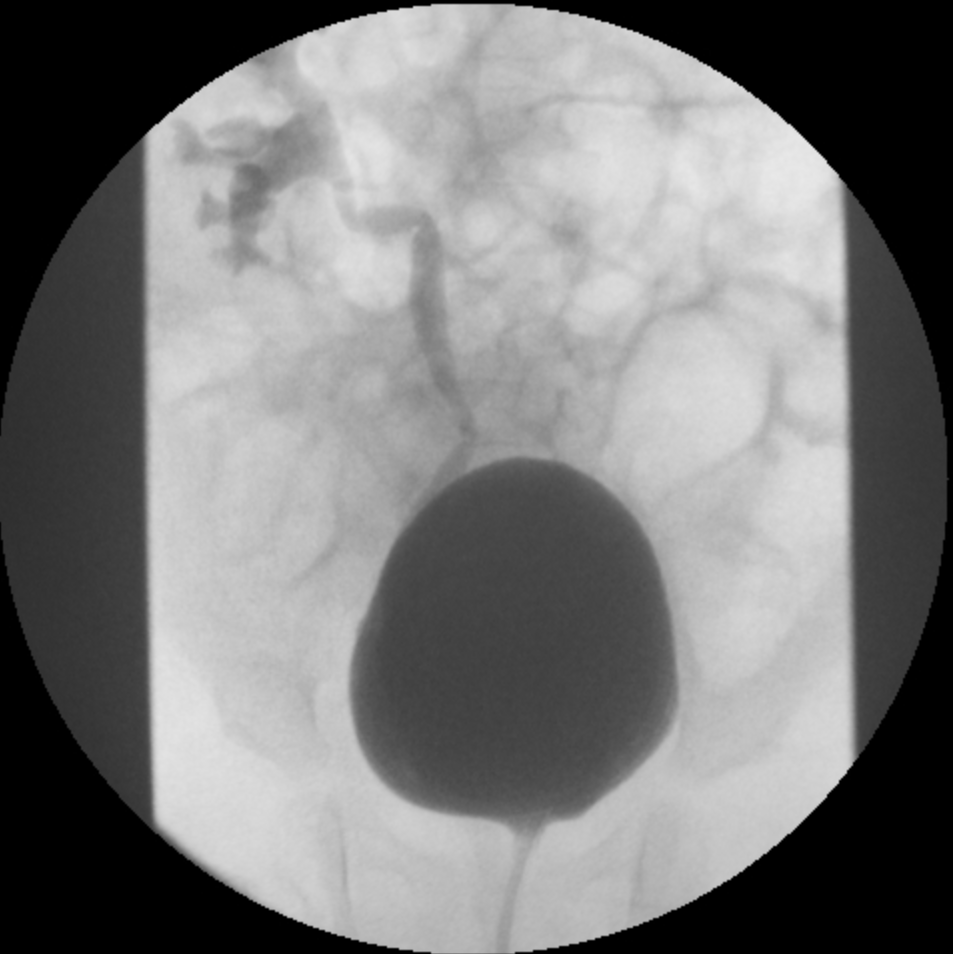
Figura 2 Grado III de RVU
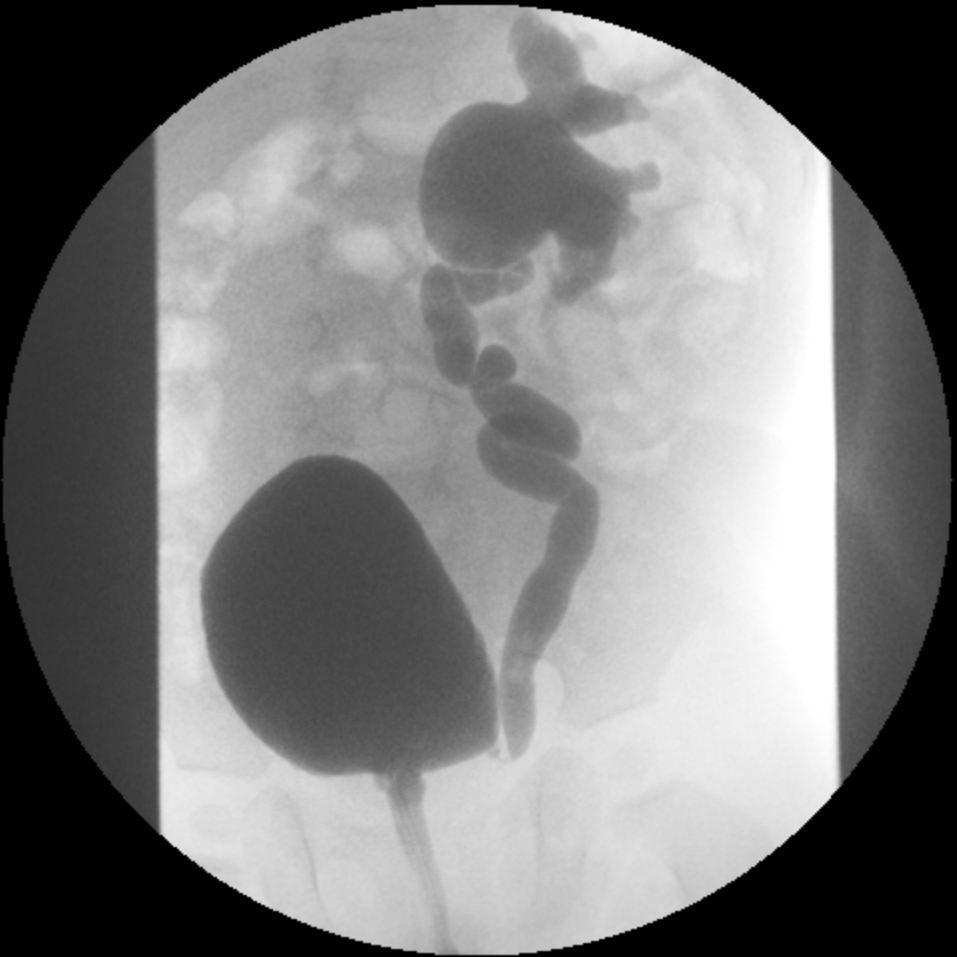
Figura 3 RVU grado IV
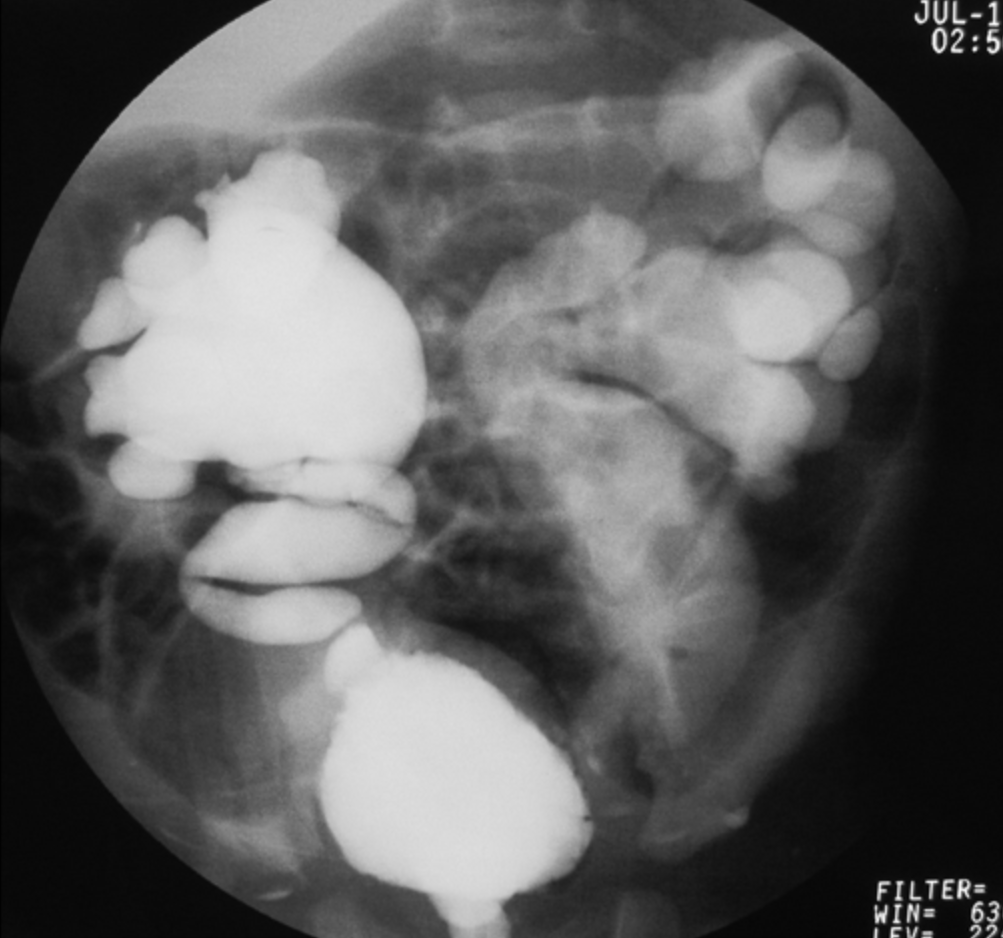
Figura 4 Grado V RVU
Múltiples estudios demuestran una correlación directa entre la prevalencia de cicatrices renales y el grado de reflujo..33 La cicatrización renal aparece con menor frecuencia en el reflujo no dilatante.22,34,35 Se ha demostrado que la probabilidad de desarrollar pérdida adicional de parénquima renal es mayor en los niños con reflujo de grados III-V que en aquellos con grados I-II.36,37 También se ha demostrado que las cicatrices renales son un predictor negativo de la resolución del RVU independientemente del grado de reflujo.38 Desafortunadamente, el sistema internacional de gradación del reflujo es subjetivo y presenta baja fiabilidad interobservador.39,40
Más recientemente, se han identificado factores adicionales que influyen en la resolución del reflujo y en las ITU de escape. Entre los factores clínicos predictivos de la resolución del reflujo, del riesgo de lesión renal y/o de ITU de escape se incluyen la edad, el sexo (el sexo femenino aumenta el riesgo), el estado de circuncisión (la circuncisión es protectora frente a la ITU), la presencia de disfunción vesicointestinal y los antecedentes de ITU. Entre los predictores radiográficos se incluyen la lateralidad (unilateral vs. bilateral), la relación del diámetro ureteral distal (relativa a la distancia entre los cuerpos vertebrales L1-L3),41,42,43,44,45 el volumen vesical al inicio del reflujo (normalizado como porcentaje de la capacidad vesical predicha para la edad),46 la presión vesical al inicio del reflujo, si el reflujo ocurre en la fase de llenado o en la de vaciado, y la presencia de cicatrices renales.38,47
En neonatos, se demostró que un índice de reflujo vesicoureteral de seis puntos que utiliza el sexo, el grado de VUR, las anomalías anatómicas ureterales y el momento del reflujo durante la VCUG es predictivo de la resolución del VUR, el tiempo hasta la mejoría y las ITU de escape.48,49 De manera similar, se ha creado una red neuronal fácil de usar que emplea información demográfica, grado de VUR, lateralidad, volumen vesical al inicio del VUR, antecedentes de ITU, disfunción vesical o intestinal y presencia de ITU febriles de escape para predecir la probabilidad de resolución del VUR, y está disponible en http://pedsurocomp.lab.uiowa.edu.50 La consideración de múltiples factores de riesgo mejora la predicción de los desenlaces clínicos y permite un manejo más individualizado de cada paciente.
Disfunción intestinal y vesical
Se ha demostrado de manera consistente que los niños con disfunción intestinal o vesical presentan una mayor incidencia de ITU irruptivas, más cicatrización renal, una menor tasa de resolución espontánea del VUR y una mayor tasa de fracaso tras el tratamiento quirúrgico que los niños con hábitos de eliminación “normales”.1,51 Estos hallazgos deben tenerse en cuenta al determinar las opciones de manejo para los niños con VUR con control de esfínteres.
Nefropatía por reflujo/Cicatrización renal
Los niños con cicatrices renales tienen más probabilidades de presentar nuevas infecciones del tracto urinario (ITU) y cicatrices adicionales que los niños sin cicatrices renales.34,52,53 Un estudio retrospectivo de 120 pacientes demostró una probabilidad significativamente mayor de desarrollar una infección del tracto urinario de escape en aquellos con reflujo de grados III-V y una anomalía en la gammagrafía DMSA basal (60%) en comparación con quienes no tenían una anomalía (6%), y otro estudio mostró un riesgo relativo de 5.1 de ITU de escape en pacientes con cicatrización renal.54,55 En un estudio con un seguimiento medio de 12 años después de una operación antirreflujo, los niños con cicatrices renales unilaterales tenían un 11% de probabilidad de desarrollar hipertensión y un 18.5% si tenían cicatrices renales bilaterales.56 Otros han sugerido que la incidencia de hipertensión en niños con cicatrices renales bilaterales es de aproximadamente el 20%.57 Los niños con cicatrices renales bilaterales graves tienen significativamente más probabilidades de desarrollar proteinuria, insuficiencia renal crónica y fallo renal que aquellos con cicatrices unilaterales o riñones sin cicatrices.58,59 Estos datos sugieren firmemente que los niños con cicatrización tienen un mayor riesgo de desarrollar más cicatrices y secuelas clínicas a largo plazo.
Diagnóstico y evaluación
Cistouretrografía miccional y cistograma nuclear
Las únicas pruebas que detectan el reflujo de forma rutinaria y fiable son la cistouretrografía miccional (CUM) y la cistografía nuclear. La CUM se realiza instilando contraste de forma retrógrada a través de un catéter uretral hacia la vejiga y obteniendo imágenes fluoroscópicas de los tractos urinarios superior e inferior durante el llenado y la micción. El cistograma nuclear se realiza mediante una técnica de escintigrafía con radioisótopos. La CUM es una prueba inicial apropiada, ya que proporciona mejores detalles anatómicos, incluida la presencia o ausencia de divertículos periureterales, duplicación ureteral y anomalías vesicales o uretrales. También permite una gradación más precisa del reflujo. Además, permite medir el diámetro ureteral distal, que ha demostrado ser más objetivo y fiable que el grado y tener un valor predictivo igual o mayor en términos de resolución y resultados clínicos.41,42,43,44,45
La cistografía con radionúclidos es beneficiosa porque reduce la dosis de radiación en comparación con la VCUG. La cistografía con radionúclidos detecta de manera fiable todos los grados de reflujo vesicoureteral y puede ser más sensible para la detección de RVU intermitente (Figura 5)60,61
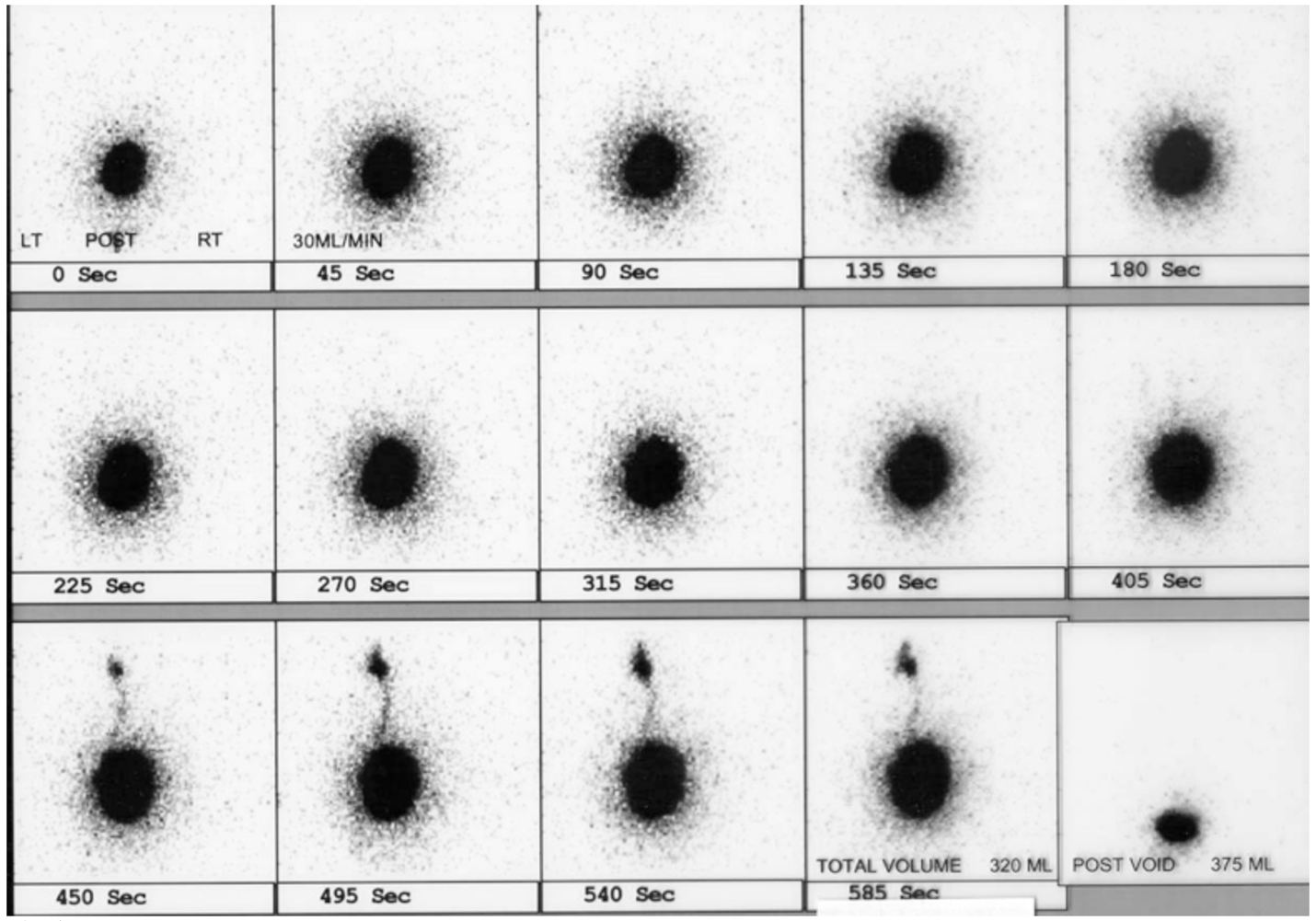
Figura 5 RVU izquierdo en cistograma nuclear
Si una cistouretrografía miccional no demuestra anomalías anatómicas significativas, puede realizarse una cistografía por radionúclidos para los estudios de seguimiento con el fin de limitar la exposición a la radiación. Aunque la cistografía por radionúclidos se considera con frecuencia una prueba más sensible, el médico solicitante debe tener en cuenta que cada tipo de cistografía tiene limitaciones en su capacidad para detectar reflujo en una población dada.62
Las Secciones de Urología y Radiología de la Academia Americana de Pediatría crearon en 2016 un protocolo estándar para la realización de VCUG con el fin de maximizar la seguridad del paciente y garantizar resultados precisos que afectan directamente el manejo del paciente.63 Las recomendaciones clave incluían observar los principios ALARA,64 llenar la vejiga por gravedad desde 100 cm por encima de la mesa de examen, obtener imágenes de la uretra durante la fase miccional, realizar un estudio cíclico (múltiples ciclos de llenado), estimar la capacidad vesical máxima, registrar el volumen vesical en el que ocurre el VUR, registrar el residuo posmiccional, registrar anomalías de la vejiga o la uretra (p. ej., divertículos vesicales o válvula uretral posterior) y graduar el reflujo según el International Reflux Study.
Además de la exposición a la radiación, la cateterización puede ser una experiencia traumática para un niño pequeño. Los esfuerzos para disminuir el carácter traumático de la VCUG incluyen el uso de lubricantes que contienen anestésicos locales, el uso de especialistas de Child Life y la sedación consciente. Históricamente, las cistografías se repetían anualmente; sin embargo, con la mejor capacidad para predecir el momento de la resolución se ha sugerido que, en los niños con menor probabilidad de resolver el VUR, el intervalo entre cistografías debería prolongarse para disminuir la exposición a la radiación, el número de estudios traumáticos y el costo.50,65,66,67
Una modalidad de imagen relativamente reciente adoptada en algunos centros es la urosonografía miccional con contraste (ceVUS), que en varios estudios ha demostrado ser segura y comparable a la VCUG para detectar RVU de grado 2 o superior, detectar reflujo intrarrenal y presentar buena concordancia interobservador (Figura 6) Permite evitar por completo la exposición a radiación ionizante, pero aún requiere cateterización e instilación intravesical del agente de contraste. Los agentes de contraste ecográfico de segunda generación no estuvieron ampliamente disponibles hasta su aprobación reciente por la FDA en los Estados Unidos.68,69 La VCUG sigue siendo el estándar de oro para el diagnóstico de RVU hasta que investigaciones adicionales demuestren sensibilidad y especificidad equivalentes de otros métodos diagnósticos.
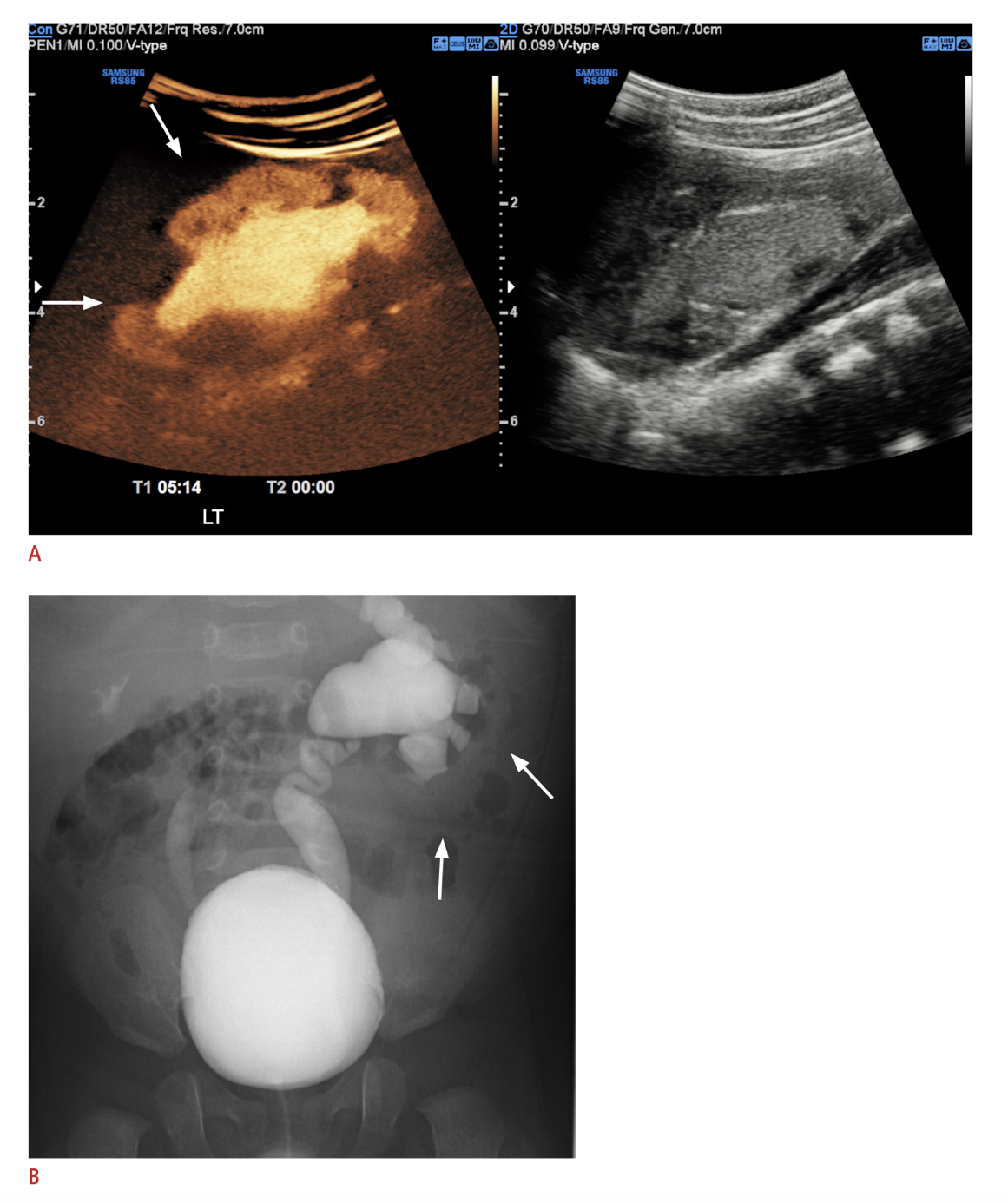
Figura 6 A. Imagen de ecografía con contraste del riñón izquierdo con reflujo intrarrenal en comparación con B. VCUG que muestra VUR izquierdo de grado V y VUR derecho de grado III. Imagen reproducida bajo los términos de la licencia Creative Commons Atribución No Comercial. Imagen reimpresa de. Copyright 2021 Sociedad Coreana de Ultrasonido en Medicina.
Gammagrafía nuclear (DMSA, MAG3)
La gammagrafía con DMSA, en la que el radiofármaco se une a los túbulos proximales, se ha encontrado que es un estudio más sensible que la pielografía intravenosa (PIV) para la detección de nefropatía por reflujo.70 La exploración proporciona información sobre la función renal diferencial y también puede detectar cambios de pielonefritis aguda con mayor sensibilidad y especificidad que la tomografía computarizada, la resonancia magnética o la ecografía.71(Figura 7)
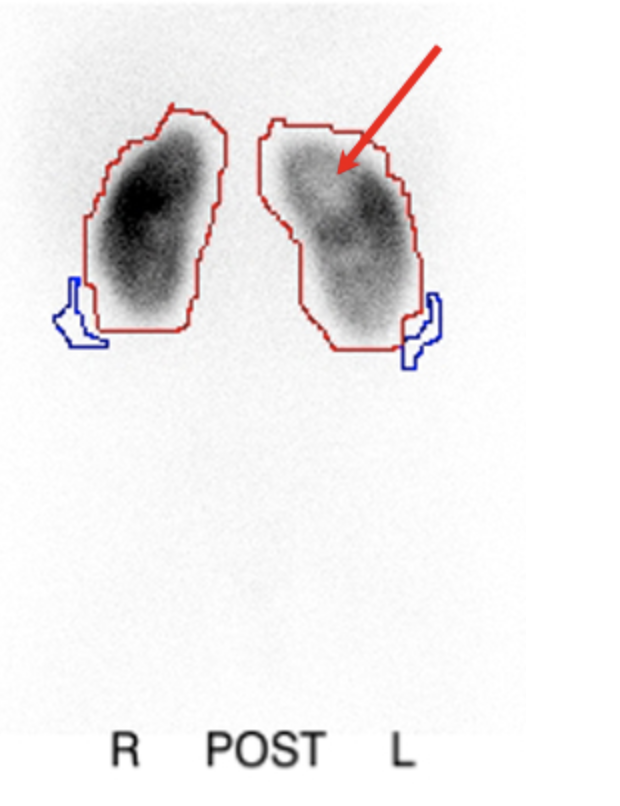
Figura 7 Gammagrafía renal con DMSA posterior a pielonefritis que muestra defectos fotopénicos en el riñón izquierdo
La asociación de las cicatrices renales con grados más altos de reflujo y el riesgo de cicatrices posteriores, así como las tasas de resolución disminuidas, llevan a algunos a concluir que la evaluación inicial estándar de un niño con una infección urinaria febril debería comenzar con una gammagrafía renal y no con una VCUG (el enfoque “de arriba hacia abajo”). Utilizando este enfoque, solo en aquellos niños con una gammagrafía anormal debería realizarse una VCUG. El beneficio de tal enfoque sería una reducción en el número de niños sometidos a VCUG y la identificación del reflujo en un grupo de mayor riesgo; en teoría, los pacientes con reflujo pero sin anomalías renales estructurales o funcionales podrían no ser diagnosticados, pero la ausencia de tales anomalías renales sugiere que el reflujo probablemente no sea clínicamente significativo. El uso de la ecografía como alternativa a la gammagrafía renal no ha sido aceptado debido a su menor sensibilidad. Un estudio señaló que hasta un 25% de los pacientes con defectos corticales en la DMSA presentaban una ecografía normal, aportando más datos sobre la utilidad de las gammagrafías renales en la evaluación de los niños con infecciones urinarias febriles.72
La escintigrafía con mercaptoacetiltriglicina (MAG3) también tiene una mejor capacidad para detectar cicatrices renales en comparación con la pielografía intravenosa (IVP). Aunque muchos consideran que la escintigrafía con DMSA es la prueba más sensible para la detección de cicatrices renales; la sensibilidad reportada de la MAG3 en comparación con la DMSA varía desde el 88% hasta ser igual o ligeramente superior a la de una escintigrafía con DMSA.73,74,75 Entre las ventajas de la MAG3 se incluyen una menor exposición a la radiación, menor coste y menor tiempo requerido, así como la visualización del sistema colector, lo que puede mejorar la especificidad en comparación con la DMSA en aquellos con dilatación significativa del sistema colector.73 La escintigrafía nuclear suele diferirse hasta 4-6 semanas de edad para garantizar un desarrollo renal adecuado que permita resultados precisos.
Indicaciones para las pruebas diagnósticas
El diagnóstico del reflujo vesicoureteral generalmente se realiza después de una o más ITU o cuando se sospecha sobre la base de imágenes renales anormales. Tradicionalmente se ha recomendado el cribado de RVU en pacientes con dilatación del tracto urinario diagnosticada prenatalmente (UTD) porque se ha informado reflujo en hasta el 31% de los lactantes con UTD prenatal; sin embargo, la UTD prenatal se correlaciona pobremente con la gravedad del RVU.76,77,78,79 El riesgo de RVU en pacientes con un sistema colector no dilatado o levemente dilatado puede ser de hasta el 25%.77,80,81 Afortunadamente, el RVU asociado con UTD detectada prenatalmente presenta una alta incidencia de resolución espontánea.81,82 Los estudios que evaluaron si los pacientes con UTD y RVU presentan o no un mayor riesgo de ITU (en comparación con UTD en ausencia de RVU) muestran resultados contradictorios.83,84,85,86,87,88,89,90 Debe considerarse la realización juiciosa de la VCUG en función de los factores de riesgo de un RVU clínicamente significativo.
La utilidad del cribado de hermanos para reflujo vesicoureteral también es controvertida.17,91 Existe un mayor riesgo de anomalías corticales renales en los hermanos cribados con antecedente de ITU, así como de un diagnóstico final de RVU de alto grado.92 Un estudio que empleó datos de reclamaciones de seguros no encontró una diferencia significativa en la tasa de ITU entre hermanos cribados y no cribados.93
Aún debe demostrarse si la detección y el manejo del VUR en un hermano asintomático sometido a cribado se traducen en una disminución significativa de las secuelas adversas; por lo tanto, actualmente no existe consenso respecto a la práctica del cribado de hermanos asintomáticos para VUR. La recomendación de las Guías Clínicas de la AUA para el Manejo del Reflujo Vesicoureteral Primario en Niños es que se realice a los hermanos un cribado con ecografía renal-vesical (RBUS), reservando la VCUG para aquellos en quienes la RBUS sea anormal.94
El momento de la evaluación del RVU en pacientes con antecedentes de ITU febril también sigue siendo controvertido. El Subcomité sobre Infección del Tracto Urinario de la AAP publicó guías clínicas en 2011 y las reafirmó en 2016, en las que se recomendaba posponer la profilaxis antibiótica y la VCUG tras la primera ITU febril en ausencia de una ecografía renal anormal en niños de 2-24 meses.95 El ensayo Randomized Intervention in Children with Vesicoureteral Reflux (RIVUR) estudió a 607 niños pequeños (2-72 meses) con RVU grados I-IV tras una primera o segunda ITU febril o sintomática, y los aleatorizó a placebo frente a profilaxis antibiótica. La profilaxis con trimetoprim/sulfametoxazol redujo la aparición de ITU en un 50%, pero no hubo diferencias significativas en la cicatriz renal entre los grupos, aunque el estudio no tenía potencia estadística para evaluar la cicatriz renal.96 Un análisis post hoc del ensayo RIVUR y de otro ensayo prospectivo multicéntrico (CUTIE) mostró que la incidencia de cicatriz renal después de una ITU febril era del 2.8%, del 25.7% después de dos ITU febriles, y del 28.6% después de tres o más ITU febriles, lo que refuerza la utilidad del cribado del RVU tras la ITU febril inicial.97
Manejo clínico
No existe un manejo óptimo universal para los niños con RVU. Como se mencionó anteriormente, múltiples variables anatómicas y fisiológicas influyen en la probabilidad de resolución espontánea del RVU y en el riesgo de ITU febriles, mientras que también deben considerarse factores extrínsecos como las preferencias del paciente y la familia, la adherencia a la medicación, las situaciones sociales y las tasas de infecciones del tracto urinario. Teniendo en cuenta que el manejo del RVU debe individualizarse para cada niño tras considerar los múltiples factores intrínsecos y extrínsecos que influyen en los resultados, a continuación analizamos las distintas opciones de tratamiento.
Manejo no quirúrgico
La administración diaria de antibióticos en dosis bajas (~ ¼ de la dosis de tratamiento) se basa en el conocimiento de que las tasas de resolución espontánea del RVU primario son muy altas (incluso en casos de RVU grave en poblaciones seleccionadas) y en que las cicatrices renales asociadas al reflujo posnatal parecen ocurrir exclusivamente en el contexto de orina infectada, en particular en los polos de los riñones, donde el sistema colector intrarrenal es más propenso a presentar cálices compuestos.98 Por lo tanto, mantener orina estéril hasta la resolución espontánea del reflujo puede evitar la morbilidad de la cirugía y las cicatrices renales. Varios estudios aleatorizados han intentado evaluar la eficacia y los efectos adversos de la profilaxis antibiótica en niños con RVU.4,99 En general, estos estudios no han logrado demostrar una reducción significativa de la pielonefritis aguda ni de las cicatrices renales en niños con RVU tratados con profilaxis antibiótica. Algunos estudios incluso informaron un aumento de ITU en los niños que recibían antibióticos, así como un incremento de bacterias resistentes a los antibióticos causantes de las ITU.4,99,100 Mediante análisis de subgrupos, otros estudios identificaron la menor edad y grados crecientes de reflujo como factores de riesgo para ITU febriles recurrentes.99,101 El ensayo multicéntrico RIVUR demostró una reducción del 50% en la recurrencia de ITU con profilaxis antibiótica frente a placebo, pero sin diferencias en la tasa de cicatrices renales.102
Muchos cuestionan la necesidad de la profilaxis antibiótica y sugieren que, en individuos seleccionados, la probabilidad de pielonefritis y lesión renal sin profilaxis antibiótica es pequeña.103,104,105,106 Entre el 30% y el 50% de los niños con antecedente de una ITU presentarán infecciones recurrentes y, debido a que el diagnóstico de reflujo suele seguir a una infección del tracto urinario, esto lleva a muchos a la suposición errónea de que el reflujo es responsable de la infección. Sin embargo, en general el reflujo no predispone de manera significativa a infecciones del tracto urinario a menos que sea de mayor grado.104,107 Con mayor frecuencia, las ITU se deben a condiciones predisponentes tales como antecedente previo de infecciones urinarias, sexo femenino, estreñimiento, micción infrecuente, vaciamiento vesical incompleto o inmunidad comprometida. Múltiples estudios demuestran ahora que los niños en profilaxis antibiótica sin infecciones de escape ni evidencia de lesión renal pueden ser observados de forma segura sin profilaxis antibiótica ni corrección del VUR.103,104 especialmente después de que se haya optimizado la disfunción intestinal y vesical.108
En general, la profilaxis antibiótica diaria parece ser segura y bien tolerada, pero conlleva costos y riesgos potenciales. Se ha asociado con un riesgo 24 veces mayor de Escherichia coli resistente a trimetoprima-sulfametoxazol.109 Otros estudios han demostrado la aparición de otras bacterias con tasas elevadas de resistencia en niños que reciben antibióticos profilácticos.110 Además de la resistencia, existen otras preocupaciones respecto a los posibles efectos adversos de los antibióticos a largo plazo sobre el microbioma intestinal y urinario, así como sobre el crecimiento.111,112,113,114 Asimismo, debe considerarse la adherencia al tratamiento. Un estudio de 2010 sugirió que la tasa de adherencia para simplemente surtir la receta fue solo del 40%, lo que sugiere que muchos pacientes a quienes se les indica profilaxis antibiótica nunca llegan a recibir el medicamento.115
El reconocimiento y tratamiento de la disfunción vesical desempeña un papel importante en el manejo conservador del RVU, ya sea de forma aislada o con profilaxis antibiótica. Actualmente se reconoce que el RVU secundario se maneja de manera más adecuada abordando la disfunción del tracto urinario inferior.116
Varios estudios prospectivos de gran tamaño han intentado abordar la eficacia de la intervención quirúrgica frente a la profilaxis antibiótica. Estos estudios, por lo general, no han mostrado diferencias significativas en la función renal ni en el crecimiento, en la progresión o aparición de nuevas cicatrices, ni en las ITU.23,36,107,117,118 Sin embargo, los síntomas de pielonefritis, incluidas las ITU febriles, tendieron a ser más frecuentes en los grupos con manejo médico.18,105,119 En general, los niños que finalmente se sometieron a una intervención quirúrgica tendieron a desarrollar cicatrices renales a una edad más temprana, pero no se observaron diferencias significativas en términos generales con un seguimiento más prolongado en cuanto a nuevas cicatrices renales entre los tratados con antibióticos en comparación con los operados.24,120 Estas observaciones sugirieron que un beneficio potencial podría ser una reducción de la pielonefritis gracias a las cirugías antirreflujo en algunos pacientes; sin embargo, otros investigadores plantearon que, una vez que se produce la cicatrización renal, la enfermedad tiende a seguir su curso y el tratamiento quirúrgico aporta poco beneficio.27,121 Una revisión concluyó que serían necesarias nueve cirugías de reimplante ureteral para prevenir una ITU febril, sin reducción en el número de niños que desarrollan daño renal,24 reforzando nuevamente la necesidad de definir mejor qué niños con VUR pueden beneficiarse de la intervención. La intervención quirúrgica se reserva, por lo general, para niños con ITU a pesar de la profilaxis antibiótica, con empeoramiento de la función renal, o en aquellos en quienes otras consideraciones favorecen una intervención definitiva frente a la administración diaria de antibióticos.
Manejo quirúrgico
Tratamiento endoscópico
Desde la aprobación por la FDA del uso del copolímero de dextranómero/ácido hialurónico (Dx/HA) (Deflux®, Q-Med, Uppsala, Suecia) en 2001 para el tratamiento del RVU primario, los profesionales han utilizado cada vez más la inyección endoscópica como alternativa al uso prolongado de antibióticos.122 Dx/HA es el único tratamiento inyectable para el reflujo vesicoureteral aprobado por la FDA y disponible comercialmente en los Estados Unidos. Es una mezcla sintética de microesferas de dextrano en un gel de ácido hialurónico que se inyecta mediante diversas técnicas en la región de los orificios ureterales. El tamaño de partícula del dextranómero evita la migración linfática.123
La corrección endoscópica del RVU ofrece un procedimiento ambulatorio mínimamente invasivo con bajo riesgo de complicaciones. Aunque es un procedimiento aparentemente sencillo, varios estudios han demostrado una curva de aprendizaje con mejores resultados obtenidos a medida que aumenta la experiencia.124,125,126 Otros factores asociados con una corrección endoscópica exitosa incluyen un menor grado de reflujo, un UDR menor, ausencia de disfunción intestinal y vesical, un mayor volumen de Dx/HA inyectado, la evaluación visual de la configuración del montículo tras la inyección y la técnica quirúrgica.126,127,128,129 Los estudios de técnica quirúrgica han mostrado que la técnica de implantación con hidrodistensión doble (HIT) permite tasas de éxito más altas que otras técnicas, incluida la técnica STING, acercándose a las de la reimplantación ureteral.130
A corto plazo, las tasas de resolución del RVU para un solo uréter tratado con Dx/HA oscilan entre el 59% y el 95%.126,131 Si los pacientes se someten a una segunda inyección por RVU persistente, la tasa de éxito mejora, pero una tercera inyección rara vez es curativa.122,124,132 Los resultados a largo plazo de pacientes con >5 años de seguimiento muestran tasas de resolución del RVU de 59-100%, afectadas de manera significativa por el grado de RVU, con tasas de ITU febril tras la inyección de 4-25%.130 La realización rutinaria de CUM para confirmar la resolución del RVU es controvertida y algunos no la consideran un requisito, a menos que se considere que el paciente tiene alto riesgo de recurrencia (RVU de alto grado, presencia de ITU febril tras la inyección, edad < 2 años) o si es la preferencia de la familia o del cirujano.133 Otros abogan por obtener CUM de forma selectiva solo si no se visualiza el montículo en la ecografía. Debe realizarse una ecografía en el posoperatorio para descartar obstrucción ureteral.134
Aparte del fracaso del tratamiento, se ha comunicado recientemente la calcificación del implante secundaria a una reacción a cuerpo extraño como otro factor potencial a largo plazo. La calcificación del montículo no es exclusiva de Dx/HA y se ha descrito con muchos agentes inyectados endoscópicamente.135,136 La calcificación puede confundirse con ureterolitiasis, y los profesionales deben mantener un alto índice de sospecha respecto de esta entidad para evitar pruebas diagnósticas e intervenciones quirúrgicas innecesarias.137 La obstrucción ureteral tras Dx/HA se reporta con poca frecuencia (< 1%) y puede ocurrir poco después de la cirugía, pero también se ha descrito hasta cinco años después de la intervención, lo que subraya la importancia de continuar el seguimiento radiográfico de los pacientes tras Deflux. La obstrucción puede ser asintomática, presentarse con cólico renal o con infección del tracto urinario.138,139 La obstrucción suele requerir reimplante ureteral con escisión del segmento afectado.139,140,141
Reimplante ureteral
El tratamiento quirúrgico del reflujo vesicoureteral ha evolucionado durante las últimas cinco décadas. Por lo general se utiliza una incisión transversa abdominal baja para una técnica abierta, dejando una cicatriz pequeña en el pliegue cutáneo que es poco visible. Se han utilizado numerosas técnicas quirúrgicas de reimplantación ureteral; las diferencias principales incluyen el abordaje intravesical (Figura 8) frente al extravesical. No existe documentación clara que demuestre que alguna técnica en particular sea superior,23 y la selección de una técnica determinada suele individualizarse para el niño a discreción del cirujano a cargo.
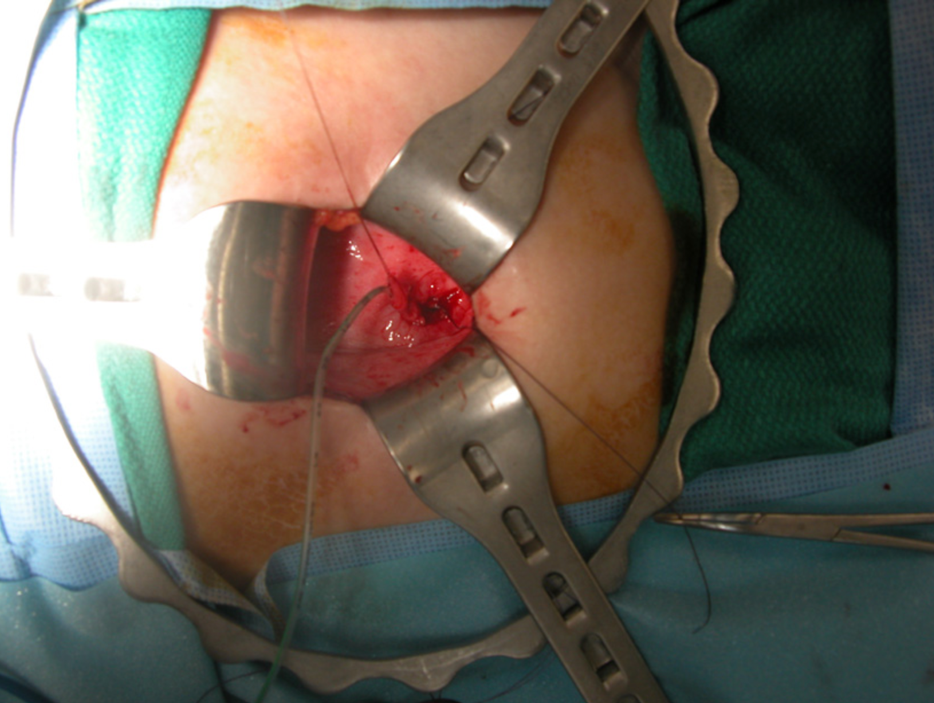
Figura 8 Reimplante ureteral intravesical
Los avances en analgesia, las técnicas quirúrgicas y la comprensión de que los niños sometidos a reimplante ureteral por RVU primario rara vez necesitan stents ureterales o drenaje vesical prolongado han acortado la estancia hospitalaria y disminuido la morbilidad del procedimiento.142 Varias series informan que los pacientes sometidos a cirugía de reimplante ureteral intravesical y extravesical pueden tratarse de forma ambulatoria.143,144,145 Los resultados de múltiples series documentan tasas de éxito con el reimplante ureteral abierto superiores al 95% y cercanas al 100% para los grados más bajos de reflujo.146,147,148 No obstante, estos procedimientos conllevan riesgos de la anestesia y posibles complicaciones, incluidas la obstrucción ureteral, el reflujo persistente, la infección y la hemorragia.23 Los principios generales del reimplante ureteral incluyen minimizar la manipulación del uréter, la resección del segmento ureteral intravesical, la confección de un túnel de al menos cinco veces el diámetro de la luz ureteral y la creación de una anastomosis sin tensión. En uréteres de gran calibre, puede ser necesario el adelgazamiento mediante resección o plicatura para facilitar la consecución de un túnel intravesical adecuado.
En los últimos años, el reimplante ureteral extravesical laparoscópico asistido por robot se ha utilizado cada vez más, con beneficios citados de menor dolor y una estancia posoperatoria más corta.149 Un estudio multiinstitucional de 260 pacientes mostró resolución radiográfica del RVU en el 88% de los pacientes, una tasa global de complicaciones del 9.6% y una tasa del 4% de retención urinaria tras el reimplante bilateral.150 Un análisis de datos a nivel nacional mostró tasas más altas de complicaciones (13% vs. 4.5%) y mayores costos en comparación con los procedimientos abiertos.151 Aunque el uso del reimplante ureteral robótico continúa en algunos centros, el uso de la cirugía abierta sigue siendo el más prevalente.152
En los pacientes en quienes se considera la intervención quirúrgica, el momento de la cirugía electiva sigue siendo motivo de debate. La mayoría de los estudios que evalúan las tasas de resolución espontánea del RVU han seguido a los pacientes durante 5 años. Aunque este criterio de valoración se basa presumiblemente en el hecho de que la probabilidad de nefropatía por reflujo de novo disminuye después de los cinco años,153 muchos médicos y familias infieren que los niños que no han resuelto su reflujo para entonces deberían someterse a cirugía correctiva. Sin embargo, en niños sin infecciones, el momento de la cirugía a menudo puede posponerse; se han reportado reimplantes ureterales en niños pospuberales y en adultos, con modificaciones en la técnica quirúrgica debido a las diferencias en el hábitus corporal entre adultos y niños, pero con resultados generalmente buenos.154
Manejo individualizado
Si bien el VUR en sí puede definirse de manera sencilla, investigaciones más detalladas confirman que el reflujo no es una entidad única, sino que se presenta con amplias variaciones en gravedad e impacto. Las respuestas a muchas preguntas sobre el reflujo siguen sin conocerse; sin embargo, es claro que el tratamiento definitivo e incluso el diagnóstico del VUR tienen un beneficio clínico cuestionable para muchos pacientes. En la actualidad, las decisiones sobre el tratamiento se basan en la valoración de riesgos y beneficios por parte del médico y de los padres. Aunque la decisión de optar por la cirugía se ha basado tradicionalmente, sobre todo, en el grado de reflujo, una decisión verdaderamente informada debe considerar múltiples otras variables, como la edad del paciente, el sexo, los antecedentes de ITU, el estado funcional renal, la probabilidad y el momento de la resolución espontánea y el riesgo de ITU febril posterior. Se han definido múltiples factores pronósticos relacionados con la probabilidad de resolución espontánea del reflujo en un niño.38,47,50,65 También deben considerarse la situación social del paciente y las preferencias de los padres, así como la disposición a cumplir con el manejo conservador o con los cuidados posoperatorios.
Intentar determinar la probabilidad y el momento de resolución espontánea del VUR en un niño en particular, teniendo en cuenta múltiples variables pronósticas como la edad, el sexo, el grado del VUR, la relación del diámetro ureteral (UDR), el volumen vesical al inicio del reflujo, la presencia de micción disfuncional, los antecedentes de ITU, la presencia de cicatrices renales, la lateralidad y la duplicación, es extremadamente complejo. Con este fin, está disponible para su uso una red neuronal fácil de usar que incorpora muchos de estos factores predictivos en http://pedsurocomp.lab.uiowa.edu (Figura 9)155
Figura 9 Red neuronal que incorpora factores predictivos para la resolución del RVU
El uso y la precisión de este modelo se validaron a nivel internacional en un grupo de niños japoneses.66 Para los niños que se han sometido a una escintigrafía renal, se generó un segundo modelo computacional que incorpora los datos adicionales de la escintigrafía renal para mejorar la precisión pronóstica y está disponible en el mismo sitio web (http://pedsurocomp.lab.uiowa.edu).50
Direcciones futuras
Aunque una mayor precisión respecto a la probabilidad y el momento de la resolución espontánea del RVU permite tomar mejores decisiones de manejo, se necesitan datos adicionales. Se requieren más estudios para definir el riesgo individual de cada niño de presentar pielonefritis posterior, daño renal y, en última instancia, secuelas clínicas. La recopilación continua de datos de grandes registros prospectivos multiinstitucionales puede permitir una mejor comprensión de la historia natural del RVU. Además, los biomarcadores para la detección de reflujo vesicoureteral clínicamente significativo pueden permitirnos determinar mejor quiénes se benefician más del tratamiento activo.
Puntos clave
- Aunque el Sistema internacional de gradación del reflujo es predictivo de la resolución espontánea del RVU y de la presencia de cicatrización renal, tiene una baja fiabilidad interobservador. Medidas radiográficas más objetivas además del grado, como la relación del diámetro ureteral distal y el volumen vesical al inicio del RVU, son predictivas de la resolución espontánea y del riesgo de ITU de escape.
- Múltiples factores clínicos y radiográficos que se han encontrado predictivos de los desenlaces clínicos del RVU se utilizan en diversas combinaciones en calculadoras de riesgo y redes neuronales fáciles de usar como http://pedsurocomp.lab.uiowa.edu para permitir una evaluación del riesgo individualizada más precisa a fin de manejar mejor a los pacientes.
- Los niños con cicatrización renal asociada al RVU tienen mayor probabilidad de desarrollar hipertensión, proteinuria y ERC, y deben someterse a vigilancia rutinaria de la presión arterial, estudios de función renal y análisis de orina para proteinuria a lo largo de la vida adulta.
- Indicar una cistouretrografía miccional basándose únicamente en la presencia de dilatación prenatal del tracto urinario a menudo no es clínicamente útil, y se recomienda un enfoque de toma de decisiones compartida con los padres que incorpore el riesgo de ITU según factores clínicos y ecográficos adicionales (p. ej., gravedad de la hidronefrosis, presencia de hidrouréter) para determinar si un niño debe someterse a una cistouretrografía miccional.
- El control adecuado de la disfunción intestinal y vesical desempeña un papel crucial en el manejo conservador del reflujo vesicoureteral, con o sin el uso de profilaxis antibiótica, y en algunos casos puede evitar la necesidad de intervención quirúrgica.
- Además del desarrollo de bacterias resistentes a antibióticos, la profilaxis antibiótica crónica puede tener efectos secundarios a largo plazo, incluidos impactos adversos sobre el microbioma intestinal y urinario normal que pueden influir en el crecimiento y el desarrollo durante la infancia.
Referencias
- Mathews R, Carpenter M, Chesney R. Controversies in the management of vesicoureteral reflux: the rationale for the RIVUR study. J Pediatr Urol 2009; 5 (5): 336–341. DOI: 10.1016/J.JPUROL.2009.05.010.
- Kaefer M, Curran M, Treves ST. Sibling vesicoureteral reflux in multiple gestation births. Pediatrics 2000; 105 (4 Pt 1): 800–804. DOI: 10.1542/PEDS.105.4.800.
- Smellie JM, Poulton A, Prescod NP. Retrospective study of children with renal scarring associated with reflux and urinary infection. 1994; 308 (6938): 1193–1196. DOI: 10.1136/bmj.308.6938.1193.
- Garin EH, Olavarria F, Nieto VG. Clinical significance of primary vesicoureteral reflux and urinary antibiotic prophylaxis after acute pyelonephritis: a multicenter, randomized, controlled study. Pediatrics 2006; 117 (3): 626–632. DOI: 10.1542/PEDS.2005-1362.
- Cooper CS, Austin JC. Vesicoureteral reflux: who benefits from surgery? Urol Clin North Am 2004; 31 (3): 535–541. DOI: 10.1016/j.ucl.2004.04.006.
- Mattoo TK. Vesicoureteral reflux and reflux nephropathy. Adv Chronic Kidney Dis 2011; 18 (5): 348–354. DOI: 10.1053/j.ackd.2011.07.006.
- Cornwell LB, Riddell JV, Mason MD. New-onset ESRD secondary to reflux nephropathy has decreased in incidence in the United States. J Pediatr Urol 2020; 16 (5). DOI: 10.1016/j.jpurol.2020.06.023.
- Zhang Y, Bailey RR. A long term follow up of adults with reflux nephropathy. N Z Med J 1995; 108 (998): 7761049.
- Hutch JA. Vesico-ureteral reflux in the paraplegic: cause and correction. J Urol 1952; 68 (2): 457–469. DOI: 10.1016/s0022-5347(05)65331-1.
- Hodson CJ. The radiological diagnosis of pyelonephritis. Proc R Soc Med 1959; 52 (8): 669–672.
- Kalayeh K, Fowlkes JB, Schultz WW. Ureterovesical junction deformation during urine storage in the bladder and the effect on vesicoureteral reflux. Journal of Biomechanics 2020. DOI: 10.1016/J.JBIOMECH.2020.110123.
- Paquin AJ. Ureterovesical anastomosis: the description and evaluation of a technique. J Urol 1959; 82 (5): 573–583. DOI: 10.1016/S0022-5347(17)65934-2.
- Koff SA. Relationship between dysfunctional voiding and reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37007-6.
- AM E, K D, E R. Genes in the ureteric budding pathway: association study on vesico-ureteral reflux patients. PLoS ONE 2012; 7 (4). DOI: 10.1371/journal.pone.0031327.
- Noe HN. The long-term results of prospective sibling reflux screening. J Urol 1992. DOI: 10.1016/s0022-5347(17)37017-9.
- Wan J, Greenfield SP, Ng M. Sibling reflux: a dual center retrospective study. J Urol 1996; 156 (2 Pt 2): 8683758. DOI: 10.1016/s0022-5347(01)65782-3.
- Noe HN. The relationship of sibling reflux to index patient dysfunctional voiding. J Urol 1988; 140 (1): 3379674. DOI: 10.1016/s0022-5347(17)41502-3.
- Weiss R, Duckett J, Spitzer A. Results of a randomized clinical trial of medical versus surgical management of infants and children with grades III and IV primary vesicoureteral reflux (United States. The International Reflux Study in Children J Urol 1992. DOI: 10.1016/s0022-5347(17)36998-7.
- Smellie JM. Reflections on 30 years of treating children with urinary tract infections. J Urol 1991; 146 (2 ( Pt 2): 10 1016 0022–5347 17 37889–37888. DOI: 10.1016/s0022-5347(17)37889-8.
- Nguyen HT, Bauer SB, Peters CA. 99m Technetium dimercapto-succinic acid renal scintigraphy abnormalities in infants with sterile high grade vesicoureteral reflux. J Urol 2000; 164 (5): 10 1016 0022–5347 05 67081–67084. DOI: 10.1097/00005392-200011000-00076.
- Patterson LT, Strife CF. Acquired versus congenital renal scarring after childhood urinary tract infection. J Pediatr 2000; 136 (1): 2–4. DOI: 10.1016/s0022-3476(00)90038-6.
- Bailey RR, Lynn KL, Smith AH. Long-term followup of infants with gross vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37010-6.
- Elder JS, Peters CA, Arant BS Jr.. Pediatric Vesicoureteral Reflux Guidelines Panel summary report on the management of primary vesicoureteral reflux in children. J Urol 1997; 157 (5): 9112544. DOI: 10.1097/00005392-199705000-00093.
- Hodson EM, Wheeler DM, Vimalchandra D. Interventions for primary vesicoureteric reflux. Cochrane Database Syst Rev 2007 (3). DOI: 10.1002/14651858.CD001532.pub3.
- Baker R, Maxted W, Maylath J. Relation of age, sex, and infection to reflux: Data indicating high spontaneous cure rate in pediatric patients. J Urol 1966; 95 (1): 10 1016 0022–5347 17 63403–63407. DOI: 10.1016/s0022-5347(17)63403-7.
- Ransley PG, Risdon RA. Reflux nephropathy: effects of antimicrobial therapy on the evolution of the early pyelonephritic scar. Kidney International 1981; 20 (6): 733–742. DOI: 10.1038/KI.1981.204.
- Winberg J. Management of primary vesico-ureteric reflux in children\–operation ineffective in preventing progressive renal damage. Infection 1994; 22 Suppl 1:S4-7. DOI: 10.1007/bf01716025.
- Sukamoto E, Itoh K, Morita K. Reappraisal of Tc-99m DMSA scintigraphy for follow up in children with vesicoureteral reflux. Ann Nucl Med 1999; 13 (6): 401–406. DOI: 10.1007/bf03164934.
- Naseer S SR, G.F.. New renal scars in children with urinary tract infections, vesicoureteral reflux and voiding dysfunction: a prospective evaluation. J Urol 1997; 158 (2): 9224361. DOI: 10.1016/s0022-5347(01)64552-x.
- Gordon I, Barkovics M, Pindoria S. Primary vesicoureteric reflux as a predictor of renal damage in children hospitalized with urinary tract infection: a systematic review and meta-analysis. J Am Soc Nephrol 2003; 14 (3): 739–744. DOI: 10.1097/01.asn.0000053416.93518.63.
- Lebowitz RL, Olbing H, Parkkulainen KV. International system of radiographic grading of vesicoureteric reflux. International Reflux Study in Children Pediatr Radiol 1985; 15 (2): 105–109. DOI: 10.1007/bf02388714.
- Schwab CW Jr., Wu HY, Selman H. Spontaneous resolution of vesicoureteral reflux: a 15-year perspective. J Urol 2002; 168 (6): 2594–2599. DOI: 10.1016/S0022-5347(05)64225-5.
- Hoberman A, Charron M, Hickey RW. Imaging Studies after a First Febrile Urinary Tract Infection in Young Children. New Engl J Med 2003; 348 (3): 195–202. DOI: 10.1056/NEJMoa021698.
- Ylinen E, Ala-Houhala M, Wikström S. Risk of renal scarring in vesicoureteral reflux detected either antenatally or during the neonatal period. Urology 2003; 61 (6): 1242–1243. DOI: 10.1016/s0090-4295(03)00229-2.
- Rolleston GL, Shannon FT, Utley WL. Relationship of infantile vesicoureteric reflux to renal damage. Br Med J 1970; 1 (5694): 460–463. DOI: 10.1136/bmj.1.5694.460.
- Duckett JW, Walker RD, Weiss R. Surgical results: International Reflux Study in Children\–United States branch. J Urol 1992. DOI: 10.1016/s0022-5347(17)36999-9.
- Berg UB. Long-term followup of renal morphology and function in children with recurrent pyelonephritis. J Urol 1992. DOI: 10.1016/s0022-5347(17)37012-x.
- Nepple KG, Knudson MJ, Austin JC. Abnormal renal scans and decreased early resolution of low grade vesicoureteral reflux. Suppl):1643-7; Discussion 1647 2008; 180(4. DOI: 10.1016/j.juro.2008.03.102.
- Metcalfe CB, Macneily AE, Afshar K. Reliability assessment of international grading system for vesicoureteral reflux. J Urol 2012; 188(4. DOI: 10.1016/j.juro.2012.02.015.
- Greenfield SP, Carpenter MA, Chesney RW. The RIVUR voiding cystourethrogram pilot study: experience with radiologic reading concordance. J Urol 2012; 188(4. DOI: 10.1016/j.juro.2012.06.032.
- Cooper CS, Alexander SE, Kieran K. Utility of the distal ureteral diameter on VCUG for grading VUR. J Pediatr Urol 2015; 11 (4). DOI: 10.1016/j.jpurol.2015.04.009.
- Arlen AM, Leong T, Guidos PJ. Distal Ureteral Diameter Ratio is Predictive of Breakthrough Febrile Urinary Tract Infection. J Urol 2017; 198 (6): 1418–1423. DOI: 10.1016/j.juro.2017.06.095.
- Cooper CS, Birusingh KK, Austin JC. Distal ureteral diameter measurement objectively predicts vesicoureteral reflux outcome. J Pediatr Urol 2013; 9 (1): 99–103. DOI: 10.1016/j.jpurol.2011.12.011.
- Arlen AM, Kirsch AJ, Leong T. Validation of the ureteral diameter ratio for predicting early spontaneous resolution of primary vesicoureteral reflux. J Pediatr Urol 2017; 13 (4). DOI: 10.1016/j.jpurol.2017.01.012.
- Troesch VL, Wald M, Bonnett MA. The additive impact of the distal ureteral diameter ratio in predicting early breakthrough urinary tract infections in children with vesicoureteral reflux. J Pediatr Urol 2021; 17 (2). DOI: 10.1016/j.jpurol.2021.01.003.
- Alexander SE, Arlen AM, Storm DW. Bladder volume at onset of vesicoureteral reflux is an independent risk factor for breakthrough febrile urinary tract infection. J Urol 2015; 193 (4): 1342–1346. DOI: 10.1016/j.juro.2014.10.002.
- McMillan ZM, Austin JC, Knudson MJ. Bladder volume at onset of reflux on initial cystogram predicts spontaneous resolution. J Urol 2006. DOI: 10.1016/s0022-5347(06)00619-7.
- Nepple KG, Knudson MJ, Austin JC. Adding renal scan data improves the accuracy of a computational model to predict vesicoureteral reflux resolution. Suppl):1648-52; Discussion 1652 DOI: 101016/Jjuro200803109 PMID 2008; 180(4: 1648–1652. DOI: 10.1016/j.juro.2008.03.109.
- Knudson MJ, Austin JC, Wald M. Computational model for predicting the chance of early resolution in children with vesicoureteral reflux. Pt 2):1824-7 DOI: 101016/Jjuro200705093 PMID 2007; 178: 1824–1827. DOI: 10.1016/j.juro.2007.05.093.
- Knudson MJ, Austin JC, McMillan ZM. Predictive factors of early spontaneous resolution in children with primary vesicoureteral reflux. J Urol 2007; 178(4. DOI: 10.1016/j.juro.2007.03.161.
- KJ A, MT M, JC A. Nuclear cystometrogram-determined bladder pressure at onset of vesicoureteral reflux predicts spontaneous resolution. Urology 2007; 69 (4): 767–770. DOI: 10.1016/j.urology.2007.01.048.
- Cooper CS, Madsen MT, Austin JC. Bladder pressure at the onset of vesicoureteral reflux determined by nuclear cystometrogram. J Urol 2003; 170: 1537–1540. DOI: 10.1097/01.ju.0000083638.36182.5e.
- Arsanjani A, Alagiri M. Identification of filling versus voiding reflux as predictor of clinical outcome. Urology 2007; 70 (2): 351–354. DOI: 10.1016/j.urology.2007.03.031.
- Garcia-Roig M, Ridley DE, McCracken C. Vesicoureteral Reflux Index: Predicting Primary Vesicoureteral Reflux Resolution in Children Diagnosed after Age 24 Months. J Urol 2017; 197 (4): 1150–1157. DOI: 10.1016/j.juro.2016.12.008.
- Arlen AM, Leong T, Wu CQ. Predicting Breakthrough Urinary Tract Infection: Comparative Analysis of Vesicoureteral Reflux Index, Reflux Grade and Ureteral Diameter Ratio. J Urol 2020; 204 (3): 572–577. DOI: 10.1097/JU.0000000000001035.
- Keren R, Shaikh N, Pohl H. Risk Factors for Recurrent Urinary Tract Infection and Renal Scarring. Pediatrics 2015; 136 (1). DOI: 10.1542/peds.2015-0409.
- Lenaghan D, Whitaker JG, Jensen F. The natural history of reflux and long-term effects of reflux on the kidney. J Urol 1976; 115 (6): 10 1016 0022–5347 17 59352–59350. DOI: 10.1016/s0022-5347(17)59352-0.
- Olbing H, Claësson I, Ebel KD. Renal scars and parenchymal thinning in children with vesicoureteral reflux: a 5-year report of the International Reflux Study in Children (European branch. J Urol 1992. DOI: 10.1016/s0022-5347(17)36995-1.
- Mingin GC, Nguyen HT, Baskin LS. Abnormal dimercapto-succinic acid scans predict an increased risk of breakthrough infection in children with vesicoureteral reflux. J Urol 2004; 172 (3): 1075–1077. DOI: 10.1097/01.ju.0000135750.17348.e4.
- Loukogeorgakis SP, Burnand K, MacDonald A. Renal scarring is the most significant predictor of breakthrough febrile urinary tract infection in patients with simplex and duplex primary vesico-ureteral reflux. J Pediatr Urol 2020; 16 (2). DOI: 10.1016/j.jpurol.2019.11.018.
- Wallace DM, Rothwell DL, Williams DI. The long-term follow-up of surgically treated vesicoureteric reflux. Br J Urol 1978; 50 (7): 10 1111 1464–1410 1978 06195. DOI: 10.1111/j.1464-410x.1978.tb06195.x.
- Edwards D, Normand IC, Prescod N. Disappearance of vesicoureteric reflux during long-term prophylaxis of urinary tract infection in children. Br Med J 1977; 2 (6082): 285–288. DOI: 10.1136/bmj.2.6082.285.
- Jodal U, Lindberg U. Guidelines for management of children with urinary tract infection and vesico-ureteric reflux. Recommendations from a Swedish state-of-the-art conference. Swedish Medical Research Council Acta Paediatr Suppl 1999; 88 (431): 87–89. DOI: 10.1111/j.1651-2227.1999.tb01323.x.
- Mor Y, Leibovitch I, Zalts R. Analysis of the long-term outcome of surgically corrected vesico-ureteric reflux. BJU Int 2003; 92 (1): 10 1046 1464–1410 2003 04264. DOI: 10.1046/j.1464-410x.2003.04264.x.
- Lebowitz RL. The detection and characterization of vesicoureteral reflux in the child. J Urol 1992. DOI: 10.1016/s0022-5347(17)36991-4.
- Dalirani R, Mahyar A, Sharifian M. The value of direct radionuclide cystography in the detection of vesicoureteral reflux in children with normal voiding cystourethrography. Pediatr Nephrol 2014; 29 (12): 10 1007 00467–00014–2871–. DOI: 10.1007/s00467-014-2871-y.
- McLaren CJ, Simpson ET. Direct comparison of radiology and nuclear medicine cystograms in young infants with vesico-ureteric reflux. BJU Int 2001; 87 (1): 10 1046 1464–1410 2001 00997. DOI: 10.1046/j.1464-410x.2001.00997.x.
- Frimberger D, Mercado-Deane MG, McKenna PH. Establishing a Standard Protocol for the Voiding Cystourethrography. Pediatrics 2016; 138 (5): 10 1542 2016–2590. DOI: 10.1542/9781610021494-part05-establishing_a_stand.
- Strauss KJ, Kaste SC. The ALARA (as low as reasonably achievable) concept in pediatric interventional and fluoroscopic imaging: striving to keep radiation doses as low as possible during fluoroscopy of pediatric patients\–a white paper executive summary. Radiology 2006; 240 (3): 621–622. DOI: 10.1148/radiol.2403060698.
- Arant BS Jr. Vesicoureteral reflux and evidence-based management. J Pediatr 2001; 139 (5): 620–621. DOI: 10.1067/mpd.2001.119451.
- Shiraishi K, Matsuyama H, Nepple KG. Validation of a prognostic calculator for prediction of early vesicoureteral reflux resolution in children. J Urol 2009; 182 (2): 690–691. DOI: 10.1016/j.juro.2009.04.036.
- Kim D, Choi YH, Choi G. Contrast-enhanced voiding urosonography for the diagnosis of vesicoureteral reflux and intrarenal reflux: a comparison of diagnostic performance with fluoroscopic voiding cystourethrography. Ultrasonography 2021; 40 (4): 530–537. DOI: 10.14366/usg.20157.
- Ntoulia A, Back SJ, Shellikeri S. Contrast-enhanced voiding urosonography (ceVUS) with the intravesical administration of the ultrasound contrast agent OptisonTM for vesicoureteral reflux detection in children: a prospective clinical trial. Pediatr Radiol 2018; 48 (2): 10 1007 00247–00017–4026–4023. DOI: 10.1007/s00247-017-4026-3.
- Elison BS, Taylor D, Wall H. Comparison of DMSA scintigraphy with intravenous urography for the detection of renal scarring and its correlation with vesicoureteric reflux. Br J Urol 1992; 69 (3): 10 1111 1464–1410 1992 15532. DOI: 10.1111/j.1464-410x.1992.tb15532.x.
- Majd M, Nussbaum Blask AR, Markle BM. Acute pyelonephritis: comparison of diagnosis with 99mTc-DMSA, SPECT, spiral CT, MR imaging, and power Doppler US in an experimental pig model. Radiology 2001; 218 (1): 101–108. DOI: 10.1148/radiology.218.1.r01ja37101.
- Hamoui N, Hagerty JA, Maizels M. Ultrasound fails to delineate significant renal pathology in children with urinary tract infections: a case for dimercapto-succinic acid scintigraphy. Suppl):1639-42; Discussion 1642 2008; 180(4. DOI: 10.1016/j.juro.2008.03.119.
- Smokvina A, Grbac-Ivanković S, Girotto N. The renal parenchyma evaluation: MAG3 vs. DMSA Coll Antropol 2005; 29 (2): 649–654.
- Sfakianakis GN, Cavagnaro F, Zilleruelo G. Diuretic MAG3 scintigraphy (F0) in acute pyelonephritis: regional parenchymal dysfunction and comparison with DMSA. J Nucl Med 2000; 41 (12): 1955–1963.
- Gordon I, Anderson PJ, Lythgoe MF. Can technetium-99m-mercaptoacetyltriglycine replace technetium-99m-dimercaptosuccinic acid in the exclusion of a focal renal defect? J Nucl Med 1992; 33 (12): 1334134.
- Lee RS, Cendron M, Kinnamon DD. Antenatal hydronephrosis as a predictor of postnatal outcome: a meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/PEDS.2006-0120.
- Herndon CDA, McKenna PH, Kolon TF. A multicenter outcomes analysis of patients with neonatal reflux presenting with prenatal hydronephrosis. J Urol 1999; 162 (3 Pt 2): 1203–1208. DOI: 10.1097/00005392-199909000-00096.
- Nguyen HT, Herndon CDA, Cooper C. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. J Pediatr Urol 2010; 6 (3): 212–231. DOI: 10.1016/J.JPUROL.2010.02.205.
- Upadhyay J, McLorie GA, Bolduc S. Natural history of neonatal reflux associated with prenatal hydronephrosis: Long-term results of a prospective study. J Urol 2003; 169 (5): 1837–1841. DOI: 10.1097/01.ju.0000062440.92454.cf.
- Berrocal T, Pinilla I, Gutiérrez J. Mild hydronephrosis in newborns and infants: can ultrasound predict the presence of vesicoureteral reflux. Pediatr Nephrol 2007; 22 (1): 91–96. DOI: 10.1007/S00467-006-0285-1.
- Farhat W, McLorie G, Geary D. The natural history of neonatal vesicoureteral reflux associated with antenatal hydronephrosis. J Urol 2000; 164 (3 Pt 2): 1057–1060. DOI: 10.1097/00005392-200009020-00033.
- M A, K W-L, BK V. Society for fetal urology recommendations for postnatal evaluation of prenatal hydronephrosis\–will fewer voiding cystourethrograms lead to more urinary tract infections? J Urol 2013. DOI: 10.1016/J.JURO.2013.03.038.
- Braga LH, Farrokhyar F, DĆruz J. Risk factors for febrile urinary tract infection in children with prenatal hydronephrosis: a prospective study. J Urol 2015. DOI: 10.1016/J.JURO.2014.10.091.
- Zee RS, Herndon CDA, Cooper CS. Time to resolution: A prospective evaluation from the Society for Fetal Urology hydronephrosis registry. J Pediatr Urol 2017; 13 (3). DOI: 10.1016/J.JPUROL.2016.12.012.
- Silay MS, Undre S, Nambiar AK. Role of antibiotic prophylaxis in antenatal hydronephrosis: A systematic review from the European Association of Urology/European Society for Paediatric Urology Guidelines Panel. J Pediatr Urol 2017; 13 (3): 306–315. DOI: 10.1016/J.JPUROL.2017.02.023.
- Braga LH, Mijovic H, Farrokhyar F. Antibiotic prophylaxis for urinary tract infections in antenatal hydronephrosis. Pediatrics 2013; 131 (1): 10 1542 2012–1870. DOI: 10.1542/peds.2012-1870.
- Easterbrook B, Capolicchio JP, Braga LH. Antibiotic prophylaxis for prevention of urinary tract infections in prenatal hydronephrosis: An updated systematic review. Can Urol Assoc J 2017; 11 (1-2Suppl1). DOI: 10.5489/CUAJ.4384.
- Zareba P, Lorenzo AJ, Braga LH. Risk factors for febrile urinary tract infection in infants with prenatal hydronephrosis: comprehensive single center analysis. J Urol 2014. DOI: 10.1016/J.JURO.2013.10.035.
- Coelho GM, Bouzada MCF, Pereira AK. Outcome of isolated antenatal hydronephrosis: a prospective cohort study. Pediatr Nephrology 2007; 22 (10): 1727–1734. DOI: 10.1007/S00467-007-0539-6.
- Szymanski KM, Al-Said AN, Pippi Salle JL. Do infants with mild prenatal hydronephrosis benefit from screening for vesicoureteral reflux? J Urol 2012; 188 (2): 576–581. DOI: 10.1016/J.JURO.2012.04.017.
- Routh JC, Grant FD, Kokorowski P. Costs and consequences of universal sibling screening for vesicoureteral reflux: decision analysis. Pediatrics 2010; 126 (5): 10 1542 2010–0744. DOI: 10.1542/peds.2010-0744d.
- Hunziker M, Colhoun E, Puri P. Renal cortical abnormalities in siblings of index patients with vesicoureteral reflux. Pediatrics 2014; 133 (4): 10 1542 2013–3498. DOI: 10.1542/peds.2013-3498d.
- Nelson CP, Finkelstein JA, Logvinenko T. Incidence of Urinary Tract Infection Among Siblings of Children With Vesicoureteral Reflux. Acad Pediatr 2016; 16 (5): 489–495. DOI: 10.1016/j.acap.2015.11.003.
- Skoog SJ, Peters CA, Arant BS Jr.. Pediatric Vesicoureteral Reflux Guidelines Panel Summary Report: Clinical Practice Guidelines for Screening Siblings of Children With Vesicoureteral Reflux and Neonates/Infants With Prenatal Hydronephrosis. J Urol 2010; 184 (3): 1145–1151. DOI: 10.1016/j.juro.2010.05.066.
- Urinary Tract Infection SCoQI S, Management RKB. Urinary Tract Infection: Clinical Practice Guideline for the Diagnosis and Management of the Initial UTI in Febrile Infants and Children 2 to 24 Months. Pediatrics 2011; 128 (3): 595–610. DOI: 10.1542/peds.2011-1330.
- Mattoo TK, Carpenter MA, Moxey-Mims M. The RIVUR trial: a factual interpretation of our data. Pediatr Nephrol 2015; 30 (5): 10 1007 00467–00014–3022–3021. DOI: 10.1007/s00467-014-3022-1.
- Shaikh N, Haralam MA, Kurs-Lasky M. Association of Renal Scarring With Number of Febrile Urinary Tract Infections in Children. JAMA Pediatrics 2019; 173 (10): 949–952. DOI: 10.1001/JAMAPediatrics.2019.2504.
- Coulthard MG, Flecknell P, Orr H. Renal scarring caused by vesicoureteric reflux and urinary infection: a study in pigs. Pediatr Nephrol 2002; 17 (7): 10 1007 00467–00002–0878–0872. DOI: 10.1007/s00467-002-0878-2.
- Montini G, Rigon L, Zucchetta P. Prophylaxis after first febrile urinary tract infection in children? A multicenter, randomized, controlled, noninferiority trial. Pediatrics 2008; 122 (5): 1064–1071. DOI: 10.1542/peds.2007-3770.
- Pennesi M, Travan L, Peratoner L. Is antibiotic prophylaxis in children with vesicoureteral reflux effective in preventing pyelonephritis and renal scars? A randomized, controlled trial. Pediatrics 2008; 121 (6): 10 1542 2007–2652. DOI: 10.1542/peds.2008-2339.
- Roussey-Kesler G, Gadjos V, Idres N. Antibiotic prophylaxis for the prevention of recurrent urinary tract infection in children with low grade vesicoureteral reflux: Results from a prospective randomized study. J Urol 2008; 179 (2): 674–679. DOI: 10.1016/J.JURO.2007.09.090.
- Conway PH, Cnaan A, Zaoutis T. Recurrent urinary tract infections in children: risk factors and association with prophylactic antimicrobials. JAMA 2007; 298 (2): 179–186. DOI: 10.1001/jama.298.2.179.
- Investigators RT, Hoberman A, Greenfield SP. Antimicrobial Prophylaxis for Children with Vesicoureteral Reflux. New Engl J Med 2014; 370 (25): 2367–2376. DOI: 10.1056/NEJMoa1401811.
- Cooper CS, Chung BI, Kirsch AJ. The outcome of stopping prophylactic antibiotics in older children with vesicoureteral reflux. J Urol 2000; 163 (1): 269–273. DOI: 10.1016/S0022-5347(05)68034-2.
- Thompson RH, Chen JJ, Pugach J. Cessation of prophylactic antibiotics for managing persistent vesicoureteral reflux. J Urol 2001; 166 (4): 1465–1469. DOI: 10.1097/00005392-200110000-00072.
- Jodal U, Koskimies O, Hanson E. Infection pattern in children with vesicoureteral reflux randomly allocated to operation or long-term antibacterial prophylaxis. The International Reflux Study in Children. J Urol 1992. DOI: 10.1016/s0022-5347(17)36994-x.
- Bailey RR. Commentary: the management of grades I and II (nondilating) vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37004-0.
- A prospective trial of operative versus non-operative treatment of severe vesico-ureteric reflux: 2 years\’observation in 96 children. The Birmingham Reflux Study Group. Contrib Nephrol 1984; 39 (169-85): 6744870. DOI: 10.1136/bmj.295.6592.237.
- Leslie B, Moore K, Salle JL. Outcome of antibiotic prophylaxis discontinuation in patients with persistent vesicoureteral reflux initially presenting with febrile urinary tract infection: time to event analysis. J Urol 2010; 184 (3): 1093–1098. DOI: 10.1016/j.juro.2010.05.013.
- Allen UD, MacDonald N, Fuite L. Risk factors for resistance to f́irst-line\’antimicrobials among urinary tract isolates of Escherichia coli in children. CMAJ 1999; 160 (10): 1436–1440.
- Cheng CH, Tsai MH, Huang YC. Antibiotic Resistance Patterns of Community-Acquired Urinary Tract Infections in Children With Vesicoureteral Reflux Receiving Prophylactic Antibiotic Therapy. Pediatrics 2008; 122 (6): 1212–1217. DOI: 10.1542/peds.2007-2926.
- Cooper CS. Fat, demented and stupid: An unrecognized legacy of pediatric urology? J Pediatr Urol 2017; 13 (4): 341–344. DOI: 10.1016/J.JPUROL.2017.04.027.
- Guidos PJ, Arlen AM, Leong T. Impact of continuous low-dose antibiotic prophylaxis on growth in children with vesicoureteral reflux. J Pediatr Urol 2018; 14 (4). DOI: 10.1016/J.JPUROL.2018.07.007.
- Gaither TW, Cooper CS, Kornberg Z. Predictors of becoming overweight among pediatric patients at risk for urinary tract infections. J Pediatr Urol 2019; 15 (1). DOI: 10.1016/J.JPUROL.2018.09.002.
- Akagawa Y, Kimata T, Akagawa S. Impact of Long-Term Low Dose Antibiotic Prophylaxis on Gut Microbiota in Children. J Urol 2020; 204 (6): 1320–1325. DOI: 10.1097/JU.0000000000001227.
- Copp HL, Nelson CP, Shortliffe LD. Compliance with antibiotic prophylaxis in children with vesicoureteral reflux: results from a national pharmacy claims database. J Urol 2010; 183 (5): 1994–2000. DOI: 10.1016/J.JURO.2010.01.036.
- Fast AM, Nees SN, Batavia JP. Outcomes of targeted treatment for vesicoureteral reflux in children with nonneurogenic lower urinary tract dysfunction. J Urol 2013; 190 (3): 1028–1032. DOI: 10.1016/j.juro.2013.03.005.
- Smellie JM. Commentary: management of children with severe vesicoureteral reflux. J Urol 1992. DOI: 10.1016/s0022-5347(17)37000-3.
- J BM, editor. Prospective trial of operative versus non-operative treatment of severe vesicoureteric reflux in children: five years\’observation. Birmingham Reflux Study Group. 1987; 295 (6592): 237–241. DOI: 10.1136/bmj.295.6592.237.
- Elo J, Tallgren LG, Alfthan O. Character of urinary tract infections and pyelonephritic renal scarring after antireflux surgery. J Urol 1983; 129 (2): 6834504. DOI: 10.1016/s0022-5347(17)52089-3.
- Belman AB. Vesicoureteral reflux. Pediatr Clin North Am 1997; 44 (5): 9326957. DOI: 10.53347/rid-12076.
- Ransley PG, Risdon RA. The pathogenesis of reflux nephropathy. Contrib Nephrol 1979; 16: 90–97. DOI: 10.1159/000402880.
- Molitierno JA, Scherz HC, Kirsch AJ. Endoscopic treatment of vesicoureteral reflux using dextranomer hyaluronic acid copolymer. J Pediatr Urol 2008; 4 (3): 221–228. DOI: 10.1016/j.jpurol.2007.11.015.
- Stenberg AM, Sundin A, Larsson BS. Lack of distant migration after injection of a 125iodine labeled dextranomer based implant into the rabbit bladder. J Urol 1997; 158 (5): 10 1016 0022–5347 01 64185–64185. DOI: 10.1016/s0022-5347(01)64185-5.
- Läckgren G, Wåhlin N, Sköldenberg E. Long-term followup of children treated with dextranomer/hyaluronic acid copolymer for vesicoureteral reflux. J Urol 2001; 166 (5): 10 1016 0022–5347 05 65713–65718. DOI: 10.1097/00005392-200111000-00076.
- Kirsch AJ, Perez-Brayfield MR, Scherz HC. Minimally invasive treatment of vesicoureteral reflux with endoscopic injection of dextranomer/hyaluronic acid copolymer: the Childrenś Hospitals of Atlanta experience. J Urol 2003; 170 (1): 211–215. DOI: 10.1097/01.ju.0000072523.43060.a0.
- Dave S, Lorenzo AJ, Khoury AE. Learning from the learning curve: factors associated with successful endoscopic correction of vesicoureteral reflux using dextranomer/hyaluronic acid copolymer. J Urol 2008; 180(4: 1594–1599. DOI: 10.1016/j.juro.2008.03.084.
- Kirsch AJ, Perez-Brayfield M, Smith EA. The modified sting procedure to correct vesicoureteral reflux: improved results with submucosal implantation within the intramural ureter. J Urol 2004; 171 (6 Pt 1): 2413–2416. DOI: 10.1097/01.ju.0000127754.79866.7f.
- McMann LP, Scherz HC, Kirsch AJ. Long-term preservation of dextranomer/hyaluronic acid copolymer implants after endoscopic treatment of vesicoureteral reflux in children: a sonographic volumetric analysis. J Urol 2007; 177 (1): 320. DOI: 10.1016/j.juro.2006.08.144.
- Baydilli N, Selvi I, Pinarbasi AS. Additional VCUG-related parameters for predicting the success of endoscopic injection in children with primary vesicoureteral reflux. J Pediatr Urol 2021; 17 (1). DOI: 10.1016/j.jpurol.2020.11.018.
- Kirsch AJ, Cooper CS, Läckgren G. Non-Animal Stabilized Hyaluronic Acid/Dextranomer Gel (NASHA/Dx, Deflux) for Endoscopic Treatment of Vesicoureteral Reflux: What Have We Learned Over the Last 20 Years? Urology 2021; 157: 15–28. DOI: 10.1016/j.urology.2021.07.032.
- Routh JC, Inman BA, Reinberg Y. Dextranomer/hyaluronic acid for pediatric vesicoureteral reflux: systematic review. Pediatrics 2010; 125 (5): 10 1542 2009–2225. DOI: 10.1016/j.yped.2011.04.057.
- Elder JS, Diaz M, Caldamone AA. Endoscopic therapy for vesicoureteral reflux: a meta-analysis. I. Reflux resolution and urinary tract infection. J Urol 2006; 175 (2): 10 1016 0022–5347 05 00210–00217. DOI: 10.1016/s0084-4071(08)70406-8.
- Arlen AM, Scherz HC, Filimon E. Is routine voiding cystourethrogram necessary following double hit for primary vesicoureteral reflux? J Pediatr Urol 2015; 11 (1). DOI: 10.1016/j.jpurol.2014.11.011.
- Wang PZT, Abdelhalim A, Walia A. Avoiding routine postoperative voiding cystourethrogram: Predicting radiologic success for endoscopically treated vesicoureteral reflux. Can Urol Assoc J 2019; 13 (5). DOI: 10.5489/cuaj.5589.
- Knudson MJ, Cooper CS, Block CA. Calcification of glutaraldehyde cross-linked collagen in bladder neck injections in children with incontinence: a long-term complication. J Urol 2006; 176 (3): 1143–1146. DOI: 10.1016/j.juro.2006.04.059.
- Gargollo PC, Paltiel HJ, Rosoklija I. Mound calcification after endoscopic treatment of vesicoureteral reflux with autologous chondrocytes\–a normal variant of mound appearance? J Urol 2009; 181 (6): 2707–2708. DOI: 10.1016/j.juro.2009.02.053.
- Noe HN. Calcification in a Deflux bleb thought to be a ureteral calculus in a child. J Pediatr Urol 2008; 4 (1): 88–89. DOI: 10.1016/j.jpurol.2007.02.005.
- Vandersteen DR, Routh JC, Kirsch AJ. Postoperative ureteral obstruction after subureteral injection of dextranomer/hyaluronic Acid copolymer. J Urol 2006; 176(4. DOI: 10.1016/j.juro.2006.06.101.
- Papagiannopoulos D, Rosoklija I, Cheng E. Delayed Obstruction With Asymptomatic Loss of Renal Function After Dextranomer/Hyaluronic Acid Copolymer (Deflux) Injection for Vesicoureteral Reflux: A Close Look at a Disturbing Outcome. Urology 2017; 101: 63–66. DOI: 10.1016/j.urology.2016.09.013.
- Romain J, Fourcade L, Centi J. Delayed-onset Ureteral Obstruction and Calcification Masquerading as Renal Colic Following Deflux Injection. Urology 2016; 94: 218–220. DOI: 10.1016/j.urology.2016.03.001.
- Christen S, Mendoza M, Gobet R. Late ureteral obstruction after injection of dextranomer/hyaluronic acid copolymer. Urology 2014; 83 (4): 920–922. DOI: 10.1016/j.urology.2013.10.053.
- Austin JC, Cooper CS. Vesicoureteral reflux: surgical approaches. Urol Clin North Am 2004; 31 (3): 543–557. DOI: 10.1016/j.ucl.2004.04.018.
- Sprunger JK, Reese CT, Decter RM. Can standard open pediatric urological procedures be performed on an outpatient basis? J Urol 2001; 166 (3): 1062–1064. DOI: 10.1097/00005392-200109000-00083.
- Marotte JB, Smith DP. Extravesical ureteral reimplantations for the correction of primary reflux can be done as outpatient procedures. J Urol 2001; 165 (6 Pt 2): 10 1097 00005392–200106001–00003. DOI: 10.1016/s0022-5347(05)66171-x.
- Palmer JS. Bilateral extravesical ureteral reimplantation in toilet-trained children: short-stay procedure without urinary retention. Urology 2009; 73 (2): 285–288. DOI: 10.1016/j.urology.2008.07.046.
- Barrieras D, Lapointe S, Reddy PP. Are postoperative studies justified after extravescial ureteral reimplantation? J Urol 2000; 164(3. DOI: 10.1097/00005392-200009020-00035.
- Bisignani G, Decter RM. Voiding cystourethrography after uncomplicated ureteral reimplantation in children: is it necessary? J Urol 1997; 158(3. DOI: 10.1016/s0022-5347(01)64437-9.
- El-Ghoneimi A, Odet E, Lamer S. Cystography after the Cohen ureterovesical reimplantation: is it necessary at a training center? J Urol 1999; 162(3. DOI: 10.1016/s0022-5347(01)68133-3.
- Harel M, Herbst KW, Silvis R. Objective pain assessment after ureteral reimplantation: comparison of open versus robotic approach. J Pediatr Urol 2015; 11 (2). DOI: 10.1016/j.jpurol.2014.12.007.
- Boysen WR, Ellison JS, Kim C. Multi-Institutional Review of Outcomes and Complications of Robot-Assisted Laparoscopic Extravesical Ureteral Reimplantation for Treatment of Primary Vesicoureteral Reflux in Children. J Urol 2017; 197 (6): 1555–1561. DOI: 10.1016/j.juro.2017.01.062.
- Kurtz MP, Leow JJ, Varda BK. Robotic versus open pediatric ureteral reimplantation: Costs and complications from a nationwide sample. J Pediatr Urol 2016; 12 (6). DOI: 10.1016/j.jpurol.2016.06.016.
- Bowen DK, Faasse MA, Liu DB. Use of Pediatric Open, Laparoscopic and Robot-Assisted Laparoscopic Ureteral Reimplantation in the United States: 2000 to 2012. J Urol 2016; 196 (1): 207–212. DOI: 10.1016/j.juro.2016.02.065.
- Rolleston GL, Maling TM, Hodson CJ. Intrarenal reflux and the scarred kidney. Arch Dis Child 1974; 49 (7): 531–539. DOI: 10.1136/adc.49.7.531.
- Austin JC. Treatment of vesicoureteral reflux after puberty. Adv Urol 2008; 2008 (590185). DOI: 10.1155/2008/590185.
Última actualización: 2025-09-21 13:35