14: Hidronefrosis y obstrucción de la unión pieloureteral
Este capítulo durará aproximadamente 27 minutos para leer.
Introducción
La hidronefrosis se define como la dilatación aséptica de la pelvis renal con o sin dilatación de los cálices. Si ocurre antes del nacimiento, se denomina hidronefrosis antenatal (ANH). La presencia de hidronefrosis infectada indica pionefrosis, mientras que la presencia de un uréter dilatado junto con una pelvis renal dilatada se denomina hidroureteronefrosis (HUN).
La importancia de ANH se atribuye a que es la anomalía del tracto urinario fetal detectada por ultrasonografía con mayor frecuencia.1 La mayoría de los casos de ANH son temporales y se resuelven de manera espontánea. Las otras causas patológicas de ANH pueden ser obstructivas o no obstructivas. Las causas obstructivas pueden ocurrir en cualquier parte del tracto urinario, pero la patología más común es la obstrucción de la unión ureteropélvica (UPJO). Las etiologías no obstructivas comprenden el reflujo vesicoureteral (VUR), el megauréter no obstructivo y sin reflujo, el síndrome de Prune-Belly, etc.
Los urólogos pediátricos utilizan muchas herramientas para medir la gravedad de la ANH. La escuela norteamericana se basa principalmente en el sistema de clasificación de la Society of Fetal Urology (SFU), mientras que en Europa se prefiere medir el APRPD.2
La UPJO se define como una alteración del flujo de orina desde la pelvis renal hacia el uréter, con la consiguiente dilatación del sistema pielocalicial. La presencia de una pelvis renal dilatada con un uréter no dilatado en RBUS plantea la sospecha de UPJO.
Este capítulo abordará la embriología, epidemiología, etiología, diagnóstico, evaluación, opciones de tratamiento, seguimiento y complicaciones de la ANH y la UPJO. Las causas restantes de la ANH se tratarán en otros capítulos.
Embriología
Los riñones se desarrollan a partir de tres estructuras secuenciales superpuestas; el pronefros, el mesonefros y el metanefros, que derivan todos de una región del mesodermo intermedio conocida como la cresta urogenital.3 En la cuarta semana de gestación, el pronefros se origina en la región cervical. Luego, partes segmentadas del mesodermo intermedio se conectan para formar el conducto pronéfrico, que se extiende desde la región cervical hasta el extremo distal del embrión (cloaca). El pronefros no es funcional y involuciona por completo al final de la cuarta semana de gestación.
Después de eso, el mesonefros emerge caudal al pronefros y la persistencia del conducto pronéfrico induce la formación de túbulos mesonéfricos a partir del mesodermo intermedio, que se abren en el conducto pronéfrico formando el conducto mesonéfrico (de Wolff). El brote ureteral surge de la porción posterior del conducto mesonéfrico.
El metanefros aparece en la quinta semana del desarrollo. Posteriormente, la yema ureteral se une al casquete metanéfrico. La yema ureteral da lugar a la mucosa del uréter, la pelvis renal, los cálices mayores y menores, y los conductos colectores. El mesénquima que rodea la yema ureteral forma la lámina propia, la capa muscular y la adventicia del uréter y de la pelvis renal. El desarrollo adecuado del uréter y la pelvis renal depende de la señalización recíproca entre sus componentes mesenquimatosos y epiteliales. La señalización anómala da lugar a un desarrollo y una ramificación inadecuados de la yema ureteral. La duplicación ureteral completa resulta del desarrollo de dos yemas ureterales en el mismo lado, mientras que la duplicación ureteral incompleta surge de una bifurcación temprana de la yema ureteral. En caso de una bifurcación tardía de la yema ureteral, se forma una pelvis renal bífida. La ley de Weigert-Meyer describe la relación entre los dos uréteres en la duplicación ureteral completa. El uréter del sistema superior se inserta en la vejiga en posición inferomedial, y es el sitio de obstrucción por un ureterocele o por un uréter ectópico. Por otro lado, el uréter del sistema inferior se inserta superolateralmente en la vejiga, lo que lo hace propenso al VUR debido al corto túnel intramural. Además, puede verse afectado por UPJO.
Finalmente, la canalización ureteral y la maduración de la pared ureteral tienen lugar al final de la embriogénesis. No obstante, esta última continúa más allá del nacimiento y esto podría explicar la resolución espontánea de muchos casos diagnosticados con ANH. El riñón fetal empieza a producir orina entre las semanas 5 y 9 de gestación. La orina representa alrededor del 90% del líquido amniótico, que, a su vez, es responsable de la expansión de los alvéolos pulmonares. Por lo tanto, el oligohidramnios se asocia con hipoplasia pulmonar, que se presenta clínicamente como distrés respiratorio. El seno urogenital da origen a la vejiga y la uretra entre las semanas 10 y 12 de gestación.
Epidemiología
La ANH es la anomalía más frecuente del tracto urinario detectada por ecografía fetal. Afecta del uno al cinco por ciento de todos los embarazos. Afortunadamente, hasta el 80% de los casos son transitorios y se resuelven espontáneamente. La UPJO es la causa más frecuente de ANH patológica y suele tratarse mediante intervención quirúrgica. Afecta a los varones el doble que a las niñas y el lado izquierdo se ve afectado el doble que el derecho. La UPJO puede afectar a ambos riñones en el 10% al 30% de los casos.
La UPJO suele ser esporádica, pero en la literatura se describieron seis casos con antecedentes familiares.4 La UPJO puede presentarse con otras anomalías urológicas (p. ej., VUR, riñón displásico multiquístico (MCDK), riñón en herradura o riñón duplicado, en el que el hemirriñón inferior es el sitio afectado con mayor frecuencia).
Etiología/Patogénesis
La mayoría de los casos de ANH son transitorios y mejoran espontáneamente con el tiempo. Las causas patológicas que no se resuelven posnatalmente pueden deberse a causas obstructivas o no obstructivas. Las causas obstructivas incluyen; UPJO, megauréter obstructivo, ureterocele, uréter ectópico, válvula uretral posterior (PUV), atresia uretral, además de vejiga neuropática. Las etiologías no obstructivas comprenden; VUR, megauréter no obstructivo y no refluyente, síndrome de Prune-Belly.
La obstrucción se acompaña de una reducción del flujo sanguíneo renal (RBF), de la tasa de filtración glomerular (GFR) y de la excreción de potasio, según Josephson et al., y solo un porcentaje ínfimo de este daño se mitiga con una intervención temprana.5
Causas de la UPJO
La OUP primaria puede deberse a causas intrínsecas, extrínsecas o intraluminales.6 La obstrucción intrínseca se debe a un segmento aperistáltico resultante de una musculatura anómala o de un desarrollo neurológico anómalo. Esto da lugar a un flujo urinario inapropiado desde la pelvis renal hacia el uréter. Otras causas de obstrucción intrínseca incluyen un segmento estenótico debido a deposición excesiva de colágeno y pliegues ureterales congénitos.
La obstrucción extrínseca está causada por un vaso aberrante que cruza por delante de la unión pieloureteral (UPJ). Este tipo de obstrucción suele ser intermitente y se presenta más tarde, a partir de los siete años de edad. La obstrucción intraluminal se debe a un pólipo fibroepitelial. Esta patología puede afectar cualquier parte del tracto urinario, desde la UPJ hasta la uretra.7 La UPJO secundaria se debe a cirugía previa, VUR, cálculo impactado y estenosis posinflamatoria.
Las anomalías asociadas a la UPJO incluyen; UPJO contralateral (10-30%), displasia renal contralateral, MCDK contralateral, agenesia renal unilateral (5%), sistema colector duplicado donde la UPJO suele ocurrir en el hemirriñón inferior, riñón en herradura, riñón ectópico, VUR (20-40%) y síndrome VACTERL.8,9
Para evitar un aumento progresivo de la presión intrapélvica, la pelvis renal se dilata para acomodarlo, lo que previene el daño renal. Sin embargo, la obstrucción prolongada, con fracaso de los mecanismos compensatorios y pérdida de distensibilidad, da lugar a un aumento de la presión intrarrenal con daño renal subsiguiente. Cuanto más precoz sea la obstrucción durante la vida fetal, mayor será el daño renal esperado. La crisis de Dietl es un dolor abdominal intermitente que surge de la distensión del sistema pielocalicial y suele estar causada por un vaso cruzado que provoca una obstrucción de la unión pieloureteral (UPJO) en niños mayores de cinco años.10
Evaluación y diagnóstico
El diagnóstico de ANH se basa en la medición del APRPD que es de cinco mm o más en el segundo trimestre y de siete mm o más en el tercer trimestre.11 La interpretación de la RBUS fetal incluye los siguientes elementos; sexo fetal, índice de líquido amniótico (AFI), edad gestacional, anomalías congénitas asociadas, hidronefrosis unilateral o bilateral, grado de hidronefrosis, APRPD, estado del parénquima en forma de grosor parenquimatoso y ecogenicidad, dilatación ureteral, plenitud vesical y ciclado además del grosor de su pared, y dilatación uretral (Tabla 1).
Tabla 1 Las diez preguntas que deben abordarse en la evaluación de la hidronefrosis antenatal.
| 10 preguntas | Pregunta |
|---|---|
| 1 pregunta relacionada con el líquido amniótico | Índice de líquido amniótico (ILA) |
| 3 preguntas relacionadas con el feto | Masculino o femenino |
| Edad gestacional | |
| Otras anomalías congénitas | |
| 3 preguntas relacionadas con el riñón | Grado y lateralidad de la hidronefrosis |
| Dilatación del uréter superior | |
| Parénquima renal (espesor del parénquima y ecogenicidad) | |
| 3 preguntas relacionadas con el resto del tracto urinario | Dilatación del uréter inferior |
| Vejiga (llenado vesical y grosor de la pared vesical) | |
| Dilatación de la uretra posterior |
Un grosor de la pared vesical en vejiga llena mayor de dos mm indica engrosamiento de la pared vesical independientemente de la edad gestacional.12 La imposibilidad de visualizar la vejiga en varias ocasiones es un signo de extrofia vesical. En las PUV, puede observarse una vejiga llena con dilatación de la uretra posterior, lo que da el “signo de ojo de cerradura”.
En el segundo trimestre, la ANH se clasifica en leve, moderada y grave cuando el APRPD es de cuatro a seis mm, de siete a diez mm y más de diez mm, respectivamente. En el tercer trimestre, la hidronefrosis prenatal se clasifica en los mismos grados anteriores cuando el APRPD mide de siete a nueve mm, de diez a 15 mm y más de 15 mm, respectivamente (Tabla 2).11
Tabla 2 Categorías de hidronefrosis antenatal.
| Grado | 2º trimestre | 3º trimestre | % de ANH |
|---|---|---|---|
| leve | 4-7 mm | 7-9 mm | 56-88% |
| moderado | 7-10 mm | 9-15 mm | 10-30% |
| grave | >10 mm | >15 mm | 2-13% |
El bebé debe ser reevaluado entre tres y siete días después del nacimiento y no antes, para evitar resultados falsos negativos causados por la oliguria transitoria del recién nacido, especialmente en las primeras 48 horas de vida. No obstante, la RBUS se realiza inmediatamente después del parto en casos de hidronefrosis bilateral de alto grado, riñón único, oligohidramnios o cuando se sospecha PUV.
En Norteamérica, se utiliza el sistema de clasificación SFU para clasificar la hidronefrosis, mientras que en Europa se utiliza el APRPD. La clasificación de la hidronefrosis según la SFU se muestra en Tabla 3.13
Tabla 3 Sistema de clasificación de la SFU.
| Grado SFU | Descriptores |
|---|---|
| Grado 0 | sin dilatación, las paredes caliciales están enfrentadas entre sí |
| Grado 1 (leve) | dilatación de la pelvis renal sin dilatación de los cálices (también puede ocurrir en la pelvis extrarrenal) |
| sin atrofia parenquimatosa | |
| Grado 2 (leve) | dilatación de la pelvis renal (leve) y de los cálices (se mantiene el patrón pielocalicial) |
| sin atrofia parenquimatosa | |
| Grado 3 (moderado) | dilatación moderada de la pelvis renal y de los cálices |
| embotamiento de los fórnices y aplanamiento de las papilas | |
| puede observarse un adelgazamiento cortical leve | |
| Grado 4 (severo) | dilatación marcada de la pelvis renal y de los cálices, que aparecen balonizados |
| pérdida de los límites entre la pelvis renal y los cálices | |
| atrofia renal evidenciada como adelgazamiento cortical |
La desventaja del sistema de clasificación de la SFU es que resulta algo subjetivo al no utilizar las mediciones del APRPD, lo que dificulta su correlación con las mediciones de ANH. Basándose en el APRPD, la hidronefrosis se clasifica en leve, moderada y marcada, con valores de APRPD de 7-10 mm, 10-15 mm y por encima de 15 mm, respectivamente.14 El inconveniente de esta clasificación es que depende de un solo elemento para graduar la hidronefrosis y descuida otros parámetros, como el grosor del parénquima y la dilatación calicial periférica.
Por lo tanto, se ha propuesto una nueva clasificación de la hidronefrosis para evitar las desventajas de los dos sistemas de graduación previos. El sistema de clasificación de la dilatación del tracto urinario (UTD) se basa en seis hallazgos de la RBUS; APRPD, dilatación calicial con la distinción entre dilatación calicial central y periférica en el periodo posnatal, espesor del parénquima renal, aspecto del parénquima renal, anomalías vesicales y anomalías ureterales. Este sistema de graduación diferencia si los hallazgos de la RBUS fueron antenatales (normal, A1, A2, A3) o posnatales (normal, P1, P2, P3).15
Si la RBUS no presenta hallazgos relevantes, debe repetirse tras cuatro a seis semanas. En caso de grado 0 de la SFU con APRPD menor de siete mm como resultado de la RBUS realizada entre la cuarta y la sexta semana, no se requiere seguimiento adicional. El efecto del grado de hidronefrosis sobre la tasa de resolución fue estudiado por.16
Si se detecta hidronefrosis posnatal en presencia de dilatación ureteral o sospecha de una vejiga anómala, debe solicitarse una cistouretrografía miccional (VCUG) para excluir VUR, PUV en niños (Figura 1), disfunción vesical neuropática o no neuropática.
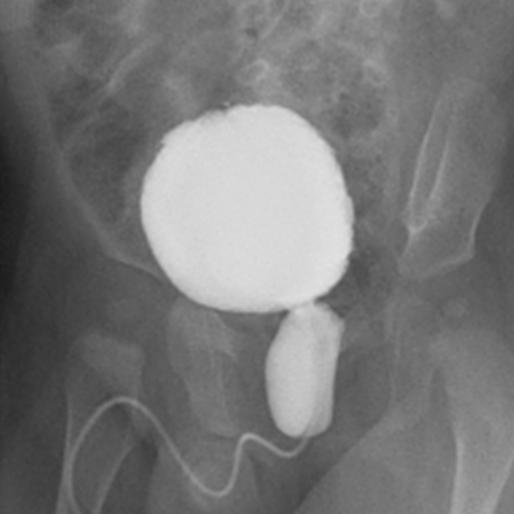
Figura 1 Cistouretrografía miccional que muestra el aspecto clásico de la válvula uretral posterior.
En presencia de hidronefrosis posnatal de grado 1 a 2 según la SFU o APRPD de menos de 15 mm sin dilatación ureteral ni vejiga anormal en un lactante asintomático, la RBUS debe realizarse cada tres a seis meses, y luego cada seis a doce meses.17 La resolución espontánea de la hidronefrosis suele esperarse en los dos primeros años de vida.
Por otro lado, la hidronefrosis de grado 3 a 4 según la SFU o un APRPD de 15 mm o más indica un seguimiento más estrecho. En tal situación, se necesita una VCUG para descartar VUR, PUV o patología vesical. Si la VCUG es normal, se recomienda un renograma dinámico, especialmente con MAG3, para estimar la función renal diferencial y la presencia de obstrucción.
La UPJO se presenta prenatalmente o después del nacimiento. En el período prenatal, la UPJO es la causa más frecuente de ANH patológica 18. Posnatalmente, el paciente puede estar asintomático con hidronefrosis descubierta de forma incidental o puede presentarse con fiebre alta por un riñón infectado y obstruido, o con dolor en el flanco en niños mayores. En niños mayores de cinco años con obstrucción intermitente, debe sospecharse la presencia de un vaso cruzado aberrante.
La hematuria es una forma de presentación poco frecuente y suele seguir a un traumatismo en el flanco, porque el riñón hidronefrótico es más susceptible a traumatismos que el riñón normal. La masa palpable en el flanco se observa rara vez en la era de la ultrasonografía.
La RBUS por sí sola puede proporcionar un diagnóstico provisional de la patología subyacente que causa la ANH. La dilatación de la pelvis renal con un uréter no dilatado indica UPJO (Figura 2) mientras que un uréter dilatado puede deberse a VUR o megauréter. En la MCDK, los quistes renales no están conectados entre sí y el parénquima renal no se conserva, mientras que los quistes renales suelen ser bilaterales y comunicantes, con parénquima renal preservado. El ureterocele aparece como un quiste dentro de un quiste (la vejiga), y se asocia con el polo superior de sistemas renales duplicados en el 80% de los casos, mientras que el 20% restante son ureteroceles de sistema único que requieren punción para la descompresión del sistema. La apariencia en ojo de cerradura de una vejiga dilatada y la uretra posterior en niños es diagnóstica de PUV.
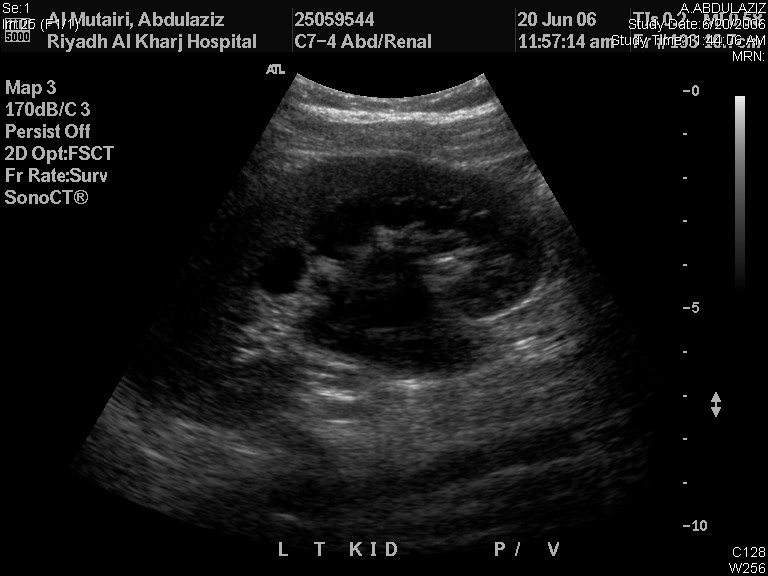
Figura 2 Ecografía renal y vesical que muestra UPJO izquierda
No se puede pasar por alto el papel de la gammagrafía renal. Se utilizan tres tipos de gammagrafía renal: mercaptoacetiltriglicina (MAG3), ácido dietilentriaminopentaacético (DTPA) y ácido dimercaptosuccínico (DMSA).18 Todas están marcadas con tecnecio-99 metaestable (99mTc). El MAG3 presenta excreción tubular y glomerular. El DTPA solo se filtra por los glomérulos; por eso no debe solicitarse en caso de insuficiencia renal. El DMSA se une únicamente a los túbulos renales proximales. La vida media (t1/2) del 99mTc es de seis horas. Muchos centros de Norteamérica tienen disponibilidad limitada del radiofármaco DMSA, lo que limita la capacidad de realizar este tipo de estudio de medicina nuclear.
MAG3 y DTPA son estudios dinámicos y funcionales a diferencia de DMSA. Aportan información sobre la función renal diferencial y la presencia de obstrucción mediante la adquisición de imágenes seriadas a lo largo del tiempo, evaluando la captación, la excreción y el drenaje. Sin embargo, en niños se prefiere el MAG3. La DMSA es una escintigrafía estática que puede detectar no solo la función diferencial, sino también la presencia de cicatrices renales. La renografía se realiza de la cuarta a la sexta semana para asegurar que se haya alcanzado la maduración renal.19
Si la gammagrafía renal se realiza antes de la maduración renal, el estudio puede mostrar una alta actividad cortical residual, reteniendo hasta el 50% o más del pico. MAG3 o DTPA se solicitan cuando se sospecha UPJO o UVJ, mientras que la DMSA puede realizarse en casos de VUR como parte de un enfoque de arriba hacia abajo (Figura 3) Los renogramas tienen tres fases. La primera es la fase vascular, que refleja el flujo sanguíneo renal y dura hasta diez segundos. La segunda es la fase parenquimatosa, que representa la captación renal y ocurre desde el segundo 10 hasta el quinto minuto tras la inyección del isótopo. Finalmente, sigue la fase excretora, que representa la excreción del radioisótopo hacia la pelvis renal.
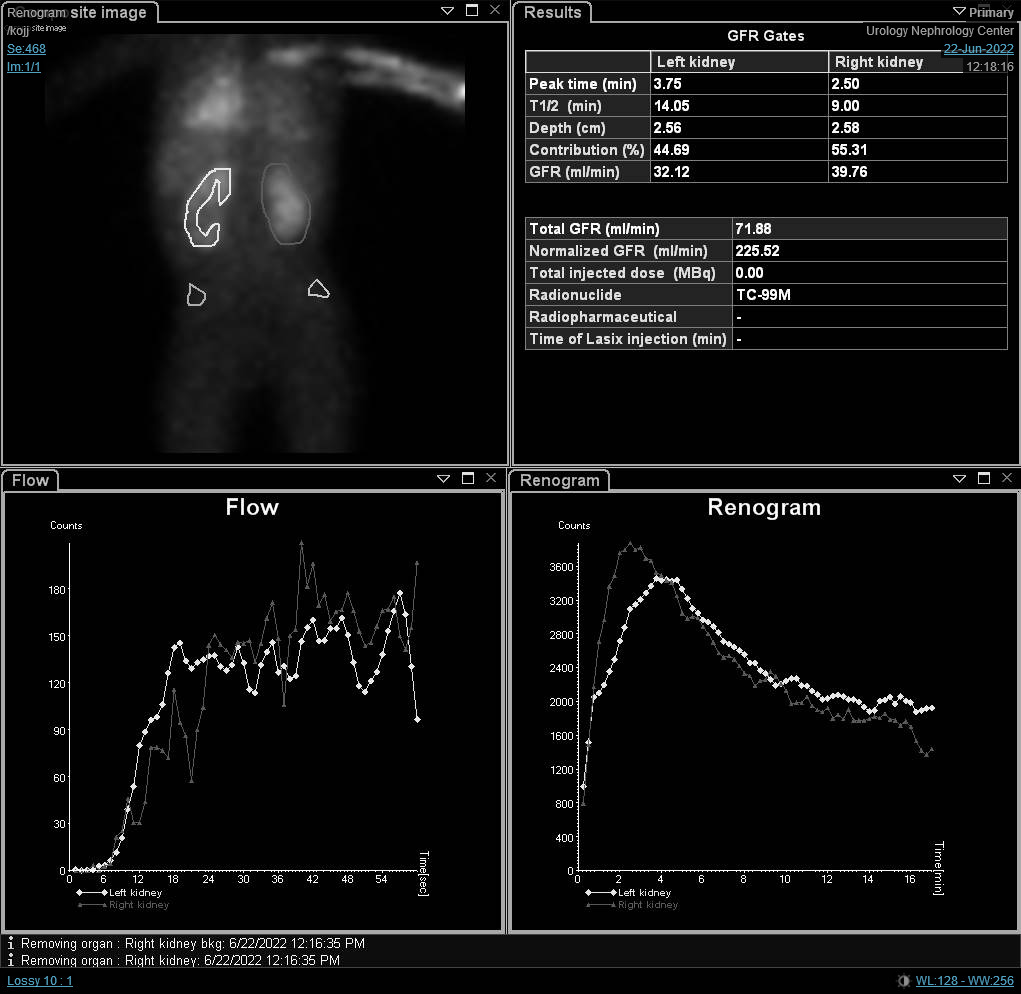
Figura 3 Cintigrafía renal con DMSA que muestra disminución de la captación del radioisótopo y cicatrización renal en el lado izquierdo
Se tienen en cuenta algunas precauciones antes de la gammagrafía renal, p. ej., hidratación adecuada o incluso perfusión intravenosa de solución salina fisiológica a una velocidad de 10 mL/ kg con un mantenimiento de 4 mL/kg /hora y colocación de un catéter uretral para vaciar la vejiga y evitar resultados falsos positivos de obstrucción. No hay consenso respecto al momento de la inyección del diurético. De forma rutinaria, se inyecta 20 minutos después del isótopo radiactivo (F+20). Para evitar el acúmulo del isótopo en sistemas pielocaliciales dilatados, se recomienda inyectar furosemida 15 minutos antes del material radiactivo (F-15). Otros autores abogan por inyectar la furosemida al mismo tiempo que el isótopo radiactivo (F+0). La dosis de furosemida (Lasix) es de 1 mg/kg en la lactancia temprana y de 0,5 mg/ kg posteriormente, con una dosis máxima de 40 mg.
Aunque la función diferencial es la variable más significativa en la gammagrafía renal, las curvas renográficas y la t1/2 pueden indicar un diagnóstico provisional de obstrucción. O’Reilly describió cuatro curvas para el renograma dinámico; la curva tipo I que representa captación y excreción normales (curva en forma de campana) (Figura 4), la curva tipo II que representa un patrón obstructivo sin respuesta al diurético (Figura 5) y Figura 6), la curva tipo IIIa que inicialmente asciende y luego desciende tras la inyección de diurético, la curva tipo IIIb que inicialmente asciende y luego ni desciende ni continúa ascendiendo (equívoca), y la tipo IV en la que se produce una descompensación tardía 15 minutos tras la inyección de furosemida.20
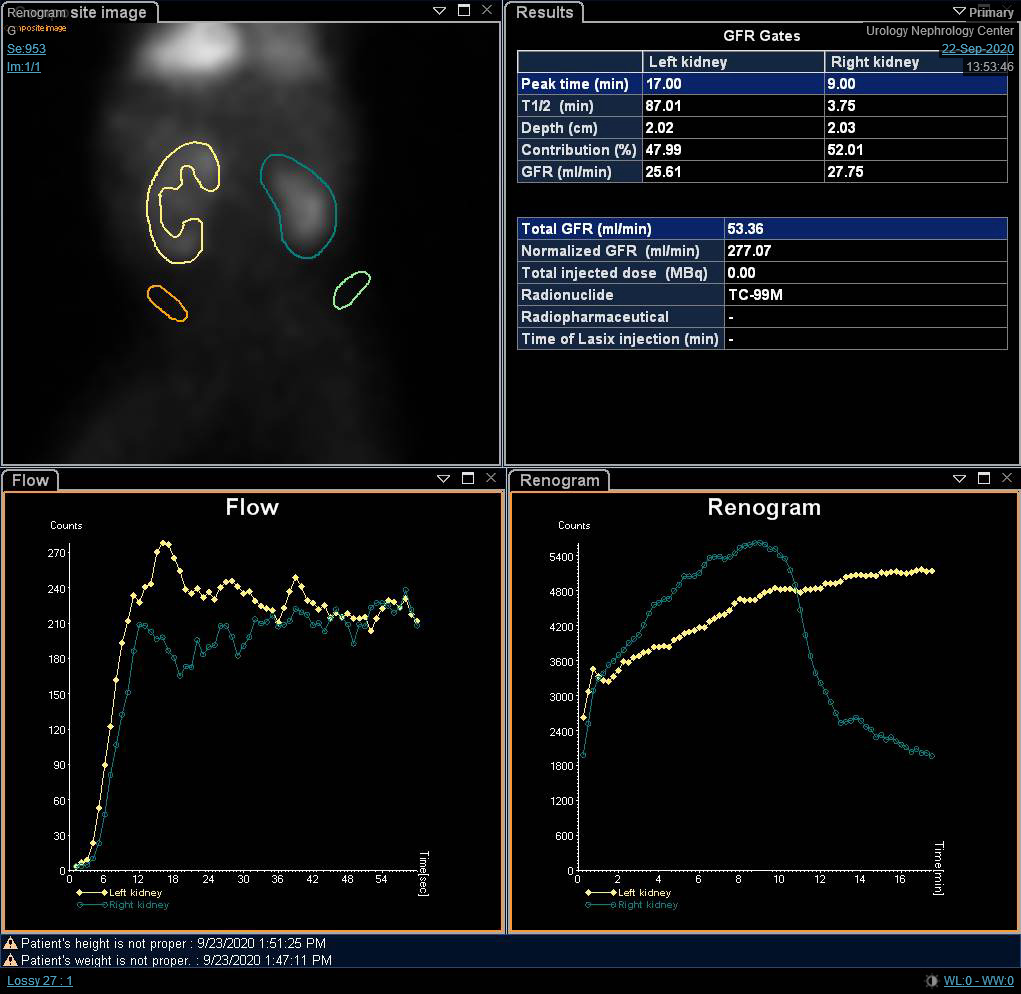
Figura 4 Renograma con DTPA que muestra curva no obstructiva en forma de campana
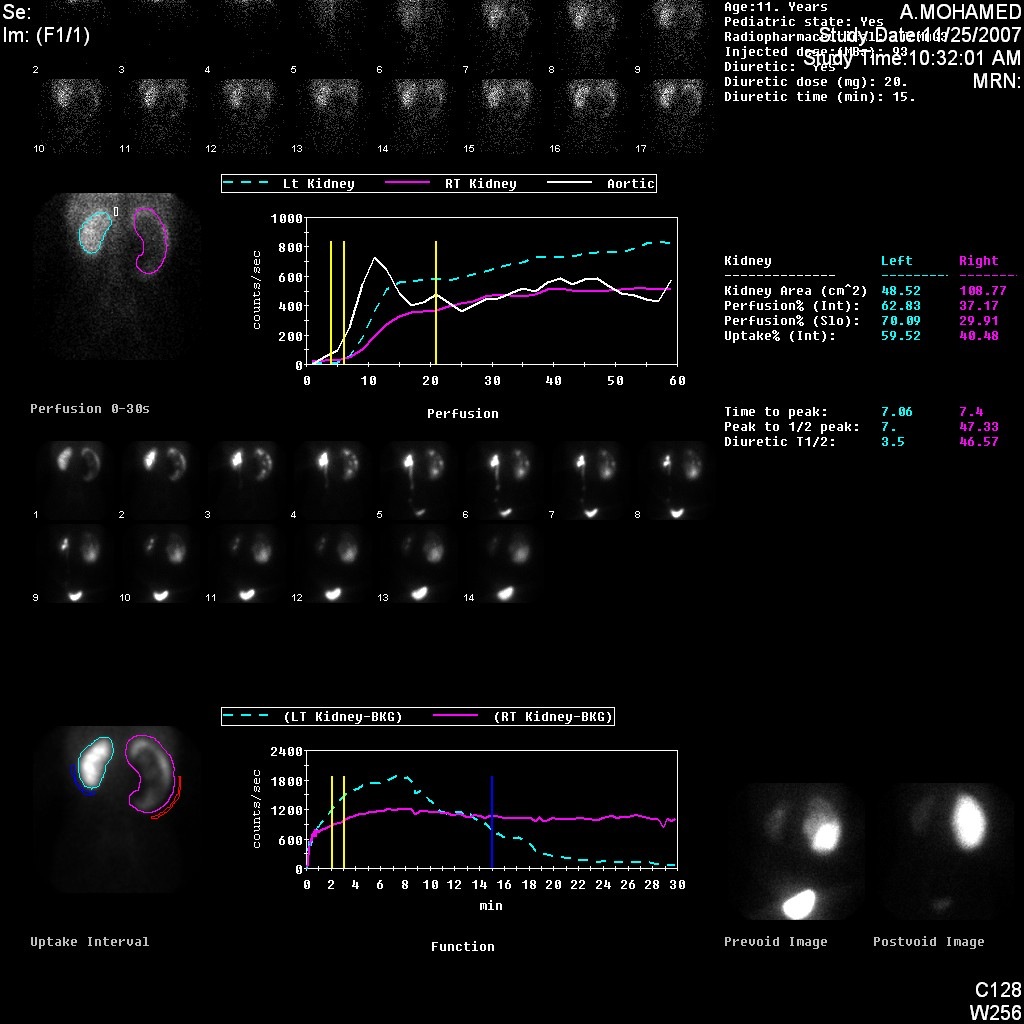
Figura 5 Renograma con DTPA que demuestra una curva obstructiva del riñón izquierdo
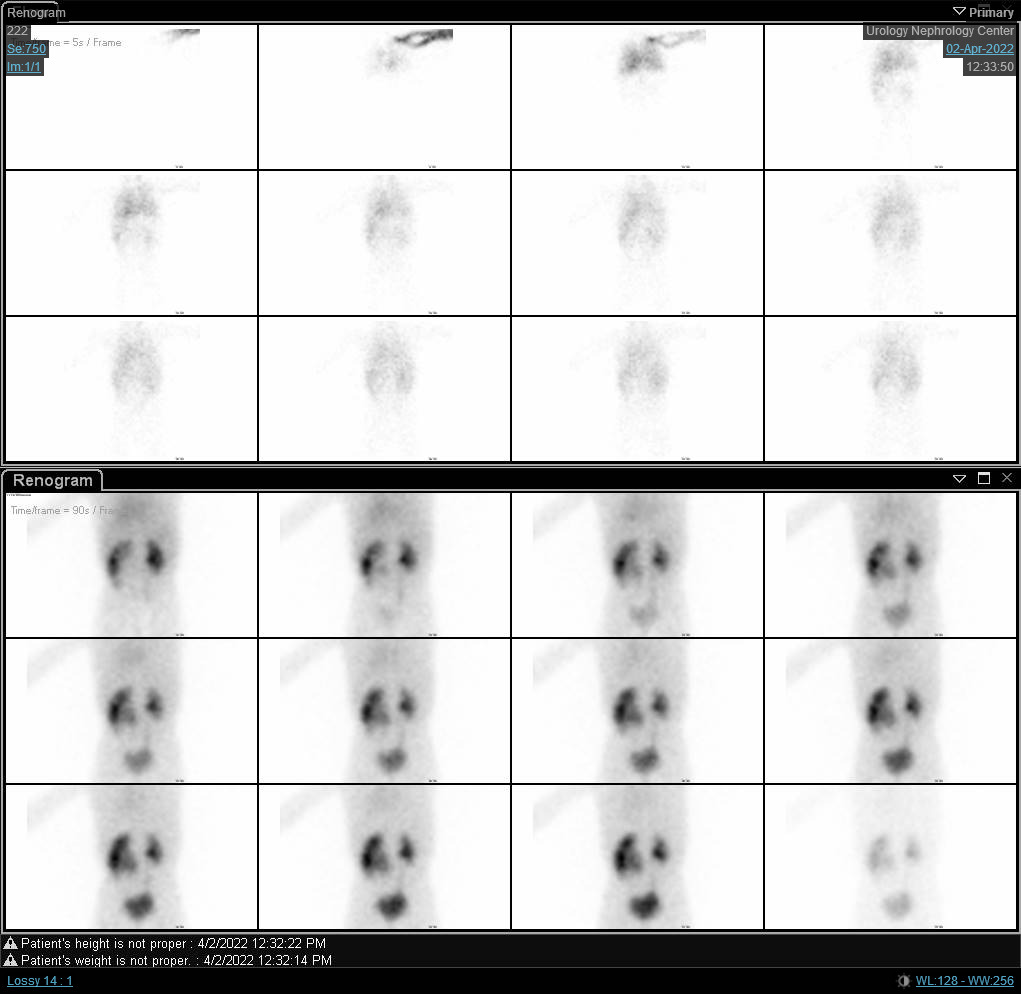
Figura 6 Renograma con DTPA que muestra una curva obstructiva del riñón derecho con t1/2 prolongado.
T1/2 de menos de 10 minutos se considera normal, mientras que t1/2 de más de 20 minutos indica obstrucción. Los valores intermedios se consideran equívocos. Sin embargo, muchos desaconsejan usar únicamente el valor de t1/2 para determinar si existe obstrucción, ya que la altura y la forma de la curva, el estado de hidratación del paciente, el drenaje de la vejiga y la función renal global pueden influir en este valor.
Para confirmar el diagnóstico de UPJO, se realiza RBUS seguida de una gammagrafía renal para aportar información tanto estructural como funcional (Figura 7) En casos discutibles, puede solicitarse una urografía por resonancia magnética (MRU). La VCUG no es necesaria siempre que el uréter no esté dilatado, mientras que la urografía intravenosa está obsoleta en la urología pediátrica moderna.
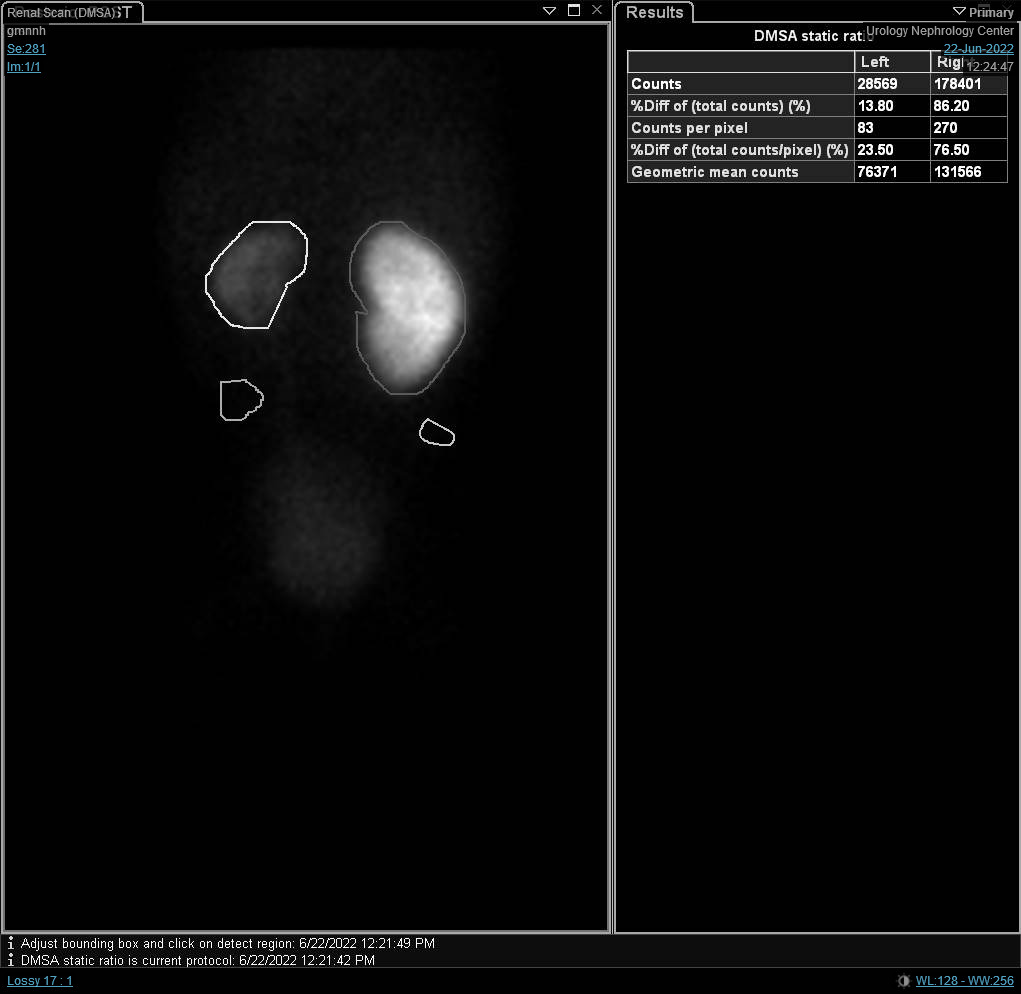
Figura 7 Gammagrafía renal con DTPA que muestra retraso en el drenaje del riñón izquierdo causado por UPJO izquierda
Mediante RBUS, se observa pelvis renal dilatada con uréter no dilatado. Como se mencionó anteriormente, se debe medir el APRPD y, si es mayor de 30 mm, se debe solicitar una gammagrafía renal porque la incidencia de deterioro de la función renal es alta en este grado de hidronefrosis.
El uso de la ecografía Doppler dúplex para sugerir obstrucción no debe pasarse por alto, aunque la exactitud de estos hallazgos puede no ser muy alta. La presencia de chorros ureterales desde el uréter hacia la vejiga excluye la obstrucción ureteral. El índice de resistencia (RI) de 0.7 o más indica obstrucción. Se mide restando la velocidad telediastólica (EDV) de la arteria renal a su velocidad pico sistólica (PSV) y el resultado se divide por la PSV. La justificación del uso del RI es que la uropatía obstructiva, en última instancia, se acompaña de una disminución del flujo sanguíneo renal. La VCUG no se solicita en el contexto de la UPJO a menos que haya dilatación del extremo distal del uréter en casos de UPJO secundaria a VUR.
Aunque la tomografía computarizada con contraste generalmente se evita en niños debido a la peligrosa radiación ionizante, puede utilizarse para detectar la presencia de un vaso cruzado en la fase arterial (corticomedular). La urografía intravenosa (UIV) ya no se recomienda en la urología pediátrica moderna. Todos los estudios con contraste deben evitarse a menos que las pruebas de función renal estén dentro de los valores normales.
La RM puede realizarse en casos equívocos en los que el RBUS no es concluyente. La RM dinámica con gadolinio ha ganado atención en los últimos años debido a su capacidad para aportar información no solo sobre el diagnóstico anatómico sino también sobre la función. Puede evaluar la función renal diferencial midiendo el volumen del parénquima con realce, utilizando un software especial, empleado por un físico de radiaciones para realizar este cálculo. Además, el cálculo del tiempo de tránsito renal, que es la diferencia de tiempo entre el realce cortical y la aparición del uréter, puede utilizarse para confirmar la obstrucción.
La ureteropielografía retrógrada puede utilizarse en el período preoperatorio para confirmar el diagnóstico en casos dudosos o si el cirujano está planificando una lumbotomía dorsal para descartar una estenosis ureteral concomitante. Por último, pero no menos importante, algunos marcadores bioquímicos se han utilizado para detectar daño tubular renal debido a la obstrucción, p. ej. β2-microglobulina, N-acetil-β-D-glucosaminidasa (NAG) y factor de crecimiento transformante beta 1 (TGF-β1).
Opciones de tratamiento y sus resultados
Manejo prenatal de la ANH
La intervención prenatal rara vez se necesita en la actualidad y solo se considera en quienes presentan obstrucción grave del tracto urinario inferior, p. ej., hidronefrosis bilateral de alto grado con oligohidramnios.21 En ausencia de condiciones que pongan en peligro la vida después de la semana 20 de gestación, no se debe interrumpir el embarazo, ni se deben modificar los planes de parto (p. ej., inducción temprana del trabajo de parto).
Manejo posnatal de la ANH
No debe omitirse el examen físico en los casos diagnosticados con ANH. Por ejemplo; puede palparse una masa abdominal en UPJO o MCDK, mientras que en el síndrome de Prune- Belly se encuentran un testículo no descendido y una musculatura deficiente de la pared abdominal anterior; además, en PUV la vejiga puede ser palpable.
Se recomienda la profilaxis antibiótica continua (CAP) en la hidronefrosis grado 3 y 4 de la SFU o APRPD de 15 mm o más para reducir la tasa de ITU en los primeros dos años de vida.17 Sin embargo, hay numerosos estudios de ANH (en ausencia de reflujo o megauréter/hidrouréter) que no muestran beneficio de la CAP en pacientes con hidronefrosis de alto grado aislada (grado 3-4).22
CAP en los primeros dos meses comprende amoxicilina y trimetoprima a una dosis de 10 a 20 mg/kg una vez al día y 2 mg/kg una vez al día, respectivamente. Después de esa edad, se prescriben nitrofurantoína y trimetoprima-sulfametoxazol (TMP/SMX) a una dosis de mg/ kg/ día. La prescripción temprana de nitrofurantoína puede causar anemia hemolítica o síndrome de dificultad respiratoria, mientras que el sulfametoxazol en los primeros dos meses causa kernícterus.
Los efectos secundarios frecuentes de la nitrofurantoína incluyen trastornos gastrointestinales y reacciones cutáneas. Los eventos adversos asociados con TMP/SMX se deben principalmente al componente sulfametoxazol, siendo las reacciones cutáneas las más frecuentes. La exposición a antibióticos durante el primer año de vida se asocia con un mayor riesgo de desarrollar enfermedades atópicas, incluyendo eccema, asma y alergia posteriormente.23 Este hallazgo se atribuye a la hipótesis de la higiene, que propone que crecer en un entorno extremadamente higiénico, con exposición microbiana mínima, puede aumentar las respuestas inmunitarias atópicas. Otra desventaja de la CAP es el desarrollo de resistencia a los antibióticos.
El principal desafío para los urólogos pediátricos es distinguir la UPJO que se va a resolver espontáneamente de aquella que causará deterioro de la función renal. La primera necesita seguimiento, mientras que la segunda requiere intervención.
Las indicaciones de intervención definitiva incluyen la presencia de síntomas (dolor, ITU febril), riñón palpable y APRPD mayor de 40 mm.24 Otras indicaciones comprenden; hidronefrosis progresiva durante el seguimiento, función renal diferencial menor del 40% y deterioro de la función diferencial en un 10% o más.25 En casos de UPJO sintomática no tratada con una función renal diferencial menor del 10%, se recomienda la nefrectomía. Sin embargo, algunos urólogos pediátricos prefieren un drenaje precoz mediante sonda de nefrostomía o stent ureteral interno y luego reevaluación.
La pieloplastia desmembrada de Anderson-Hynes (AHDP) sigue siendo la operación patrón de oro para el tratamiento definitivo de la obstrucción de la unión ureteropélvica (UPJO).17 En esta técnica, se reseca el segmento adinámico o estenótico, se espatula el uréter contra el polo inferior del riñón y, posteriormente, se anastomosa la pelvis renal al uréter espatulado sobre un stent transanastomótico. Para un uréter de inserción alta, antes se prefería la plastia en Y-V de Foley, pero en gran medida ha sido reemplazada por la AHDP. La pieloplastia en Y-V de Foley puede ser apropiada para la UPJO en el contexto de un riñón en herradura.
La técnica de vascular hitch sigue teniendo un papel en la urología pediátrica moderna porque es menos exigente y requiere menos tiempo que la AHDP. Además, su tasa de éxito alcanza hasta el 90% con menores tasas de complicaciones (p. ej., fuga urinaria y estenosis anastomótica). Implica la elevación del vaso cruzado anteriormente, alejándolo de la unión ureteropélvica (UPJ). Sin embargo, debe excluirse una obstrucción intrínseca concomitante mediante una prueba diurética para evitar un fracaso técnico.
El paciente se coloca en posición de flanco lateral, con el lado objetivo orientado hacia arriba. La incisión se realiza subcostal anterior (Figura 8) con un abordaje extraperitoneal. Tras separar o dividir los músculos oblicuo externo, oblicuo interno y transverso del abdomen, con retracción medial del peritoneo y de la grasa extraperitoneal (pararrenal), se abren las dos capas de la fascia de Gerota. Se identifica la UPJ y se colocan dos puntos de sostén, uno proximal y otro distal a la UPJ, antes de dividirla.
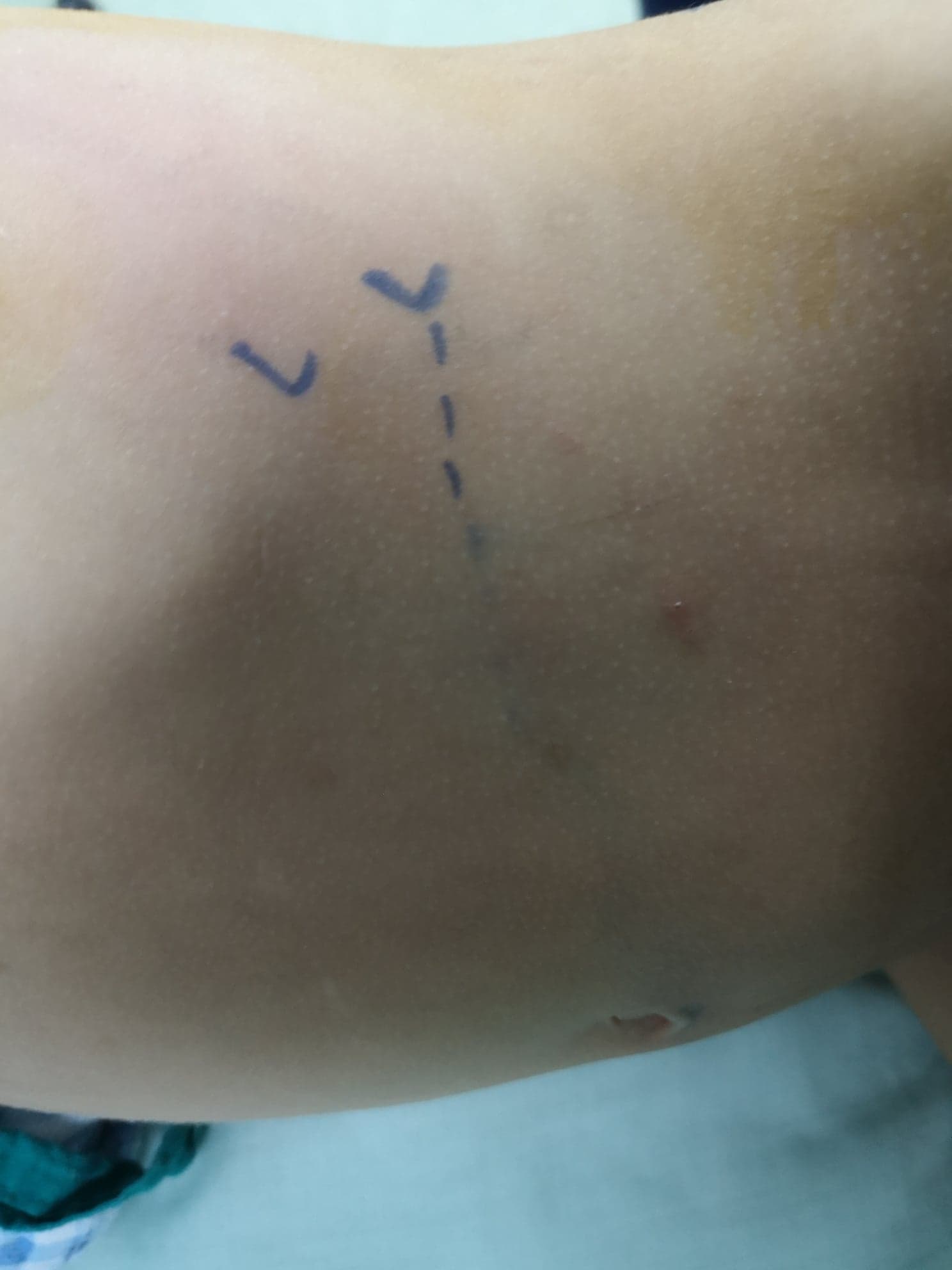
Figura 8 Incisión lumbar anterior por delante del extremo de la última costilla para pieloplastia izquierda abierta
La UPJ se secciona entre los dos puntos de reparo. La pieloplastia de reducción se realiza solo en casos de marcada redundancia de la pelvis renal en los que se reseca el exceso de pelvis renal. Por otro lado, otros autores concluyeron que la resección de la pelvis renal (pieloplastia de reducción) no es necesaria en la mayoría de los casos de pieloplastia desmembrada.26 Hallaron que los casos con o sin pieloplastia de reducción tenían resultados quirúrgicos similares. El siguiente paso es anastomosar los dos labios de la pelvis renal con los dos labios del uréter espatulado.
La primera sutura que se coloca es la del ángulo, seguida de la línea de sutura posterior, insertando el stent transanastomótico y completando la línea de sutura anterior. Los dos extremos restantes de la pelvis renal se suturan entre sí. Las suturas utilizadas son 6-0 vicryl (u otra sutura de monofilamento absorbible), ya sea de forma continua o en puntos separados. Al inicio de la curva de aprendizaje, comience con puntos separados hasta dominar la técnica.
Otro abordaje para la pieloplastia abierta distinto del abordaje lumbar anterior es la lumbotomía posterior o dorsal (DL) (Figura 9)27 Es el abordaje más antiguo utilizado para acceder al riñón y al uréter superior. Sin embargo, en la actualidad no se utiliza de forma generalizada, especialmente en niños. La DL puede realizarse mediante una de las siguientes incisiones cutáneas; incisión vertical de Gil-Vernet a lo largo del borde lateral del músculo sacroespinal, incisión vertical de la modificación de Lurz siguiendo el borde lateral del músculo cuadrado lumbar, o incisión transversal siguiendo las líneas de Langer.
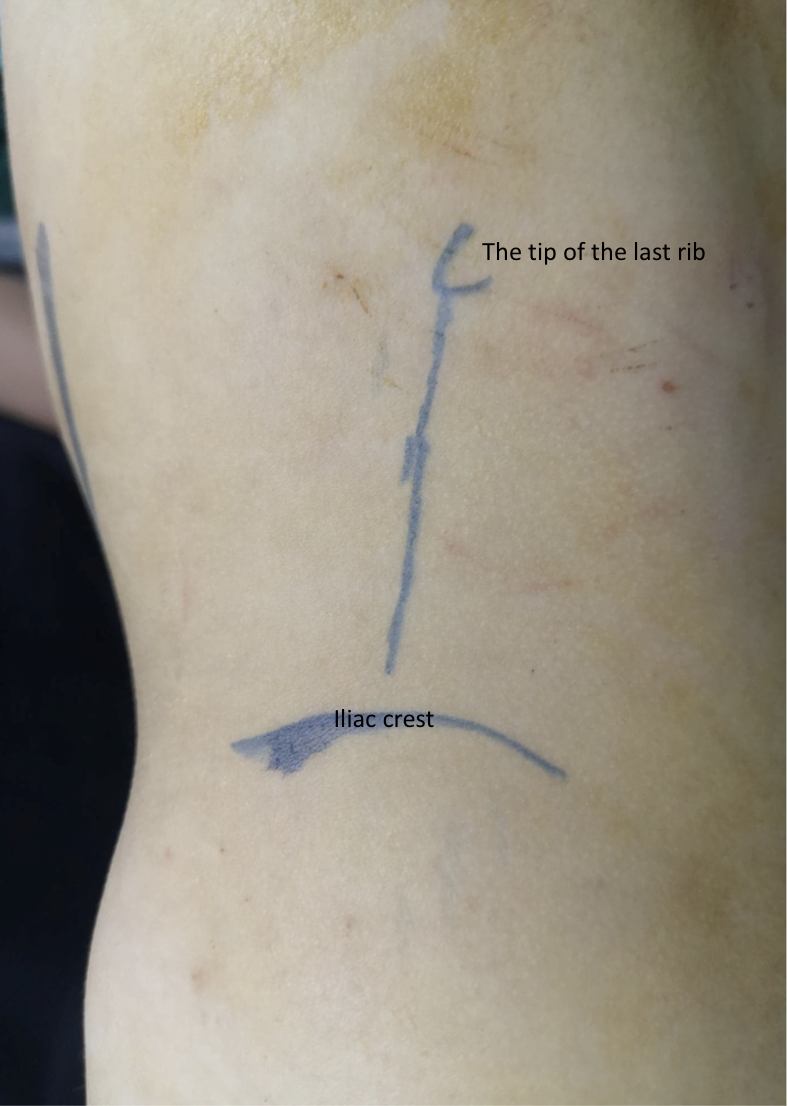
Figura 9 Incisión de lumbotomía dorsal para pieloplastia abierta del lado izquierdo
La principal ventaja de la DL es el acceso fácil al retroperitoneo mediante dos incisiones simples sin sección muscular. Un riñón hidronefrótico voluminoso ya no se considera una contraindicación para la DL porque los riñones suelen ser más móviles en los niños. Sin embargo, debe evitarse la DL en casos de malrotación o malposición renal.
Aunque la pieloplastia abierta es la técnica estándar en pacientes de corta edad, con una tasa de éxito del 95 %, las técnicas laparoscópicas y asistidas por robot presentan tasas de éxito comparables.28 Las técnicas mínimamente invasivas tienen la ventaja de menos dolor, una estancia hospitalaria posoperatoria más corta y cicatrices mínimas en los sitios de los trócares. No obstante, requieren un armamentario especial con el consiguiente aumento de los costos, además de una curva de aprendizaje relativamente más prolongada. El uso del sistema robótico da Vinci® ha hecho que la sutura intracorpórea sea más fácil que antes.
La pieloplastia laparoscópica y asistida por robot puede realizarse mediante un abordaje transperitoneal o retroperitoneal.28 El abordaje transperitoneal se utiliza con mayor frecuencia debido a los puntos de referencia anatómicos evidentes y al espacio de trabajo relativamente amplio. No obstante, presenta más complicaciones que el retroperitoneal en forma de lesión de órganos y obstrucción intestinal. Para reducir el tiempo operatorio y la manipulación intestinal en la pieloplastia laparoscópica transperitoneal, se utiliza el abordaje transmesocólico para movilizar directamente la unión pieloureteral izquierda sin movilización del colon.29
En la pieloplastia laparoscópica se utilizan al menos tres puertos, uno en el ombligo por técnica abierta para la cámara, y dos puertos de trabajo. El primer puerto de trabajo se coloca en la línea subcostal mientras que el segundo se sitúa en la línea espino-umbilical, y se prefiere que ambos estén en la línea pararectal (Figura 10) En la pieloplastia robótica, el puerto de la cámara se coloca justo por encima del ombligo mientras que los dos puertos de trabajo se ubican a mitad de camino entre el ombligo y la espina ilíaca anterosuperior, y a un dedo por debajo del margen costal sobre la línea pararectal. El puerto auxiliar se coloca a mitad de camino entre el ombligo y el xifoesternón (Figura 11)
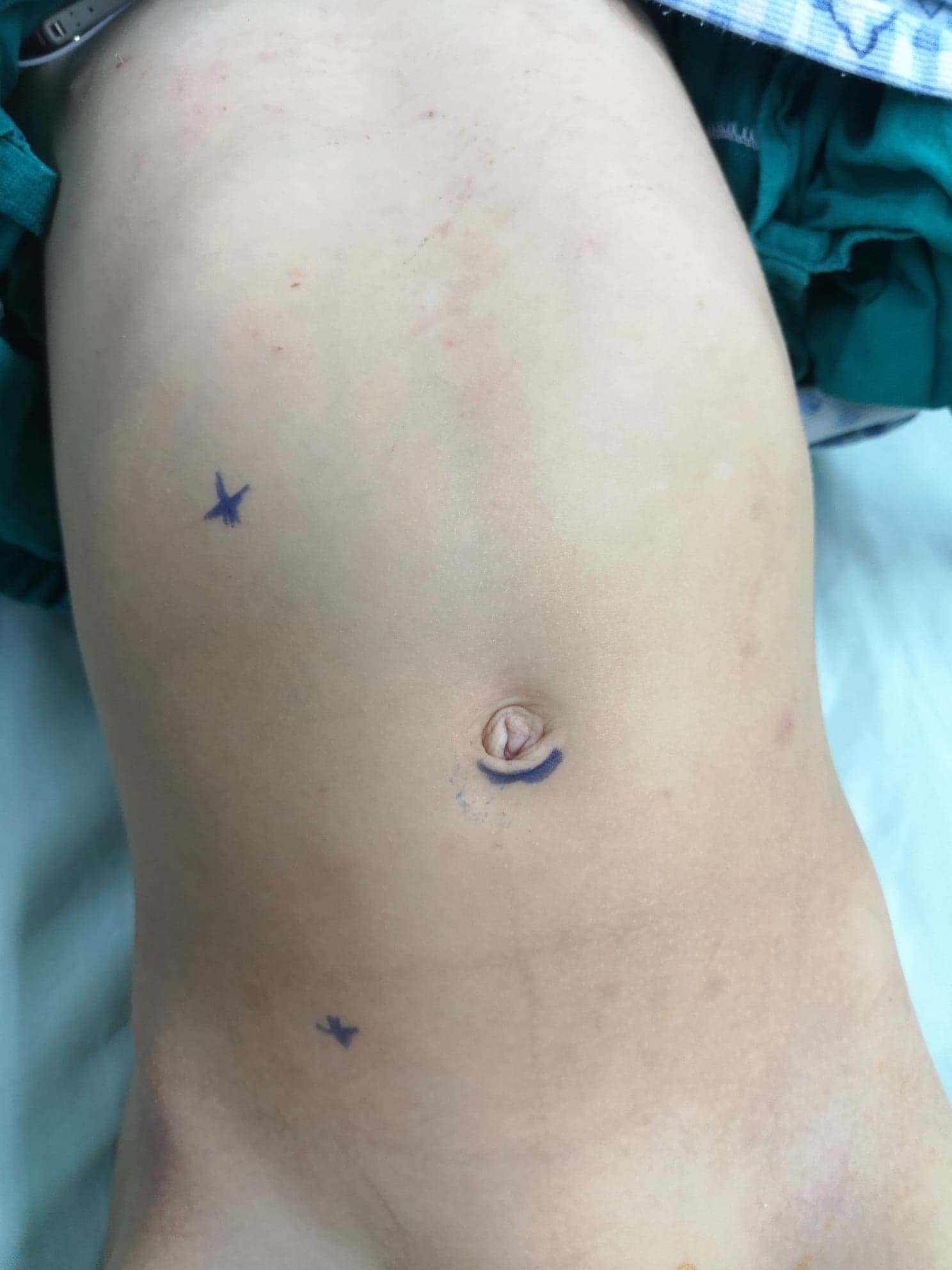
Figura 10 Distribución de los trócares para pieloplastia laparoscópica desmembrada de Anderson-Hynes del lado derecho
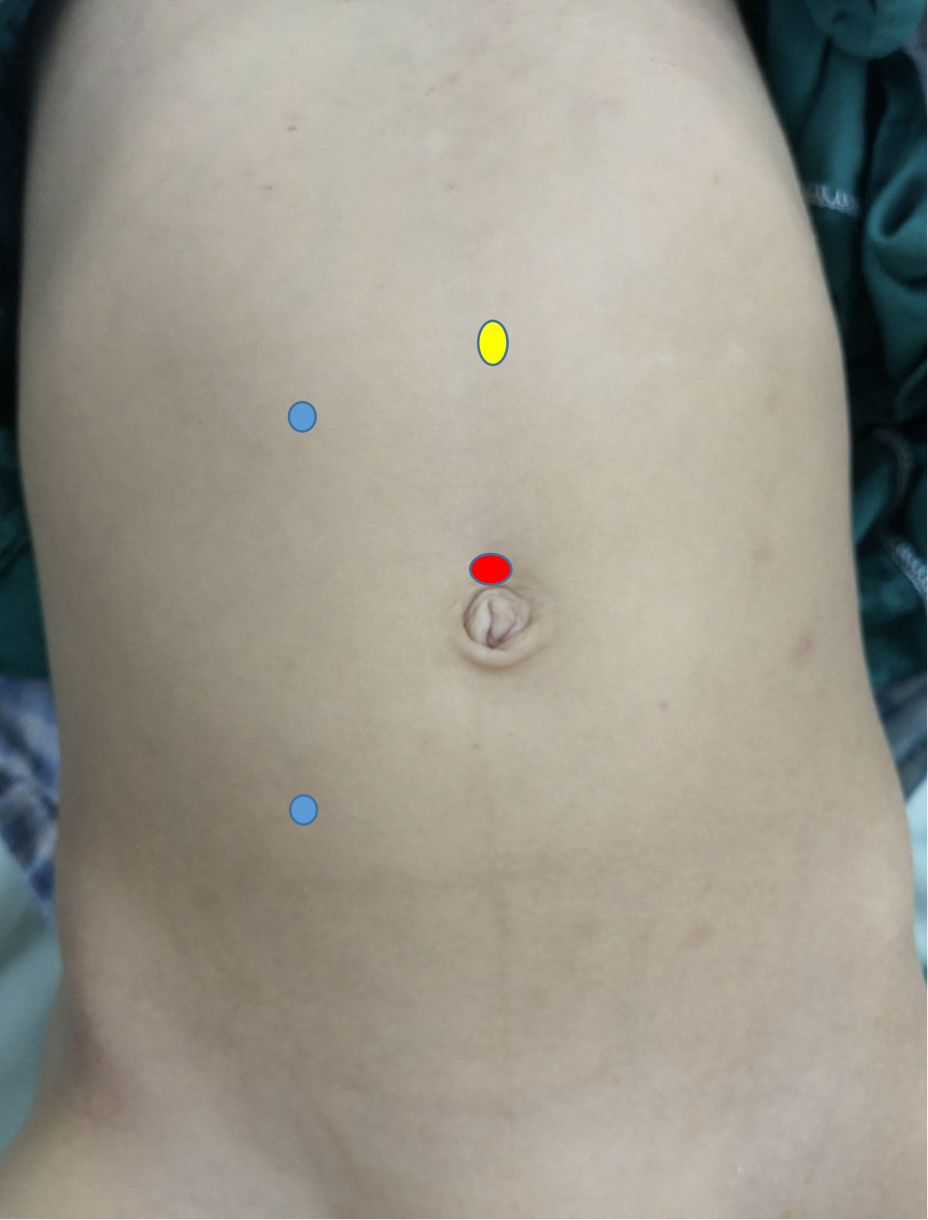
Figura 11 Distribución de puertos para pieloplastia robótica derecha
Independientemente del enfoque utilizado, el objetivo principal de la pieloplastia es lograr una anastomosis permeable, declive, en forma de embudo, estanca y sin tensión entre el uréter y la pelvis renal. El stent transanastomótico puede ser externo o interno, o no colocarse ninguno en absoluto.30
El stent externo se exterioriza a través del parénquima renal o de la pelvis renal y suele dejarse durante diez a catorce días. Es crucial asegurarse de que haya al menos un poro dentro de la pelvis renal para evitar la obstrucción del stent por el propio uréter. Además, evite dejar poros fuera del sistema pielocalicial por riesgo de fuga urinaria posoperatoria.
Una de las mejores maneras de confirmar que el asa distal del stent de doble cola de cerdo (doble J) ha alcanzado la vejiga es llenar la vejiga a través de un catéter uretral previamente fijado y comprobar el reflujo. Otro consejo para la colocación es utilizar el stent del menor diámetro disponible y colocarlo sobre una guía hidrofílica. Esto tiene menos probabilidad de quedar trabado en la unión ureterovesical y de causar una lesión allí, lo cual se ha descrito. Un stent interno se mantiene durante una a cuatro semanas y luego se retira mediante cistoscopia. La necesidad de una sesión adicional de anestesia es una desventaja del stent interno. Dejar un drenaje tubular no es una práctica de rutina salvo en casos difíciles o recurrentes.
Muchos cirujanos prefieren el uso de stent externo incluso en abordajes laparoscópicos y asistidos por robot para evitar una segunda anestesia general para retirar el stent interno.31,32 El stent pieloureteral externalizado Salle para pieloplastia intraoperatoria es otra alternativa eficaz al uso de stent interno, porque su costo es menor que el de una segunda sesión de anestesia general.32
En caso de pelvis renal redundante con un defecto de segmento largo, se recomiendan el colgajo espiral de Culp-DeWeerd o el colgajo vertical de Scardino-Prince. Si la pelvis renal es insuficiente para confeccionar un colgajo que puentee el defecto entre la pelvis renal y el uréter, la ureterocalicostomía puede ser una opción. En la ureterocalicostomía, el uréter se anastomosa al cáliz inferior después de amputar el polo inferior del riñón.
La endopielotomía endoscópica es una opción para una estenosis de segmento corto (menos de dos cm) en un riñón potencialmente recuperable, tras excluir la presencia de un vaso cruzado.33 Puede realizarse en casos primarios o recurrentes por vía anterógrada o retrógrada utilizando cuchillete frío o láser de holmio. Presenta tasas de éxito inferiores en comparación con AHDP (70% Vs 95%, respectivamente). Está contraindicada en presencia de infección activa del tracto urinario, vaso cruzado y diátesis hemorrágica. En las pieloplastias fallidas, la re-pieloplastia tiene tasas de éxito superiores (95-99%) en comparación con la endopielotomía endoscópica (39%), especialmente en niños pequeños y en segmentos estenóticos de más de un centímetro.33
Complicaciones
Si no se trata, la UPJO puede provocar deterioro de la función del riñón afectado hasta la pérdida completa de la función. La hipertensión secundaria es una complicación poco frecuente. Las complicaciones de la pieloplastia son precoces o tardías. Las complicaciones precoces incluyen fuga urinaria por la herida o por el drenaje, con o sin colección, stent externo no drenante, stent interno desplazado, hematuria, fiebre e infección de la herida. Las complicaciones tardías implican fracaso técnico o reestenosis.34
La extravasación urinaria se maneja mediante derivación urinaria en forma de nefrostomía percutánea o colocación retrógrada de un stent interno. En ocasiones puede atribuirse a la presencia de poros del stent fuera del riñón, con la consiguiente fuga hacia el retroperitoneo. En caso de una colección perinéfrica de tamaño considerable, se recomienda un drenaje percutáneo. Un stent externo que no drena puede deberse a un coágulo sanguíneo que obstruye el stent o a la ausencia de poros en la porción del stent dentro de la pelvis renal, mientras que el resto de los poros de drenaje están obstruidos por el uréter. La primera causa se maneja con lavado del stent, mientras que la segunda se trata con retracción del stent.
La hematuria suele manejarse de forma conservadora mediante hidratación adecuada con o sin uso de hemostáticos, mientras que la infección de la herida se trata con terapia antimicrobiana guiada por cultivo además de curaciones frecuentes de la herida. En caso de fiebre, debe descartarse la obstrucción persistente mediante RBUS, seguido de antibióticos intravenosos.
La conducta ante una pieloplastia fallida depende principalmente de la función renal diferencial. En un riñón con obstrucción sintomática y mala función, con una función renal diferencial menor del 10-15 %, se considera la nefrectomía. En un riñón potencialmente recuperable, se realiza una re-pieloplastia o, a veces, flebotomía endoscópica. El momento de la intervención es al menos tres meses después de la cirugía primaria.
Seguimiento recomendado
En casos de ANH unilateral, la RBUS debe realizarse una vez en el tercer trimestre. Si la ANH es bilateral, la RBUS debe realizarse mensualmente hasta el parto, dependiendo de la presencia de signos sugestivos de obstrucción del tracto urinario inferior, p. ej., hidronefrosis progresiva, oligohidramnios o engrosamiento de la pared vesical.11
Se suele recomendar el manejo conservador de las dilataciones de la pelvis renal asintomáticas con una función renal diferencial superior al 40 %, ya que la mayoría de los casos experimentan resolución espontánea. La hidronefrosis progresiva o el deterioro de la función renal durante la observación constituyen una indicación aceptada de una intervención definitiva para prevenir un daño renal ulterior.
No existe consenso respecto al seguimiento tras la pieloplastia, y lo publicado en la literatura consiste en opiniones de expertos o experiencias anecdóticas.35 En nuestra institución, el paciente se evalúa clínicamente a las dos semanas en caso de colocación de stent externo o a las seis semanas en caso de fijación de stent interno. Tres meses después de la cirugía, se solicita RBUS y se evalúan el grado de hidronefrosis y el APRPD. Si hay mejoría en los parámetros antes mencionados, el siguiente control será al año de la cirugía utilizando RBUS. En caso de RBUS estático, el próximo control será tres meses después mediante RBUS. Si se observa hidronefrosis progresiva o el paciente está sintomático, se debe solicitar una gammagrafía MAG3.
Lecturas recomendadas
- Han HH, Ham WS, Kim JH, Hong CH, Choi YD, Han SW. Transmesocolic approach for left side laparoscopic pyeloplasty: Comparison with laterocolic approach in the initial learning period. Yonsei Medical Journal 2013; 54 (1): 197–203. DOI: 10.3349/ymj.2013.54.1.197.
- Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction. Pediatric Nephrology 2018; 33 (4): 553–571. DOI: 10.1007/s00467-017-3629-0.
- Gopal M, Peycelon M, Caldamone A, Chrzan R, El-Ghoneimi A, Olsen H. Management of ureteropelvic junction obstruction in children—a roundtable discussion. Journal of Pediatric Urology 2019; 15 (4): 322–329. DOI: 10.1016/j.jpurol.2019.05.010.
- Chertin B, Pollack A, Koulikov D, Rabinowitz R, Hain D, Hadas-Halpren I. Conservative treatment of ureteropelvic junction obstruction in children with antenatal diagnosis of hydronephrosis: lessons learned after 16 years of follow-up. European Urology 2006; 49 (4): 734–739. DOI: 10.1016/s0084-4071(08)70420-2.
- Värelä S, Omling E, Börjesson A, Salö M. Resolution of hydronephrosis after pyeloplasty in children. Journal of Pediatric Urology 2021; 17 (1): 1–7. DOI: 10.1016/j.jpurol.2020.10.031.
- Sarihan H, Comert HSY, İmamoğlu M, Basar D. Reverse tubularized pelvis flap method for the treatment of long segment ureteropelvic junction obstruction. Medical Principles and Practice 2020; 29 (2): 128–133. DOI: 10.1159/000502028.
Puntos clave
- La pelvis renal dilatada con uréter no dilatado en la ecografía renal y vesical es altamente sugestiva de UPJO.
- Considere la intervención en uno de los siguientes escenarios; UPJO sintomática (sepsis, dolor significativo o formación de cálculos) APRPD de más de 5 centímetros Hidronefrosis progresiva Deterioro de la función renal superior al 10% en gammagrafías renales seriadas. Función renal diferencial menor del 40% con t1/2 prolongado.
- Espatule el uréter hacia el polo inferior del riñón durante la pieloplastia desmembrada de Anderson-Hynes.
- Evite la manipulación del uréter durante la creación de la anastomosis pieloureteral.
- Asegúrese de que todos los poros externos del stent estén dentro del sistema pielocalicial para evitar fuga urinaria.
Referencias
- Oliveira EA, Oliveira MCL, Mak RH. Evaluation and management of hydronephrosis in the neonate. Current Opinion in Pediatrics 2016; 28 (2): 195–201. DOI: 10.1097/mop.0000000000000321.
- Onen A. An alternative grading system to refine the criteria for severity of hydronephrosis and optimal treatment guidelines in neonates with primary UPJ-type hydronephrosis. Journal of Pediatric Urology 2007; 3 (3): 200–205. DOI: 10.1016/j.jpurol.2006.08.002.
- Shapiro E. Clinical implications of genitourinary embryology. Current Opinion in Urology 2009; 19 (4): 427–433. DOI: 10.1097/mou.0b013e32832c90ff.
- Beksaç S, Balcı S, Yapıcı Z, Özyüncü Ö. Prenatally Diagnosed Ureteropelvic Junction Obstruction in Three Siblings of one Family: A Case Report. Gynecology Obstetrics & Reproductive Medicine 2008; 14 (3): 193–195.
- Josephson S. Antenatally detected, unilateral dilatation of the renal pelvis: a critical review. 1. Postnatal non-operative treatment 20 years on\–is it safe? Scandinavian Journal of Urology and Nephrology 2002; 36 (4): 243–250. DOI: 10.1080/003655902320248191.
- Krajewski W, Wojciechowska J, Dembowski J, Zdrojowy R, Szydełko T. Hydronephrosis in the course of ureteropelvic junction obstruction: An underestimated problem? Current opinions on the pathogenesis, diagnosis and treatment. Advances in Clinical and Experimental Medicine: Official Organ Wroclaw Medical University 2017; 26 (5): 857–864. DOI: 10.17219/acem/59509.
- Atwa AM, Abdelhalim A, Edwan M, Soltan M, Hashim A, Abdelhameed M. Holmium Laser En Bloc Resection of Urethral Polyps in Children: A Case Series. Journal of Endourology Case Reports 2020; 6 (4): 457–460. DOI: 10.1089/cren.2020.0099.
- Houat AP, Guimarães CT, Takahashi MS, Rodi GP, Gasparetto TP, Blasbalg R. Congenital anomalies of the upper urinary tract: a comprehensive review. Radiographics 2021; 41 (2): 462–486. DOI: 10.1148/rg.2021219009.
- Alagiri M, Polepalle SK. Dietlś crisis: an under-recognized clinical entity in the pediatric population. International Braz j Urol 2006; 32: 451–453. DOI: 10.1590/s1677-55382006000400012.
- Yalçınkaya F, Özçakar ZB. Management of antenatal hydronephrosis. Pediatric Nephrology 2020; 35 (12): 2231–2239. DOI: 10.1201/b13478-107.
- Has R, Sarac Sivrikoz T. Prenatal diagnosis and findings in ureteropelvic junction type hydronephrosis. Frontiers in Pediatrics 2020; 8 (492). DOI: 10.3389/fped.2020.00492.
- Hodhod A, Capolicchio J-P, Jednak R, El-Sherif E, El-Doray AE-A, El-Sherbiny M. Evaluation of urinary tract dilation classification system for grading postnatal hydronephrosis. The Journal of Urology 2016; 195 (3): 725–730. DOI: 10.1016/j.juro.2015.10.089.
- ElSheemy MS. Postnatal management of children with antenatal hydronephrosis. African Journal of Urology 2020; 26 (1): 1–14. DOI: 10.1186/s12301-020-00097-8.
- Chow JS, Koning JL, Back SJ, Nguyen HT, Phelps A, Darge K. Classification of pediatric urinary tract dilation: the new language. Pediatric Radiology 2017; 47 (9): 1109–1115. DOI: 10.1007/s00247-017-3883-0.
- Elmaci AM, Dönmez Mİ. Time to resolution of isolated antenatal hydronephrosis with anteroposterior diameter≤ 20 mm. European Journal of Pediatrics 2019; 178 (6): 823–828. DOI: 10.1007/s00431-019-03359-y.
- Engin MMN. Management of Infants Diagnosed with Antenatal Hydronephrosis and Determining the Need for Surgical Intervention. 2020. DOI: 10.33309/2639-9164.030202.
- Hashim H, Woodhouse CR. Ureteropelvic junction obstruction. European Urology Supplements 2012; 11 (2): 25–32. DOI: 10.1007/978-1-62703-206-3_4.
- Riccabona M. Assessment and management of newborn hydronephrosis. World Journal of Urology 2004; 22 (2): 73–78. DOI: 10.1007/s00345-004-0405-0.
- Taghavi R, Ariana K, Arab D. Diuresis renography for differentiation of upper urinary tract dilatation from obstruction F+ 20 and F-15 methods. 2007. DOI: 10.1016/j.urology.2007.06.721.
- Clayton DB, Brock JW. Current state of fetal intervention for lower urinary tract obstruction. Current Urology Reports 2018; 19 (1): 1–8. DOI: 10.1007/s11934-018-0760-9.
- Chamberlin JD, Braga LH, Davis-Dao CA, Herndon CA, Holzman SA, Herbst KW. Continuous antibiotic prophylaxis in isolated prenatal hydronephrosis. Journal of Pediatric Urology 2022. DOI: 10.1016/j.jpurol.2022.03.027.
- Ahmadizar F, Vijverberg SJ, Arets HG, Boer A, Lang JE, Garssen J. Early‐life antibiotic exposure increases the risk of developing allergic symptoms later in life: a meta‐analysis. Allergy 2018; 73 (5): 971–986. DOI: 10.1111/all.13332.
- Dhillon H. Prenatally diagnosed hydronephrosis: the Great Ormond street experience: Perinatal Urology. British Journal of Urology Supplement 1998; 81 (2): 39–44. DOI: 10.1046/j.1464-410x.1998.0810s2039.x.
- Hafez AT, McLorie G, Bägli D, Khoury A. Analysis of trends on serial ultrasound for high grade neonatal hydronephrosis. The Journal of Urology 2002; 168 (4 Part 1): 1518–1521. DOI: 10.1097/00005392-200210010-00072.
- Morsi HA, Mursi K, Abdelaziz AY, ElSheemy MS, Salah M, Eissa MA. Renal pelvis reduction during dismembered pyeloplasty: is it necessary? Journal of Pediatric Urology 2013; 9 (3): 303–306. DOI: 10.1016/j.jpurol.2012.03.002.
- Braga LH, Lorenzo AJ, Bägli DJ, Mahdi M, Salle JLP, Khoury AE. Comparison of flank, dorsal lumbotomy and laparoscopic approaches for dismembered pyeloplasty in children older than 3 years with ureteropelvic junction obstruction. The Journal of Urology 2010; 183 (1): 306–311. DOI: 10.1016/j.juro.2009.09.008.
- Başataç C, Boylu U, Önol FF, Gümüş E. Comparison of surgical and functional outcomes of open, laparoscopic and robotic pyeloplasty for the treatment of ureteropelvic junction obstruction. Turkish Journal of Urology 2014; 40 (1). DOI: 10.5152/tud.2014.06956.
- Han HH, Ham WS, Kim JH, Hong CH, Choi YD, Han SW. Transmesocolic approach for left side laparoscopic pyeloplasty: Comparison with laterocolic approach in the initial learning period. Yonsei Medical Journal 2013; 54 (1): 197–203. DOI: 10.3349/ymj.2013.54.1.197.
- Yiee JH, Baskin LS. Use of internal stent, external transanastomotic stent or no stent during pediatric pyeloplasty: a decision tree cost-effectiveness analysis. The Journal of Urology 2011; 185 (2): 673–681. DOI: 10.1016/j.juro.2010.09.118.
- Helmy T, Blanc T, Paye-Jaouen A, El-Ghoneimi A. Preliminary experience with external ureteropelvic stent: alternative to double-j stent in laparoscopic pyeloplasty in children. The Journal of Urology 2011; 185 (3): 1065–1070. DOI: 10.1016/j.juro.2010.10.056.
- Chu DI, Shrivastava D, Batavia JP, Bowen DK, Tong CC, Long CJ. Outcomes of externalized pyeloureteral versus internal ureteral stent in pediatric robotic-assisted laparoscopic pyeloplasty. Journal of Pediatric Urology 2018; 14 (5): 1–. DOI: 10.1016/j.jpurol.2018.04.012.
- Lucas JW, Ghiraldi E, Ellis J, Friedlander JI. Endoscopic management of ureteral strictures: an update. Current Urology Reports 2018; 19 (4): 1–7. DOI: 10.1007/s11934-018-0773-4.
- Khemchandani SI. Outcome analysis of pediatric pyeloplasty in varied presentation in developing countries. Urological Science 2019; 30 (6). DOI: 10.4103/uros.uros_31_19.
- Gopal M, Peycelon M, Caldamone A, Chrzan R, El-Ghoneimi A, Olsen H. Management of ureteropelvic junction obstruction in children—a roundtable discussion. Journal of Pediatric Urology 2019; 15 (4): 322–329. DOI: 10.1016/j.jpurol.2019.05.010.
- Freilich DA, Nguyen HT, Borer J, Nelson C, Passerotti CC. Concurrent management of bilateral ureteropelvic junction obstruction in children using robotic-assisted laparoscopic surgery. International Braz j Urol 2008; 34: 198–205. DOI: 10.1590/s1677-55382008000200010.
- Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction. Pediatric Nephrology 2018; 33 (4): 553–571. DOI: 10.1007/s00467-017-3629-0.
- Chertin B, Pollack A, Koulikov D, Rabinowitz R, Hain D, Hadas-Halpren I. Conservative treatment of ureteropelvic junction obstruction in children with antenatal diagnosis of hydronephrosis: lessons learned after 16 years of follow-up. European Urology 2006; 49 (4): 734–739. DOI: 10.1016/s0084-4071(08)70420-2.
- Värelä S, Omling E, Börjesson A, Salö M. Resolution of hydronephrosis after pyeloplasty in children. Journal of Pediatric Urology 2021; 17 (1): 1–7. DOI: 10.1016/j.jpurol.2020.10.031.
- Sarihan H, Comert HSY, İmamoğlu M, Basar D. Reverse tubularized pelvis flap method for the treatment of long segment ureteropelvic junction obstruction. Medical Principles and Practice 2020; 29 (2): 128–133. DOI: 10.1159/000502028.
Última actualización: 2025-09-21 13:35