09: Fundamentos de la endoscopia pediátrica
Este capítulo durará aproximadamente 22 minutos para leer.
Introducción
La llegada de la instrumentación endoscópica ha revolucionado el campo de la urología, mejorando tanto el potencial diagnóstico como terapéutico para los trastornos urológicos. En las últimas décadas, los avances tecnológicos han permitido la miniaturización de instrumentos urológicos para adultos para su uso en el tracto genitourinario pediátrico. La cistouretroscopia, la ureteroscopia y la nefroscopia son instrumentos indispensables para que el urólogo pediátrico diagnostique y trate afecciones que van desde el reflujo vesicoureteral, la nefrolitiasis y las válvulas uretrales posteriores hasta las anomalías congénitas y el traumatismo genitourinario. Procedimientos quirúrgicos previamente abiertos se han transformado en procedimientos endoscópicos que son menos invasivos y permiten una recuperación más rápida de nuestros pacientes.
En este capítulo, abordaremos el papel de la endoscopia del tracto superior e inferior en el paciente pediátrico y proporcionaremos una guía para la evaluación, el diagnóstico y el tratamiento de las afecciones que requieren endoscopia pediátrica.
Historia de la endourología
Antes de la llegada de los instrumentos endoscópicos, los procedimientos quirúrgicos que involucraban orificios corporales se limitaban al uso de espéculos, sondas y bisturíes.1 El primer prototipo endoscópico fue introducido por Phillip Bozzini en 1806. El ‘lichtleiter’ o ‘conductor de luz’ consistía en un embudo largo colocado en una caja cubierta de piel de tiburón y una vela para la iluminación. Espejos angulados dentro de la caja dirigían la luz hacia el cuerpo humano. Se utilizó para examinar la vagina, la vejiga y la nasofaringe, pero nunca se usó dentro de un paciente.1,2,3,4 En 1853, Antoine Desormeaux introdujo el primer cistoscopio funcional y es reconocido como el ‘padre de la cistoscopia’.2,3,4 Los avances tecnológicos incluyeron un endoscopio más pequeño, una lámpara de queroseno y un espejo cóncavo con un orificio central que mejoraba la iluminación del dispositivo.2 Es el primero conocido en utilizar su cistoscopio primitivo en un paciente para la extirpación de un papiloma uretral.4 Las principales complicaciones incluían quemaduras térmicas asociadas con la fuente de luz de queroseno y una iluminación insuficiente.5 En 1877, el urólogo alemán Maximilian Nitze utilizó un telescopio miniaturizado con una serie de lentes a lo largo de un tubo hueco para ampliar la imagen y, en el extremo, un filamento eléctrico de platino refrigerado por agua para la iluminación.6 Cuando Thomas Edison inventó la bombilla en 1878, el dispositivo de Nitze se modificó añadiendo una bombilla en la punta del cistoscopio.2,7 El prisma de Amici, desarrollado en 1906, permitió que las imágenes desplazadas 90˚ aparecieran en la orientación correcta, y esta tecnología se incorporó posteriormente al diseño del cistoscopio.7
El descubrimiento de que el vidrio era un mejor conductor de la luz que el aire allanó el camino para diseños de fibra óptica. Harold Hopkins inventó el sistema de lentes en varilla en 1951 al agrupar y disponer fibras de vidrio de 0,1 mm de diámetro coaxialmente con el ocular para transmitir imágenes.7 El ‘fibroscopio’ acoplado a una fuente de luz externa mejoró la transmisión de luz > 80 veces, y el sistema fue patentado en 1959.7 Esta tecnología sentó las bases del cistoscopio rígido moderno.
Además de los avances endoscópicos, los sistemas de cámaras también han mejorado con el tiempo. Con la miniaturización del equipo de cámara y la invención de un dispositivo de carga acoplada, las imágenes ópticas obtenidas del endoscopio se convierten en fotones y en imágenes digitales.3,8 Ahora las imágenes digitales pueden mostrarse en monitores externos, una innovación transformadora para la educación quirúrgica urológica.
Cistouretroscopia
Indicaciones
La cistoscopia cumple una función importante en el diagnóstico y tratamiento de la patología del tracto genitourinario pediátrico. Además, la información anatómica obtenida mediante cistouretroscopia facilita la planificación de la reconstrucción genitourinaria. Las indicaciones frecuentes incluyen la evaluación de anomalías genitourinarias congénitas (complejo de extrofia vesical-epispadias, anomalías cloacales, valvas uretrales posteriores, uréteres ectópicos), la anatomía vaginal y los canales urinarios, la inyección endoscópica para el reflujo vesicoureteral y el tratamiento de los cálculos vesicales.9 Prácticamente todos los procedimientos se realizan bajo anestesia general en el quirófano. La Tabla 1 describe las indicaciones frecuentes para la cistouretroscopia pediátrica. La Tabla 2 presenta intervenciones terapéuticas frecuentes.
Tabla 1 Indicaciones comunes para la cistouretroscopia pediátrica.
| Diagnóstico | Detalles |
|---|---|
| Anomalías congénitas | Complejo de extrofia-epispadias |
| Anomalías cloacales | |
| Uréteres ectópicos | |
| Vaginoscopia para anomalías vaginales | |
| Pielogramas retrógrados para estenosis ureterales, obstrucción de la UPJ y la UVJ | |
| Malignidad | Vigilancia de la ampliación gástrica |
| Evaluación de masa vesical o uretral | |
| Evaluación de síntomas miccionales: hematuria macroscópica, chorro débil, incontinencia urinaria | |
| CMG para urodinámica intraoperatoria | |
| Evaluación de cirugía reconstructiva previa | Procedimientos del cuello vesical |
| Conductos urinarios |
Tabla 2 Intervenciones terapéuticas comunes en cistouretroscopia.
| Tratamiento |
|---|
| Válvulas de uretra posterior |
| Extracción de cálculo vesical |
| Inyección endoscópica para RVU, incompetencia esfinteriana, incompetencia del conducto |
| Punción de ureterocele |
| Colocación de catéter suprapúbico o uretral |
Equipo
Los cistoscopios pediátricos y para adolescentes se presentan en una variedad de tamaños, en modelos tanto flexibles como rígidos. El tamaño del instrumento se expresa en la unidad French (Fr), siendo un diámetro de 1 Fr equivalente a 1/3 mm.10 Los componentes del cistoscopio rígido incluyen una lente óptica, un puente, una vaina y un obturador. Las lentes se fabrican con ángulos de punta que van de 0–120˚. En nuestra práctica, las lentes de 0˚ y 30˚ son las más comunes. El puente conecta la lente con la vaina y proporciona 1–2 canales de trabajo. Los tamaños de las vainas van desde 5 Fr hasta tamaños de adulto y cuentan con puertos de irrigación asociados. El obturador puede utilizarse en lugar de la lente dentro de la vaina para hacer romo el extremo de la vaina y permitir el paso a ciegas a través de la uretra hacia la vejiga. La cistoscopia rígida también requiere una fuente de luz, una cámara endoscópica, un monitor externo y líquido de irrigación. Los cistoscopios flexibles incorporan el endoscopio, la fuente de luz y la cámara y tienen un único canal de trabajo para la irrigación y el paso de instrumentos. Las puntas de los cistoscopios flexibles pueden desviarse hasta 210˚, lo que facilita la maniobrabilidad del dispositivo, y están disponibles en una variedad de tamaños.
En nuestra práctica, se utilizan cistoscopios rígidos en la mayoría de los casos y los cistoscopios flexibles se reservan para los casos en los que el posicionamiento en litotomía es difícil o para la navegación de canales cateterizables tortuosos.
Consideraciones preoperatorias
Se debe realizar un análisis de orina antes de la instrumentación del tracto urinario y, si corresponde, un urocultivo.11 El urocultivo preoperatorio y el tratamiento antibiótico, si están indicados, son especialmente importantes en pacientes en quienes es probable que el tracto urinario esté colonizado, como aquellos en cateterismo intermitente o con catéteres permanentes. Si existe una infección del tracto urinario, se debe tratar al paciente con antibióticos dirigidos según el cultivo y posponer el procedimiento debido al riesgo de bacteriemia y sepsis.
La Declaración de Mejores Prácticas de la AUA sobre Procedimientos Urológicos y Profilaxis Antimicrobiana de 2019 recomienda no administrar antibióticos preprocedimiento para la cistoscopia diagnóstica de rutina en ausencia de factores de riesgo específicos del paciente, tales como inmunodepresión, colonización crónica del tracto genitourinario, anomalías anatómicas que predisponen a estasis urinaria y mal estado nutricional.12 No existe una guía clara específicamente para la instrumentación endourológica pediátrica, pero usamos estas guías para orientar la profilaxis antibiótica periprocedimiento. Una historia quirúrgica detallada, incluida la revisión de los informes operatorios, es esencial antes de la endoscopia, especialmente en el contexto de una reconstrucción genitourinaria previa.
Consideraciones quirúrgicas
Antes de la inducción de la anestesia, los instrumentos endoscópicos deben ser inspeccionados para verificar su integridad, compatibilidad y funcionamiento. Esto es especialmente importante en la endoscopia pediátrica, donde se utilizan diversos tamaños de instrumentos y accesorios. Tras la inducción de anestesia general y la profilaxis antibiótica preprocedimiento (cuando esté indicada), el paciente se coloca en litotomía dorsal (Figura 1). En lactantes, se pueden colocar pequeñas toallas enrolladas o rodillos de gel bajo las rodillas y las piernas se aseguran en su lugar con cinta. Los niños de mayor tamaño se posicionan con estribos. Los genitales y el periné se preparan con una solución antiséptica que contenga betadine, ya que las preparaciones a base de alcohol y clorhexidina pueden dañar las membranas mucosas. Se examina la anatomía externa. La estenosis meatal leve puede tratarse con dilatación secuencial con bujías de McCrae, mientras que la estenosis meatal grave puede requerir una meatotomía formal. A continuación, se introduce en la uretra un cistoscopio lubricado y se inicia la irrigación. En los pacientes varones, el pene se coloca en tracción y se dirige hacia arriba. Esta posición es óptima para la uretroscopia de la uretra anterior; luego, se desciende la mano del cirujano para permitir el paso a la uretra posterior y la vejiga. Se realiza una evaluación sistemática de la vejiga, se efectúan las intervenciones complementarias necesarias y se visualiza la uretra con entrada activa de irrigación durante la retirada del cistoscopio. Obsérvese que la inspección de la vejiga aumentada puede ser difícil debido a pliegues mucosos y producción de moco. La irrigación para evacuar el moco de la vejiga y el uso juicioso de la irrigación pueden mejorar la visualización. Debe evitarse la sobredistensión de la vejiga aumentada, ya que esto puede provocar perforación vesical. El cistoscopio flexible se introduce por vía uretral de forma similar a un catéter uretral y se deflecta la punta según sea necesario para la visualización y la inspección al entrar en la vejiga.
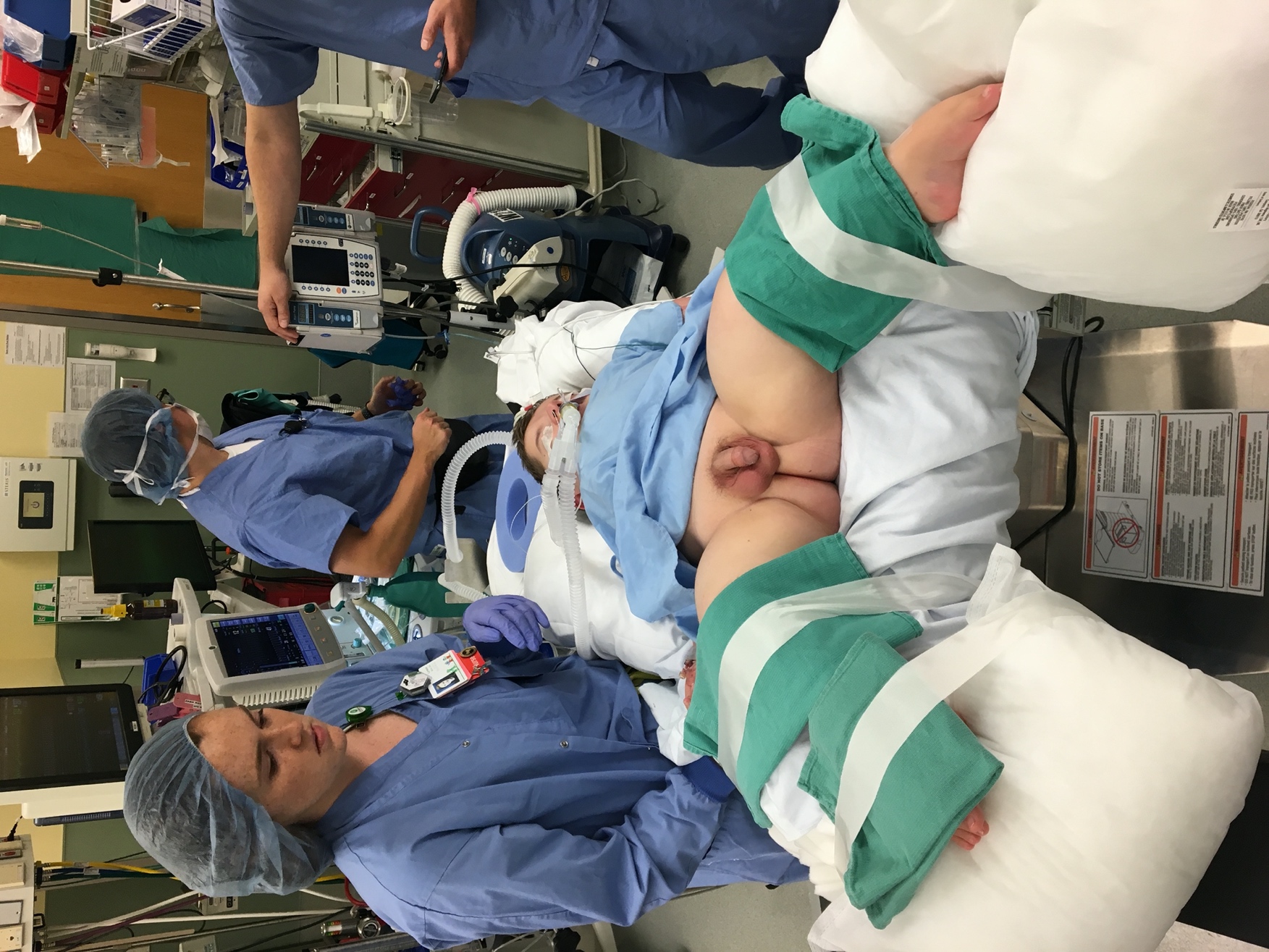
Figura 1 Litotomía dorsal modificada. Colocación cuidadosa en litotomía dorsal modificada en un paciente con osteogénesis imperfecta para la extracción ureteroscópica de cálculos.
La cistoscopia también puede realizarse a través del trayecto de un catéter suprapúbico, una vesicostomía o un conducto cateterizable con técnica similar. Es importante documentar los detalles quirúrgicos (p. ej., tipo de segmento entérico utilizado, trayecto del conducto, mecanismo de continencia) antes de la endoscopia. Los conductos cateterizables son delicados y no se debe avanzar el cistoscopio hasta visualizar la luz, para evitar lesión o perforación del conducto.
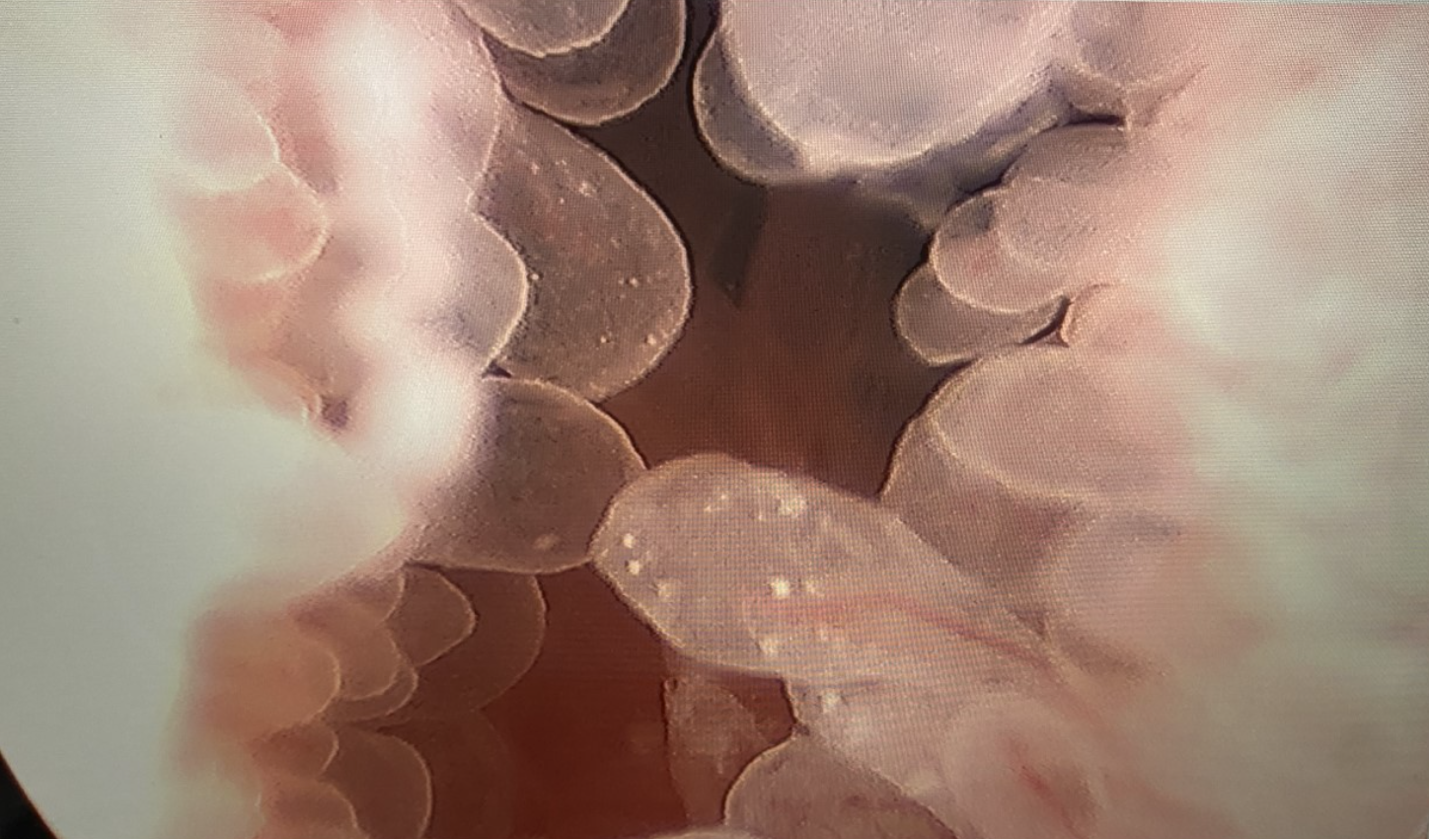
Figura 2 Cistoscopia con resección transuretral de tumor vesical. Resección transuretral de una masa papilar del cuello vesical en un varón adolescente con cistitis eosinofílica.
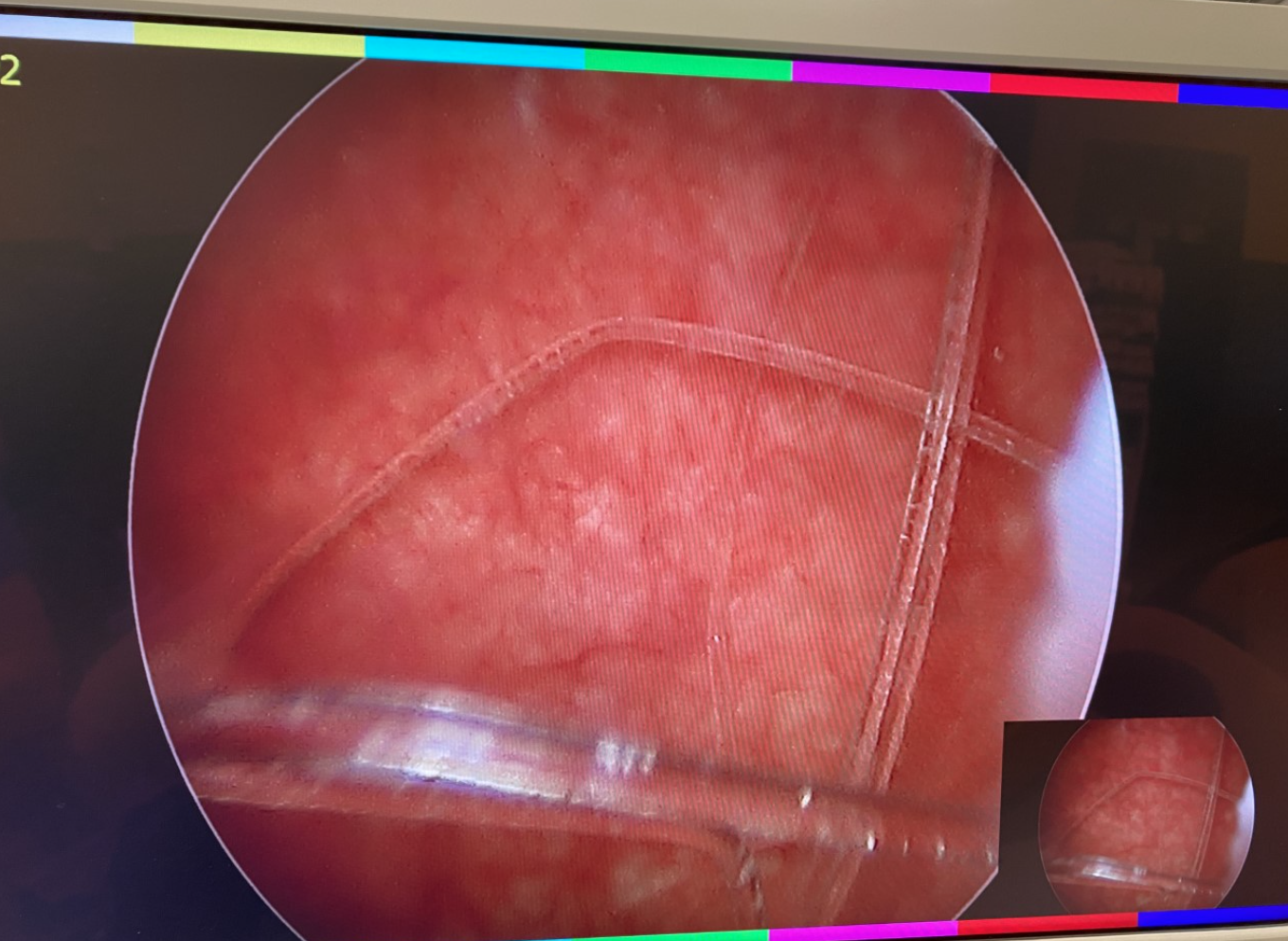
Figura 3 Cuerpo extraño vesical. Cistoscopia con extracción mediante cesta de un cuerpo extraño vesical.
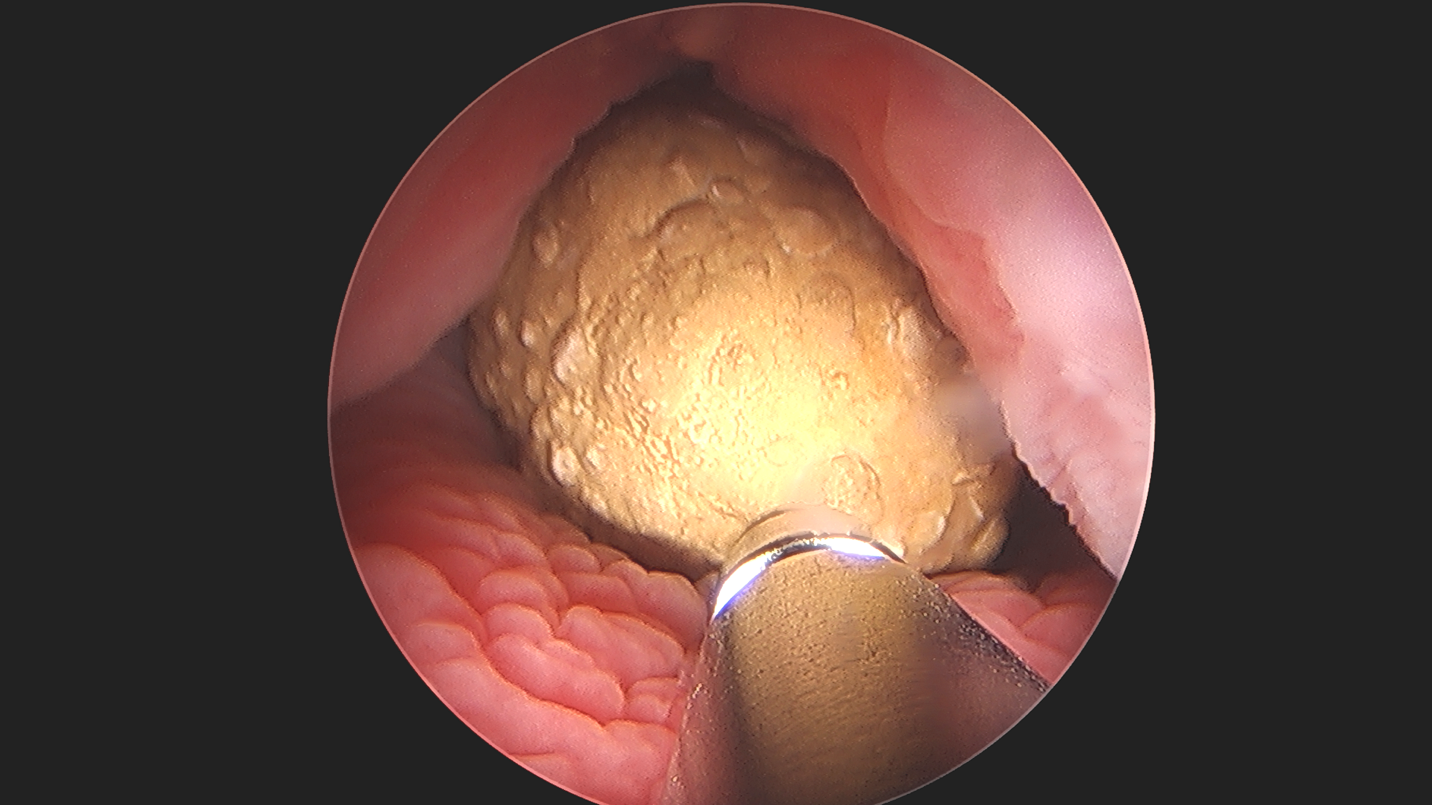
Figura 4 Cistolitotomía percutánea. Litotricia ultrasónica de un cálculo vesical de gran tamaño en una vejiga aumentada, lo que demuestra la aplicabilidad y la versatilidad de la endoscopia.
Complicaciones
Las complicaciones tras la cistouretroscopia diagnóstica son poco frecuentes e incluyen bacteriuria asintomática (5–8%), infección del tracto urinario sintomática (2–5%) y hematuria macroscópica.13
Cuidados postoperatorios y seguimiento
La cistouretroscopia suele ser un procedimiento quirúrgico ambulatorio y provoca una incomodidad mínima o nula en los pacientes. Salvo que esté contraindicado, siempre aplicamos anestésicos tópicos al final de la cistouretroscopia (p. ej., gel de lidocaína). No prescribimos antibióticos posoperatorios, a menos que el paciente presente factores de riesgo de urosepsis y se realice un tratamiento endoscópico.12 La profilaxis antibiótica continua para el reflujo vesicoureteral se mantiene hasta el seguimiento ambulatorio posterior a la inyección endoscópica. La disuria u otros síntomas de almacenamiento del tracto urinario inferior se tratan con acetaminofén o antiinflamatorios no esteroideos y anticolinérgicos, si es necesario. El seguimiento se determina según el diagnóstico del paciente y la intervención realizada.
Ureteroscopia
Indicaciones
La ureteroscopia proporciona acceso al tracto urinario superior con fines diagnósticos y terapéuticos. La mejora de la óptica y la miniaturización de los ureteroscopios permiten que los cálculos ureterales y renales que antes se trataban con litotricia por ondas de choque sean tratados ureteroscópicamente.14 Las Guías 2016 de la AUA/Endourology Society sobre el manejo quirúrgico de los cálculos señalan la ureteroscopia como una opción para pacientes pediátricos con una carga litiásica renal total de ≤ 20 mm.15 Otras indicaciones incluyen la incisión con láser para estenosis ureterales cortas, la endopielotomía para la obstrucción recurrente de la unión ureteropélvica (en casos seleccionados) y la evaluación de hematuria macroscópica lateralizante y defectos de llenado ureterales.
Equipo
Los ureteroscopios están disponibles en modelos flexibles y semirrígidos digitales y de fibra óptica, con una variedad de tamaños que van de 4.5–11 Fr.16 Los ureteroscopios semirrígidos son más pequeños, ya que la fibra óptica está incorporada en el endoscopio y requieren una fuente de luz y una cámara externas. Dos canales, uno utilizado para irrigación y el otro para el paso de instrumentos, mejoran la visualización. Los ureteroscopios semirrígidos se utilizan en el uréter distal a los vasos ilíacos.17 Los microureteroscopios, como el ureteroscopio semirrígido Ultrathin de 4.5 Fr (Richard Wolf, Knittlingen, Alemania), reducen el fracaso de acceso en uréteres pediátricos de pequeño calibre.18 Los ureteroscopios flexibles incorporan un sistema óptico, un mecanismo de deflexión y un canal de trabajo. Los modelos digitales incluyen la fuente de luz y la cámara integradas en el endoscopio, mientras que los modelos de fibra óptica requieren una cámara y una fuente de luz externas. La deflexión de la punta distal de hasta 270˚ permite la navegación por uréteres tortuosos y por la pelvis y los cálices renales.19 Se prefiere el ureteroscopio flexible para su uso en el uréter proximal a los vasos ilíacos y en la pelvis y los cálices renales. El mecanismo de deflexión del ureteroscopio flexible es delicado y puede dañarse con el uso repetido. Su canal de trabajo puede sufrir daños por el paso de instrumentos o por la activación inadvertida del láser dentro del endoscopio, lo que puede provocar el mal funcionamiento del dispositivo.11 En consecuencia, los ureteroscopios flexibles de un solo uso están ganando popularidad, ya que demuestran una eficacia similar a la de los ureteroscopios flexibles convencionales y pueden ofrecer ahorro de costos.20 En la actualidad, su papel en el paciente pediátrico está por dilucidarse.
La ureteroscopia debe realizarse en una sala de endoscopia bien equipada con todos los suministros necesarios, fluoroscopia y personal de quirófano experimentado. El equipo básico necesario para la ureteroscopia incluye endoscopios (semirrígidos y flexibles), un láser de holmio y fibras láser, guías, catéteres ureterales de extremo abierto, catéteres de doble luz, dilatadores coaxiales, vainas de acceso ureteral, cestas y stents ureterales. Debe haber disponibles instrumentos desechables de diversos tamaños, adaptados al tamaño del niño.
Consideraciones preoperatorias
Se debe realizar un urocultivo antes de la instrumentación del tracto urinario. Si existe una infección del tracto urinario o colonización bacteriana crónica, se debe tratar al paciente con antibióticos específicos según el cultivo y posponer el procedimiento debido al riesgo de bacteriemia y sepsis.11 La Declaración de Mejores Prácticas de la AUA sobre Procedimientos Urológicos y Profilaxis Antimicrobiana de 2019 recomienda una dosis única de TMP-SMX en el perioperatorio o una cefalosporina de 1a o 2a generación para los procedimientos ureteroscópicos.12 Aunque no existe una guía específica para pacientes pediátricos, en nuestra práctica usamos cefazolina con o sin gentamicina antes de la ureteroscopia.
Si bien el objetivo de la ureteroscopia con extracción de cálculos es lograr la eliminación completa de los cálculos con el menor número de procedimientos posible, pueden ser necesarios múltiples procedimientos para tratar con éxito los cálculos ureterales o renales en niños. El pequeño calibre de los uréteres pediátricos, especialmente en niños pequeños, puede dificultar el acceso ureteral directo. En casos de fallo en el acceso, la colocación de un stent ureteral proporciona una dilatación ureteral pasiva y puede aumentar la probabilidad de un acceso exitoso en el futuro. Sin embargo, no se recomienda la colocación rutinaria de stents ureterales antes del procedimiento.15
Técnica quirúrgica
Tras la inducción de la anestesia general y la administración de profilaxis antibiótica dirigida por guías, el paciente se coloca en posición de litotomía dorsal como se discutió previamente. Se utiliza solución de irrigación de suero salino isotónico calentada a temperatura corporal, dado el riesgo de absorción e hiponatremia.11 Se utiliza un cistoscopio para obtener acceso ureteral, y se realiza un pielograma retrógrado para definir la anatomía del sistema colector y determinar la localización del cálculo. Se coloca una guía de seguridad (0.025–0.038 pulgadas). También puede colocarse en este momento una guía de trabajo, lo que permite el paso de una vaina de acceso ureteral o un ureteroscopio flexible. El ureteroscopio se introduce en el orificio ureteral tras la hidrodilatación utilizando una bomba de irrigación manual y se avanza hasta el cálculo.21 Si el ureteroscopio no progresa, se coloca un stent ureteral para permitir la dilatación ureteral pasiva durante 2–3 semanas antes de repetir la ureteroscopia. De forma alternativa, puede emplearse la dilatación ureteral activa con un catéter de doble luz de 8–10 Fr o un dilatador coaxial, pero debe evitarse la dilatación con balón del orificio ureteral debido al riesgo de estenosis ureteral.22 Si el cálculo es demasiado grande para la extracción en bloque con cesta, se utiliza un láser de Holmio:YAG para tratar el cálculo utilizando ajustes de fragmentación (alta energía, baja frecuencia) o pulverización (baja energía, alta frecuencia). Los fragmentos grandes del cálculo se extraen con cesta y se envían para análisis del cálculo, y los fragmentos más pequeños (< 1mm) se dejan in situ para que pasen espontáneamente. Las vainas de acceso ureteral (9.5–14 Fr) deben utilizarse para cálculos ureterales proximales o renales grandes, ya que su uso ha demostrado disminuir las presiones intrarrenales, facilitar múltiples pasadas del endoscopio y proteger el uréter del traumatismo.23 Sin embargo, el uso de una vaina de acceso ureteral no siempre es factible debido al pequeño calibre de los uréteres pediátricos. Tras completar la litotricia, puede colocarse un stent ureteral. La decisión de colocar un stent ureteral se basa en el tiempo operatorio, la carga litiásica, el edema ureteral y el traumatismo durante el procedimiento. En casos seleccionados, los stents ureterales se colocan con un hilo externalizado que permite su retirada sin un segundo procedimiento. El uso de rayos X durante el procedimiento debe seguir el concepto ALARA (as low as reasonably achievable) ya que los niños con nefrolitiasis a menudo requieren más estudios de imagen en el futuro.24 El uso intermitente de rayos X de baja dosis con máxima distancia piel-objetivo, una ventana de imagen estrecha y la evitación de la ampliación puede reducir la exposición a la radiación del procedimiento.25
Complicaciones
Las series contemporáneas informan tasas globales de complicaciones de la ureteroscopia que oscilan entre 0-14% en pacientes pediátricos e incluyen infección del tracto urinario, hematuria, cólico renal, hidronefrosis posoperatoria y lesión ureteral.18,26,27,28 Las complicaciones más graves (> Clavien 3) son poco frecuentes, con avulsión ureteral completa y sepsis que ocurren en <1% de los pacientes.29 La menor edad puede asociarse con un mayor riesgo de complicaciones tras procedimientos ureteroscópicos. Una revisión sistemática de 10 estudios (1,377 procedimientos) demostró una mayor tasa de complicaciones en niños < 6 años (24%) en comparación con niños > 6 años (7.1%).28
Cuidados posoperatorios y seguimiento
La ureteroscopia es un procedimiento quirúrgico ambulatorio en la mayoría de los casos. El dolor posoperatorio se trata con antiinflamatorios no esteroideos y el uso de analgésicos opioides es limitado. Un ensayo controlado aleatorizado, doble ciego, reciente en pacientes adultos demostró que 10 mg de ketorolaco no fue inferior a 5 mg de oxicodona para el tratamiento del dolor después de la ureteroscopia.30 A los pacientes con stents ureterales se les prescriben anticolinérgicos y alfa-bloqueantes, ya que su uso puede reducir los síntomas asociados al stent ureteral.31,32 La obstrucción ureteral asintomática después de la ureteroscopia ocurre en hasta el 3% de los pacientes. Por lo tanto, es nuestra práctica realizar una ecografía renal 4 semanas después de la ureteroscopia en todos los pacientes.33
Nefroscopia
Indicaciones
La nefroscopia percutánea con nefrolitotomía es la piedra angular del tratamiento de los cálculos renales grandes y de los cálculos en riñones con anomalías anatómicas que impiden la litotricia con ondas de choque o la cirugía intrarrenal retrógrada.19 Históricamente, existían preocupaciones de que el uso de instrumentos y vainas de tamaño adulto (24–30 Fr) en riñones pediátricos provocara daño parenquimatoso y aumentara el riesgo de complicaciones a corto y largo plazo.34 Las guías de 2016 de la AUA/Endourology Society sobre el manejo quirúrgico de los cálculos recomiendan la PCNL como una opción de tratamiento para una carga litiásica renal total de >20mm.15 Además, la PCNL puede utilizarse para tratar cálculos en divertículos caliciales, otros riñones anatómicamente complejos, o cuando el acceso retrógrado no es factible, como ocurre con la derivación urinaria.
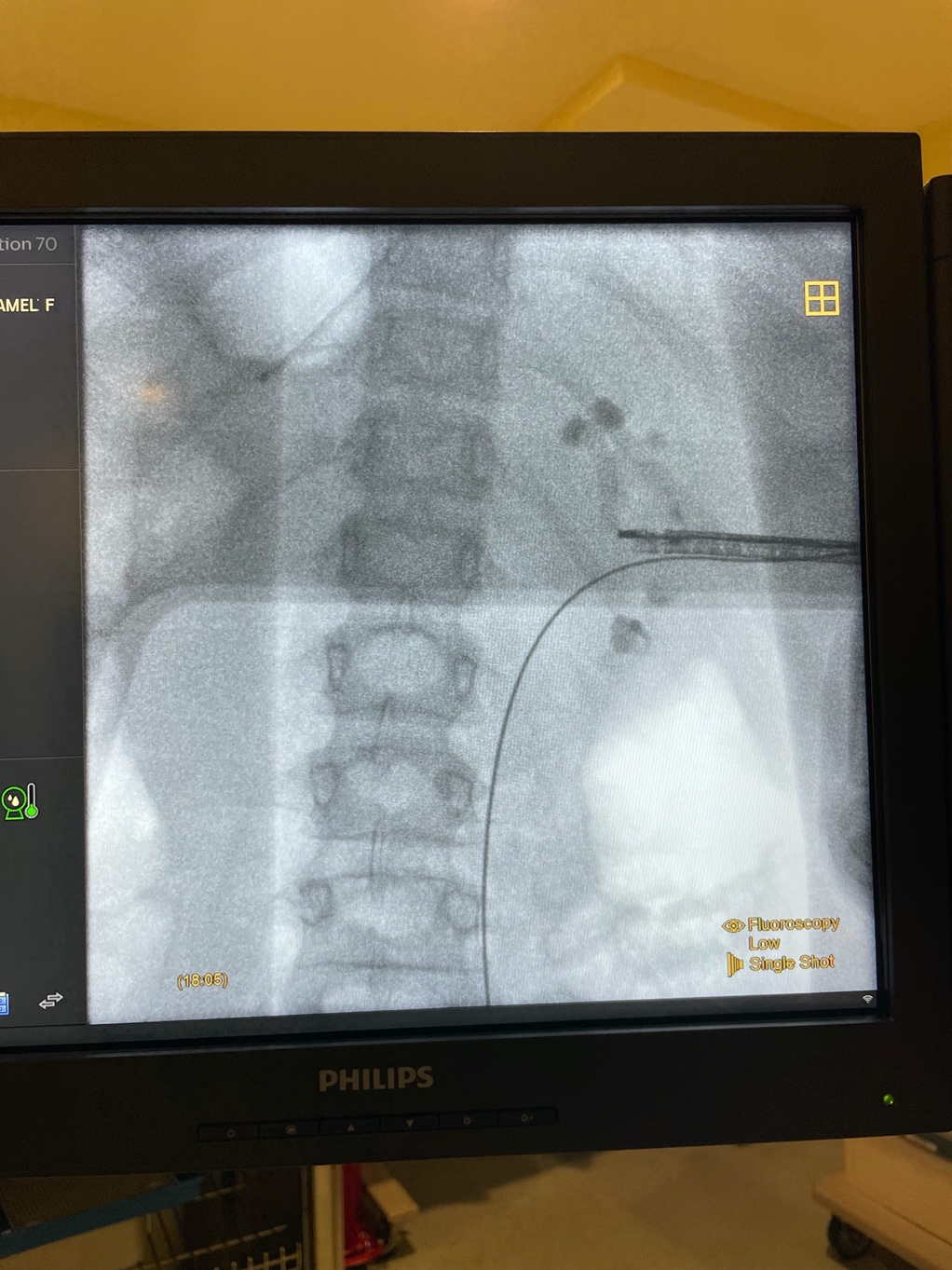
Figura 5 Nefroscopia rígida. Imágenes de rayos X durante una PCNL de reexploración para cálculos renales de gran tamaño utilizando un nefroscopio rígido con acceso interpolar.
Equipo
Los nefroscopios rígidos permiten la visualización de la pelvis renal y los cálices, están disponibles en modelos de fibra óptica y digitales, y se presentan en una variedad de tamaños (4.8–24 Fr).16 El modelo de lentes en varilla de fibra óptica requiere una cámara externa y una fuente de luz, mientras que el modelo digital incorpora el endoscopio, la fuente de luz y la cámara en el dispositivo.35 Un canal de trabajo permite la introducción de instrumentos y los puertos de entrada y salida permiten el llenado y vaciamiento simultáneos del sistema colector.
Los litotritores intracorpóreos incluyen modelos ultrasónicos, neumáticos y combinados.35 Un sistema de aspiración de gran calibre incorporado elimina los fragmentos de cálculos y el polvo durante la litotricia.
La PCNL estándar implica el uso de una vaina de Amplatz de 24–30 Fr y de instrumentos de tamaño adulto. Ante la preocupación de que el uso de instrumentos de tamaño adulto pueda aumentar las tasas de complicaciones en la PCNL pediátrica, se desarrollaron técnicas que emplean instrumentos más pequeños. Mini-PCNL describe el uso de tractos de nefrostomía de 15–24 Fr, la ultra-mini PCNL con tractos de 11–15 Fr y la micro-PCNL con tractos < 10 Fr.16 Los procedimientos deben realizarse en un quirófano con personal experimentado, fluoroscopia y equipo adecuado en una variedad de tamaños. Los instrumentos necesarios para la PCNL incluyen nefroscopios rígidos y flexibles, dilatadores con balón o de Amplatz, vainas de acceso, láser de holmio:YAG, litotriptor neumático o ultrasónico, guías, catéteres ureterales, catéteres de doble lumen y cestas.
Consideraciones preoperatorias
Todos los pacientes considerados para PCNL deben someterse a una tomografía computarizada de baja dosis del abdomen y la pelvis para determinar la factibilidad y evaluar la carga litiásica renal total.15 Además, las imágenes de sección transversal permiten determinar el cáliz óptimo para el acceso, la proximidad a los órganos circundantes (colon, pleura, costillas) y las alteraciones en la anatomía renal.
Debe realizarse un urocultivo preoperatorio y todos los pacientes con una infección del tracto urinario deben ser tratados con antibióticos dirigidos según el cultivo antes del procedimiento. Es importante señalar que un cultivo del tracto urinario inferior puede no reflejar los cultivos del cálculo o de la orina del tracto superior. La Declaración de Buenas Prácticas de la AUA de 2019 sobre Procedimientos Urológicos y Profilaxis Antimicrobiana recomienda las siguientes opciones de antibióticos antes de la PCNL, basadas en literatura de alta calidad en pacientes adultos: cefalosporina de 1a/2a generación, aminoglucósido y metronidazol, aztreonam y metronidazol, aminoglucósido y clindamicina o aztreonam y clindamicina.12 La literatura sobre la profilaxis antibiótica preoperatoria antes de la PCNL en pacientes pediátricos es limitada. Una revisión retrospectiva de 830 niños de < 12 años de edad examinó la tasa de infección urinaria febril después de la PCNL. Se encontró que las cefalosporinas de primera, segunda y tercera generación fueron igualmente eficaces para la profilaxis en niños < 12 sometidos a PCNL.36 En nuestra práctica, usamos cefazolina y gentamicina como profilaxis antibiótica antes de la PCNL.
Consideraciones quirúrgicas
Tras la inducción de anestesia general y la administración de antibióticos intravenosos, el paciente se coloca en decúbito prono sobre rodillos de gel. Se realiza el acceso percutáneo al cáliz deseado bajo guía fluoroscópica o ecográfica. Alternativamente, radiología intervencionista puede obtener un acceso percutáneo guiado por TC en casos de anatomía aberrante o disrafismo espinal. Pueden ser necesarios múltiples accesos para el tratamiento de cálculos coraliformes parciales o completos. Se colocan una guía de trabajo y una guía de seguridad, se incide la piel y se dilata el trayecto con un balón o con dilatadores de Amplatz, según preferencia del cirujano. La elección del dilatador y del tamaño de la vaina se basa en la edad del paciente, el hábito corporal, la anatomía, la carga litiásica y el tamaño del nefroscopio disponible. Tenga en cuenta que los riñones pediátricos son más móviles que los riñones de los adultos y pueden desplazarse al dilatar o avanzar la vaina.37 A continuación, la vaina se introduce sobre el dilatador hasta el sistema colector. Recortar la vaina puede mejorar la maniobrabilidad. Se utiliza líquido isotónico templado dada la propensión a la hipotermia y la hipervolemia. Se avanza el nefroscopio rígido hasta el cálculo y se inicia la fragmentación, utilizando un láser de holmio:YAG o un litotriptor. Los fragmentos se extraen y se envían para análisis del cálculo y cultivo. Se utiliza un cistoscopio o ureteroscopio flexible para realizar nefroscopia flexible y se extraen los fragmentos residuales. Tras la eliminación de la carga litiásica, puede colocarse un tubo de nefrostomía percutánea, un stent ureteral o ambos. Esta decisión se basa en la complejidad quirúrgica, la carga litiásica residual, la necesidad de un procedimiento de segunda mirada y la preferencia del cirujano.38 Recomendamos limitar el tiempo operatorio a 90 minutos, ya que tiempos operatorios prolongados aumentan el riesgo de ITU febril posoperatoria.36
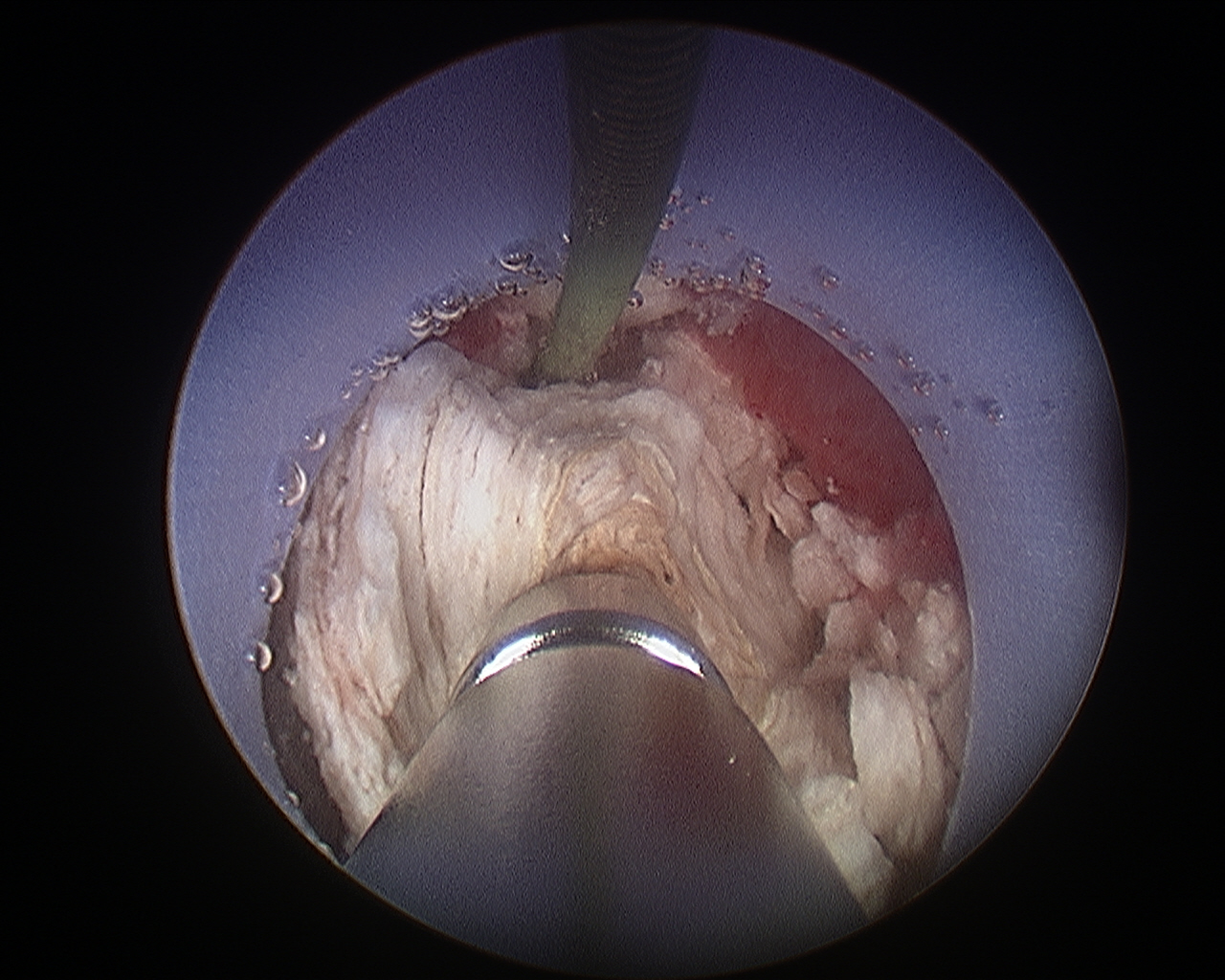
Figura 6 Nefrolitotomía percutánea. Litotricia ultrasónica de un cálculo renal grande durante una nefrolitotomía percutánea.
Complicaciones
Las series contemporáneas informan tasas de complicaciones tras la PCNL pediátrica de 11–40%.34,39 Las complicaciones más comunes son la infección urinaria febril y la hemorragia que requiere transfusión.34,39 Las complicaciones graves, como la hemorragia masiva, la fuga de orina que requiere drenaje, la lesión visceral (colon, pleura), la lesión de la pelvis renal y el hidrotórax, son poco frecuentes, con 84% de las complicaciones < grado III de Clavien.34,39 El tamaño del cálculo, la complejidad del caso y el tiempo operatorio se asocian con las tasas de complicaciones.34,40 La PCNL ultra-mini y micro, que usan tractos de acceso más pequeños, demuestran tasas globales de complicaciones más bajas (11.2%).41
Cuidados posoperatorios y seguimiento
Después de la PCNL, los pacientes permanecen hospitalizados durante 2–5 días. Se continúan los antibióticos perioperatorios durante 24 horas después de la cirugía. Se solicitan pruebas de laboratorio para evaluar anomalías electrolíticas y/o pérdida sanguínea significativa. Se obtienen estudios de imagen posoperatorios para evaluar la carga residual de cálculos y planificar tratamiento quirúrgico adicional. Si no se planea un PCNL de reexploración y la hematuria macroscópica ha cedido, se retira el tubo de nefrostomía antes del alta hospitalaria. Con frecuencia, se requieren procedimientos adicionales para lograr la eliminación completa de los cálculos. Las tasas libres de cálculos tras la PCNL oscilan entre 63–85.4% y aumentan a 91.7–93.7% con tratamiento posterior (PCNL de reexploración, litotricia por ondas de choque, cirugía intrarrenal retrógrada).34,42,43
Conclusiones
Los avances tecnológicos en el equipo endoscópico han transformado el campo de la urología pediátrica, mejorando el potencial diagnóstico y terapéutico. Afecciones que anteriormente se trataban con procedimientos quirúrgicos abiertos ahora se manejan endoscópicamente. A medida que la innovación en dispositivos avanza a un ritmo exponencial, también deberían hacerlo los estudios prospectivos de alta calidad para esclarecer el papel de esta nueva tecnología en el arsenal terapéutico del urólogo pediátrico.
Puntos clave
- La miniaturización de los instrumentos endoscópicos para adultos y las mejoras tecnológicas dieron lugar al desarrollo de cistoscopios, ureteroscopios y nefroscopios pediátricos
- La elección del tipo y tamaño del endoscopio debe adaptarse a la edad, el tamaño, el hábitus corporal y la anatomía particular del niño
- La profilaxis antibiótica previa al procedimiento de rutina no se recomienda para la cistoscopia no complicada, pero está indicada para la instrumentación del tracto urinario superior
- Al realizar endoscopia pediátrica, debemos seguir el principio ALARA para limitar la exposición a radiación del procedimiento
- La eliminación completa de cálculos mediante ureteroscopia o PCNL puede requerir múltiples procedimientos dado el pequeño calibre del sistema colector y el uréter pediátricos
Recursos para pacientes
- https://www.urologyhealth.org/healthy-living/urologyhealth-extra/magazine-archives/summer-2020/kidney-stones-in-children
- https://pedsnet.org/pkids/
Lecturas recomendadas
- Tekgül S, Stein R, Bogaert G, Nijman RJM, Quaedackers J, Hoen L ’t, et al.. European Association of Urology and European Society for Paediatric Urology Guidelines on Paediatric Urinary Stone Disease. Eur Urol Focus 2021; 8 (3): 833–839. DOI: 10.1016/j.euf.2021.05.006.
- Kokorowski PJ, Chow JS, K S. Prospective Measurement of Patient Exposure to Radiation During Pediatric Ureteroscopy. Yearbook of Urology 2012; 2012 (4): 224–225. DOI: 10.1016/j.yuro.2012.07.025.
- Duty B, Conlin M. Principles of Urologic Endoscopy. In: Partin A, editor. Campbell-Walsh-Wein Urology. 12th ed. Philadelphia, PA: Elsevier; 2021. DOI: 10.1016/s0025-6196(12)60891-x.
Referencias
- REUTER MATTHIASA, REUTER HANSJ. The Development Of The Cystoscope. J Urol 1998; 59 (3): 638–640. DOI: 10.1016/S0022-5347(01)63691-7.
- Shah J. Endoscopy through the ages. BJU Int 2002; 89 (7): 645–652. DOI: 10.1046/j.1464-410x.2002.02726.x.
- Samplaski MK, Jones JS. Two centuries of cystoscopy: the development of imaging, instrumentation and synergistic technologies. BJU Int 2009; 103 (2): 154–158. DOI: 10.1111/j.1464-410x.2008.08244.x.
- Talwar HS. The journey of the “Lichtleiter”, the first ever cystoscope: An ode to Philipp Bozzini and his great invention. Eur Urol 1969; 81: S751. DOI: 10.1016/s0302-2838(22)00581-4.
- Nicholson P. Problems encountered by early endoscopists. Urology 1982; 19 (1): 114–119. DOI: 10.1016/0090-4295(82)90065-6.
- Herr HW. Max Nitze, the Cystoscope and Urology. J Urol 2006; 176 (4): 1313–1316. DOI: 10.1016/j.juro.2006.06.085.
- Sasian J. Harold H. Hopkins. Introduction to Aberrations in Optical Imaging Systems 1998; 2 (1): xvii–xviii. DOI: 10.1017/cbo9780511795183.
- Berci G, Paz-Partlow M. Electronic imaging in endoscopy. Surg Endosc 1988; 2 (4): 227–233. DOI: 10.1007/bf00705327.
- Gobbi D, Midrio P, Gamba P. Instrumentation for minimally invasive surgery in pediatric urology. Transl Pediatr 2015; 5 (4): 186–204. DOI: 10.21037/tp.2016.10.07.
- Osborn NK, Baron TH. The history of the “French” gauge. Gastrointest Endosc 2006; 63 (3): 461–462. DOI: 10.1016/j.gie.2005.11.019.
- Duty B, Conlin M. Principles of Urologic Endoscopy. In: Partin A, editor. Campbell-Walsh-Wein Urology. 12th ed. Philadelphia, PA: Elsevier; 2021. DOI: 10.1016/s0025-6196(12)60891-x.
- Lightner DJ, Wymer K, Sanchez J, Kavoussi L. Best Practice Statement on Urologic Procedures and Antimicrobial Prophylaxis. J Urol 2020; 203 (2): 351–356. DOI: 10.1097/ju.0000000000000509.
- TURAN HALE, BALCI UGUR, ERDINC FSEBNEM, TULEK NECLA, GERMIYANOGLU CANKON. Bacteriuria, pyuria and bacteremia frequency following outpatient cystoscopy. Int J Urol 2006; 13 (1): 25–28. DOI: 10.1111/j.1442-2042.2006.01219.x.
- Salerno A, Nappo SG, Matarazzo E, De Dominicis M, Caione P. Treatment of pediatric renal stones in a Western country: A changing pattern. J Pediatr Surg 2013; 48 (4): 835–839. DOI: 10.1016/j.jpedsurg.2012.09.058.
- Assimos D, Krambeck A, NL M. Faculty Opinions recommendation of Surgical management of stones: american urological association/endourological society guideline, PART I. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2016; 96 (4): 161–169. DOI: 10.3410/f.726388210.793519339.
- Silay MS. Recent Advances in the Surgical Treatment of Pediatric Stone Disease Management. European Urology Supplements 2017; 16 (8): 182–188. DOI: 10.1016/j.eursup.2017.07.002.
- Payne DA KJFX. Rigid and flexible ureteroscopes: technical features. In: Smith AD, Badlani GH, Preminger GM, Kavoussi LR, editors. Smith’s Textbook of Endourology. 3rd ed. West Sussex, UK: Wiley-Blackwell;2012:365-87; . DOI: 10.1002/9781444345148.ch34.
- Kucukdurmaz F, Efe E, Sahinkanat T, Amasyalı AS, Resim S. Ureteroscopy With Holmium:Yag Laser Lithotripsy for Ureteral Stones in Preschool Children: Analysis of the Factors Affecting the Complications and Success. Urology 2018; 111: 162–167. DOI: 10.1016/j.urology.2017.09.006.
- Tasian GE, Copelovitch LA. Management of pediatric kidney stone disease. In: Partin A, editor. Campbell-Walsh-Wein Urology. 12th ed. Philadelphia, PA: Elsevier; 2021. DOI: 10.1007/s11934-007-0067-8.
- Davis NF, Quinlan MR, Browne C, Bhatt NR, Manecksha RP, D’Arcy FT, et al.. Single-use flexible ureteropyeloscopy: a systematic review. World J Urol 2018; 36 (4): 529–536. DOI: 10.1007/s00345-017-2131-4.
- Soygur T, Zumrutbas AE, Gulpinar O, Suer E, Arikan N. Hydrodilation of the Ureteral Orifice in Children Renders Ureteroscopic Access Possible Without any Further Active Dilation. J Urol 2006; 176 (1): 285–287. DOI: 10.1016/s0022-5347(06)00580-5.
- MINEVICH EUGENE, DeFOOR WILLIAM, REDDY PRAMOD, NISHINAKA KAZUYUKI, WACKSMAN JEFFREY, SHELDON CURTIS, et al.. Ureteroscopy Is Safe And Effective In Prepubertal Children. J Urol 2005; 174 (1): 276–279. DOI: 10.1097/01.ju.0000161212.69078.e6.
- Auge BK, Pietrow PK, Lallas CD, Raj GV, Santa-Cruz RW, Preminger GM. Ureteral Access Sheath Provides Protection against Elevated Renal Pressures during Routine Flexible Ureteroscopic Stone Manipulation. J Endourol 2004; 18 (1): 33–36. DOI: 10.1089/089277904322836631.
- Kuhns LR, Oliver WJ, Christodoulou E, Goodsitt MM. The Predicted Increased Cancer Risk Associated With a Single Computed Tomography Examination for Calculus Detection in Pediatric Patients Compared With the Natural Cancer Incidence. Pediatr Emerg Care 2011; 27 (4): 345–350. DOI: 10.1097/pec.0b013e3182132016.
- Kokorowski PJ, Chow JS, K S. Prospective Measurement of Patient Exposure to Radiation During Pediatric Ureteroscopy. Yearbook of Urology 2012; 2012 (4): 224–225. DOI: 10.1016/j.yuro.2012.07.025.
- Tolga-Gulpinar M, Resorlu B, Atis G, Tepeler A, Ozyuvali E, Oztuna D, et al.. Safety and efficacy of retrograde intrarenal surgery in patients of different age groups. Actas Urol Esp (Engl Ed) 2015; 39 (6): 354–359. DOI: 10.1016/j.acuroe.2015.05.005.
- Dogan HS, Onal B, N S. Factors Affecting Complication Rates of Ureteroscopic Lithotripsy in Children: Results of Multi-Institutional Retrospective Analysis by Pediatric Stone Disease Study Group of Turkish Pediatric Urology Society. J Urol 2011; 186 (3): 1035–1040. DOI: 10.1016/j.juro.2011.04.097.
- Ishii H, Griffin S, Somani BK. Flexible ureteroscopy and lasertripsy (FURSL) for paediatric renal calculi: Results from a systematic review. J Pediatr Urol 2014; 11 (3): 164. DOI: 10.1016/j.jpurol.2015.01.010.
- De Coninck V, Keller EX, Somani B, Giusti G, Proietti S, Rodriguez-Socarras M, et al.. Complications of ureteroscopy: a complete overview. World J Urol 2020; 38 (9): 2147–2166. DOI: 10.1007/s00345-019-03012-1.
- Fedrigon D, Faris A, N K. SKOPE–Study of Ketorolac vs Opioid for Pain after Endoscopy: A Double-Blinded Randomized Control Trial in Patients Undergoing Ureteroscopy. Reply. J Urol 2021; 206 (6): 1529–1530. DOI: 10.1097/ju.0000000000002194.
- Zhou L, Cai X, Li H, Wang K-jie. Effects of \ensuremathα-Blockers, Antimuscarinics, or Combination Therapy in Relieving Ureteral Stent-Related Symptoms: A Meta-Analysis. J Endourol 2015; 29 (6): 650–656. DOI: 10.1089/end.2014.0715.
- Sivalingam S, Streeper NM, Sehgal PD, Sninsky BC, Best SL, Nakada SY. Does Combination Therapy with Tamsulosin and Tolterodine Improve Ureteral Stent Discomfort Compared with Tamsulosin Alone? A Double-Blind, Randomized, Controlled Trial. J Urol 2016; 195 (2): 385–390. DOI: 10.1016/j.juro.2015.08.104.
- Weizer AZ, Auge BK, Silverstein AD, Delvecchio FC, Brizuela RM, Dahm P, et al.. Routine Postoperative Imaging is Important After Ureteroscopic Stone Manipulation. J Urol 2002; 68 (2): 46–50. DOI: 10.1016/S0022-5347(05)64829-X.
- Goyal NK, Goel A, Sankhwar SN, Singh V, Singh BP, Sinha RJ, et al.. A critical appraisal of complications of percutaneous nephrolithotomy in paediatric patients using adult instruments. BJU Int 2014; 113 (5): 801–810. DOI: 10.1111/bju.12506.
- Canales BK, Pugh JW. New instrumentation in percutaneous nephrolithotomy. Indian J Urol 2010; 26 (3): 389. DOI: 10.4103/0970-1591.70579.
- Kaygısız O, Satar N, Güneş A, Doğan HS, Erözenci A, Özden E, et al.. Factors predicting postoperative febrile urinary tract infection following percutaneous nephrolithotomy in prepubertal children. J Pediatr Urol 2018; 14 (5): 448.e1–448.e7. DOI: 10.1016/j.jpurol.2018.04.010.
- Tekgül S, Stein R, Bogaert G, Nijman RJM, Quaedackers J, Hoen L ’t, et al.. European Association of Urology and European Society for Paediatric Urology Guidelines on Paediatric Urinary Stone Disease. Eur Urol Focus 2021; 8 (3): 833–839. DOI: 10.1016/j.euf.2021.05.006.
- Aghamir SMK, Salavati A, Aloosh M, Farahmand H, Meysamie A, Pourmand G. Feasibility of Totally Tubeless Percutaneous Nephrolithotomy Under the Age of 14 Years: A Randomized Clinical Trial. J Endourol 2012; 26 (6): 621–624. DOI: 10.1089/end.2011.0547.
- Hosseini MM, Irani D, Altofeyli A, Eslahi A, Basiratnia M, Haghpanah A, et al.. Outcome of Mini-Percutaneous Nephrolithotomy in Patients Under the Age of 18: An Experience With 112 Cases. Front Surg 2021; 8 (613812). DOI: 10.3389/fsurg.2021.613812.
- Nouralizadeh A, Basiri A, Javaherforooshzadeh A, Soltani MH, Tajali F. Experience of percutaneous nephrolithotomy using adult-size instruments in children less than 5 years old. J Pediatr Urol 2009; 5 (5): 351–354. DOI: 10.1016/j.jpurol.2008.12.009.
- Çitamak B, Dogan HS, Ceylan T, Hazir B, Bilen CY, Sahin A, et al.. A new simple scoring system for prediction of success and complication rates in pediatric percutaneous nephrolithotomy: stone-kidney size score. J Pediatr Urol 2019; 15 (1): 67.e1–67.e6. DOI: 10.1016/j.jpurol.2018.09.019.
- Baydilli N, Tosun H, Akınsal EC, Gölbaşı A, Yel S, Demirci D. Effectiveness and complications of mini-percutaneous nephrolithotomy in children: one center experience with 232 kidney units. Turk J Urol 2019; 46 (1): 69–75. DOI: 10.5152/tud.2019.19158.
- Jones P, Bennett G, Aboumarzouk OM, Griffin S, Somani BK. Role of Minimally Invasive Percutaneous Nephrolithotomy Techniques–Micro and Ultra-Mini PCNL (<15F) in the Pediatric Population: A Systematic Review. J Endourol 2017; 31 (9): 816–824. DOI: 10.1089/end.2017.0136.
- Xue W, Pacik D, Boellaard W, Breda A, Botoca M, Rassweiler J, et al.. Management of Single Large Nonstaghorn Renal Stones in the CROES PCNL Global Study. J Urol 2012; 187 (4): 1293–1297. DOI: 10.1016/j.juro.2011.11.113.
- Unsal A, Resorlu B, Kara C, Bozkurt OF, Ozyuvali E. Safety and Efficacy of Percutaneous Nephrolithotomy in Infants, Preschool Age, and Older Children With Different Sizes of Instruments. Urology 2010; 76 (1): 247–252. DOI: 10.1016/j.urology.2009.08.087.
Última actualización: 2025-09-21 13:35