08: Aplicaciones laparoscópicas y robóticas
Este capítulo durará aproximadamente 19 minutos para leer.
Breve historia de las aplicaciones laparoscópicas y robóticas en urología pediátrica
La laparoscopia y la laparoscopia asistida por robot forman parte de la cirugía mínimamente invasiva y se han vuelto cada vez más populares en todo el mundo. La historia de la laparoscopia se remonta a 1805, cuando Bozzini desarrolló el primer cistoscopio. El término laparoscopia (“laparothorakoskopie”) fue acuñado por el cirujano sueco Hans Christian Jacobaeus en 1901. Ese mismo año comunicó 17 casos de laparoscopia y 2 toracoscopias.1 En sus inicios, la laparoscopia presentaba muchas limitaciones y generó más preocupaciones por el aumento significativo de las tasas de complicaciones.
La técnica de vídeo se desarrolló en la década de 1960, lo que permitió a los cirujanos observar el campo operatorio en un monitor. El primer caso de técnica laparoscópica en urología pediátrica fue para testículos no descendidos no palpables, el cual fue reportado en 1976.2 Durante las décadas de 1970 y 1980, la laparoscopia solo obtuvo una aceptación generalizada con fines diagnósticos entre los urólogos pediátricos. La siguiente fase de la cirugía laparoscópica operativa fue en la década de 1990, cuando comenzaron a surgir procedimientos laparoscópicos más complejos siguiendo la práctica de la cirugía de adultos. En 1993, Kavoussi describió la primera pieloplastia laparoscópica en una mujer de 24 años. Dos años después, Craig Peters reportó la primera pieloplastia laparoscópica desmembrada para una obstrucción de la unión ureteropélvica derecha en un niño.3 La pieloplastia laparoscópica ha disminuido significativamente la duración de la estancia hospitalaria y ha mejorado el control del dolor posoperatorio. Desde entonces, varias empresas como Karl Storz Endocsopy, Richard Wolf comenzaron a trabajar con urólogos pediátricos para desarrollar y mejorar los instrumentos laparoscópicos.
En las últimas décadas, la cirugía laparoscópica se ha convertido en una parte importante de la práctica urológica pediátrica. En algunos casos, ha reemplazado la cirugía abierta convencional y en varios se reconoce como el enfoque estándar de oro. La cirugía laparoscópica presenta resultados comparables y, además, reduce las incisiones quirúrgicas a puertos de 3 mm y 5 mm. Con el objetivo de ausencia de cicatrices, incluso la cirugía endoscópica transluminal por orificios naturales (NOTES) y la cirugía laparoscópica de sitio único son posibles y se practican en algunos centros.4
En 2000, la FDA aprobó un sistema quirúrgico robótico denominado da Vinci Surgical System, desarrollado por Intuitive Surgical. Está diseñado para facilitar la cirugía laparoscópica y es controlado por un cirujano desde una consola en el quirófano. Presenta ventajas como una visión 3D estable y ampliada, filtrado del temblor y escalado de los movimientos para una exposición y sutura intracorpóreas precisas. En las dos últimas décadas, la cirugía asistida por robot se ha utilizado comúnmente en urología, ginecología, cirugía general y cirugía pediátrica. El sistema quirúrgico da Vinci ha evolucionado desde el modelo S de primera generación al Si y, más recientemente, al Xi y al sistema SP de puerto único.

Figura 1 La evolución del sistema quirúrgico da Vinci
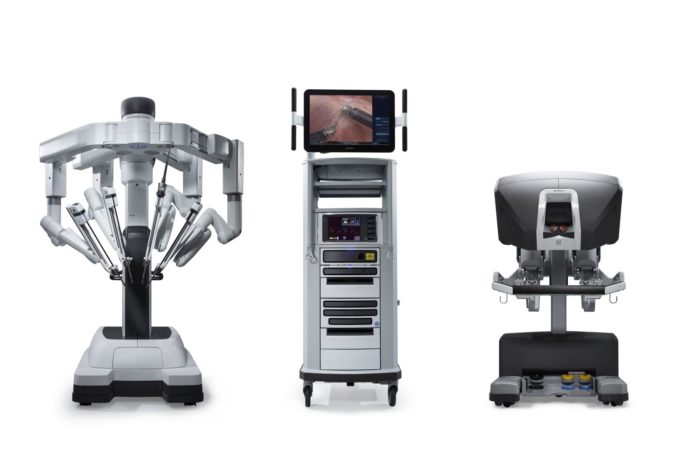
Figura 2 Sistema quirúrgico da Vinci Xi
En 2001, Meininger reportó el primer caso de fundoplicatura de Nissen asistida por robot en un paciente pediátrico.5 Este trabajo inspiró el avance de la cirugía pediátrica. La pieloplastia laparoscópica asistida por robot (RALP) fue la primera cirugía realizada con la plataforma da Vinci en el ámbito urológico pediátrico, reportada por Olsen y Jorgensen en 2004.6 En 2005, Atug describió su experiencia con RALP en siete pacientes pediátricos de entre 6 y 15 años.7 En 2006, Lee comparó los resultados de la RALP y la pieloplastia abierta (OP) emparejando por edad y sexo en 33 pacientes.8 Encontraron que el tiempo operatorio medio fue de 219 minutos en el grupo RALP, mientras que fue de solo 181 minutos en el grupo de procedimiento abierto. El tiempo operatorio de la RALP disminuyó significativamente después de 15 casos. La cohorte de RALP demostró una estancia hospitalaria más corta, menor requerimiento de analgésicos, y la tasa de éxito fue del 93.9%.9 Dada la alta tasa de éxito y la baja tasa de complicaciones de la RALP, algunos urólogos han ampliado este enfoque a lactantes. Recientemente, Andolfi publicó su serie de casos de RALP en lactantes y demostró que la RALP es una opción de manejo atractiva para la UPJO en lactantes, ya que presenta resultados satisfactorios, beneficios de una menor duración de la estancia hospitalaria y mejoría estética.10 El equipo de Higganbotham incluso realizó una orquiopexia laparoscópica asistida por robot en un niño con testículos no descendidos bilaterales.11
En la actualidad, la orquidopexia laparoscópica y la ligadura alta laparoscópica del conducto peritoneo‑vaginal se han convertido en tratamientos de rutina en todo el mundo. La cirugía laparoscópica asistida por robot también se ha generalizado en Estados Unidos, Europa y Asia. Muchas otras empresas han intentado desarrollar sistemas de robots quirúrgicos para desafiar el dominio de da Vinci Surgical Systems. Entre ellos se incluyen el sistema quirúrgico Senhance de TransEnterix, Single Port Orifce Robotic Technology (SPORT) de Titan Medical, Hinotori Surgical Robot System de Medicaroid, REVO‑I Robotic Surgical System de Meere Company, Edge surgical system de Edge Medical Robotics, entre otros. Decenas de sistemas quirúrgicos robóticos aún se encuentran en proceso de desarrollo.12 La demanda de cirugía asistida por robot sigue aumentando. Las nuevas tecnologías podrían potenciar los esfuerzos mínimamente invasivos y mejorar las capacidades de los sistemas previamente establecidos. Se necesitan estudios futuros para evaluar más a fondo las fortalezas y debilidades de cada dispositivo y plataforma quirúrgica robótica en el quirófano.13
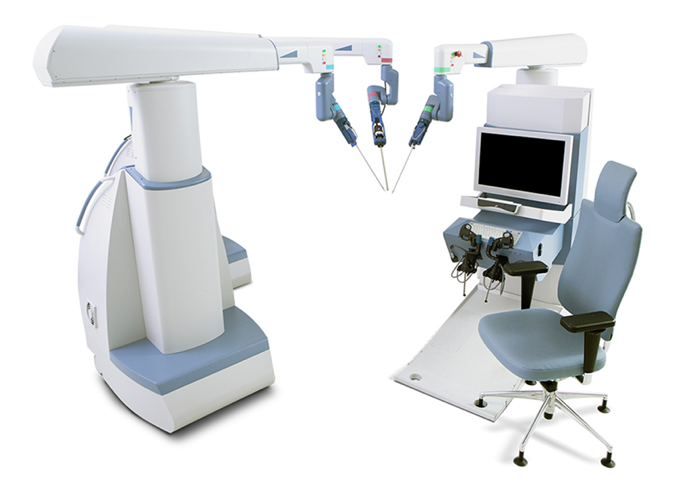
Figura 3 Sistema quirúrgico Senhance
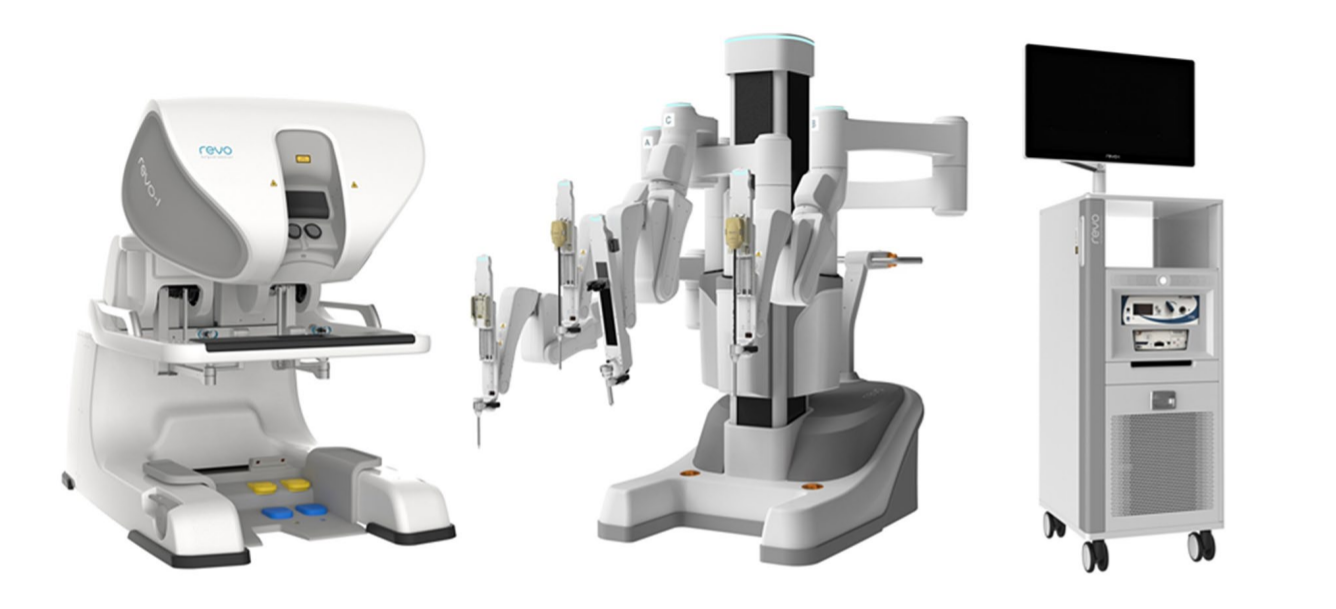
Figura 4 Sistema robótico REVO-I

Figura 5 Sistema robótico Hinotori
Instrumental para aplicaciones laparoscópicas y robóticas
Instrumentación de la cirugía laparoscópica urológica pediátrica
Equipo para neumoperitoneo
El equipo de neumoperitoneo consta de un insuflador de neumoperitoneo, cilindro de CO2, tubería de salida de gas e instrumental de punción. El insuflador de neumoperitoneo puede regular la presión del neumoperitoneo (6–10 mm Hg) y el flujo de gas. Los insufladores actuales pueden ajustar automáticamente la presión intraabdominal, insuflar gas con rapidez y monitorizar el consumo de CO2, y cuentan con alarmas por presión de CO2 insuficiente en el cilindro o por presión intraabdominal que exceda el rango preestablecido, de modo que el cirujano pueda detectar oportunamente cualquier problema, lo que mejora la seguridad de la intervención. Los insufladores de neumoperitoneo modernos (Figura 6) pueden lograr: ① Circulación automática para filtrar el humo y garantizar un campo quirúrgico despejado; ② Monitorización en tiempo real de la presión del neumoperitoneo para asegurar una presión constante; ③ Algunos equipos de insuflación para neumoperitoneo disponen de un sistema de calentamiento del gas para evitar el descenso de la temperatura corporal del paciente. ④ Eliminar las emisiones de humo hacia el quirófano, para proteger la salud de cirujanos y personal de enfermería.

Figura 6 Insuflador moderno para neumoperitoneo
Carro de alimentación eléctrica
El carro de potencia (Figura 7) integra el monitor, el insuflador, el sistema de cámara, el sistema de fuente de luz y el bisturí eléctrico en un solo carro, que es cómodo de empujar y facilita al operador cambiar la posición en cualquier momento.

Figura 7 Carro de energía
Sistema óptico
Actualmente, los laparoscopios utilizan en su mayoría ópticas de varilla con buena transmisión de luz, imágenes sin distorsión, imágenes planas, ángulos ultraamplios, brillo uniforme, gran profundidad de campo y una fuerte sensación estereoscópica. El diámetro es de 5–10 mm, la longitud de trabajo es de 31 cm y el campo de visión es de 0˚, 30˚ y 45˚ (Figura 8). El laparoscopio de 30˚ con un diámetro de 5 mm es el más utilizado en urología pediátrica, y ofrece las ventajas de cambiar el campo de visión quirúrgico, reducir las zonas ciegas, permitir la observación de la misma estructura desde distintos ángulos, facilitar la formación de una percepción tridimensional por parte del cirujano y reducir la interferencia mutua entre el laparoscopio y los instrumentos.
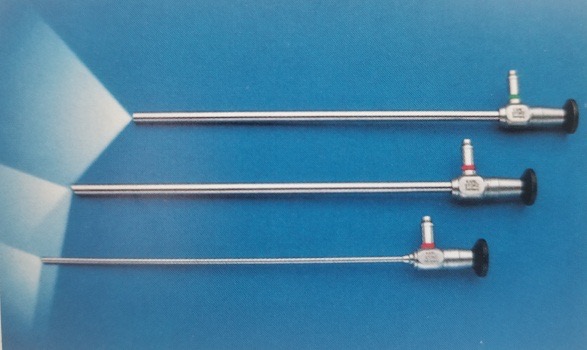
Figura 8 El laparoscopio de 0°, 30° y 45°.
Fuente de luz fría y sonda de fibra óptica
Una fuente de luz de baja temperatura o fría (Figura 7) proporciona proporciones iguales de luz en longitudes de onda roja, azul y verde para crear luz blanca y es el tipo más común de luz utilizado en la cirugía laparoscópica. Muchos dispositivos utilizan actualmente una lámpara de xenón (300 W) o una lámpara de xenón con tecnología LED acoplada a un ajuste automático del brillo para proporcionar una fuente de luz fiable durante la cirugía. La vida media de la lámpara es de hasta 3,000 horas. Este tipo de fuente de luz es económica, duradera y eficiente. La sonda de fibra óptica en la lente (Figura 8) está compuesta por un haz flexible de fibras guía de luz con transmisión de luz de alta calidad. Estas pueden romperse con la deflexión o la flexión de la lente y requieren reparación o reemplazo.
Sistema de cámara
El sistema de cámara laparoscópica (Figura 9) ha evolucionado de definición estándar a alta definición y a ultra alta definición, y más recientemente a sistemas de cámara 4K. A medida que mejora la resolución, puede ofrecer al operador vistas quirúrgicas más nítidas. La tecnología de laparoscopia 3D está disponible actualmente, pero solo está disponible con un diámetro de 10 mm, por lo que es menos común en urología pediátrica.
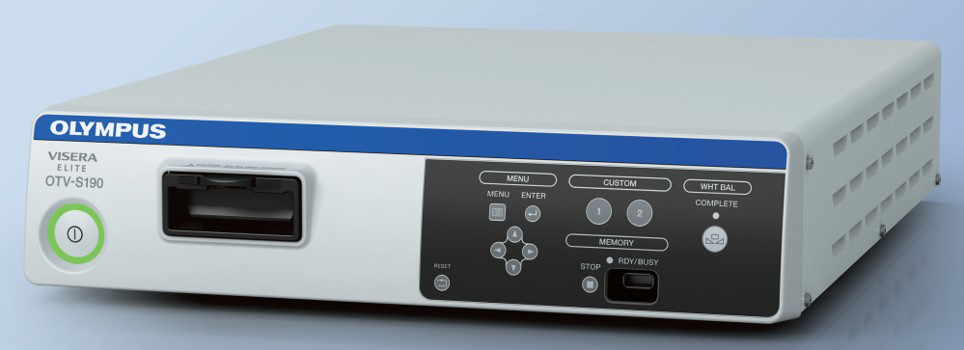
Figura 9 Sistema de cámara laparoscópica
Sistema electroquirúrgico
Se incluyeron el Electrodebrider y el sistema de electrocoagulación, bisturí ultrasónico (Harmonic scalpel), plataforma de energía y Ligasure. Estos dispositivos proporcionan diversos tipos de energía, incluidos el electrocauterio monopolar, el electrocauterio bipolar, la energía ultrasónica y combinaciones para ayudar a los cirujanos (Figura 10, Figura 11, Figura 12, y Figura 13).

Figura 10 Unidad de electrocirugía

Figura 11 Bisturí ultrasónico

Figura 12 Plataforma de energía

Figura 13 Ligasure
Otros instrumentos
Los instrumentos de uso común incluyen aguja de Veress, trócar, aplicadores de clips Hem-o-Lok, aplicadores de clips de titanio, pinzas de prensión, portaagujas, tijeras, entre otros (Figura 14, Figura 15, Figura 16).

Figura 14 Instrumental común
Figura 15 Trócar

Figura 16 Aguja de Veress

Figura 17 Aplicador de clips Hem-o-lok
Instrumentación de la cirugía laparoscópica asistida por el robot Da Vinci
El sistema quirúrgico da Vinci se compone principalmente de tres partes: consola del cirujano, sistema de brazo robótico junto a la cama (Patient Cart) y sistema de imagen 3D (Vision Cart), como se muestra en Figura 18.
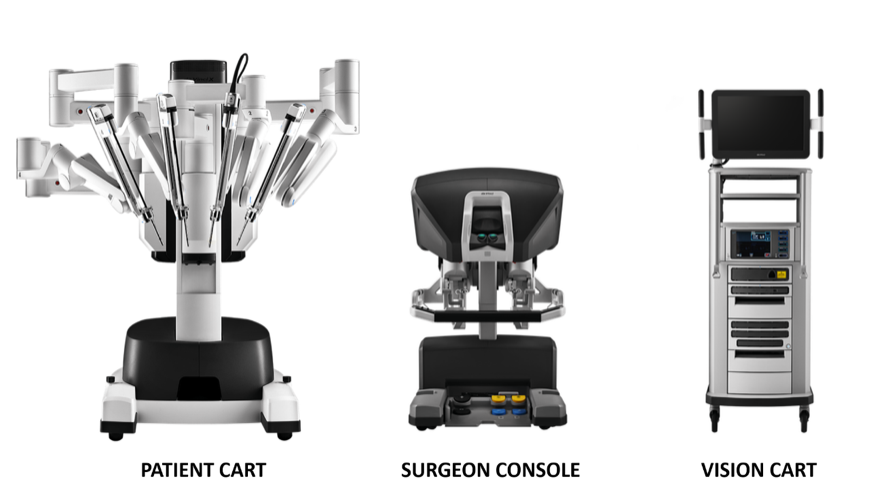
Figura 18 Tres componentes que componen el sistema da Vinci
Consola quirúrgica: Esta consola puede colocarse fuera de la puerta de la sala estéril del quirófano. Se basa principalmente en las manos y los pedales de pie del cirujano para controlar el brazo operativo y el endoscopio 3D de alta definición.
Sistema de brazos robóticos de cabecera (Carro del paciente): Este sistema es la parte quirúrgica del robot, que principalmente proporciona soporte para el brazo de instrumentos y el brazo de la cámara. Por lo general incluye de 2 a 3 brazos operativos, cada uno de los cuales está equipado con portaagujas, tijeras, pinzas de prensión, etc. Las posiciones pueden intercambiarse según las necesidades intraoperatorias, y el número de brazos mecánicos puede aumentarse o disminuirse.
Sistema de imagen 3D (Vision Cart): El sistema cuenta con un procesador central integrado y equipo de procesamiento de imágenes, que puede insertarse en equipos quirúrgicos auxiliares (sistema de insuflación), y proporciona una imagen tridimensional del campo visual quirúrgico tridimensional con señales de doble canal para que la visión intraoperatoria se acerque más al efecto visual a simple vista. El carro de visión incluye un par de controladores de videocámara, un par de fuentes de luz y sincronizadores de señales de video para los ojos izquierdo y derecho. La cámara endoscópica contiene lentes dobles, y las imágenes captadas a través de las lentes dobles forman una imagen 3D bajo la acción del sincronizador de señales de video, lo cual ayuda al cirujano a identificar las relaciones tisulares.
El equipo del robot da Vinci comúnmente utilizado en niños incluye lo siguiente. Trócar robótico, consolas, carro del paciente. Además del canal de la cámara endoscópica, que utiliza un canal de trabajo de 8 mm (Xi) o 8,5 mm (Si) de diámetro, los demás canales operativos utilizan sus canales de trabajo de 8 mm o 5 mm (Si). La cánula especial del sistema del robot da Vinci está marcada con una línea de marcaje "dos finas y una gruesa" en el extremo dentro de la cavidad abdominal. La profundidad de inserción en la pared abdominal es menor que la de un laparoscopio tradicional.
Conjunto estéril de brazo robótico de un solo uso con un adaptador. Es el “puente” entre el brazo robótico y el instrumento quirúrgico.
Instrumentos quirúrgicos: Cada instrumento quirúrgico se compone de tres partes: disco, vástago y articulación de la muñeca. Los instrumentos quirúrgicos robóticos de uso común en urología pediátrica se dividen en instrumentos quirúrgicos de 8 mm y de 5mm, e incluyen tijeras curvas unipolares, pinzas atraumáticas, portaagujas grande, pinzas bipolares fenestradas, bisturí electroquirúrgico de electrodo, tijeras curvas quirúrgicas, portaagujas y bisturí armónico (Xi). La articulación EndoWrist de los instrumentos permite un control preciso con ±90 grados de articulación en la muñeca, escalado del movimiento y eliminación del temblor de la mano. Con los instrumentos laparoscópicos estándar hay cuatro grados de libertad en dos ejes (movimiento hacia adentro, hacia afuera, en sentido horario y en sentido antihorario).
Posicionamiento del paciente, colocación de los trócares y acceso inicial
Cirugía del tracto urinario superior
Para la cirugía laparoscópica del tracto urinario superior, solemos seleccionar el decúbito supino reclinado hacia el lado sano, con el lado afectado acolchado entre 45˚ y 60˚, lo más cerca posible del borde de la cama, a unos 1 cm.
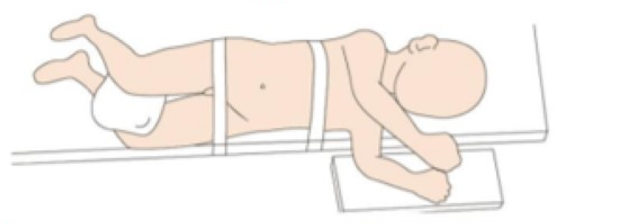
Figura 19 Posición del paciente para cirugía laparoscópica del tracto urinario superior
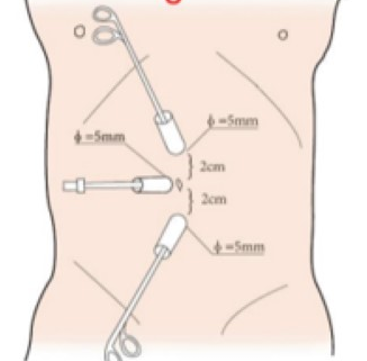
Figura 20 Posición del trócar para laparoscopia del tracto urinario superior
Para la selección de la posición del paciente en cirugía laparoscópica del tracto urinario superior asistida por robot, tenemos cuatro reglas: en primer lugar, el paciente se coloca en posición de riñón para proporcionar espacio operatorio y evitar la interferencia con los brazos del robot. En segundo lugar, el paciente se coloca cerca del borde de la mesa para disminuir la distancia con el asistente. Con el uso de la rotación de la mesa, preferimos la posición de decúbito lateral a 80˚. Por último, el manejo de la temperatura en el quirófano es muy importante. Se deben utilizar una máquina de aire caliente y mantas térmicas para la cirugía en lactantes.
Todos los puertos se colocaron bajo visión directa, incluyendo un trócar de cámara de 8.5 mm, un trócar de 8 mm y un trócar de 5 mm. Se colocaron uno o dos trócares auxiliares adicionales de 3 mm a 3 cm laterales del punto medio de la línea de Pfannenstiel, para mejorar la eficiencia de la sutura
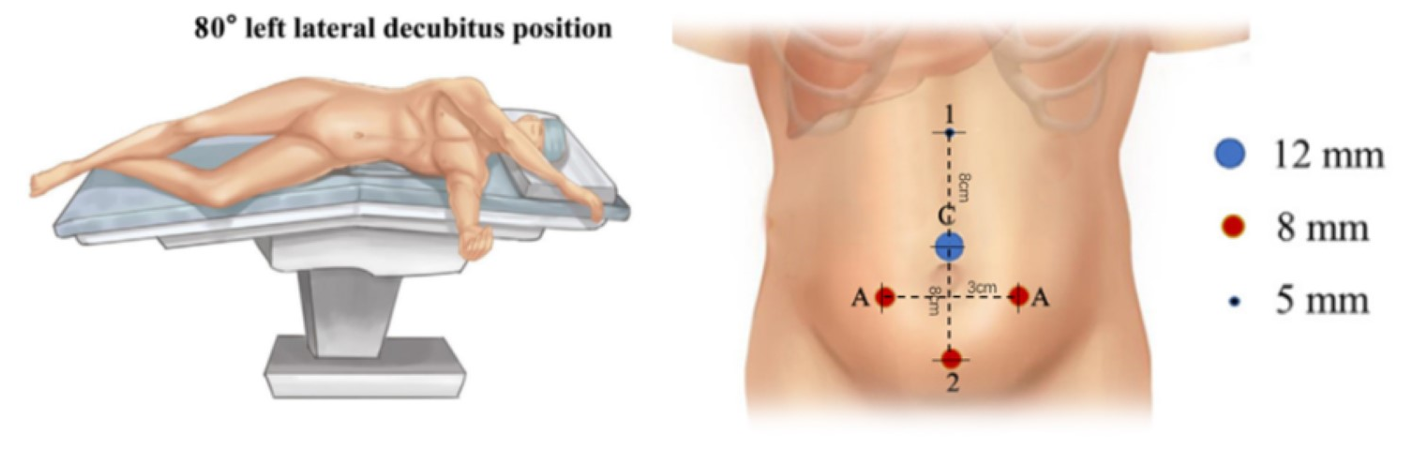
Figura 21 Posición del paciente y de los trócares para la cirugía laparoscópica del tracto urinario superior asistida por robot
Cirugía del tracto urinario inferior
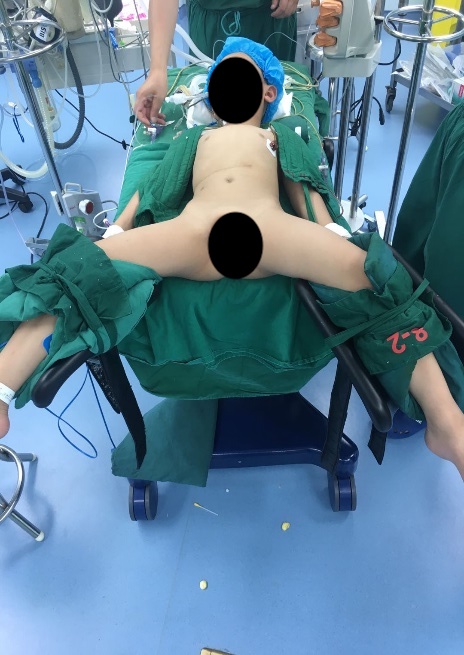
Figura 22 Posición de litotomía modificada para cirugía del tracto urinario inferior
Para la cirugía del tracto urinario inferior, tanto la cirugía laparoscópica como la cirugía laparoscópica asistida por robot, empleamos la posición de litotomía modificada con la cabeza hacia abajo 30–45˚. Se colocan puertos laparoscópicos o robóticos, incluido un trócar de cámara a través del ombligo, y dos trócares adicionales colocados a nivel umbilical, con una distancia de 4–6 cm entre ellos.
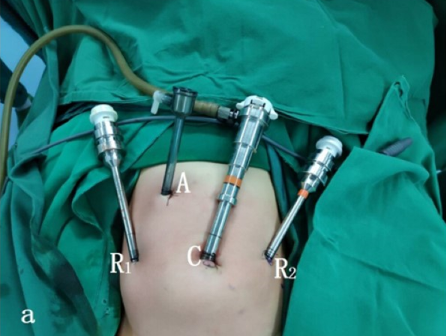
Figura 23 Posición del trócar para cirugía del tracto urinario inferior
Aplicaciones de la técnica laparoscópica y robótica
Pieloplastia
La evidencia sólida ha demostrado que la pieloplastia laparoscópica o la RALP no solo tienen tasas de éxito iguales a las de la pieloplastia abierta, sino que también presentan las ventajas de ser mínimamente invasivas, ofrecer un mejor resultado estético, ocasionar menos dolor posoperatorio, disminuir la duración de la estancia hospitalaria y permitir una recuperación temprana. La pieloplastia desmembrada de Anderson-Hynes es el estándar de oro para cualquier abordaje.
Pieloplastia laparoscópica
Para la pieloplastia laparoscópica, tanto el abordaje transperitoneal como el retroperitoneal pueden proporcionar un campo operatorio satisfactorio. Sin embargo, en la cirugía asistida por robot, el espacio retroperitoneal es demasiado reducido. Por lo tanto, presentamos tanto el abordaje transperitoneal como el retroperitoneal para la pieloplastia laparoscópica y el abordaje transperitoneal para la RALP.
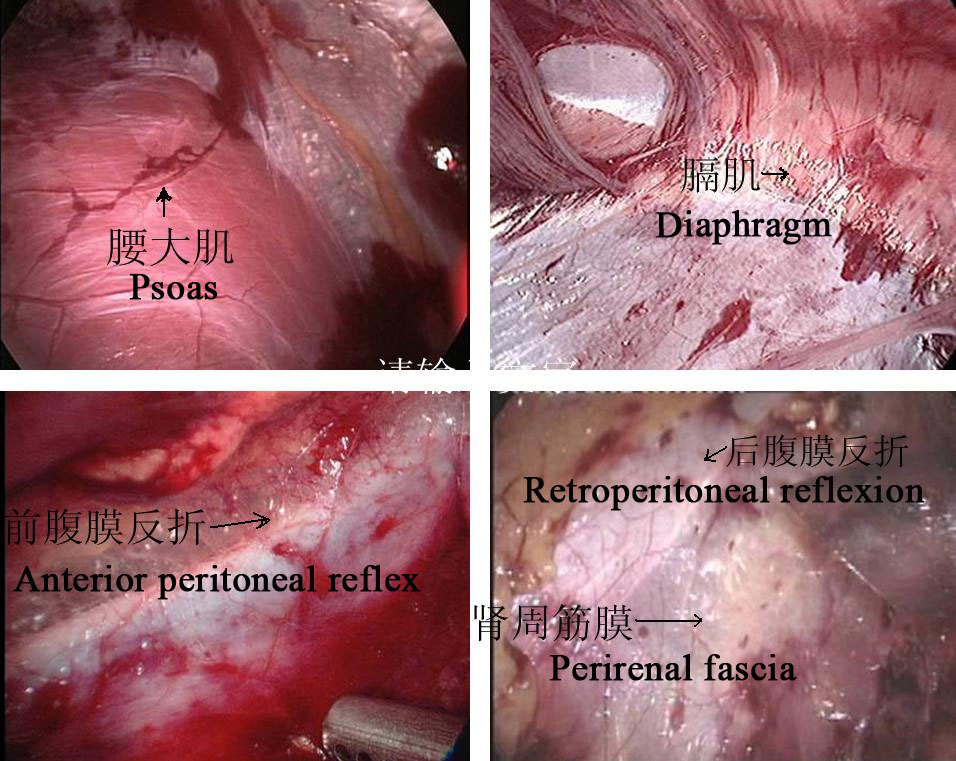
Figura 24 Marcadores anatómicos retroperitoneales
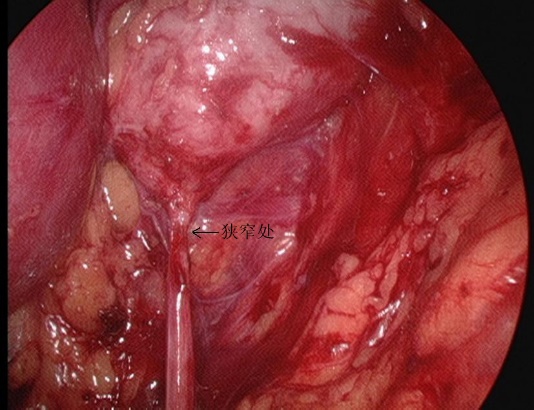
Figura 25 La porción estenótica de la UPJ desde la vista retroperitoneal
Abordaje retroperitoneal
- Realizar una incisión longitudinal de la piel 1.5–2.0 cm por debajo de la punta de la 12.ª costilla en la línea axilar posterior. La membrana tendinosa en el origen del músculo transverso del abdomen y la fascia lumbodorsal se separan romamente con pinzas vasculares para alcanzar el área perirrenal. Tras la separación roma del espacio perirrenal con el dedo índice, se coloca un balón para crear el espacio operatorio retroperitoneal, y se mantiene la presión de neumoperitoneo en 8–14 mmHg, con un promedio de 10 mm Hg.
- La fascia perinefrítica se corta longitudinalmente con bisturí ultrasónico para exponer la cara dorsal del polo inferior del riñón, y se separan la pelvis renal y el uréter superior para revelar el sitio y la causa de la estenosis. Separar la cara dorsal de los polos medio e inferior del riñón, liberar y exponer completamente la pelvis renal y el uréter superior, y aclarar la UPJO.
- Cortar la pelvis renal. Mantener la parte medial de la pelvis incompletamente desprendida y aún conectada al uréter, y abrir el uréter longitudinalmente hasta sobrepasar la estenosis en 1.0 a 2.0 cm.
- Suturar el colgajo de la pelvis renal con el punto más declive del uréter utilizando sutura absorbible 5-0.
- Seccionar el uréter aproximadamente 0.5 cm proximal al segmento estenótico y completar posteriormente el corte de la pelvis renal para retirar el segmento estenótico de la UPJ y parte de la pelvis renal dilatada.
- Sutura secuencial de la pared posterior de la anastomosis con 1 punto de bloqueo cada 2 puntos.
- Continuar la sutura del orificio del colgajo de pelvis renal sobrante sin cortar las suturas.
- Colocación de un catéter doble J en línea a través de la anastomosis.
- Sutura interrumpida de la pared anterior de la anastomosis.
- En presencia de compresión vascular ectópica, el vaso se coloca dorsal al uréter de la pelvis renal para plicatura, se reduce la presión de neumoperitoneo, se confirma que no hay sangrado activo en el campo operatorio y se deja en su lugar un drenaje retroperitoneal a través de una aguja de trócar en la cresta ilíaca para cerrar la incisión.
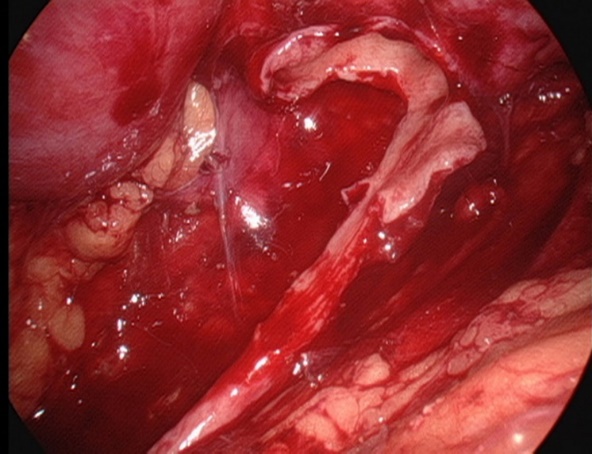
Figura 26 Mantenga la porción medial de la pelvis renal incompletamente separada y aún conectada al uréter
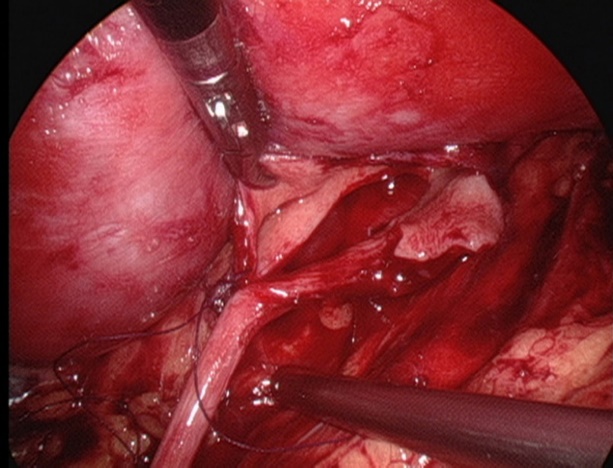
Figura 27 Suture el punto más inferior del uréter
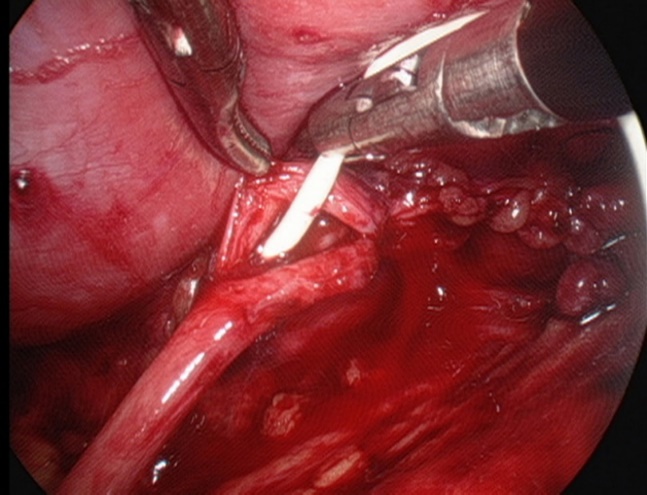
Figura 28 Colocación de un catéter doble J
Abordaje transperitoneal
- Tras establecer un acceso normal con trócar, la presión neumoperitoneal se mantiene en 8–14 mmHg, con una media de 10 mmHg.
- Abrir el peritoneo lateral a lo largo del lado lateral del surco paracólico para liberar completamente el colon, desplazar el colon medialmente para identificar la vena gonadal y el uréter. Para la pieloplastia del lado izquierdo, abrir el área avascular a lo largo del espacio mesentérico y, tras liberar la grasa perirrenal, exponer la pelvis renal y el uréter proximal.
- La pelvis renal se libera completamente de los vasos hiliares mediante tracción hacia abajo y disección roma. Luego se libera la pelvis dorsalmente para expandir la pelvis renal y se observa la presencia de vasos vagales que cruzan la unión ureteropélvica para precisar el sitio de estenosis.
- El cuerno superior de la pelvis renal se suspende de la pared abdominal con alambre Mousse 2-0. Luego se corta la pelvis renal de posterior a inferior y superior para formar una forma de embudo. Luego se corta el uréter longitudinalmente sobrepasando la estenosis en 1 a 2 cm.
- Suturar el colgajo de la pelvis renal con el punto más declive del uréter usando hilo reabsorbible 5-0.
- Separar el uréter aproximadamente 0,5 cm distal al segmento estenótico y completar adicionalmente el corte de la pelvis renal para resecar el segmento estenótico de la unión ureteropélvica (UPJ) y la pelvis renal parcialmente dilatada
- Sutura secuencial de la pared posterior de la anastomosis con 1 punto de bloqueo cada 2 puntos.
- Continuar suturando la abertura del colgajo excedente de la pelvis renal sin cortar las suturas.
- Colocación de un catéter doble J.
- Sutura continua de la pared anterior de la anastomosis, hemostasia cuidadosa y minuciosa, e irrigación con suero salino tibio del campo operatorio.
- Sutura discontinua del peritoneo lateral o del defecto mesentérico.
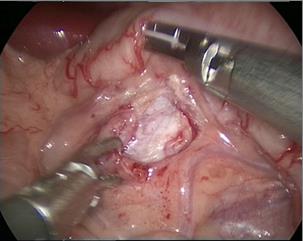
Figura 29 El abordaje transmesentérico
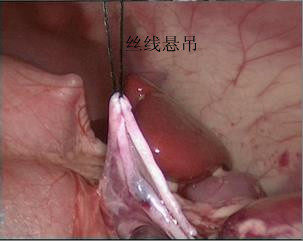
Figura 30 El cuerno superior de la pelvis renal está suspendido
Pieloplastia laparoscópica asistida por robot
- En los casos del lado izquierdo, se adoptó el abordaje transmesentérico cuando la pelvis renal dilatada se encontraba en la cara medial del colon descendente. En los casos del lado derecho, seleccionamos el abordaje por el surco paracólico.
- A continuación, disecamos cuidadosamente el uréter proximal y la pelvis renal, preservando la vascularización ureteral.
- La pelvis se seccionó por encima del tejido obstructivo y se remodeló mediante un punto de tracción percutáneo para estabilizarla y facilitar la anastomosis.
- Tras espatular el uréter distal luego de la exéresis del segmento obstructivo, suturamos el punto más declive del segmento ureteral aperistáltico y el extremo de la pelvis con una sutura continua 6-0 de PDS-II.
- Luego se cerró la pared posterior del uréter mediante sutura continua. Antes de iniciar las anastomosis anteriores con una segunda sutura continua 6-0 de PDS II, se colocó de manera anterógrada un catéter ureteral doble J (COOK, USI-512, Ireland).
- Por último, cerramos el mesenterio o el peritoneo con una sutura absorbible 5-0.
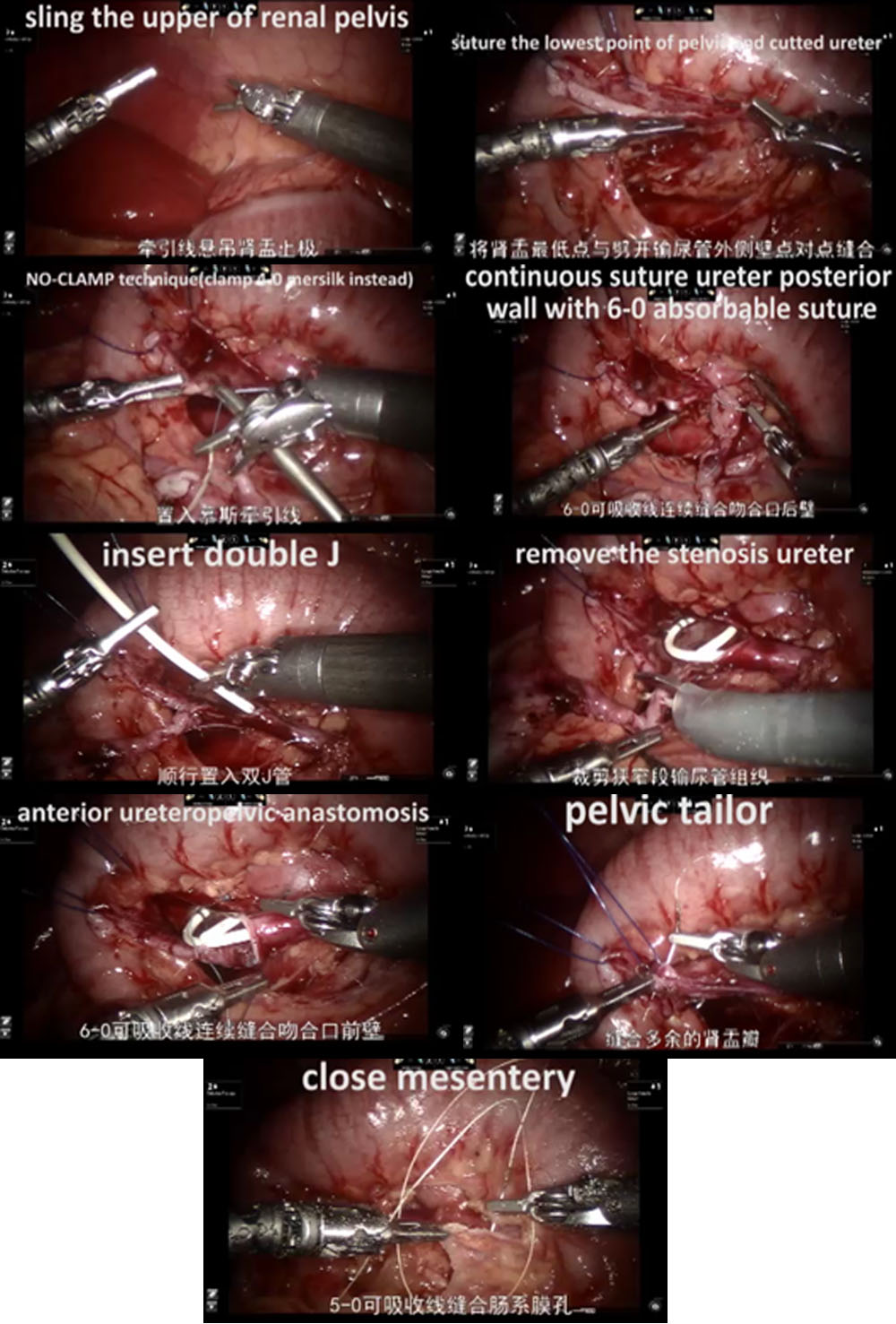
Figura 31 El procedimiento de RALP
Reimplante ureteral
El reimplante ureteral es el tratamiento de referencia del reflujo vesicoureteral y de la estenosis ureteral. Tradicionalmente, este procedimiento se ha realizado mediante un abordaje abierto. Pueden emplearse muchas técnicas diferentes: reimplante intravesical de Cohen, reimplante transvesical de Politano-Leadbetter, reimplante extravesical de Lich-Gregoir. Todas las técnicas pueden realizarse mediante un abordaje laparoscópico, laparoscópico neumovesical o robótico. Aquí presentamos el procedimiento de reimplante de Cohen por laparoscopia neumovesical (anastomosis ureterovesical mediante túnel vesical submucoso transversal) y el reimplante extravesical de Lich-Gregoir.
Establecimiento del neumovesicum
- Se colocó el cistoscopio a través de la uretra. Luego se inyectó gas CO2 a través del cistoscopio hasta que la vejiga se dilató hasta el nivel umbilical. Se realizó tracción de vejiga llena de forma percutánea bajo observación cistoscópica. Se fijó la parte superior de la vejiga llena en la posición subumbilical en la línea media del abdomen, y se cortó la piel en el borde inferior de la línea de tracción. Se puncionó el trócar inmediatamente después de fijar la tracción. Se colocó un trócar operatorio de 3-5 mm en los lados izquierdo y derecho, respectivamente. Luego se retiró el cistoscopio. Se inyectó gas CO2 a través del trócar oftalmoscópico.
- Localización de los orificios ureterales bilaterales.
- Se sutura un punto de tracción en el orificio ureteral del lado afectado. Corte la mucosa a lo largo del orificio ureteral con un gancho en asa eléctrico. Libere el uréter del segmento interno de la pared vesical mediante bisturí eléctrico o bisturí ultrasónico de forma cercana. El uréter liberado se arrastra hacia la vejiga unos 5.0 cm hasta el segmento dilatado del uréter que puede ser traccionado sin tensión hasta la parte superior del orificio ureteral contralateral. En el paciente masculino, se debe proteger el conducto deferente al liberar el uréter.
- Realice una pequeña abertura en la unión del segmento distal dilatado del uréter y el segmento estenótico para drenar el líquido. Para un diámetro ureteral mayor de 12 mm, se debe realizar plicatura o resección del uréter dilatado.
- Corte la capa mucosa a unos 2.0 cm por encima del orificio del uréter contralateral. Luego separe la capa submucosa con tijeras o pinzas vasculares y confeccione un túnel submucoso hasta el orificio ureteral.
- Arrastre el uréter al lado opuesto a través del túnel submucoso, reseque el tejido de la lesión estenótica en el orificio ureteral, y fije todo el uréter a la mucosa vesical con suturas Vicryl 5-0 o 6-0 con 6-8 puntos y 2 puntos con la capa muscular vesical.
- Cierre la capa muscular vesical del orificio ureteral original con la capa muscular ureteral con sutura Vicryl 5-0
- Deje un stent doble J a través del trócar.
- Retire cada trócar, suture el tejido subcutáneo y la piel.
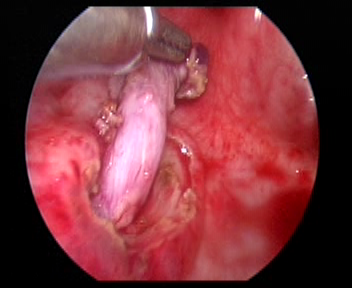
Figura 32 Libere el uréter
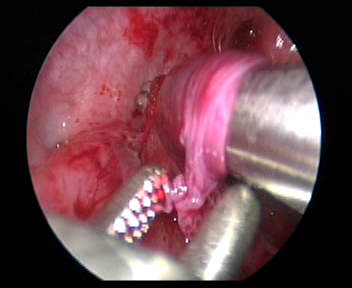
Figura 33 Realice un túnel submucoso hasta el orificio ureteral.
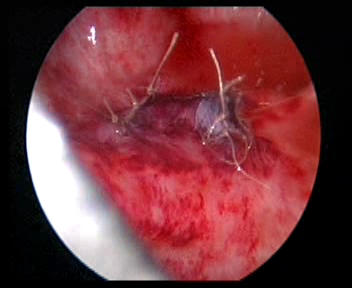
Figura 34 Cierre el orificio ureteral original
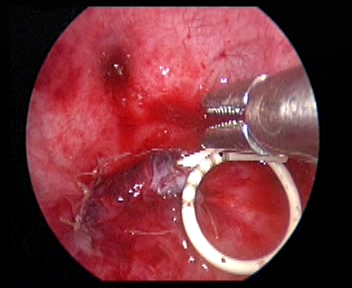
Figura 35 Dejar un catéter en doble J
Reimplantación Lich-Gregoir asistida por robot
- Abra el peritoneo lateral a nivel de la arteria ilíaca externa pulsátil, identifique el uréter que cruza la arteria ilíaca externa y libere el uréter lo más distal posible hasta la unión ureterovesical para exponer por completo la estenosis ureteral.
- Llene la vejiga con 60 ml de solución salina para mantenerla ligeramente llena. Se realizó una incisión de 5 cm en la pared posterolateral de la vejiga. Luego incida la vejiga hasta la submucosa.
- Desinserte el uréter en la unión ureterovesical, recorte el uréter distal hasta un calibre normal. Amplíe la hendidura de la mucosa vesical en esta unión. Luego suture el uréter recortado a la hendidura de la mucosa vesical con sutura reabsorbible 6/0 para fijarlo. Complete la anastomosis de la pared posterior y deje el catéter doble J en su lugar para continuar y completar la pared anterior de la anastomosis (En los casos de reflujo, inserte el catéter doble J antes de la cirugía).
- Se utilizaron suturas reabsorbibles para cerrar el peritoneo en la pared lateral de la vejiga y el peritoneo alrededor del uréter en el segmento pélvico. Se retiró el sistema robótico, se colocó un tubo de drenaje y se suturó la incisión cutánea.
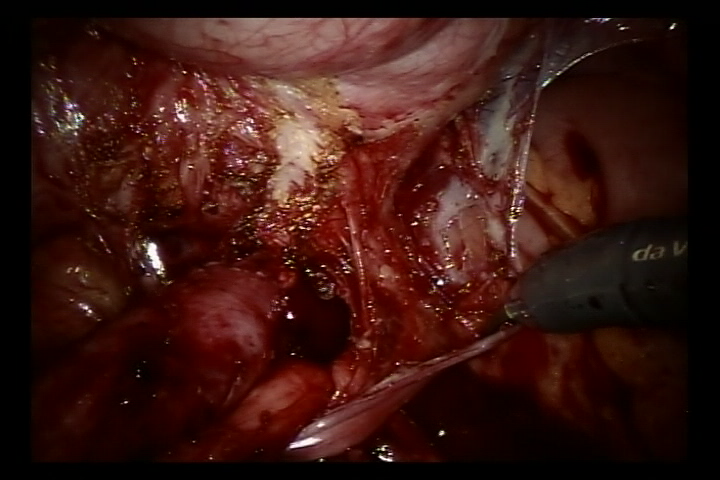
Figura 36 Libere el uréter
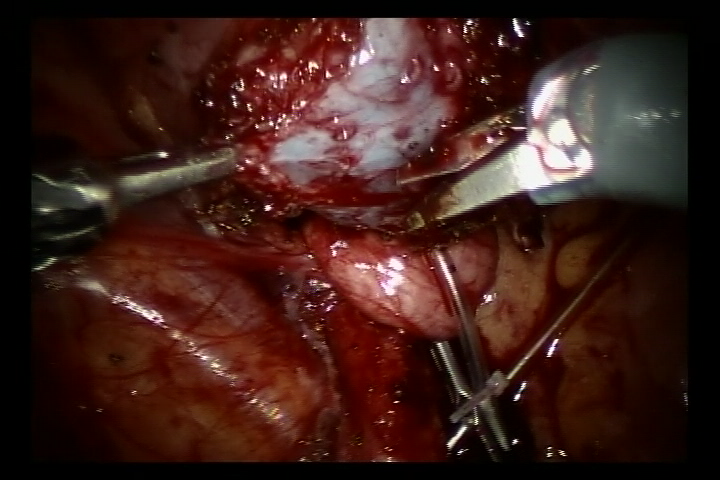
Figura 37 Incida la vejiga hasta la submucosa de la vejiga
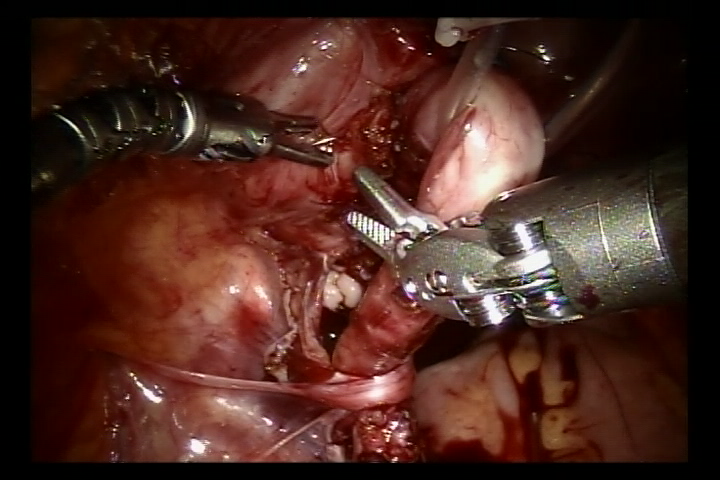
Figura 38 Suture ambos lados de la capa muscular detrusora para formar un túnel submucoso
Rabdomiosarcoma de vejiga
El rabdomiosarcoma (RMS) es el sarcoma de partes blandas más frecuente en niños. Debe realizarse una cistectomía radical o parcial para extirpar el tumor. Aquí presentamos nuestra experiencia con cistectomía radical asistida por robot con reconstrucción de neovejiga ortotópica sigmoidea con reimplante ureteral bilateral (técnica de Politano-Leadbetter).
- Se colocó un puerto de 10 mm a unos 6 cm de la sínfisis púbica para la cámara. Se colocaron dos puertos robóticos de 8 mm para los brazos robóticos n.º 1 y n.º 2, a 6 cm del puerto de la cámara, en la línea medioclavicular por encima de la espina ilíaca anterosuperior. Se colocaron dos puertos auxiliares de 5 mm en la línea medioclavicular derecha, cerca por debajo del margen costal.
- Después de la cuidadosa y precisa resección radical del tumor vesical
-
y de los ganglios linfáticos pélvicos periféricos, aislamos un segmento de aproximadamente 20 cm de colon sigmoide y lo detubulizamos dándole una forma esférica para reconstruir la neovejiga que eventualmente puede
- contener aproximadamente 100 mL.
- Luego realizamos el reimplante antirreflujo (técnica de Politano-Leadbetter) de ambos uréteres a través del túnel submucoso
- Por último, extrajimos la pieza quirúrgica a través de la incisión inguinal (línea del bikini).
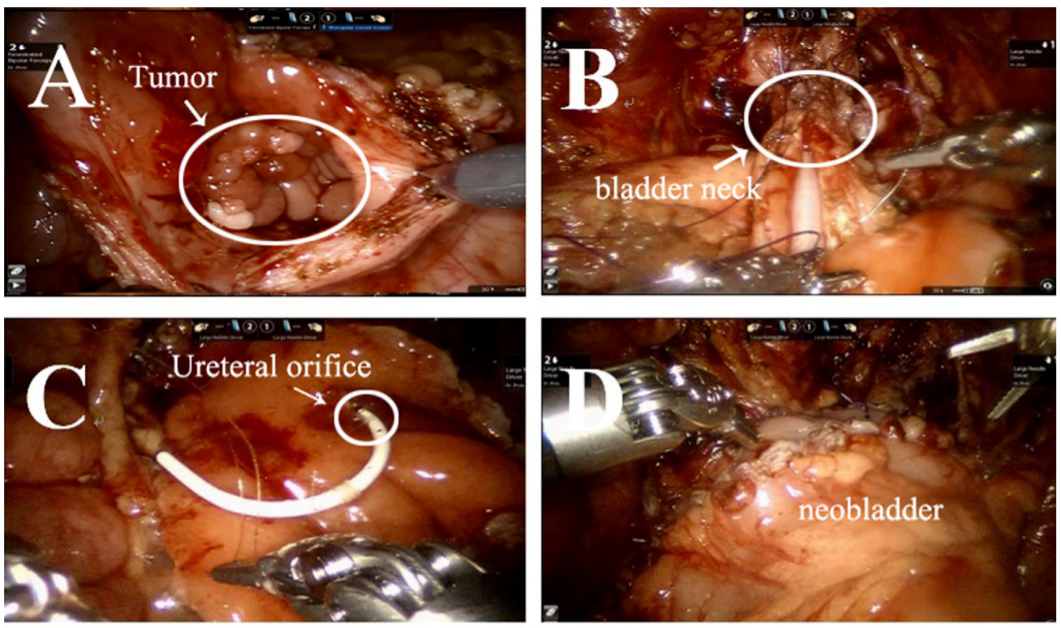
Figura 39 El procedimiento de cistectomía radical con reconstrucción de neovejiga ortotópica sigmoidea con reimplante ureteral bilateral
Otras aplicaciones
También hemos realizado cirugía laparoscópica asistida por robot para el tumor de Wilms (nefrectomía o cirugía de preservación de nefronas), la resección de neuroblastoma, la capsulotomía prostática y la reconstrucción del conducto deferente. En los casos de hidronefrosis compleja, se llevan a cabo reemplazos ureterales mediante la técnica de Yang-Monti, con apéndice o con mucosa oral. Con la mejora de los instrumentos y la tecnología, el futuro de la cirugía mínimamente invasiva es prometedor.
Consideraciones
Para la reimplantación, se debe liberar el uréter con la longitud suficiente para resecar adecuadamente la lesión ureteral y, en la medida de lo posible, garantizar una anastomosis sin tensión. Debido a la ausencia de retroalimentación de fuerza en los sistemas de cirugía asistida por robot, debe evitarse el pinzamiento excesivo de los tejidos ureterales y deben preservarse los tejidos circundantes al uréter y su vascularización. Debe prestarse atención a mantener suturas simétricas al realizar la reimplantación ureterovesical para prevenir la torsión o angulación del uréter.
Si el diámetro del uréter supera 1,5 cm en el estado posmiccional, debe ser recortado; de lo contrario, es difícil establecer una estructura antirreflujo. La longitud del túnel submucoso de la vejiga debe ser aproximadamente 5 veces el diámetro del uréter para mantener una pinza relativamente fija como soporte y así obtener un efecto antirreflujo satisfactorio.
Para la pieloplastia, la pelvis renal debe liberarse más ampliamente, lo que puede reducir la tensión de la anastomosis, y el uréter proximal debe liberarse lo menos posible para minimizar el pinzamiento directo del uréter por los instrumentos del sistema robótico y proteger la vascularización ureteral. La primera sutura es la más importante. Si el uréter pélvico se separa completamente y luego se anastomosa, es probable que se produzca distorsión del uréter. Por lo tanto, la dirección del eje renal debe juzgarse con precisión intraoperatoriamente. y el colgajo pélvico inferior. El punto más bajo de la pelvis renal debe anastomosarse con la pared lateral del uréter hendido longitudinalmente.
Referencias
- WE. KJ. The evolution of laparoscopy and the revolution in surgery in the decade of the. 1990; 2 (4): 51.
- Cortesi N, Ferrari P, Zambarda E, Manenti A, Baldini A, Pignatti Morano F. Diagnosis of Bilateral Abdominal Cryptorchidism by Laparoscopy. Endoscopy 1976; 08 (01): 33–34. DOI: 10.1055/s-0028-1098372.
- Peters CA, Schlussel RN, Retik AB. Pediatric Laparoscopic Dismembered Pyeloplasty. J Urol 1995; 53 (6): 1962–1965. DOI: 10.1016/S0022-5347(01)67378-6.
- Blanco FC, Kane TD. Single-Port Laparoscopic Surgery in Children: Concept and Controversies of the New Technique. Minim Invasive Surg 2012; 2012 (232347): 1–5. DOI: 10.1155/2012/232347.
- Meininger DD, Byhahn C, Heller K, Gutt CN, Westphal K. Totally endoscopic Nissen fundoplication with a robotic system in a child. Surg Endosc 2001; 15 (11): 1360–1360. DOI: 10.1007/s00464-001-4200-3.
- OLSEN LH, JORGENSEN TM. Computer Assisted Pyeloplasty In Children: The Retroperitoneal Approach. J Urol 2004; 171 (6 Part 2): 2629–2631. DOI: 10.1097/01.ju.0000110655.38368.56.
- ATUG FATIH, WOODS MICHAEL, BURGESS SCOTTV, CASTLE ERIKP, THOMAS RAJU. Robotic Assisted Laparoscopic Pyeloplasty In Children. J Urol 2005; 174 (4 Part 1): 1440–1442. DOI: 10.1097/01.ju.0000173131.64558.c9.
- Lee RS, Retik AB, Borer JG, Peters CA. Pediatric Robot Assisted Laparoscopic Dismembered Pyeloplasty: Comparison With a Cohort of Open Surgery. Yearbook of Urology 2006; 2006 (2): 273–274. DOI: 10.1016/s0084-4071(08)70423-8.
- Hollis MV, Cho PS, Yu RN. Robot-Assisted Laparoscopic Pyeloplasty. Pediatric Robotic Urology 2015; 1: 109–121. DOI: 10.1007/978-1-60327-422-7_8.
- Andolfi C, Rodríguez VM, Galansky L, Gundeti MS. Infant Robot-assisted Laparoscopic Pyeloplasty: Outcomes at a Single Institution, and Tips for Safety and Success. Eur Urol 2021; 80 (5): 621–631. DOI: 10.1016/j.eururo.2021.06.019.
- Higganbotham C, Cook G, Rensing A. Bilateral Robot-Assisted Laparoscopic Orchiopexy for Undescended Testes. Urology 2021; 148 (314): 314. DOI: 10.1016/j.urology.2020.10.044.
- Rao PP. Robotic surgery: new robots and finally some real competition! World J Urol 2018; 36 (4): 537–541. DOI: 10.1007/s00345-018-2213-y.
- Peters BS, Armijo PR, Krause C, Choudhury SA, Oleynikov D. Review of emerging surgical robotic technology. Surg Endosc 2018; 32 (4): 1636–1655. DOI: 10.1007/s00464-018-6079-2.
Última actualización: 2025-09-21 13:35