6: Consideraciones sobre la anestesia general en niños
Este capítulo durará aproximadamente 30 minutos para leer.
Introducción
Los procedimientos de urología pediátrica abarcan una amplia variedad de tipos de pacientes, abordajes quirúrgicos y un amplio espectro de requerimientos y enfoques anestésicos. Los planes anestésicos pueden variar desde la anestesia para procedimientos de cirugía ambulatoria en el mismo día en pacientes sanos con una afección urológica aislada, hasta planes más complejos y de mayor envergadura.
La anestesia en pacientes médicamente complejos o en aquellos que requieren múltiples etapas de intervención quirúrgica puede incluir analgesia multimodal, diversas técnicas de bloqueo anestésico neuraxial o regional además de la anestesia general y puede requerir ingresos hospitalarios donde se puedan proporcionar servicios de manejo del dolor agudo posoperatorio. Los pacientes médicamente complejos pueden beneficiarse de una visita a la clínica de preanestesia o de optimización prequirúrgica para garantizar que toda la información de seguimiento esté actualizada (p. ej., ecocardiograma y autorización por cardiología en pacientes con cardiopatía congénita) y para permitir la realización oportuna de cualquier prueba de laboratorio o estudio de imagen necesario.
Una buena comunicación preoperatoria entre los equipos de cirugía y anestesia es ideal y puede incluir cualquier necesidad perioperatoria especial, el ingreso posoperatorio previsto o problemas de dolor previstos.
Es posible que los padres hayan consultado información sobre la anestesia en línea o que tengan preguntas para el urólogo sobre los anestésicos. A estos padres, por lo general, se les puede asegurar que hablarán con un profesional de anestesia el día de la cirugía, o se les puede proporcionar la información de contacto del grupo de anestesia para preguntas adicionales.
Evaluación preoperatoria
Ansiolisis
La ansiedad preoperatoria en los niños puede dar lugar a una morbilidad significativa y a cambios de conducta postoperatorios. Los datos de Estados Unidos y Europa han mostrado que hasta el 54% de los pacientes presentarán ansiedad general, pesadillas, llanto nocturno, enuresis, ansiedad por separación y rabietas durante 2 semanas después de su procedimiento quirúrgico. Algunos niños continúan presentando cambios de conducta desadaptativos entre 6 meses y 1 año después de su procedimiento. La calidad de su experiencia médica es crucial para limitar los cambios de conducta postoperatorios y disminuir la ansiedad en visitas posteriores. Existen varios métodos disponibles para ayudar a disminuir la ansiedad preoperatoria de los pacientes y mejorar su experiencia perioperatoria.1
Tanto los agentes farmacológicos como las tecnologías de distracción pueden ser eficaces en niños con ansiedad.2 La ansiedad por separación comienza alrededor del año de edad. La ansiedad situacional alcanza su pico en el niño en edad preescolar. Por lo tanto, administramos un ansiolítico por vía oral (como midazolam en solución oral, 0,5–0,75 mg/kg) en el área de espera preoperatoria 15–30 minutos antes de la inducción de la anestesia por inhalación para permitir la sincronización óptima del efecto del medicamento. La administración intranasal e intramuscular de agentes farmacológicos son otras opciones para la administración de ansiolíticos.
Los niños con desarrollo normal generalmente pueden permanecer sentados para la colocación de un catéter intravenoso (IV) en el área de espera preoperatoria de nuestra institución a partir de los 7 años, por lo que es más habitual ofrecer una inducción intravenosa a los niños mayores, aunque la inducción por inhalación puede seguir siendo más factible en ciertos pacientes. Los especialistas en vida infantil (personas capacitadas para proporcionar distracción y tranquilidad a los niños durante las visitas médicas) están disponibles para enseñar habilidades de afrontamiento, proporcionar juego, describir el proceso de inducción y ayudar con la colocación del catéter IV. Pueden utilizarse dispositivos adicionales, como lidocaína tamponada administrada mediante chorro a presión (crea un habón de piel insensible utilizando lidocaína presurizada y sin aguja) a través del cual puede insertarse el catéter IV, provocando un dolor mínimo. También pueden aplicarse anestésicos tópicos en la piel, si el tiempo lo permite, para reducir el dolor de la colocación del catéter IV.3
La presencia de los padres durante la inducción también puede ayudar a disminuir la ansiedad y aumentar la satisfacción de los padres. Algunos padres pueden preferir estar presentes independientemente de la edad de su hijo. Ciertas poblaciones de pacientes, como aquellos con diagnóstico de trastorno del espectro autista, a veces se benefician cuando están presentes personas familiares como los padres o cuidadores. Aunque la presencia de los padres durante la inducción puede ser apropiada, los estudios han demostrado que la premedicación farmacológica para tratar la ansiedad es superior a la presencia de los padres durante la inducción. Un progenitor muy ansioso o con conductas disruptivas puede obstaculizar el proceso de inducción. Además, la presencia de los padres durante la inducción no afecta los cambios conductuales posoperatorios, mientras que se ha demostrado que el midazolam oral disminuye los resultados conductuales posoperatorios negativos inmediatos en niños pequeños. La decisión final de invitar a los padres a regresar al quirófano debe ser tomada por el equipo de anestesia después de la entrevista preoperatoria y de una discusión del plan anestésico. En general, la presencia de los padres durante la inducción se ha desalentado durante la pandemia actual, excepto en circunstancias muy especiales.1
Enfermedades agudas
Enfermedades transmisibles
- Posponga los procedimientos electivos para evitar infectar a otras personas con enfermedades transmisibles.
- Varicela: deja de ser contagiosa una vez que todas las lesiones cutáneas han formado costra.4,5
- Enfermedad de manos, pies y boca: deja de ser contagiosa 3 semanas después de la resolución del exantema.5,6
Infecciones respiratorias
Un dilema común en la práctica de la anestesia pediátrica es anestesiar al niño sano frente al niño enfermo. Ciertos patógenos y la reactividad subsiguiente de la mucosa de la vía aérea pueden provocar complicaciones durante la anestesia. Tras un resfriado con tos, o una infección no complicada de las vías respiratorias superiores (IVRS), la reactividad de la vía aérea puede permanecer elevada durante semanas. Es nuestra política posponer los procedimientos electivos hasta cuatro semanas después de la resolución completa de los síntomas de una IVRS, o seis semanas después de haber presentado síntomas de una infección de las vías respiratorias inferiores (IVRI), como virus sincitial respiratorio (VSR), influenza o neumonía. Esto permite que la reactividad de la vía aérea vuelva a su nivel basal y reduce el riesgo de complicaciones anestésicas intraoperatorias como broncoespasmo, laringoespasmo, hipoxia y un ingreso postoperatorio no planificado.7,8
En general, los síntomas de IVRS e IVRI se identifican durante la llamada telefónica de evaluación preoperatoria y los casos pueden cancelarse con tiempo suficiente para cubrir el hueco en la programación quirúrgica. Pero, ¿qué debe hacerse con el paciente que se presenta en ese momento para su caso en el área de espera preoperatoria y que “recién” ha desarrollado rinorrea, fiebre, tos o un conjunto de nuevos síntomas? Ciertos aspectos de una IVRS, como secreción nasal verdosa, sibilancias en la auscultación pulmonar o fiebre dentro de las 48 horas, aumentan lo suficiente el riesgo relativo de eventos de la vía aérea como para que la cancelación el día de la cirugía sea una decisión sencilla.9 Sin embargo, el caso puede no ser siempre tan claro, por ejemplo, con síntomas de rinorrea acuosa aislada y tos seca ocasional. El paciente puede haber tenido pruebas preoperatorias; los padres pueden haber tomado el día libre en el trabajo; el niño puede estar en ayuno adecuado; y las cancelaciones el día de la cirugía son inconvenientes para todos los involucrados. Es nuestra práctica evaluar a cada niño caso por caso, con la seguridad como objetivo principal, descartando signos de enfermedad florida, como fiebre activa, y teniendo en cuenta la urgencia del procedimiento quirúrgico y cualquier circunstancia atenuante, como cuando se ha recorrido una larga distancia, o cuando el niño se enferma con frecuencia hasta el punto de que encontrar un bloque de cuatro semanas de recuperación sin síntomas puede ser casi imposible, o cuando existe una licencia laboral parental limitada para cuidar al niño, lo que podría hacer que reprogramar el caso sea particularmente difícil. También incluimos a los padres en el proceso de toma de decisiones, informándoles que, aunque el riesgo absoluto general es bajo, la anestesia en el contexto de una infección de vías respiratorias superiores activa puede presentar más riesgo que en un niño sano. La estratificación del riesgo por tipo y duración de los síntomas y por factores de riesgo del paciente, como la exposición pasiva al humo del tabaco, la edad y el asma, está respaldada en la literatura, con recomendaciones generales de proceder con síntomas leves en pacientes de bajo riesgo y reprogramar ante síntomas significativos en aquellos con mayor riesgo.1
SARS-CoV-2
Un estudio de cohorte retrospectivo en un gran hospital pediátrico universitario mostró que cada niño con una prueba positiva para SARS-CoV-2 en los 10 días previos a un procedimiento presentó una incidencia mucho mayor de complicaciones respiratorias (11,8% vs 1,0%, IC del 95% 1,6-19,8%, p = 0,003) en comparación con controles emparejados. Dado el riesgo adicional de transmisión a otros pacientes cercanos y al personal sanitario, recomendamos realizar de forma sistemática la prueba preoperatoria de SARS-CoV-2 a todos los pacientes y reprogramar los procedimientos electivos cuando exista un resultado positivo reciente para COVID-19.10
Asma
Las cirugías electivas deben posponerse hasta que se haya optimizado la terapia en los pacientes con mal control de los síntomas. Los procedimientos para quienes presenten exacerbaciones agudas de asma deben aplazarse durante 4 semanas tras la resolución y el retorno a la situación basal. Los pacientes deben utilizar de forma constante sus medicamentos preventivos para el asma en las semanas y días previos a la anestesia.11,12
Comorbilidades médicas
Según la forma de presentación del estado de la enfermedad (agudo, subagudo, crónico) y la urgencia de un procedimiento quirúrgico, el paciente de urología pediátrica puede presentarse en perfecto estado de salud o con un espectro de alteraciones hemodinámicas, desequilibrios electrolíticos y disfunción orgánica.
Los pacientes con comorbilidades médicas complejas deben ser evaluados en la clínica preoperatoria para garantizar que las condiciones médicas estén controladas de forma óptima antes de la cirugía. La derivación temprana a la clínica preoperatoria permite contar con tiempo suficiente para iniciar de manera efectiva un programa de optimización y para manejar los riesgos modificables. Los pacientes que reciben medicamentos de mantenimiento para sus enfermedades médicas crónicas deben continuar esos medicamentos en el período perioperatorio.13,14
Guías de ayuno preoperatorio
Existen guías para reducir el riesgo de aspiración pulmonar en pacientes que reciben medicamentos que disminuyen los reflejos protectores de la vía aérea. La Sociedad Estadounidense de Anestesiólogos recomienda que los pacientes ayunen de alimentos sólidos grasos durante 8 horas antes de la cirugía. Las recomendaciones de ayuno para comidas ligeras, cualquier bebida no clara, leche no humana y nutrición enteral artificial son de 6 horas. La leche materna debe suspenderse 4 horas antes y los líquidos claros 2 horas antes de la anestesia.15 La Sociedad Canadiense de Anestesiólogos tiene guías similares, pero la Sociedad Canadiense de Anestesia Pediátrica ahora anima a que los niños ingieran líquidos claros hasta una hora antes de la cirugía.16 Las guías de ayuno de la Sociedad Europea de Anestesiología prohíben los alimentos sólidos 6 horas antes de la cirugía y fomentan que los pacientes adultos ingieran líquidos claros hasta 2 horas y que los pacientes pediátricos ingieran líquidos claros hasta 1 hora antes de la cirugía.17
Ha habido inquietudes de que las guías sobre líquidos claros podrían ser demasiado rígidas y podrían contribuir a resultados adversos. Debido a la imprevisibilidad de los quirófanos, un ayuno de 2 horas para líquidos claros en realidad se traduce en un período de ayuno mucho más largo. El ayuno prolongado puede aumentar el malestar y ocasionar efectos fisiológicos y metabólicos perjudiciales. También es difícil hacer cumplir las guías de ayuno en niños pequeños. Los defensores de las ecografías gástricas han sugerido que una medición del contenido gástrico puede ser más confiable que las instrucciones de ayuno por sí solas. Debe obtenerse una ecografía gástrica antes de cancelar o retrasar un caso por incumplimiento de NPO.
Consideraciones anestésicas
Anestesia general frente a anestesia espinal
Aplicación de la anestesia raquídea
La anestesia espinal es una buena opción anestésica para pacientes sometidos a procedimientos por debajo del ombligo.18 Desde el punto de vista técnico, no existe un límite de edad para realizar una anestesia espinal. No obstante, fuera del período neonatal y de lactantes, es poco probable que una anestesia espinal pura sea exitosa sin ansiolíticos o sedación, dado el desarrollo cognitivo de los pacientes y su incapacidad para cooperar con la colocación de la anestesia espinal y el procedimiento quirúrgico. Los exprematuros suelen tener antecedentes de apnea de la prematuridad, displasia broncopulmonar y enfermedad pulmonar crónica. Su riesgo de apnea posoperatoria es aún mayor en comparación con los lactantes nacidos a término.19 Cuando sea factible, la anestesia espinal ayudaría a disminuir los riesgos potenciales asociados con la anestesia general, como la neurotoxicidad, la apnea y los eventos cardiopulmonares adversos. Debe considerarse la anestesia espinal para pacientes en quienes la anestesia general pueda representar un riesgo aumentado, como aquellos con dismorfia facial, vía aérea difícil, distrofia muscular o antecedentes familiares de hipertermia maligna.
Los cambios hemodinámicos secundarios a la simpatectomía producida por una anestesia espinal o epidural, comunes en adultos, no se observan en niños pequeños. Los niños tienen sistemas nerviosos simpáticos relativamente inmaduros y dependen menos del tono vasomotor para mantener la presión arterial. Además, presentan una menor capacitancia venosa en las extremidades inferiores y, por lo tanto, menor estasis venosa.
Contraindicaciones de la anestesia espinal
La anestesia espinal se limita a cirugías de 90 minutos o menos. Los niños tienen un mayor volumen de líquido cefalorraquídeo (LCR) y un recambio del LCR más rápido en comparación con los adultos. Dada esta diferencia, la anestesia espinal generalmente dura más en los niños mayores y en los adultos que en los neonatos y los lactantes. Una anestesia espinal de inyección única suele durar 60-90 minutos y puede prolongarse hasta 120 minutos si se realiza en combinación con un bloqueo caudal.
Las contraindicaciones incluyen coagulopatías, infección sistémica o infección local en el sitio de punción, hipovolemia no corregida, negativa de los padres y un paciente no colaborador. Las anomalías neurológicas, como la espina bífida y la hipertensión intracraneal, también son contraindicaciones para la anestesia espinal.
Complicaciones
Las complicaciones posteriores a la anestesia espinal incluyen punción traumática que puede provocar hemorragia, dolor y lesión de las estructuras que rodean el sitio de punción. Con técnicas asépticas cuidadosas, la incidencia de complicaciones infecciosas graves como la meningitis es muy baja.20 La insuficiencia respiratoria y cardiovascular puede resultar de un bloqueo espinal alto. La lesión neurológica y la toxicidad por anestésico local pueden resultar de la inyección de una solución incorrecta o de una dosis incorrecta de anestésico local, respectivamente. La cefalea pospunción dural es otra complicación de la anestesia espinal. Sin embargo, se desconoce la incidencia de PDPH en los niños más pequeños debido a la dificultad para evaluar las cefaleas en esa población.
Consideraciones laparoscópicas y robóticas
Los abordajes urológicos robóticos y laparoscópicos están en aumento.21 Estos abordajes presentan cambios particulares en la ventilación, el retorno venoso, la hemodinámica y la perfusión de los órganos abdominopélvicos durante el procedimiento. Se requiere anestesia general con intubación endotraqueal para este tipo de casos, ya que los pacientes despiertos no toleran la insuflación peritoneal. Además, los procedimientos laparoscópicos suelen requerir relajación muscular para optimizar las condiciones quirúrgicas. El neumoperitoneo a menudo contribuye a una oliguria o anuria reversible y a cambios hemodinámicos y respiratorios similares a los observados en la laparoscopia del adulto.
Tabla 1 Cambios fisiológicos en respuesta a la laparoscopia. CVP: presión venosa central; CO: gasto cardíaco; MAP: presión arterial media; SVR: resistencia vascular sistémica; FRC, capacidad residual funcional; TLV, volumen pulmonar total; VTE, tromboembolismo venoso. Fuente: Miller RD et al. Miller’s Anesthesia 7.ª ed. Cap.: Anestesia para cirugía laparoscópica (Cap. 68) páginas 2185-2193.22
| Sistema orgánico | Intervención | Efectos | Tratamiento |
|---|---|---|---|
| Cardiovascular | Posición con la cabeza hacia abajo | Aumento de la PVC, aumento del GC | Reducir la inclinación |
| Posición con la cabeza elevada | Disminución de la PVC, PAM | Reducir la inclinación | |
| Insuflación | Reflejo barorreceptor → bradicardia refleja o asistolia | Reducir o cesar la insuflación, tratar la frecuencia cardíaca | |
| Aumento de la RVS | Reducir la inclinación en cabeza arriba, uso de vasodilatadores, profundizar la anestesia | ||
| Respiratorio | Insuflación, posicionamiento con la cabeza hacia abajo | Atelectasias → disminución de la CRF, VPT, distensibilidad pulmonar → hipoxemia, hipercapnia | Aumentar los parámetros ventilatorios, disminuir las presiones de insuflación, reducir la inclinación cabeza abajo |
| Neurológico | Posicionamiento con la cabeza hacia abajo | Elevación de las presiones intracraneal e intraocular en pacientes con baja complacencia intracraneal | Reducir la inclinación hacia abajo |
| Renal | Insuflación | Oliguria, anuria | Típicamente reversible y transitoria una vez liberada la insuflación |
| Endocrino | Insuflación | Elevación de catecolaminas, hormonas del estrés | Profundizar la anestesia, tratar adecuadamente los estímulos dolorosos |
| Vascular | Posicionamiento (especialmente litotomía) e insuflación | Estasis venosa en las piernas → mayor riesgo de TEV | Uso de dispositivos anti-TEV, cambios periódicos de posición |
Anestesia regional
Inyecciones epidurales de dosis única
La anestesia caudal es una técnica bien establecida con un largo historial de seguridad (Polaner et al—estudio PRAN). Los beneficios de la anestesia caudal incluyen una menor necesidad de analgésicos intraoperatorios y posoperatorios, una disminución de la respuesta hormonal al estrés y un aumento de la satisfacción general del paciente y de los padres.23
Los bloqueos caudales consisten en la inyección de anestésico local en el espacio epidural al que se accede a través del hiato sacro. Los puntos de referencia óseos del hiato suelen ser palpables en pacientes pediátricos pequeños o visualizarse mediante ecografía.
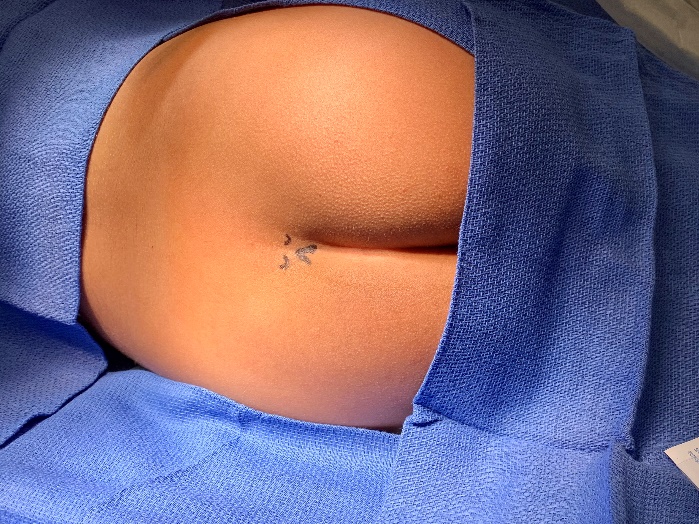
Figura 1 Enfoque anatómico del bloqueo caudal utilizando la palpación de reparos óseos. Palpación de los reparos óseos al utilizar un enfoque anatómico. Anatomía externa: cuernos sacros y hiato sacro.
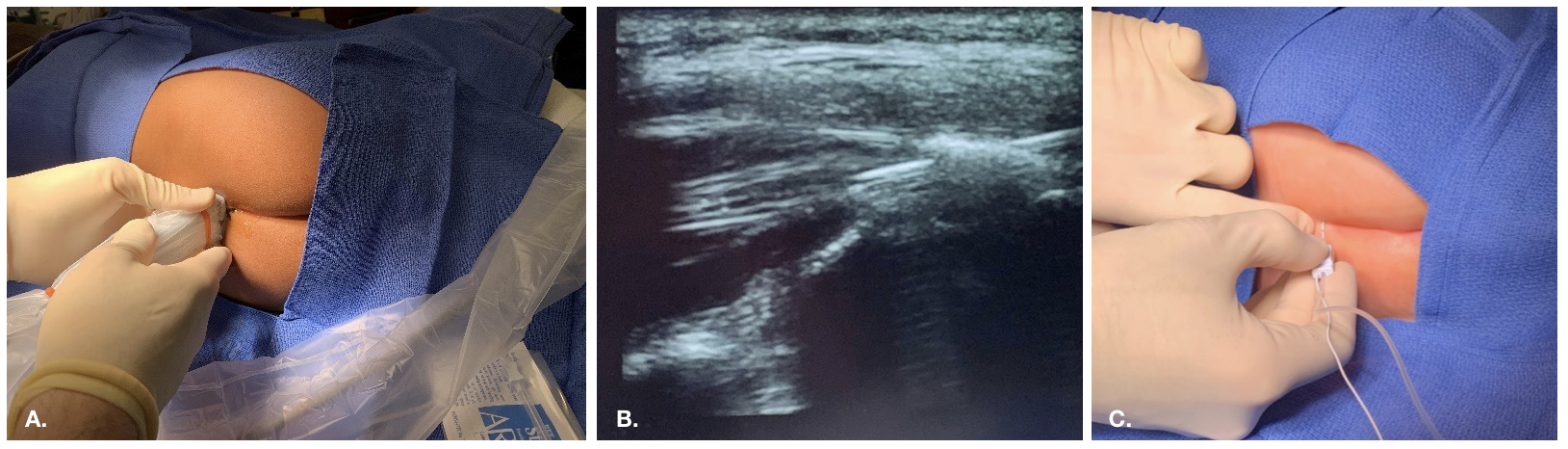
Figura 2 Abordaje del bloqueo caudal guiado por ecografía
Figura 3 Colocación epidural guiada por fluoroscopia en un paciente con cambios anatómicos y posquirúrgicos complejos
Contraindicaciones del bloqueo caudal
Las contraindicaciones incluyen disrafismo espinal (p. ej., síndrome de médula anclada), infección en el sitio de la inyección o quiste pilonidal, negativa del paciente y aumento (relativo) del riesgo de hemorragia.
Los bloqueos caudales, aunque por lo general son sencillos, no complicados y exitosos, se asocian con cierta tasa de fracaso, incluso en manos experimentadas. El fracaso ocurre con mayor frecuencia debido a una localización anatómica inapropiada del material inyectado (p. ej., subcutánea, intravascular), que puede pasar inadvertida inicialmente.
Complicaciones del bloqueo caudal
Los riesgos incluyen hemorragia, infección, lesión nerviosa, punción dural inadvertida y cefalea pospunción dural, reacción alérgica y toxicidad por anestésico local. El evento adverso más común es la incapacidad para realizar un bloqueo o el fracaso del bloqueo.20
Límite de edad
Aunque algunos centros limitan los bloqueos caudales a poblaciones no deambulantes (lactantes), los bloqueos caudales también pueden ser seguros y eficaces en niños mayores. En nuestra práctica pediátrica, a menudo realizamos bloqueos caudales en niños mayores, dependiendo del hábitus, para cirugías en las que es deseable un nivel sacro de control del dolor (p. ej., circuncisión). En niños de mayor tamaño (más de 50 kg) o de mayor edad, una epidural lumbar de dosis única realizada al nivel correspondiente suele ser sencilla, pero puede presentar respeto sacro debido al tamaño relativamente grande de las raíces nerviosas sacras, por lo que se adapta más idealmente a una analgesia a nivel lumbar (p. ej., para una incisión de Pfannenstiel).2,24 Estudios en adultos sugieren una tasa mayor de lo esperado de inyección intravascular accidental cuando se realiza una epidurografía caudal confirmatoria.25 Los cambios en el hábitus corporal, la osificación de la membrana sacrococcígea y los cambios en el espacio epidural también pueden llevar a preferir un punto de acceso a nivel de la columna lumbar o torácica para los bloqueos neuraxiales en niños mayores y de gran tamaño y en adultos.
Tasa de complicaciones en hipospadias
La reparación de hipospadias es un procedimiento urológico frecuente en varones jóvenes. Los informes publicados han analizado principalmente el impacto de las técnicas quirúrgicas y la gravedad de los defectos en la incidencia de complicaciones quirúrgicas. En los últimos años, se han publicado informes controvertidos sobre el efecto de la técnica anestésica en la tasa de complicaciones posquirúrgicas, como fístula uretrocutánea o dehiscencia glandular.
En un estudio aleatorizado que comparó la eficacia del bloqueo peneano y la anestesia caudal para reparaciones de hipospadias, Kundra et al observaron incidentalmente una mayor incidencia de fístula uretrocutánea en los pacientes que recibieron un bloqueo caudal.26 Es importante señalar la N pequeña de 54, y que los niños en este estudio tenían entre 4 y 12 años; una edad mayor que la recomendada contemporáneamente para la reparación del hipospadias. Algunos estudios han encontrado una mayor edad del paciente como factor de riesgo de complicaciones.27,28 Además, la cirugía fue realizada tanto por urólogos como por cirujanos plásticos y las técnicas quirúrgicas fueron diferentes en el grupo con bloqueo caudal en comparación con el grupo con bloqueo peneano.
Taicher et al., en una revisión de las reparaciones primarias de hipospadias realizadas por un único cirujano entre 2001 y 2014, encontraron que las complicaciones se asociaron con bloqueos caudales, hipospadias proximales, mayor duración quirúrgica y los primeros años de práctica del cirujano.29 Tras ajustar por factores de confusión mediante un análisis de regresión logística multivariable, concluyeron que tanto los bloqueos caudales como las hipospadias proximales siguieron estando altamente asociados con complicaciones posoperatorias. Los autores señalaron el uso rutinario de lidocaína con epinefrina por parte de su cirujano en todos los casos salvo los glandulares mínimos. Sin embargo, dado que la información sobre el uso de epinefrina subcutánea no se registró de forma consistente en su base de datos, no pueden comentar si desempeñó algún papel en sus hallazgos.
Zaidi et al encontraron que la localización del meato uretral (proximal >segmento distal del cuerpo del pene) se asociaba fuertemente con el desarrollo de fístula uretrocutánea. En contraste con Taicher et al., su análisis de un subgrupo que se sometió a reparación tubularizada del meato uretral distal no reveló asociación entre la formación de fístula y el uso de bloqueos caudales, pero sí encontró una asociación entre la formación de fístula y el uso de epinefrina subcutánea.29,30 De manera similar, Barga et al encontraron únicamente una asociación entre hipospadias proximal y la formación de fístula tras el análisis multivariante.31
Una revisión sistemática y metanálisis de estudios observacionales no aleatorizados no encontró asociación entre los bloqueos caudales y las complicaciones posoperatorias.32 La ventaja de un metanálisis es su capacidad para aumentar el número de observaciones y, por lo tanto, la potencia estadística. Pero debemos tener en cuenta que el metanálisis está limitado por los sesgos y las limitaciones de los datos de origen.
Los bloqueos caudales, en comparación con el bloqueo del nervio peneano (PNB), se asociaron con una menor tasa de cirugía de revisión por hipospadias, a pesar de informes previos que sugerían lo contrario.33
El mecanismo por el cual los bloqueos caudales podrían contribuir a complicaciones posquirúrgicas no está claro. Se ha planteado la hipótesis de que la estasis sanguínea secundaria a la simpatectomía provoca ingurgitación peneana, edema posoperatorio y mala cicatrización de la herida.26 Otros sostienen que el aumento del flujo sanguíneo arterial secundario al bloqueo caudal disminuye la isquemia tisular.33
Catéter epidural
Para procedimientos dolorosos que requieren hospitalización, o para pacientes seleccionados en quienes se desea una analgesia neuraxial de mayor duración, un catéter caudal o epidural es ventajoso para aumentar la duración del control del dolor regional. En nuestra institución, muchos de nuestros pacientes estarán en “vía rápida” después de una reparación planificada (p. ej., alta en el primer día posoperatorio), como un reimplante ureteral abierto, y con mayor frecuencia reciben bloqueos caudales de inyección única con un coadyuvante para prolongar el bloqueo. Los pacientes que tienen reparaciones más complejas y que necesitarán una estancia posoperatoria más prolongada, o aquellos con antecedentes de problemas de control del dolor, son valorados conjuntamente por los equipos de urología y de dolor agudo de anestesia antes de la cirugía y se les colocan catéteres epidurales. Esto permite una infusión continua de anestésico local en el posoperatorio. La infusión epidural puede interrumpirse temporalmente para determinar si el paciente es capaz de controlar el dolor con un régimen oral antes del alta. Si la prueba resulta exitosa, el catéter puede retirarse, por lo general el día anterior al alta.
Bloqueos troncales
El bloqueo del nervio ilioinguinal es una opción para procedimientos inguinoescrotales unilaterales cuando un bloqueo caudal no es apropiado debido a la edad, dificultades anatómicas o negativa del paciente. La colocación preincisional del bloqueo es preferible, ya que permitiría disminuir el uso de analgésicos intravenosos intraoperatorios. Sin embargo, la infiltración con anestésico local puede distorsionar la anatomía para el cirujano.
Medicamentos y adyuvantes para bloqueos regionales
Los anestésicos locales más comunes que usamos en nuestra práctica de anestesia regional pediátrica son la ropivacaína y la bupivacaína, ambas utilizadas al 0,125–0,25%, y administradas por lo general a 1 cc/kg para obtener un nivel sacro de analgesia. Generalmente, usamos al menos epinefrina como adyuvante, que también sirve para indicar si se ha producido una inyección intravascular inadvertida. La epinefrina como adyuvante, administrada intravascularmente, aumenta la frecuencia cardíaca del paciente y ocasionalmente provoca cambios en el ECG durante una “dosis de prueba” (es decir, una pequeña cantidad del anestésico local que contiene epinefrina, que se inyecta primero, luego seguida de un breve período de espera para observar cualquier cambio en el ECG o en los signos vitales).
Para obtener un nivel de bloqueo más alto, puede utilizarse un volumen adicional de solución inyectada diluyendo la concentración del anestésico local (p. ej., 1 cc/kg de anestésico local más 0,5 cc/kg de diluyente, como solución salina normal sin conservantes).
Los adyuvantes más comunes de los anestésicos locales utilizados en nuestra práctica son la clonidina (generalmente 1 mcg/kg), el fentanilo (1 mcg/kg) y la hidromorfona (5–10 mcg/kg). Se ha observado una asociación entre el uso de opioides caudales y un aumento de náuseas y vómitos posoperatorios.34 No existe una diferencia significativa en la duración de acción ni en los eventos adversos al usar clonidina frente a morfina (libre de conservantes) como adyuvante. Por lo tanto, limitamos el uso de opioides como adyuvantes (con o sin clonidina) a los pacientes con menor riesgo de desarrollar náuseas y vómitos posoperatorios y que probablemente se beneficien en mayor medida de una mayor duración del bloqueo (p. ej., incisión más extensa, procedimientos más dolorosos). Por lo general, se evita la clonidina en la población neonatal debido a la preocupación por apnea y bradicardia.
El uso de dexmedetomidina como adyuvante de la anestesia caudal se ha asociado con puntuaciones de sedación más altas y una mayor incidencia de bradicardia.35
Analgesia multimodal
La analgesia multimodal combina el uso de bloqueos nerviosos, analgésicos opioides y no opioides para optimizar el control del dolor.
AINEs
A pesar de la falta de evidencia sólida y de gran escala sobre su eficacia, el ketorolaco probablemente sea seguro y actualmente se usa ampliamente en el periodo perioperatorio.36 El ketorolaco está indicado, solo para uso a corto plazo, en afecciones dolorosas agudas. No está indicado para el dolor leve y está contraindicado en pacientes con enfermedad renal avanzada y en aquellos que no han recibido una reanimación con volumen adecuada. Su uso en la dosis efectiva más baja (p. ej., 0.5 mg/kg IV o menos) se asocia con una analgesia igual a la de dosis más altas, pero con efectos secundarios mínimos. El ketorolaco también debe evitarse en pacientes con alto riesgo de sangrado o con enfermedad ulcerosa gastrointestinal. La práctica entre los anestesiólogos varía, pero la literatura reciente sugiere que su uso en neonatos sanos (al menos 3 semanas de vida y no pretérmino) y lactantes no se asocia con un aumento de los efectos adversos.37,38
Paracetamol
El paracetamol es el analgésico no opioide más utilizado en la población pediátrica para tratar el dolor leve a moderado. Está disponible en múltiples formulaciones y concentraciones y puede administrarse por vía oral, rectal e intravenosa. La dosificación varía según la vía de administración, la edad del paciente y la formulación intravenosa disponible. El paracetamol conlleva un riesgo bajo de efectos adversos graves. La hepatotoxicidad es el principal efecto adverso grave y con mayor frecuencia se asocia a la sobredosis, tanto intencional como no intencional.39 Debe evitarse su administración en pacientes con vómitos prolongados, ayuno prolongado, deshidratación y disfunción hepática.40
Preocupaciones posoperatorias
NVPO
Un efecto secundario común y potencialmente prevenible de la cirugía y la anestesia es la presencia de náuseas y vómitos posoperatorios (NVPO). Las NVPO pueden ocasionar malestar significativo, así como una disminución de la satisfacción del paciente.41 La terapia combinada es más eficaz que la monoterapia. Las consideraciones anestésicas para reducir el riesgo de NVPO incluyen la anestesia regional y la analgesia multimodal para reducir la necesidad de opioides perioperatorios, una hidratación preoperatoria adecuada mediante la minimización de los tiempos de ayuno, una hidratación intraoperatoria adecuada, la evitación de anestésicos volátiles y el tratamiento profiláctico con agentes farmacológicos.42,43
Tabla 2 Factores de riesgo de náuseas y vómitos posoperatorios en pacientes pediátricos. Los factores de riesgo mayores están en negrita y se ha demostrado que son aditivos.44
| Paciente | Quirúrgico | Anestésico |
|---|---|---|
| Sexo femenino después de la pubertad | Corrección de estrabismo | Uso de agentes volátiles |
| Antecedentes de náuseas y vómitos postoperatorios (NVPO) o cinetosis | Procedimientos de oído | Uso de óxido nitroso |
| Edad > 3 años | Amigdalectomía/adenoidectomía | Uso de opioides |
| Orquidopexia | Duración de la anestesia > 30 minutos | |
| Reparación de hernia |
Tabla 3 Agentes farmacológicos para la profilaxis de las náuseas y los vómitos postoperatorios. Ondansetrón y dexametasona son los dos agentes más utilizados en la población pediátrica.42 El parche transdérmico de escopolamina no suele utilizarse en niños menores de 12 años. El British National Formulary for Children recomienda el uso de un cuarto de parche desde 1 mes hasta 3 años y la mitad de un parche entre los 3–10 años. La metoclopramida también puede causar discinesia tardía.
| Medicamento | Sitio de acción | Dosis | Efectos secundarios |
|---|---|---|---|
| Ondansetrón | Antagonista del receptor de serotonina 5-HT3 | 0.1–0.15mg/kg IV (máx 4 mg) | Intervalo QT prolongado |
| Dexametasona | No bien comprendido | 0.15 mg/kg IV | Síndrome de lisis tumoral |
| Escopolamina | Antagonista M-1 de la acetilcolina | 1.5 mg parche transdérmico | Boca seca, alteraciones visuales, sedación |
| Aprepitant | Antagonista de neuroquinina-1 | 1 mg/kg VO (máx 40 mg) | Raros |
| Lorazepam | Agonista de GABA | 0.05 mg/kg IV (máx 2 mg) | Sedación |
| Difenhidramina | Antagonista del receptor H-1 de histamina | 1 mg/kg IV (máx 50 mg) | Sedación |
| Metoclopramida | Antagonista del receptor D-2 de dopamina | 0.1–0.25 mg/kg IV (máx 20 mg) | Intervalo QT prolongado |
Apnea
Se ha observado que los ex prematuros presentan un mayor riesgo de apnea posoperatoria. El riesgo de apnea disminuye en pacientes nacidos a mayor edad gestacional. Cote et al hallaron en su estudio fundamental que la incidencia de apnea se relaciona estrechamente con la edad gestacional y la edad posconcepcional, y que la incidencia global disminuye de manera marcada después de las 43 semanas de edad posconcepcional. En pacientes nacidos a una edad gestacional de 35 semanas, la incidencia de apnea disminuye a menos del 5% después de las 48 semanas de edad posconcepcional y a menos del 1% después de las 54 semanas de edad posconcepcional. En aquellos que nacieron a las 32 semanas, observaron una disminución de la incidencia de apnea a menos del 5% y a menos del 1% después de una edad posconcepcional de 50 y 56 semanas, respectivamente.19
La anestesia general puede poner en evidencia anomalías del control ventilatorio y, por lo tanto, también una propensión a la apnea no observada previamente en un lactante ex prematuro o incluso nacido a término. La anestesia general disminuye el tono muscular, lo que resulta en obstrucción de la vía aérea superior que contribuye a la apnea; por lo tanto, es razonable inferir que la anestesia espinal disminuiría el riesgo de apnea. Davidson et al hallaron de manera similar que la prematuridad era el predictor más fuerte de apnea. Observaron una reducción de los eventos apneicos en los primeros 30 minutos, una disminución en el grado de desaturación y en el nivel de intervención necesario para los episodios de apnea con anestesia espinal en vigilia en comparación con anestesia general. No encontraron diferencias en la incidencia de apnea tardía (apnea entre los 30 minutos y las 12 horas después de la anestesia). No obstante, su ensayo no incluyó lactantes nacidos extremadamente prematuros (menos de 26 semanas de gestación) ni aquellos con comorbilidades significativas. Es posible que los beneficios de la anestesia espinal respecto a la apnea sean diferentes en esas poblaciones.45
Dado lo anterior, los lactantes que se sometan a procedimientos que requieran anestesia (sedación, anestesia raquídea y anestesia general) deben ser admitidos para observación. El ingreso debe ser por al menos 23 horas tras la anestesia e incluir oximetría de pulso continua. Los requisitos de ingreso varían de una institución a otra. Nuestra institución ha exigido de manera conservadora el ingreso posanestésico de los lactantes con antecedente de prematuridad (nacidos a < 37 semanas de edad gestacional) que tienen menos de 60 semanas de edad postconcepcional. En los lactantes a término por lo demás sanos, el ingreso tras la anestesia no es necesario después de las 44 semanas de edad postconcepcional. Los niños con comorbilidades significativas deben evaluarse caso por caso.
Complicaciones inesperadas
Los padres siempre deben estar preparados para posibles ingresos hospitalarios, especialmente en pacientes menores de 60 semanas de edad postconcepcional. Además, los pacientes con síntomas respiratorios leves recientes o actuales pueden requerir ingreso hospitalario secundario a vías aéreas hiperreactivas.
Actualización sobre la anestesia pediátrica y la neurotoxicidad
Existen preocupaciones continuas acerca de la neurotoxicidad inducida por la anestesia en el cerebro en desarrollo. ¿Cómo equilibramos los riesgos potenciales asociados con la anestesia y el momento óptimo de las intervenciones quirúrgicas? En modelos animales, incluidos primates no humanos, la exposición a agentes anestésicos generales de uso común, como halogenados volátiles, propofol y ketamina, resulta en una serie de cambios morfológicos y funcionales. En los animales expuestos se ha observado muerte celular neuronal apoptótica, muerte glial, neurogénesis alterada y formación axonal anormal. En algunos, la exposición en la infancia se ha asociado con conducta alterada y deterioro del aprendizaje y la formación de la memoria que persisten hasta la adultez temprana. La exposición parece ser dependiente de la dosis, de la duración de la exposición y del sexo. En comparación con sus contrapartes hembras, los roedores machos presentaron deterioro del aprendizaje y la memoria contextuales a pesar de una muerte neuronal comparable.46 Sin embargo, es difícil extrapolar los resultados de los modelos animales a los humanos, ya que las dosis utilizadas en estos estudios son significativamente más altas que las que se emplean típicamente en humanos.47
Existe evidencia mixta de estudios de cohorte y retrospectivos de que los niños pequeños expuestos a anestesia tienen un mayor riesgo de resultados del neurodesarrollo desfavorables. Algunos estudios han sugerido un mayor riesgo de trastornos del desarrollo conductual con exposiciones múltiples, pero no con una única exposición. DiMaggio et al realizaron un metanálisis de estudios seleccionados publicados entre 2008 y 2012 y concluyeron que los resultados indicaban un riesgo modesto, pero elevado.48
O’Leary et al llevaron a cabo un estudio de cohorte poblacional en Ontario, Canadá, al vincular bases de datos administrativas de salud provinciales con los resultados del desarrollo infantil medidos mediante el Early Development Instrument (EDI). Los niños que se sometieron a cirugía antes de la finalización del EDI (edad de 5 a 6 años) fueron emparejados con niños no expuestos. El resultado primario fue la vulnerabilidad del desarrollo temprano, definida como cualquier dominio del EDI en el decil inferior de la población. Se realizaron análisis de subgrupos en función de la edad en la primera cirugía (menor de 2 años y mayor o igual a 2 años) y de la frecuencia de la cirugía. Los autores concluyeron que los niños que se sometieron a cirugía antes de la edad de ingreso a la escuela primaria presentaban un mayor riesgo de vulnerabilidad del desarrollo temprano, pero la magnitud de la diferencia entre los niños expuestos y no expuestos fue pequeña. Una edad menor de 2 años en la primera exposición y múltiples exposiciones a la cirugía no fueron factores de riesgo de desenlaces adversos del desarrollo.49
Un estudio poblacional en Australia de forma similar encontró que, entre los niños sin trastornos del neurodesarrollo preexistentes conocidos, aquellos expuestos a anestesia general antes de los 4 años tenían puntuaciones reducidas en lectura y competencia numérica (matemáticas) en tercer grado y tenían más probabilidades de ser considerados de alto riesgo en el desarrollo (puntuaciones en el 10o percentil inferior en dos o más dominios) al ingreso escolar. Al restringir a solo una anestesia general y una hospitalización, observaron una atenuación de la asociación con el desarrollo deficiente y las puntuaciones de lectura, pero se mantuvo el resultado deficiente en competencia numérica. En contraste con O’Leary et al., sí encontraron una asociación entre el número de exposiciones y resultados del desarrollo deficientes.50
El estudio PANDA es un estudio de cohorte con emparejamiento entre hermanos que comparó los resultados del neurodesarrollo de 105 niños que estuvieron expuestos a anestesia general antes de los 36 meses de edad por reparaciones de hernia inguinal y sus hermanos no expuestos. Se realizaron pruebas neuropsicológicas entre los 8 y 15 años de edad. Sus datos no mostraron diferencias estadísticamente significativas entre las puntuaciones de CI de niños sanos con una sola exposición anestésica antes de los 36 meses de edad en comparación con sus hermanos sanos no expuestos.51 De igual manera, el estudio de cohorte MASK no encontró evidencia de una diferencia en las puntuaciones de las pruebas entre los niños con una sola anestesia antes de los 3 años de edad en comparación con aquellos sin exposición a anestesia. Sin embargo, el estudio sí encontró un mayor riesgo de déficit en la velocidad de procesamiento y en el desempeño motor fino entre aquellos con múltiples anestesias. Los padres del grupo con exposiciones múltiples informaron un aumento de problemas relacionados con la función ejecutiva, el comportamiento y la lectura.52
El estudio de Anestesia General Comparada con Anestesia Raquídea, o “estudio GAS”, es un ensayo internacional, prospectivo, multicéntrico, aleatorizado y controlado que investiga el resultado del neurodesarrollo a los 2 y 5 años de edad tras la reparación de hernia antes de las 60 semanas de edad posmenstrual. Los lactantes se estratificaron por centro y edad gestacional al nacer y se asignaron aleatoriamente (1:1) para recibir anestesia regional en vigilia o anestesia general basada en sevoflurano. Se excluyó a los lactantes si presentaban factores de riesgo preexistentes de lesión neurológica. Los resultados mostraron que una exposición de algo menos de 1 hora a una anestesia general con sevoflurano en la infancia no aumentó el riesgo de un resultado del neurodesarrollo adverso a los 2 años de edad.53 El ensayo mostró de manera similar evidencia de equivalencia en la puntuación del Cociente Intelectual Total de la Escala de Inteligencia de Wechsler para Preescolar y Primaria, Tercera Edición (WPPSI-III), medida a los 5 años en esta población de estudio predominantemente masculina.54
Basándonos en los datos disponibles, podemos tranquilizarnos a nosotros mismos y a los padres de que, entre los niños pequeños por lo demás sanos, una única exposición breve a anestesia general no dará como resultado un peor desarrollo neurocognitivo. No obstante, la anestesia general no es un proceso completamente benigno. Existe cierta evidencia de un efecto perjudicial tras exposiciones repetidas, pero aún hay datos limitados sobre la exposición prolongada y los subgrupos vulnerables. La mayoría de los estudios en animales han encontrado que las exposiciones más prolongadas (3 horas o más; en primates no humanos, 5 horas o más) tienen mayor probabilidad de causar neurotoxicidad. Sin embargo, no conocemos la equivalencia del tiempo de exposición en animales con el de los humanos.55 Además, aún no sabemos cuál es peor: múltiples exposiciones breves o una única exposición prolongada. Aun así, no sabemos la edad a la que la anestesia general deja de suponer una amenaza para el desarrollo neurocognitivo de un niño. Para los pacientes y procedimientos apropiados, puede ser prudente ofrecer una técnica anestésica neuroaxial para limitar el número de posibles exposiciones a anestesia general. Si se requiere anestesia general, una técnica combinada de anestesia regional y general sería útil para disminuir la cantidad de agentes intravenosos e inhalatorios necesarios para mantener un buen nivel de anestesia durante el caso.
Conclusión
La anestesia pediátrica es desafiante, ya que trabajamos con una variedad de pacientes no solo con diferentes comorbilidades médicas, sino también en distintos estados de desarrollo neurocognitivo. Apenas estamos comenzando a comprender los efectos de los anestésicos sobre la neuroinflamación, el estrés perioperatorio y el neurodesarrollo. Actualmente, contamos con evidencia que sugiere que una exposición única y breve a la anestesia general en pacientes jóvenes sanos no se asocia con desenlaces neurocognitivos adversos. Es difícil dilucidar si los desenlaces adversos en los pacientes que requieren cirugías prolongadas y múltiples procedimientos son consecuencia de los anestésicos, de cambios asociados al estrés inducido por la cirugía, o más bien un marcador de fenotipos predispuestos a la neurotoxicidad. La realidad probablemente sea multifactorial. Una buena comunicación preoperatoria entre los equipos de urología y anestesia, en relación con las necesidades específicas del paciente y del caso, conduce a una atención óptima e individualizada.
Puntos clave
- Los pacientes jóvenes sanos con una exposición única y breve a la anestesia general no tienen un mayor riesgo de presentar un desarrollo neurocognitivo deficiente
- Un bloqueo caudal, epidural o troncular proporciona un control del dolor seguro y eficaz para cirugías urológicas ambulatorias
- Los pacientes que requerirán una hospitalización más prolongada tras procedimientos dolorosos pueden beneficiarse de un catéter caudal o epidural para proporcionar analgesia de mayor duración
- La cirugía laparoscópica y robótica produce cambios en la fisiología que por lo general pueden ser mitigados parcialmente por el equipo de anestesia
- Los niños enfermos deben reprogramarse si los procedimientos son electivos, pero pueden evaluarse caso por caso si los síntomas son mínimos
- Los niños con riesgo de apnea posoperatoria deben ser ingresados para observación
- Una buena comunicación preoperatoria entre los equipos de urología y anestesia respecto a las necesidades específicas del paciente y del caso conduce a una atención óptima e individualizada
Referencias
- Davis PJ, Cladis F. Smith’s Anesthesia for Infants and Children. 2017; 9. DOI: 10.1213/00000539-199009000-00032.
- Sola C, Lefauconnier A, Bringuier S, Raux O, Capdevila X, Dadure C. Childhood preoperative anxiolysis: Is sedation and distraction better than either alone? A prospective randomized study. Paediatr Anaesth 2017; 27 (8): 827–834. DOI: 10.1111/pan.13180.
- Auerbach M, Tunik M, Mojica M. A Randomized, Double-blind Controlled Study of Jet Lidocaine Compared to Jet Placebo for Pain Relief in Children Undergoing Needle Insertion in the Emergency Department. Acad Emerg Med 2009; 16 (5): 388–393. DOI: 10.1111/j.1553-2712.2009.00401.x.
- Disease Control C for, Prevention. Chickenpox (Varicella). 2021. DOI: 10.1016/b978-1-4831-8407-4.50023-7.
- Kimberlin DW, Barnett ED, Lynfield R, Sawyer MH. Red book: report of the Committee on Infectious Diseases. vol. 2021, American Academy of Pediatrics; , DOI: 10.1111/j.1651-2227.2009.01642.x.
- Disease Control C for, Prevention. Hand, Foot, and Mouth Disease (HFMD). 2021. DOI: 10.3329/bjch.v40i2.31567.
- Mallory MD, Travers C, McCracken CE, Hertzog J, Cravero JP. Upper Respiratory Infections and Airway Adverse Events in Pediatric Procedural Sedation. Pediatrics 2017; 140 (1). DOI: 10.1542/peds.2017-0009.
- Lee LK, Bernardo MKL, Grogan TR, Elashoff DA, Ren WHP. Perioperative respiratory adverse event risk assessment in children with upper respiratory tract infection: Validation of the COLDS score. Paediatr Anaesth 2018; 28 (11): 1007–1014. DOI: 10.1111/pan.13491.
- Lema GF, Berhe YW, Gebrezgi AH, Getu AA. Evidence-based perioperative management of a child with upper respiratory tract infections (URTIs) undergoing elective surgery; A systematic review. Int J Surg Open 2018; 12: 17–24. DOI: 10.1016/j.ijso.2018.05.002.
- Saynhalath R, Alex G, Efune PN, Szmuk P, Zhu H, Sanford EL. Anesthetic Complications Associated With Severe Acute Respiratory Syndrome Coronavirus 2 in Pediatric Patients. Anesth Analg 2021; 133 (2): 483–490. DOI: 10.1213/ane.0000000000005606.
- Woods BD, Sladen RN. Perioperative considerations for the patient with asthma and bronchospasm. Br J Anaesth 2009; 103: i57–i65. DOI: 10.1093/bja/aep271.
- Dones F, Foresta G, Russotto V. Update on Perioperative Management of the Child with Asthma. Pediatr Rep 2012; 4 (2): e19. DOI: 10.4081/pr.2012.e19.
- Aronson S, Murray S, Martin G, Blitz J, Crittenden T, Lipkin ME, et al.. Roadmap for Transforming Preoperative Assessment to Preoperative Optimization. Anesth Analg 2020; 130 (4): 811–819. DOI: 10.1213/ane.0000000000004571.
- Shah NN, Vetter TR. Comprehensive Preoperative Assessment and Global Optimization. Anesthesiol Clin 2018; 36 (2): 259–280. DOI: 10.1016/j.anclin.2018.01.006.
- Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures. Anesthesiology 2017; 90 (3): 896–905. DOI: 10.1097/00000542-199903000-00034.
- Dobson G, Chow L, Flexman A. Practice Guidelines for Ophthalmic Anesthesia. Practice Guidelines in Anesthesia-2 2019; 6 (1): 175–175. DOI: 10.5005/jp/books/14207_19.
- Smith I, Kranke P, Murat I, Smith A, OʼSullivan G, Sreide E, et al.. Perioperative fasting in adults and children. Eur J Anaesthesiol 2011; 28 (8): 556–569. DOI: 10.1097/eja.0b013e3283495ba1.
- Dadure C, Sola C, Capdevila X. Preoperative nutrition through a prehabilitation program: A key component of transfusion limitation in paediatric scoliosis surgery. Anaesth Crit Care Pain Med 2015; 34 (6): 311–312. DOI: 10.1016/j.accpm.2015.12.004.
- Cote CJ, Zaslavsky A, Downes JJ, Kurth CD, Welborn LG, Warner LO, et al.. Postoperative Apnea in Former Preterm Infants After Inguinal Herniorrhaphy. Survey of Anesthesiology 1995; 40 (3): 163. DOI: 10.1097/00132586-199606000-00031.
- Polaner DM, Taenzer AH, Walker BJ. Faculty Opinions recommendation of Pediatric Regional Anesthesia Network (PRAN): a multi-institutional study of the use and incidence of complications of pediatric regional anesthesia. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2012; 15 (6): 353–1364. DOI: 10.3410/f.717968230.793467936.
- Sheth KR, Batavia JP, Bowen DK, Koh CJ, Srinivasan AK. Complications in Pediatric Urology Minimally Invasive Surgery. Minimally Invasive and Robotic-Assisted Surgery in Pediatric Urology 2018; 5 (4): 381–404. DOI: 10.1007/978-3-030-57219-8_26.
- Joris JL. Anesthesia for Laparoscopic Surgery. Miller’s Anesthesia. Churchill Livingstone, Philadelphia, 2185-2202. 2010.
- Cyna AM, Middleton P. Caudal epidural block versus other methods of postoperative pain relief for circumcision in boys. Cochrane Database Syst Rev 2008; 2008 (4). DOI: 10.1002/14651858.cd003005.pub2.
- Wiegele M, Marhofer P, Lönnqvist P-A. Caudal epidural blocks in paediatric patients: a review and practical considerations. Br J Anaesth 2019; 122 (4): 509–517. DOI: 10.1016/j.bja.2018.11.030.
- Fukazawa K, Matsuki Y, Ueno H, Hosokawa T, Hirose M. Risk factors related to accidental intravascular injection during caudal anesthesia. J Anesth 2014; 28 (6): 940–943. DOI: 10.1007/s00540-014-1840-8.
- Kundra P, Yuvaraj K, Agrawal K, Krishnappa S, Kumar LT. Surgical outcome in children undergoing hypospadias repair under caudal epidural vs penile block. Paediatr Anaesth 2012; 22 (7): 707–712. DOI: 10.1111/j.1460-9592.2011.03702.x.
- Yildiz T, Tahtali IN, Ates DC, Keles I, Ilce Z. Age of patient is a risk factor for urethrocutaneous fistula in hypospadias surgery. J Pediatr Urol 2013; 9 (6): 900–903. DOI: 10.1016/j.jpurol.2012.12.007.
- Zhang J, Zhu S, Zhang L, Fu W, Hu J, Zhang Z, et al.. The association between caudal block and urethroplasty complications of distal tubularized incised plate repair: experience from a South China National Children’s Medical Center. Transl Androl Urol 2021; 10 (5): 2084–2090. DOI: 10.21037/tau-21-355.
- Taicher BM, Routh JC, Eck JB, Ross SS, Wiener JS, Ross AK. The association between caudal anesthesia and increased risk of postoperative surgical complications in boys undergoing hypospadias repair: Comment on data sparsity. Paediatr Anaesth 2017; 27 (9): 974–974. DOI: 10.1111/pan.13207.
- Zaidi RH, Casanova NF, Haydar B, Voepel-Lewis T, Wan JH. Urethrocutaneous fistula following hypospadias repair: regional anesthesia and other factors. Paediatr Anaesth 2015; 25 (11): 1144–1150. DOI: 10.1111/pan.12719.
- Braga LH, Jegatheeswaran K, McGrath M, Easterbrook B, Rickard M, DeMaria J, et al.. Cause and Effect versus Confounding–Is There a True Association between Caudal Blocks and Tubularized Incised Plate Repair Complications? J Urol 2017; 197 (3 Part 2): 845–851. DOI: 10.1016/j.juro.2016.08.110.
- Zhu C, Wei R, Tong Y, Liu J, Song Z, Zhang S. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Ngoo A, Borzi P, McBride CA, Patel B. Penile nerve block predicts higher revision surgery rate following distal hypospadias repair when compared with caudal epidural block: A consecutive cohort study. J Pediatr Urol 2020; 16 (4): 439.e1–439.e6. DOI: 10.1016/j.jpurol.2020.05.150.
- Goyal S, Sharma A, Goswami D, Kothari N, Goyal A, Vyas V, et al.. Clonidine and Morphine as Adjuvants for Caudal Anaesthesia in Children: A Systematic Review and Meta-Analysis of Randomised Controlled Trials. Turk J Anaesthesiol Reanim 2020; 48 (4): 265–272. DOI: 10.5152/tjar.2020.29863.
- Wang X-xue, Dai J, Dai L, Guo H-jing, Zhou A-guo, Pan D-bo. Caudal dexmedetomidine in pediatric caudal anesthesia. Medicine (Baltimore) 2020; 99 (31): e21397. DOI: 10.1097/md.0000000000021397.
- Rowe E, Cooper TE, McNicol ED. Ketorolac for postoperative pain in children. Cochrane Database Syst Rev 2018; 7:cd012294. DOI: 10.1002/14651858.cd012294.
- Aldrink JH, Ma M, Wang W, Caniano DA, Wispe J, Puthoff T. Safety of ketorolac in surgical neonates and infants 0 to 3 months old. J Pediatr Surg 2011; 46 (6): 1081–1085. DOI: 10.1016/j.jpedsurg.2011.03.031.
- Stone SB. Ketorolac in Postoperative Neonates and Infants: A Systematic Review. J Pediatr Pharmacol Ther 2021; 26 (3): 240–247. DOI: 10.5863/1551-6776-26.3.240.
- Anesthesia BBP. Non-Opioid Analgesic Agents. People’s Medical Publishing House; 2011, DOI: 10.1016/j.mpaic.2007.11.012.
- Drugs C on. Acetaminophen Toxicity in Children. Pediatrics 2001; 108 (4): 1020–1024. DOI: 10.1542/peds.108.4.1020.
- Chandrakantan A. Postoperative Nausea and Vomiting in Children. Case Studies in Pediatric Anesthesia 2014; 7 (3): 24–25. DOI: 10.1017/9781108668736.006.
- Urits I, Orhurhu V, Jones MR. Postoperative nausea and vomiting in paediatric strabismus surgery. Br J Anaesth 2020; 105 (4): 550–551. DOI: 10.1093/bja/aeq219.
- Gan TJ, Diemunsch P, Habib AS, Kovac A, Kranke P, Meyer TA, et al.. Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg 2014; 118 (1): 85–113. DOI: 10.1213/ane.0000000000000002.
- Eberhart LHJ, Geldner G, Kranke P. Development and validation of a risk score to predict the probability of postoperative vomiting in pediatric patients: the VPOP score. Paediatr Anaesth 2004; 25 (3): 330–330. DOI: 10.1111/pan.12596.
- Davidson AJ, Morton NS, Arnup SJ. Faculty Opinions recommendation of Apnea after Awake Regional and General Anesthesia in Infants: The General Anesthesia Compared to Spinal Anesthesia Study–Comparing Apnea and Neurodevelopmental Outcomes, a Randomized Controlled Trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2015; 23 (1): 8–54. DOI: 10.3410/f.725508900.793507986.
- Lee BH, Chan JT, Kraeva E, Peterson K, Sall JW. Isoflurane exposure in newborn rats induces long-term cognitive dysfunction in males but not females. Neuropharmacology 2014; 83: 9–17. DOI: 10.1016/j.neuropharm.2014.03.011.
- Vutskits L, Xie Z. Lasting impact of general anaesthesia on the brain: mechanisms and relevance. Nat Rev Neurosci 2016; 17 (11): 705–717. DOI: 10.1038/nrn.2016.128.
- DiMaggio C, Sun LS, Ing C, Li G. Pediatric Anesthesia and Neurodevelopmental Impairments. J Neurosurg Anesthesiol 2012; 24 (4): 376–381. DOI: 10.1097/ana.0b013e31826a038d.
- O’Leary JD, Janus M, Duku E, Wijeysundera DN, To T, Li P, et al.. A Population-based Study Evaluating the Association Between Surgery in Early Life and Child Development at Primary School Entry. Obstetric Anesthesia Digest 2016; 37 (2): 78–79. DOI: 10.1097/01.aoa.0000515748.52953.0b.
- Schneuer FJ, Bentley JP, Davidson AJ, Holland AJA, Badawi N, Martin AJ, et al.. The impact of general anesthesia on child development and school performance: a population-based study. Paediatr Anaesth 2018; 28 (6): 528–536. DOI: 10.1111/pan.13390.
- Sun LS, Li G, Miller TLK, Salorio C, Byrne MW, Bellinger DC, et al.. Association Between a Single General Anesthesia Exposure Before Age 36 Months and Neurocognitive Outcomes in Later Childhood. Jama 2016; 315 (21): 2312. DOI: 10.1001/jama.2016.6967.
- Warner DO, Zaccariello MJ, Katusic SK. Faculty Opinions recommendation of Neuropsychological and Behavioral Outcomes after Exposure of Young Children to Procedures Requiring General Anesthesia: The Mayo Anesthesia Safety in Kids (MASK) Study. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2018; 29 (1): 9–105. DOI: 10.3410/f.733078932.793559248.
- Davidson AJ, Disma N, Graaff JC de, Withington DE, Dorris L, Bell G, et al.. Neurodevelopmental outcome at 2 years of age after general anaesthesia and awake-regional anaesthesia in infancy (GAS): an international multicentre, randomised controlled trial. Lancet 2016; 387 (10015): 239–250. DOI: 10.1016/s0140-6736(15)00608-x.
- McCann ME, Graaff JC, Dorris L. Faculty Opinions recommendation of Neurodevelopmental outcome at 5 years of age after general anaesthesia or awake-regional anaesthesia in infancy (GAS): an international, multicentre, randomised, controlled equivalence trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2019; 93 (10172): 64–677. DOI: 10.3410/f.735131691.793559701.
- Creeley C, Dikranian K, Dissen G, Martin L, Olney J, Brambrink A. Propofol-induced apoptosis of neurones and oligodendrocytes in fetal and neonatal rhesus macaque brain. Br J Anaesth 2013; 110: i29–i38. DOI: 10.1093/bja/aet173.
Última actualización: 2025-09-21 13:35