5: Diagnóstico prenatal y cirugía antenatal
Este capítulo durará aproximadamente 24 minutos para leer.
Introducción
La encuesta anatómica fetal integral del segundo trimestre se ha convertido en la atención prenatal estándar. La ecografía prenatal detecta entre el 84,4 y el 97% de todas las malformaciones del tracto urinario fetal, y estas anomalías pueden identificarse desde las 12–14 semanas de gestación.1,2 Antes de la detección sistemática antenatal, los niños sintomáticos con anomalías urológicas se identificaban tras el nacimiento, presentando síntomas como urosepsis, dolor, hematuria, masa palpable o falta de medro, que a menudo requerían intervención quirúrgica. La generalización de la ecografía prenatal ha desplazado el foco de la urología pediátrica desde un modelo principalmente intervencionista/quirúrgico hacia un papel de asesoramiento antenatal.
La hidronefrosis antenatal se observa en el 1–5% de todos los embarazos y constituye el diagnóstico prenatal más frecuente.3 La mayoría de estos pacientes presentan una dilatación leve de la pelvis renal que se resuelve espontáneamente; sin embargo, la hidronefrosis puede ser secundaria a una obstrucción del tracto urinario, que puede o no beneficiarse de intervención prenatal. Por ello, se requiere un conocimiento exhaustivo de la fisiopatología de las posibles malformaciones del tracto urinario detectables mediante cribado antenatal y de sus manifestaciones e intervenciones prenatales posibles.
Embriología
Embriología renal
Los tractos urinario y genital derivan del mesodermo intermedio. En la cuarta semana tras la concepción, el mesonefros se forma a partir de dos abultamientos alargados de mesodermo. Este sistema rudimentario produce orina temporalmente entre las semanas 6 y 10 de gestación y posteriormente involuciona. A las 5–6 semanas de gestación, el brote ureteral se origina como una evaginación del conducto mesonéfrico (de Wolff). El brote ureteral crece en dirección cefálica y penetra el blastema metanéfrico en la semana 7. Esto induce al mesénquima indiferenciado, transformándolo en nefronas funcionales del riñón metanéfrico (Figura 1). La interacción entre el brote ureteral y el blastema metanéfrico es crucial para la formación de riñones funcionales; si no ocurre, se produce agenesia renal.
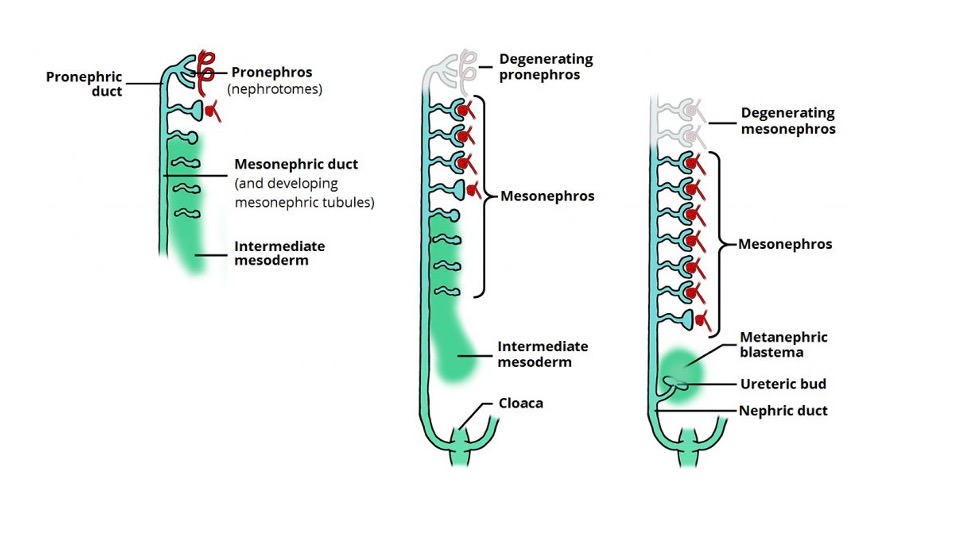
Figura 1 Desarrollo y degeneración secuencial del pronefros y el mesonefros e inducción del brote ureteral y del blastema metanéfrico que conducen al desarrollo renal. Imagen obtenida de Teach Me Anatomy.
La corteza renal y las nefronas se desarrollan a partir del blastema metanéfrico, mientras que los túbulos colectores, conductos papilares, cálices y pelvis renal, así como el uréter, derivan del brote ureteral. El uréter forma un cordón sólido de tejido hacia la sexta semana de gestación y sufre canalización, que comienza en el segmento medio ureteral y se extiende en sentido bidireccional. La unión pieloureteral y la unión ureterovesical son los últimos segmentos en canalizarse. La membrana que se desarrolla durante la canalización, llamada membrana de Chwalla, puede contribuir a una hidronefrosis e hidroureteronefrosis transitorias/fisiológicas si su perforación se retrasa.4 En la décima semana, las nefronas se conectan al conducto colector y comienza la producción de orina. Si las nefronas y el sistema colector no se unen adecuadamente, puede ocurrir un proceso obstructivo temprano, que puede dar lugar al desarrollo de un riñón displásico multiquístico.5
Entre las semanas sexta y novena de gestación, los riñones ascienden hasta su localización definitiva en la región lumbar. La ectopia renal ocurre cuando los riñones no migran; la pelvis es la localización ectópica más común. Además, la fusión de los polos inferiores puede producir un riñón en herradura. En el riñón en herradura, el ascenso al abdomen se ve limitado por la arteria mesentérica inferior, lo que resulta en su posición ectópica. Un video que muestra el desarrollo renal prenatal normal está disponible (Video 1).
Video 1. Representación del desarrollo renal prenatal normal.
Para la décima semana de gestación, la nefrona está madura y comienza la producción de orina. Los riñones son capaces de eliminar sodio y concentrar urea entre las semanas 12 y 14 de gestación, y después de 18 semanas de vida intrauterina, casi todo el líquido amniótico es orina fetal. Esta capacidad renal para producir orina y mantener volúmenes adecuados de líquido amniótico influye profundamente en el crecimiento y desarrollo del feto y desempeña un papel clave en el desarrollo pulmonar fetal.
Embriología vesical
El desarrollo de la pared abdominal anterior, la vejiga y el tabique urorrectal están interrelacionados. En la quinta a sexta semana de gestación, el tabique urorrectal divide inicialmente la cloaca en el canal anorrectal dorsal y el seno urogenital ventral. Las anomalías de la membrana cloacal dan lugar a malformaciones anorrectales. El seno urogenital forma la vejiga y la uretra, y el alantoides es el precursor embrionario del remanente uracal.
Los conductos mesonéfricos (de Wolff) se fusionan con la cloaca justo antes de su subdivisión por el tabique urorrectal. La entrada de los conductos mesonéfricos distingue el canal vesicouretral cefálico del seno urogenital caudal. El canal vesicouretral forma la vejiga y la uretra pélvica. La porción caudal del seno urogenital forma la uretra fálica en el varón y el vestíbulo uretral y vaginal en la mujer. Estas divisiones normales de la cloaca se muestran en la (Figura 2). Un video detallado que describe el desarrollo vesical normal está disponible (Video 2).
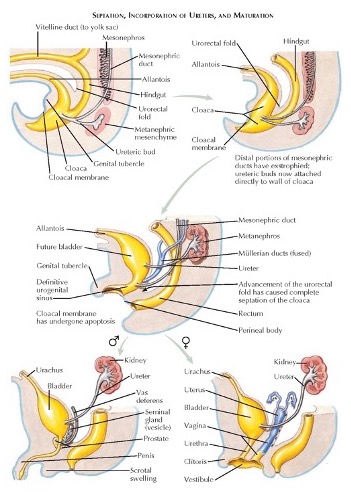
Figura 2 División embriológica normal de la cloaca y desarrollo del sistema genitourinario.
Video 2. Descripción del desarrollo vesical normal.
La membrana cloacal define originalmente la pared ventral del tabique urogenital. A medida que la membrana involuciona, durante la semana 6 de gestación, las crestas mesodérmicas migran hacia la línea media para formar la pared ventral definitiva. La extrofia vesical resulta cuando la membrana cloacal no involuciona y no permite la migración del mesodermo. La extrofia cloacal ocurre cuando la membrana cloacal involuciona antes de que se desarrolle el tabique urorrectal y quedan expuestos tanto la vejiga como el intestino.
Función renal y líquido amniótico
El pronóstico de las anomalías renales es peor cuando el volumen de líquido amniótico es insuficiente, ya que este es vital para el desarrollo pulmonar. Antes de las 16 semanas de gestación, el amnios transporta activamente solutos y el agua difunde pasivamente a través de su membrana. Inicialmente, durante el primer y segundo trimestres, los electrolitos y la osmolaridad de la orina fetal son similares a los de la sangre fetal y materna. Más adelante en la gestación, a medida que el riñón fetal comienza a reabsorber sodio y cloruro por la maduración tubular, la orina y el líquido amniótico se vuelven más hipotónicos.6 El resultado es una composición urinaria con electrolitos bajos y creatinina elevada, muy similar a la observada posnatalmente. Los riñones que han sufrido daño prenatal producen orina isotónica, pues han perdido la capacidad de reabsorber electrolitos y proteínas.
Antes de las 16 semanas de gestación, la cantidad de líquido amniótico puede ser relativamente normal incluso con mala función renal, ya que la mayor parte del líquido amniótico se produce por fuentes no renales. Después de las 16 semanas, los riñones pasan a ser los principales responsables del volumen de líquido amniótico. En el tercer trimestre, la producción horaria de orina fetal alcanza 30–40 mL/hora y constituye alrededor del 90% del líquido amniótico.7
Se reconoce desde hace tiempo que el líquido amniótico desempeña un papel importante en el desarrollo pulmonar fetal. La reducción del volumen de líquido amniótico provoca grados variables de hipoplasia pulmonar. No está claro si el líquido amniótico desempeña solo un papel mecánico en el desarrollo pulmonar fetal o si aporta factores de crecimiento de origen renal. Lo que sí está claro es su importancia en la prevención de la hipoplasia pulmonar, que, cuando es grave, es mortal. El síndrome de Potter (hipoplasia pulmonar grave asociada a agenesia renal bilateral) es mortal y ocurre cuando existe una anomalía renal grave u obstrucción urinaria que ocasiona oligohidramnios severo en etapas tempranas de la gestación.8
Epidemiología
Las anomalías congénitas del riñón y del tracto urinario9 ocurren en 1/500 nacidos vivos, y la incidencia de muerte neonatal por CAKUT es de aproximadamente 1/2000 nacidos vivos.9,10 La hidronefrosis es la anomalía urinaria prenatal identificada con mayor frecuencia, presente en 1–5% de los embarazos; el riesgo de patología posnatal aumenta con el grado de hidronefrosis (11,9% en leve, 45,1% en moderada y 88,3% en grave).11 La mayoría de las anomalías urológicas obstructivas ocurren en varones, con una proporción varón:mujer de 4:1, y con predilección por el riñón izquierdo.12,13
Patogénesis
La uropatía fetal puede deberse a causas genéticas, como la enfermedad renal poliquística autosómica recesiva, o a problemas asociados con la nefrogénesis y la obstrucción del tracto urinario. La nefrogénesis defectuosa puede provocar agenesia renal y también displasia renal. La displasia renal puede resultar de una interacción defectuosa entre el brote ureteral y el mesénquima metanéfrico, de defectos intrínsecos de diferenciación, así como de obstrucción. Las anomalías congénitas del riñón y del tracto urinario incluyen agenesia renal, riñón multiquístico, displasia renal, anomalías de duplicación renal, obstrucción de la unión pieloureteral, megauréteres, válvulas uretrales posteriores y reflujo vesicoureteral. CAKUT suele producir displasia renal y se ha propuesto una posible causa genética, ya que se han identificado anomalías renales en familiares cercanos de 10% de los pacientes con CAKUT.9,10 Se han considerado numerosas mutaciones genéticas, como alteraciones en HNF1β, PAX2 y señalización de RET, pero no se ha identificado un patrón claro de herencia,14,15
Evaluación y diagnóstico
Como se mencionó, la ecografía prenatal detecta entre el 84,4 y el 97% de todas las malformaciones del tracto urinario fetal, y estas anomalías pueden identificarse desde las 12–14 semanas de gestación.1,2 Muchas de estas anomalías pueden diagnosticarse mediante ecografía, y la RM fetal aporta mayor clarificación. Además, muchas de estas afecciones genitourinarias presentan solapamiento en la imagen inicial.
Ultrasonografía prenatal
La ultrasonografía prenatal se emplea ahora de forma sistemática como cribado y vigilancia del crecimiento y desarrollo fetal en el segundo trimestre. La detección de anomalías urológicas antes del nacimiento es relativamente sensible, con hasta el 88% de las anomalías del tracto urinario diagnosticadas prenatalmente.16 Generalmente, los riñones no se visualizan por ecografía hasta la semana 15 de gestación (Figura 3). Un diámetro anteroposterior de la pelvis renal (APRPD) menor de 4 mm entre las semanas 16–27 de gestación y menor de 7 mm a partir de la semana 28 se consideran dentro del rango fisiológico normal.17 Si los uréteres no están dilatados, no deberían ser visibles en la ecografía prenatal. La vejiga suele observarse a las 10 semanas de gestación, pero debe visualizarse a las 12 semanas. El grosor normal de la pared vesical no supera los 3 mm.2
Figura 3 Ecografía prenatal que muestra riñón derecho e izquierdo normales.
RM fetal
La RM fetal se utiliza con frecuencia para aportar más detalle anatómico de anomalías congénitas inicialmente detectadas por ecografía. En un estudio, la sensibilidad diagnóstica global fue del 96% para la RM fetal frente al 58% para la ecografía.18 La RM fetal también aporta información diagnóstica adicional, especialmente para la evaluación de la anatomía ureteral. Entre sus ventajas se incluyen mayor contraste tisular, mejor evaluación morfológica, detección de anomalías adicionales y estimación de la función renal fetal.19 A medida que la imagen fetal avanza, técnicas como la cistoscopia virtual 3D se utilizan para dilucidar mejor anomalías urogenitales.20
En RM, la vejiga se observa como una estructura redondeada/ovoide con señal homogénea alta y una pared de grosor uniforme y liso. Los riñones se localizan paravertebrales en el abdomen superior y se observan como estructuras ovoides con señal intermedia en secuencias ponderadas en T2. Deben evaluarse en cuanto a tamaño, cambios displásicos, pieloectasia y ureterectasia.
Anomalías prenatales
Dilatación del tracto urinario superior
La hidronefrosis se detecta en 1–5% de las ecografías prenatales.21 La dilatación del tracto urinario superior debe considerarse junto con otros hallazgos, como el aspecto del parénquima renal, el volumen del líquido amniótico, la dilatación ureteral o el aspecto de la vejiga y la uretra fetales.22,23 Las tres anomalías más frecuentes relacionadas con la dilatación del tracto superior prenatal son alteraciones de la unión pieloureteral (UPJ), de la unión ureterovesical (UVJ) y el reflujo vesicoureteral (VUR).
Sistemas de graduación de la hidronefrosis
Para delimitar mejor el grado de hidronefrosis, se han propuesto distintos sistemas de graduación. Los principales sistemas utilizados son el de la Society for Fetal Urology (SFU)24 y el de urinary tract dilation (UTD).25 El APRPD también se ha utilizado como complemento de estos sistemas.26
Sistema de graduación SFU
En el sistema SFU, la graduación de la hidronefrosis se basa en el grado de dilatación de la pelvis renal y los cálices. La (Figura 4) ilustra el sistema de la SFU. Es importante destacar que la SFU no se concibió originalmente para la evaluación antenatal y que no se ha adoptado ampliamente fuera de la urología pediátrica.
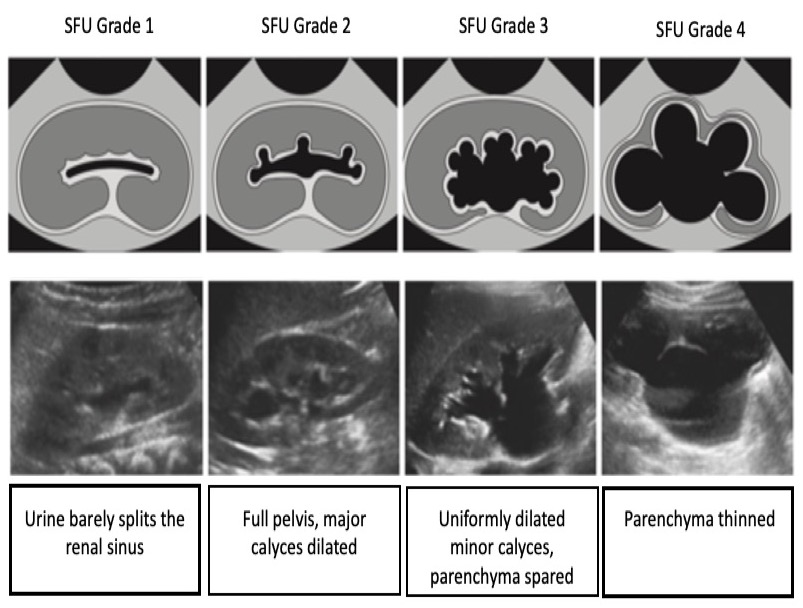
Figura 4 Sistema de graduación de la hidronefrosis de la SFU.
Sistema de graduación UTD
Este sistema se basa en seis categorías que se identifican de forma rutinaria por ecografía: diámetro anteroposterior de la pelvis renal (APRPD), dilatación de los cálices renales, grosor del parénquima renal, aspecto del parénquima renal, anomalías vesicales y anomalías ureterales. Este sistema también se estratifica por edad gestacional. En la hidronefrosis prenatal, puede clasificarse como UTD A1 (riesgo bajo) si existe dilatación central o de cálices y el resto de los parámetros mencionados son normales. UTD A2–3 se utiliza cuando existe mayor riesgo de uropatías posnatales, agrupando en una sola categoría los grupos de riesgo intermedio (A2) y alto (A3) (Figura 5).
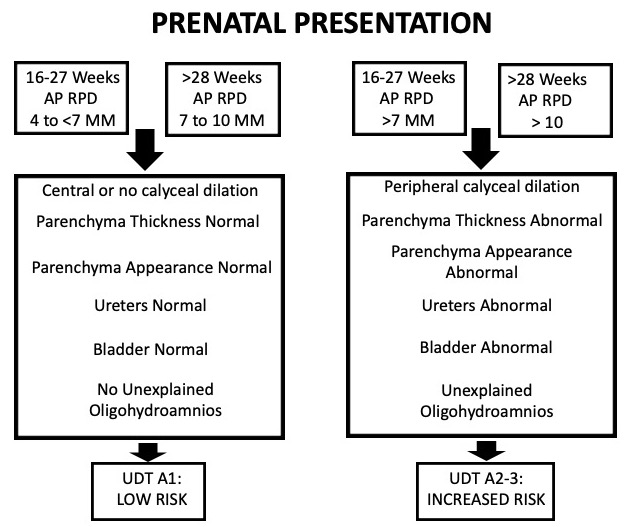
Figura 5 Tabla que muestra la clasificación UTD cuando la hidronefrosis se presenta prenatalmente.
Hidronefrosis/Unión pieloureteral
En la mayoría de los casos de hidronefrosis antenatal aislada, este hallazgo sugiere un proceso transitorio y no patológico.11 La obstrucción de la UPJ puede sugerirse por el grado de hidronefrosis. El riesgo de patología posnatal aumenta significativamente con la severidad de la hidronefrosis prenatal. Se ha reportado un riesgo de patología posnatal del 11,9%, 45,1% y 88,3% para hidronefrosis prenatal leve, moderada y grave, respectivamente.11 La obstrucción de la UVJ también puede sospecharse cuando se observa hidronefrosis junto con dilatación ureteral.
La necesidad de más imágenes prenatales puede basarse en el diámetro anteroposterior de la pelvis. En un estudio, ningún lactante con APRPD <7 mm en el segundo trimestre requirió intervención posnatal ni desarrolló insuficiencia renal.27 Otro estudio sugirió que una dilatación de la pelvis renal de 15 mm era un umbral significativo para sospechar obstrucción en 80% de los fetos, con sensibilidad y especificidad del 73% y 82%, respectivamente.28 Además, se encontró que un punto de corte de 18 mm para la dilatación pélvica fetal tenía una razón de momios diagnóstica de 97,7 para identificar a los lactantes que requirieron pieloplastia.29
Reflujo vesicoureteral
En el informe de 2010 del panel de Guías Pediátricas de VUR, los autores señalaron que de 6.579 lactantes con hidronefrosis prenatal, el VUR estuvo presente en 4.756 (72%).30 A pesar de ello, la imagen prenatal tiene baja sensibilidad para detectar VUR. Incluso si el diámetro de la pelvis renal (RPD) aumenta en la ecografía prenatal, dicho incremento no predice VUR.31,32 Otro estudio identificó que el cambio en la forma/tamaño de la pelvis renal y del uréter en la imagen prenatal ocurrió solo en 17,2% de los fetos que posteriormente fueron diagnosticados de VUR posnatal, por lo que es un predictor deficiente de reflujo urinario.32
Obstrucción del tracto urinario inferior
La obstrucción del tracto urinario inferior (LUTO) comprende un grupo de anomalías urogenitales que provocan obstrucción uretral. Su presentación antenatal es similar y, por lo general, incluye una vejiga distendida e hidroureteronefrosis.
Identificar la LUTO es importante por su posible impacto a largo plazo en la función renal y en el desarrollo pulmonar prenatal, especialmente si existe oligohidramnios asociado. Los hallazgos ecográficos y características del feto que pueden predecir LUTO son megacistis grave (definida como volumen vesical >35 mm3), dilatación ureteral bilateral, oligo/anhidramnios y sexo fetal masculino.33 La RM puede ayudar a evaluar el parénquima renal, el tamaño renal, la cantidad de líquido amniótico y el grado de distensión ureteral y vesical.34 Además, la medición del área parenquimatosa puede correlacionarse con la función renal posnatal; un valor de 8 cm2 o mayor en el tercer trimestre es el mejor predictor del desarrollo de enfermedad renal terminal.35
Válvulas uretrales posteriores
Las válvulas uretrales posteriores (PUV) pueden manifestarse como hidronefrosis, hidroureteronefrosis o megacistis en la ecografía prenatal. Sin embargo, el signo ecográfico característico de PUV es la vejiga con forma de “cerradura” con dilatación leve de la uretra proximal (Figura 6). Los hallazgos ecográficos prenatales más predictivos de PUV incluyen dilatación de la uretra posterior (el hallazgo ecográfico más discriminatorio), pared vesical engrosada y anhidramnios.32
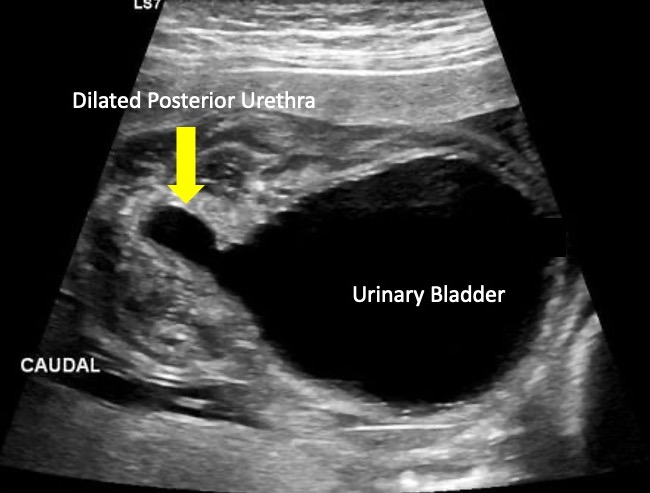
Figura 6 Imagen ecográfica que muestra el signo de “cerradura” típico de las válvulas uretrales posteriores.
Síndrome de Prune Belly
Dado que la gravedad del PBS es variable, su diagnóstico antenatal es difícil. En general, los riñones aparecen hiperecogénicos y displásicos, con dilatación de los uréteres y engrosamiento de la pared vesical. También pueden observarse anhidramnios y compresión del contenido abdominal y torácico.36,37 Cuanto más precoz es la sospecha de PBS en la imagen prenatal, peor es el pronóstico. La RM puede delimitar mejor el alcance de las anomalías genitourinarias, incluyendo hipoplasia/displasia renal, dilatación ureteral, megacistis, dilatación de la uretra prostática e hipoplasia prostática.34
Atresia uretral y anomalías uretrales anteriores
La atresia uretral es una de las entidades bajo el paraguas de las anomalías uretrales anteriores, que también incluyen las válvulas uretrales anteriores y el divertículo uretral. Son poco frecuentes, pero pueden sospecharse ante la presencia de hidroureteronefrosis, vejiga dilatada y engrosada, oligohidramnios, así como uretra dilatada en la imagen prenatal. Las anomalías congénitas del riñón y del tracto urinario concomitantes aumentan la probabilidad de desarrollar enfermedad renal crónica.38
Riñón displásico multiquístico
La enfermedad renal quística prenatal es difícil de identificar y distinguir solo con ecografía. A menudo puede resultar complicado diferenciar un MCDK de una obstrucción grave de la UPJ en la ecografía prenatal. La RM fetal se ha utilizado para complementar los hallazgos ecográficos iniciales sugerentes de MCDK. Clásicamente, el riñón está completamente reemplazado por quistes de diferentes tamaños que no se comunican (Figura 7). Por lo general, no se observa una pelvis renal normal debido a la falta de ramificación tubular, lo que puede ser un hallazgo característico de MCDK.39 Además de MCDK, los quistes renales en la imagen prenatal también pueden indicar displasia/enfermedad quística renal.
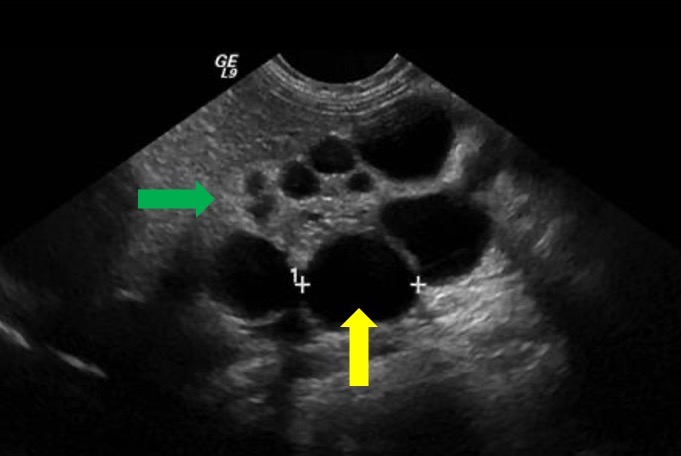
Figura 7 Imagen ecográfica que muestra MCDK. La flecha amarilla indica un quiste renal. La flecha verde indica parénquima renal adelgazado y ecogénico compatible con displasia renal.
Anomalías de duplicación
La exactitud diagnóstica de la ecografía prenatal para identificar sistemas colectores dobles aislados es de hasta 90%.40 Cuando existe duplicación ureteral, un ureterocele puede asociarse con la unidad superior. Aunque la mayoría de las anomalías de duplicación pueden diagnosticarse con ecografía (Figura 8), la RM puede ser útil en casos concretos.41 Un estudio reportó que en pacientes con diagnóstico prenatal de sistema colector doble aislado, el ureterocele y el megauréter se asociaron en 70,7% y 36,6% de los casos, respectivamente.40
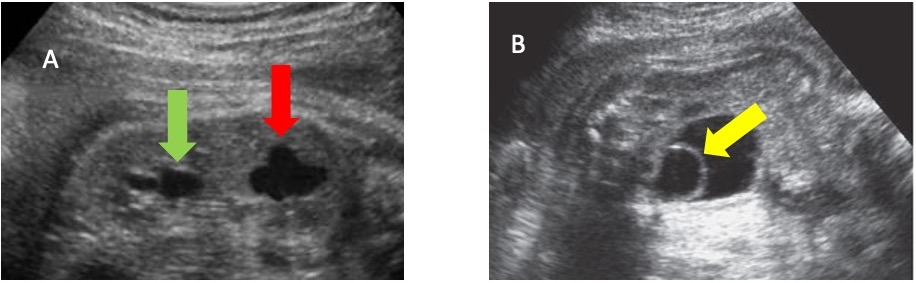
Figura 8 A. Ecografía que muestra riñón duplicado con hidronefrosis en el polo inferior (flecha verde) y en el polo superior (flecha roja). B. Ecografía que muestra vejiga con ureterocele (flecha amarilla) en su interior.
Extrofia vesical, cloaca y seno urogenital
La extrofia vesical y la extrofia cloacal también pueden observarse en la imagen prenatal. La diferenciación correcta entre ambas puede lograrse identificando la localización de la inserción del cordón umbilical en relación con el defecto de la pared abdominal (superior, medio o inferior), lo que puede realizarse con ecografía fetal o RM.42 Si el defecto de la pared abdominal se observa por debajo del cordón y no se visualiza una vejiga completa, el diagnóstico probable es extrofia vesical. Si el defecto se sitúa al nivel del cordón o por encima de él, es más probable un onfalocele.
En RM, la extrofia vesical se visualiza como una masa infraumbilical de la pared abdominal, con inserción baja del cordón umbilical. Dado que los riñones y uréteres suelen ser normales, la cantidad de líquido amniótico será normal. También puede observarse diástasis de la sínfisis púbica.
Los hallazgos ecográficos prenatales sugestivos de cloaca clásica incluyen uno o dos quistes contiguos en la pelvis fetal femenina, ascitis transitoria y posición elevada del recto con dilatación proximal y estrechamiento distal romo o en pico, así como hidronefrosis y megacistis. Las características más específicas que apoyan el diagnóstico de malformación cloacal son un colon dilatado lleno de líquido con enterolitos y la presencia de meconio en el tracto urinario. Los hallazgos en RM fetal sugestivos de extrofia cloacal incluyen vejiga ausente con volumen normal de líquido amniótico, contorno pélvico anterior prominente, ausencia de meconio en el intestino y onfalocele.43 La RM fetal también ayuda a identificar el número y la localización de los orificios perineales.
En el seno urogenital persistente, la ecografía fetal puede mostrar hidrometrocolpos como una lesión oblonga, anecoica y tabicada situada detrás de la vejiga fetal.44 En RM, un seno urogenital se presenta con calibre normal del recto y colon, señal de meconio normal y orificio anal perineal en su localización fisiológica. Existe un canal urogenital común con un orificio en el periné donde debería situarse la uretra.45
Opciones de tratamiento
Desde la perspectiva urológica, la mayoría de las intervenciones prenatales se realizan por obstrucción del tracto urinario inferior. Estas intervenciones buscan aliviar la obstrucción para maximizar la función renal y normalizar el volumen de líquido amniótico, evitando el daño asociado al oligohidramnios.
Existen dos intervenciones ampliamente aceptadas para LUTO prenatal: la colocación de una derivación vesicoamniótica (VAS) y la cistoscopia fetal. La intervención fetal se centra en descomprimir el tracto urogenital superior para prevenir daño progresivo del parénquima renal y restaurar el volumen de líquido amniótico para el desarrollo pulmonar. Antes de considerar cualquier intervención prenatal, es necesaria una evaluación de riesgo que debe comenzar con dos vesicocentesis consecutivas.46,47,48,49 En conjunto con el aspecto ecográfico de los riñones, el uso de los criterios de Glick puede emplearse como factor pronóstico y también para guiar la intervención fetal (Tabla 1).50 Es importante señalar que esta estratificación pronóstica no se ajusta por edad gestacional y no refleja necesariamente la función posnatal.48
Tabla 1 Criterios pronósticos para el feto con uropatía obstructiva
| Función prevista | Estado del líquido amniótico al momento de la presentación inicial | Aspecto ecográfico de los riñones | Orina fetal – sodio (mEq/mL) | Orina fetal – cloruro (mEq/mL) | Orina fetal – osmolaridad (mOsm) | Diuresis fetal (mL/hora) |
|---|---|---|---|---|---|---|
| Mala | Moderadamente a severamente disminuido | Ecogénico a quístico | > 100 | > 90 | > 210 | < 2 |
| Buena | Normal a moderadamente disminuido | Normal a ecogénico | < 100 | < 90 | < 210 | > 2 |
Derivación vesicoamniótica
La derivación vesicoamniótica se realiza con anestesia local bajo guía ecográfica bidimensional en tiempo real.51,52 Bajo técnica estéril, se inserta percutáneamente un catéter vesicoamniótico, con colocación óptima del extremo distal en la vejiga fetal y del extremo proximal en la cavidad amniótica (Figura 9).52 Los modelos iniciales describen el uso de catéteres con doble “pigtail”, mientras que estudios más recientes han explorado catéteres de doble “basket” como alternativa. Los resultados son variables, con tasas de supervivencia entre 41% y 80%, dependiendo de la selección de pacientes,53,54 El ensayo aleatorizado PLUTO más reciente enfrentó dificultades importantes de reclutamiento y se suspendió de forma prematura, pese a intentar aportar mayor claridad sobre la utilidad de la derivación vesicoamniótica.52 Este estudio, junto con pequeños análisis retrospectivos y evidencia anecdótica, ha mostrado mejoría en la supervivencia perinatal,53,54,55 aunque los desenlaces a largo plazo siguen sin estar claros. Todos los estudios subrayan la necesidad de ensayos prospectivos y aleatorizados adicionales para esta intervención.
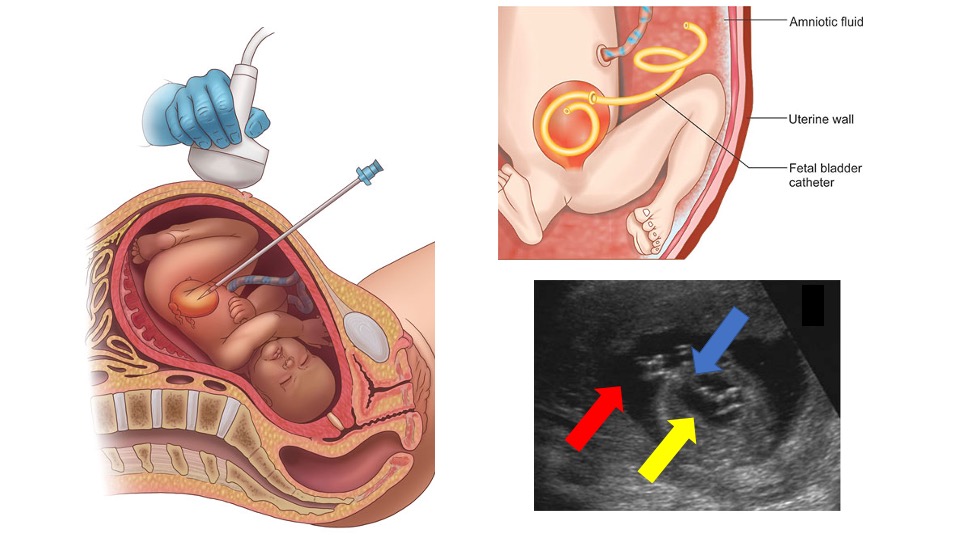
Figura 9 Representación de la colocación de una derivación vesicoamniótica bajo guía ecográfica, colocación final y ecografía mostrando la derivación (flecha azul) dentro de la vejiga urinaria (flecha amarilla) y del espacio amniótico (flecha roja).
Cistoscopia
La cistoscopia fetal in útero se describió por primera vez en 1995.56 Aunque técnicamente más desafiante que la derivación vesicoamniótica, permite la visualización directa, el establecimiento de un diagnóstico específico y un posible tratamiento en el mismo acto. Se utiliza un trócar de mayor calibre que el de la VAS y un fetoscopio de 1,0–1,3 mm en una vaina curva con al menos 70° de campo de visión.57 Una de las anomalías más frecuentes observadas en la cistoscopia fetal son las PUV. Si se observa una estructura membranosa y se diagnostican PUV, pueden emplearse fulguración con láser, hidroablación o perforación con guía como métodos de intervención inmediata (Figura 10).58 La estenosis uretral es un diagnóstico cistoscópico intraoperatorio que puede tratarse con éxito con la colocación de un stent uretral sobre una guía.57 Si se diagnostica atresia uretral, no se intenta perforar la uretra y se completa una VAS.59
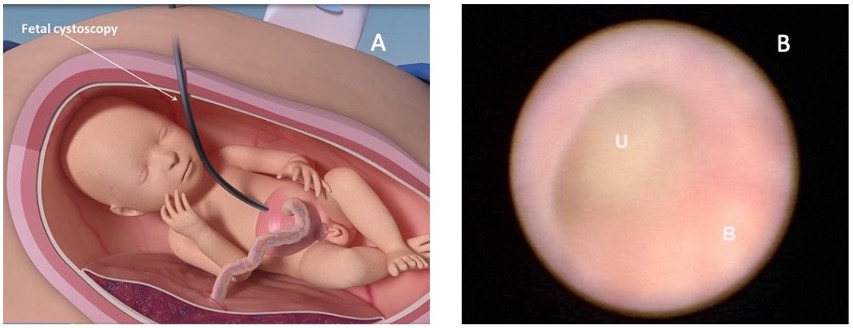
Figura 10 La imagen A muestra cómo se realiza la cistoscopia fetal. La imagen B muestra una imagen cistoscópica fetal dentro de la vejiga (B) y el punto de obstrucción en la uretra (U). Imagen obtenida de: Prenatal regenerative fetoscopic interventions for congenital anomalies. SBRE 2020.
Un video que muestra la intervención fetal para LUTO está disponible (Video 3). Además, está disponible un pódcast que revisa las intervenciones prenatales para LUTO.
Video 3. Representación de la intervención fetal para LUTO.
Complicaciones
Las intervenciones prenatales para LUTO no están exentas de riesgos y posibles complicaciones. Un riesgo asociado tanto a la VAS como a la cistoscopia fetal es la rotura prematura de membranas, que puede conducir a parto pretérmino.60 Entre las complicaciones de la VAS se incluyen el riesgo de obstrucción y desalojo del shunt, ambos con potencial de producir muerte fetal.55 También se han descrito casos de mala colocación del shunt en órganos intraabdominales adyacentes.61 La cistoscopia fetal con ablación láser se ha asociado con una tasa de fístula del 10%, que varió de manera estadísticamente significativa según la edad gestacional, el uso de vainas curvas o semicorvas, el tipo y los parámetros del láser, así como la experiencia del operador.62
Conclusiones
Las anomalías urológicas se detectan con frecuencia en la encuesta anatómica fetal integral de rutina del segundo trimestre. La anomalía más común identificada es la hidronefrosis prenatal, que típicamente es transitoria. Sin embargo, otras anomalías genitourinarias detectadas prenatalmente pueden tener peores desenlaces. En particular, la obstrucción del tracto urinario inferior puede producir una marcada morbilidad y mortalidad fetal. En ocasiones, el tratamiento prenatal puede estar indicado para preservar la función renal y prevenir la hipoplasia pulmonar.
Puntos clave
- La hidronefrosis antenatal se observa en 1–5% de todos los embarazos y constituye el diagnóstico prenatal más frecuente.
- Un diámetro anteroposterior de la pelvis renal (APRPD) menor de 4 mm entre las semanas 16–27 de gestación y menor de 7 mm a partir de la semana 28 se consideran dentro del rango fisiológico.
- Existen muchas afecciones y anomalías urogenitales que se detectan mediante imagen prenatal. Muchas pueden diagnosticarse por ecografía, y la RM fetal aporta mayor clarificación.
- La obstrucción del tracto urinario inferior sin intervención puede conllevar marcada morbilidad y mortalidad fetal. Aunque existen varias modalidades de tratamiento, se requieren estudios de gran tamaño para determinar su eficacia a la hora de preservar la función renal y prevenir la hipoplasia pulmonar.
Lecturas sugeridas
- Lee RS, Cendron M, Kinnamon DD, Nguyen HT. Antenatal Hydronephrosis as a Predictor of Postnatal Outcome: A Meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/peds.2006-0120.
- Mallik M, Watson AR. Antenatally detected urinary tract abnormalities: more detection but less action. Pediatr Nephrol 2008; 23 (6): 897–904. DOI: 10.1007/s00467-008-0746-9.
- Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: Introduction to the system used by the society for fetal urology. Pediatr Radiol 1993; 23 (6): 478–480. DOI: 10.1007/bf02012459.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B, et al.. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 0 (6): 82–98. DOI: 10.3410/f.725257762.793506733.
- Haeri S. Fetal Lower Urinary Tract Obstruction (LUTO): a practical review for providers. Matern Health Neonatol Perinatol 0AD; 1 (1). DOI: 10.1186/s40748-015-0026-1.
Referencias
- Bronshtein M, Yoffe N, Brandes JM, Blumenfeld Z. First and early second-trimester diagnosis of fetal urinary tract anomalies using transvaginal sonography. Prenat Diagn 1990; 10 (10): 653–666. DOI: 10.1002/pd.1970101005.
- Corteville JE, Gray DL, Crane JP. Congenital hydronephrosis: Correlation of fetal ultrasonographic findings with infant outcome. Am J Obstet Gynecol 1991; 165 (2): 384–388. DOI: 10.1016/0002-9378(91)90099-d.
- Mallik M, Watson AR. Antenatally detected urinary tract abnormalities: more detection but less action. Pediatr Nephrol 2008; 23 (6): 897–904. DOI: 10.1007/s00467-008-0746-9.
- Alcaraz A, Vinaixa F, Tejedo-Mateu A, Forés MM, Gotzens V, Mestres CA, et al.. Obstruction and Recanalization of the Ureter during Embryonic Development. J Urol 1991; 145 (2): 410–416. DOI: 10.1016/s0022-5347(17)38354-4.
- Saphier CJ, Gaddipati S, Applewhite LE, Berkowitz RL. Prenatal Diagnosis And Management Of Abnormalities In The Urologic System. Clin Perinatol 2000; 27 (4): 921–945. DOI: 10.1016/s0095-5108(05)70058-0.
- Glibert WM, Moore TR, Brace RA. Amniotic fluid volume dynamics. Fetal Matern Med Rev 1991; 3 (2): 89–104. DOI: 10.1017/s0965539500000486.
- Rabinowitz R, Peters MT, Vyas S, Campbell S, Nicolaides KH. Measurement of fetal urine production in normal pregnancy by real-time ultrasonography. Am J Obstet Gynecol 1989; 161 (5): 1264–1266. DOI: 10.1016/0002-9378(89)90679-0.
- Pitkin R. Potter EL. Bilateral absence of ureters and kidneys: a report of 50 cases. Obstet Gynecol 1965;25:3–12. Obstet Gynecol 0AD; 101 (6): 1159. DOI: 10.1016/s0029-7844(02)02394-3.
- Renkema KY, Winyard PJ, Skovorodkin IN, Levtchenko E, Hindryckx A, Jeanpierre C, et al.. Congenital anomalies of the kidney and urinary tract (CAKUT). Lijec Vjesn 2011; 144 (Supp 1): 843–851. DOI: 10.26800/lv-144-supl1-26.
- Hogan J, Dourthe M-E, Blondiaux E, Jouannic J-M, Garel C, Ulinski T. Renal outcome in children with antenatal diagnosis of severe CAKUT. Pediatr Nephrol 2012; 27 (3): 497–502. DOI: 10.1007/s00467-011-2068-6.
- Lee RS, Cendron M, Kinnamon DD, Nguyen HT. Antenatal Hydronephrosis as a Predictor of Postnatal Outcome: A Meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/peds.2006-0120.
- Shih VE, Laframboise R, Mandell R, Pichette J. Neonatal form of the hyperornithinaemia, hyperammonaemia, and homocitrullinuria (HHH) syndrome and prenatal diagnosis. Prenat Diagn 0AD; 12 (9): 717–723. DOI: 10.1002/pd.1970120905.
- Harrison MR, Golbus MS, Filly RA, Nakayama DK, Callen PW, Lorimier AAde, et al.. Management of the fetus with congenital hydronephrosis. J Pediatr Surg 1982; 17 (6): 728–742. DOI: 10.1016/s0022-3468(82)80437-5.
- Paces-Fessy M, Fabre M, Lesaulnier C, Cereghini S. Hnf1b and Pax2 cooperate to control different pathways in kidney and ureter morphogenesis. Hum Mol Genet 2012; 21 (14): 3143–3155. DOI: 10.1093/hmg/dds141.
- Allison SJ. Ret signaling reveals insights into the pathogenesis of CAKUT. Nat Rev Nephrol 2012; 8 (8): 432–432. DOI: 10.1038/nrneph.2012.119.
- Clayton DB, Brock JW. Prenatal Ultrasound and Urological Anomalies. Pediatr Clin North Am 0AD; 59 (4): 739–756. DOI: 10.1016/j.pcl.2012.05.003.
- Grignon A, Filion R, Filiatrault D, Robitaille P, Homsy Y, Boutin H, et al.. Urinary tract dilatation in utero: classification and clinical applications. Radiology 1986; 160 (3): 645–647. DOI: 10.1148/radiology.160.3.3526402.
- Kajbafzadeh A-M, Payabvash S, Sadeghi Z, Elmi A, Jamal A, Hantoshzadeh Z, et al.. Comparison of magnetic resonance urography with ultrasound studies in detection of fetal urogenital anomalies. J Pediatr Urol 2008; 4 (1): 32–39. DOI: 10.1016/j.jpurol.2007.07.005.
- Chalouhi GE, Millischer A-É, Mahallati H, Siauve N, Melbourne A, Grevent D, et al.. The use of fetal MRI for renal and urogenital tract anomalies. Prenat Diagn 2020; 40 (1): 100–109. DOI: 10.1002/pd.5610.
- Werner H, Lopes J, Ribeiro G, Jésus NR, Santos GR, Alexandria HAF, et al.. Three-dimensional virtual cystoscopy: Noninvasive approach for the assessment of urinary tract in fetuses with lower urinary tract obstruction. Prenat Diagn 2020; 37 (13): 1350–1352. DOI: 10.1002/pd.5188.
- Swenson DW, Darge K, Ziniel SI, Chow JS. Characterizing upper urinary tract dilation on ultrasound: a survey of North American pediatric radiologists’ practices. Pediatr Radiol 2015; 45 (5): 686–694. DOI: 10.1007/s00247-014-3221-8.
- Mure P-Y, Mouriquand P. Upper urinary tract dilatation: Prenatal diagnosis, management and outcome. Semin Fetal Neonatal Med 2008; 13 (3): 152–163. DOI: 10.1016/j.siny.2007.09.010.
- Mouriquand PDE, Whitten M, Pracros J-P. Pathophysiology, diagnosis and management of prenatal upper tract dilatation. Prenat Diagn 2001; 21 (11): 942–951. DOI: 10.1002/pd.207.
- Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: Introduction to the system used by the society for fetal urology. Pediatr Radiol 1993; 23 (6): 478–480. DOI: 10.1007/bf02012459.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B, et al.. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 0 (6): 82–98. DOI: 10.3410/f.725257762.793506733.
- Onen A. Grading of Hydronephrosis: An Ongoing Challenge. Front Pediatr 0AD; 8 (458). DOI: 10.3389/fped.2020.00458.
- Roo R de, Voskamp BJ, Kleinrouweler CE, Mol BW, Pajkrt E, Bouts AHM. Determination of threshold value for follow-up of isolated antenatal hydronephrosis detected in the second trimester. J Pediatr Urol 2017; 13 (6): 594–601. DOI: 10.1016/j.jpurol.2017.06.001.
- Coplen DE, Austin PF, Yan Y, Blanco VM, Dicke JM. The Magnitude of Fetal Renal Pelvic Dilatation can Identify Obstructive Postnatal Hydronephrosis, and Direct Postnatal Evaluation and Management. Yearbook of Urology 2006; 2007 (2): 237–238. DOI: 10.1016/s0084-4071(08)70187-8.
- Dias CS, Silva JM, Pereira AK, Marino VS, Silva LA, Coelho AM, et al.. Faculty Opinions recommendation of Diagnostic accuracy of renal pelvic dilatation for detecting surgically managed ureteropelvic junction obstruction. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2013; 90 (2): 61–66. DOI: 10.3410/f.718084698.793482695.
- Skoog SJ, Peters CA, Arant BS Jr., Copp HL, Elder JS, Hudson RG, et al.. Pediatric Vesicoureteral Reflux Guidelines Panel Summary Report: Clinical Practice Guidelines for Screening Siblings of Children With Vesicoureteral Reflux and Neonates/Infants With Prenatal Hydronephrosis. Yearbook of Urology 2010; 2011 (3): 205–207. DOI: 10.1016/j.yuro.2010.12.022.
- Dias CS, Bouzada MCF, Pereira AK, Barros PS, Chaves ACL, Amaro AP, et al.. Predictive Factors for Vesicoureteral Reflux and Prenatally Diagnosed Renal Pelvic Dilatation. J Urol 2009; 182 (5): 2440–2445. DOI: 10.1016/j.juro.2009.07.058.
- Chitrit Y, Bourdon M, Korb D, Grapin-Dagorno C, Joinau-Zoulovits F, Vuillard E, et al.. Posterior urethral valves and vesicoureteral reflux: can prenatal ultrasonography distinguish between these two conditions in male fetuses? Prenat Diagn 2016; 36 (9): 831–837. DOI: 10.1002/pd.4868.
- Fontanella F, Duin LK, Scheltema PN Adama van, Cohen-Overbeek TE, Pajkrt E, Bekker M, et al.. Prenatal diagnosis of LUTO: improving diagnostic accuracy. Ultrasound Obstet Gynecol 2018; 52 (6): 739–743. DOI: 10.1002/uog.18990.
- Chauvin NA, Epelman M, Victoria T, Johnson AM. Complex Genitourinary Abnormalities on Fetal MRI: Imaging Findings and Approach to Diagnosis. AJR Am J Roentgenol 2012; 199 (2): W222–w231. DOI: 10.2214/ajr.11.7761.
- Moscardi PRM, Katsoufis CP, Jahromi M, Blachman-Braun R, DeFreitas MJ, Kozakowski K, et al.. Re: Prenatal Renal Parenchymal Area as a Predictor of Early End-Stage Renal Disease in Children with Vesicoamniotic Shunting for Lower Urinary Tract Obstruction. J Urol 2018; 204 (5): 1083–1083. DOI: 10.1097/ju.0000000000001254.
- Alkhamis WH, Abdulghani SH, Altaki A. Challenging diagnosis of prune belly syndrome antenatally: a case report. J Med Case Rep 2019; 13 (1): 98. DOI: 10.1186/s13256-019-2120-x.
- Ome M, Wangnapi R, Hamura N, Umbers AJ, Siba P, Laman M, et al.. A case of ultrasound-guided prenatal diagnosis of prune belly syndrome in Papua New Guinea – implications for management. BMC Pediatr 0AD; 13 (1). DOI: 10.1186/1471-2431-13-70.
- Perlman S, Borovitz Y, Ben-Meir D, Hazan Y, Nagar R, Bardin R, et al.. Prenatal diagnosis and postnatal outcome of anterior urethral anomalies. Prenat Diagn 2020; 40 (2): 191–196. DOI: 10.1002/pd.5582.
- Meyers ML, Treece AL, Brown BP, Vemulakonda VM. Imaging of fetal cystic kidney disease: multicystic dysplastic kidney versus renal cystic dysplasia. Pediatr Radiol 2020; 50 (13): 1921–1933. DOI: 10.1007/s00247-020-04755-5.
- Bascietto F, Khalil A, Rizzo G, Makatsariya A, Buca D, Silvi C, et al.. Prenatal imaging features and postnatal outcomes of isolated fetal duplex renal collecting system: A systematic review and meta-analysis. Prenat Diagn 2020; 40 (4): 424–431. DOI: 10.1002/pd.5622.
- Sozubir S, Lorenzo AJ, Twickler DM, Baker LA, Ewalt DH. Prenatal diagnosis of a prolapsed ureterocele with magnetic resonance imaging. Urology 2003; 62 (1): 144. DOI: 10.1016/s0090-4295(03)00152-3.
- Weiss DA, Oliver ER, Borer JG, Kryger JV, Roth EB, Groth TW, et al.. Key anatomic findings on fetal ultrasound and MRI in the prenatal diagnosis of bladder and cloacal exstrophy. J Pediatr Urol 2020; 16 (5): 665–671. DOI: 10.1016/j.jpurol.2020.07.024.
- Clements MB, Chalmers DJ, Meyers ML, Vemulakonda VM. Prenatal Diagnosis of Cloacal Exstrophy: A Case Report and Review of the Literature. Urology 2014; 83 (5): 1162–1164. DOI: 10.1016/j.urology.2013.10.050.
- Giuliani M, Gui B, Laino M, Zecchi V, Rodolfino E, Ninivaggi V, et al.. Persistent Urogenital Sinus: Diagnostic Imaging for Clinical Management. What Does the Radiologist Need to Know? Am J Perinatol 2016; 33 (05): 425–432. DOI: 10.1055/s-0035-1565996.
- Capito C, Belarbi N, Paye Jaouen A, Leger J, Carel J-C, Oury J-F, et al.. Prenatal pelvic MRI: Additional clues for assessment of urogenital obstructive anomalies. J Pediatr Urol 2014; 10 (1): 162–166. DOI: 10.1016/j.jpurol.2013.07.020.
- Craparo FJ, Rustico M, Tassis B, Coviello D, Nicolini U. Fetal Serum \ensuremathβ2-Microglobulin Before and After Bladder Shunting: A 2-Step Approach to Evaluate Fetuses With Lower Urinary Tract Obstruction. J Urol 2007; 178 (6): 2576–2579. DOI: 10.1016/j.juro.2007.08.052.
- FISK NM, RONDEROS-DUMIT D, TANNIRANDORN Y, NICOLINI U, TALBERT D, RODECK CH. Normal amniotic pressure throughout gestation. Bjog 1992; 99 (1): 18–22. DOI: 10.1111/j.1471-0528.1992.tb14385.x.
- Nicolini U, Tannirandorn Y, Vaughan J, Fisk NM, Nicolaidis P, Rodeck CH. Further predictors of renal dysplasia in fetal obstructive uropathy: Bladder pressure and biochemistry of ‘fresh’ urine. Prenat Diagn 1991; 11 (3): 159–166. DOI: 10.1002/pd.1970110305.
- Johnson MP, Freedman AL. Fetal uropathy. Curr Opin Obstet Gynecol 1999. 0AD; 1 (2): 85–94. DOI: 10.1097/00001703-199904000-00011.
- Glick PL, Harrison MR, Golbus MS, Adzick NS, Filly RA, Callen PW, et al.. Management of the Fetus With Congenital Hydronephrosis II: Prognostic Criteria and Selection for Treatment. J Urol 1985; 135 (2): 444–445. DOI: 10.1016/s0022-5347(17)45673-4.
- Kilby MD, Morris RK. Fetal therapy for the treatment of congenital bladder neck obstruction. Nat Rev Urol 2014; 11 (7): 412–419. DOI: 10.1038/nrurol.2014.132.
- Morris RK, Malin GL, Quinlan-Jones E, Middleton LJ, Diwakar L, Hemming K, et al.. The Percutaneous shunting in Lower Urinary Tract Obstruction (PLUTO) study and randomised controlled trial: evaluation of the effectiveness, cost-effectiveness and acceptability of percutaneous vesicoamniotic shunting for lower urinary tract obstruction. Health Technol Assess 2013; 17 (59): –232. DOI: 10.3310/hta17590.
- Manning FA, Harrison MR, Rodeck C, International Fetal Medicine of the, Surgery Society M. Catheter Shunts for Fetal Hydronephrosis and Hydrocephalus. N Engl J Med 1986; 315 (5): 336–340. DOI: 10.1056/nejm198607313150532.
- Won H-S, Kim S-K, Shim J-Y, Ryang Lee P, Kim A. Vesicoamniotic shunting using a double-basket catheter appears effective in treating fetal bladder outlet obstruction. Acta Obstet Gynecol Scand 2006; 85 (7): 879–884. DOI: 10.1080/00016340500449923.
- Morris RK, Malin GL, Quinlan-Jones E, Middleton LJ, Hemming K, Burke D, et al.. Faculty of 1000 evaluation for Percutaneous vesicoamniotic shunting versus conservative management for fetal lower urinary tract obstruction (PLUTO): a randomised trial. F1000 - Post-Publication Peer Review of the Biomedical Literature 2013; 82 (9903): 496–506. DOI: 10.3410/f.718077679.793484579.
- Quintero RA, Johnson MP, Romero R, Cotton DB, Evans MI, Smith C, et al.. In-utero percutaneous cystoscopy in the management of fetal lower obstructive uropathy. Lancet 1995; 346 (8974): 537–540. DOI: 10.1016/s0140-6736(95)91381-5.
- Ruano R, Yoshizaki CT, Giron AM, Srougi M, Zugaib M. Cystoscopic placement of transurethral stent in a fetus with urethral stenosis. Ultrasound Obstet Gynecol 2014; 44 (2): 238–240. DOI: 10.1002/uog.13293.
- Haeri S. Fetal Lower Urinary Tract Obstruction (LUTO): a practical review for providers. Matern Health Neonatol Perinatol 0AD; 1 (1). DOI: 10.1186/s40748-015-0026-1.
- Ruano R, Sananes N, Sangi-Haghpeykar H, Hernandez-Ruano S, Moog R, Becmeur F, et al.. Fetal intervention for severe lower urinary tract obstruction: a multicenter case-control study comparing fetal cystoscopy with vesicoamniotic shunting. Ultrasound Obstet Gynecol 2015; 45 (4): 452–458. DOI: 10.1002/uog.14652.
- Crombleholme TM, Harrison MR, Langer JC, Longaker MT, Anderson RL, Slotnick NS, et al.. Early experience with open fetal surgery for congenital hydronephrosis. J Pediatr Surg 1988; 23 (12): 1114–1121. DOI: 10.1016/s0022-3468(88)80325-7.
- Mann S, Johnson MP, Wilson RD. Fetal thoracic and bladder shunts. Semin Fetal Neonatal Med 2010; 15 (1): 28–33. DOI: 10.1016/j.siny.2009.06.001.
- Sananes N, Favre R, Koh CJ, Zaloszyc A, Braun MC, Roth DR, et al.. Urological fistulas after fetal cystoscopic laser ablation of posterior urethral valves: surgical technical aspects. Ultrasound Obstet Gynecol 2015; 45 (2): 183–189. DOI: 10.1002/uog.13405.
Última actualización: 2025-09-21 13:35