1: Embriología del tracto urinario
Este capítulo durará aproximadamente 23 minutos para leer.
Introducción
A pesar de las diferencias funcionales entre el tracto urinario y el sistema reproductor, los orígenes y el desarrollo embriológicos de estos sistemas están integrados entre sí. El tracto urinario está compuesto por los riñones, uréteres, vejiga y uretra. Este sistema cumple la función de excretar desechos y mantener el equilibrio hidroelectrolítico. Los riñones también producen hormonas que regulan la presión arterial, la producción de eritropoyetina y la síntesis de vitamina D. El sistema genital está compuesto por las gónadas, los tractos reproductores y los genitales externos. Este sistema sintetiza y recibe hormonas para el crecimiento y el desarrollo, produce y transporta espermatozoides y ovocitos y, en las mujeres, sostiene y apoya el desarrollo fetal.
Una comprensión del desarrollo embriológico del tracto genitourinario proporciona una base para comprender la función anatómica y fisiológica de estos órganos, así como la fisiopatología de las estructuras con desarrollo anómalo. Si bien la embriología relacionada con diversas afecciones genitourinarias se expone en detalle en otros capítulos, el propósito de este capítulo es ofrecer una visión general de la embriología del tracto genitourinario.
En este panorama general, usamos “masculino” para referirnos a los genitales internos y externos que se observan con mayor frecuencia en personas con el genotipo 46,XY y “femenino” para referirnos a los genitales internos y externos que se observan con mayor frecuencia en personas con el genotipo 46,XX.
Riñones y tracto urinario superior
El desarrollo del riñón y del tracto urinario superior progresa a través de las etapas propuestas de pronefros, mesonefros y metanefros (Figura 1) El desarrollo de cada unidad renal finalmente da lugar al parénquima renal funcional (compuesto por aproximadamente 250,000 a 3 millones de nefronas1,2), y al sistema colector: cálices menores y mayores, pelvis renal y uréter.
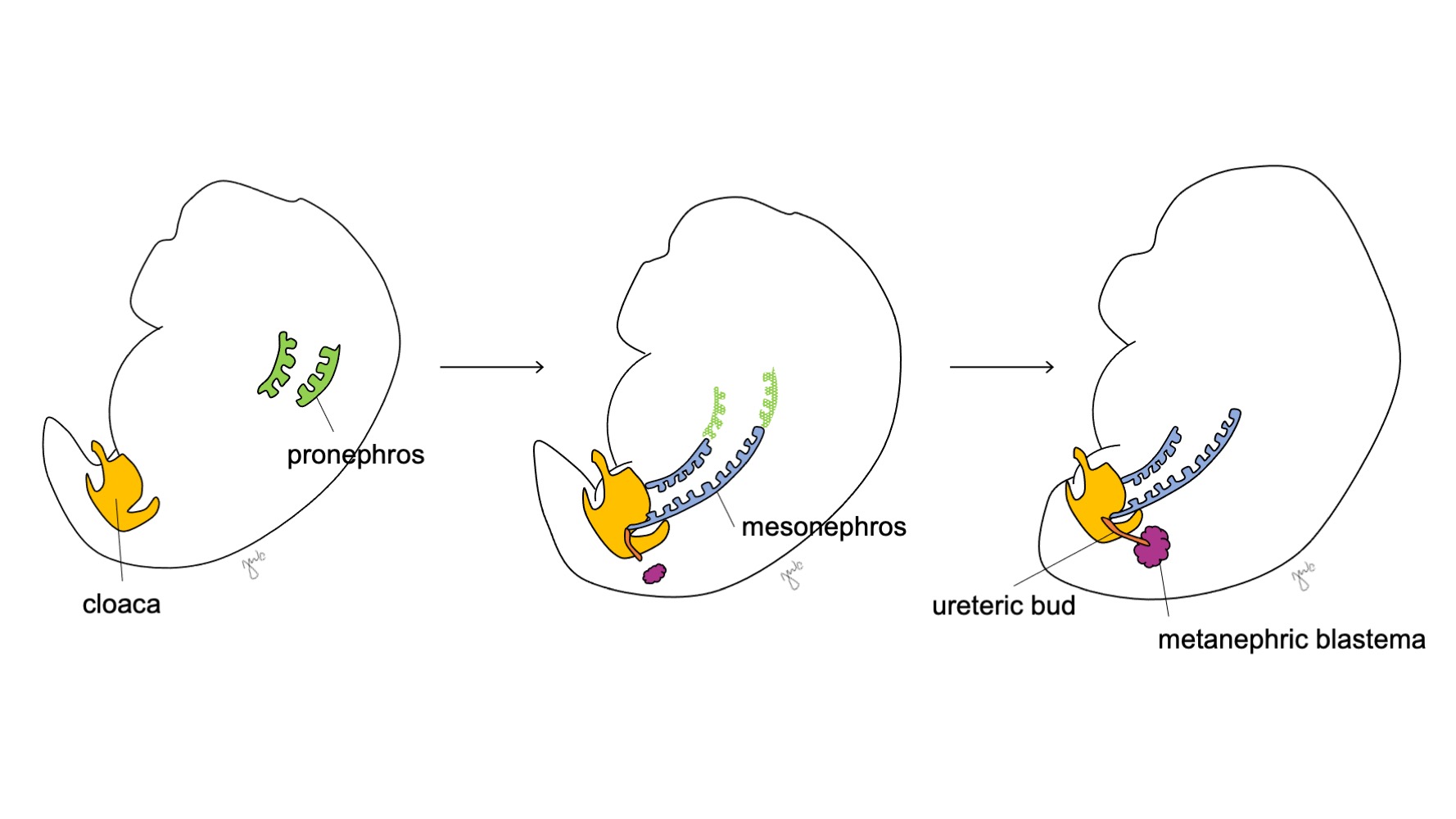
Figura 1 Etapas del desarrollo del riñón y del tracto urinario superior. El riñón progresa a través del pronefros en la semana 3 (verde), del mesonefros a partir de la semana 4 (azul) y del metanefros a partir de la semana 5 de gestación. A medida que el mesonefros se une a la cloaca, el brote ureteral (naranja) surge adyacente a esta unión y se fusiona con el blastema metanéfrico (granate).
En la semana 3 de la gestación, el mesodermo intermedio en las regiones cervicales y torácicas superiores se condensa para formar el pronefros. El pronefros es una estructura primitiva y no funcional de esferas huecas de tejido y aparentemente cumple una función transitoria en el desarrollo embriológico del riñón. Los conductos pronéfricos se extienden caudalmente para dar origen a los conductos mesonéfricos y degeneran al final de la cuarta semana de gestación. Según el concepto de que la ontogenia recapitula la filogenia (es decir, el desarrollo embriológico progresa a través de etapas de la evolución de las especies), se propone el papel transitorio del pronefros humano a partir de su función en el riñón embrionario de diversos cordados.3 Sin embargo, se sabe poco sobre el pronefros humano y las estructuras pronéfricas no fueron detectables en la evaluación de embriones humanos a las 3-4 semanas de desarrollo.3
El mesonefros se origina a nivel de las vértebras torácicas aproximadamente a las 4 semanas de gestación.3 Hacia el final de la cuarta semana, el mesonefros se extiende caudalmente para unirse a la cloaca. El mesonefros funciona como un riñón primitivo que filtra la sangre a través de túbulos. Aunque los túbulos degeneran y el mesonefros se reduce en relación con el tamaño del embrión en crecimiento, los conductos mesonéfricos (de Wolff) persisten bilateralmente y contribuyen además al desarrollo del tracto urinario (trígono vesical y uréteres) y del tracto reproductor masculino (conducto deferente, epidídimo, vesícula seminal, apéndice epididimario).4
Después de que el mesonefros se adhiere a la cloaca, la yema ureteral surge a partir de la porción distal posterior del conducto mesonéfrico cerca de su unión con la cloaca en la semana 5 de gestación.3 El blastema metanéfrico surge simultáneamente como una masa de tejido mesenquimatoso agrupada a partir del mesodermo intermedio. En conjunto, la yema ureteral y el blastema metanéfrico forman el metanefros, que constituye la etapa final del desarrollo del riñón y de la vía urinaria superior. El blastema metanéfrico y la yema ureteral se inducen mutuamente para desarrollarse: el blastema metanéfrico encapsula y se fusiona con la yema ureteral, y la yema ureteral penetra en el blastema metanéfrico y comienza a bifurcarse. A medida que la yema ureteral se alarga para formar el uréter, se bifurca para formar la pelvis renal y los cálices mayores, que luego se ramifican para formar los cálices menores, la pirámide renal y, en última instancia, los túbulos colectores de la nefrona (Figura 2) Mientras tanto, a medida que la yema ureteral se alarga y se bifurca, el blastema metanéfrico forma estructuras de la nefrona (Figura 3) El factor de crecimiento endotelial vascular 2 (VEGF-2) inicia la vascularización en el blastema metanéfrico.5 Los túbulos excretores con forma de S adquieren capilares para formar glomérulos, cada uno con una cápsula de Bowman que los encapsula. Estos túbulos excretores se alargan para formar el túbulo contorneado proximal, el asa de Henle y el túbulo contorneado distal. El túbulo contorneado distal se une con el túbulo colector (derivado de la yema ureteral) para formar la nefrona.
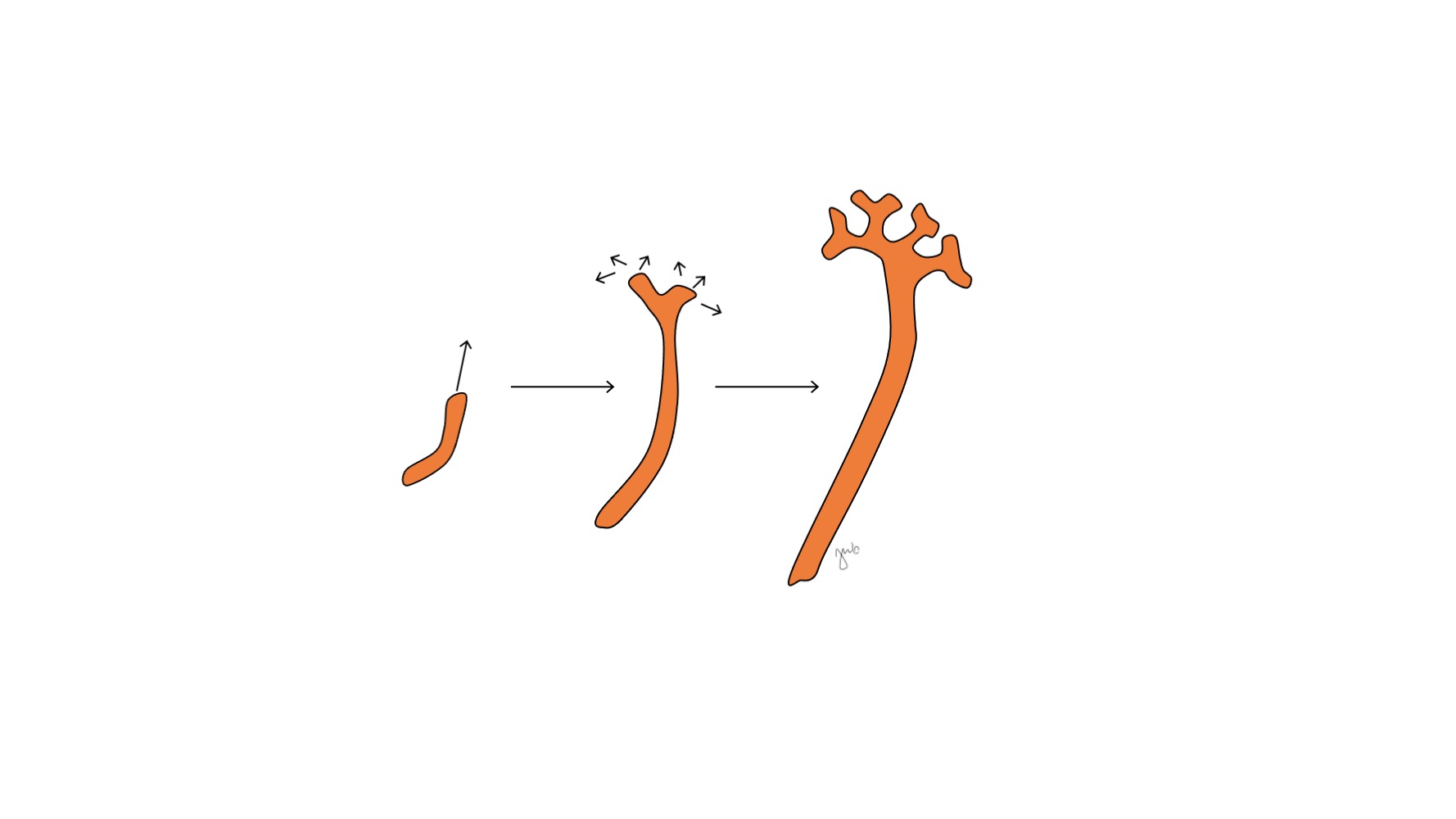
Figura 2 Brote ureteral. El brote ureteral se alarga y se ramifica para formar la pelvis renal, los cálices mayores y menores y el túbulo colector de la nefrona.
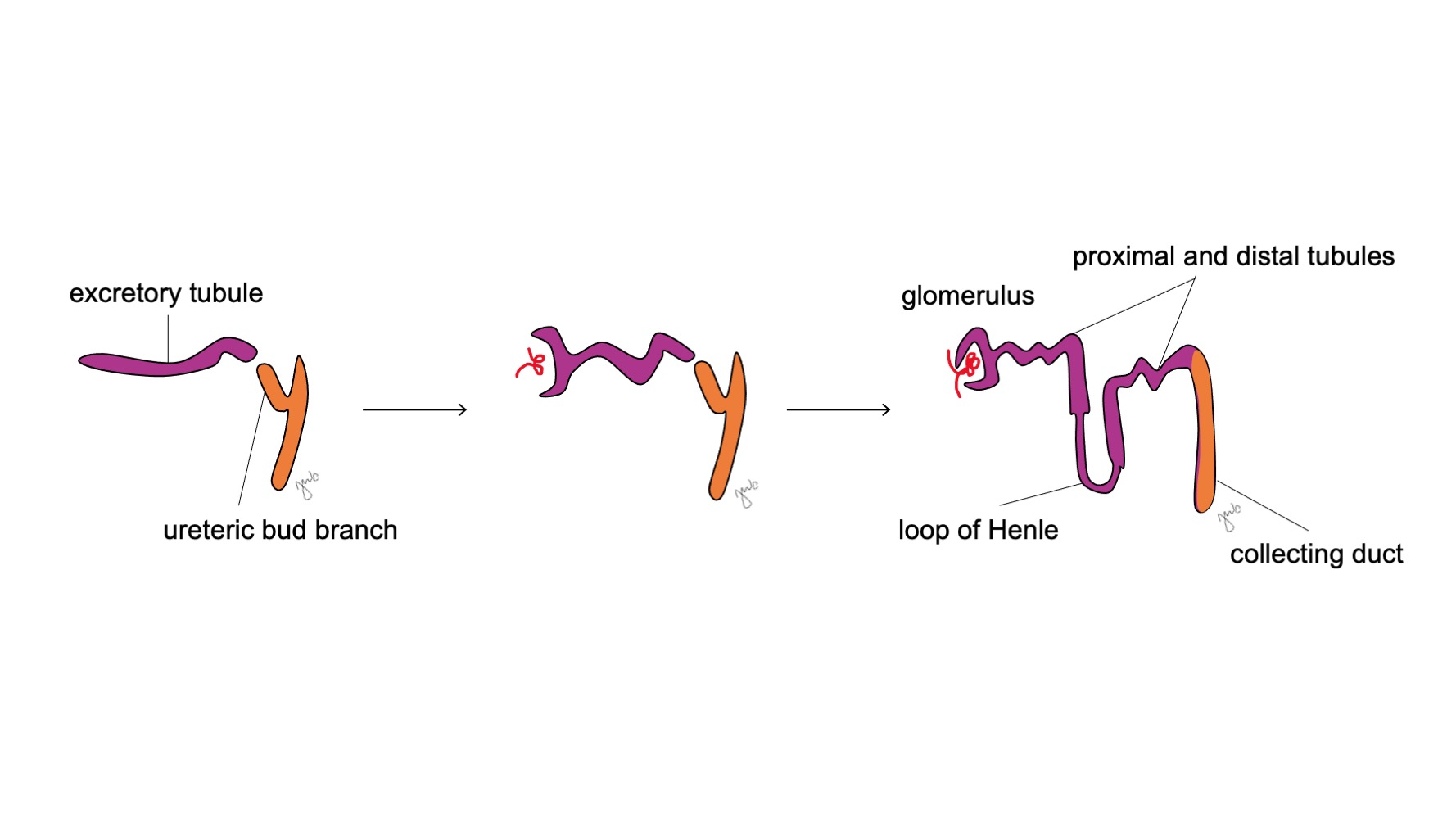
Figura 3 Desarrollo del nefrón. Los túbulos excretores en forma de S (morado; del blastema metanéfrico) adquieren capilares para formar glomérulos, se alargan para formar los túbulos proximal y distal y las asas de Henle, y se unen con los conductos colectores derivados de la yema ureteral (naranja; de los conductos mesonéfricos) para formar finalmente nefronas.
La yema ureteral y el blastema metanéfrico inducen recíprocamente el crecimiento a través de diversos factores e interacciones moleculares que contribuyen al desarrollo del metanéfros. La proteína morfogenética ósea BMP-4 se expresa en el mesénquima y cumple una doble función al inhibir la brotación de la yema ureteral y promover la elongación ureteral.6 La expresión local del antagonista de BMP gremlin (grem1) permite que se inicie la brotación ureteral.6,7 Tras el inicio de la brotación de la yema ureteral, BMP-4 posteriormente promueve la elongación y parece estar implicada en promover el desarrollo del músculo liso periureteral.6,8 BMP-7, proveniente del blastema metanéfrico y de la yema ureteral, mantiene y sensibiliza a los progenitores nefrónicos a la señalización de la yema ureteral.6 El blastema metanéfrico secreta el factor neurotrófico derivado de células gliales (GDNF) que también induce a la yema ureteral a ramificarse y elongarse.9 La glicoproteína WNT11 se expresa en el extremo de la yema ureteral en ramificación y ayuda a mantener la expresión de GDNF.10,11 Existe una interacción recíproca entre WNT11, GDNF y el receptor tirosina cinasa RET en el desarrollo del metanéfros, ya que las mutaciones de WNT11 y RET dan lugar a defectos de ramificación e hipoplasia renal.11 Los ligandos del factor de crecimiento de fibroblastos (FGF) y sus receptores correspondientes (FGFR) también contribuyen a la organización del mesénquima metanéfrico, la inducción de la yema ureteral, la ramificación de la yema ureteral y la nefrogénesis.12 Además, el contacto directo con el mesénquima también promueve la elongación de la yema ureteral y su patrón de ramificación.13
El metanefros se desarrolla hasta convertirse en el riñón funcional y anatómicamente posicionado, con producción temprana de orina, ascenso y revascularización renales, y rotación renal. La producción de orina fetal comienza en las semanas 10-11 de gestación y se convierte en el componente predominante del líquido amniótico.14 Los riñones están inicialmente en estrecha proximidad entre sí en la región sacra del embrión.15,16 A medida que el embrión crece longitudinalmente, cada riñón asciende en las semanas 6-9 desde su ubicación pélvica inicial hasta el retroperitoneo superior en la región torácica inferior y lumbar superior (Figura 4) Vasos sanguíneos transitorios se desarrollan y degeneran a medida que los riñones ascienden hasta que alcanzan su destino final en el retroperitoneo superior y se desarrollan las arterias y venas renales definitivas. Los riñones rotan de modo que la pelvis renal pasa de una orientación anterior a una medial.16
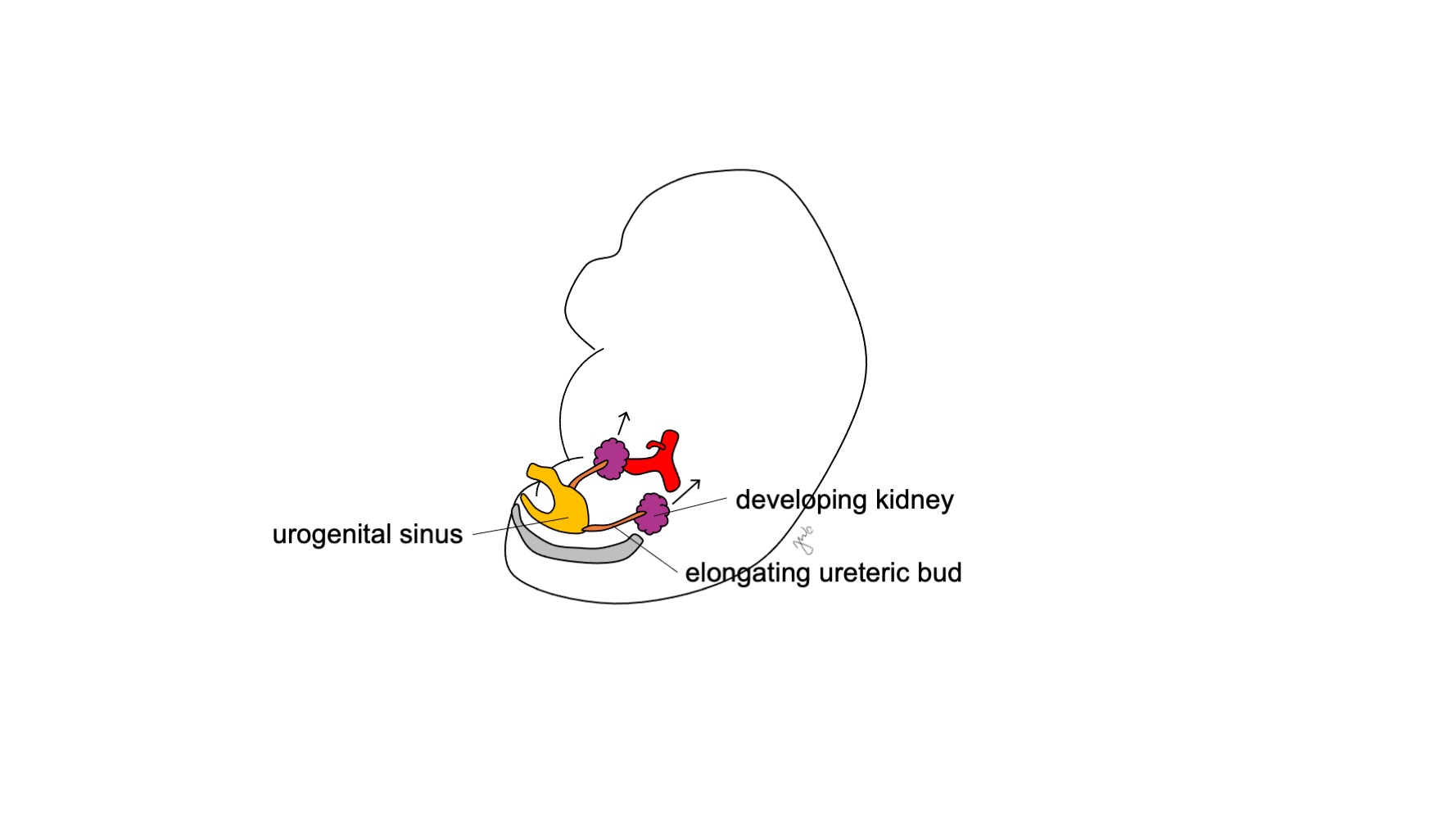
Figura 4 Ascenso renal. El riñón en desarrollo asciende desde su posición pélvica hasta el retroperitoneo superior.
Puntos clave
El riñón en desarrollo y el tracto urinario superior atraviesan las etapas de pronefros, mesonefros y metanefros. El metanefros está compuesto por el blastema metanéfrico y el brote ureteral, que se desarrollan respectivamente en el parénquima renal y el sistema colector. El mesonefros persiste y contribuye al desarrollo del trígono vesical, del sistema colector del tracto urinario superior y del sistema reproductor masculino.
Tracto urinario inferior
La cloaca actúa como una cámara común para los tractos urogenital y anorrectal al conectarse con el alantoides (saco vitelino) y el intestino posterior. Es una combinación de ectodermo revestida por endodermo que se abre en un orificio único en el extremo caudal del embrión en desarrollo. A medida que el mesonefros se une a la cloaca y el tracto urinario superior se desarrolla como el metanefros, el tracto urinario inferior se desarrolla a partir de la cloaca para formar la vejiga y la uretra.
Aproximadamente en la semana 7 de gestación, el tabique urorectal crece caudalmente, separando la cloaca en el seno urogenital anterior y el canal anorrectal posterior, y finalmente se convierte en el cuerpo perineal (Figura 5)17 El seno urogenital luego se subdivide craneal y caudalmente para formar, respectivamente, la vejiga y la uretra.
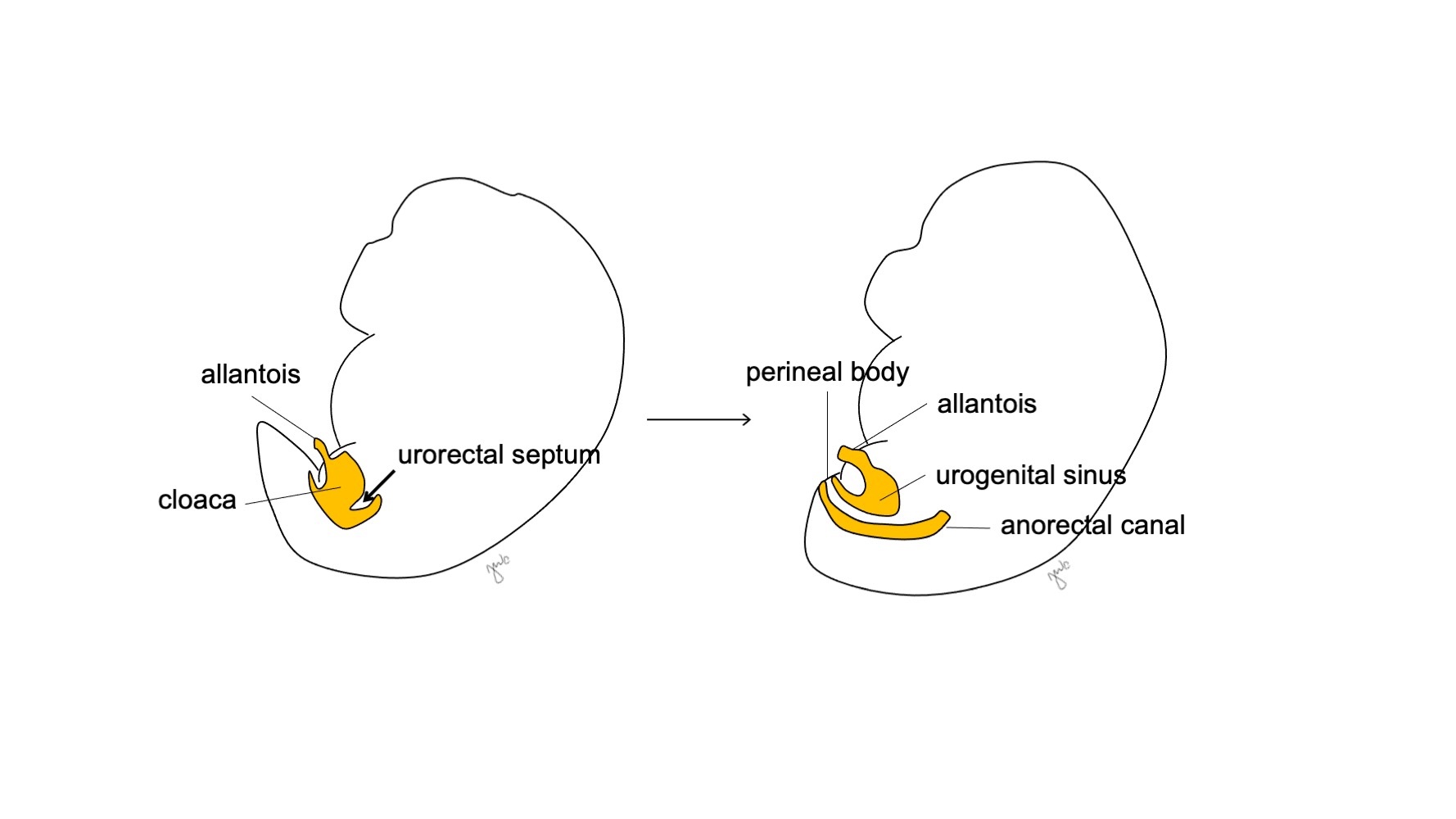
Figura 5 División cloacal. El tabique urorrectal divide la cloaca en el seno urogenital y el canal anorrectal. El tabique urorrectal luego se desarrolla para formar el cuerpo perineal.
La porción craneal del seno urogenital se agranda y se convierte en la vejiga, que inicialmente está en continuidad con el alantoides (Figura 6) Mientras que el endodermo de la antigua cloaca da origen al revestimiento urotelial de la vejiga.18 la diferenciación del músculo liso vesical depende de interacciones entre mesénquima y epitelio.19 El conducto mesonéfrico que previamente se había unido a la cloaca permanece unido a la vejiga en desarrollo; involuciona y es absorbido caudalmente en el trígono vesical y los orificios ureterales. La apoptosis de los conductos mesonéfricos inducida por vitamina A, las interacciones entre el músculo liso vesical y el ureteral, y los orígenes endodérmicos son otros mecanismos propuestos que contribuyen al desarrollo del trígono.20,21,22
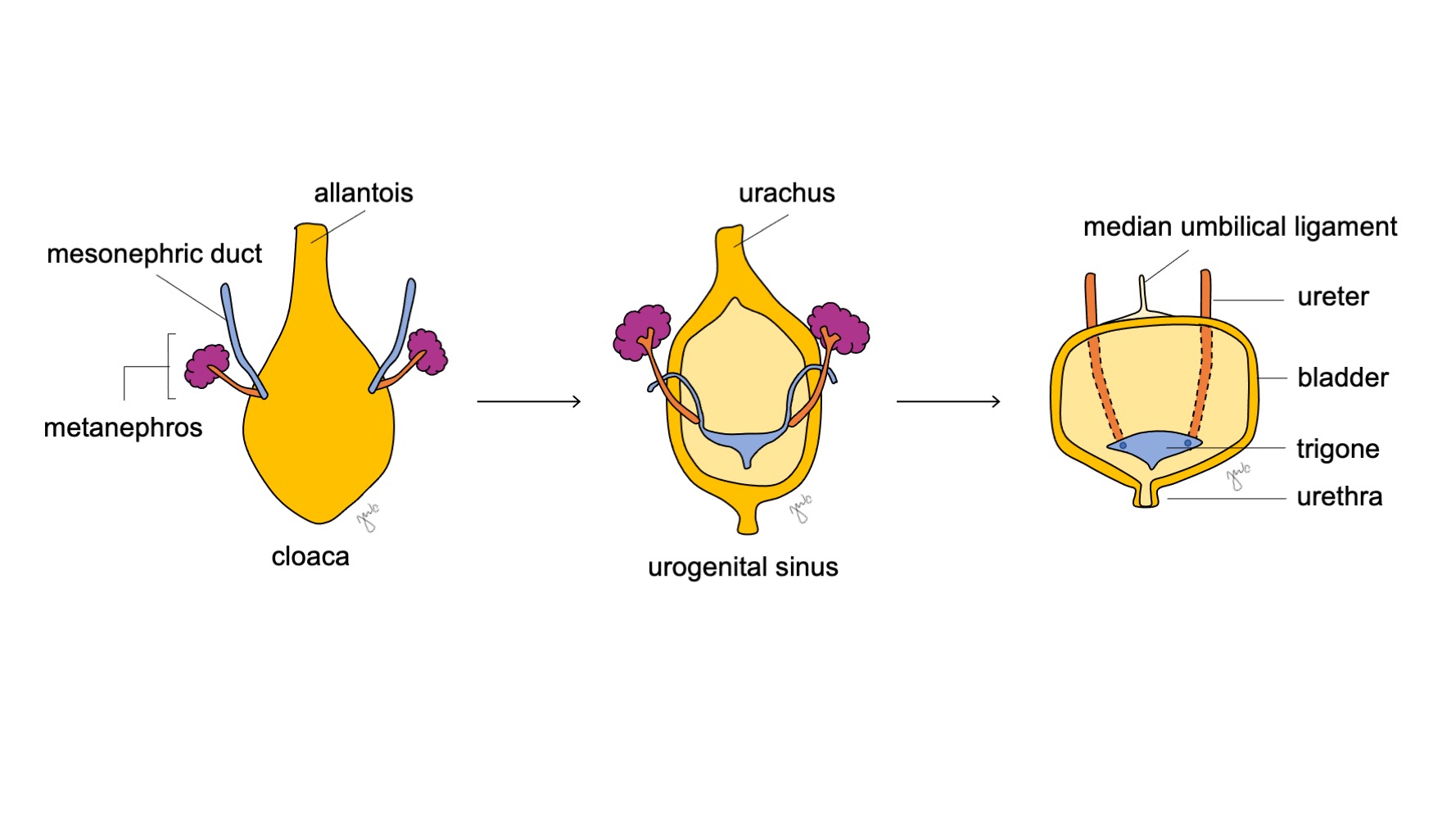
Figura 6 Desarrollo de la vejiga. La porción craneal del seno urogenital se agranda hasta convertirse en la vejiga. El conducto mesonéfrico (azul) involuciona y se incorpora al trígono vesical y a los orificios ureterales. Mientras tanto, el alantoides involuciona y se convierte en el uraco, que posteriormente se fibrosa más y pasa a formar el ligamento umbilical medio.
El resto de los conductos mesonéfricos posteriormente dan lugar al tracto reproductor masculino (analizado en la sección de gónadas y tractos reproductores). Los derivados de los conductos mesonéfricos se alejan entre sí a medida que el embrión continúa creciendo: los orificios ureterales se desplazan craneolateralmente, mientras que los tractos reproductores masculinos se desplazan caudal y medialmente. El desplazamiento de la yema ureteral con respecto a la ubicación del conducto mesonéfrico puede afectar la ubicación definitiva del orificio ureteral y el desarrollo del riñón correspondiente.23,24 Un desplazamiento más leve puede dar lugar a una posición craneolateral o caudomedial del orificio ureteral, mientras que un desplazamiento severo puede resultar en un uréter ectópico que se inserta fuera de la vejiga y/o en displasia renal.23,24
A medida que se desarrolla la vejiga, el alantoides involuciona y se transforma en el uraco que conecta la cúpula vesical con el ombligo. Después del nacimiento, el remanente uracal se vuelve más fibroso y se convierte en el ligamento umbilical medio.25
La porción inferocaudal del seno urogenital forma la uretra prostática y membranosa en los varones y la uretra y el vestíbulo vaginal en las mujeres.25 Al igual que la vejiga, el revestimiento urotelial de la uretra deriva del endodermo.18 En los varones, el seno urogenital se extiende hasta el tubérculo genital para formar la uretra prostática y membranosa, mientras que sus pliegues urogenitales asociados forman la uretra peneana.18,26 Ramificaciones y brotes adicionales de la uretra prostática forman las glándulas prostáticas aproximadamente a las 9-10 semanas de gestación.27 El estroma prostático se origina del mesénquima y se desarrolla bajo la influencia de andrógenos y de la señalización paracrina de múltiples factores, incluidos FGF, sonic hedgehog (SHH), el factor de transcripción Nkx3.1, los genes homeobox (HOX), los factores de transcripción forkhead box (FOX), el factor de transcripción SRY-box (SOX-9), BMP y WNT.27,28,29,30,31 Aunque la testosterona puede contribuir al desarrollo prostático, la dihidrotestosterona (DHT) tiene un efecto mucho más potente sobre la próstata.27 El mesénquima prostático forma el tejido estromal y el músculo liso que rodea las glándulas y los conductos prostáticos. En los varones, las glándulas bulbouretrales (de Cowper) se forman por gemación a partir de la uretra. La uretra peneana se forma cuando la placa uretral se tubulariza18,26 (se analiza en la sección de genitales externos). El desarrollo de la porción glandular de la uretra es objeto de debate en la actualidad y, según estudios más recientes, puede formarse a partir de la tubularización con posterior diferenciación endodérmica hacia epitelio escamoso.18,32,33
En las mujeres, el seno urogenital forma toda la uretra y la vagina distal. Homólogas a las glándulas prostáticas masculinas, la porción craneal de la uretra forma las glándulas parauretrales (de Skene). Homólogas a las glándulas bulbouretrales masculinas (de Cowper), las glándulas de Bartholin se forman por gemación a partir de la uretra.
Puntos clave
La cloaca es inicialmente una cámara común que es dividida por el tabique urorectal para formar el seno urogenital y el canal anorrectal. Posteriormente, el seno urogenital se expande cranealmente para formar la vejiga y contribuye a la formación de la uretra en ambos sexos. Simultáneamente, el alantoides involuciona para formar el uraco, que más tarde se convierte en el ligamento umbilical medio.
Gónadas y tractos reproductivos
Las gónadas y el tracto reproductor interno de los sexos masculino y femenino son inicialmente indiferenciados. La influencia de factores genéticos y hormonales determina el desarrollo para que se formen ya sea los testículos y las estructuras mesonéfricas (de Wolff) asociadas o los ovarios y las estructuras paramesonéfricas (de Müller) asociadas.
Durante la quinta semana de gestación, la proliferación y condensación del epitelio germinal y del mesénquima forman la cresta gonadal adyacente al mesonefros. Las células germinales primordiales se incorporan con cúmulos de epitelio llamados cordones sexuales. Los cordones sexuales invaginan el tejido mesenquimal local y permiten la migración de las células germinales primordiales a través de la cavidad del saco vitelino hacia la cresta gonadal a las 6 semanas.34 A medida que las células germinales y los cordones sexuales se agrupan en la cresta gonadal, se desarrollan las regiones cortical y medular de la gónada.35,36 Los factores WNT4 y SOX-9 se expresan en las crestas gonadales y varían en su expresión en la determinación del sexo humano.37 La formación de la gónada también está regulada por factores de transcripción incluidos Wilms tumor 1 (WT1), LIM homeobox 9 (LHX9) y steroidogenesis factor 1 (SF1).38
Las gónadas indiferenciadas son bipotenciales (Figura 7) y las células germinales primordiales tienen la capacidad de diferenciarse en espermatogonias en los varones o en ovogonias en las mujeres hasta la séptima semana de gestación.38 Conductos mesonéfricos (wolffianos) y conductos paramesonéfricos (müllerianos) también son bipotenciales en este momento.
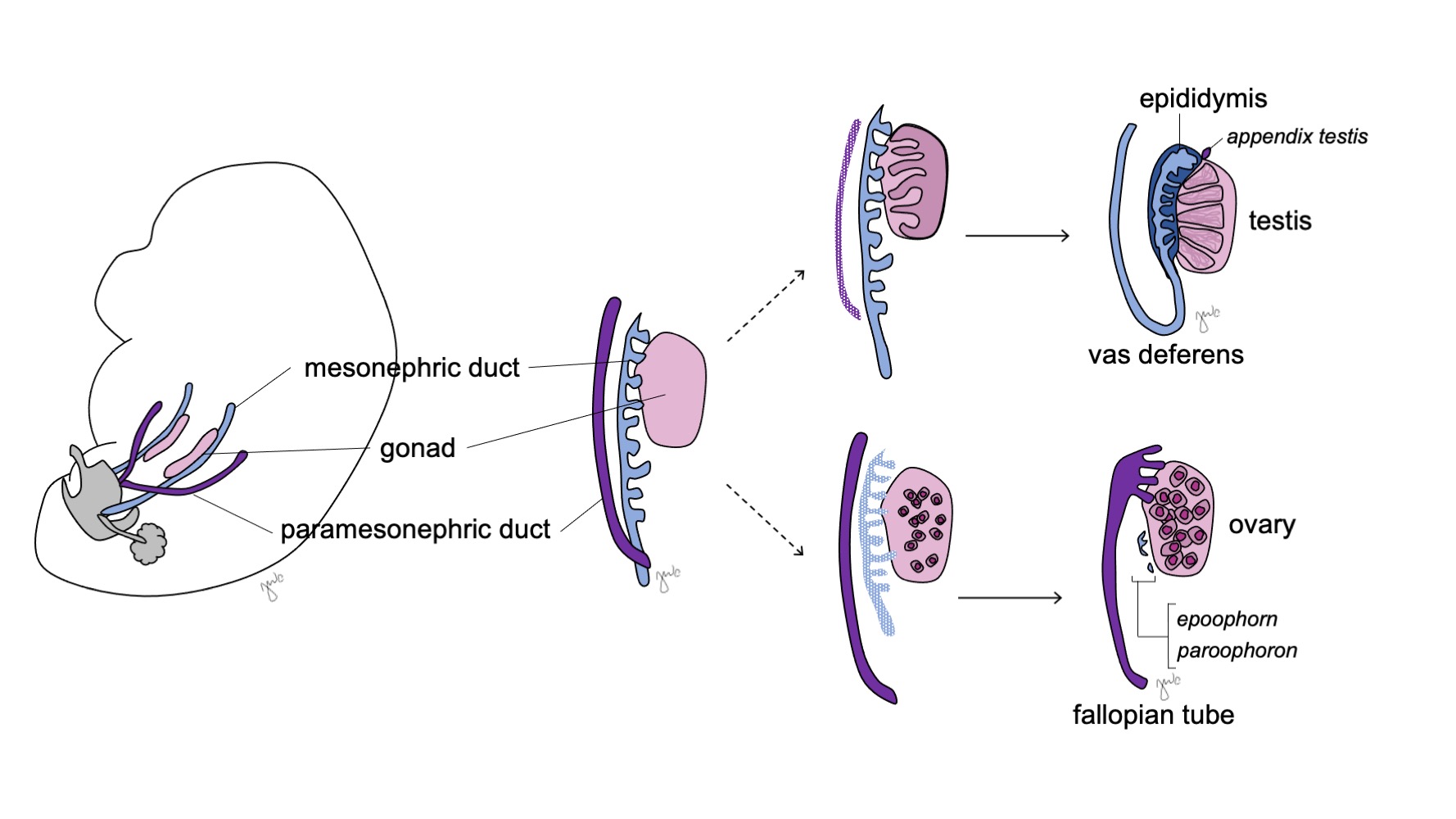
Figura 7 Diferenciación gonadal. La gónada (rosa) suele diferenciarse en el testículo con las estructuras correspondientes del conducto mesonéfrico (azul) o en el ovario con las estructuras correspondientes del conducto paramesonéfrico (púrpura).
La gónada masculina y el tracto reproductor
En los varones, la gónada indiferenciada se diferencia en el testículo y los conductos mesonéfricos (de Wolff) se diferencian en el epidídimo, el apéndice del epidídimo, el conducto deferente, la vesícula seminal y el conducto eyaculador.
El gen SRY (sexodeterminante región del Y-cromosoma) (también conocido como factor determinante del testículo [TDF]) se localiza en el brazo corto del cromosoma Y en Yp11.3 e inicia la diferenciación sexual masculina.39,40 La proteína SRY correspondiente y los factores de transcripción de los genes SOX-9, DAX-1, WT1 y SF1 influyen en la diferenciación gonadal,.% cite mcelreavey1995a vilain1998a –file 01-01 %} Se ha constatado que SRY incrementa la expresión de SOX-9 para activar la expresión de SF1 y promover la diferenciación de las células de Sertoli y de Leydig.37,41,42 Los cordones sexuales gonadales primitivos se organizan en la rete testis y en cordones seminíferos. Las células de Sertoli y las de Leydig se desarrollan entre los cordones seminíferos e inician la producción de hormonas que promueve la diferenciación masculina (se analiza más abajo). La túnica albugínea encapsula estos cordones para formar el testículo. Los seminíferos cordones eventualmente desarrollan una luz y se convierten en los seminíferos túbulos en la pubertad.
Posteriormente, las células de Sertoli y de Leydig inician la producción de hormonas testiculares que resulta en una cascada de procesos de masculinización. Las células de Sertoli secretan el factor inhibidor mülleriano (MIF) o hormona antimülleriana (AMH) bajo la influencia de SOX-9, SF1, WT1 y DAX1, así como de la hormona foliculoestimulante (FSH).43 Posteriormente, la hormona antimülleriana provoca la degeneración de los conductos paramesonéfricos (de Müller), quedando como remanentes el apéndice testicular y el utrículo prostático.40,43,44 SOX-9 y SF1 interactúan para aumentar el efecto de la AMH y provocar la regresión mülleriana. Simultáneamente, las células de Leydig responden a la hormona luteinizante (LH) y a la gonadotropina coriónica humana (hCG), de estructura análoga, para iniciar la producción de testosterona en las semanas 8-9. La testosterona induce la diferenciación del conducto mesonéfrico (Figura 8) en el epidídimo, apéndice del epidídimo, conducto deferente, conducto eyaculador y vesícula seminal44 así como la masculinización de los genitales externos mediante su conversión a DHT.
Durante el desarrollo, el descenso testicular comienza en la semana 10 y depende de la presión intraabdominal, las influencias hormonales y la tensión del gubernáculo.45 A medida que el testículo entra por el anillo inguinal profundo (interno) y forma el conducto inguinal, una capa de peritoneo forma la túnica vaginal. El testículo atraviesa el conducto inguinal entre las semanas 20-28 y sale a través del anillo inguinal superficial (externo) para entrar en el escroto. El músculo oblicuo externo, el músculo oblicuo interno y la fascia transversalis de la pared abdominal anterior proporcionan las respectivas capas escrotales que cubren el testículo como la fascia espermática externa, la fascia cremastérica y el músculo cremáster, y la fascia espermática interna.45
La gónada femenina y el tracto reproductivo
En el sexo femenino, la gónada indiferenciada se desarrolla en el ovario y el conducto paramesonéfrico (de Müller) se desarrolla en la trompa de Falopio, el útero, el cuello uterino y la vagina proximal.
Los ovarios se desarrollan en ausencia del gen SRY en quienes tienen genotipo 46,XX o genotipo 46,XY pero con pérdida del gen SRY.46 La corteza ovárica prolifera y forma cordones sexuales primarios que se extienden hasta la médula gonadal. A los 4 meses, los cordones se dividen y forman folículos primordiales compuestos por ovogonias y células foliculares. Las ovogonias sufren mitosis y los ovocitos primarios quedan detenidos en la prófase I en el momento del nacimiento como una reserva de folículos para la reproducción futura.42 En comparación con el descenso testicular, los ovarios descienden hacia la pelvis en menos tiempo.45
El desarrollo gonadal femenino se ha considerado anteriormente como el mecanismo “por defecto” que ocurre en ausencia de influencia del gen SRY.37,40,41,42 Sin embargo, el desarrollo ovárico no parece ser un proceso pasivo simple. Se promueve activamente a través de las influencias genéticas y moleculares de WNT4 y DAX-1.37,40 WNT4 aumenta la expresión de DAX-1 para suprimir la actividad transcripcional de SF1, inhibir la función de SOX-9 y, en última instancia, promover el desarrollo ovárico.41,42
Antes de la diferenciación sexual, los conductos paramesonéfricos (müllerianos) surgen como invaginaciones epiteliales laterales a los conductos mesonéfricos (wolffianos).47 La ausencia de AMH en las primeras etapas del desarrollo embrionario permite que los conductos paramesonéfricos (müllerianos) se desarrollen en las trompas de Falopio, el útero, el cérvix y la vagina proximal (Figura 8).42,44,48 Las porciones laterales de estos conductos forman las trompas de Falopio. Las porciones mediales de los conductos paramesonéfricos (müllerianos) se fusionan en la línea media para formar el útero, y el extremo distal de los conductos combinados entra en contacto con el seno urogenital para unir la vagina proximal y distal (Figura 9).44,47,49 El mesénquima circundante da origen al endometrio y al miometrio del útero.48 De manera homóloga a la degeneración de los conductos paramesonéfricos (müllerianos) en el apéndice testicular en los varones, los conductos mesonéfricos degeneran en la mujer para formar el epoóforo, el paroóforo y el conducto de Gartner adyacente a la vagina.44
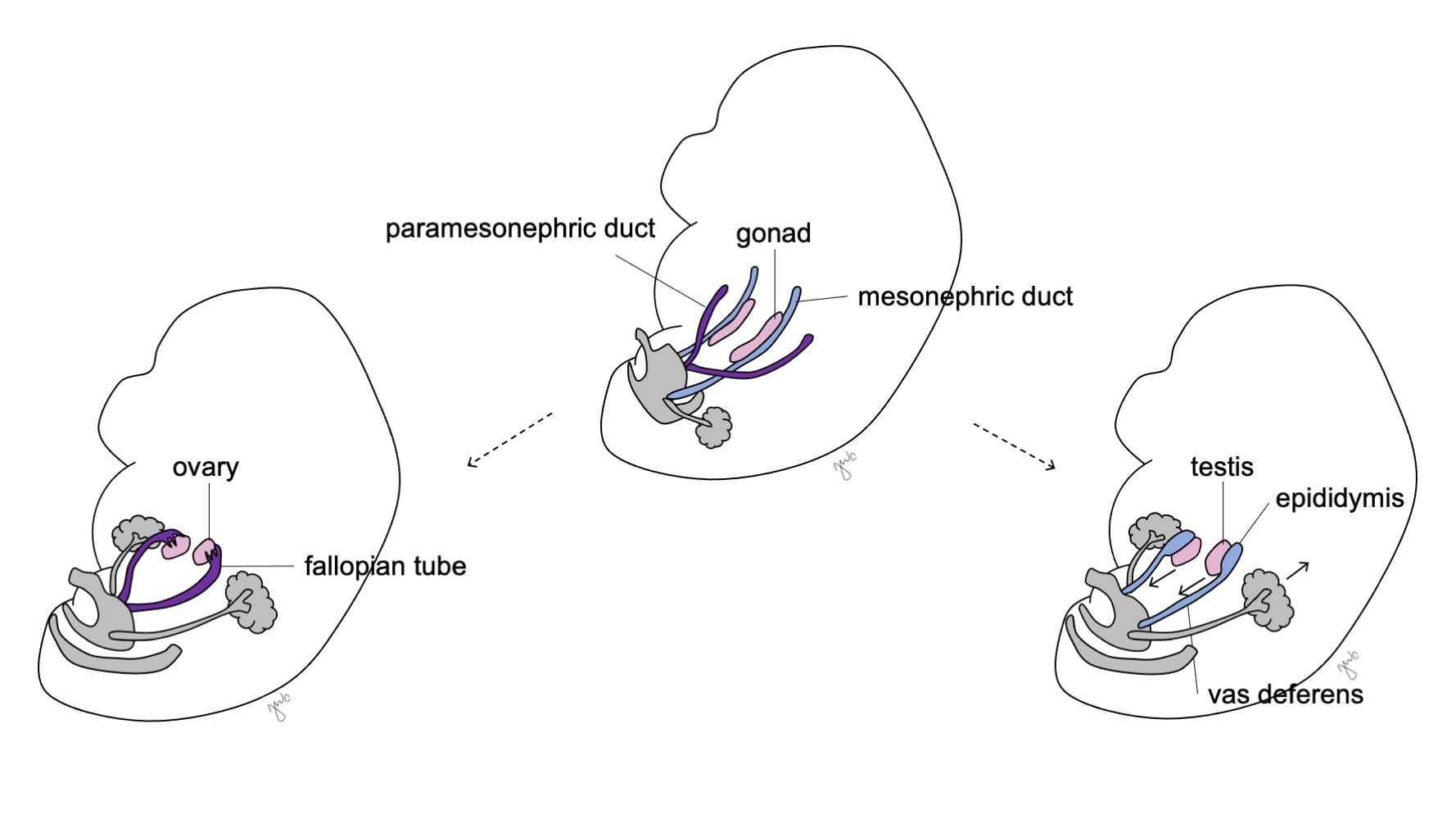
Figura 8 Diferenciación de los conductos mesonéfrico y paramesonéfrico. En los varones, el conducto mesonéfrico (azul) se diferencia en el epidídimo, el conducto deferente, el conducto eyaculador y la vesícula seminal. En las mujeres, el conducto paramesonéfrico (púrpura) se diferencia en la trompa de Falopio, el útero, el cuello uterino y la vagina proximal.
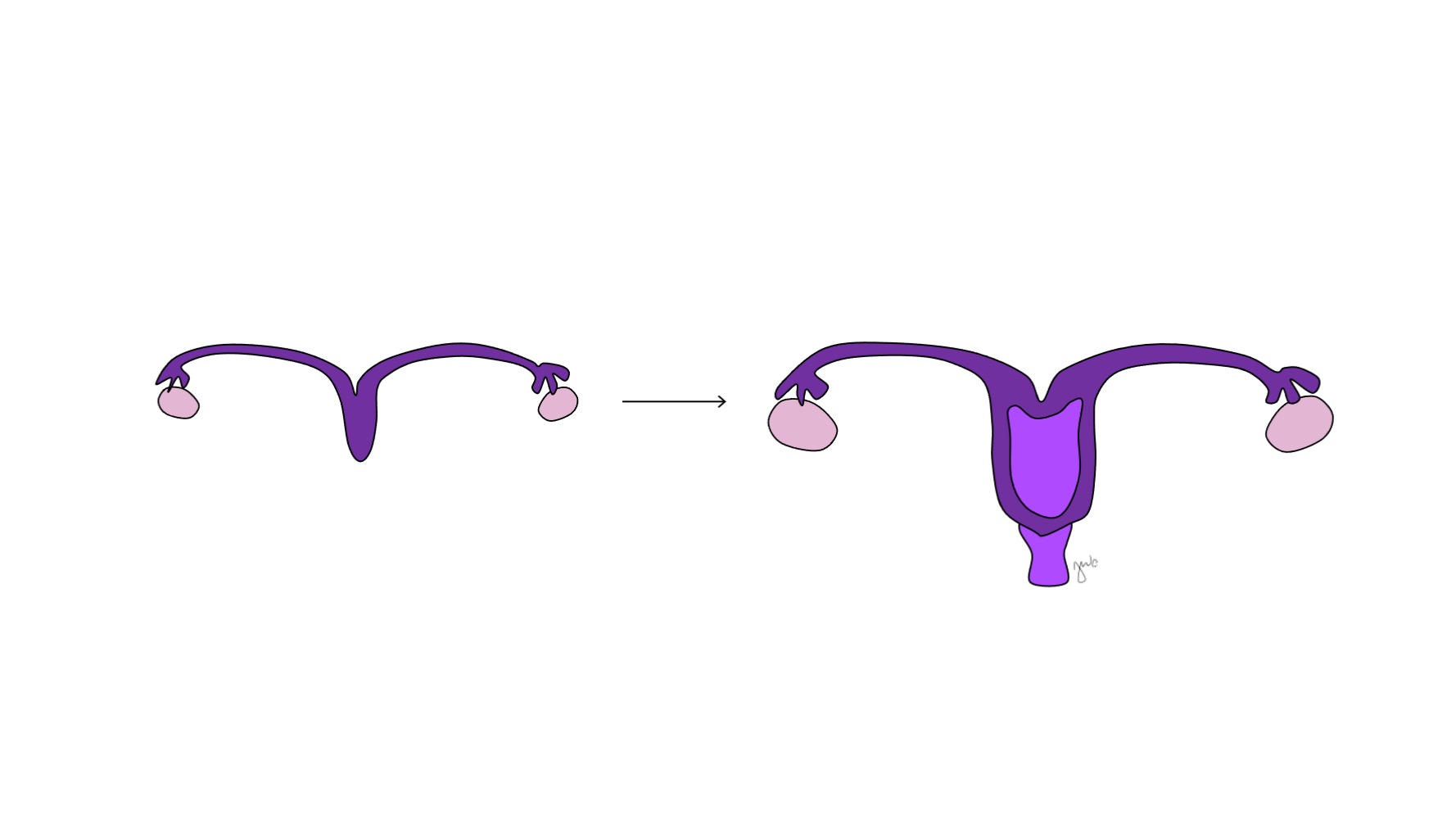
Figura 9 Fusión de los conductos paramesonéfricos. Los aspectos mediales de los conductos paramesonéfricos se fusionan en la línea media para formar el útero. El extremo distal de esta combinación forma el cuello uterino y la vagina proximal, que luego se conecta caudalmente con el seno urogenital.
De manera comparable al desarrollo gonadal, el desarrollo del tracto reproductor femenino tampoco es un mecanismo «por defecto» pasivo, ya que la señalización de WNT4 es esencial para el desarrollo y la diferenciación del conducto de Müller, así como para la supresión de la diferenciación masculina.42,48 Los genes homeobox contribuyen a la alineación anteroposterior de las estructuras paramesonéfricas (müllerianas).48 De forma similar a las células de Sertoli del testículo, las células de la granulosa ovárica finalmente secretan AMH, pero lo hacen más tarde en el desarrollo fetal después de que se hayan desarrollado las estructuras paramesonéfricas (müllerianas).43
Puntos clave
La diferenciación gonadal y de los conductos se describe en Tabla 1. La gónada indiferenciada y las células germinales primordiales pueden desarrollarse en el testículo con espermatogonias o en el ovario con ovogonias. La secreción hormonal subsiguiente de estas gónadas influye para que el conducto mesonéfrico (de Wolff) se convierta en el epidídimo, el apéndice del epidídimo, el conducto deferente, el conducto eyaculador y la vesícula seminal, o para que el conducto paramesonéfrico (de Müller) se convierta en la trompa de Falopio, el útero, el cérvix y la vagina proximal.
Genitales externos
Los genitales externos son inicialmente bipotenciales en ambos sexos hasta la séptima semana de gestación. A medida que la cloaca se separa en el seno urogenital y el canal anorrectal (analizado previamente en la sección del tracto urinario inferior), se desarrollan pliegues a ambos lados de la cloaca. Después de que el tabique urorectal completa la división cloacal, los pliegues laterales se convierten en los pliegues urogenitales y la porción anterior de los pliegues se fusiona para formar el tubérculo genital. Las prominencias laterales al tubérculo genital forman las prominencias labioscrotales. El tubérculo genital, los pliegues urogenitales y las prominencias labioscrotales (Figura 10) se diferencian bajo la influencia hormonal procedente de las gónadas que se desarrollan simultáneamente.
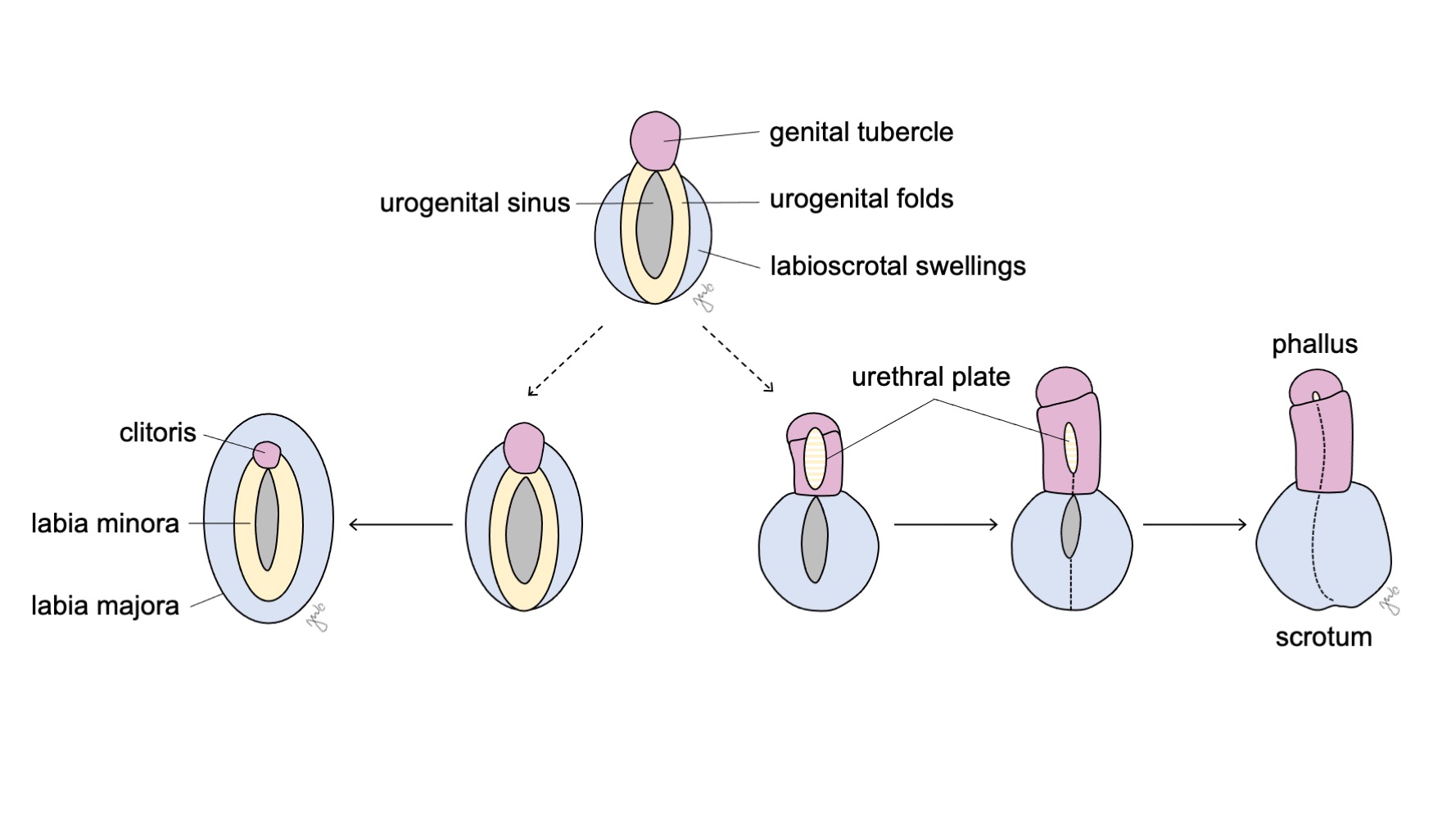
Figura 10 Diferenciación de los genitales externos. El tubérculo genital (rosa), los pliegues urogenitales (amarillo) y las eminencias labioescrotales (azul) se diferencian, respectivamente, ya sea en el clítoris, los labios menores y los labios mayores en las mujeres, o en el falo, la placa uretral y el escroto en los varones.
Genitales externos masculinos
La influencia androgénica de la testosterona y la dihidrotestosterona (DHT) causa la masculinización del seno urogenital y de los genitales externos en el pene y el escroto (Figura 10).34,44
La exposición a andrógenos provoca que el tubérculo genital se alargue entre las semanas 8 y 12, con crecimiento lineal posterior a partir de las 14 semanas de gestación y detección ultrasonográfica de la estructura fálica a partir de las 18 semanas.34,50,51 SHH se expresa en el tubérculo genital y en el epitelio de la placa uretral y puede facilitar la influencia de los andrógenos en la formación del pene y otras formas de masculinización genital.34,52 Las condensaciones mesenquimatosas penianas forman los cuerpos cavernosos y el cuerpo esponjoso.53 Se ha identificado curvatura ventral del pene en fetos hasta la 20ª semana de gestación, con resolución gradual durante el resto de la gestación.54
Los pliegues urogenitales se fusionan en la línea media para formar la placa uretral como parte del desarrollo de la uretra peneana. Un surco en la línea media de la placa uretral se profundiza y los bordes epiteliales de la placa se fusionan para formar un tubo.33,55 La línea epitelial formada por esta fusión luego se remodela y es reemplazada por células mesenquimales.55 Mientras la uretra peneana proximal se fusiona caudalmente con la uretra prostática derivada del seno urogenital, la tubularización progresa en sentido distal y ventral. Como se comentó anteriormente, el desarrollo de la uretra del glande es motivo de debate. Aunque anteriormente se atribuía este aspecto de la uretra a una invaginación ectodérmica desde la punta del glande del pene, estudios más recientes han propuesto que la uretra del glande se forma mediante tubularización con posterior diferenciación endodérmica en epitelio escamoso.18,32,33 A medida que el falo se alarga y la placa uretral se tubulariza, las prominencias labioscrotales se fusionan en la línea media a nivel del rafe medio para formar el escroto.56
Genitales externos femeninos
Aunque la ausencia de andrógenos evita la masculinización, el desarrollo de los genitales externos femeninos no es el proceso “predeterminado”, ya que dos cromosomas X, el desarrollo ovárico y los estrógenos contribuyen al proceso. La importancia de las influencias genéticas, gonadales y hormonales en el desarrollo puede demostrarse por la presencia de genitales externos hipoplásicos en pacientes con síndrome de Turner que carecen de un cromosoma X o en informes de translocación del cromosoma X.57,58
El seno urogenital y los genitales externos se desarrollan hasta convertirse en el clítoris, los labios mayores y menores y la vagina distal, tanto bajo la influencia de los estrógenos como en ausencia de andrógenos (Figura 10) El tubérculo genital involuciona en ausencia de andrógenos y forma el clítoris. El seno urogenital (formado inicialmente tras la división cloacal) da origen a toda la uretra femenina y a la vagina distal. La vagina distal se fusiona cranealmente con los conductos paramesonéfricos. Las células centrales se degradan para formar la luz vaginal y la pared posterior se invagina para formar el himen. Los pliegues urogenitales se convierten en los labios menores con una mínima fusión posterior para formar la horquilla posterior. Las prominencias labioescrotales permanecen sin fusionar en la mujer y se convierten en los labios mayores.
Tabla 1 Diferenciación y desarrollo sexuales.
| Masculino | Femenino | |
|---|---|---|
| Gónadas | ||
| Células germinales primordiales | Espermatogonias | Ovogonias |
| Cordones sexuales | Cordones seminíferos | Folículos primordiales |
| Conductos mesonéfricos (de Wolff) | Epidídimo, apéndice del epidídimo, conducto deferente, vesícula seminal, conducto eyaculador | Conducto de Gartner, epoóforo, paroóforo |
| Conductos paramesonéfricos (de Müller) | Apéndice del testículo, utrículo prostático | Trompa de Falopio, útero, cérvix, vagina proximal |
| Seno urogenital | Vejiga, uretra proximal, posiblemente la uretra glandar distal | Vejiga, uretra, vagina distal |
| Genitales externos | ||
| Tubérculo genital | Pene | Clítoris |
| Pliegues urogenitales | Placa uretral | Labios menores |
| Prominencias labioescrotales | Escroto | Labios mayores |
Puntos clave
La diferenciación de los genitales externos también se describe en la Tabla 1. El tubérculo genital se convierte en el falo en los varones y en el clítoris en las mujeres. Los pliegues urogenitales se convierten en la placa uretral en los varones y en los labios menores en las mujeres. Las prominencias labioescrotales se desarrollan hasta convertirse en el escroto en los varones y en los labios mayores en las mujeres. Como parte del desarrollo del tracto urinario inferior, el seno urogenital forma la uretra proximal y sus pliegues urogenitales forman la placa uretral de la uretra distal en los varones. En contraste, en las mujeres el seno urogenital forma toda la uretra, así como la vagina distal.
Conclusión
El desarrollo de los tractos urinario y reproductor está integrado debido a sus orígenes e interacciones durante el desarrollo embrionario. El riñón en desarrollo progresa a través de las etapas de pronefros, mesonefros y metanefros. La interacción entre el mesonefros y la cloaca da lugar a la yema ureteral y al blastema metanéfrico, que finalmente se desarrollan en el riñón y el tracto urinario superior. La cloaca se divide de manera concomitante, y el seno urogenital anterior se desarrolla en la vejiga y contribuye a la uretra masculina y femenina. Las gónadas, los conductos mesonéfricos (de Wolff) y paramesonéfricos (de Müller) y los genitales externos tienen el potencial de desarrollarse a lo largo del espectro de la diferenciación sexual masculina y femenina: las influencias genéticas y hormonales condicionan, respectivamente, la función gonadal y el aspecto fenotípico del embrión en desarrollo. Diversas alteraciones en los genes, las interacciones moleculares o los tejidos en desarrollo implicados en estos procesos pueden afectar la anatomía y la función a largo plazo de sus respectivas estructuras.
Referencias
- Bertram JF, Douglas-Denton RN, Diouf B, Hughson MD, Hoy WE. Human nephron number: implications for health and disease. Pediatr Nephrol 2011; 26 (9): 1529–1533. DOI: 10.1007/s00467-011-1843-8.
- Tryggvason K, Kouvalainen K. Number of Nephrons in Normal Human Kidneys and Kidneys of Patients with the Congenital Nephrotic Syndrome. Nephron 1975; 15 (1): 62–68. DOI: 10.1159/000180493.
- Bakker BS de, Hoff MJB van den, Vize PD, Oostra RJ. The Pronephros; a Fresh Perspective. Integr Comp Biol 2019; 59 (1): 29–47. DOI: 10.1093/icb/icz001.
- Ludwig KS, Landmann L. Early development of the human mesonephros. Anat Embryol (Berl) 2005; 209 (6): 439–447. DOI: 10.1007/s00429-005-0460-3.
- Nagata M. Glomerulogenesis and the role of endothelium. Curr Opin Nephrol Hypertens 2018; 27 (3): 159–164. DOI: 10.1097/mnh.0000000000000402.
- Nishinakamura R, Sakaguchi M. BMP signaling and its modifiers in kidney development. Pediatr Nephrol 2014; 29 (4): 681–686. DOI: 10.1007/s00467-013-2671-9.
- Michos O, Panman L, Vintersten K, Beier K, Zeller R, Zuniga A. Gremlin-mediated BMP antagonism induces the epithelial-mesenchymal feedback signaling controlling metanephric kidney and limb organogenesis. Development 2004; 131 (14): 3401–3410. DOI: 10.1242/dev.01251.
- Wang GJ, Brenner-Anantharam A, Vaughan ED, Herzlinger D. Antagonism of BMP4 Signaling Disrupts Smooth Muscle Investment of the Ureter and Ureteropelvic Junction. J Urol 2009; 181 (1): 401–407. DOI: 10.1016/j.juro.2008.08.117.
- Sajithlal G, Zou D, Silvius D, Xu P-X. Eya1 acts as a critical regulator for specifying the metanephric mesenchyme. Dev Biol 2005; 284 (2): 323–336. DOI: 10.1016/j.ydbio.2005.05.029.
- Yu J, McMahon AP, Valerius MT. Recent genetic studies of mouse kidney development. Curr Opin Genet Dev 2004; 14 (5): 550–557. DOI: 10.1016/j.gde.2004.07.009.
- Majumdar A, Vainio S, Kispert A, McMahon J, McMahon AP. Wnt11andRet/Gdnfpathways cooperate in regulating ureteric branching during metanephric kidney development. Development 2003; 130 (14): 3175–3185. DOI: 10.1242/dev.00520.
- Walker KA, Sims-Lucas S, Bates CM. Fibroblast growth factor receptor signaling in kidney and lower urinary tract development. Pediatr Nephrol 2016; 31 (6): 885–895. DOI: 10.1007/s00467-015-3151-1.
- Qiao J, Sakurai H, Nigam SK. Branching morphogenesis independent of mesenchymal–epithelial contact in the developing kidney. Proc Natl Acad Sci U S A 1999; 96 (13): 7330–7335. DOI: 10.1073/pnas.96.13.7330.
- Underwood MA, Gilbert WM, Sherman MP. Amniotic Fluid: Not Just Fetal Urine Anymore. J Perinatol 2005; 25 (5): 341–348. DOI: 10.1038/sj.jp.7211290.
- Taghavi K, Kirkpatrick J, Mirjalili SA. The horseshoe kidney: Surgical anatomy and embryology. J Pediatr Urol 2016; 12 (5): 275–280. DOI: 10.1016/j.jpurol.2016.04.033.
- Friedland GW, De Vries P. Renal ectopia and fusion. Urology 1975; 5 (5): 698–706. DOI: 10.1016/0090-4295(75)90137-5.
- Kruepunga N, Hikspoors JP, Mekonen HK, Mommen GM, Meemon K, Weerachatyanukul W, et al.. Faculty Opinions recommendation of The development of the cloaca in the human embryo. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2018; 33 (6): 24–39. DOI: 10.3410/f.734193252.793568763.
- Seifert AW, Harfe BD, Cohn MJ. Cell lineage analysis demonstrates an endodermal origin of the distal urethra and perineum. Dev Biol 2008; 318 (1): 143–152. DOI: 10.1016/j.ydbio.2008.03.017.
- Baskin LS, Hayward SW, Young P, Cunha GR. Role of Mesenchymal-Epithelial Interactions in Normal Bladder Development. J Urol 1996; 56 (5): 1820–1827. DOI: 10.1097/00005392-199611000-00101.
- Batourina E, Tsai S, Lambert S, Sprenkle P, Viana R, Dutta S, et al.. Faculty Opinions recommendation of Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2005; 7 (10): 082–089. DOI: 10.3410/f.1029077.343528.
- Viana R, Batourina E, Huang H, Dressler GR, Kobayashi A, Behringer RR, et al.. The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134 (20): 3763–3769. DOI: 10.1242/dev.011270.
- Tanaka ST, Ishii K, Demarco RT, Pope JC, Brock JW, Hayward SW. Endodermal Origin of Bladder Trigone Inferred From Mesenchymal-Epithelial Interaction. J Urol 2010; 183 (1): 386–391. DOI: 10.1016/j.juro.2009.08.107.
- Mackie GG, Stephens FD. Duplex Kidneys: A Correlation of Renal Dysplasia with Position of the Ureteral Orifice. J Urol 1975; 114 (2): 274–280. DOI: 10.1016/s0022-5347(17)67007-1.
- Wen JG, Frøkiaer J, Zhao JB, Ringgaard S, Jørgensen TM, Djurhuus JC. Severe partial ureteric obstruction in newborn rats can produce renal dysplasia. BJU Int 1981; 89 (7): 740–745. DOI: 10.1046/j.1464-410x.2002.02747.x.
- Parada Villavicencio C, Adam SZ, Nikolaidis P, Yaghmai V, Miller FH. Imaging of the Urachus: Anomalies, Complications, and Mimics. Radiographics 2016; 36 (7): 2049–2063. DOI: 10.1148/rg.2016160062.
- Krishnan A, Souza A de, Konijeti R, Baskin LS. The Anatomy and Embryology of Posterior Urethral Valves. J Urol 2006; 175 (4): 1214–1220. DOI: 10.1016/s0022-5347(05)00642-7.
- Cunha GR, Vezina CM, Isaacson D, Ricke WA, Timms BG, Cao M, et al.. A comparison of prostatic development in xenografts of human fetal prostate and human female fetal proximal urethra grown in dihydrotestosterone-treated hosts. Differentiation 2018; 115 (24-45): 37–52. DOI: 10.1016/j.diff.2020.06.001.
- Thomson AA. Role of androgens and fibroblast growth factors in prostatic development. Reproduction 2001; 21 (2): 187–195. DOI: 10.1530/rep.0.1210187.
- LASNITZKI ILSE, MIZUNO TAKEO. Prostatic Induction: Interaction Of Epithelium And Mesenchyme From Normal Wild-type Mice And Androgen-insensitive Mice With Testicular Feminization. J Endocrinol 1980; 85 (3): 423–np. DOI: 10.1677/joe.0.0850423.
- Meeks JJ, Schaeffer EM. Genetic Regulation of Prostate Development. J Androl 2011; 32 (3): 210–217. DOI: 10.2164/jandrol.110.011577.
- Marker PC, Donjacour AA, Dahiya R, Cunha GR. Hormonal, cellular, and molecular control of prostatic development. Dev Biol 2003; 253 (2): 165–174. DOI: 10.1016/s0012-1606(02)00031-3.
- Kurzrock EA, Baskin LS, Cunha GR. Ontogeny of the male urethra: Theory of endodermal differentiation. Differentiation 1999; 64 (2): 115–122. DOI: 10.1046/j.1432-0436.1999.6420115.x.
- Hadidi AT, Roessler J, Coerdt W. Development of the human male urethra: A histochemical study on human embryos. J Pediatr Surg 2014; 49 (7): 1146–1152. DOI: 10.1016/j.jpedsurg.2014.01.009.
- Blaschko SD, Cunha GR, Baskin LS. Molecular mechanisms of external genitalia development. Differentiation 2012; 84 (3): 261–268. DOI: 10.1016/j.diff.2012.06.003.
- Satoh M. Histogenesis and organogenesis of the gonads in human embryos. Med Electron Microsc 1991; 27 (3-4): 254–256. DOI: 10.1007/bf02349668.
- McKay DG, Hertig AT, Adams EC, Danziger S. Histochemical observations on the germ cells of human embryos. Anat Rec 1953; 117 (2): 201–219. DOI: 10.1002/ar.1091170206.
- Hanley NA, Hagan DM, Clement-Jones M, Ball SG, Strachan T, Salas-Cortés L, et al.. SRY, SOX9, and DAX1 expression patterns during human sex determination and gonadal development. Mech Dev 2000; 91 (1-2): 403–407. DOI: 10.1016/s0925-4773(99)00307-x.
- Yao HH-C. The pathway to femaleness: current knowledge on embryonic development of the ovary. Mol Cell Endocrinol 2005; 230 (1-2): 87–93. DOI: 10.1016/j.mce.2004.11.003.
- Berta P, Hawkins JB, Sinclair AH, Taylor A, Griffiths BL, Goodfellow PN, et al.. Genetic evidence equating SRY and the testis-determining factor. Nature 1990; 348 (6300): 448–450. DOI: 10.1038/348448a0.
- Rey RA, Grinspon RP. Normal male sexual differentiation and aetiology of disorders of sex development. Best Pract Res Clin Endocrinol Metab 2011; 25 (2): 221–238. DOI: 10.1016/j.beem.2010.08.013.
- McElreavey K, Barbaux S, Ion A, Fellous M. The genetic basis of murine and human sex determination: a review. Heredity (Edinb) 1995; 75 (6): 599–611. DOI: 10.1038/hdy.1995.179.
- Vilain E, McCabe ERB. Mammalian Sex Determination: From Gonads to Brain. Mol Genet Metab 1998; 65 (2): 74–84. DOI: 10.1006/mgme.1998.2749.
- Sinisi AA, Pasquali D, Notaro A, Bellastella A. Sexual Differentiation. Encyclopedic Dictionary of Genetics, Genomics and Proteomics 2003; 26 (3 Suppl): 473–494. DOI: 10.1002/0471684228.egp11478.
- Biason-Lauber A, Chaboissier M-C. Ovarian development and disease: The known and the unexpected. Semin Cell Dev Biol 2015; 45 (59-67): 59–67. DOI: 10.1016/j.semcdb.2015.10.021.
- Rey R, Lukas-Croisier C, Lasala C, Bedecarrás P. AMH/MIS: what we know already about the gene, the protein and its regulation. Mol Cell Endocrinol 2003; 211 (1-2): 21–31. DOI: 10.1016/j.mce.2003.09.007.
- Sajjad Y. Development of the genital ducts and external genitalia in the early human embryo. J Obstet Gynaecol Res 2010; 36 (5): 929–937. DOI: 10.1111/j.1447-0756.2010.01272.x.
- Barteczko KJ, Jacob MI, Jacob MI. Development, Shape and Fate of Gubernaculum Hunteri and Processus Vaginalis Peritonei - Own Phases of Testicular Descent. Adv Anat Embryol Cell Biol 2000; 156:iii-x: 17–72. DOI: 10.1007/978-3-642-58353-7_4.
- Hawkins JR, Taylor A, Berta P, Levilliers J, Auwera B Van der, Goodfellow PN. Mutational analysis of SRY: nonsense and missense mutations in XY sex reversal. Hum Genet 1992; 88 (4): 471–474. DOI: 10.1007/bf00215684.
- Spencer TE, Dunlap KA, Filant J. Comparative developmental biology of the uterus: Insights into mechanisms and developmental disruption. Mol Cell Endocrinol 2012; 354 (1-2): 34–53. DOI: 10.1016/j.mce.2011.09.035.
- Kobayashi A, Behringer RR. Developmental genetics of the female reproductive tract in mammals. Nat Rev Genet 2003; 4 (12): 969–980. DOI: 10.1038/nrg1225.
- Cunha GR. The dual origin of vaginal epithelium. Am J Anat 1975; 143 (3): 387–392. DOI: 10.1002/aja.1001430309.
- Feldman KW, Smith DW. Fetal phallic growth and penile standards for newborn male infants. J Pediatr 1975; 86 (3): 395–398. DOI: 10.1016/s0022-3476(75)80969-3.
- Zalel Y, Pinhas-Hamiel O, Lipitz S, Mashiach S, Achiron R. The development of the fetal penis-anin uterosonographic evaluation. Ultrasound Obstet Gynecol 2001; 17 (2): 129–131. DOI: 10.1046/j.1469-0705.2001.00216.x.
- Miyagawa S, Matsumaru D, Murashima A, Omori A, Satoh Y, Haraguchi R, et al.. The Role of Sonic Hedgehog-Gli2 Pathway in the Masculinization of External Genitalia. Endocrinology 2011; 152 (7): 2894–2903. DOI: 10.1210/en.2011-0263.
- BASKIN LS, LEE YT, CUNHA GR. Neuroanatomical ontogeny of the human fetal penis. BJU Int 1997; 79 (4): 628–640. DOI: 10.1046/j.1464-410x.1997.00119.x.
- Kaplan GW, Lamm DL. Embryogenesis of Chordee. J Urol 1975; 114 (5): 769–772. DOI: 10.1016/s0022-5347(17)67140-4.
- Baskin L, Erol A, Jegatheesan P, Li Y, Liu W, Cunha G. Urethral seam formation and hypospadias. Cell Tissue Res 2001; 305 (3): 379–387. DOI: 10.1007/s004410000345.
- Kluth D, Fiegel HC, Geyer C, Metzger R. Embryology of the distal urethra and external genitals. Semin Pediatr Surg 2011; 20 (3): 176–187. DOI: 10.1053/j.sempedsurg.2011.03.003.
- Omar HA, Hummel M, Jones EA, Perkins KC. Hypoplastic external genitalia in association with X;autosome chromosome translocation. J Pediatr Adolesc Gynecol 1999; 12 (3): 161–164. DOI: 10.1016/s1038-3188(99)00011-x.
- Ferguson-Smith MA. Karyotype-phenotype Correlations in Gonadal Dysgenesis and Their Bearing on the Pathogenesis of Malformations. J Med Genet 1965; 2 (2): 142–155. DOI: 10.1136/jmg.2.2.142.
Última actualización: 2025-09-21 13:35