38: 泄殖腔畸形
阅读本章大约需要 9 分钟。
引言
肛门直肠畸形涵盖了涉及直肠和肛门的一系列先天性畸形。患有肛门直肠畸形(ARM)的儿童常被诊断为”肛门闭锁”,因为在正常应有肛门开口的位置没有开口。这个称谓过于简化了其潜在的病理学改变,后者常常累及泌尿生殖系统、脊柱和骨盆底肌群。位于该谱系一端的是较轻的畸形,其中肛管存在,但肛门前移或被会阴皮肤覆盖。随着畸形程度加重,直肠未能到达会阴,而是与泌尿生殖道相通。
女童肛门直肠畸形中最严重的表现是泄殖腔畸形,其中直肠、尿道和阴道汇合为一条单一的共同通道,并开口于会阴部。典型情况下,泄殖腔的会阴开口位于会阴的前部,即正常尿道外口所在的位置。后位泄殖腔异常是一种罕见的变异,其开口向后偏移,泌尿生殖窦开口于正位直肠内或仅位于其前方。1,2
胚胎学与流行病学
泄殖腔畸形的发生率约为每 25,000–50,000 例活产中 1 例。其胚胎学病因尚未完全明确,但涉及在妊娠早期由泌尿直肠隔和 Rathke 褶对原始泄殖腔的分隔失败。3 异常的泄殖腔分隔与在时间和空间上近邻形成的其他器官系统的异常发育有关,包括椎骨、输尿管、肾脏以及苗勒管衍生物。当一个孩子出生时患有肛门直肠畸形(ARM)时,其今后出生的同胞患 ARM 的风险为 1%。4
在泄殖腔畸形中,阴道、直肠和尿道合并为单一共同通道。阴道积液可在阴道被尿液和黏液充满时发生,而扩张的阴道腔可通过对输尿管或膀胱出口的外压迫导致泌尿道梗阻。共同通道较长(> 3 cm)的患儿更易合并骶骨发育不良及其他先天畸形,直肠和尿道括约肌肌群发育较差,且更可能需要更为复杂的外科重建,包括阴道重建。
发病机制与相关畸形
患有肛门直肠畸形的患者常见泌尿系统异常,但总体上未被充分认识。该问题在合并泄殖腔畸形的女童中尤为常见。儿科医生、小儿外科医生和泌尿外科医生必须认识到这些患者中泌尿系统合并症的高发生率,且所有患者都应接受泌尿生殖系统异常的筛查。文献报道 ARM 患者相关泌尿生殖系统异常的发生率差异很大,范围为 18% 至 85%。5 这种差异主要可归因于筛查是否充分的不同。大多数采用主动筛查方案的系列研究报告称,在所有 ARM 类型中患病率约为 50%,且在更严重的 ARM 亚型中泌尿系统异常的发生率更高。6 泄殖腔畸形是女性肛门直肠畸形中最严重的亚型,且绝大多数此类患者会有泌尿生殖系统合并症(表 1)。这强调了在为肛门直肠畸形患者提供诊疗所需的多学科团队中,将泌尿外科医生纳入核心成员的重要性。5,7
表 1 在俄亥俄州哥伦布的Nationwide Children’s Hospital接受治疗的712名肛门直肠畸形患儿中泌尿系统异常的患病率。大多数报告的泌尿系统异常的患病率随ARM严重程度增加而升高。括号内给出了患病率范围,范围从轻型ARM(会阴型)到重型ARM(女性为长共同通道型泄殖腔畸形,男性为膀胱颈瘘)。不同ARM类型间无差异的异常以星号标注,且不报告范围。下尿路功能障碍和苗勒管(Müllerian)异常未纳入本分析。改编自 Fuchs 等,2021 年。6
| 泌尿系统异常 | 泄殖腔 < 3 cm (n=55) |
泄殖腔 > 3 cm (n=60) |
|---|---|---|
| >1 项泌尿系统诊断 | 72.7% | 93.9% |
| >2 项泌尿系统诊断 | 36.4% | 71.7% |
| 肾积水 | 47.3% | 76.7% |
| 膀胱输尿管返流 | 21.8% | 31.8% |
| 单肾 | 12.7% | 25.0% |
| 肾融合畸形 | 7.3% | 11.7% |
| 重复肾 | 5.5% | 8.3% |
上尿路畸形
在肛直肠畸形患者中,合并上、下尿路解剖异常的比例为50–60%。常见的异常包括肾积水、膀胱输尿管返流、肾发育不良、肾发育缺如、重复畸形,以及异位变异,包括单纯性肾异位、交叉融合性肾异位、马蹄肾和输尿管异位。上尿路异常的模式(连同男性生殖器异常)来自一项近期稳健的单一系列研究,已汇总于表1.6
除了解剖结构异常外,据报道,患有泄殖腔畸形的女孩中近50%会发生严重的肾功能损害。因此,早期发现肾功能损害至关重要,同样重要的是对下尿路进行积极的监测与管理。8
下尿路功能障碍
膀胱功能障碍在所有患有肛门直肠畸形(ARM)的患者中很常见。这通常与共存的脊柱异常有关;然而,一些儿童即使骶骨的骨性结构和脊髓均正常,仍会有先天性的膀胱功能障碍。9,10 尤其在泄殖腔畸形中,获得性膀胱功能障碍可能源于肛门直肠畸形修复术过程中发生的神经肌肉损伤。11,12 尽管采用精细的手术技术并尽量减少单极电凝的使用是明智之举,但由于ARM患者的盆腔自主神经丛位置更靠近中线,某些神经肌肉损伤可能仍难以避免。13 对于轻型ARM且脊柱影像学正常的患者,使用尿流测定进行筛查可能已足够;但我们主张所有合并泄殖腔畸形的女童均应接受尿动力学评估。
生殖器畸形
女性生殖道的异常在外部检查中不易发现,然而在患有 ARM 的女孩中,苗勒管异常非常常见。14 泄殖腔畸形与内部生殖器异常的发生率极高有关,报道范围为 53%~67%。15 常可见不同程度的苗勒管重复,自阴道中隔至完全的子宫和阴道重复皆可。苗勒管结构也可能发育不全,且重复生殖道常见不对称。明确患有 ARM 的女孩的苗勒管解剖至关重要。阴道积液常见,可导致疼痛、尿路梗阻、感染以及不孕。临床医生必须在新生儿期评估并处理阴道积液,其时阴道内液体主要为滞留于生殖道中的尿液;并在青春期初潮后再次评估处理,此时经血可潴留于阴道(可为多个)内。月经梗阻的发生率据报道约为 40%。8 在这些患者中,阴道梗阻可为先天性,亦可由于阴道狭窄所致,而后者在后矢状肛直肠-阴道-尿道成形术(PSARVUP)后较为常见。14,16
脊柱异常
患有 ARM 的患者中,约有四分之一到三分之一存在相关的椎体或脊髓病变。17,18,19 就泄殖腔畸形患者而言,小样本系列提示脊柱异常的发生率更高(超过70%),但一项近期的大型回顾性研究报告其中有42%的患者存在脊柱病变。20,21 常见异常包括脊髓栓系、骶骨发育不全、半骶骨(与骶前肿块相关。脊柱病变可导致泌尿、神经和骨科并发症。17 常规脊柱影像学检查是标准的护理措施,且存在脊柱病变的儿童需要监测神经源性膀胱。
VACTERL 关联
多种综合征和遗传性疾病已被描述,其中将肛门直肠畸形作为其特征之一。其中最重要的是 VACTERL 关联,尽管还描述了许多其他情况。VACTERL 是以下术语的首字母缩写:v椎体畸形、a肛门直肠畸形、c心脏畸形、t气管e食管瘘、r肾脏畸形,以及 l肢体畸形。大多数病例为散发而非遗传。并非所有 VACTERL 关联的组成部分都会在每位患者中表现出来。最常见的是椎体、肛门直肠和肾脏异常。诊断 VACTERL/VACTER 综合征需要至少存在 3 项缺陷。22 其他常与肛门直肠畸形相关的综合征包括 MURCS(苗勒管发育缺如、肾发育缺如以及颈胸段体节发育不良)、OEIS(脐膨出、膀胱外翻、肛门闭锁以及脊柱缺陷)。23
评估与诊断
产前
由于并发畸形和阴道积液发生率增高,泄殖腔畸形可在产前被诊断。产前诊断的优势有二:一是可以对父母进行咨询,二是可安排在熟悉新生儿肛门直肠畸形管理的中心分娩。产前超声的线索包括:肠管扩张、胎粪钙化、直肠内无胎粪、阴道积液(通常表现为盆腔囊性结构并伴膀胱显像不清)、肾脏异常、神经管缺陷以及桡骨缺如等。多系统异常可增强对 VACTERL 或其他伴有肛门直肠畸形的综合征的怀疑。一些中心尝试进行产前 MRI 以期确认诊断,但这同样并不完善,且目前并非标准护理做法。24,25
体格检查
虽然可以在产前影像上怀疑泄殖腔畸形的产前诊断,但确诊依赖于出生后的体格检查。进行会阴和外生殖器检查时,泌尿科医师应评估会阴开口的数量和位置以及臀裂。对于女孩,应有三个彼此分离的会阴开口(尿道、阴道、肛门),肛门口应位于肛门括约肌复合体的中心,并由会阴体与阴道分隔。女孩出现单一的会阴开口对泄殖腔畸形具有诊断特异性,且通常位于预期的尿道位置。会阴外观可能存在很大差异,但单一开口是体检中的关键发现(图 1)。一种较少见的泄殖腔畸形变异称为后位泄殖腔变异,其会阴开口更靠后,位于原本应为阴道或肛门的位置(图 2)。偶尔,突出的阴蒂包皮会呈现出阴蒂肥大的外观。在未触及到增大的海绵体结构的情况下,不应因此常规进行针对性发育障碍的内分泌学评估。26
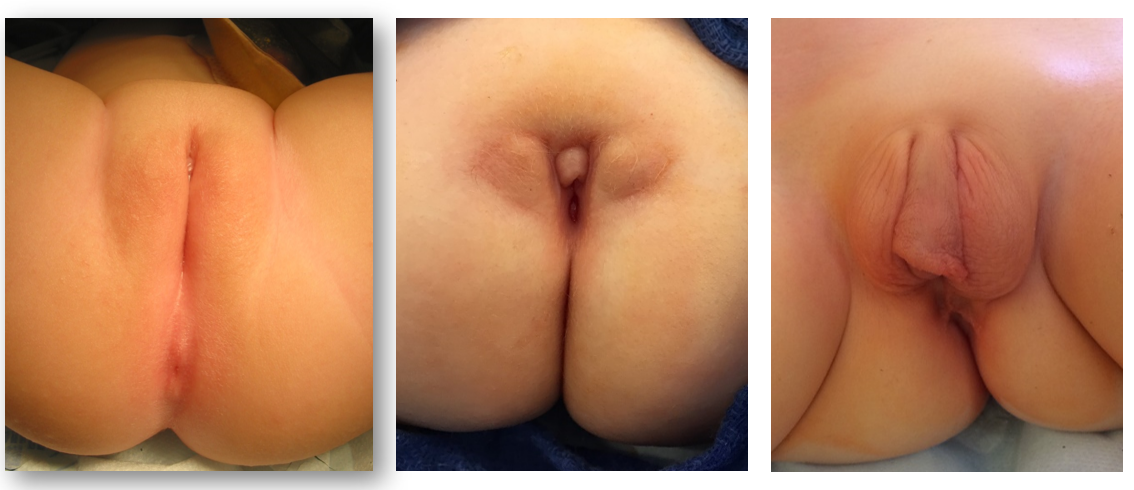
图 1 患有泄殖腔畸形的女童的会阴部照片。肛门开口缺如,唯一的会阴开口位于阴蒂后方,接近预期的尿道口位置。阴蒂包皮冗余很常见。
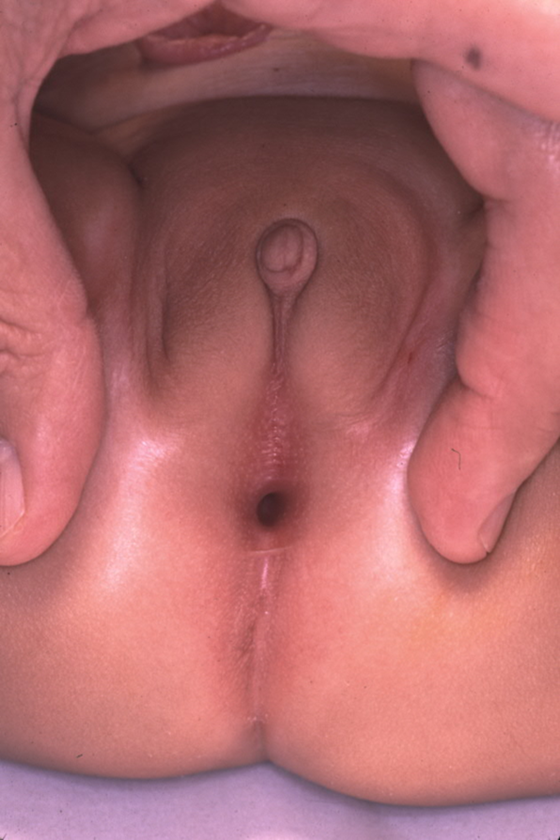
图 2 后位型泄殖腔畸形,单一会阴开口向后移位,朝向预期的肛门位置。
实验室检查与影像学检查
后续的检查重点在于评估潜在的合并畸形。
超声心动图
这对于评估结构性心脏异常是必要的,尤其是在麻醉前。
完整腹部超声检查
评估是否存在肾脏畸形、泌尿道梗阻、阴道积液,以及苗勒管重复畸形。
脊柱影像
应进行脊髓超声检查,主要用于评估是否存在脊髓栓系。常规X线摄片在尾骨骨化后有助于评估骶骨。骶骨的前后位和侧位X线片可显示骶骨异常,如半骶骨和骶椎半椎,并可评估骶骨发育不全的程度。通常,发育不全越严重,控禁功能结局越差。27 对“骶骨比值”的测量已被提出可作为肠道控便的预后指标,但尚未被证明可靠用于预测尿控、神经源性膀胱的发生或是否需要间歇性导尿。28
对于存在脊柱异常的患者,应进一步进行神经外科评估和脊柱MRI检查,并需要就神经源性膀胱进行持续的泌尿科监测。在出生后3–4个月以后就诊的儿童需要进行脊柱MRI检查,因为椎弓的骨化会遮挡超声声窗。
肾功能检查
测定血清肌酐以评估基线肾功能。请注意,儿童肾功能评估并不完善,而新生儿的肾脏未成熟可能导致对肾功能的低估,尤其在早产儿中。胱抑素C正越来越多地作为血清肌酐的补充指标使用。
根据临床指征通常会进行额外的影像学检查。在因阴道积液或膀胱扩张导致肾积水的情况下,阴道积液引流后应复查肾脏超声以确认肾积水是否改善。若担心肾引流不良或需评估相对肾功能,可考虑进行肾脏显像或MR尿路造影。VCUG 可用于筛查膀胱输尿管返流,但常规术前行排尿性膀胱尿道造影的作用仍有争议,且盲插膀胱导尿可能较为困难。最后,尽管尿动力学异常的发生率较高,尿动力学检查无需在外科重建前进行,可于术后再开展。
术前计划
其余的检查评估用于明确解剖结构,为外科重建做准备。
结肠造影
高压远端结肠造影可界定直肠瘘的水平,评估可用于牵引成形的远端结肠长度,并确定直肠与骶骨和尾骨的关系。结肠造口建立后,将弗利导尿管插入黏液瘘内,轻轻充盈囊球以防渗漏。随后通过导管注入造影剂,使远端结肠显影。注入造影剂的压力必须足以克服提肛肌的张力;鉴于结肠穿孔虽少见但可能发生,所用造影剂必须为水溶性且等渗。或者,可采用”倒置片”来评估肛门或直肠闭锁的缺损程度。先用不透射线标记物标记肛门,将婴儿倒置,使直肠内的气体上升至最高点,然后拍摄侧位片。直肠内气体与不透射线标记物之间的距离即为直肠至会阴皮肤的距离。
内镜检查
膀胱镜检查和阴道镜检查对于泄殖腔畸形或泌尿生殖窦畸形修复的术前计划至关重要。这可与转流性结肠造口术或其他手术同步安排,以避免不必要的麻醉。内镜可明确共同通道的长度以及从膀胱颈到汇合处的距离,评估膀胱颈和括约肌复合体的特征,并评估膀胱与输尿管。若缺乏正位输尿管开口,应怀疑存在异位输尿管。阴道镜检查将显示是否存在阴道中隔、重复阴道,以及为未来重建所需的阴道(单个或多个)大小。
确定阴道汇合处相对于膀胱颈的位置尤为重要。29 该距离代表尿道长度,并且对手术修复和控尿结局具有重要意义。30 尿道长度越短,提示畸形越为严重。29
生殖道造影
透视下生殖道造影常用于描绘泌尿、妇科及直肠结构。将Foley导尿管置入会阴开口并注入造影剂。传统二维透视检查易受被造影剂显影的结构重叠影响,因此在界定三维关系和获得准确测量方面能力有限,这凸显了进行内镜评估的必要性。许多中心现已采用三维计算机断层扫描或磁共振成像来描绘复杂畸形的解剖结构 (图3).31,32
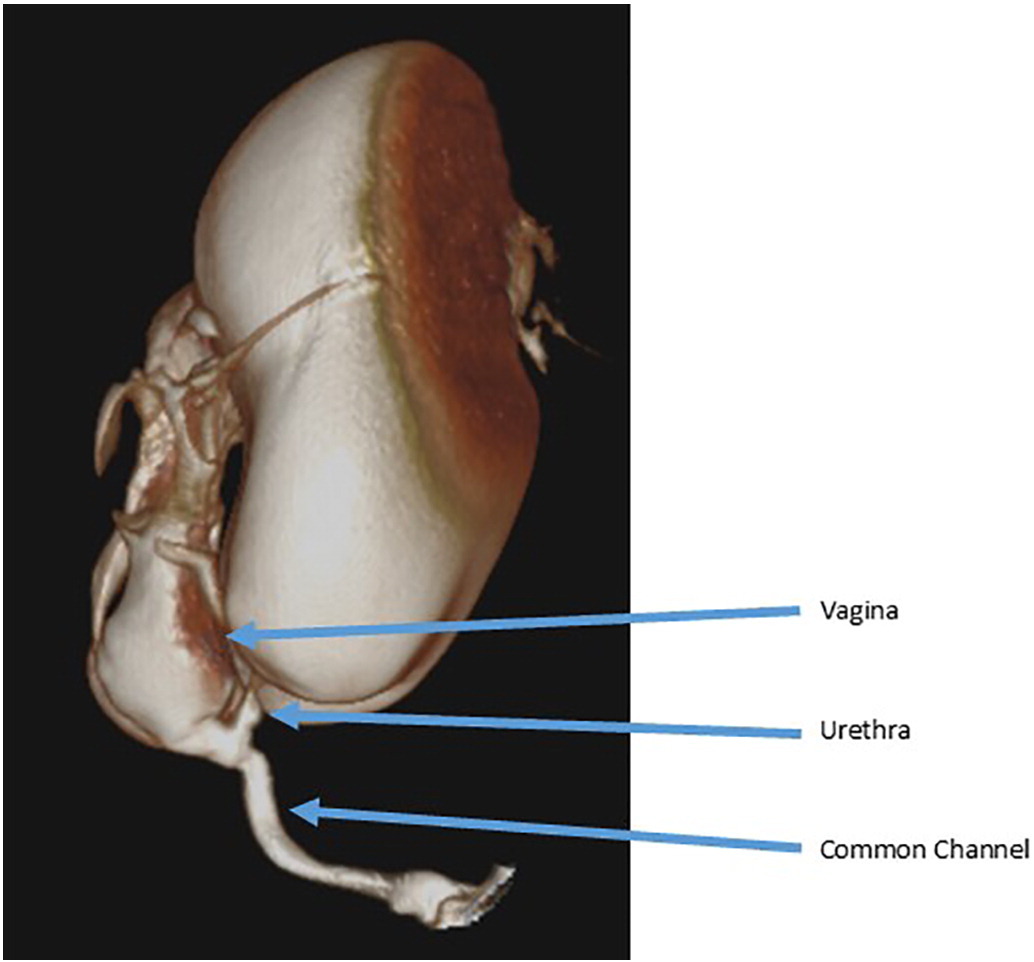
图 3 三维泄殖腔造影示例,显示长共同通道、高位阴道汇合及短尿道。
三维泄殖腔造影(或常规盆腔磁共振成像)也有助于明确苗勒管解剖以及输尿管异位。泌尿科医生应当了解一种称为阻塞性半阴道伴同侧肾异常(OHVIRA)的情况,其中一侧半阴道被阻塞,因此阴道镜检查将仅显示一个阴道和一个宫颈。对于超声提示而与内镜检查结果不一致的苗勒管畸形,应进一步评估,并且在有机会时(例如初次行分流性结肠造口术时)应直接检查内生殖器。16
治疗选择、结局和并发症
新生儿期
在新生儿期,确保婴儿得到充分的复苏并对受阻的器官系统进行减压至关重要。初始处理必须在新生儿期进行结肠造口及黏液瘘,通常在出生后最初的24–48小时内完成。这样可使结肠减压,并将粪流与泌尿道分离。
阴道积液的管理
阴道积液和膀胱扩张并充盈液体在患有泄殖腔畸形的女童中很常见,其发生是由于远端尿路梗阻导致尿液逆流进入阴道。阴道扩张可严重到引起上尿路梗阻,尿液还可经输卵管逆流至腹腔,造成尿性腹水。关于新生儿期阴道积液的处理尚无共识,但若存在梗阻性泌尿病变则需要行引流。传统上通过阴道造口、经皮阴道造口管或膀胱造口进行外科减压以实现引流。近年来,创伤更小的共同通道清洁间歇性导尿已被采用。33 当对共同通道进行置管时,导尿管通常更倾向于进入阴道而非膀胱。在比较两种减压方法(手术与CIC)时,肌酐变化趋势无差异,这为CIC作为阴道积液减压的良好、非侵入性初始选择提供了有力证据。33 如果存在阴道中隔,阴道造口可能只能引流阴道一侧,无法充分减压整个系统。在此情况下,可在阴道另一侧行造口,或切开阴道中隔,以实现更充分的引流。
对于所有阴道积液减压方法,一个重要原则是进行随访以确认引流成功。在为阴道积液开始CIC后,应通过超声确认阴道已减压且泌尿道扩张已消退。若未成功,应考虑更具侵袭性的方案。如果尽管已对阴道进行减压但肾积水仍持续存在,应完成对其他导致输尿管肾积水的病因的评估,并应考虑神经源性膀胱。
膀胱管理
许多患有泄殖腔畸形的女孩在膀胱排空方面并不需要任何干预。若发现膀胱顺应性差或为高压状态并伴不完全排空,可行皮肤膀胱造口术,以实现对尿路的充分减压。清洁间歇导尿通常不可行,因为如上所述,由于尿道起始部常以前位,导尿管更倾向于进入阴道。对于存在高级别膀胱输尿管返流或反复感染的女孩,也可能需要行皮肤膀胱造口术。同样,需要通过超声确认尿路的引流与减压。
泄殖腔畸形的手术修复
修复时机
在受阻的器官系统已解除梗阻并减压后,泄殖腔畸形的一期外科修复不必立即进行。这种延迟既为家庭与患儿之间的亲密联结提供充足时间,也为组建参与患儿照护的多学科团队提供时间。这一时期还可优化营养状态与体力。关于最佳修复年龄尚无共识,但研究表明,出生后 < 6 个月进行修复的术后并发症发生率更高,尤其是切口裂开,且多数人认为 6–12 个月龄似乎是一期修复的理想时机。34
手术技术
手术入路取决于泄殖腔造影和膀胱阴道镜检查所示的解剖情况。用于修复的手术技术有两种:泌尿生殖道整体游离术和泌尿生殖分离术。手术修复的原则是将尿道、阴道和直肠游离并下拉至会阴,使其形成三个彼此独立的开口。该操作通过后矢状切口完成,必要时可联合开腹术。婴儿取俯卧位的后矢状入路是初始入路。与截石位相比,此体位有助于更好地显露解剖结构。首先,识别直肠进入共同通道的位置,并向上游离至腹膜反折处。手术进行至此时,可实施泌尿生殖道整体游离术或泌尿生殖分离术。
泌尿生殖分离
泌尿生殖分离术是最初用于修复泄殖腔畸形的技术,并由 Hendren 推广为标准术式 (图 4, 图 5, 图 6, 图 7, 图 8, 图 9, 图 10).35 它仍是共同通道长度 > 3 厘米的女童的首选术式。在泌尿生殖分离术中,将直肠、阴道和尿道分离,并分别牵至会阴。将直肠自共同通道游离后,再将阴道从尿道后壁、膀胱颈及膀胱仔细分离。随后在导尿管支撑下对因阴道游离而形成的尿道缺损行一期缝合关闭。该分离操作具有一定难度,应注意避免造成泌尿道去血管化或去神经化。应尽可能向上游离阴道,使其能无张力地到达会阴皮肤。若阴道仍无法到达,可能需要经腹入路以最大化游离。一旦阴道能够到达皮肤,即将其牵降至会阴皮肤,在尿道后方固定,随后向两侧环行塑形以形成新阴道入口。随后重建会阴体,并将直肠置于肌肉复合体内。若在游离后阴道仍不能到达,已有其他阴道成形术被描述,如阴道转换术、肠段间置移植,或在张力下牵降原生阴道,预期其可能瘢痕化并在青春期初期需要行阴道入口成形术或颊黏膜阴道成形术。关于阴道成形术技术的选择需由妇科、结直肠外科与泌尿外科进行多学科讨论,并应在术前与患儿家庭进行沟通。
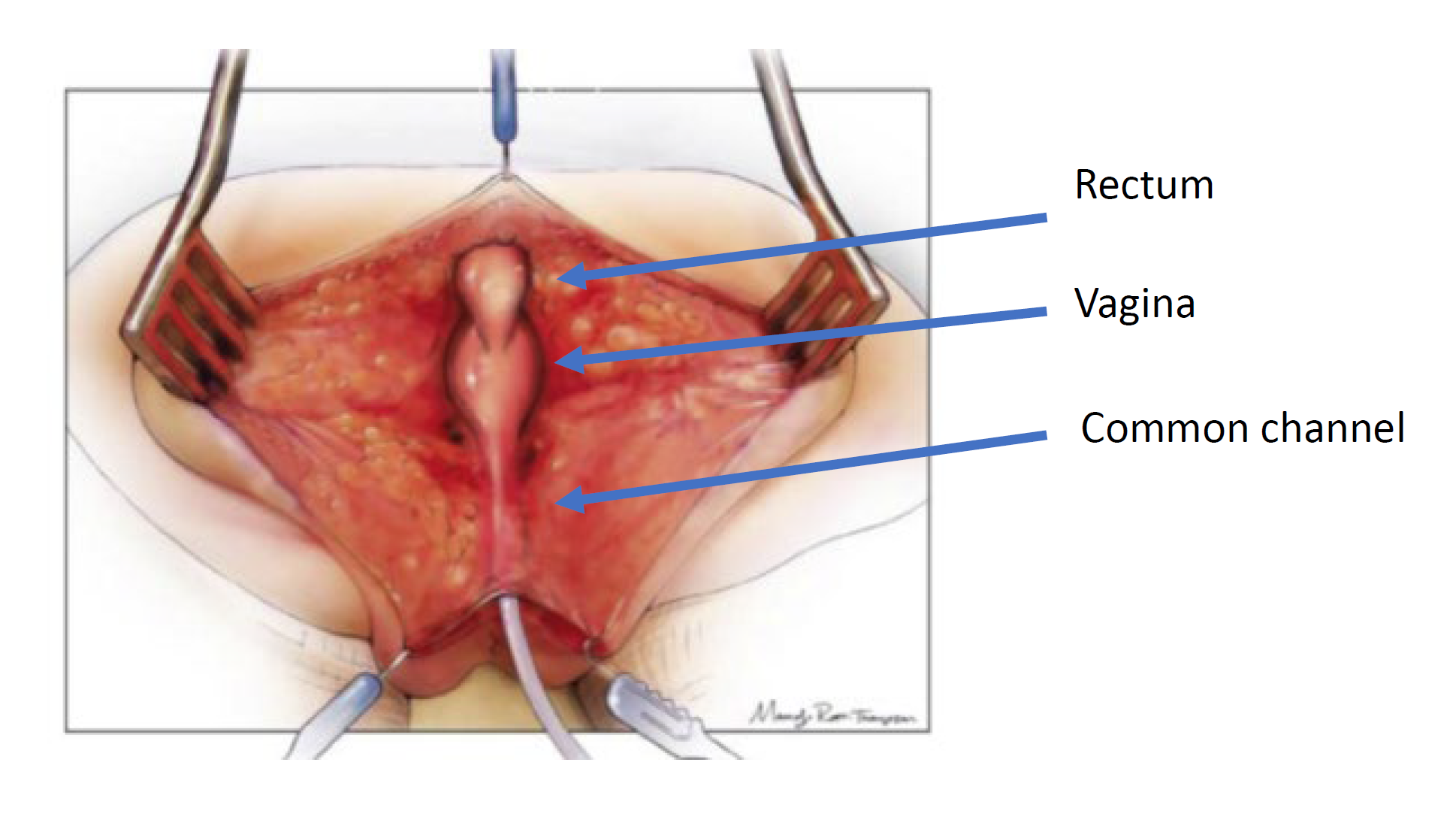
图 4 泌尿生殖道分离的示意图。患者处于俯卧位,已行后矢状切口,暴露了直肠、阴道和共同通道的后壁。(续见图 5)
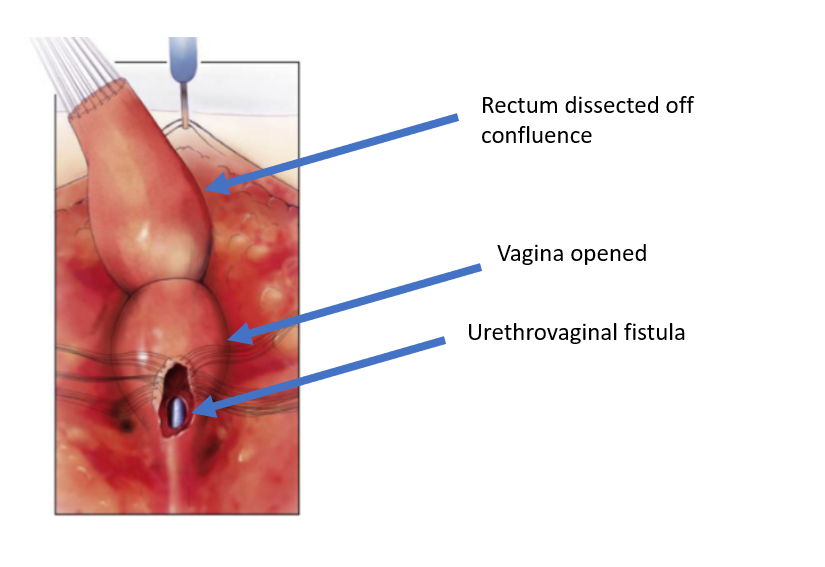
图 5 直肠已从阴道汇合处游离,留下了阴道内的一个开口。 (承接自图 4, 续至图 6)
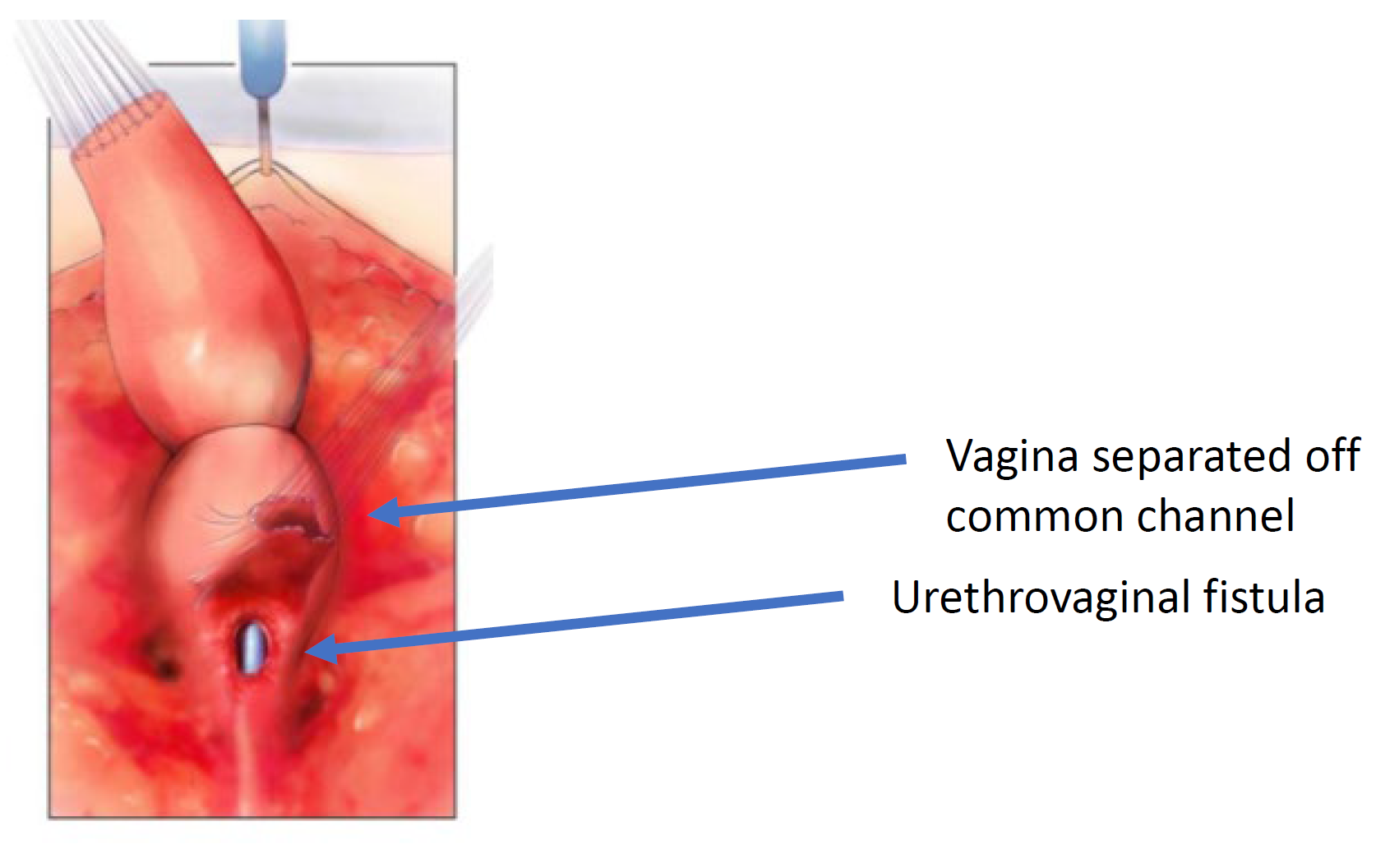
图 6 阴道已在其与尿道的汇合处从共同通道上游离。可见导管通过的开口即为尿道阴道瘘。(续自图 5,续至图 7)
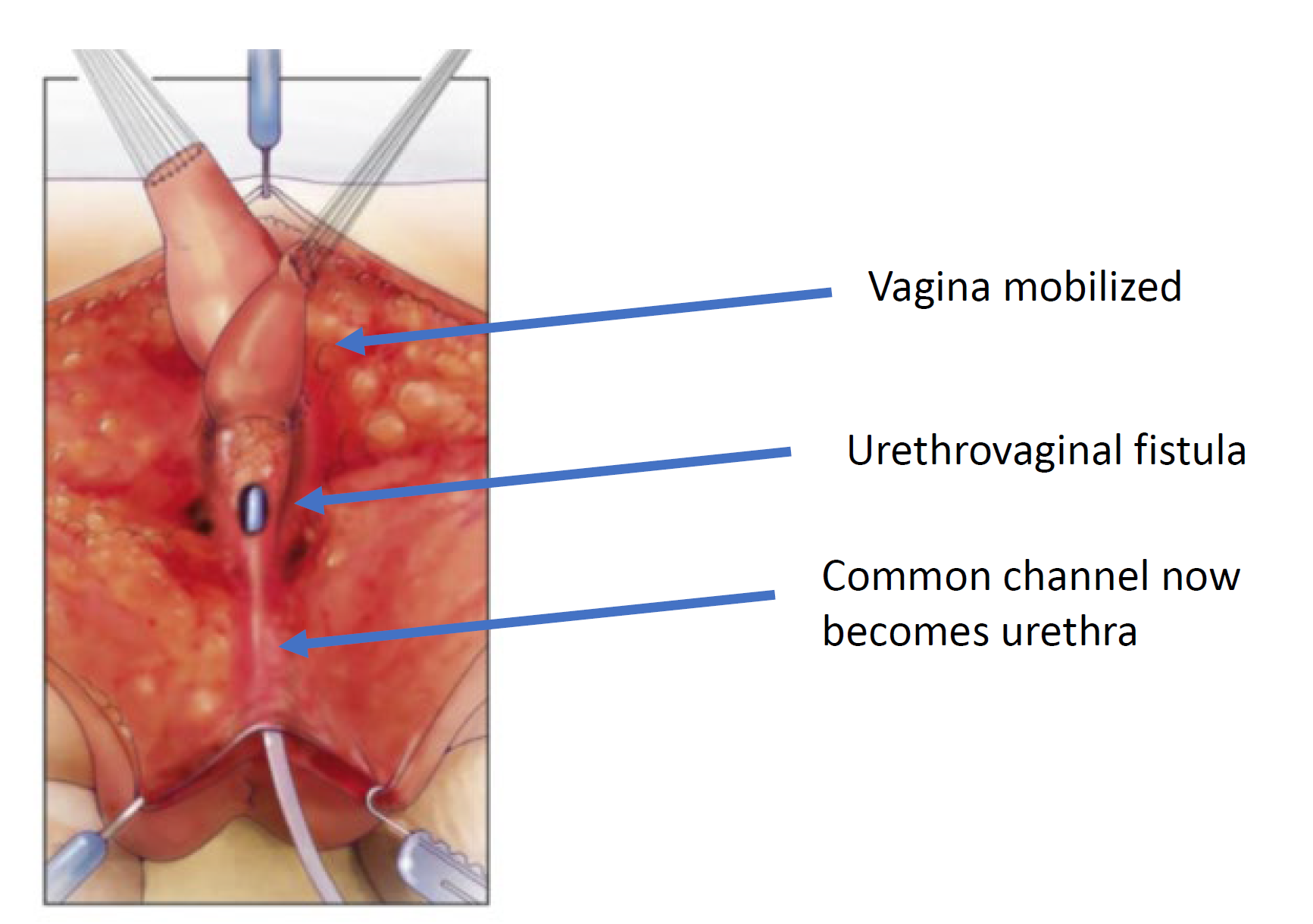
图 7 阴道向近端游离,以获得足够的长度和弹性,使其能够到达会阴。(承接自图 6,续至图 8)
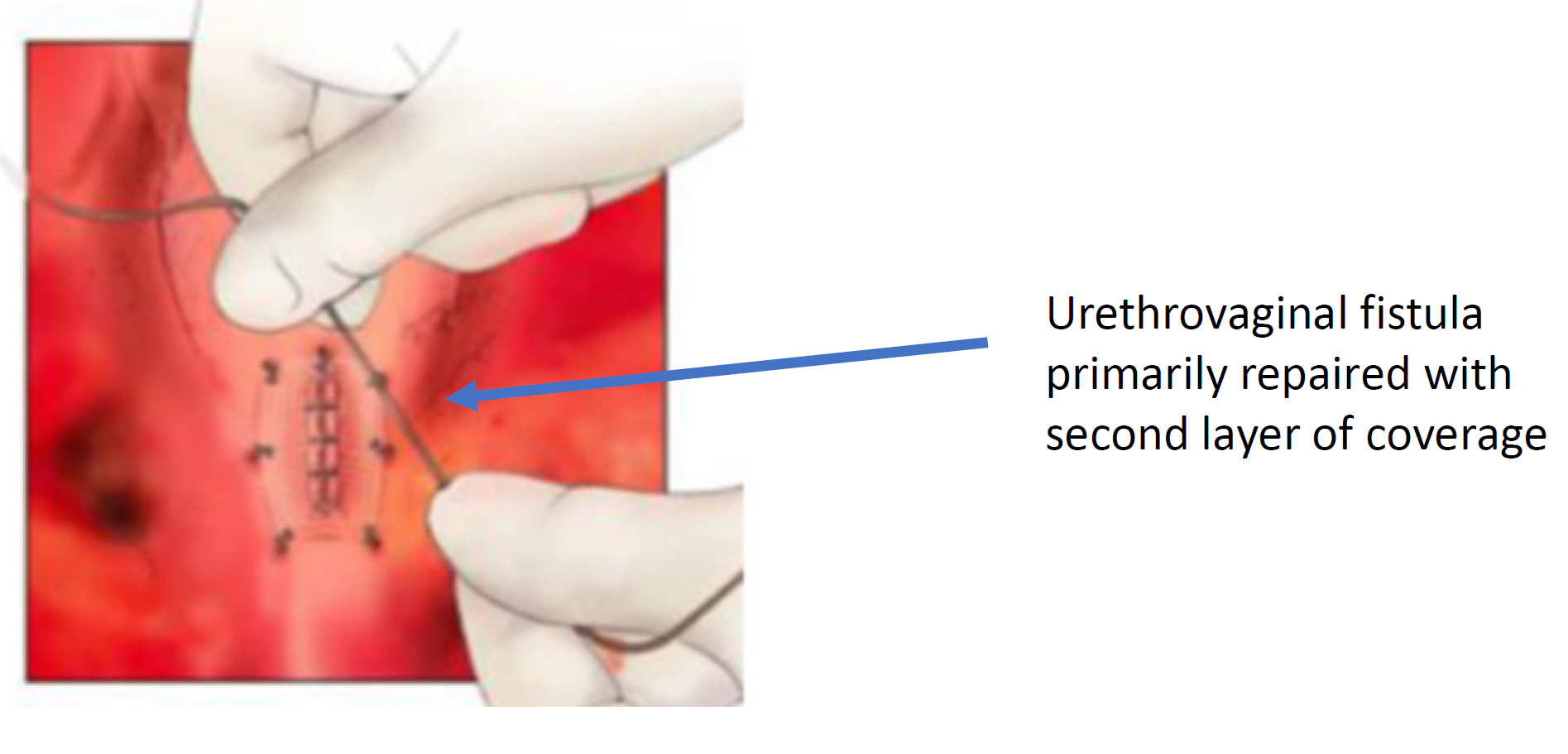
图 8 尿道阴道瘘已闭合。(续自图 7)
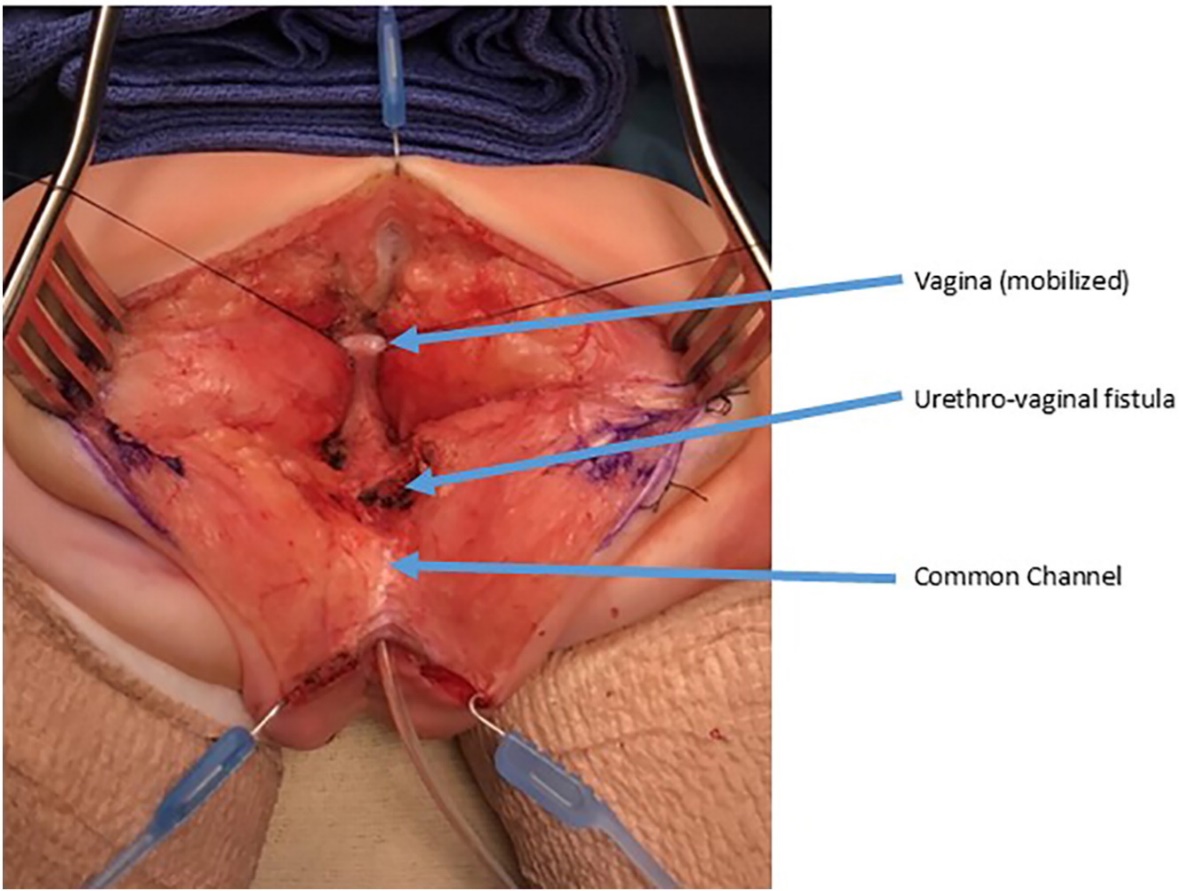
图 9 泌尿生殖分离术中的照片。已行后矢状切口。共同通道内置有导管。阴道以牵引缝线牵引固定。阴道与尿道的汇合处标注为尿道阴道瘘,待将阴道与尿道分离后予以关闭。(续见图 10)
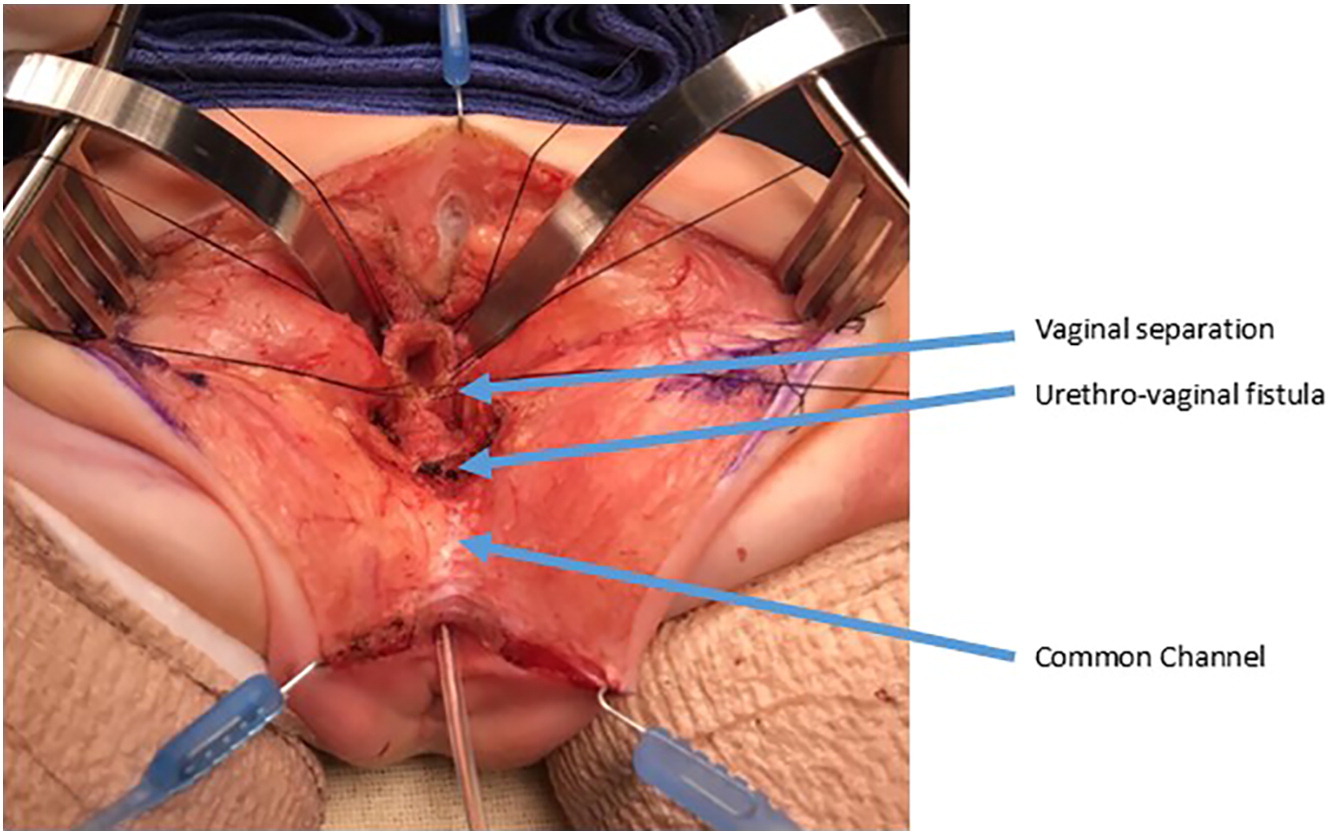
图 10 泌尿生殖道分离术的术中照片。阴道已被切开并与尿道分离。随后将向近端游离阴道,以获得足够长度使其能够到达会阴。尿道阴道瘘再次予以标记,并将在导尿管留置的情况下行分层原发闭合。 (续自图 9)
全泌尿生殖道游离术
Peña 于 1997 年首先将全泌尿生殖道整体游离术用于泄殖腔修复,并认为这是一种“更简便的泄殖腔处理方法”,因为它不需要将阴道与泌尿道分离(图 11, 图 12, 图 13).36 相反,这是一种拉出技术,通过游离泌尿生殖窦,直到汇合部达到会阴,在此处将尿道与阴道分离,并与会阴吻合。Peña 提出该技术可减少尿阴道瘘以及对泌尿道血供的破坏。由于泌尿道的游离程度不如阴道,因此采用该技术对共同通道的可游离长度存在局限;它最适用于共同通道较短(< 3 cm)的泄殖腔畸形。当直肠自共同通道游离后,从会阴对共同通道进行环周游离,并开放共同通道,直至尿道与阴道的汇合部无张力地到达会阴皮肤。将共同通道劈开并用于阴唇成形术。将尿道吻合至入口的前缘,紧邻阴蒂组织之后方。尿道与阴道入口均在无张力下与皮肤吻合。重建会阴体,并在括约肌复合体内将直肠牵至皮肤。
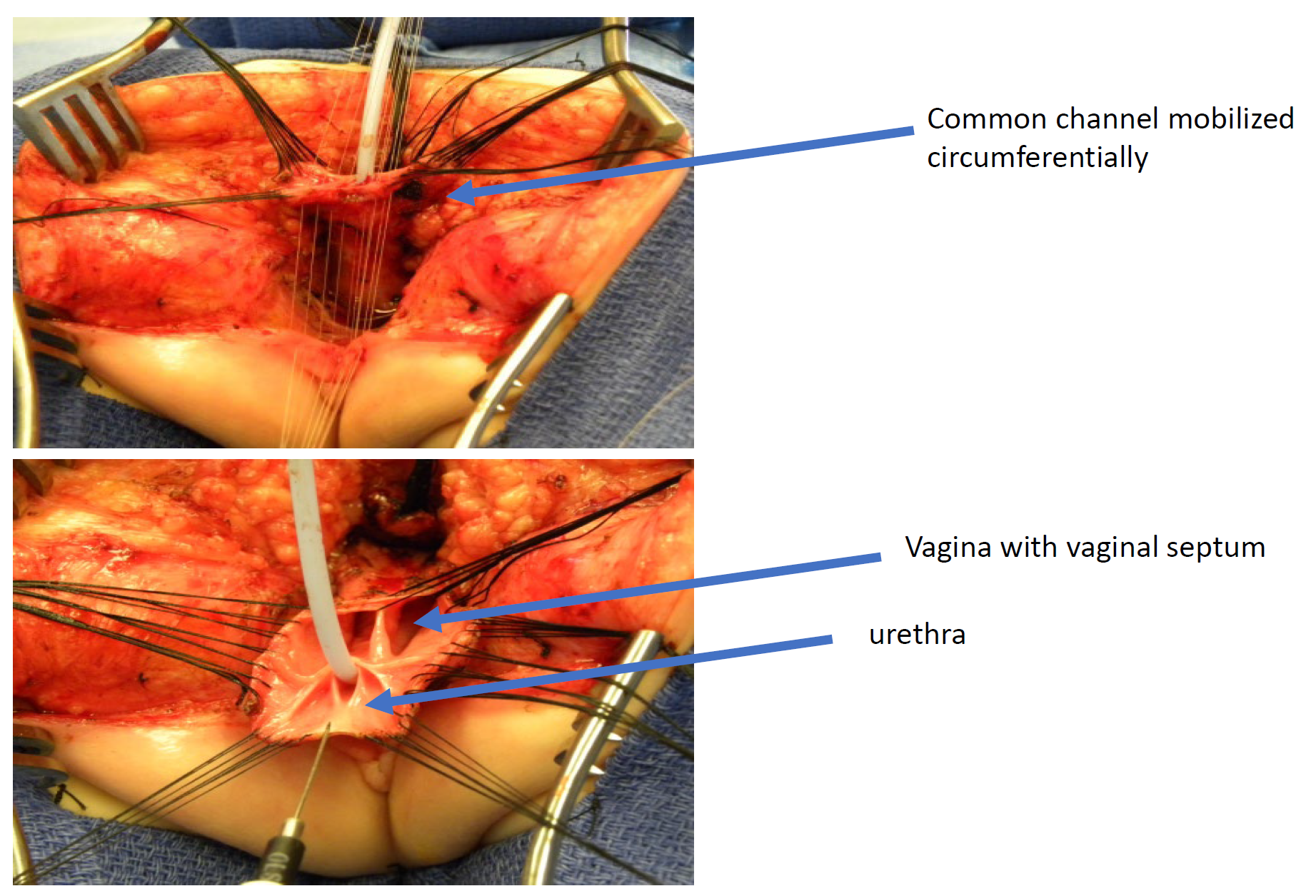
图 11 全泌尿生殖道动员(TUM)泄殖腔修复的术中照片。已行后矢状切口,且共同通道和阴道已被一并向会阴方向游离。在此照片中,直肠已被分离。
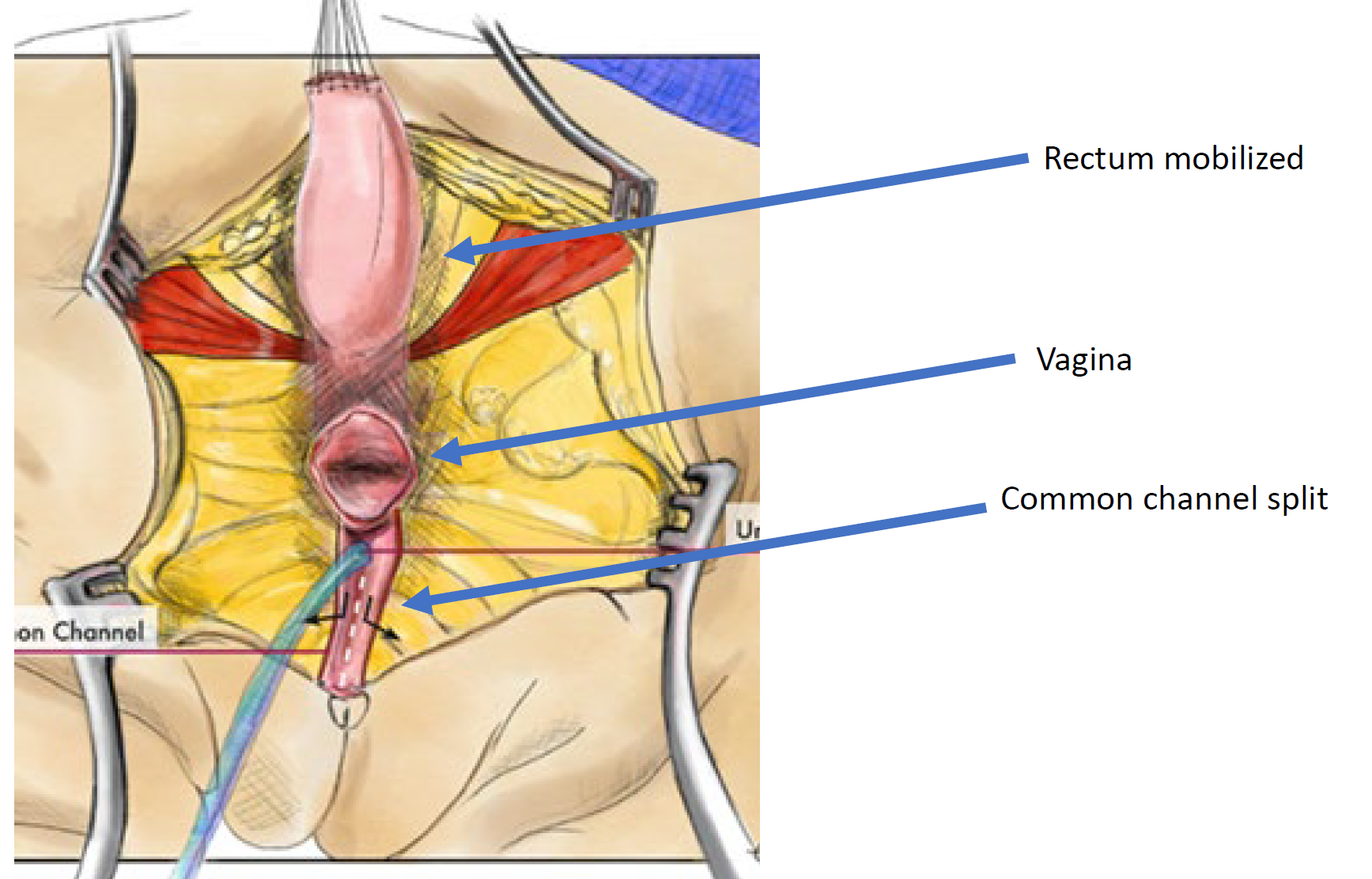
图 12 全泌尿生殖道游离(TUM)泄殖腔修复的示意图。游离在汇合部到达会阴且尿道、阴道和直肠可分别与会阴吻合时即告完成。将共同通道分开,并旋转冗余组织以铺衬阴道口。(续见图 13)
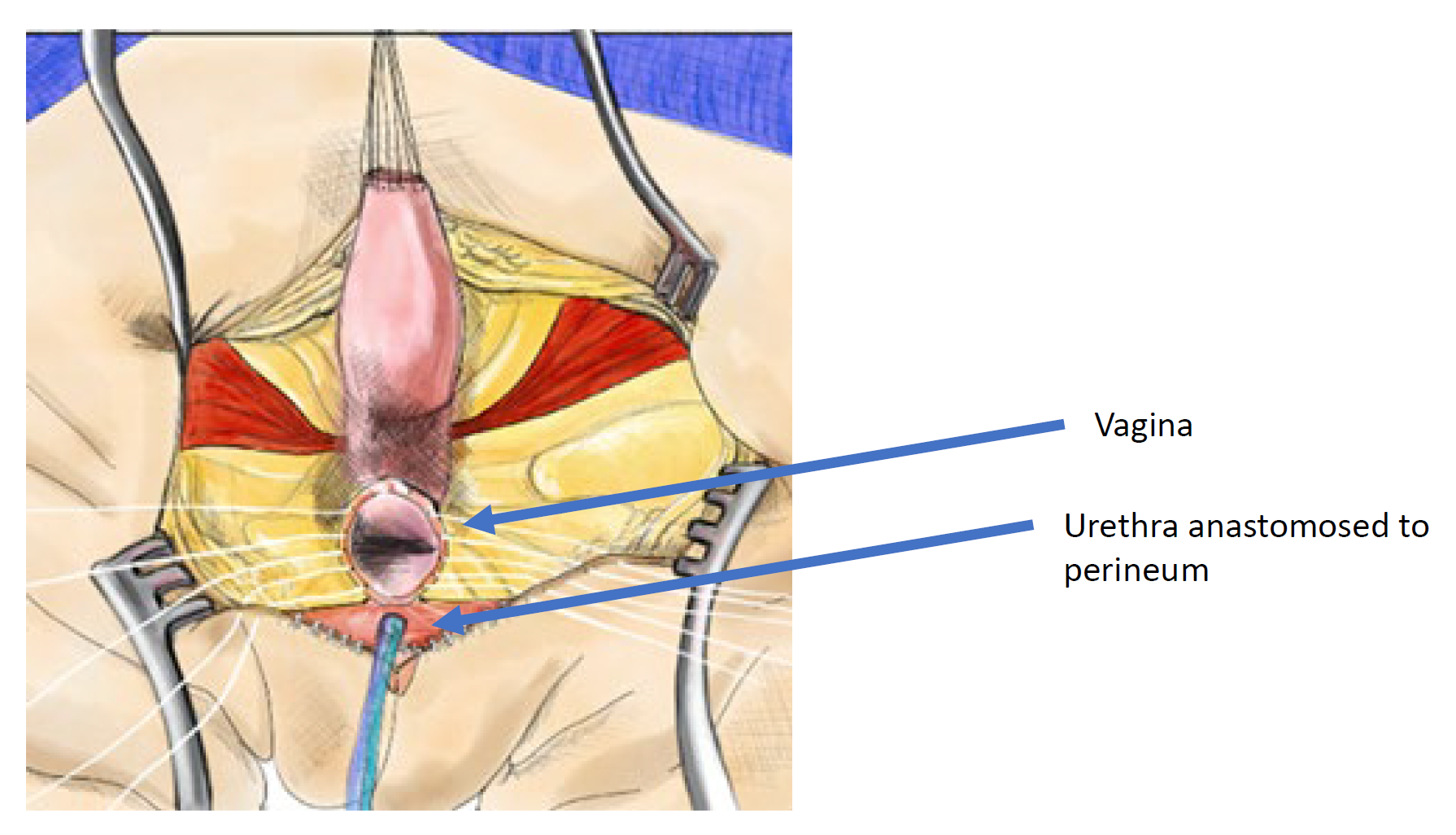
图 13 全泌尿生殖道游离(TUM)泄殖腔修复的示意图。当汇合处到达会阴,且尿道、阴道和直肠可分别与会阴吻合时,即完成游离。将共同通道分开,并将多余组织旋转用于铺衬阴道口。(续自图 12)
确定术式
历史回顾
泌尿生殖分离术曾是泄殖腔修复的主要技术,且常需联合后矢状切口与开腹手术。该技术对术者要求高且耗时。一位手术量大的外科医生的早期报告显示了尚可的结果:58.8% 可自主排尿,28.4% 进行CIC,2.8% 行尿流改道。35 该研究报告了”尿控”,但未提供关于尿路意外、排空或肾功能的细节。Peña 对全泌尿生殖动员术的描述为泄殖腔畸形引入了一种更为简便的处理方法。在大量TUM手术后,他报告手术时间和住院时间缩短,以及尿控(74%)和自主排便的改善。37 然而,他也指出,对于共同通道较长(> 3 cm)的泄殖腔病例,术中决策复杂度很高,且常见的是在共同通道完全游离但无法到达后,将阴道自已游离的共同通道上分离,导致尿道与膀胱颈被环周游离,血供受损并可能去神经化。这使尿道面临去血管化及坏死的风险。
1990年代后期的这两次重要经验促成了一个基于共同通道测量的手术算法。短共同通道(< 3 cm)最适合行全泌尿生殖道游离,而长共同通道(> 3 cm)则建议行泌尿生殖道分离,可合并或不合并开腹或腹腔镜操作;若阴道无法到达皮肤,则需行肠段间置移植。该算法高度依赖对共同通道的准确测量。测量可在内镜直视下进行,或依据二维或三维重建的泄殖腔造影(图 14)。然而,三维重建的泄殖腔造影已被证明是测量共同通道最准确的方法,并且使经验较少的外科医生和受训者能够以与资深外科医生相同的水平理解这一复杂解剖,从而提升手术准备度。38,39
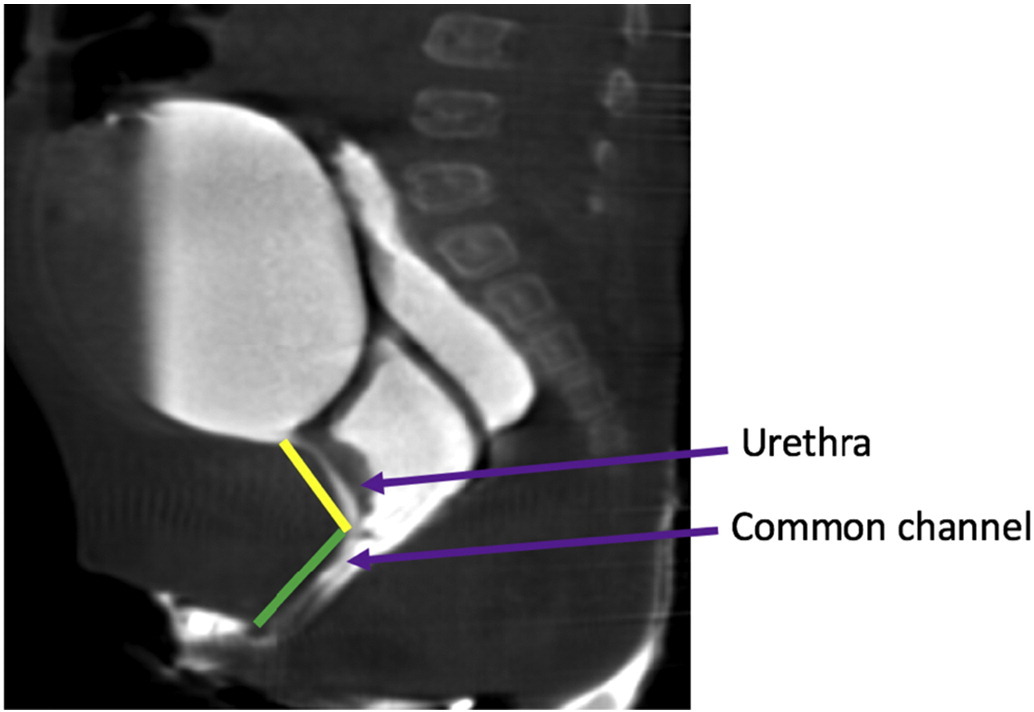
图 14 矢状位 T2 加权 MRI 图像显示泄殖腔畸形,并勾勒出尿道与共同通道的长度。
现行手术决策算法的制定
在将近20年里,仅基于共同通道长度进行手术决策一直是标准做法。然而,随着多学科诊疗的日益普及,泌尿外科医师与小儿外科一道更加紧密地参与这些患者的治疗,观察到尽管大多数共同通道较短的女童具有较长的尿道,但仍存在一种不常见亚型:共同通道短而尿道也非常短的女童。在这部分患者中,若实施TUM,将导致尿道极短,且使膀胱颈几乎位于会阴处,控尿潜能非常差。基于这一观察,制定了一个更新的手术决策算法,将共同通道长度与尿道长度共同纳入手术路径的选择中 图 15.13 在该算法中,若共同通道 > 3 cm,不论尿道长度如何,均行 UG 分离术。若共同通道 < 3 cm 且尿道 > 1.5 cm,则TUM为首选手术方式。对于这一不常见变异——共同通道 < 3 cm 且尿道 < 1.5 cm——新算法主张为患儿行 UG 分离术,从而使膀胱及膀胱颈保持在骨盆内的解剖位置,避免将其向下游离至骨盆膈下方。这一手术算法是自Peña提出TUM以来二十多年来首次提出的新手术技术,且已在高病例量中心获得广泛接受。该算法在降低决策复杂性以及减少术中更改手术计划方面取得了优异结果。通过对尿道与共同通道测量的准确术前评估,可避免显著的泌尿系统并发症,并使97%的患者获得通畅且可导尿的尿道。40
图 15 泄殖腔畸形的建议手术算法。13
术后管理
在后矢状泄殖腔修复术后,伤口管理和导管引流至关重要。关于泄殖腔修复后的尿道留置导尿时间尚无共识,但在 TUM 中通常为 1–2 周,而在 UG 分离中可长达 4 周。一些人主张通过膀胱造口对膀胱进行引流,但这并非必需。后矢状切口和阴道口切口存在裂开风险,因此在愈合期间避免任何跨骑或劈叉动作至关重要。还建议避免会阴受压,不要用会阴托住儿童,亦不要让其坐在跳跳椅或跨骑类玩具上。术后解剖情况通常通过详尽的门诊检查,或在手术室麻醉下进行膀胱镜检查与查体来评估。
术后膀胱管理
在对泄殖腔畸形进行手术修复后,确保膀胱充分排空非常重要。手术游离以及潜在的膀胱功能障碍可能导致尿潴留或排空不全。可通过在拔除导尿管后让所有患儿进行间歇性导尿,并根据尿量调整导尿的时间安排来进行管理。也有人使用术前尿动力学评估来帮助决定是否进行CIC。关于术后经导尿的膀胱管理尚无共识。在一项针对18名接受泄殖腔修复的女孩的最新报告中,44.4%需要辅助膀胱排空(CIC或膀胱造口术),其余则使用尿布管理。41 与修复术后需要CIC相关的因素包括共同通道长度较长、尿生殖分离以及在手术修复前即需要辅助膀胱排空。重要的是,术前采用尿布管理并不能保证术后可以避免辅助膀胱排空。
术后阴道管理
术后阴道口的通畅性通常通过全面的门诊检查或麻醉下检查进行评估。如果阴道口在幼年期出现狭窄,可以观察随访,直至患儿年长并进入青春期。如果狭窄严重到阻碍经血外流,则应在初潮前加以处理。建议在乳芽发育后6–9个月开始进行生殖道的超声监测,并在至初潮期间每隔6–9个月持续进行,评估每个子宫体的子宫内膜厚度。15 如果发现经血流出受阻,应会诊妇科或内分泌科,启动激素抑制以暂时性处理,直至实施外科干预。首选的阴道口或阴道狭窄手术技术包括单纯阴道口成形术或颊黏膜阴道成形术。42 许多中心配备儿科与青少年妇科专科医生负责监测此情况;在缺乏儿科妇科医生的地方,泌尿科医生也可承担此项照护。
长期结局
膀胱功能
由于人群的复杂性和异质性,评估控尿能力具有挑战性。Hendren 报告 ~60% 自主排尿并具有“尿控”,而 Peña 同样报告 54% 控尿、46% 需要清洁间歇性导尿。然而,这两项研究均未给出控尿的定义,也未报告膀胱重建率。35,36 近期,有一项针对50例年龄超过3岁、已行泄殖腔畸形修复患儿的长期结局综述。该研究报道80%的女童达到“社交性控尿”,其中22%可自主排尿,其余行 CIC。43 同一队列中,有46%的患者为实现控尿需接受手术,平均手术次数为4.7次。 再次强调,“控尿”的定义并不明确,而且不少“社交性控尿”者接受过重建手术。迫切需要对该人群进行长期随访,以明确与实现控尿相关的因素,并获得可靠的控尿率。
肾功能
在患有泄殖腔畸形的女童中,肾功能不全始终是一个令人关注的问题。最大的一项包含64例患者的系列研究报告显示,超过50%的患者GFR < 80 mL/min/1.73 m2,其中17%发生终末期肾病,6%需要移植,另有6%死于肾衰竭。44 同一研究团队强调,肾功能受损似乎是随时间逐渐获得的,因为在进展为慢性肾功能不全的女孩中,66%的血清肌酐最低值曾为正常。其他较小的系列则报告了更为理想的结果,在5–9年随访时有66–100%的女孩肾功能正常。45,46,47 有趣的是,这些系列均较为近期,且均来自为这些女孩提供照护的多学科团队所在的机构。再次强调,非常需要来自高病例量中心、针对这些患者肾功能的长期随访。
关键要点
- 泄殖腔畸形是女性最严重的肛门直肠畸形
- 泌尿系统及全身合并症常见,包括上尿路畸形、苗勒管畸形和膀胱功能障碍。全面的泌尿评估和多学科协作管理至关重要
- 初始处理优先进行阴道积液的早期引流和分流性结肠造口
- 修复泄殖腔畸形的手术称为经后正中矢状入路肛阴道直肠成形术(PSARVUP)。主要有两种手术方式:泌尿生殖道整体游离(用于较轻畸形)和泌尿生殖道分离(用于较重畸形)
- 许多女童需要膀胱导尿。关于控禁功能结局和肾功能的长期数据仍然缺乏
建议阅读
- Levitt MA, Peña A. Pitfalls in the management of newborn cloacas. Pediatr Surg Int 2005; 21: 264–269. DOI: 10.1007/s00383-005-1380-2.
- Harris KT, Kong L, Vargas M, Hou V, Pyrzanowski JL, Desanto K, et al.. Considerations and outcomes for adolescents and young adults with cloacal anomalies: a scoping review of urologic, colorectal, gynecologic and psychosocial concerns. Urology 2023. DOI: 10.1016/j.urology.2023.08.047.
参考文献
- AbouZeid AA, Mohammad SA, Shokry SS, El-Naggar O. Posterior cloaca: A urogenital rather than anorectal anomaly. J Pediatr Urol 2021; 17 (3): 410.e1–410.e7. DOI: 10.1016/j.jpurol.2021.01.014.
- Peña A, Bischoff A, Breech L, Louden E, Levitt MA. Posterior cloaca–further experience and guidelines for the treatment of an unusual anorectal malformation. J Pediatr Surg 2010; 45 (6): 1234–1240. DOI: 10.1016/j.jpedsurg.2010.02.095.
- Thomas DFM. The embryology of persistent cloaca and urogenital sinus malformations. Asian J Androl 2019; 22 (2): 124. DOI: 10.4103/aja.aja_72_19.
- Falcone RA, Levitt MA, Peña A, Bates M. Increased heritability of certain types of anorectal malformations. J Pediatr Surg 2007; 42 (1): 124–128. DOI: 10.1016/j.jpedsurg.2006.09.012.
- Skerritt C, DaJusta DG, Fuchs ME, Pohl H, Gomez-Lobo V, Hewitt G. Long-term urologic and gynecologic follow-up and the importance of collaboration for patients with anorectal malformations. Semin Pediatr Surg 2020; 29 (6): 150987. DOI: 10.1016/j.sempedsurg.2020.150987.
- Fuchs ME, Halleran DR, Bourgeois T, Sebastião Y, Weaver L, Farrell N, et al.. Correlation of anorectal malformation complexity and associated urologic abnormalities. J Pediatr Surg 2021; 56 (11): 1988–1992. DOI: 10.1016/j.jpedsurg.2021.02.051.
- Vilanova-Sanchez A, Halleran DR, Reck-Burneo CA. Re: A Descriptive Model for a Multidisciplinary Unit for Colorectal and Pelvic Malformations. J Urol 2019; 203 (4): 651–651. DOI: 10.1097/ju.0000000000000723.04.
- Warne SA, Wilcox DT, Creighton S, Ransley PG. Long-Term Gynecological Outcome of Patients with Persistent Cloaca. J Urol 2003; 170 (4 Part 2): 1493–1496. DOI: 10.1097/01.ju.0000086702.87930.c2.
- Mosiello GIOVANNI, Capitanucci MARIALUISA, Gatti CLAUDIA, Adorisio OTTAVIO, Lucchetti MARIACHIARA, Silveri MASSIMILIANO, et al.. How to Investigate Neurovesical Dysfunction in Children With Anorectal Malformations. J Urol 2003; 170 (4 Part 2): 1610–1613. DOI: 10.1097/01.ju.0000083883.16836.91.
- Goossens WJH, Blaauw I de, Wijnen MH, Gier RPE de, Kortmann B, Feitz WFJ. Urological anomalies in anorectal malformations in The Netherlands: effects of screening all patients on long-term outcome. Pediatr Surg Int 2011; 27 (10): 1091–1097. DOI: 10.1007/s00383-011-2959-4.
- Jindal B, Grover V, Bhatnagar V. The Assessment of Lower Urinary Tract Function in Children with Anorectal Malformations before and after PSARP. Eur J Pediatr Surg 2009; 19 (01): 34–37. DOI: 10.1055/s-2008-1039027.
- Warne STEPHANIEA, Godley MARGARETL, Wilcox DUNCANT. Surgical Reconstruction Of Cloacal Malformation Can Alter Bladder Function: A Comparative Study With Anorectal Anomalies. J Urol 2004; 172 (6 Part 1): 2377–2381. DOI: 10.1097/01.ju.0000145201.94571.67.
- Davies MRQ. Anatomy of the nerve supply of the rectum, bladder, and internal genitalia in anorectal dysgenesis in the male. J Pediatr Surg 1997; 32 (4): 536–541. DOI: 10.1016/s0022-3468(97)90702-8.
- Cardamone S, Creighton S. A gynaecologic perspective on cloacal malformations. Curr Opin Obstet Gynecol 2015; 27 (5): 345–352. DOI: 10.1097/gco.0000000000000205.
- Breech L. Gynecologic concerns in patients with anorectal malformations. Semin Pediatr Surg 2010; 19 (2): 139–145. DOI: 10.1053/j.sempedsurg.2009.11.019.
- Breech L. Gynecologic concerns in patients with cloacal anomaly. Semin Pediatr Surg 2016; 25 (2): 90–95. DOI: 10.1053/j.sempedsurg.2015.11.006.
- Levitt MA, Patel M, Rodriguez G, Gaylin DS, Pena A. Tethered Spinal Cord in Patients with Anorectal Malformations. Anorectal Malformations in Children 1997; 2 (3): 281–286. DOI: 10.1007/978-3-540-31751-7_18.
- Kim SM, Chang HK, Lee MJ. Re: Spinal Dysraphism With Anorectal Malformation: Lumbosacral Magnetic Resonance Imaging Evaluation of 120 Patients. J Urol 2010; 185 (3): 1094–1094. DOI: 10.1016/s0022-5347(11)60163-8.
- Beaufort CMC de, Groenveld JC, Mackay TM, Slot KM, Beer SA de, Jong JR de, et al.. Spinal cord anomalies in children with anorectal malformations: a retrospective cohort study. Pediatr Surg Int 2023; 39 (1): 281–286. DOI: 10.1007/s00383-023-05440-y.
- Muller CO, Crétolle C, Blanc T, Alova I, Jais J-P, Lortat-Jacob S, et al.. Impact of spinal dysraphism on urinary and faecal prognosis in 25 cases of cloacal malformation. J Pediatr Urol 2014; 10 (6): 1199–1205. DOI: 10.1016/j.jpurol.2014.05.012.
- Garvey EM, Fuller M, Frischer J, Calkins CM, Rentea RM, Ralls M, et al.. Multi-Institutional Review From the Pediatric Colorectal and Pelvic Learning Consortium of Minor Spinal Cord Dysraphism in the Setting of Anorectal Malformations: Diagnosis, Treatment, and Outcomes. J Pediatr Surg 2023; 58 (8): 1582–1587. DOI: 10.1016/j.jpedsurg.2023.04.009.
- Inserm. VACTERL/VATER association. Definitions 2011; 6 (56). DOI: 10.32388/m8pjt5.
- Levitt MA, Peña A. Anorectal malformations. Pediatr Surg Int 2007; 3-3 (2-3). DOI: 10.1007/bf00182758.
- Jacobs SE, Tiusaba L, Al-Shamaileh T, Bokova E, Russell TL, Ho CP, et al.. Fetal and Newborn Management of Cloacal Malformations. Children (Basel) 2022; 9 (6): 888. DOI: 10.3390/children9060888.
- Dannull KA, Browne LP, Meyers MZ. The spectrum of cloacal malformations: how to differentiate each entity prenatally with fetal MRI. Pediatr Radiol 2019; 49 (3): 387–398. DOI: 10.1007/s00247-018-4302-x.
- Bischoff A, Trecartin A, Alaniz V, Hecht S, Wilcox DT, Peña A. A cloacal anomaly is not a disorder of sex development. Pediatr Surg Int 2019; 35 (9): 985–987. DOI: 10.1007/s00383-019-04511-3.
- Vilanova-Sanchez A, Reck CA, Sebastião YV, Fuchs M, Halleran DR, Weaver L, et al.. Can sacral development as a marker for caudal regression help identify associated urologic anomalies in patients with anorectal malformation? J Pediatr Surg 2018; 53 (11): 2178–2182. DOI: 10.1016/j.jpedsurg.2018.03.018.
- VanderBrink BA, Reddy PP. Early urologic considerations in patients with persistent cloaca. Semin Pediatr Surg 2016; 25 (2): 82–89. DOI: 10.1053/j.sempedsurg.2015.11.005.
- Rink RC, Adams MC, Misseri R. A New Classification for Genital Ambiguity and Urogenital Sinus Anomalies. J Urol 2005; 175 (4): 1500–1501. DOI: 10.1016/s0022-5347(05)00847-5.
- Wood RJ, Reck-Burneo CA, Dajusta D. Re: Cloaca Reconstruction: A New Algorithm Which Considers the Role of Urethral Length in Determining Surgical Planning. J Urol 2018; 204 (6): 1368–1368. DOI: 10.1097/ju.0000000000001276.02.
- Patel MN, Racadio JM, Levitt MA, Bischoff A, Racadio JM, Peña A. Complex cloacal malformations: use of rotational fluoroscopy and 3-D reconstruction in diagnosis and surgical planning. Pediatr Radiol 2012; 42 (3): 355–363. DOI: 10.1007/s00247-011-2282-1.
- Halleran DR, Smith CA, Fuller MK, Durhm MM, Dickie B, Avansino JR, et al.. Measure twice and cut once: Comparing endoscopy and 3D cloacagram for the common channel and urethral measurements in patients with cloacal malformations. J Pediatr Surg 2020; 55 (2): 257–260. DOI: 10.1016/j.jpedsurg.2019.10.045.
- Chalmers DJ, Rove KO, Wiedel CA, Tong S, Siparsky GL, Wilcox DT. Clean intermittent catheterization as an initial management strategy provides for adequate preservation of renal function in newborns with persistent cloaca. J Pediatr Urol 2015; 11 (4): 211.e1–211.e4. DOI: 10.1016/j.jpurol.2015.05.014.
- Versteegh HP, Sutcliffe JR, Sloots CEJ, Wijnen RMH, Blaauw I de. Postoperative complications after reconstructive surgery for cloacal malformations: a systematic review. Tech Coloproctol 2015; 19 (4): 201–207. DOI: 10.1007/s10151-015-1265-x.
- Hendren WH. Cloaca, The Most Severe Degree of Imperforate Anus. Ann Surg 1998; 228 (3): 331–346. DOI: 10.1097/00000658-199809000-00006.
- Peña A. Total urogenital mobilization–An easier way to repair cloacas. J Pediatr Surg 1997; 32 (2): 263–268. DOI: 10.1016/s0022-3468(97)90191-3.
- Levitt MA, Peña A. Cloacal malformations: lessons learned from 490 cases. Semin Pediatr Surg 2010; 19 (2): 128–138. DOI: 10.1053/j.sempedsurg.2009.11.012.
- Reck-Burneo CA, Lane V, Bates DG. Re: The Use of Rotational Fluoroscopy and 3-D Reconstruction in the Diagnosis and Surgical Planning for Complex Cloacal Malformations. J Urol 2019; 204 (6): 1367–1368. DOI: 10.1097/ju.0000000000001276.01.
- Gasior AC, Reck C, Lane V, Wood RJ, Patterson J, Strouse R, et al.. Transcending Dimensions: a Comparative Analysis of Cloaca Imaging in Advancing the Surgeon’s Understanding of Complex Anatomy. J Digit Imaging 2019; 32 (5): 761–765. DOI: 10.1007/s10278-018-0139-y.
- Skerritt C, Wood RJ, Jayanthi VR, Levitt MA, Ching CB, DaJusta DG, et al.. Does a standardized operative approach in cloacal reconstruction allow for preservation of a patent urethra? J Pediatr Surg 2021; 56 (12): 2295–2298. DOI: 10.1016/j.jpedsurg.2021.01.011.
- Davis M, Mohan S, Russell T, Feng C, Badillo A, Levitt M, et al.. A prospective cohort study of assisted bladder emptying following primary cloacal repair: The Children’s National experience. J Pediatr Urol 2023; 19 (4): 371.e1–371.e11. DOI: 10.1016/j.jpurol.2023.03.017.
- Leeuwen K van, Baker L, Grimsby G. Autologous buccal mucosa graft for primary and secondary reconstruction of vaginal anomalies. Semin Pediatr Surg 2019; 28 (5): 150843. DOI: 10.1016/j.sempedsurg.2019.150843.
- Warne SA, Wilcox DT, Ransley PG. Long-term Urological Outcome of Patients Presenting with Persistent Cloaca. J Urol 2002; 168(4: 1859–1862. DOI: 10.1097/00005392-200210020-00048.
- Warne SA, Wilcox DT, Ledermann SE, Ransley PG. Renal Outcome in Patients With Cloaca. J Urol 2002; 67 (6): 2548–2551. DOI: 10.1097/00005392-200206000-00055.
- Braga LHP, Lorenzo AJ, Dave S, Del-Valle MH, Khoury AE, Pippi-Salle JL. Long-term renal function and continence status in patients with. Can Urol Assoc J 2007; 1 (4): 371. DOI: 10.5489/cuaj.442.
- DeFoor WR, Bischoff A, Reddy P, VanderBrink B, Minevich E, Schulte M, et al.. Chronic Kidney Disease Stage Progression in Patients Undergoing Repair of Persistent Cloaca. J Urol 2015; 194 (1): 190–194. DOI: 10.1016/j.juro.2015.01.080.
- Rink RC, Herndon CDA, Cain MP, Kaefer M, Dussinger AM, King SJ, et al.. Upper and lower urinary tract outcome after surgical repair of cloacal malformations: a three-decade experience. BJU Int 2005; 96 (1): 131–134. DOI: 10.1111/j.1464-410x.2005.05581.x.
- Levitt MA, Peña A. Pitfalls in the management of newborn cloacas. Pediatr Surg Int 2005; 21: 264–269. DOI: 10.1007/s00383-005-1380-2.
- Harris KT, Kong L, Vargas M, Hou V, Pyrzanowski JL, Desanto K, et al.. Considerations and outcomes for adolescents and young adults with cloacal anomalies: a scoping review of urologic, colorectal, gynecologic and psychosocial concerns. Urology 2023. DOI: 10.1016/j.urology.2023.08.047.
最近更新时间: 2025-09-22 08:00