22: 泄殖腔外翻
阅读本章大约需要 12 分钟。
引言
泄殖腔外翻(CE),常被称为脐膨出、膀胱外翻、肛门闭锁及脊柱异常(OEIS)复合体,是外翻-尿道上裂复合体(EEC)中最少见的表现,然而却在解剖与发育方面与典型状态的偏离最大。作为一种多系统缺陷,它需要专门的多学科协作以为患者及其家庭实现最佳结局。本章以现代视角回顾泄殖腔外翻,并展望加深对这一高负担疾病认识的未来方向。
胚胎学
关于 EEC 的主流理论认为,是中胚层向内生长未能加固泄殖腔膜。1 泄殖腔膜是由外胚层和内胚层组织构成的双层结构,位于正在发育的脐下腹壁之胚盘的尾侧。在正常发育中,于妊娠第4th至第5th周,这两层之间的间充质向内生长,形成下腹部肌肉和骨性骨盆。该泌尿直肠隔继续向尾侧下降,导致其与泄殖腔膜融合,并最终将泄殖腔分隔为前方的膀胱和后方的直肠(图 1)。2 泄殖腔膜通常在与泌尿直肠隔融合之后、约于发育第6th周发生穿孔,形成彼此分开的泌尿生殖口和肛门口。随后,产生外生殖器的成对生殖结节向内侧迁移并在中线融合。3
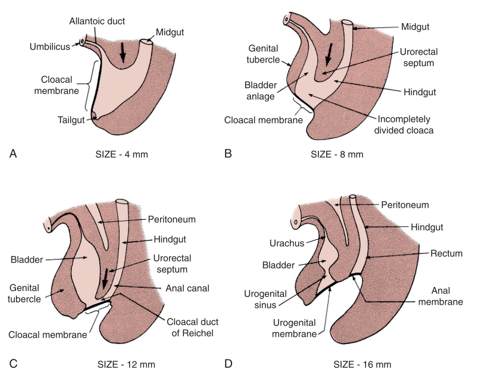
图 1 泄殖腔膜、泌尿生殖窦和肛门开口的发育。间充质向内生长,伴随尿直肠隔向尾侧下降及泄殖腔膜的穿孔,最终形成泌尿生殖腔与肛腔。
缺乏间充质加固以及由此导致的泄殖腔膜过度发育,使泄殖腔膜有发生早期破裂的风险。该膜发生早期破裂的时间点和程度决定了在EEC中所见的疾病谱;CE是最早形成的缺陷。
流行病学
CE 的发病率约为每 200,000-400,000 例活产中有 1 例4,5 从历史上看,在 CE 中存在 2:1 的男:女偏倚,尽管有些系列报道将其估计得更接近 1:1。6,7,8 然而,随着影像学手段和产前诊断的改进,由于 23% 的病例选择性终止妊娠,且多达 50% 的妊娠会自发流产,CE 的活产数已显著减少。9
大多数病例呈散发,但遗传学分析已发现可能的致病因素。Thauvin-Robinet et al 描述了9号染色体长臂与Y染色体之间的不平衡易位,导致9q34.1-qter缺失,作为一种可能的原因,而其他研究者则将影响中胚层发育的一组同源盒基因(包括HLXB9和HOX家族)的突变牵连其中。10
除了家族史外,还涉及其他CE特异性的危险因素。在对232个家庭的临床与分子分析中,父母高龄被提示为可能的危险因素,平均母亲年龄为34岁、平均父亲年龄为32岁(相比之下,依据2010年人口普查数据分别为26岁和27岁)。有趣的是,49%的外翻病例来自初次妊娠,这也可能佐证父母生育年龄推迟。10 激素影响也可能起作用,Wood及其同事发现,在妊娠第一孕期早期接受大剂量黄体酮的母亲,其外翻患儿的出生风险增加10倍。11 同一研究还报告了与辅助生殖技术的关联:通过 体外 受精(IVF)受孕的儿童,其外翻发生风险增加7.5倍。
目前,与泄殖腔外翻最密切相关的环境因素是母体烟草暴露,具体为围受孕期母亲接触吸烟以及妊娠第一孕期的母亲吸烟。12 综合来看,在咨询中出现两个关键要点:1)围绕如何优化围受孕期和妊娠第一孕期的适当咨询 – 处于器官发生时期,并2)理解社会对生育计划的观念正在转变(初次为人父母者的年龄在增长)以及可能需要辅助生殖技术。
发病机制与相关畸形
确定 CE 潜在多因素病因的复杂性,体现在该表型所观察到的广泛缺陷范围(表 1)上。由于 CE 是早期发育事件的结果,其表现为异常更多、程度最重,代表膀胱外翻-尿道上裂谱系中最具挑战的一端。CE 的经典表型表现为一条外翻的盲肠条带,两侧为两半外翻的膀胱,常伴有回肠段脱垂,形成”象鼻样畸形”(图 2)。此外,后肠缩短且常为盲端,导致肛门闭锁。由于生殖结节未能在中线融合,在耻骨联合分离增宽的两侧可见两半生殖器(图 3)。腹壁缺损通常合并不同大小的脐膨出。2 鉴于该缺陷具有多系统累及的特征,本文将分别对各异常进行更为详细的描述。
表 1 泄殖腔外翻及其相关合并畸形。
| 胃肠道 | 泌尿生殖系统 | 中枢神经系统 | 肌肉骨骼系统 |
|---|---|---|---|
| 脐膨出 | 单侧肾发育缺如 | 脊髓栓系 | 椎骨(缺如或半椎缺陷) |
| 肛门未通、肛门闭锁或狭窄 | 盆腔肾 | 脊髓脊膜膨出 | 马蹄足 |
| 短肠综合征 | 输尿管重复畸形 | 髋关节半脱位 | |
| 肠旋转不良 | 肾积水 | 骨盆底前部肌群缺乏 | |
| 肠重复畸形 | 双侧隐睾 | ||
| 腹股沟疝 | |||
| 子宫重复畸形 | |||
| 阴道重复畸形 |
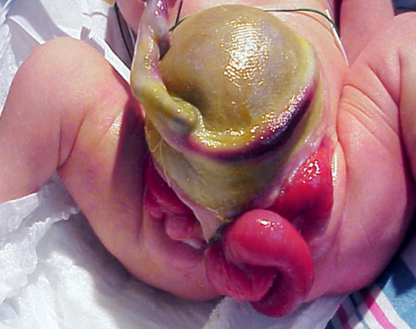
图 2 男性,典型的泄殖腔外翻表现,伴回肠段脱垂,形成“象鼻”畸形。
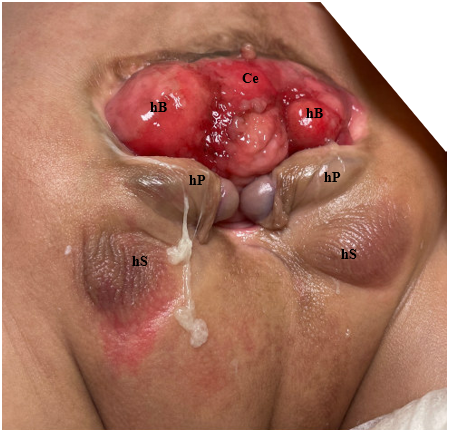
图3 患有泄殖腔外翻的男性的照片。注意:已行结肠造口术。Ce = 盲肠; hB = 半膀胱; hP = 半阴茎; hS = 半阴囊。
肌肉骨骼
骨性骨盆
骨性骨盆的异常及其相关的耻骨联合分离是膀胱外翻的标志性特征。1995 年,Sponseller 等人 在膀胱外翻患者中应用骨性骨盆的三维(3D)计算机断层扫描(CT),并阐明了与耻骨联合特征性增宽相关的异常,从而更新了我们对此的认识。尤其值得注意的是,他们将这些异常归纳为两大类,分别为旋转性异常和维度性异常(表 2)。
表 2 骨性骨盆的异常.
| 旋转性 | 尺寸性 |
|---|---|
| 骨盆后部/髂翼外旋 | 耻骨联合间隙增宽 |
| 骨盆前段外旋 | 耻骨前段缩短(30%) |
| 骶髂关节冠状位旋转 | 三放射软骨间距增宽 |
| 髋臼后倾 | |
| 髂翼会聚 | |
| 股骨后倾 |
与年龄匹配的对照相比,Sponseller et al 发现,在典型膀胱外翻(CBE)中,骨盆后部在每侧平均外旋 12 度,而骨盆前部平均外旋 18 度。此外,耻骨支缩短 30%,与髋臼后倾相结合,导致 CBE 中平均耻骨联合分离为 4.8 cm(图 4)。13 在 CE 患者中,这些缺陷更为显著,整个骨盆的骨骼长度总体减少 43%,平均耻骨联合分离超过 6 cm,且骨盆左右两侧不对称的可能性增加。为明确起见,轻度分离小于 4 cm,中度分离介于 4 和 6 cm 之间,极度分离为任何 > 6 cm。
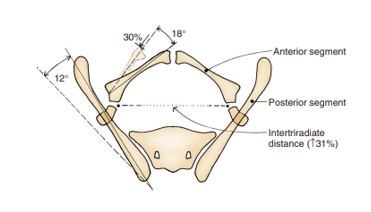
图 4 经典型膀胱外翻所见的骨盆骨异常。后部骨段双侧外旋12˚,但长度不变。前部骨段双侧外旋18˚,并缩短30%。三放射软骨之间的距离增加31%。注意:在泄殖腔外翻中,异常更为严重,且不对称更常见。经Brady 泌尿学研究所许可使用。
盆底缺陷
骨性骨盆的旋转和尺寸异常直接影响骨盆底的发育不良。三维CT对膀胱外翻患儿的成像显示,与年龄匹配的对照相比,提肛肌的位置更靠后(后向68%/前向32%),而对照为(后向52%/前向48%) (图 5).14 除了更偏向后方之外,提肛肌的凹度也更小。骨性骨盆畸形在骨盆底的另一种表现是,与其通常的锥形相比,耻骨直肠肌更为扁平。前部骨盆底肌群的匮乏以及缺乏锥形形态,决定了重建骨性骨盆和骨盆底的手术技术,相关内容另行讨论。
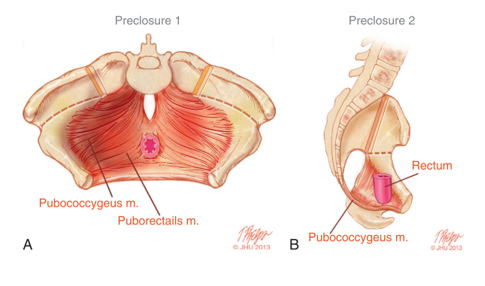
图 5 A) 膀胱外翻闭合术前的盆底肌群,已标记截骨切口。B) 盆底解剖的侧位视图,显示盆底肌群向后移位至直肠后方。
下肢与步态异常
在CE中经常可见下肢异常。由于耻骨联合分离增大、髋部间距增大以及髋臼外旋,儿童可能以下肢外旋和摇摆步态进行代偿。其他畸形包括胫骨扭转、马蹄内翻畸形和跟足畸形。15 尽管存在这些肢体畸形,这些患者的关节活动度通常不受影响,按需使用矫形支具可随着时间帮助纠正步态。到2岁时,大多数儿童已可行走,仅需极少的辅助器具,且在儿童期很少需要轮椅辅助。
胃肠道畸形
几乎所有患者在某种程度上都存在胃肠道畸形,这在围手术期(尤其在营养方面)以及长期管理中,显著增加了并发症负担和管理难度。脐膨出是该疾病的特征性表现,在88–100%的病例中可见。16,17,18,19 脐膨出的大小及其内容物差异很大,可能包含小肠、肝脏,或两者兼有。为防止后续破裂并提供有利的环境,通常在新生儿期立即关闭脐膨出缺损,或将其置于保护性囊袋(silo)中。在Davidoff 等 报道的一个系列中,纳入了26例CE患者,所有人均表现为脐膨出。其中,19例(73%)行原发关闭,其余则需要使用临时假体囊袋(silo)进行分期回纳。16
短肠综合征在25%的病例中出现,是导致营养相关并发症增加的广泛存在的原因,即便在肠道长度正常的情况下也可能发生。4 肠道可能存在固有的吸收异常,这进一步凸显了为这些患者优化围手术期营养的重要性,以及在重建过程中尽可能保留大肠长度的必要性。若不用于粪便通道,后肠残余可在泌尿生殖道重建时予以纳入。17 虽然肠道初始处理存在多种路径,Sawaya et al 的研究在2009年引发了范式转变:首先将盲肠板管状化并行端式结肠造口,因为这大幅降低了短肠综合征的发生,并使符合条件的患者未来能够进行下拉术。20
其他与胃肠道相关的伴随畸形在46%的病例中可见,包括重复畸形、腹裂、肠旋转不良、十二指肠闭锁以及外翻的结肠段。16,17,21 肛门闭锁也很常见,有一项病例系列报告在37例患者中有36例存在该情况。17
其他泌尿系统异常
上尿路异常很常见,发生于41–66%的患者中。17,18 特别需要重视对患者上尿路解剖的识别与理解,因为单侧肾缺如、盆腔肾或肾积水在多达48%的病例中可见,且16%的患者存在多种并存的肾脏异常。(missing reference) 马蹄肾、融合异常,以及包括巨输尿管和重复输尿管在内的输尿管异常报道较少。值得注意的是,输尿管异常的表现差异很大,可能出现输尿管异位开口:男性可开口于输精管,女性可开口于子宫、阴道或输卵管。19
中枢神经系统和椎体异常
脊髓裂畸形(包括脊髓栓系、脊髓脊膜膨出或脂肪脊髓脊膜膨出)在64-100%的患者中以某种形式存在,其中80%位于腰段。2,18 除裂畸形外的椎体异常包括半椎体及其相关的脊柱侧弯,后者见于40%的患者,但多数病例中侧弯不进展。15 鉴于脊髓及椎体缺陷的高发生率,建议对CE新生儿行MRI评估,并在需要时请神经外科参与。
神经系统受损最终可能影响膀胱功能、尿控能力和下肢运动。各项受累程度的变异性与脊髓和椎体异常一样大。此外,在死后条件下对一名患有CE的婴儿骨盆进行的显微解剖显示自主神经的起源和血供异常。22 这种神经方面的不可预测性增加了帮助这些患者实现尿控的难度。腹壁缺陷
泄殖腔膜的早破可导致出现下腹壁完全缺如的大型缺损。尽管这种缺损的表现十分明显,但一些细微之处需要特别注意。由于耻骨联合分离增宽以及腹股沟管典型斜行方向的改变,多达50%的CE患者可见腹股沟疝,且应予以修补。23
影响生殖器官和外生殖器的异常
在男性CE患者中,典型表现为阴茎完全且不对称地分离为两半,并伴阴囊两半相应分离。睾丸可能位于各自的半阴囊内;然而,它们常为未下降,并与腹股沟疝相关,需要手术矫治。在女性中,阴蒂体同样呈明显的分离,且间距较大。
苗勒管畸形在CE中也很常见,95%的病例可见子宫重复。19 以部分重复为主,其中双角子宫为最常见的亚型。阴道畸形范围从缺如,见于25-50%的患者,到阴道重复,其发生率可高达65%。21 在存在子宫或输卵管重复的情况下,应优先考虑保留,以便可能纳入下尿路重建。
心血管与肺部异常
罕见情况下,CE 会伴随可立即危及生命的心血管或肺部缺陷。尽管罕见,报告仍包括多种重大畸形,其中包括主动脉重复和腔静脉重复。23 其他报道描述了法洛四联症、肺动脉闭锁、肺动脉狭窄以及动脉导管未闭。24
鉴于这种先天畸形对几乎所有器官系统发育的相关影响,对这些易受伤害患者的医疗照护应在具备相关手术技术经验并能够实施跨专科围手术期和术后管理的中心进行。
评估与诊断
确诊
考虑到与CE相关的缺陷范围,产前诊断在历史上一直很具挑战性,甚至可以说难以实现。准确诊断CE并将其与CBE区分,对于正确开展对家庭的咨询至关重要,尤其是考虑到患有CE的儿童往往在一生中面临更多与健康相关的问题。产前诊断可进行规划,可能优化出生后的内科和外科管理。1985年首次对CE的产前诊断依赖于三项关键的胎儿超声(fUS)发现:1. 脐下正中大型前腹壁缺损,2. 腰骶部脊髓脊膜膨出,3. 膀胱不可见。25 Austin及其同事通过将诊断标准划分为主要或次要发现,进一步细化了该列表。出现于>50%病例者构成主要标准,包括:膀胱不可见(91%)、脐下正中大型前腹壁缺损或前腹壁囊性结构(82%)、脐膨出(77%)以及脊髓脊膜膨出(68%)。次要标准为出现在<50%病例者,包括:下肢缺陷(23%)、肾脏异常(23%)、腹水(41%)、耻骨弓增宽(18%)、胸廓狭窄(9%)、脑积水(9%)和单脐动脉(9%)。26 尽管自fUS首次作为诊断工具引入以来,其成像能力已有巨大提升,但仅约15%的患者可仅凭fUS在产前得到诊断,因为这些发现可能被不完整地识别为孤立性脐膨出、CBE或其他正中线缺陷。
在产前诊断中引入胎儿磁共振成像(fMRI)为评估 CE 增添了一种有价值的辅助手段。与 fUS 相比,当未能识别到膀胱时,fMRI 能提供更优的解剖结构显示,并且当在 US 上不易识别时,还可帮助评估脐膨出及相关脊柱缺陷的有无,并判断性别。27,28
近期,Weiss 等人 在 fUS 和 fMRI 上识别了关键的解剖学发现,以评估它们在产前诊断 CBE(经典型膀胱外翻)和 CE(泄殖腔外翻)方面各自的有效性。2001 年至 2018 年间,他们纳入了 21 例接受产前影像检查的患者。14 例出生后诊断为 CBE,其余为 CE。21 例中有 15 例同时具备 fUS 和 fMRI 资料可供评估,进行产前影像评估时的孕周中位数为 25 周。在 16 份有初始解读的 fUS 中,原始产前诊断在 12 例中正确,fUS 的敏感性为 69%。所有 4 例产前误诊为 CE 的病例,随后均被确定为 CBE。在纳入分析的 18 份 fMRI 中,16/18 的诊断与最终结果一致(敏感性 83%),两例产前误诊为 CE 的病例被重新分类为 CBE。这些误诊归因于体积较大且突出的膀胱板,后方伴有肠袢,外观模拟了含肠的脐膨出。他们得出结论,鉴于存在腹壁缺损,在 fUS 和 fMRI 上识别脐带附着点是区分 CBE 与 CE 的明智做法。29
泄殖腔外翻的变异会带来额外的诊断挑战。尽管极为罕见,也可能出现皮肤覆盖型变异,如一项小型病例系列所述,在6例患者中有5例出现此情况。30
评估与出生后即刻管理
出生后,首先要确保患儿病情稳定。需要进行详尽的体格检查,以确认可能存在的各种解剖异常(表 1)。明确合并的出生缺陷及其严重程度,有助于制定内外科管理方案。与 CBE 患者一样,应将外翻的肠管和膀胱段保持湿润,并以塑料敷料覆盖保护。31 完整的影像学系列检查,包括普通X线片、超声(US)和 MRI,有助于判定相关缺陷的严重程度,并促进小儿骨科、小儿神经外科和小儿普外科等会诊专科的早期介入。将社会工作与营养服务的意见和支持纳入并完善多学科团队,是照护 CE 患儿及其家庭的关键。
性别指定
在婴儿病情稳定且对病情的全貌有了充分了解之后,有必要就性别指定进行坦诚而深思熟虑的讨论。在许多情况下,这可能需要来自小儿内分泌学、儿童心理学或小儿精神病学的会诊。所有关于性别指定的决定都应仅在完成核型分析、进行充分讨论并给予适当的父母咨询之后作出。
鉴于CE男孩的典型表型表现为阴茎体与阴囊分离距离较大,且海绵体体积较小,最初的报告主张将 46, XY 男孩普遍进行性别重新指定为功能性女性。32 这推动了早期的治疗原则,包括行双侧睾丸切除术,并将阴茎重建为功能性阴蒂以及进行阴道成形术,手术可早期或延迟实施。
这种做法的长期影响目前仍是激烈争论的话题。随着患有这种疾病的患者生存期延长,他们为这种做法在社会心理方面的影响以及基因型和宫内激素环境的潜在作用提供了一些线索。在一个由29名患有CE并接受女性性别重新指定的男性组成的队列中,尽管未经历任何青春期激素激增,全部29例在性心理发育方面均表现出以男性方向为主的转变。33 然而,其他系列研究并未显示在行为或社会心理问题方面存在差异,尽管有一例报道称,一名46XY性别转换患者因异位睾丸而发生男性化。34,35 当前的态度倾向于在可能的情况下进行与核型一致的性别指派。一项对小儿泌尿外科医师的调查支持了这一点,其中三分之二倾向于进行与性别一致的重建。36
手术治疗与预后
初始管理
建议在新生儿期尽早进行脐膨出闭合以
以防止过早破裂;然而,这仅在神经外科相关问题得到处理后才进行。在初次脐膨出关闭时,通常采用三种路径之一进行肠道转流和后肠处理,包括回肠造口并切除后肠、回肠造口并建立后肠黏液瘘,或盲肠管状化并建立端结肠造口。
从历史上看,最初的肠道改道依赖于回肠造口联合后肠切除,然而这带来了若干意想不到的后果。首先,这几乎普遍导致短肠综合征,并降低了日后进行胃肠道重建的可能性。其次,高排量回肠造口使患儿更易因反复脱水和电解质紊乱而增加住院率。18,20 由于回肠造口高排量所致的继发性酸中毒对钙稳态产生不利影响,并直接调节生长激素-IFG-1 轴,减弱生长激素的释放。长期来看,这与 CE 患者的生长相关发病负担有关。37
因此,在初始肠道转流和后肠管理方面出现了范式转变。在其包含77例患者的队列中,Sawaya 等人 发现后肠长度差异很大,从2到>20 cm不等,其中超过一半在6至15 cm范围内。有趣的是,与XX基因型相比,XY基因型患者更可能具有小于10 cm的后肠长度。在该系列中,仅有10例患者接受了后肠切除,且仅在后肠活力可疑或长度极短的情况下才行之。因此,作者主张采用盲肠管状化并行末端结肠造口,以避免短肠综合征并促进肠道下拉术的实施。20 通常,胃肠道重建在初次粪便转流后1至2年进行;然而,若该重建与膀胱关闭同时进行,则耻骨联合的靠拢对成功的膀胱、腹壁和肠道重建至关重要。通常,这些重建的成功依赖于合并截骨术的骨盆重建。17
在同一病例系列中,Sawaya et al 共实施了8例肠道拉出术——其中7例在5岁前接受手术,年龄范围为2至12岁——且所有患者均保留了至少10 cm长的后肠。20 在决定是否进行肠道拉出术时,还应考虑其他因素,包括患者排出成形大便的能力,以及在麻醉下检查时肛门括约肌肌群对刺激有反应的证据。对于不适合行肠道拉出术的儿童,永久性粪便造口是长期管理最为耐久的选择。值得注意的是,如果后肠残端未被纳入粪便通路,应予保留,以备日后进行膀胱扩大或阴道重建。17
如果在脐膨出关闭的初始阶段确定无法安全、成功地同时完成膀胱与腹壁的关闭,则应将膀胱两半在正中线予以对合,从而将该缺损转变为CBE。17 这有助于腹腔扩张并使膀胱板增大,以便随后延期关闭。最后,若未在初次肠道重建中纳入后肠,则此时将后肠留置为黏液瘘。
尿路重建
现代分期修复
CE的泌尿重建与CBE的重建相似。将两半膀胱向后靠拢可使缺损从CE转变为CBE,并涉及将膀胱两半的外侧面自腹壁分离,并于中线闭合。38通过将膀胱及后尿道置入骨盆深处以恢复解剖结构,仍是成功外科重建的关键因素。将增宽的骨盆予以靠拢有助于实现这一目标,使腹壁和泌尿道得以重建,然而,这通常需要进行骨盆截骨和固定,如本章后文将述及。
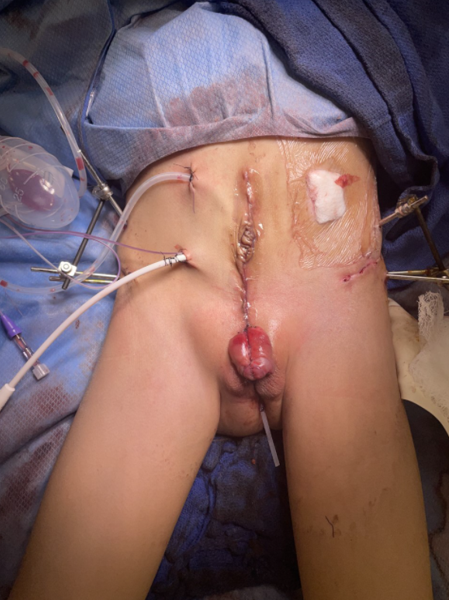
图6 外翻的现代分期修复术。图3中所示术前照片患者的术后照片。注意在安装外固定装置前截骨钢针的放置位置。
在 CE 中发现的巨大腹壁缺损对无张力腹壁重建构成了重大挑战 (图 7)。若在闭合时未考虑张力,可能会影响成功闭合和瘘形成的发生率。诸如 Alloderm(Allergan,Branchburg,NJ)等生物假体材料在腹壁组织不足时用于桥接缺损,同时实现无张力闭合方面显示出巨大前景。39 此外,Alloderm 还被用作辅助手段,在泌尿道重建时通过覆盖耻骨间缝线以减少阴茎-耻骨瘘的发生。40
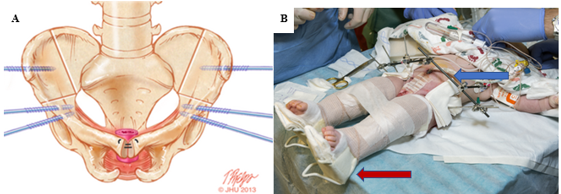
图 7 A, 在骨面上标记了双侧前部无名骨与垂直髂骨联合截骨的位置,并示固定针置入的理想位置。B, 右侧为改良Buck牵引(红箭头)与外固定(蓝箭头)。
为确保与指定性别一致,在出生后即刻的新生儿期尽可能早进行外生殖器重建。对于基因型男性,这将确保他们以与其表型一致的方式被抚养。尽管接受性别重新指定的儿童在远期心理社会与性心理方面的影响目前备受关注,如前所述,对接受性别重新指定的男性受试者的睾丸所做的组织学研究证实其组织学表现正常,即使存在隐睾亦然。41 鉴于常见的阴茎组织体量较小且不对称,阴茎重建仍具挑战,结果参差不齐。
阴茎成形术已成为一种用于阴茎替代的成功重建方案,但这通常推迟至青春期后期进行(图 8)。42 然而,在因组织匮乏而需要男性至女性的性别重新指派(男转女)的情况下,初始外生殖器重建应将阴茎两半在中线相接以形成阴蒂。若阴茎组织充足,则在1岁时行尿道上裂修复术,常采用已广泛描述的 Cantwell-Ransley 修复术。43 在遗传学女性中,阴道重建通常早期进行;而在性别重新指派的男性(男转女)中,适宜延迟进行新阴道重建,并需要对新阴道进行长期扩张。44 由于遗传学女性的尿道较短,单纯性尿道上裂的修复通常与 Young-Dees-Leadbetter 膀胱颈重建术(BNR)、耻丘整形术和阴蒂成形术联合进行。
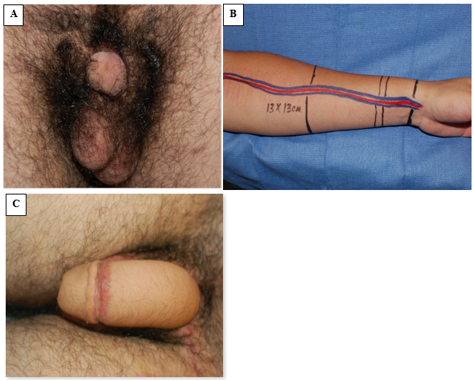
图 8 桡前臂游离皮瓣阴茎再造术。A,术前照片,可见较小的阴茎组织。B,术中准备前臂皮瓣组织及相应蒂部血管。C,术后照片显示阴茎再造术的效果。
截骨术的重要性
截骨术已成为大多数 CBE 患儿实现成功关闭的关键因素,并且在膀胱关闭时,所有 CE 患儿均有行截骨术的适应证。17,44 截骨术可矫正宽大的耻骨联合分离,并使膀胱和后尿道尽可能深地置于骨盆内的原位,同时有助于在最小张力下完成膀胱与腹壁重建。这种张力的降低与伤口裂开和术后腹壁疝发生率的下降相关。此外,已发现截骨术可将显著并发症的发生可能性从未行截骨关闭患者的89%降至行截骨关闭患儿的17%。45 这一点在一项纳入80例 CE 患者的大型系列研究中得到证实:在关闭时实施截骨术,外翻修补的成功率达91%。46 尽管截骨术有助于成功关闭,但在 CE 患者中并未发现其会影响最终的控尿结局。
本院首选联合行双侧前无名骨截骨与垂直髂骨截骨,并与膀胱关闭手术协同进行,这一策略被称为“双阶段路径(DSP)”。47 采用仰卧位进行截骨的途径具有一个额外优势:在进行膀胱和腹壁关闭前无需再次为患者重新摆位(图 7)。由于避免了后路入路,损伤任何脊柱修复的风险也降至最低。此外,在膀胱和腹壁关闭前2至3周,可通过外固定逐步实现骨盆复位缩窄。这常用于耻骨联合分离极宽(> 10 cm)的情形,并已在一例耻骨联合分离达16 cm的患者中成功应用。47 在我院,外固定和改良Buck牵引通常维持6至8周,以确保充分愈合。根据我们的经验,这种制动技术在原发性关闭中的失败率为3.8%,疗效卓越;相比之下,采用人字石膏固定的失败率为65.7%。48
一期重建
针对 CE 患者的另一种修复策略是单期修复,即外翻完全一期修复 (CPRE),由 Grady 和 Mitchell 推广。49 与分期策略不同,后者先进行腹壁和膀胱重建,随后进行尿道上裂修复以及控尿手术;单期修复将各阶段的要点整合为一次手术完成。该术式与针对 CBE 描述的相似,但会结合脐膨出的情况考虑关闭时机,强调对于巨大脐膨出或其他使情况复杂的医学问题应延迟关闭。其他人得出的结论是,尽管单期修复适用于一部分精选患者,但可能限制其应用的因素包括膀胱板较小、耻骨联合分离 >6 cm,或脊柱裂等其他医学状况;这些情况即便在不存在外翻时也可能需要多次手术 。50 在一项仅纳入 6 例患者的小系列中,Lee 等人 报告通过完全一期修复获得了成功关闭。然而,他们也注意到两名儿童出现了膀胱正中隔,并伴有肾积水。此外,一名儿童可自行排尿,另一名接受了膀胱扩大成形术 (AC)。51
该技术的支持者认为,它可能降低成本、减少与多次手术相关的并发症和创伤,甚至促进膀胱的早期生长。在这种情况下,尿道上裂修复通过阴茎解剖分离术实施,其中将尿道板从阴茎海绵体完全游离。这有利于进行尿道闭合,并使膀胱颈在骨盆内向后定位。52 CPRE 的倡导者将实现控尿所需手术次数的减少归因于在早期即增加了膀胱出口阻力。然而,许多患者仍需行 BNR,而且值得注意的是,在追加 BNR 后,先前仍失禁的 CPRE 患者中仅有 20-56% 能够实现控尿。53,54
并发症
在CE中,单期修复与分期修复均为可接受的重建技术。虽然每种方法各有优点,但据报道的结局显示,单期修复的失败率为48%,而分期修复为15%。伤口裂开、膀胱脱垂、膀胱出口梗阻以及膀胱皮肤瘘的形成均应视为闭合失败,而且在单期与分期技术中均有报道。
无论采用哪种手术方式,成功的膀胱一期关闭是首要目标。关闭失败对患者及其家庭是毁灭性的,且后果严重。在 CE 中一期关闭失败的患者将面临更多的手术和全身麻醉暴露。尽管在 CBE 中,膀胱关闭失败会对最终的尿控产生负面影响,但这种对控尿的影响在 CE 患者中不那么显著,因为无论一期手术结果如何,这些患者大多仍需要额外的控尿手术。55,56 其影响不仅限于额外的手术,还包括经济负担。Goldstein 等 对 CE 患者进行了费用分析,发现当 CE 的一期修复成功时,达到控尿大约需要花费 $196,000;而在膀胱一期关闭失败后,达到控尿的费用上升至 $407,000。57
一项针对膀胱外翻一期成功闭合预测因素的大型系列研究报告称,分期CE闭合以及采用骨盆截骨术,是成功闭合的重要独立预测因素。此外,在膀胱闭合后,术后制动对成功至关重要。58 基于此,我们建议采用外固定联合牵引,这也是我们机构的常规做法。其他方法(例如人字石膏)可能无法提供足够的制动,因此可能导致骨盆重建失败率升高。截骨术相关并发症罕见且多为自限性,但包括一过性神经和肌肉麻痹风险增加(通常在术后12周内恢复)、髂骨延迟愈合,以及针道浅表感染或炎症。59 在作者所在机构的经验中,尽管骨盆截骨术联合术后制动可能会延长住院时间,但失败率的大幅降低被患者和照护者认为是值得的。
新兴证据提示,初次闭合的时机会影响成功率。2014年,Shah等报告了60例CE患者的结局,发现闭合前分离距离每增加1 cm,初次闭合失败的几率增加2.64倍。随后行截骨术并推迟闭合,同时利用外固定器减少分离距离,可提高闭合成功率。有趣的是,闭合失败的患者中有77%在出生后第一周内完成闭合,而分期闭合患者中这一比例为26%。此外,闭合失败组中仅有31%的患者在初次闭合时实施了截骨术,而分期闭合组则为82%。其他防止失败的策略包括将初次膀胱闭合推迟至脐膨出闭合之后。60 最后,再闭合成功的患者中有92%接受了截骨术。47 这些显示延期原发修复成功率更高的结果也得到了另一项系列研究的支持:与在出生后30天以后进行闭合的患者相比,出生后30天内行原发膀胱闭合者的失败比例更高(47.7% vs 19.3%)。55
在初次闭合失败后,如要实现控尿,必须进行二次膀胱闭合术。与Shah et al. 报道的发现相似,Davis及其同事发现,进行二次膀胱闭合的年龄可预测总体成功率。他们报告,二次膀胱闭合成功的患者在接受二次闭合时的年龄比失败者大一年以上(中位年龄104周 vs 38周)。56 二次闭合成功的中位延迟为154周,而失败的二次闭合中位延迟为30周。膀胱外翻患儿的尿路重建一旦失败意义重大,因为这可能导致膀胱生长迟缓并丧失膀胱板,从而使实现控尿变得愈发困难,甚至可能不可能。
实现控尿
由于常见多种可能异常的聚集——膀胱板偏小、膀胱顺应性差、膀胱颈广泛开放(若存在)、以及可导致神经源性肠道与膀胱的脊柱异常——经尿道自排尿实现的控尿可能性不大。然而,在膀胱外翻重建中,控尿仍是最终目标,以使这些儿童能够过上更为典型的生活。为此,往往需要追加手术;Maruf 等人 在一项大型系列研究中证实,患者为获得超过3小时的干燥间隔,通常需要中位数为2次(范围1–4次)的尿控相关手术。61
在作者所在机构的一项大样本系列研究中,评估了80例OEIS复合征患者的结局,其中73例有泌尿道重建的数据可用。在40名达到干爽的患者中,38例保留了自身膀胱,2例为小肠新膀胱(Koch囊袋)。在这38例保留自身膀胱的患者中,30例(79%)接受了可控导尿通道(控尿性尿流改道,CUD),利用阑尾(n =3)或肠段(n = 27)构建;并且有32例(84%)在达到干爽之前还接受了膀胱扩大成形术(AC)。仅有9例患者(24%)维持了通畅且具控尿功能的尿道。46 在汇总评估CE尿控情况的研究中,多达50%的患者需要AC,整体干爽率为72%。62
这些用于控尿的额外辅助手段 AC 和 CUD 存在特有的并发症,包括黏液分泌过多、膀胱结石、慢性细菌定植和上皮性息肉。与 AC 相关的其他长期问题包括慢性代谢性酸中毒以及(发生可能性较小的)癌。63,64 随着时间推移,为 CUD 建立的造口可能发生狭窄、脱垂、坏死或渗漏,需要修复。64
在遗传性别为女性的患者中,Young-Dees-Leadbetter BNR 后可成功实现控尿,但大多数患者需要清洁间歇性导尿。用于男性和女性以增强膀胱容量的技术先前已有描述,其中包括纳入后肠段(在可用时)、小肠和大肠,且较少情况下还包括胃。38 在性别重新指派为女性的男转女患者中,实现控尿要困难得多,而从长期来看,可控造口可能是最有利的策略。17 无论采用何种技术,依据我们机构的经验,患儿在中位年龄为11岁时实现尿控。61 在一项针对泄殖腔外翻患者控尿情况的大型系列研究中,50%(61例中35例)的儿童获得控尿,其中30例经可控造口行间歇性导尿,其余则经尿道排尿或导尿。65
建议的随访
患有膀胱外翻的患者、其家属以及负责治疗的内科与外科团队会形成一种在医学中独一无二的特殊纽带。完成尿路和腹壁重建以及可能随后进行的尿道上裂修复术后,治疗管理的重点转向保护上尿路。为此,在作者所在机构,我们通过每年进行膀胱造影和膀胱镜检查来监测是否存在任何反流的证据,同时追踪膀胱生长。对于学龄期儿童(至少5-7岁),我们在进行膀胱颈重建之前评估膀胱容量、尿动力学,以及通过评估手部灵巧度和成熟度来判断其参与自我护理的能力。31
结论
CE 是一种灾难性的多系统先天缺陷,过去常使患儿面临显著的疾病负担,甚至死亡风险。然而,在这些患儿的外科和内科管理方面已取得长足进步,使他们能够在步入成年后过上接近正常的生活。当代管理之所以成功,源于多学科协作的方法,来克服这些患者所面临的挑战。随着这些患者在成年期乃至更久的生命历程中持续保持健康生活,我们将继续在生活质量以及如何优化患者整体功能方面获得更多认识。
要点
- 准确而全面的围产期诊断对于组织适当的多学科管理至关重要——fUS 和 fMRI 是实现这一目标的有用手段。
- 出生后的初始处理应确保患者病情稳定。一旦稳定,应进行全面的体格检查和适当的影像学检查,以确保全面识别所有相关畸形。
- 腹部及泌尿道重建仅可在经神经外科对脊柱或中枢神经系统受累进行评估并予以放行后进行。
- 在这些儿童中,应不惜一切代价保留任何后肠残端,因为其可能用于胃肠或泌尿生殖系统重建。
- 在未来重建之前,将膀胱与胃肠道分离并同时进行粪便分流是关键。末端结肠造口术已成为并发症最少的一种粪便分流方式。
- 这些患者在重建后需密切随访,以确保上尿路功能的保留。
未来方向
当前研究旨在为患者及其家庭开发更好的预测工具,从而改进咨询并减少与手术相关的并发症。更好的咨询可通过诸如预测膀胱容量及其生长的工具(Sholklapper et al 2022,已提交)来实现,这可能会影响未来的手术方案以及获得控尿的能力。66 此外,对膀胱外翻患者的膀胱与年龄匹配的正常对照之间超微结构差异的基础科学研究,可能为这些患者的膀胱差异性生长曲线提供更清晰的图景。将影像学用于评估盆底解剖、作为手术规划的工具,可为术中决策提供更多信息,并预计此类影像的应用将进一步扩大。从长期来看,关注不断发展的转化泌尿学领域,以及明确这些儿童步入成年后由谁来提供照护,将有助于优化对这些患者的管理。最后,在医疗中心之间拓展用于会诊的远程医疗,可能改善关于这种罕见疾病的沟通,并通过降低与可及性、出行和费用支出相关的负担来提升患者及其家庭的福祉。
推荐阅读
- Gearhart JP, Carlo HN. Exstrophy-epispadias complex. 12th ed., Philadelphia, PA: Elsevier; 2020, DOI: 10.1201/9780429194993-25.
- Grady RW, Mitchell ME. Complete Primary Repair Of Exstrophy. J Urol 1999; 65 (1): 1415–1420. DOI: 10.1097/00005392-199910000-00071.
- Davis R, Stewart D, Maruf M, Lau H, Gearhart JP. Complex abdominal wall reconstruction combined with bladder closure in OEIS complex. J Pediatr Surg 2019; 54 (11): 2408–2412. DOI: 10.1016/j.jpedsurg.2019.03.022.
- Tourchi A, Inouye BM, Di Carlo HN, Young E, Ko J, Gearhart JP. New advances in the pathophysiologic and radiologic basis of the exstrophy spectrum. Journal of Pediatric Urology 2014; 10 (2): 212–218.
- Kasprenski M, Michaud J, Yang Z, Maruf M, Benz K, Jayman J, et al.. Urothelial differences in the exstrophy-epispadias complex: potential implications for management. The Journal of Urology 2021; 205 (5): 1460–1465.
- Di Carlo HN, Maruf M, Massanyi EZ, Shah B, Tekes A, Gearhart JP. 3-dimensional magnetic resonance imaging guided pelvic floor dissection for bladder exstrophy: a single arm trial. The Journal of Urology 2019; 202 (2): 406–412.
参考文献
- Muecke EC. The Role of the Cloacae Membrane in Exstrophy: The First Successful Experimental Study. J Urol 1069; 92 (6): 659–668. DOI: 10.1016/s0022-5347(17)64028-x.
- Woo LL, Thomas JC, Brock JW. Cloacal exstrophy: A comprehensive review of an uncommon problem. J Pediatr Urol 2010; 6 (2): 102–111. DOI: 10.1016/j.jpurol.2009.09.011.
- Moore KL. Organogenetic Period: The Fourth to Eighth Weeks. In: Moore KL, Persaud TVN, editors. The Developing Human: Clinically Oriented Embryology. 7th ed. Philadelphia, PA: Saunders; 2003.
- Howell C, Caldamone A, Snyder H, Ziegler M, Duckett J. Optimal management of cloacal exstrophy. J Pediatr Surg 1983; 18 (4): 365–369. DOI: 10.1016/s0022-3468(83)80182-1.
- Cervellione RM, Mantovani A, Gearhart J, Bogaert G, Gobet R, Caione P, et al.. Prospective study on the incidence of bladder/cloacal exstrophy and epispadias in Europe. J Pediatr Urol 2015; 11 (6): 337.e1–337.e6. DOI: 10.1016/j.jpurol.2015.03.023.
- Shapiro E, Lepor H, Jeffs RD. The Inheritance of the Exstrophy-Epispadias Complex. J Urol 1984; 132 (2): 308–310. DOI: 10.1016/s0022-5347(17)49605-4.
- Ives E, Coffey R, Carter CO. A family study of bladder exstrophy. J Med Genet 1980; 17 (2): 139–141. DOI: 10.1136/jmg.17.2.139.
- Birth Defects Monitoring Systems IC for. Epidemiology of bladder exstrophy and epispadias: A communication from the international clearinghouse for birth defects monitoring systems. Teratology 1987; 36 (2): 221–227. DOI: 10.1002/tera.1420360210.
- Botto LD, Feldkamp ML, Amar E, Carey JC, Castilla EE, Clementi M, et al.. Acardia: Epidemiologic findings and literature review from the International Clearinghouse for Birth Defects Surveillance and Research. Am J Med Genet C Semin Med Genet 2011; 157 (4): 262–273. DOI: 10.1002/ajmg.c.30318.
- Boyadjiev SA, Dodson JL, Radford CL, Ashrafi GH, Beaty TH, Mathews RI, et al.. Clinical and molecular characterization of the bladder exstrophy-epispadias complex: analysis of 232 families. BJU Int 2004; 94 (9): 1337–1343. DOI: 10.1111/j.1464-410x.2004.05170.x.
- WOOD HADLEYM, TROCK BRUCEJ, GEARHART JOHNP. In Vitro Fertilization and the Cloacal-Bladder Exstrophy-Epispadias Complex: Is there an Association? J Urol 2003; 169 (4): 1512–1515. DOI: 10.1097/01.ju.0000054984.76384.66.
- Reutter H, Boyadjiev SA, Gambhir L, Ebert A-K, Rösch WH, Stein R, et al.. Phenotype Severity in the Bladder Exstrophy-Epispadias Complex: Analysis of Genetic and Nongenetic Contributing Factors in 441 Families from North America and Europe. J Pediatr 2011; 159 (5): 825–831.e1. DOI: 10.1016/j.jpeds.2011.04.042.
- Sponseller PD, Bisson LJ, Gearhart JP, Jeffs RD, Magid D, Fishman E. The anatomy of the pelvis in the exstrophy complex. J Bone Joint Surg Am 1995; 77 (2): 177–189. DOI: 10.2106/00004623-199502000-00003.
- Stec AA, Pannu HK, Tadros YE, Sponseller PD, Fishman EK, Gearhart JP. Pelvic Floor Anatomy In Classic Bladder Exstrophy Using 3-dimensional Computerized Tomography: J Urol 2001; 166 (4): 1444–1449. DOI: 10.1097/00005392-200110000-00066.
- Greene WB, Dias LS, Lindseth RE, Torch MA. Musculoskeletal problems in association with cloacal exstrophy. J Bone Joint Surg Am 1991; 73 (4): 551–560. DOI: 10.2106/00004623-199173040-00012.
- Davidoff AM, Hebra A, Balmer D, Templeton JM, Schnaufer L. Management of the gastrointestinal tract and nutrition in patients with cloacal exstrophy. J Pediatr Surg 1996; 31 (6): 771–773. DOI: 10.1016/s0022-3468(96)90129-3.
- Mathews R, Jeffs RD, Reiner WG, Docimo SG, Gearhart JP. Cloacal Exstrophy-improving The Quality Of Life. J Urol 1998; 6 (2): 2452–2456. DOI: 10.1097/00005392-199812020-00017.
- McHoney M, Ransley PG, Duffy P, Wilcox DT, Spitz L. Cloacal exstrophy: Morbidity associated with abnormalities of the gastrointestinal tract and spine. J Pediatr Surg 2004; 39 (8): 1209–1213. DOI: 10.1016/j.jpedsurg.2004.04.019.
- Sugar EC, Firlit CF. Management of cloacal exstrophy. Urology 2004; 32 (4): 320–322. DOI: 10.1016/0090-4295(88)90234-8.
- Sawaya D, Goldstein S, Seetharamaiah R, Suson K, Nabaweesi R, Colombani P, et al.. Gastrointestinal ramifications of the cloacal exstrophy complex: a 44-year experience. J Pediatr Surg 2010; 45 (1): 171–176. DOI: 10.1016/j.jpedsurg.2009.10.030.
- Hurwitz RS, Manzoni GAM, Ransley PG, Stephens FD. Cloacal Exstrophy: A Report of 34 Cases. J Urol 1987; 138 (4 Part 2): 1060–1064. DOI: 10.1016/s0022-5347(17)43502-6.
- Phillips TM, Salmasi AH, Stec A, Novak T, Gearhart JP, Mathew J. Re: Urological Outcomes in the Omphalocele Exstrophy Imperforate Anus Spinal Defects (OEIS) Complex: Experience with 80 Patients. J Urol 2013; 191 (4): 1118–1119. DOI: 10.1016/j.juro.2014.01.044.
- Schlegel PN, Gearhart JP. Neuroanatomy of the Pelvis in an Infant with Cloacal Exstrophy: A Detailed Microdissection with Histology. J Urol 1989; 141 (3 Part 1): 583–585. DOI: 10.1016/s0022-5347(17)40901-3.
- Connolly JA, Peppas DS, Jeffs RD, Gearhart JP. Prevalence and Repair of Inguinal Hernias in Children with Bladder Exstrophy. J Urol 1995; 154 (5): 1900–1901. DOI: 10.1097/00005392-199511000-00093.
- Sadula SR, Kanhere SV, Phadke VD. Exstrophy of Cloaca Sequence (Oeis Complex) With Multiple Cardiac Malformations. Indian Journal of Case Reports 2019; 05 (04): 317–319. DOI: 10.32677/ijcr.2019.v05.i04.006.
- Meizner I, Bar-Ziv J. In utero prenatal ultrasonic diagnosis of a rare case of cloacal exstrophy. J Clin Ultrasound 1985; 13 (7): 500–502. DOI: 10.1002/jcu.1870130714.
- Austin PF, Homsy YL, Gearhart JP, Porter K, Guidi C, Madsen K, et al.. The Prenatal Diagnosis Of Cloacal Exstrophy. J Urol 1998; 160 (3.2): 1179–1181. DOI: 10.1097/00005392-199809020-00061.
- Calvo-Garcia MA, Kline-Fath BM, Rubio EI, Merrow AC, Guimaraes CV, Lim F-Y. Fetal MRI of cloacal exstrophy. Pediatr Radiol 2013; 43 (5): 593–604. DOI: 10.1007/s00247-012-2571-3.
- Goto S, Suzumori N, Obayashi S, Mizutani E, Hayashi Y, Sugiura-Ogasawara M. Prenatal findings of omphalocele-exstrophy of the bladder-imperforate anus-spinal defects (OEIS) complex. Congenit Anom (Kyoto) 2012; 52 (3): 179–181. DOI: 10.1111/j.1741-4520.2011.00342.x.
- Weiss DA, Oliver ER, Borer JG, Kryger JV, Roth EB, Groth TW, et al.. Key anatomic findings on fetal ultrasound and MRI in the prenatal diagnosis of bladder and cloacal exstrophy. J Pediatr Urol 2020; 16 (5): 665–671. DOI: 10.1016/j.jpurol.2020.07.024.
- Lowentritt BH, Van Zijl PS, Frimberger D, Baird A, Lakshmanan Y, Gearhart JP. Variants Of The Exstrophy Complex: A Single Institution Experience. J Urol 2005; 173 (5): 1732–1737. DOI: 10.1097/01.ju.0000154353.03056.5c.
- Gearhart JP, Jeffs RD. The bladder exstrophy-epispadias complex. 3rd ed., Philadelphia, PA: Saunders; 1998, DOI: 10.1007/978-3-319-44182-5_13.
- Tank ES, Lindenauer SM. Principles of management of exstrophy of the cloaca. Am J Surg 1970; 119 (1): 95–98. DOI: 10.1016/0002-9610(70)90018-8.
- Reiner WG, Gearhart JP. Discordant Sexual Identity in Some Genetic Males with Cloacal Exstrophy Assigned to Female Sex at Birth. N Engl J Med 2004; 350 (4): 333–341. DOI: 10.1056/nejmoa022236.
- Baker Towell DM, Towell AD. A Preliminary Investigation Into Quality of Life, Psychological Distress and Social Competence in Children With Cloacal Exstrophy. J Urol 2003; 169 (5): 1850–1853. DOI: 10.1097/01.ju.0000062480.01456.34.
- Mirheydar H, Evason K, Coakley F, Baskin LS, DiSandro M. 46, XY female with cloacal exstrophy and masculinization at puberty. J Pediatr Urol 2009; 5 (5): 408–411. DOI: 10.1016/j.jpurol.2009.03.013.
- Diamond DA, Burns JP, Mitchell C, Lamb K, Kartashov AI, Retik AB. Sex assignment for newborns with ambiguous genitalia and exposure to fetal testosterone: Attitudes and practices of pediatric urologists. J Pediatr 2006; 148 (4): 445–449. DOI: 10.1016/j.jpeds.2005.10.043.
- Fullerton BS, Sparks EA, Hall AM, Chan Y-M, Duggan C, Lund DP, et al.. Growth morbidity in patients with cloacal exstrophy: a 42-year experience. J Pediatr Surg 2016; 51 (6): 1017–1021. DOI: 10.1016/j.jpedsurg.2016.02.075.
- Gearhart JP, Jeffs RD. Techniques to Create Urinary Continence in the Cloacal Exstrophy Patient. J Urol 1991; 146 (2 Part 2): 616–618. DOI: 10.1016/s0022-5347(17)37871-0.
- Davis R, Stewart D, Maruf M, Lau H, Gearhart JP. Complex abdominal wall reconstruction combined with bladder closure in OEIS complex. J Pediatr Surg 2019; 54 (11): 2408–2412. DOI: 10.1016/j.jpedsurg.2019.03.022.
- Henderson CG, North AC, Gearhart JP. The use of alloderm as an adjunct in the closure of the bladder – Cloacal exstrophy complex. J Pediatr Urol 2011; 7 (1): 44–47. DOI: 10.1016/j.jpurol.2010.02.209.
- Mathews, Perlman, Marsh, Gearhart. Gonadal morphology in cloacal exstrophy: implications in gender assignment. BJU Int 1999; 84 (1): 99–100. DOI: 10.1046/j.1464-410x.1999.00148.x.
- Lumen N, Monstrey S, Selvaggi G, Ceulemans P, De Cuypere G, Van Laecke E, et al.. Phalloplasty: A Valuable Treatment for Males with Penile Insufficiency. Urology 2008; 71 (2): 272–276. DOI: 10.1016/j.urology.2007.08.066.
- Gearhart JP, Leonard MP, Burgers JK, Jeffs RD. The Cantwell-Ransley Technique for Repair of Epispadias. J Urol 1992; 148 (3 Part 1): 851–854. DOI: 10.1016/s0022-5347(17)36742-3.
- Gearhart JP, Carlo HN. Exstrophy-epispadias complex. 12th ed., Philadelphia, PA: Elsevier; 2020, DOI: 10.1201/9780429194993-25.
- Ben-Chaim J, Peppas DS, Sponseller PD, Jeffs RD, Gearhart JP. Applications of Osteotomy in the Cloacal Exstrophy Patient. J Urol 1995; 154 (2.2): 865–867. DOI: 10.1097/00005392-199508000-00146.
- Mathews R, Gearhart JP, Bhatnagar R, Sponseller P. Staged Pelvic Closure of Extreme Pubic Diastasis in the Exstrophy-Epispadias Complex. J Urol 2006; 176 (5): 2196–2198. DOI: 10.1016/j.juro.2006.07.058.
- Benz KS, Jayman J, Maruf M, Baumgartner T, Kasprenski MC, Friedlander DA, et al.. Pelvic and lower extremity immobilization for cloacal exstrophy bladder and abdominal closure in neonates and older children. J Pediatr Surg 2018; 53 (11): 2160–2163. DOI: 10.1016/j.jpedsurg.2017.11.066.
- Grady RW, Mitchell ME. Complete Primary Repair Of Exstrophy. J Urol 1999; 65 (1): 1415–1420. DOI: 10.1097/00005392-199910000-00071.
- Thomas JC, DeMarco RT, Pope JC, Adams MC, Brock JW. First Stage Approximation of the Exstrophic Bladder in Patients With Cloacal Exstrophy–Should This be the Initial Surgical Approach in all Patients? J Urol 2007; 178 (4s): 1632–1636. DOI: 10.1016/j.juro.2007.03.164.
- Lee RS, Grady R, Joyner B, Casale P, Mitchell M. Can a Complete Primary Repair Approach be Applied to Cloacal Exstrophy? J Urol 2006; 176 (6): 2643–2648. DOI: 10.1016/j.juro.2006.08.052.
- Mitchell ME, Bagli DJ. Complete Penile Disassembly for Epispadias Repair. J Urol 1996; 155 (1): 300–304. DOI: 10.1097/00005392-199601000-00128.
- Gargollo P, Hendren WH, Diamond DA, Pennison M, Grant R, Rosoklija I, et al.. Bladder Neck Reconstruction is Often Necessary After Complete Primary Repair of Exstrophy. J Urol 2011; 185 (6s): 2563–2571. DOI: 10.1016/j.juro.2011.01.024.
- Schaeffer AJ, Stec AA, Purves JT, Cervellione RM, Nelson CP, Gearhart JP. Complete Primary Repair of Bladder Exstrophy: A Single Institution Referral Experience. J Urol 2011; 186 (3): 1041–1047. DOI: 10.1016/j.juro.2011.04.099.
- Friedlander DA, Di Carlo HN, Sponseller PD, Gearhart JP. Complications of bladder closure in cloacal exstrophy: Do osteotomy and reoperative closure factor in? J Pediatr Surg 2017; 52 (11): 1836–1841. DOI: 10.1016/j.jpedsurg.2016.12.002.
- Davis R, Sood A, Maruf M, Singh P, Kasprenski MC, DiCarlo HN, et al.. The failed bladder closure in cloacal exstrophy: Management and outcomes. J Pediatr Surg 2019; 54 (11): 2416–2420. DOI: 10.1016/j.jpedsurg.2019.02.012.
- Goldstein SD, Inouye BM, Reddy S, Lue K, Young EE, Abdelwahab M, et al.. Continence in the cloacal exstrophy patient: What does it cost? J Pediatr Surg 2016; 51 (4): 622–625. DOI: 10.1016/j.jpedsurg.2015.12.003.
- Jayman J, Tourchi A, Feng Z, Trock BJ, Maruf M, Benz K, et al.. Predictors of a successful primary bladder closure in cloacal exstrophy: A multivariable analysis. J Pediatr Surg 2019; 54 (3): 491–494. DOI: 10.1016/j.jpedsurg.2018.06.030.
- Inouye BM, Tourchi A, Di Carlo HN, Young EE, Gearhart JP. Modern Management of the Exstrophy-Epispadias Complex. Surg Res Pract 2014; 2014 (587064): 1–9. DOI: 10.1155/2014/587064.
- Shah BB, Di Carlo H, Goldstein SD, Pierorazio PM, Inouye BM, Massanyi EZ, et al.. Initial bladder closure of the cloacal exstrophy complex: Outcome related risk factors and keys to success. J Pediatr Surg 2014; 49 (6): 1036–1040. DOI: 10.1016/j.jpedsurg.2014.01.047.
- Maruf M, Kasprenski M, Jayman J, Goldstein SD, Benz K, Baumgartner T, et al.. Achieving urinary continence in cloacal exstrophy: The surgical cost. J Pediatr Surg 2018; 53 (10): 1937–1941. DOI: 10.1016/j.jpedsurg.2018.02.055.
- Mathews R. Achieving urinary continence in cloacal exstrophy. Semin Pediatr Surg 2011; 20 (2): 126–129. DOI: 10.1053/j.sempedsurg.2010.12.009.
- Surer I, Ferrer FA, Baker LA, Gearhart JP. Continent Urinary Diversion and the Exstrophy-Epispadias Complex. J Urol 2003; 169 (3): 1102–1105. DOI: 10.1097/01.ju.0000044921.19074.d0.
- Woodhouse CRJ, North AC, Gearhart JP. Standing the test of time: long-term outcome of reconstruction of the exstrophy bladder. World J Urol 2006; 24 (3): 244–249. DOI: 10.1007/s00345-006-0053-7.
- Suson K, Novak T, Gupta A, Benson J, Sponseller PD, Gearhart JP. The Neuro-Orthopedic Manifestations of the Omphalocele Exstrophy Imperforate Anus Spinal Defects (OEIS) Complex. J Pediatr Urol 2010; 5 (4): S54. DOI: 10.1016/j.jpurol.2009.02.083.
- Di Carlo HN, Maruf M, Massanyi EZ, Shah B, Tekes A, Gearhart JP. 3-dimensional magnetic resonance imaging guided pelvic floor dissection for bladder exstrophy: a single arm trial. The Journal of Urology 2019; 202 (2): 406–412.
- Tourchi A, Inouye BM, Di Carlo HN, Young E, Ko J, Gearhart JP. New advances in the pathophysiologic and radiologic basis of the exstrophy spectrum. Journal of Pediatric Urology 2014; 10 (2): 212–218.
- Kasprenski M, Michaud J, Yang Z, Maruf M, Benz K, Jayman J, et al.. Urothelial differences in the exstrophy-epispadias complex: potential implications for management. The Journal of Urology 2021; 205 (5): 1460–1465.
最近更新时间: 2025-09-22 08:00