17: 巨输尿管
阅读本章大约需要 9 分钟。
引言
输尿管膀胱连接部(UVJ)的先天性异常常表现为扩张的或“巨大”的输尿管 (图 1). 该病况有许多同义称谓,包括输尿管积水和巨大输尿管,但都指直径大于正常、可伴或不伴肾盂扩张的输尿管。Smith 将巨大输尿管分为四类:梗阻型、反流型、反流合并梗阻型,以及非反流/非梗阻型;随后 King 又将其细分为原发性和继发性。1,2 Pfister-Hendren 分类建立于 1978 年,基于形态学外观:I 型累及输尿管远端且不伴肾积水;II 型累及输尿管及肾盂;III 型与重度肾盂输尿管积水和输尿管迂曲相关。3 先天性巨大输尿管在男性中更为常见,发生率约为女性的两倍,且左侧对右侧之比为 1.8:1。4 由于反流型 UVJ 异常已在他处详述,本章将重点讨论梗阻型以及非梗阻非反流型巨大输尿管。
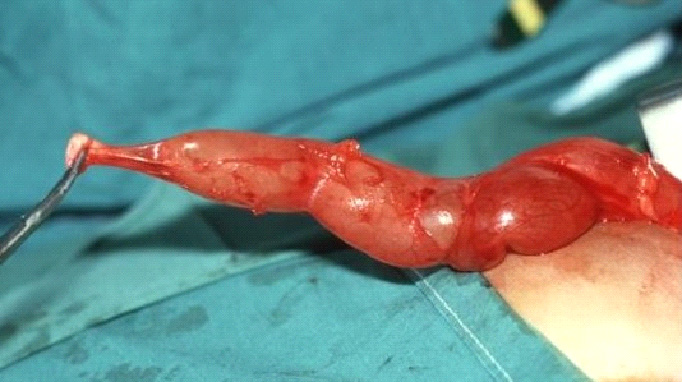
图 1 术中所见为巨输尿管(MU)及狭窄、无蠕动的输尿管近膀胱段(AS)。
文献中对“扩张的输尿管”的定义尚未明确。Cussen 检查了孕周超过 20 周的胎儿和年龄至 12 岁的儿童,并为妊娠 30 周的胎儿,以及在 3 个月、3 岁、6 岁和 12 岁的婴儿与儿童确立了输尿管的平均尺寸。5 从出生至 12 岁,输尿管中段直径的范围上限为 0.5–0.65 cm;因此,正常上限被认为接近 0.7 cm。Hellstrom et al 提供了 194 名年龄为 0 至 16 岁儿童的正常输尿管直径的影像学数据,并同样得出结论:在该年龄组中,输尿管直径超过 7 mm 属异常。6
输尿管膀胱连接处的胚胎学与遗传学
UVJ 异常属于肾脏与泌尿道先天性畸形(CAKUT)的一部分。CAKUT 包括影响泌尿道发育的一系列异常,包括肾缺如、发育不良或发育不全;输尿管近端或远端梗阻(肾盂输尿管连接部(UPJ)或 UVJ 梗阻);输尿管扩张(巨输尿管);膀胱输尿管反流(VUR)以及尿道梗阻(例如由于后尿道瓣膜或尿道闭锁)。7 从胚胎学角度看,哺乳动物的肾脏源自两个组成部分:输尿管芽(一种反复分支形成集合管的上皮)和后肾间充质。输尿管芽还形成肾盂和输尿管的上皮,称为尿路上皮。
迄今,我们对正常输尿管发育的认识局限于动物模型的研究,包括具有肾/输尿管异常表型的转基因小鼠。这些研究提示,多种基因、转录因子以及分泌蛋白共同参与正常的输尿管发育;一旦发生紊乱,便表现为各种形式的先天性肾与泌尿道畸形(CAKUT)。8 输尿管发育中的关键参与者是胶质细胞系来源的神经营养因子与跨膜 c-ret 蛋白酪氨酸激酶(GDNF/c-ret)轴。9 输尿管芽的萌出与分支依赖于 GDNF 与其共受体——糖基磷脂酰肌醇锚定的共受体1(Gfrα1)——之间的相互作用,它们与 c-ret 结合并将其激活。GDNF 主要在后肾间充质、远端输尿管的三角楔区以及泌尿生殖窦中表达。在 c-ret -/-突变体中,可见肾缺如、严重的低发育/发育不良以及盲端输尿管;同时在 GDNF -/- 和 Gfrα1 -/- 突变体中也观察到类似表型,提示 GDNF-c-ret 轴对于输尿管芽的起始和早期分支形态发生是必需的。
C-ret 的表达依赖于视黄酸(维生素A的代谢产物)。9 Batourina 等人 证明,维生素A和Ret原癌基因对于膀胱与输尿管之间正常连接的形成是必需的。10 缺失Ret的,或同时缺失Rara和Rarb(视黄酸受体家族的两个成员)的小鼠突变体出现肾积水和巨输尿管,这两种情况均与输尿管成熟早期阶段的缺陷有关,在该阶段,“共同肾导管”(CND——Batourina 等人 对中肾管中位于输尿管芽起源近端那一部分所给的名称)的重塑促使输尿管口从中肾管分离。他们的研究提示,维生素A和Ret对于CND的扩展以形成一种称为“楔”(wedge)的结构是必需的,他们提出该结构很可能是膀胱三角的前体。11,12
远端输尿管平滑肌分化的时间尚不明确,但这可能是理解为何VUR或梗阻在出生后会改善的关键。Pirker 等人 研究了来自猪胎儿、新生仔猪和6月龄仔猪的膀胱标本。13 他们发现,在60天时,膀胱逼尿肌发育良好且神经支配完善,而膀胱内外段输尿管才刚开始分化。到90天时,膀胱外段输尿管的神经支配已相当完善,但膀胱内段输尿管直到出生后才成熟。所有平滑肌成分在新生期与后期标本之间的体积均显著增加。本研究中肌肉发育的时间进程与人类的发现相一致:在人类中,输尿管壁外段的平滑肌束在妊娠第17至22周首次出现,且输尿管肌发育沿颅尾方向进行。14 作者还注意到,输尿管周鞘的发育早于输尿管平滑肌的发育,这在人类中也有报道。输尿管周鞘在出生后表现出显著的神经肌肉发育;其肌纤维显著生长,并在6个月时几乎形成连续层。13 Tanagho 亦观察到,远端输尿管是最后形成其肌层的部分,且早期的肌性分化主要为环形肌。其他研究提出了UVJ梗阻发生的可能解释。15 这些包括:输尿管远端周围存在厚肌袖、胶原纤维沉积增加,以及在梗阻性巨大输尿管的近膀胱段存在失调的神经调节。11,16,17
产前诊断
输尿管扩张在5–10%的病例中与产前肾积水相关。18 目前,近79%的输尿管肾积水患者是在围产期超声检查(USS)中被发现的,其余则在发生发热性泌尿道感染(UTI)后被发现。19 通过超声在宫内检测到扩张的输尿管是一项困难的工作。胎儿可能不处于合适的体位,或者输尿管可能被上覆结构或母体肠道气体所遮挡。此外,技术人员可能未接受在常规筛查中专门查找输尿管扩张的培训。因此,产前对输尿管扩张的检出可能不可靠。在一项纳入101例转诊至大奥蒙德街医院、出生后确诊为输尿管肾积水的患者的研究中,仅有20%在产前记录到输尿管扩张。48例(47.5%)婴儿被发现存在VUR或其他病变,53例(52.5%)被怀疑存在UVJ梗阻。4
出生后管理
输尿管扩张超过7mm的患者发生尿路感染(UTI)的风险增加,因此建议给予持续性抗生素预防(CAP)。20 一项针对237例输尿管扩张患者的前瞻性多中心研究得出结论:在校正性别、包皮环切状态、抗生素预防及肾积水分级后,输尿管直径≥7 mm的患者发生UTI的风险几乎是3倍。对于接受排尿性膀胱尿道造影(VCUG)检查且未发现膀胱输尿管返流(VUR)的患者,该较高风险同样存在。CAP对UTI具有显著的保护作用。21
当扩张为单侧时,建议在出生后 48 小时至 4 周之间进行超声(US)检查(UTD 共识)(图2)。22 对于双侧输尿管肾积水,应更紧急地进行评估,并在新生儿出院前排除膀胱出口梗阻。存在扩张的输尿管提示需要进行 VCUG,以排除尿道梗阻或 VUR。存在 VUR 即可确诊为 “反流性巨大输尿管”。在 MCUG 上,膀胱排空后确保上尿路引流十分重要。VCUG 显示引流不良,尤其在 USS 显示明显上尿路扩张的情况下,可能提示 “反流性并梗阻性” 巨大输尿管。20
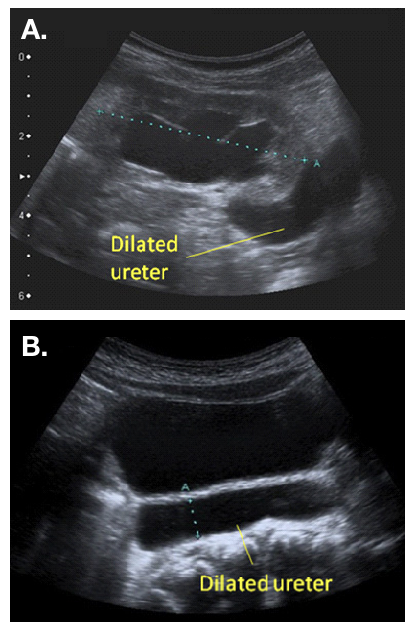
图 2 扩张的输尿管的超声表现,可见从扩张的肾盂延续而出(a),并在膀胱后方可见(b)
在不存在VUR或尿道梗阻的情况下,应在满6周龄后进行动态肾显像,如99mTc-MAG-3利尿肾显像,并复查超声检查。这些检查将有助于区分”梗阻性”或”非梗阻-非返流性”巨输尿管。出生后就诊的婴儿(例如,伴有UTI)也以类似方式进行检查,但在开始进行VCUG或MAG-3肾显像之前,最好先等待泌尿源性脓毒症恢复。20
根据欧洲核医学协会(EANM)关于儿童标准和利尿性肾图检查的指南,肾图检查可用于评估肾功能的两个方面。23 第一个方面是肾清除率,即差异肾功能(DRF)。DRF的估算以示踪剂注射后1–2分钟进行为佳。第二个方面是示踪剂从肾脏的排泄(或消失)。传统上,明显的排泄延迟表现为曲线持续上升并出现延迟通过,即Tmax(达到曲线最大值或峰值所需的时间)超过20分钟(图3)。然而,延迟通过可能是由于扩张的肾盂和输尿管带来的容量增加所致。因此,给予呋塞米以区分梗阻与扩张系统效应。引流不良也可能因为膀胱充盈,或由于重力对引流的作用不充分而出现。基于上述原因,对利尿性肾图中“引流受损”的解释存在争议。24
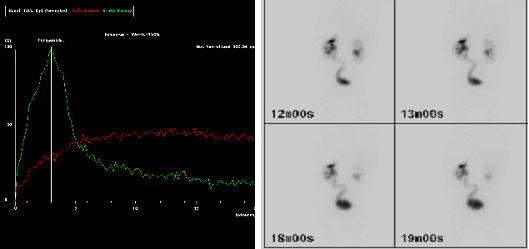
图3 MAG-3 图像显示在 20 分钟(a)时示踪剂(红色曲线)引流延迟,并在延迟成像(b)中可见左侧(L)输尿管,提示左侧输尿管膀胱连接处(UVJ)存在阻滞。
在将巨输尿管判定为”梗阻性”或”非梗阻性”时,必须综合考虑临床与影像学发现。出现症状(如发热性尿路感染或疼痛)是提示可能存在梗阻的临床指标。在无症状患者中,DRF低于40%,和/或在连续超声随访中扩张进行性增加,也提示梗阻并构成干预指征。对于无症状患者,若在扩张稳定或改善、且DRF高于40%的情况下,MAG-3显示排泄延迟,可采用保守治疗。20 Liu et al 和 McLellan et al 提出,膀胱后段输尿管直径大于10 mm的患儿更可能需要手术干预。4,25
需要注意的是,同侧的UPJ和UVJ梗阻可能同时存在。术前MAG-3在发现梗阻的输尿管先缓慢充盈而后无法引流时,可能提示双重病变。在这种情况下,逆行肾盂造影有助于作出诊断。26
处理
原发性巨输尿管的管理在过去30年中发生了变化。1989年,Peters 等人 报道,89%的患者在8个月龄之前需要手术。27 同年,Keating 等人 报道,当干预决策基于绝对肾功能时,高达87%的患者可以保守随访。28 来自同一单位的进一步发表证实,对同一组采取保守管理的患者进行长期随访时,其病情稳定或有所改善。29 Liu 等人 也提出,大多数巨输尿管可进行保守随访,并显示在平均随访3.1年时,34%的原发性巨输尿管可自行缓解。其余病例中,17%因突破性感染或肾功能恶化而接受输尿管再植术,而49%在随访时仍存在持续性扩张,继续保守随访。4
非梗阻性、非返流性巨大输尿管
对于无症状患儿合并DRF >40%的巨输尿管,可采取保守治疗。建议密切随访,进行间隔性超声检查并给予抗生素预防,尤其当输尿管扩张超过7mm时21 Song et al 显示,与UPJ梗阻相比,UVJ梗阻的UTI风险更高,且UTI多发生在出生后前六个月。30 一旦观察到肾积水有所改善,随访频率可先改为每6个月一次,随后每年一次,并可停用抗生素预防。肾盂输尿管积水的消退可能需要数年。McLellan et al 报告在中位随访25.8个月时,72%的病例肾积水完全消退。25
对于扩张持续存在的情况,建议进行长期随访。Shukla 等人 的一项长期随访研究报告了一名14岁双侧原发性巨输尿管男孩的晚期恶化,该患儿在结束保守随访后6年出现扩张加重和功能恶化。31 Hemal 等人. 30 报告了55例在生命第三个十年首次就诊的先天性巨输尿管患者的结局,其中20例发现有肾结石。5例双侧巨输尿管患者在诊断时已处于慢性肾功能衰竭,其中2例最终死于该病。32 因此,经保守治疗后出现的早期缓解并非终身保证,建议随访至成年期。
梗阻性巨输尿管
梗阻的诊断依据为:在诊断时DRF降低至<40%,或在间隔复查肾图显像时DRF下降>10%。在USS上扩张加重,以及出现症状(UTI/疼痛)也提示梗阻。手术干预的选择取决于患儿年龄(小于或大于1岁),以及在考虑内镜方案时设备和专业技术的可获得性。外科治疗选择包括:
- 输尿管再植术(开放/腹腔镜或机器人辅助手术)
- 暂时性双J支架留置
- 内镜下球囊扩张 ± 输尿管内切开术
- 返流性输尿管膀胱吻合术
- 输尿管皮肤造口术
输尿管再植术
输尿管再植的目的在于切除无蠕动、狭窄的 UVJ 段,并以防反流的方式将输尿管隧道化进入膀胱。依据 Paquin 于 1959 年的研究,隧道长度至少需为输尿管直径的五倍方能有效。33 为达到该比例,当输尿管直径超过 10 mm 时,输尿管远端 10 cm 可能需要行缩径。亦可能需要进行腰大肌悬吊,以确保输尿管直线进入膀胱。用于巨输尿管整形的两种最常用技术是 Starr 和 Kalicinski et al. 报道的褶皱缝合术,以及 Hendren 改良的缩径术。34,35,36 Kalicinski et al 描述了一种折叠技术,即通过纵行连续缝合将输尿管外侧无血管部分自管腔中排除,随后在再植前向后折叠。Starr 对该术式进行了改良,引入多枚间断 Lembert 缝合,将输尿管壁向内折叠,从而保留其血供,但使随后的再植更为繁琐。Hendren 主张切除式缩径,即切除冗余输尿管的一条纵行条带,并将输尿管分两层缝合。35,36 Ben-Meir et al 比较了巨输尿管再植在行与不行整形情况下的结局,结果显示结局无显著差异(整形组成功率为 94%,未整形组为 96%)。37 关于伴随缩径的再植示例见(图 4 和 图 5)。
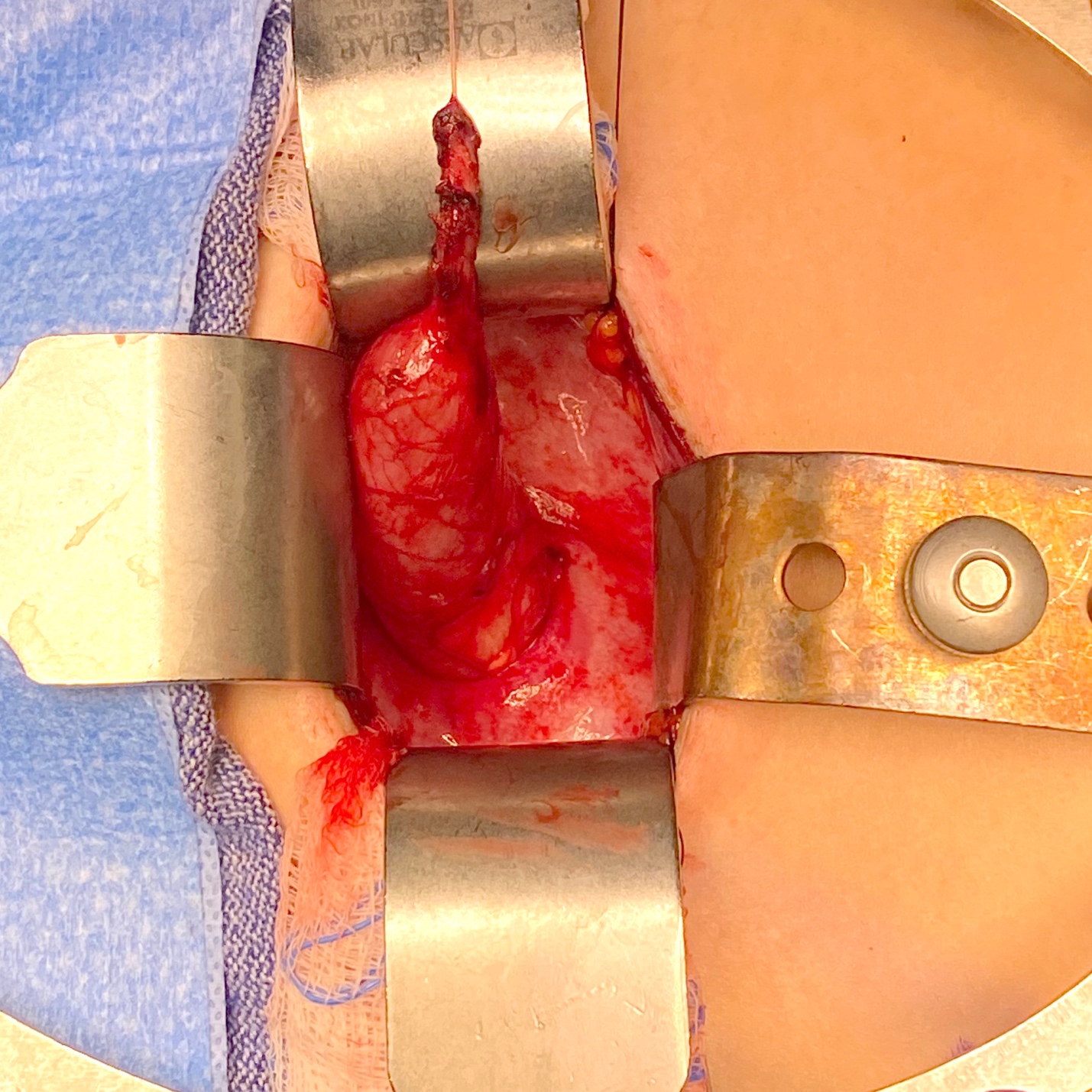
图 4 巨输尿管伴无蠕动节段及近端扩张的术中视图。
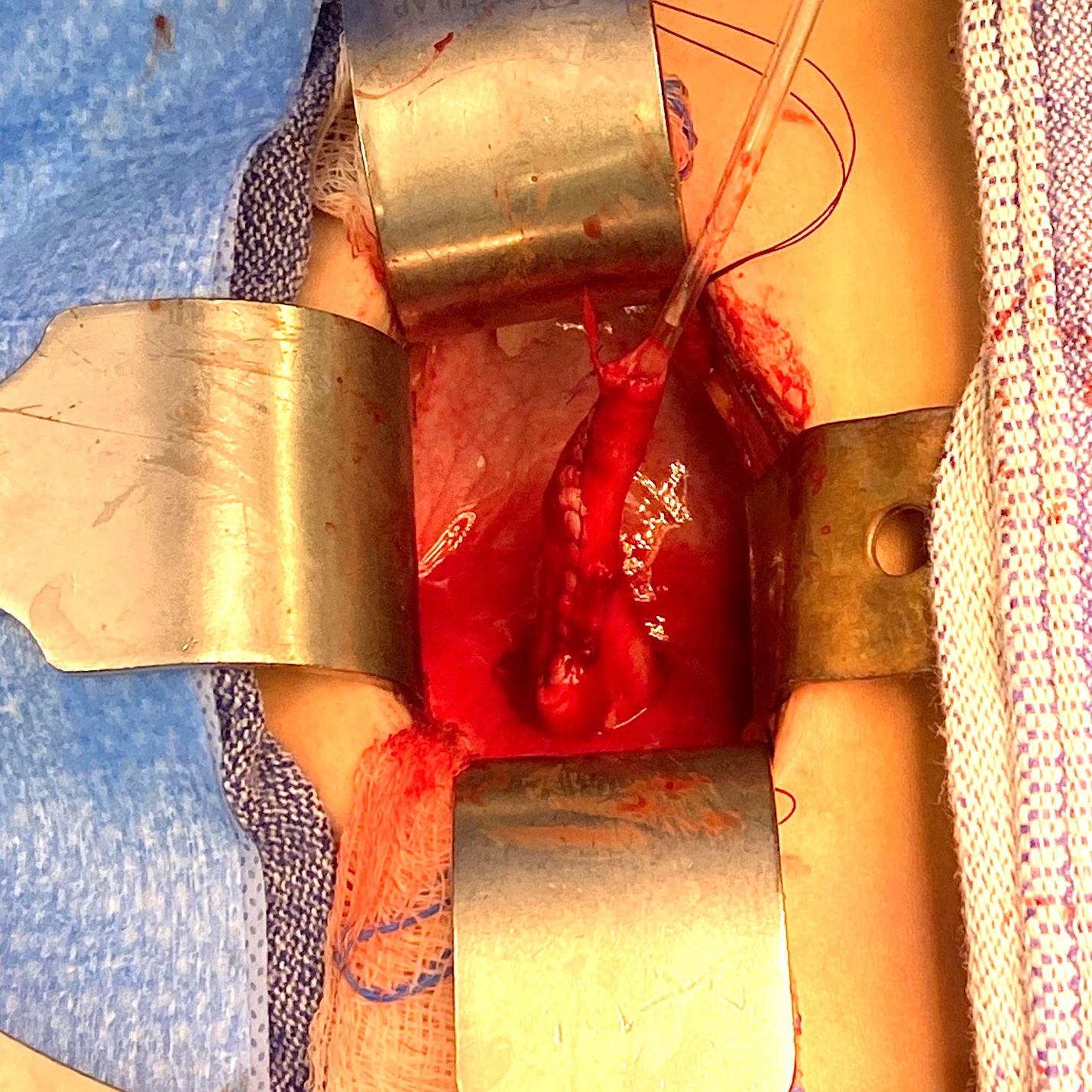
图5 来自图4的同一输尿管,在以 10 Fr 导管为芯进行锥形化后之术中视图。随后通过建立跨膀胱三角隧道,将其经隧道通过并予以固定,完成再植。留置输尿管支架 2 周。
当采用腹腔镜或机器人辅助(RALUR)技术时,常优先选择膀胱外 Lich–Gregoir 再植术。38,39,40 在髂血管下方辨认扩张的输尿管,并沿输尿管切开分离腹膜,直至与输精管交叉的水平。以钝性分离游离输尿管,以尽量减少对神经及血供的损伤风险,随后在狭窄处将其离断。使用钩形电凝标记浆肌层隧道的走行,然后用剪刀锐性切开逼尿肌纤维,直至膀胱黏膜自由隆起。于隧道末端切开膀胱黏膜,采用间断缝合完成输尿管膀胱吻合。随后将输尿管置入隧道内,并以连续或间断缝合对合该隧道。
文献报道,在多项相对小样本系列中,膀胱外入路的 RALUR 术后 VUR 消失率范围为 66.7% 至 100%。40 合并这些系列后的总体成功率为 91%。一项多机构回顾性研究在 280 条输尿管中报告了 87.9% 的影像学消失。近期,一项大型前瞻性的多机构研究在 199 条输尿管中报告了 93.8% 的消失率。40 RALUR 可行双侧手术;然而,人们担心对膀胱后方进行双侧分离可能破坏盆神经丛,导致较高的术后尿潴留发生率。为降低此并发症,已提出保神经分离技术。2008 年,Casale 等人 报告在 41 例患者中行双侧保神经 RALUR 后成功率为 97.6%。41 未出现并发症或尿潴留。Herz 等人 报告单侧 RALUR 的成功率为 91.7%,而双侧病例的成功率仅为按输尿管计 77.8%(按患儿计 72.2%)。在该研究中,双侧病例的并发症发生率(包括输尿管梗阻、再入院和尿潴留)更高。未采用保神经技术。42
一岁以下婴儿的输尿管再植术可能具有挑战性,因为显著扩张的输尿管与婴儿小膀胱之间存在不匹配,同时还担心可能出现医源性膀胱功能障碍。De Jong et al 调查了49名患有原发性梗阻性或返流性巨输尿管并接受 Politano-Leadbetter 手术的新生儿和婴儿,在平均7.3年随访时的膀胱功能结局。43 随访未见出现排尿功能障碍,且相对于年龄的膀胱容量显著增大。亦未观察到术后输尿管梗阻。作者总结认为,只要由专门的儿科泌尿外科医生实施,早期下尿路的大型重建并不损害膀胱和盆底的尿动力学特性。同一研究组的另一项研究 41 比较了在一岁之前或之后接受输尿管再植术的患者之尿动力学结局,未发现膀胱容量、顺应性或不稳定发生率存在显著差异。44
临时输尿管双J支架置入
1999年,Shenoy 和 Rance 报道了将双J支架作为原发性梗阻性巨大输尿管婴儿的暂时性处理措施的应用。45 该操作包括置入双猪尾支架,尽可能经内镜进行。严重的输尿管膀胱连接部(UVJ)梗阻可能使内镜置入无法进行,此时可经膀胱造口行开放置入,并使用泪道探针扩张输尿管开口。支架获批的留置时间为6个月,随后应予以拔除或更换。巨大输尿管应持续留置支架直至婴儿超过1岁;若届时扩张仍未缓解,则可安全行输尿管再植术。45 在支架留置期间,由于存在支架感染风险,婴儿应持续接受预防性抗生素治疗,并应通过超声监测以确保系统减压,并检查支架位置。46 支架拔除后3个月进行的超声检查和MAG-3肾动态显像将指导进一步处理。若扩张和引流改善且功能保留,可能无需进一步干预。经过一段时间支架留置后扩张仍持续或加重,或出现进一步感染,则提示需要行输尿管再植术。一项长期结局研究显示,56%的病例在拔除支架后无需进一步干预。然而,三分之二的患者需要开放置入支架,且三分之一出现并发症(移位、结石形成和感染)。47
内镜下球囊扩张术
内镜治疗已被接受为一种创伤较小的治疗选择。内镜途径的优势包括微创、不干扰输尿管远端血供,以及无需长期留置导尿管。48 此外,若内镜治疗失败,仍可进行输尿管再植术。然而,为取出支架而可能需要的二次麻醉必须在有关内镜途径风险的讨论中予以考虑。该操作使用小儿硬性膀胱镜(8F–10.5F),并置入柔性导丝至肾盂。对于高压球囊扩张(HPBD),使用球囊导管(通常3F–5F,球囊长度2–4 cm,充盈后球囊直径3–7 mm)扩张输尿管膀胱连接部,随后置入双J输尿管支架。对于切开式输尿管切开术,Kajbafzadeh 等人 和 Shirazi 和 等人 均在6点位处行切开。49,50,51
Doudt 等 发表了一项关于内镜治疗长期结局的系统综述。48 共纳入11项回顾性和1项前瞻性、单机构病例系列。手术时平均年龄为24.6个月(范围3–84)。首次内镜治疗尝试在10.5%的病例中未能奏效,原因要么是无法在内镜下送入支架,要么是儿科膀胱镜经尿道推进困难。有效完成的内镜方案包括:49.5%为膀胱镜+高压球囊扩张(HPBD)+置入Double-J输尿管支架,27.8%为膀胱镜+切开性输尿管切开术+置入Double-J输尿管支架,18.9%为膀胱镜+置入Double-J输尿管支架,3.7%为膀胱镜+HPBD+切开性输尿管切开术+置入Double-J输尿管支架。支架平均留置时间为2.3个月(范围0.25–6)。在平均随访3.2年时,初次成功率为76.7%。15.1%的病例接受了内镜再治疗,整体外科再次干预率为36.7%。作者总结认为,对于年龄>12个月且POM持续或进展的儿童,内镜治疗是输尿管再植术的一种微创替代方案,其成功率中等。在婴儿中,它可能最适合作为一种临时性权宜措施。约三分之一的患者需要外科再次干预。48
反流性再植术
Kaefer 提出了一个处理婴儿阻塞性巨大输尿管的全新方法,分两期实施。52 第一期在无需顾虑建立抗返流机制的情况下解除梗阻:仅需在阻塞近端将输尿管切断,并与膀胱行端侧返流性吻合;随后,随着婴儿期膀胱体积增大,进行第二期手术,即行标准锥形输尿管再植术,并建立抗返流瓣膜机制。52,53 Alyami et al 报道了他们在32例产前诊断为远端输尿管梗阻患儿中采用返流性再植术的经验。54 手术时平均年龄为3.7个月(范围0至33),平均随访34.3个月(范围6至58)。多数男性患儿亦同时行包皮环切术。32例中,86%显示扩张显著改善。6例接受了进一步手术,包括包皮环切术以及因反复感染行的2例输尿管再植术。作者总结认为,尽管通过制造返流来解除梗阻存在权衡,这一术式对于保持无感染的患儿可被视为潜在的根治性干预。密切随访对于证实令人满意的长期疗效至关重要。54
皮肤输尿管造口术
暂时性皮肤输尿管造口术仍然是一种安全且有效的选择,尤其是在存在尿源性败血症时,或在无法获得内镜技术的情况下。Shrestha 等人 发表了25例接受端式皮肤输尿管造口术(ECU)POM 的患者结局,手术时平均年龄为7个月(范围23天至2.5岁)。尿流改道后,所有患者的肾衰竭均已缓解,并且在等待再植期间有1例发生了发热性尿路感染(UTI)。55 该研究未报告造口并发症,尽管其他研究已报告并发症,包括造口狭窄和肾盂肾炎。56
结论
与巨输尿管相关的UVJ异常可为梗阻性、反流性、非梗阻且不反流,或既反流又梗阻。仅有10-20%的巨输尿管需要干预,其余可保守监测。手术选择包括输尿管再植术(可伴或不伴输尿管减径整形)、内镜手术、反流性输尿管膀胱新吻合术,或皮肤输尿管造口术。由于存在长期结石形成的风险,非梗阻、非反流型巨输尿管的持续扩张需要重视。
要点
- 警惕罕见的返流性且梗阻性的巨输尿管:当在排尿期膀胱尿道造影(VCUG)上确诊高分级膀胱输尿管返流(VUR)时,注意观察膀胱排空后的上尿路引流情况。如存在与显著上尿路扩张相关的引流不良,应行利尿性MAG-3肾动态显像(renogram)。在这种情况下,输尿管再植术是最佳选择。
- 输尿管膀胱连接部(UVJ)和肾盂输尿管连接部(UPJ)的梗阻可同时存在。留意肾盂与输尿管扩张程度的不一致,尤其是当一处似乎改善而另一处未改善时。检查MAG-3肾动态显像以评估两个连接处的引流。如存在高度怀疑,可通过逆行肾盂造影辅助诊断。初始外科策略可为肾盂成形术并置入双J支架;其后于拔除支架后再行进一步影像学评估。
- 对非梗阻、非返流型巨输尿管采取保守治疗时,现有文献建议当输尿管扩张超过7 mm时给予抗生素预防;发生泌尿道感染(UTI)的最高风险在生命的第一年。
- 对于儿童期仍未自行缓解的输尿管扩张,建议进行长期随访,因为双侧病例存在结石形成或肾功能恶化的长期风险。
参考文献
- Ferenci P, Lockwood A, Mullen K, Tarter R, Weissenborn K, Blei AT. Hepatic encephalopathy-Definition, nomenclature, diagnosis, and quantification: Final report of the Working Party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology 1977; 35 (3): 716–721. DOI: 10.1053/jhep.2002.31250.
- King LR. Megaloureter: Definition, Diagnosis and Management. J Urol 1980; 123 (2): 222–223. DOI: 10.1016/s0022-5347(17)55867-x.
- Pfister RC, Hendren WH. Primary megaureter in children and adults Clinical and pathophysiologic features of 150 ureters. Urology 1978; 12 (2): 160–176. DOI: 10.1016/0090-4295(78)90327-8.
- Liu HYA, Dhillon HK, Yeung CK, Diamond DA, Duffy PG, Ransley PG. Clinical Outcome and Management of Prenatally Diagnosed Primary Megaureters. J Urol 1994; 152 (2 Part 2): 614–617. DOI: 10.1016/s0022-5347(17)32664-2.
- Cussen LJ. Normal Position of the Ureteral Orifice in Infancy and Childhood: A Quantitative Study. J Urol 1967; 121 (5): 646–647. DOI: 10.1016/s0022-5347(17)56920-7.
- Hellström M, Hjälmås K, Jacobsson B, Jodal U, Odén A. Normal Ureteral Diameter in Infancy and Childhood. Acta Radiol Diagn (Stockh) 1985; 26 (4): 433–439. DOI: 10.1177/028418518502600412.
- Stahl DA, Koul HK, Chacko JK, Mingin GC. Congenital anomalies of the kidney and urinary tract (CAKUT): A current review of cell signaling processes in ureteral development. J Pediatr Urol 2006; 2 (1): 2–9. DOI: 10.1016/j.jpurol.2005.04.006.
- Woolf AS. A molecular and genetic view of human renal and urinary tract malformations. Kidney Int 2000; 58 (2): 500–512. DOI: 10.1046/j.1523-1755.2000.00196.x.
- Takahashi M. The GDNF/RET signaling pathway and human diseases. Cytokine Growth Factor Rev 2001; 12 (4): 361–373. DOI: 10.1016/s1359-6101(01)00012-0.
- Batourina E, Choi C, Paragas N, Bello N, Hensle T, Costantini FD. Faculty Opinions recommendation of Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2002; 32. DOI: 10.3410/f.1009006.124259.
- Viana R, Batourina E, Huang H, Dressler GR, Kobayashi A, Behringer RR, et al.. The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134 (20): 3763–3769. DOI: 10.1242/dev.011270.
- Batourina E, Tsai S, Lambert S, Sprenkle P, Viana R, Dutta S. Faculty Opinions recommendation of Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2005; 37. DOI: 10.3410/f.1029077.343528.
- Pirker ME, Rolle U, Shinkai T, Shinkai M, Puri P. Prenatal and Postnatal Neuromuscular Development of the Ureterovesical Junction. J Urol 2007; 177 (4): 1546–1551. DOI: 10.1016/j.juro.2006.11.081.
- Matsuno T, Tokunaka S, Koyanagi T. Muscular Development in the Urinary Tract. J Urol 1984; 132 (1): 148–152. DOI: 10.1016/s0022-5347(17)49508-5.
- Tanagho EA, Meyers FH, Smith DR. The Trigone: Anatomical and Physiological Considerations. 1. In Relation to the Ureterovesical Junction. J Urol 1968; 100 (5): 623–632. DOI: 10.1016/s0022-5347(17)62584-9.
- Tanagho EA. Intrauterine Fetal Ureteral Obstruction. J Urol 1973; 109 (2): 196–203. DOI: 10.1016/s0022-5347(17)60388-4.
- Lee BR, Silver RI, Partin AW, Epstein JI, Gearhart JP. A Quantitative Histologic Analysis of Collagen Subtypes: The Primary Obstructed and Refluxing Megaureter of Childhood. Urology 1998; 51 (5): 820–823. DOI: 10.1016/s0090-4295(98)00013-2.
- Nguyen HT, Herndon CDA, Cooper C, Gatti J, Kirsch A, Kokorowski P. The Society for Fetal Urology consensus statement on the evaluation and management of antenatal hydronephrosis. Yearbook of Urology 2010; 2010: 209. DOI: 10.1016/s0084-4071(10)79537-3.
- Rubenwolf P, Herrmann-Nuber J, Schreckenberger M, Stein R, Beetz R. Primary non-refluxive megaureter in children: single-center experience and follow-up of 212 patients. Int Urol Nephrol 2016; 48 (11): 1743–1749. DOI: 10.1007/s11255-016-1384-y.
- Farrugia M-K, Hitchcock R, Radford A, Burki T, Robb A, Murphy F. British Association of Paediatric Urologists consensus statement on the management of the primary obstructive megaureter. J Pediatr Urol 2014; 10 (1): 26–33. DOI: 10.1016/j.jpurol.2013.09.018.
- Holzman SA, Braga LH, Zee RS, Herndon CDA, Davis-Dao CA, Kern NG. Correspondence to the article ‘risk of urinary tract infection in patients with hydroureter: an analysis from the society of fetal urology prenatal hydronephrosis registry.’ J Pediatr Urol 2021; 18 (5): 722–723. DOI: 10.1016/j.jpurol.2022.07.031.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 10: 982–998. DOI: 10.3410/f.725257762.793506733.
- Gordon I, Piepsz A, Sixt R. Guidelines for standard and diuretic renogram in children. Eur J Nucl Med Mol Imaging 2011; 38 (6): 1175–1188. DOI: 10.1007/s00259-011-1811-3.
- Gordon I. Diuretic renography in infants with prenatal unilateral hydronephrosis: an explanation for the controversy about poor drainage. BJU Int 2001; 87 (6): 551–555. DOI: 10.1046/j.1464-410x.2001.00081.x.
- McLELLAN DAWNL, RETIK ALANB, BAUER STUARTB, DIAMOND DAVIDA, ATALA ANTHONY, MANDELL JAMES, et al.. Rate and Predictors of Spontaneous Resolution of Prenatally Diagnosed Primary Nonrefluxing Megaureter. J Urol 2002: 2177–2180. DOI: 10.1097/00005392-200211000-00091.
- CAY ALI, IMAMOGLU MUSTAFA, BAHAT ELIF, SARIHAN HALUK. Diagnostic difficulties in children with coexisting pelvi-ureteric and vesico-ureteric junction obstruction. BJU Int 2006; 98 (1): 177–182. DOI: 10.1111/j.1464-410x.2006.06187.x.
- Peters CA, Mandell J, Lebowitz RL, Colodny AH, Bauer SB, Hendren WH. Congenital obstructed megaureters in early infancy: Diagnosis and treatment. J Pediatr Surg 1989; 25 (5): 576. DOI: 10.1016/0022-3468(90)90639-q.
- Keating MA, Escala J, Snyder HMC, Heyman S, Duckett JW. Changing Concepts in Management of Primary Obstructive Megaureter. J Urol 1989; 142 (2 Part 2): 636–640. DOI: 10.1016/s0022-5347(17)38841-9.
- Baskin LS, Zderic SA, Snyder HM, Duckett JW. Primary Dilated Megaureter: Long-Term Followup. J Urol 1994; 152 (2 Part 2): 618–621. DOI: 10.1016/s0022-5347(17)32665-4.
- Song S-H, Lee S-B, Park YS, Kim KS. Is Antibiotic Prophylaxis Necessary in Infants With Obstructive Hydronephrosis? J Urol 2007; 177 (3): 1098–1101. DOI: 10.1016/j.juro.2006.11.002.
- SHUKLA ASEEMR, COOPER JEFFREY, PATEL RAKESHP, CARR MICHAELC, CANNING DOUGLASA, ZDERIC STEPHENA, et al.. Prenatally Detected Primary Megaureter: A Role For Extended Followup. J Urol 2005; 173 (4): 1353–1356. DOI: 10.1097/01.ju.0000152319.72909.52.
- Hemal AK, Ansari MS, Doddamani D, Gupta NP. Symptomatic and complicated adult and adolescent primary obstructive megaureter–indications for surgery: analysis, outcome, and follow-up. Urology 2003; 61 (4): 703–707. DOI: 10.1016/s0090-4295(02)02590-6.
- Paquin AJ. Ureterovesical Anastomosis: the Description and Evaluation of a Technique. J Urol 1959; 82 (5): 573–583. DOI: 10.1016/s0022-5347(17)65934-2.
- Villanueva CA. Extracorporeal ureteral tailoring during HIDES laparoscopic robotic-assisted ureteral reimplantation for megaureter. J Pediatr Urol 1979; 11 (6): 362–363. DOI: 10.1016/j.jpurol.2015.08.006.
- Kaliciński ZH, Kansy J, Kotarbińska B, Joszt WLELA. Surgery of megaureters–Modification of Hendren’s operation. J Pediatr Surg 1977; 12 (2): 183–188. DOI: 10.1016/s0022-3468(77)80005-5.
- Hendren WH. Operative Repair of Megaureter in Children. J Urol 1969; 101 (4): 491–507. DOI: 10.1016/s0022-5347(17)62370-x.
- Ben-Meir D, McMullin N, Kimber C, Gibikote S, Kongola K, Hutson JM. Reimplantation of obstructive megaureters with and without tailoring. J Pediatr Urol 2006; 2 (3): 178–181. DOI: 10.1016/j.jpurol.2005.05.010.
- Stanasel I, Atala A, Hemal A. Robotic Assisted Ureteral Reimplantation: Current Status. Curr Urol Rep 2013; 14 (1): 32–36. DOI: 10.1007/s11934-012-0298-1.
- LEE S, AKBAL C, KAEFER M, Chertin B, Pollack A, Koulikov D. Laparoscopic Ureteral Reimplantation With Extracorporeal Tailoring for Megaureter: A Simple Technical Nuance. J Urol 2006; 176 (6): 2640–2642. DOI: 10.1016/j.juro.2006.08.025.
- Bilgutay AN, Kirsch AJ. Robotic Ureteral Reconstruction in the Pediatric Population. Front Pediatr 2019; 7. DOI: 10.3389/fped.2019.00085.
- Casale P, Patel RP, Kolon TF. Nerve Sparing Robotic Extravesical Ureteral Reimplantation. J Urol 2008; 179 (5): 1987–1990. DOI: 10.1016/j.juro.2008.01.062.
- Herz D, Fuchs M, Todd A, McLeod D, Smith J. Robot-assisted laparoscopic extravesical ureteral reimplant: A critical look at surgical outcomes. J Pediatr Urol 2016; 12 (6): 402.e1–402.e9. DOI: 10.1016/j.jpurol.2016.05.042.
- Nelson CP. Obstructing congenital anomalies of the urinary tract: ureteropelvic junction obstruction, ureterocele, megaureter, and posterior urethral valves. The Brady Urology Manual 1997; 65: 207–220. DOI: 10.1201/9780429194993-21.
- KORT LAETITIAMO de, KLIJN AARTJ, UITERWAAL CUNOSPM, JONG TOMPVM de. Ureteral Reimplantation In Infants And Children: J Urol 2002; 167: 285–287. DOI: 10.1097/00005392-200201000-00084.
- Shenoy, Rance. Is there a place for the insertion of a JJ stent as a temporizing procedure for symptomatic partial congenital vesico-ureteric junction obstruction in infancy? BJU Int 1999; 84 (4): 524–525. DOI: 10.1046/j.1464-410x.1999.00256.x.
- Farrugia M-K, Steinbrecher HA, Malone PS. The utilization of stents in the management of primary obstructive megaureters requiring intervention before 1 year of age. J Pediatr Urol 2011; 7 (2): 198–202. DOI: 10.1016/j.jpurol.2010.04.015.
- Farrugia MK, Steinbrecher HA, Malone PS. Re: The Utilization of Stents in the Management of Primary Obstructive Megaureters Requiring Intervention Before 1 Year of Age. J Urol 2011; 186 (5): 2063–2063. DOI: 10.1016/j.juro.2011.07.142.
- Doudt AD, Pusateri CR, Christman MS. Endoscopic Management of Primary Obstructive Megaureter: A Systematic Review. J Endourol 2018; 32 (6): 482–487. DOI: 10.1089/end.2017.0434.
- Kajbafzadeh A-M, Payabvash S, Salmasi AH, Arshadi H, Hashemi S-M, Arabian S, et al.. Endoureterotomy for Treatment of Primary Obstructive Megaureter in Children. J Endourol 2007; 21 (7): 743–749. DOI: 10.1089/end.2006.0330.
- Tourchi A, Kajbafzadeh AM, Mazaheri T, Raad M. Endoscopic Management of Obstructive Refluxing Megaureter: a Novel Approach. J Pediatr Urol 2010; 6: S62. DOI: 10.1016/j.jpurol.2010.02.110.
- Shirazi M, Natami M, Hekmati P, Farsiani M. Result of Endoureterotomy in the Management of Primary Obstructive Megaureter in the First Year of Life: Preliminary Report. J Endourol 2014; 28 (1): 79–83. DOI: 10.1089/end.2013.0098.
- LEE SANGDON, AKBAL CEM, KAEFER MARTIN. Refluxing Ureteral Reimplant As Temporary Treatment Of Obstructive Megaureter In Neonate And Infant. J Urol 2005; 173 (4): 1357–1360. DOI: 10.1097/01.ju.0000152317.72166.df.
- Kaefer M, Misseri R, Frank E, Rhee A, Lee D. Re: Refluxing Ureteral Reimplantation: A Logical Method for Managing Neonatal UVJ Obstruction. J Urol 2014; 194 (2): 518–518. DOI: 10.1016/j.juro.2015.05.043.
- Alyami FA, Koyle MA, Bowlin PR, Gleason JM, Braga LH, Lorenzo AJ. Side-to-Side Refluxing Nondismembered Ureterocystotomy: A Novel Strategy to Address Obstructed Megaureters in Children. J Urol 2017; 198 (5): 1159–1167. DOI: 10.1016/j.juro.2017.05.078.
- Shrestha AL, Bal HS, Kisku SMC, Sen S. Commentary to “Outcome of end cutaneous ureterostomy (ECU) as a non conservative option in the management of primary obstructive megaureters (POM).” J Pediatr Urol 2018; 15 (3): 294–295. DOI: 10.1016/j.jpurol.2019.02.024.
- Kitchens DM, DeFoor W, Minevich E, Reddy P, Polsky E, McGregor A, et al.. End Cutaneous Ureterostomy for the Management of Severe Hydronephrosis. J Urol 2007; 177 (4): 1501–1504. DOI: 10.1016/j.juro.2006.11.076.
最近更新时间: 2025-09-22 08:00