14: 肾积水和肾盂输尿管连接部梗阻
阅读本章大约需要 10 分钟。
引言
肾积水定义为肾盂的无菌性扩张,可伴或不伴肾盏扩张。若发生在出生前,称为产前肾积水(ANH)。存在感染性肾积水称为肾积脓;而当扩张的肾盂伴有扩张的输尿管时,称为肾盂输尿管积水(HUN)。
ANH 的重要性在于,它是通过超声检查最常见检测到的胎儿泌尿道异常。1 大多数 ANH 为暂时性,且可自行消退。ANH 的其他病理性原因可为梗阻性或非梗阻性。梗阻性原因可发生于泌尿道的任何部位,但最常见的病变是肾盂输尿管连接部梗阻(UPJO)。非梗阻性病因包括膀胱输尿管返流(VUR)、非梗阻性非返流性巨大输尿管、梅干腹综合征等。
小儿泌尿外科医生使用多种工具来评估 ANH 的严重程度。北美地区主要依赖胎儿泌尿学会(SFU)分级系统,而欧洲更倾向于测量 APRPD。2
UPJO 被定义为尿液自肾盂向输尿管的流出受阻,并继发肾盂肾盏系统扩张。RBUS 显示肾盂扩张而输尿管未扩张时,应怀疑 UPJO。
本章将讨论 ANH 和 UPJO 的胚胎学、流行病学、病因学、诊断、评估、治疗选择、随访以及并发症。ANH 的其余病因将在其他章节中涵盖。
胚胎学
肾脏由三个相互重叠、依次出现的结构发育而来:前肾、中肾和后肾,它们均源自中间中胚层中的一个区域,称为泌尿生殖嵴。3 在妊娠第4周,前肾出现在颈部区域。随后,中间中胚层的分节部分相连,形成前肾管,该管自颈部区域延伸至胚胎远端(泄殖腔)。前肾不具功能,并在妊娠第4周末完全退化。
随后,中肾在前肾的尾侧出现,而前肾管的持续存在诱导中间中胚层形成中肾小管,这些小管开口于前肾管,从而形成中肾(沃尔夫)管。输尿管芽起源于中肾管的后侧部。
后肾在胚胎发育第5周出现。随后,输尿管芽与后肾帽结合。输尿管芽产生输尿管的黏膜、肾盂、大小肾盏以及集合管。包绕输尿管芽的间充质形成输尿管和肾盂的固有层、肌层和外膜。输尿管与肾盂的正常发育依赖其间充质与上皮成分之间的相互信号传导。信号异常会导致输尿管芽的发育及分支异常。完全性重复输尿管源于同侧出现两个输尿管芽,而不完全性重复输尿管则源于输尿管芽的早期分叉。若输尿管芽在较晚期分叉,则形成分叉肾盂。Weigert-Meyer 定律描述了完全性重复输尿管中两条输尿管之间的关系。上半肾输尿管在膀胱的开口位于下内侧处,常因输尿管囊肿或异位输尿管而受阻。相反,下半肾输尿管在膀胱的开口位于上外侧处,由于壁内段较短,易发生膀胱输尿管返流(VUR)。此外,还可受肾盂输尿管连接部梗阻(UPJO)累及。
最终,输尿管成腔和输尿管壁成熟在胚胎发生末期完成。然而,后者在出生后仍持续,这可能解释许多被诊断为ANH的病例的自发消退。胎儿肾脏在妊娠第5至第9周开始产生尿液。尿液约占羊水的90%,而羊水又负责肺泡的扩张。因此,少羊水与肺发育不全相关,临床表现为呼吸窘迫。尿生殖窦在妊娠第10至第12周发育形成膀胱和尿道。
流行病学
ANH 是通过胎儿超声检查检测到的泌尿道最常见异常。它影响所有妊娠的1%至5%。幸运的是,高达80%的病例是暂时性的,并可自行缓解。UPJO 是病理性 ANH 最常见的病因,通常通过外科手术干预进行治疗。其在男孩中的发生率是女孩的两倍,且左侧受累的发生率是右侧的两倍。UPJO 可在10%至30%的病例中累及双肾。
UPJO通常为散发性,但文献中已有6例具有家族史的报道。4 UPJO可与其他泌尿系统畸形同时发生(例如,VUR、多囊性发育不良肾(MCDK)、马蹄肾,或重复肾,其中以下半肾最常受累)。
病因/发病机制
大多数 ANH 是暂时性的,并会随着时间自行改善。出生后仍未自行消退的病理性原因可能由梗阻性或非梗阻性病因所致。梗阻性原因包括;UPJO、梗阻性巨输尿管、输尿管膨出、异位输尿管、后尿道瓣膜 (PUV)、尿道闭锁,以及神经源性膀胱。非梗阻性病因包括;VUR、非梗阻性非返流性巨输尿管、无腹肌综合征。
据 Josephson 等人报道,梗阻伴有肾血流量(RBF)、肾小球滤过率(GFR)和钾排泄的降低,且早期干预仅能缓解其中极小比例的损害。5
UPJO 的病因
原发性UPJO可由内源性、外源性或腔内原因引起。6 内源性梗阻是由于异常肌层或神经发育导致的无蠕动节段所致。这导致尿液从肾盂向输尿管的流动不正常。内源性梗阻的其他原因包括由过度胶原沉积引起的狭窄节段以及先天性输尿管皱襞。
外在性梗阻是由一条在输尿管肾盂连接部(UPJ)前方通过的异常交叉血管所致。此类梗阻通常为间歇性,常于7岁及以上的年龄才出现。腔内性梗阻则源于纤维上皮性息肉。该病变可累及泌尿道的任何部位,自UPJ起至尿道。7继发性UPJO可由于既往手术、VUR、嵌顿结石以及炎症后狭窄所致。
与UPJO相关的异常包括;对侧UPJO(10-30%)、对侧肾发育不良、对侧多囊性发育不良肾(MCDK)、单侧肾缺如(5%)、重复集合系统,其中UPJO通常发生在下分肾, 马蹄肾、异位肾、膀胱输尿管返流(VUR)(20-40%)以及VACTERL综合征。8,9
为避免肾盂内压力进行性升高,肾盂会扩张以适应,从而防止肾损伤。然而,梗阻长期存在且代偿机制失败并伴顺应性丧失,会导致肾内压力升高,继而发生肾损伤。胎儿期梗阻出现得越早,预期肾损伤越重。Dietl危象是由肾盂肾盏系统扩张引起的间歇性腹痛,通常见于5岁以上儿童,多由穿行血管导致的肾盂输尿管连接部梗阻(UPJO)所致。10
评估与诊断
ANH 的诊断基于测量 APRPD:第二孕期≥5 mm,第三孕期≥7 mm。11 胎儿 RBUS 的解读涉及以下项目:胎儿性别、羊水指数(AFI)、孕周、相关的先天性异常、单侧或双侧肾积水、肾积水程度、APRPD、肾实质状态(包括实质厚度和回声性)、输尿管扩张、膀胱充盈与循环及其壁厚,以及尿道扩张(表 1)。
表 1 评估产前肾积水需要解答的十个问题。
| 10个问题 | 问题 |
|---|---|
| 1个与羊水相关的问题 | 羊水指数 (AFI) |
| 3个与胎儿相关的问题 | 男或女 |
| 胎龄 | |
| 其他先天性异常 | |
| 3个与肾脏相关的问题 | 肾积水的分级和侧别 |
| 上段输尿管扩张 | |
| 肾实质 (实质厚度和回声性) | |
| 3个与泌尿道其余部分相关的问题 | 下段输尿管扩张 |
| 膀胱 (膀胱充盈度和膀胱壁厚) | |
| 后尿道扩张 |
充盈时膀胱壁厚度超过 2 mm 表示膀胱壁增厚,与胎龄无关。12 多次检查中无法显示膀胱是膀胱外翻的征象。在后尿道瓣膜(PUV)中,可见充盈的膀胱伴后尿道扩张,呈现”钥匙孔征”。
在孕中期,当APRPD分别等于4–6 mm、7–10 mm和>10 mm时,ANH被分为轻度、中度和重度。在孕晚期,当APRPD分别为7–9 mm、10–15 mm和>15 mm时,产前肾积水被分为与前述相同的分级 (表2).11
表 2 产前肾积水分类。
| 程度 | 第二孕期 | 第三孕期 | ANH 的百分比 |
|---|---|---|---|
| 轻度 | 4-7 mm | 7-9 mm | 56-88% |
| 中度 | 7-10 mm | 9-15 mm | 10-30% |
| 重度 | >10 mm | >15 mm | 2-13% |
婴儿应在出生后3至7天进行复评,且不应更早,以避免由于新生儿一过性少尿而导致的假阴性结果,尤其是在出生后前48小时内。尽管如此,在出现双侧高级别肾积水、单肾、羊水过少,或怀疑PUV的情况下,应在分娩后立即进行RBUS。
在北美,SFU 分级系统用于肾积水分级,而在欧洲则使用 APRPD。肾积水的 SFU 分级见表 3.13
表 3 SFU 分级系统。
| SFU 分级 | 描述 |
|---|---|
| 0级 | 无扩张,肾盏壁彼此贴靠 |
| 1级 (轻度) | 肾盂扩张而无肾盏扩张(也可发生于肾外肾盂) |
| 无肾实质萎缩 | |
| 2级 (轻度) | 肾盂(轻度)和肾盏扩张(肾盂肾盏形态保留) |
| 无肾实质萎缩 | |
| 3级 (中度) | 肾盂和肾盏中度扩张 |
| 肾盏穹隆变钝,肾乳头变平 | |
| 可见轻度肾皮质变薄 | |
| 4级 (重度) | 肾盂和肾盏显著扩张,呈球囊样膨大 |
| 肾盂与肾盏间界限消失 | |
| 肾萎缩,表现为肾皮质变薄 |
SFU分级系统的缺点在于,由于不采用APRPD测量,具有一定的主观性,从而难以与ANH测量结果进行相关。基于APRPD,肾积水被分为轻度、中度和重度,其中APRPD分别为7-10 mm、10-15 mm和超过15 mm。14 该分级的不足在于仅依赖单一指标来分级肾积水,而忽视了其他参数,例如肾实质厚度和外周肾盏扩张。
因此,为避免此前两种分级系统的缺点,提出了一种新的肾积水分类。泌尿道扩张(UTD)分级系统依赖于六项RBUS发现; APRPD, 肾盏扩张(产后区分中央与周围肾盏扩张), 肾实质厚度, 肾实质外观, 膀胱异常, 以及输尿管异常。该分级系统区分RBUS发现是产前(正常, A1, A2, A3)或产后(正常, P1, P2, P3)。15
如果 RBUS 未见异常,应在 4 至 6 周后重复检查。若在第 4 至第 6 周进行的 RBUS 显示 SFU 0 级且 APRPD 小于 7 mm,则无需进一步随访。肾积水分级对消退率的影响已被研究。16
如果发现出生后肾积水并伴有输尿管扩张,或怀疑膀胱异常,应申请进行排尿性膀胱尿道造影(VCUG),以排除VUR、男孩的PUV(图1),以及神经源性或非神经源性膀胱功能障碍。
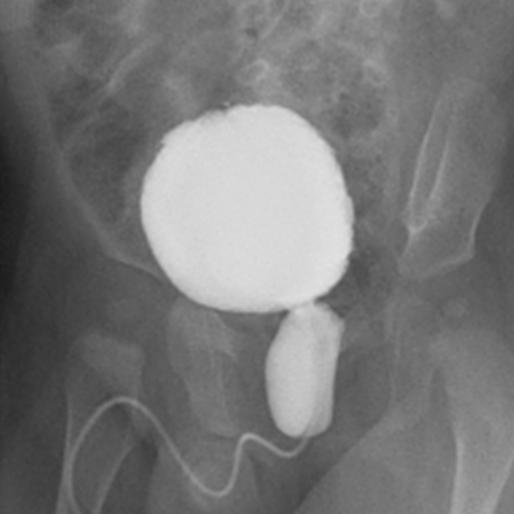
图 1 排尿性膀胱尿道造影显示后尿道瓣膜的典型表现。
对于无症状婴儿,如存在 SFU 1~2 级的出生后肾积水,或 APRPD 小于 15 mm 且无输尿管扩张或膀胱异常,应每三至六个月进行一次 RBUS,随后每六至十二个月进行一次。17 肾积水通常预期在生命的前两年内自发缓解。
另一方面,SFU 3~4 级肾积水或 APRPD 达到 15 mm 或以上提示需要更密切的随访。在这种情况下,需要进行 VCUG 以排除 VUR、PUV 或膀胱病变。若 VCUG 未见异常,建议进行动态肾显像,尤其是 MAG3,以评估分肾功能并判断是否存在梗阻。
UPJO 可在产前或出生后被发现。在产前阶段,UPJO 是病理性 ANH 的最常见原因 18。出生后,患儿可能无症状,偶然发现肾积水;也可能因梗阻并感染的肾脏而出现高热,或在年龄较大的儿童中表现为腰痛。对于5岁以上伴有间歇性梗阻的儿童,应怀疑异常跨行血管。
血尿是一种不常见的表现,通常继发于腰部外伤,因为肾积水的肾脏比正常肾更易受伤。在超声检查时代,很少遇到可触及的腰区包块。
仅凭 RBUS 即可对导致 ANH 的潜在病变做出初步诊断。肾盂扩张而输尿管不扩张提示 UPJO(图2),而输尿管扩张则可能由 VUR 或巨大输尿管所致。在 MCDK 中,肾囊肿彼此不相通,且肾实质未保留;而肾囊肿通常为双侧且相通,并伴有肾实质保留。输尿管囊肿表现为囊内囊(膀胱),80% 的病例与重复肾集合系统的上极相关,其余 20% 为单系统输尿管囊肿,需要穿刺进行系统减压。男孩膀胱和后尿道扩张呈钥匙孔样外观,对 PUV 具有诊断意义。
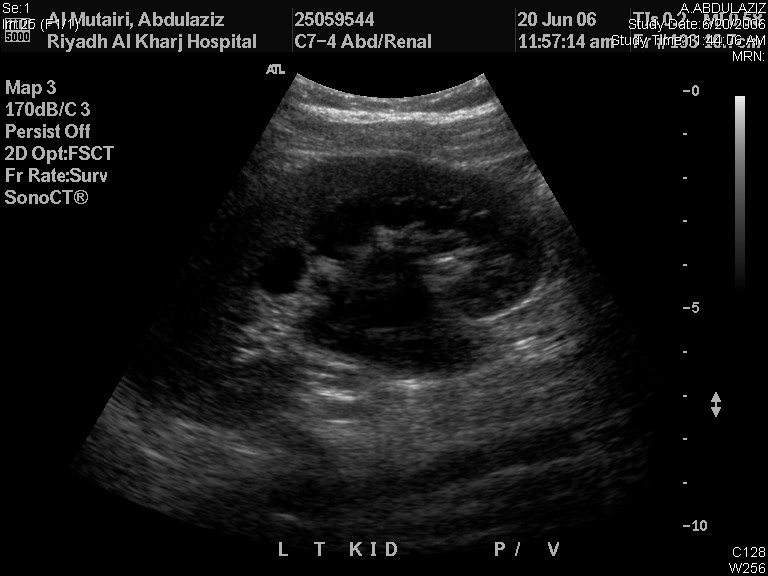
图 2 肾脏和膀胱超声显示左侧UPJO
肾脏放射性核素显像的作用不容忽视。可采用三种肾脏显像方法:巯基乙酰三甘氨酸(MAG3)、二乙烯三胺五乙酸(DTPA)和二巯基丁二酸(DMSA)。18 它们均以亚稳态锝-99m(99mTc)标记。MAG3 经肾小管和肾小球双重排泄。DTPA 仅经肾小球滤过,因此在肾功能不全时不应选择该检查。DMSA 仅与肾近端小管结合。99mTc 的半衰期(t1/2)为6小时。北美许多中心对 DMSA 制剂的可及性有限,从而限制了开展此类核医学检查的能力。
MAG3 和 DTPA 与 DMSA 相比属于动态、功能性检查。它们通过随时间获取序列图像,观察摄取、排泄和引流,从而提供分肾功能以及是否存在梗阻的信息。然而,在儿童中更倾向于使用 MAG3。DMSA 属于静态扫描,不仅可检测分肾功能,还可发现是否存在肾瘢痕。肾图检查在第4至第6周进行,以确保已达到肾脏成熟。19
如果在肾脏成熟之前进行肾闪烁显像,扫描可能显示较高的皮质残余活性,保留高达峰值的50%或以上。 在怀疑UPJO或UVJ时通常选择MAG3或DTPA,而在VUR病例中,DMSA可作为自上而下策略的一部分 (图3) 肾图有三个相位。第一为血管相,反映肾血流,持续至多10秒。第二为实质相,代表肾摄取,发生在注射同位素后第10秒至第5分钟。最终为排泄相,表示放射性同位素排入肾盂。
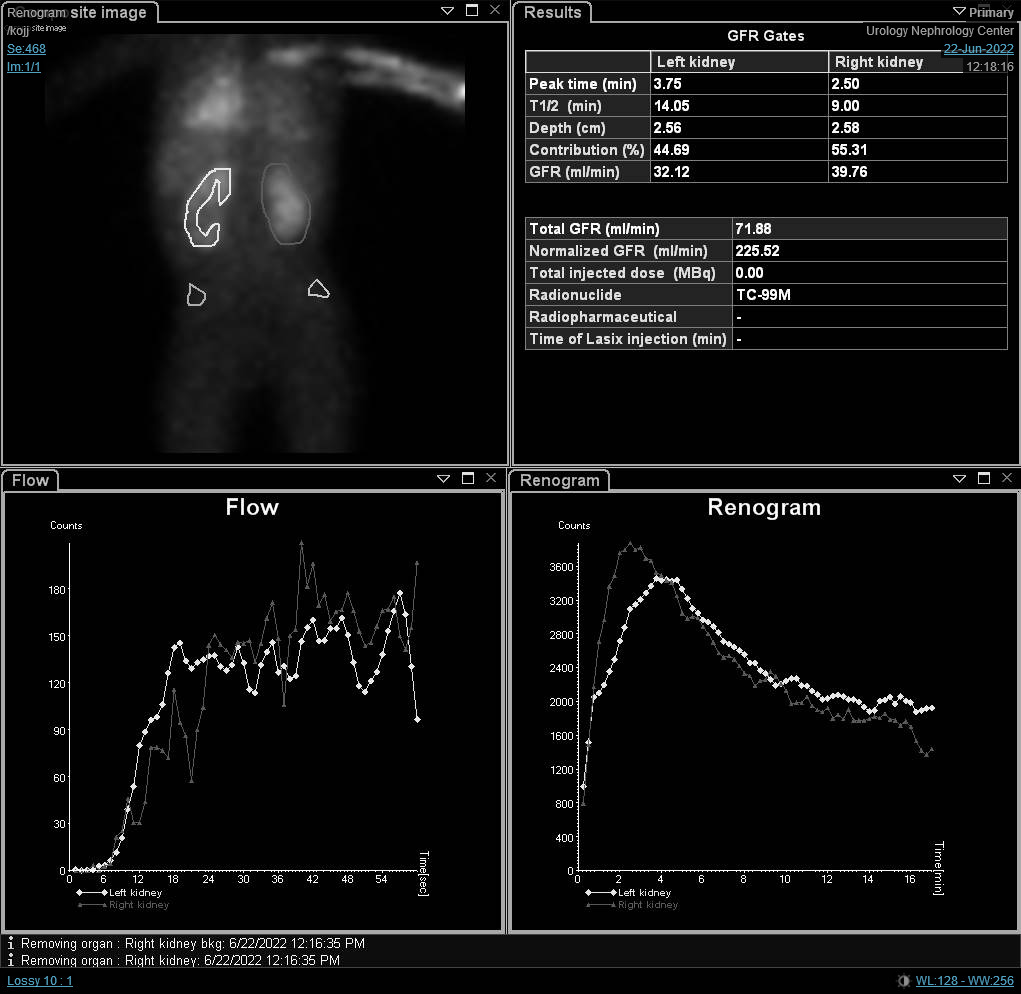
图 3 DMSA 扫描显示左侧肾脏瘢痕,伴放射性同位素摄取减少
在肾脏核素显像前应考虑一些预防措施,例如充分补液,甚至以 10 mL/kg 的速度静脉输注生理盐水,并以 4 mL/kg/小时 的速度维持;同时固定尿道导管以排空膀胱,避免梗阻的假阳性结果。关于利尿剂注射的时机尚无共识。常规是在放射性同位素注射后 20 分钟给药(F+20)。为避免放射性同位素在扩张的肾盂肾盏系统内聚集,建议在放射性物质注射前 15 分钟注射呋塞米(F-15)。也有作者主张与放射性同位素同时注射呋塞米(F+0)。呋塞米(Lasix)的剂量在早婴儿期为 1 mg/kg,之后为 0.5 mg/kg,最大剂量为 40 mg。
尽管分肾功能是肾脏显像中最重要的变量,肾动态显像曲线和 t1/2 可能提示阻塞的初步诊断。O’Reilly 描述了动态肾图的四种曲线; I型曲线代表摄取与排泄正常(钟形曲线)(图 4),II型曲线代表阻塞型,对利尿剂无反应(图 5 和 图 6),IIIa型曲线初期上升,随后在注射利尿剂后下降,IIIb型曲线初期上升,其后既不下降也不继续上升(可疑),以及IV型,在注射呋塞米后15分钟出现延迟性失代偿。20
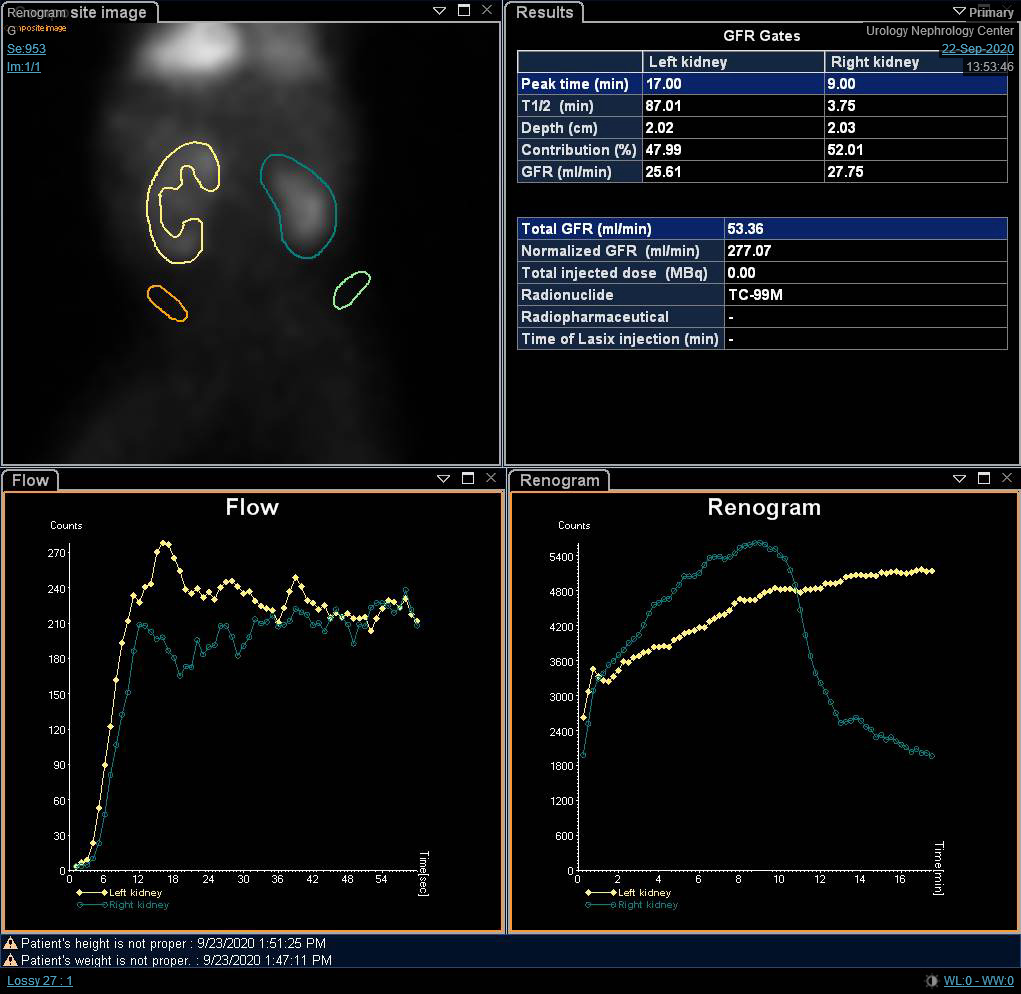
图 4 DTPA 扫描显示钟形的非梗阻型曲线
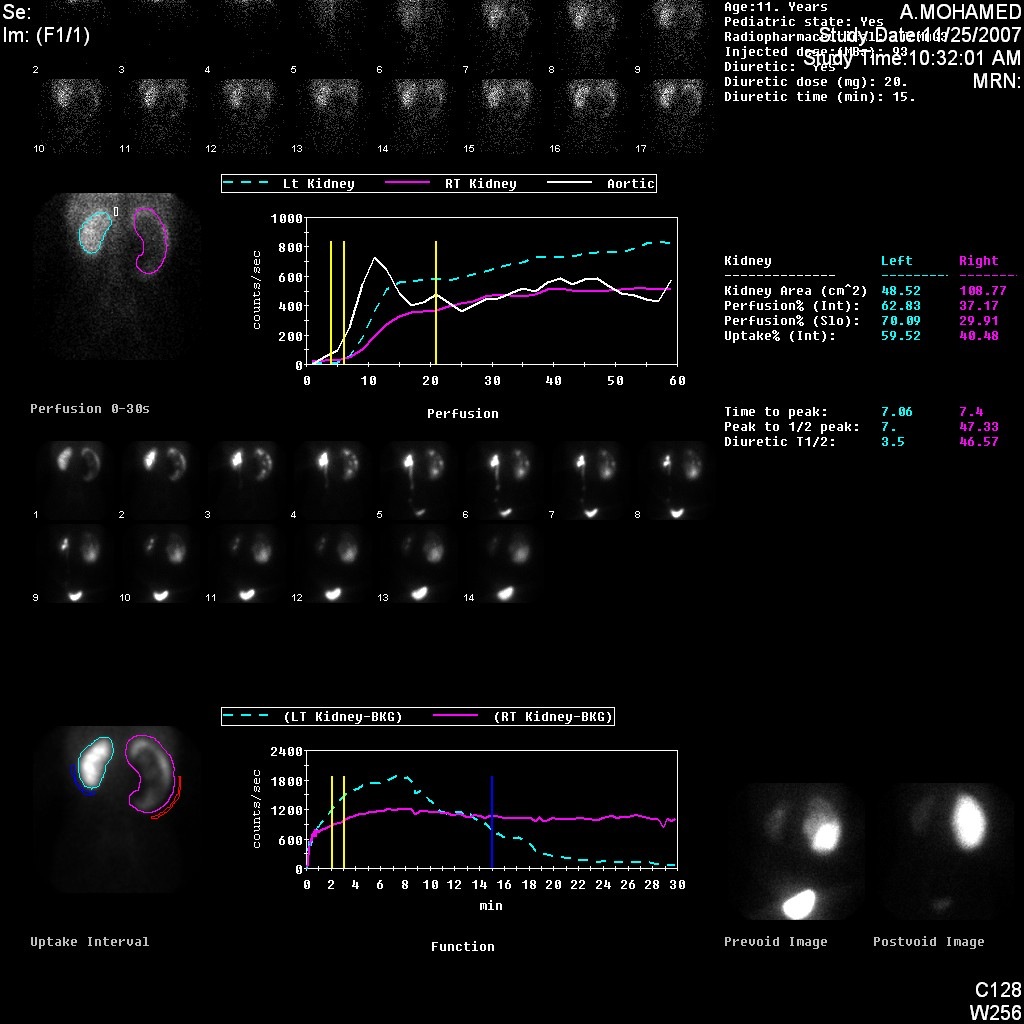
图 5 DTPA 显像显示左肾梗阻型曲线
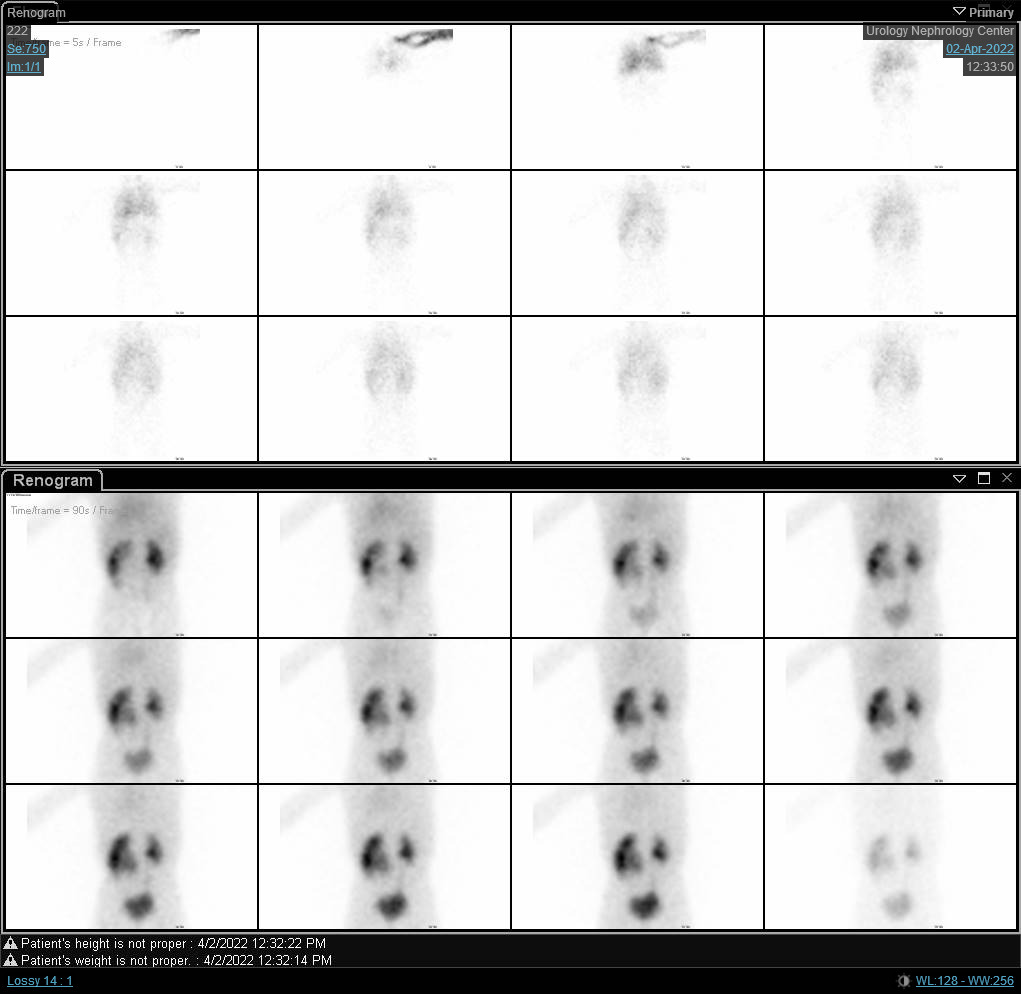
图 6 DTPA 扫描显示右肾呈梗阻性曲线,t1/2延长。
T1/2 小于10分钟为正常,而 t1/2 大于20分钟提示梗阻。介于其间的数值被认为不确定。然而,许多人主张不要仅凭 t1/2 数值来判断是否存在梗阻,因为曲线的高度、形态、患者的体液状态、膀胱的引流以及整体肾功能都会影响该数值。
为确认UPJO的诊断,先行RBUS,随后进行肾脏核素显像,以提供解剖结构和功能方面的信息(图7) 在存在争议的情况下,可考虑行磁共振尿路成像(MRU)。只要输尿管未扩张,则不需要行VCUG,而静脉尿路造影在现代小儿泌尿外科中已被淘汰。
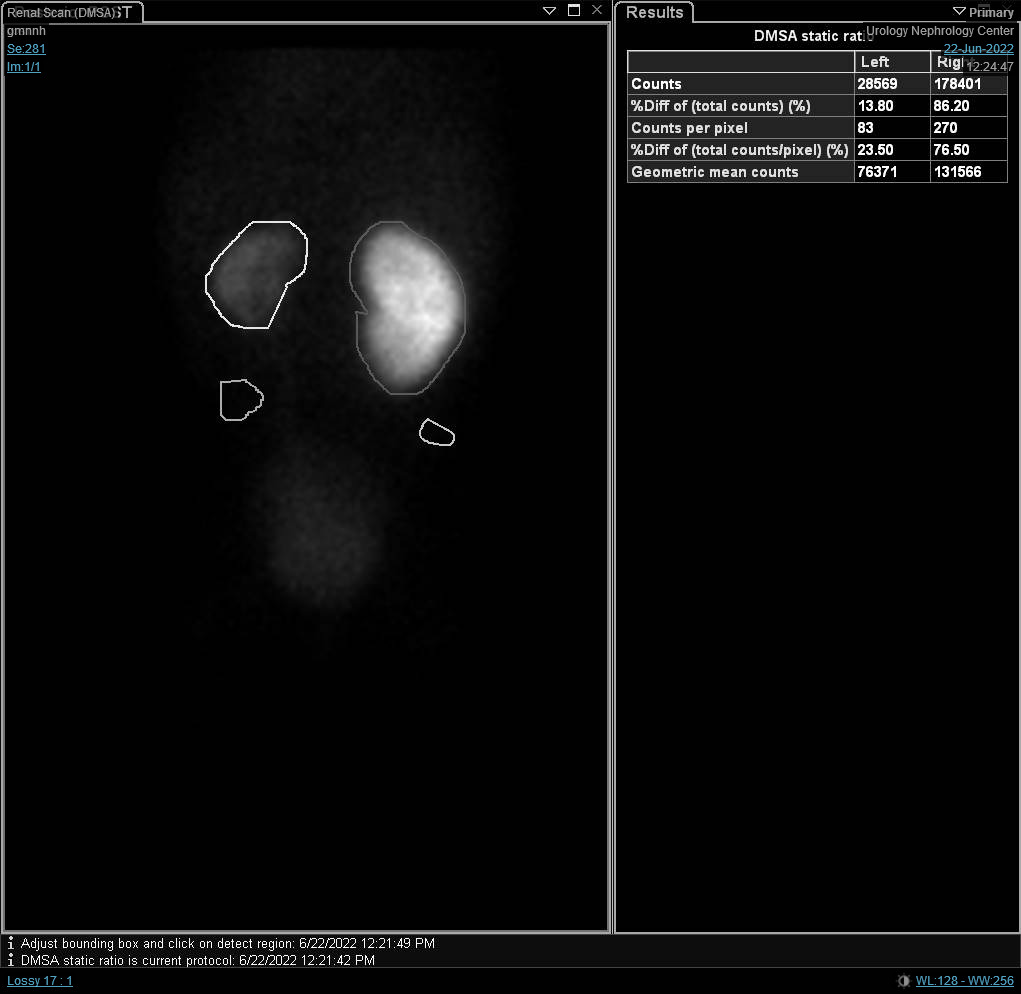
图 7 DTPA 扫描显示由左侧 UPJO 导致的左肾引流延迟
通过RBUS,可见肾盂扩张而输尿管不扩张。如前所述,应测量肾盂前后径(APRPD),如果大于30 mm,应申请肾脏核素显像,因为在这种程度的肾积水中肾功能恶化的发生率较高。
用于提示梗阻的双工超声检查不应被忽视,尽管这些发现的准确性可能并不很高。从输尿管进入膀胱的输尿管射流的存在可排除输尿管梗阻。阻力指数(RI)≥0.7提示梗阻。其测量方法为用肾动脉收缩期峰值流速(PSV)减去舒张末期流速(EDV),并将结果除以PSV。应用RI的理论依据是,梗阻性尿路病变最终会伴随肾血流量减少。除非在由VUR继发的UPJO病例中见到输尿管下端扩张,否则在UPJO的评估中不需要进行VCUG。
尽管由于有害的电离辐射,儿童一般避免进行对比增强计算机断层扫描(增强CT),但在动脉期(皮髓质期)它可用于检测是否存在交叉血管。现代小儿泌尿学中已不再推荐静脉尿路造影(IVU)。除非肾功能检查在正常范围内,否则应避免进行所有造影检查。
在RBUS结论不明确的可疑病例中,可以进行MRI检查。近几年,钆增强动态MRI因其不仅能提供解剖学诊断信息,还能提供功能信息而受到关注。它可由医学物理师使用专用软件,通过测量强化肾实质体积来评估分肾功能。此外,计算肾通过时间(指从肾皮质强化到输尿管显影的时间差)可用于确认梗阻。
在诊断可疑的病例中,或当外科医生计划行背侧腰切开术以排除伴发的输尿管狭窄时,术前可使用逆行输尿管肾盂造影来确认诊断。最后,已有一些生化标志物用于检测因梗阻导致的肾小管损伤,例如β2-微球蛋白、N-乙酰-β-D-氨基葡萄糖苷酶(NAG)以及转化生长因子-β1(TGF-β1)。
治疗选项及其结局
ANH 的产前管理
目前很少需要进行产前干预,且仅在存在严重下尿路梗阻者(例如伴有羊水过少的双侧高级别肾积水)时才予以考虑。21 在妊娠第20周之后,如无危及生命的情况,不应终止妊娠,也不应影响分娩计划(例如,提前引产)。
ANH 的出生后管理
对于被诊断为 ANH 的病例,体格检查不容忽视。例如;在 UPJO 或 MCDK 时可能触及腹部包块,而在梅干腹综合征中可见隐睾和前腹壁肌肉发育不全,此外在 PUV 可触及膀胱。
在生命最初两年中,为降低尿路感染的发生率,建议对SFU 3级和4级肾积水或APRPD达15毫米或以上者实施持续性抗生素预防(CAP)。17 然而,关于ANH的众多研究(在不存在反流或巨大输尿管/输尿管积水的情况下)显示,在孤立性高级别肾积水(3-4级)患者中,CAP并无益处。22
生命最初两个月的 CAP 包括阿莫西林和甲氧苄啶,剂量分别为每日一次 10–20 mg/kg 和每日一次 2 mg/kg。此后,可处方呋喃妥因和甲氧苄啶-磺胺甲噁唑(TMP/SMX),剂量为 mg/kg/日。过早使用呋喃妥因可导致溶血性贫血或呼吸窘迫综合征,而在生命最初两个月使用磺胺甲噁唑会导致核黄疸。
呋喃妥因的常见副作用包括胃肠道不适和皮肤反应。与 TMP/SMX 相关的不良反应主要由磺胺甲恶唑成分所致,且以皮肤反应最为常见。生命的第一年接受抗生素暴露与此后发生特应性疾病(包括湿疹、哮喘和过敏)风险增加相关。23 这一发现被归因于“卫生假说”,该假说认为,在极其卫生、微生物暴露极少的环境中成长,可能会增强特应性免疫反应。CAP 的另一弊端是抗生素耐药性的产生。
小儿泌尿外科医生面临的主要挑战是区分会自行缓解的UPJO与会导致肾功能恶化的UPJO。前者需要随访,而后者需要干预。
明确的手术干预指征包括存在症状(疼痛、发热性尿路感染)、肾脏可触及,以及 APRPD 超过 40 mm。24 其他指征包括;随访过程中肾积水进行性加重、分肾功能低于 40%,以及分肾功能下降 10% 或以上。25 对于症状性且被忽视的 UPJO,且分肾功能低于 10% 的情况,主张行肾切除术。然而,一些小儿泌尿外科医师倾向于先通过肾造瘘管或输尿管内支架进行早期引流,随后再评估。
Anderson-Hynes 离断式肾盂成形术(AHDP)仍然是对UPJO进行根治性治疗的金标准手术。17 在该技术中,切除动力异常或狭窄的段,将输尿管朝向肾下极进行鱼口化,随后在一根跨吻合口支架上将肾盂与已鱼口化的输尿管行吻合。对于高位插入的输尿管,以往更倾向于Foley Y-V 成形术,但其已在很大程度上被AHDP取代。Foley Y-V 肾盂成形术可能适用于马蹄肾背景下的UPJO。
The vascular hitch technique is still having a role in modern pediatric urology because it is less demanding and less time-consuming than AHDP. Moreover, its success rate is up to 90% with less complication rates (e.g., urinary leakage and anastomotic stricture). It involves elevation of the crossing vessel anteriorly away from the UPJ. However, concomitant intrinsic obstruction should be excluded by diuretic test to avoid technical failure.
患者取侧卧位,手术侧向上。切口经前方肋下处(图 8),采用腹膜外入路。分离或切开腹外斜肌、腹内斜肌及腹横肌,并将腹膜及腹膜外(肾旁)脂肪向内牵开后,打开Gerota筋膜的两层。识别UPJ,在离断UPJ之前,于其近端和远端各置一枚牵引缝线。
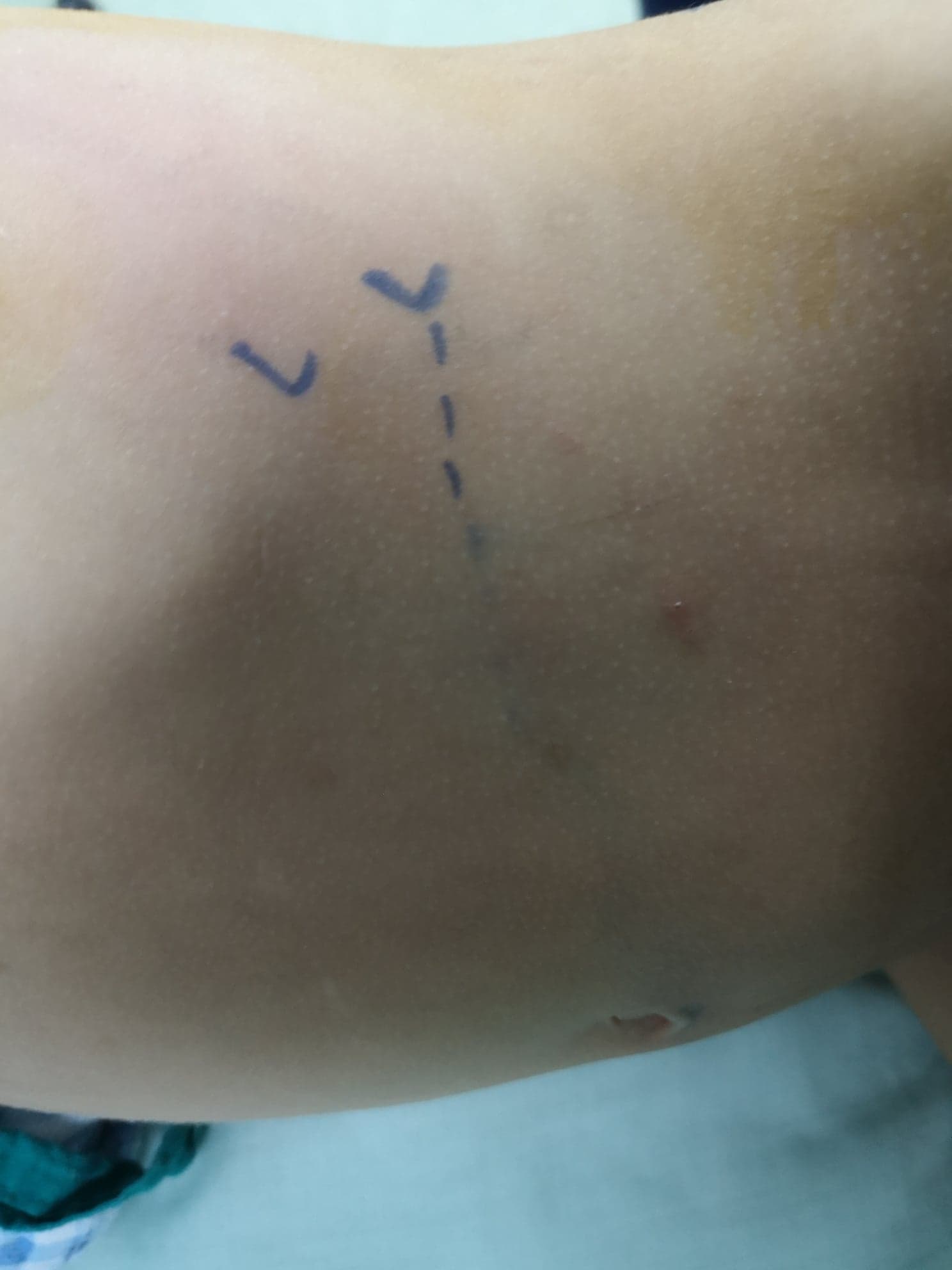
图 8 前腰部切口位于最后一根肋骨肋尖前方,用于左侧开放性肾盂成形术
在两条牵引缝线之间离断UPJ。仅在肾盂明显冗余的病例中进行肾盂缩小成形术,此时会修剪多余的肾盂组织。另一方面,亦有作者得出结论,在多数离断式肾盂成形术病例中不需要切除肾盂(肾盂缩小成形术)。26 他们发现,无论是否进行肾盂缩小成形术,手术结局相似。下一步是将肾盂的两侧与经舌形劈开的输尿管两侧缘进行吻合。
首先缝合角部,随后缝合后壁缝合线,置入经吻合口支架并完成前壁缝合线。肾盂剩余的两侧相互缝合。所用缝线为 6-0 vicryl(或其他可吸收单丝缝线),可采用连续或间断方式。在学习曲线的最初阶段,建议从间断缝合开始,直至熟练掌握该技术。
除前腰入路外,开放性肾盂成形术的另一种入路是后路或背侧腰部切开术 (DL) (图9)27 它是最早用于进入肾脏和上段输尿管的入路。然而,如今已不广泛应用,尤其在儿童中。DL 可通过以下皮肤切口之一进行; 沿竖脊肌外侧缘的 Gil-Vernet 纵行切口、沿腰方肌外侧缘的 Lurz 改良纵行切口,或沿兰格皮纹线的横行切口。
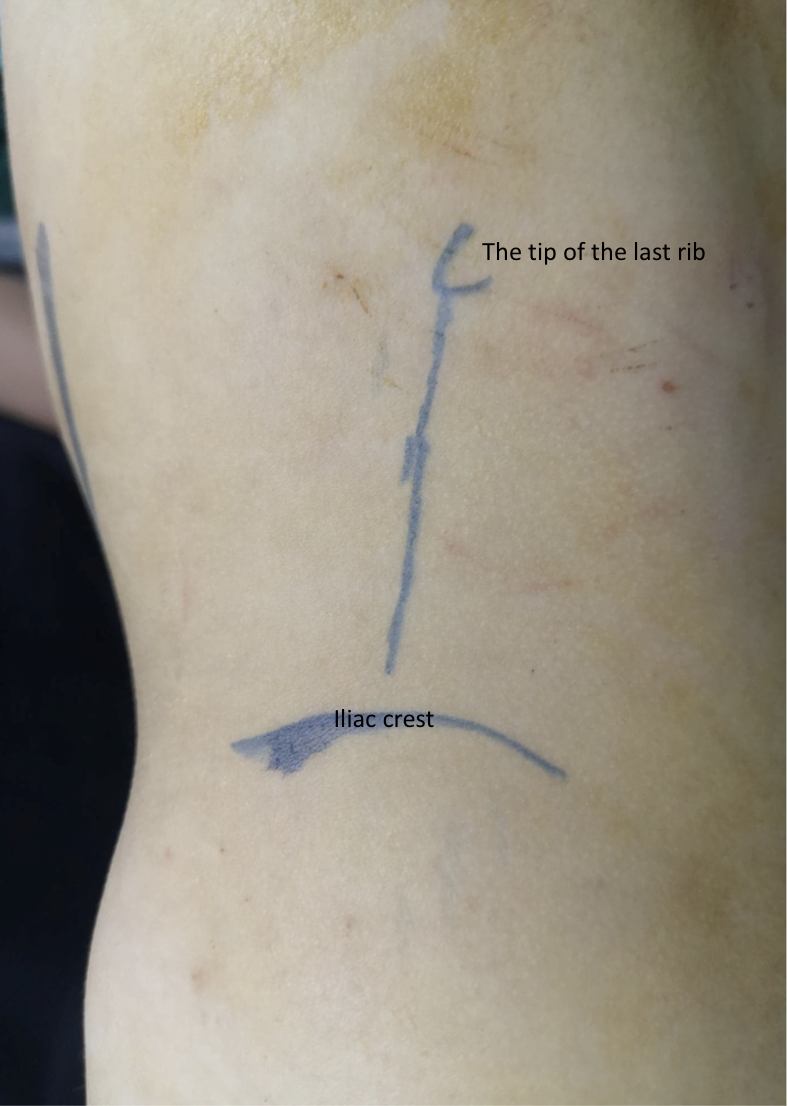
图 9 用于左侧开放式肾盂成形术的后腰切口
DL 的主要优点是在无需切断肌肉的情况下,通过两个简单切口即可轻松进入后腹膜腔。巨大积水肾已不再被视为 DL 的禁忌证,因为儿童的肾脏通常具有更大的活动度。然而,在存在肾旋转不良或肾位置异常时应避免采用 DL。
虽然在幼龄患者中开放肾盂成形术是标准术式,成功率可达95%,但腹腔镜和机器人辅助手术的成功率与之相当。28 微创技术的优势在于疼痛更轻、术后住院时间更短,以及套管针穿刺口处的瘢痕极小。然而,这些技术需要专用器械,随之而来的成本更高,且学习曲线相对更长。采用达芬奇®机器人系统使体内缝合较以往更为容易。
腹腔镜和机器人辅助的肾盂成形术可经腹膜或后腹膜入路完成。28 由于解剖标志清晰且操作空间相对宽敞,经腹膜入路更为常用。尽管如此,与后腹膜入路相比,其并发症更多,表现为器官损伤和肠梗阻。为在经腹膜腹腔镜肾盂成形术中减少手术时间和肠管操作,可采用经结肠系膜入路,在无需反折结肠的情况下直接游离左侧肾盂输尿管连接部(UPJ)。29
在腹腔镜肾盂成形术中,至少设置三个穿刺孔,其中一个在脐部采用开放法建立,作为腹腔镜镜孔,另两个为操作孔。第一个操作孔位于肋下线,第二个位于髂前上棘-脐连线,两者均优选置于旁直肌线(图 10) 在机器人肾盂成形术中,镜孔位于略高于脐部的位置,而两个操作孔位于旁直肌线:一个在脐与髂前上棘之间的中点,另一个在肋缘下约一指处。助手孔置于脐与剑突之间的中点(图 11)
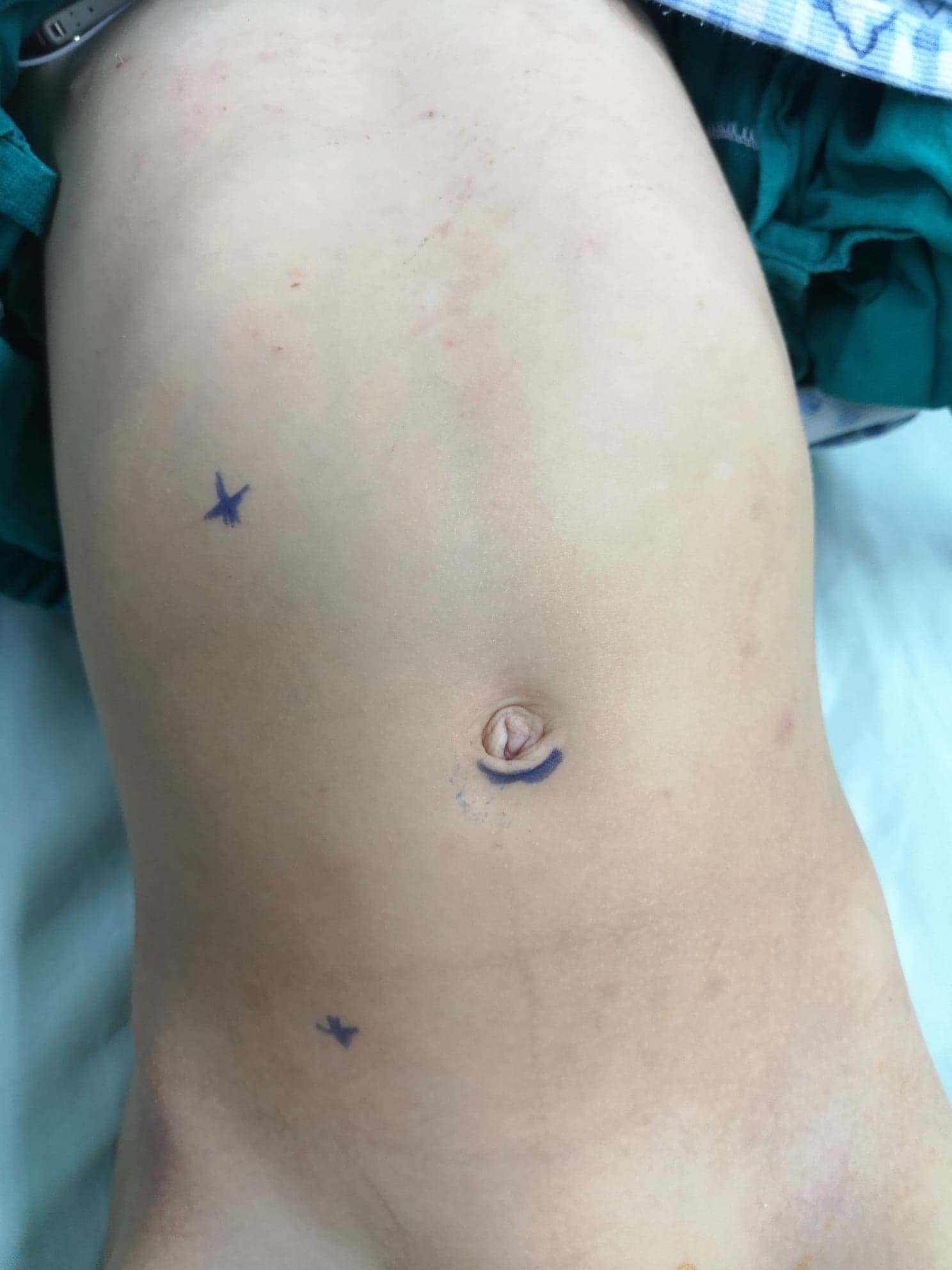
图 10 腹腔镜右侧离断式 Anderson-Hynes 肾盂成形术的套管口分布
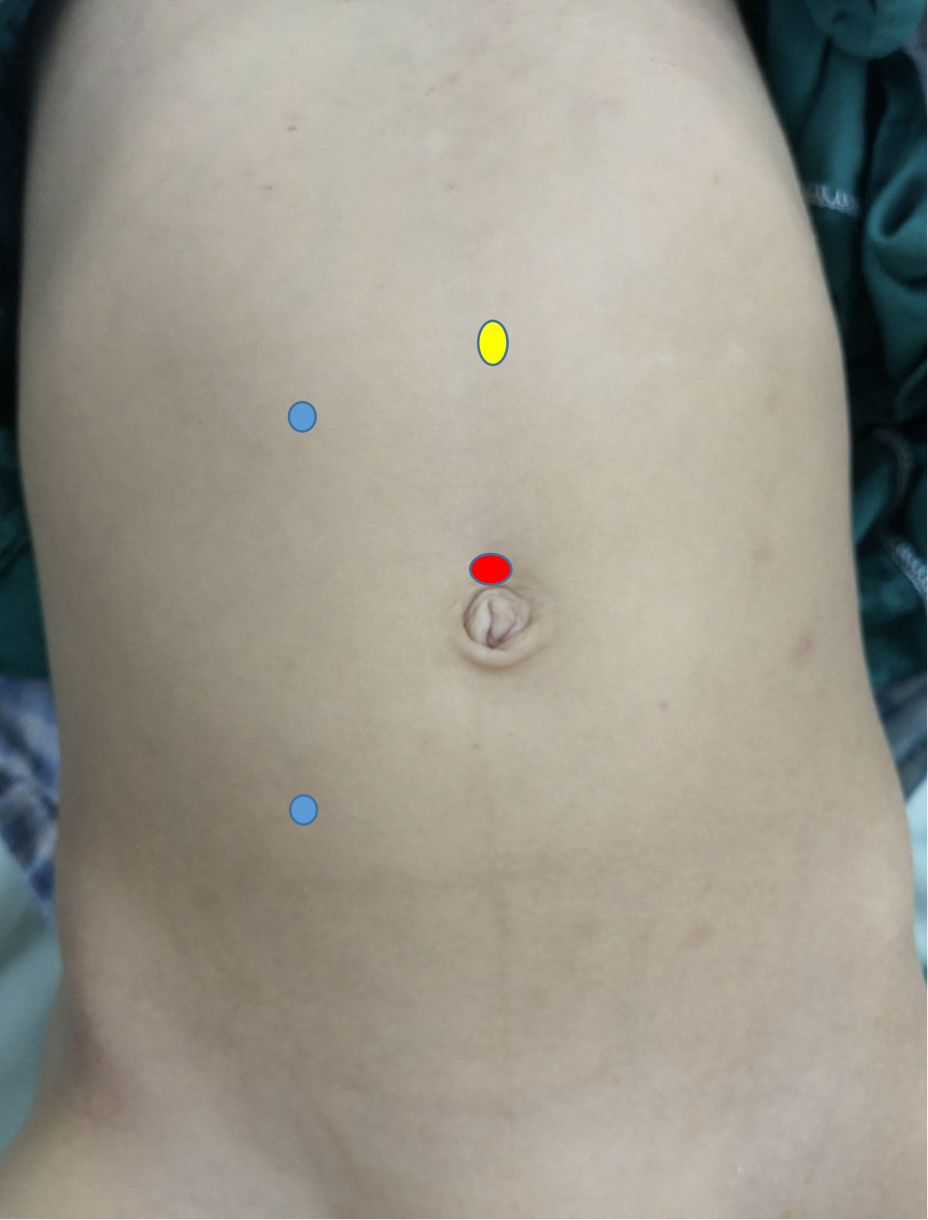
图 11 机器人右侧肾盂成形术的套管口分布
无论采用何种方式,肾盂成形术的主要目标是建立一个在输尿管与肾盂之间通畅、位于依赖引流位、漏斗状、水密且无张力的吻合口。跨吻合口支架可以为外置或内置,亦可不放置。30
外置支架经肾实质或肾盂引出体外,通常留置10至14天。关键是要确保至少有一个侧孔位于肾盂内,以避免支架被输尿管本身阻塞。此外,应避免将侧孔留在肾盂肾盏系统之外,以防术后尿漏。
确认双猪尾(双J)支架的下端卷曲段已到达膀胱的最佳方法之一,是通过先前固定的尿道导尿管向膀胱充盈并检查回流。关于置入的另一条技巧是使用可获得的最小直径支架,并在亲水导丝引导下置入。据报道,这样更不易在输尿管膀胱连接部卡住并造成损伤。内置支架保留一至四周,随后在膀胱镜下取出。需要额外一次麻醉是内置支架的一个缺点。除非病例困难或复发,否则一般不常规留置引流管。
许多外科医生即使在腹腔镜和机器人辅助手术中也倾向于使用外置支架,以避免为取出内置支架而进行第二次全身麻醉。31,32 外引流肾盂输尿管 Salle 术中肾盂成形术支架是内置支架的另一种有效替代方案,因为其费用低于第二次全身麻醉的费用。32
对于存在长段缺损的冗大的肾盂,推荐采用 Culp-DeWeerd 螺旋瓣或 Scardino-Prince 纵向瓣。若肾盂不足以制备用于桥接肾盂与输尿管之间间隙的瓣,可选择行输尿管肾盏吻合术。在输尿管肾盏吻合术中,在切除肾下极后,将输尿管与下肾盏行吻合。
在排除存在交叉血管后,对于功能可保留的肾脏,内镜下肾盂输尿管连接部内切开术是治疗短段狭窄(小于2 cm)的一种选择。33 该术可用于原发或复发病例,可经顺行或逆行途径,采用冷刀或钬激光完成。与AHDP相比,其成功率较低(分别为70%与95%)。在存在活动性尿路感染、交叉血管及出血倾向时为禁忌。对于肾盂成形术失败的病例,再次肾盂成形术的成功率(95-99%)高于内镜下肾盂输尿管连接部内切开术(39%),尤其是在幼儿及狭窄段超过1厘米时。33
并发症
如果不予治疗,UPJO 可导致患侧肾功能逐渐恶化,直至完全丧失。继发性高血压是不常见的并发症。肾盂成形术的并发症可分为早期和晚期。早期并发症包括切口或引流处尿液渗漏(可伴或不伴积液)、外置支架无引流、内置支架移位、血尿、发热及切口感染。晚期并发症包括技术失败或再狭窄。34
尿漏可通过尿路分流来处理,方式包括经皮肾造瘘或逆行置入内支架。有时可归因于支架的引流孔位于肾脏之外,随后尿液漏入后腹膜腔。对于体积较大的肾周积液,建议行经皮置管引流。外引流支架不引流的原因可能是血凝块堵塞支架,或支架在肾盂内的那一段没有开孔,而其余引流孔被输尿管阻挡。前者可通过冲洗支架处理,后者则通过回撤支架处理。
血尿通常采用保守处理,通过充分补液,伴或不伴止血治疗;而伤口感染则在频繁换药的同时,依据培养结果给予抗菌药物治疗。若出现发热,应通过RBUS排除持续性梗阻,随后给予静脉抗生素治疗。
肾盂成形术失败后的处理主要取决于分肾功能。对于有症状的梗阻且功能差、分肾功能低于10-15%的肾脏,可考虑行肾切除术。对于可挽救的肾脏,可行再次肾盂成形术,或有时行内镜放血术。干预时机为在初次手术后至少三个月。
建议的后续随访
对于单侧 ANH,RBUS 应在妊娠第三孕期进行一次。若为双侧 ANH,则应视是否存在提示下尿路梗阻的征象(例如进行性肾积水、羊水过少或膀胱壁增厚),在分娩前按月进行 RBUS。11
对于分肾功能超过40%的无症状肾盂扩张,通常主张采取保守治疗,因为多数病例可自然缓解。观察期间出现进行性肾积水或肾功能恶化,被视为为防止进一步损害而进行决定性干预的公认指征。
关于肾盂成形术后的随访,目前尚无共识,文献报道多为专家意见或个案经验。35 在我们机构,若置入外置支架,术后两周进行临床复诊;若为内置支架留置,术后六周复诊。术后三个月安排RBUS,评估肾积水分级和APRPD。若上述参数改善,下一次随访为术后一年,采用RBUS。若RBUS无变化,下一次随访为三个月后继续行RBUS。若出现进行性肾积水或患者有症状,应申请MAG3扫描。
建议阅读
- Han HH, Ham WS, Kim JH, Hong CH, Choi YD, Han SW. Transmesocolic approach for left side laparoscopic pyeloplasty: Comparison with laterocolic approach in the initial learning period. Yonsei Medical Journal 2013; 54 (1): 197–203. DOI: 10.3349/ymj.2013.54.1.197.
- Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction. Pediatric Nephrology 2018; 33 (4): 553–571. DOI: 10.1007/s00467-017-3629-0.
- Gopal M, Peycelon M, Caldamone A, Chrzan R, El-Ghoneimi A, Olsen H. Management of ureteropelvic junction obstruction in children—a roundtable discussion. Journal of Pediatric Urology 2019; 15 (4): 322–329. DOI: 10.1016/j.jpurol.2019.05.010.
- Chertin B, Pollack A, Koulikov D, Rabinowitz R, Hain D, Hadas-Halpren I. Conservative treatment of ureteropelvic junction obstruction in children with antenatal diagnosis of hydronephrosis: lessons learned after 16 years of follow-up. European Urology 2006; 49 (4): 734–739. DOI: 10.1016/s0084-4071(08)70420-2.
- Värelä S, Omling E, Börjesson A, Salö M. Resolution of hydronephrosis after pyeloplasty in children. Journal of Pediatric Urology 2021; 17 (1): 1–7. DOI: 10.1016/j.jpurol.2020.10.031.
- Sarihan H, Comert HSY, İmamoğlu M, Basar D. Reverse tubularized pelvis flap method for the treatment of long segment ureteropelvic junction obstruction. Medical Principles and Practice 2020; 29 (2): 128–133. DOI: 10.1159/000502028.
要点
- 肾脏及膀胱超声显示肾盂扩张而输尿管不扩张,高度提示UPJO。
- 在以下情形之一应考虑干预; 有症状的UPJO(脓毒症、明显疼痛或结石形成) APRPD大于5厘米 进行性肾积水 连续肾显像检查显示肾功能下降超过10%。 分肾功能低于40%,且t1/2延长。
- 在Anderson-Hynes离断肾盂成形术中,将输尿管朝向肾下极作铲形切开。
- 在建立肾盂输尿管吻合时,避免对输尿管进行操作。
- 确保支架的所有外侧孔均位于肾盂肾盏系统内,以避免尿漏。
参考文献
- Oliveira EA, Oliveira MCL, Mak RH. Evaluation and management of hydronephrosis in the neonate. Current Opinion in Pediatrics 2016; 28 (2): 195–201. DOI: 10.1097/mop.0000000000000321.
- Onen A. An alternative grading system to refine the criteria for severity of hydronephrosis and optimal treatment guidelines in neonates with primary UPJ-type hydronephrosis. Journal of Pediatric Urology 2007; 3 (3): 200–205. DOI: 10.1016/j.jpurol.2006.08.002.
- Shapiro E. Clinical implications of genitourinary embryology. Current Opinion in Urology 2009; 19 (4): 427–433. DOI: 10.1097/mou.0b013e32832c90ff.
- Beksaç S, Balcı S, Yapıcı Z, Özyüncü Ö. Prenatally Diagnosed Ureteropelvic Junction Obstruction in Three Siblings of one Family: A Case Report. Gynecology Obstetrics & Reproductive Medicine 2008; 14 (3): 193–195.
- Josephson S. Antenatally detected, unilateral dilatation of the renal pelvis: a critical review. 1. Postnatal non-operative treatment 20 years on\–is it safe? Scandinavian Journal of Urology and Nephrology 2002; 36 (4): 243–250. DOI: 10.1080/003655902320248191.
- Krajewski W, Wojciechowska J, Dembowski J, Zdrojowy R, Szydełko T. Hydronephrosis in the course of ureteropelvic junction obstruction: An underestimated problem? Current opinions on the pathogenesis, diagnosis and treatment. Advances in Clinical and Experimental Medicine: Official Organ Wroclaw Medical University 2017; 26 (5): 857–864. DOI: 10.17219/acem/59509.
- Atwa AM, Abdelhalim A, Edwan M, Soltan M, Hashim A, Abdelhameed M. Holmium Laser En Bloc Resection of Urethral Polyps in Children: A Case Series. Journal of Endourology Case Reports 2020; 6 (4): 457–460. DOI: 10.1089/cren.2020.0099.
- Houat AP, Guimarães CT, Takahashi MS, Rodi GP, Gasparetto TP, Blasbalg R. Congenital anomalies of the upper urinary tract: a comprehensive review. Radiographics 2021; 41 (2): 462–486. DOI: 10.1148/rg.2021219009.
- Alagiri M, Polepalle SK. Dietlś crisis: an under-recognized clinical entity in the pediatric population. International Braz j Urol 2006; 32: 451–453. DOI: 10.1590/s1677-55382006000400012.
- Yalçınkaya F, Özçakar ZB. Management of antenatal hydronephrosis. Pediatric Nephrology 2020; 35 (12): 2231–2239. DOI: 10.1201/b13478-107.
- Has R, Sarac Sivrikoz T. Prenatal diagnosis and findings in ureteropelvic junction type hydronephrosis. Frontiers in Pediatrics 2020; 8 (492). DOI: 10.3389/fped.2020.00492.
- Hodhod A, Capolicchio J-P, Jednak R, El-Sherif E, El-Doray AE-A, El-Sherbiny M. Evaluation of urinary tract dilation classification system for grading postnatal hydronephrosis. The Journal of Urology 2016; 195 (3): 725–730. DOI: 10.1016/j.juro.2015.10.089.
- ElSheemy MS. Postnatal management of children with antenatal hydronephrosis. African Journal of Urology 2020; 26 (1): 1–14. DOI: 10.1186/s12301-020-00097-8.
- Chow JS, Koning JL, Back SJ, Nguyen HT, Phelps A, Darge K. Classification of pediatric urinary tract dilation: the new language. Pediatric Radiology 2017; 47 (9): 1109–1115. DOI: 10.1007/s00247-017-3883-0.
- Elmaci AM, Dönmez Mİ. Time to resolution of isolated antenatal hydronephrosis with anteroposterior diameter≤ 20 mm. European Journal of Pediatrics 2019; 178 (6): 823–828. DOI: 10.1007/s00431-019-03359-y.
- Engin MMN. Management of Infants Diagnosed with Antenatal Hydronephrosis and Determining the Need for Surgical Intervention. 2020. DOI: 10.33309/2639-9164.030202.
- Hashim H, Woodhouse CR. Ureteropelvic junction obstruction. European Urology Supplements 2012; 11 (2): 25–32. DOI: 10.1007/978-1-62703-206-3_4.
- Riccabona M. Assessment and management of newborn hydronephrosis. World Journal of Urology 2004; 22 (2): 73–78. DOI: 10.1007/s00345-004-0405-0.
- Taghavi R, Ariana K, Arab D. Diuresis renography for differentiation of upper urinary tract dilatation from obstruction F+ 20 and F-15 methods. 2007. DOI: 10.1016/j.urology.2007.06.721.
- Clayton DB, Brock JW. Current state of fetal intervention for lower urinary tract obstruction. Current Urology Reports 2018; 19 (1): 1–8. DOI: 10.1007/s11934-018-0760-9.
- Chamberlin JD, Braga LH, Davis-Dao CA, Herndon CA, Holzman SA, Herbst KW. Continuous antibiotic prophylaxis in isolated prenatal hydronephrosis. Journal of Pediatric Urology 2022. DOI: 10.1016/j.jpurol.2022.03.027.
- Ahmadizar F, Vijverberg SJ, Arets HG, Boer A, Lang JE, Garssen J. Early‐life antibiotic exposure increases the risk of developing allergic symptoms later in life: a meta‐analysis. Allergy 2018; 73 (5): 971–986. DOI: 10.1111/all.13332.
- Dhillon H. Prenatally diagnosed hydronephrosis: the Great Ormond street experience: Perinatal Urology. British Journal of Urology Supplement 1998; 81 (2): 39–44. DOI: 10.1046/j.1464-410x.1998.0810s2039.x.
- Hafez AT, McLorie G, Bägli D, Khoury A. Analysis of trends on serial ultrasound for high grade neonatal hydronephrosis. The Journal of Urology 2002; 168 (4 Part 1): 1518–1521. DOI: 10.1097/00005392-200210010-00072.
- Morsi HA, Mursi K, Abdelaziz AY, ElSheemy MS, Salah M, Eissa MA. Renal pelvis reduction during dismembered pyeloplasty: is it necessary? Journal of Pediatric Urology 2013; 9 (3): 303–306. DOI: 10.1016/j.jpurol.2012.03.002.
- Braga LH, Lorenzo AJ, Bägli DJ, Mahdi M, Salle JLP, Khoury AE. Comparison of flank, dorsal lumbotomy and laparoscopic approaches for dismembered pyeloplasty in children older than 3 years with ureteropelvic junction obstruction. The Journal of Urology 2010; 183 (1): 306–311. DOI: 10.1016/j.juro.2009.09.008.
- Başataç C, Boylu U, Önol FF, Gümüş E. Comparison of surgical and functional outcomes of open, laparoscopic and robotic pyeloplasty for the treatment of ureteropelvic junction obstruction. Turkish Journal of Urology 2014; 40 (1). DOI: 10.5152/tud.2014.06956.
- Han HH, Ham WS, Kim JH, Hong CH, Choi YD, Han SW. Transmesocolic approach for left side laparoscopic pyeloplasty: Comparison with laterocolic approach in the initial learning period. Yonsei Medical Journal 2013; 54 (1): 197–203. DOI: 10.3349/ymj.2013.54.1.197.
- Yiee JH, Baskin LS. Use of internal stent, external transanastomotic stent or no stent during pediatric pyeloplasty: a decision tree cost-effectiveness analysis. The Journal of Urology 2011; 185 (2): 673–681. DOI: 10.1016/j.juro.2010.09.118.
- Helmy T, Blanc T, Paye-Jaouen A, El-Ghoneimi A. Preliminary experience with external ureteropelvic stent: alternative to double-j stent in laparoscopic pyeloplasty in children. The Journal of Urology 2011; 185 (3): 1065–1070. DOI: 10.1016/j.juro.2010.10.056.
- Chu DI, Shrivastava D, Batavia JP, Bowen DK, Tong CC, Long CJ. Outcomes of externalized pyeloureteral versus internal ureteral stent in pediatric robotic-assisted laparoscopic pyeloplasty. Journal of Pediatric Urology 2018; 14 (5): 1–. DOI: 10.1016/j.jpurol.2018.04.012.
- Lucas JW, Ghiraldi E, Ellis J, Friedlander JI. Endoscopic management of ureteral strictures: an update. Current Urology Reports 2018; 19 (4): 1–7. DOI: 10.1007/s11934-018-0773-4.
- Khemchandani SI. Outcome analysis of pediatric pyeloplasty in varied presentation in developing countries. Urological Science 2019; 30 (6). DOI: 10.4103/uros.uros_31_19.
- Gopal M, Peycelon M, Caldamone A, Chrzan R, El-Ghoneimi A, Olsen H. Management of ureteropelvic junction obstruction in children—a roundtable discussion. Journal of Pediatric Urology 2019; 15 (4): 322–329. DOI: 10.1016/j.jpurol.2019.05.010.
- Freilich DA, Nguyen HT, Borer J, Nelson C, Passerotti CC. Concurrent management of bilateral ureteropelvic junction obstruction in children using robotic-assisted laparoscopic surgery. International Braz j Urol 2008; 34: 198–205. DOI: 10.1590/s1677-55382008000200010.
- Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction. Pediatric Nephrology 2018; 33 (4): 553–571. DOI: 10.1007/s00467-017-3629-0.
- Chertin B, Pollack A, Koulikov D, Rabinowitz R, Hain D, Hadas-Halpren I. Conservative treatment of ureteropelvic junction obstruction in children with antenatal diagnosis of hydronephrosis: lessons learned after 16 years of follow-up. European Urology 2006; 49 (4): 734–739. DOI: 10.1016/s0084-4071(08)70420-2.
- Värelä S, Omling E, Börjesson A, Salö M. Resolution of hydronephrosis after pyeloplasty in children. Journal of Pediatric Urology 2021; 17 (1): 1–7. DOI: 10.1016/j.jpurol.2020.10.031.
- Sarihan H, Comert HSY, İmamoğlu M, Basar D. Reverse tubularized pelvis flap method for the treatment of long segment ureteropelvic junction obstruction. Medical Principles and Practice 2020; 29 (2): 128–133. DOI: 10.1159/000502028.
最近更新时间: 2025-09-22 08:00