08: 腹腔镜与机器人应用
阅读本章大约需要 5 分钟。
腹腔镜与机器人在小儿泌尿外科中的应用简史
腹腔镜和机器人辅助腹腔镜属于微创外科范畴,并在全球范围内日益普及。腹腔镜的历史可追溯到1805年,当时Bozzini开发了第一台膀胱镜。腹腔镜一词 (“laparothorakoskopie”) 由瑞典外科医生Hans Christian Jacobaeus于1901年提出。他在同年报告了17例腹腔镜检查和2例胸腔镜检查。1 早期腹腔镜存在许多局限性,并因并发症发生率显著增加而引发更多担忧。
20世纪60年代,视频技术得到发展,帮助外科医生在监视器上观察手术视野。儿科泌尿外科中腹腔镜技术的首例应用是用于不可触及的隐睾,发表于1976年。2 在20世纪70至80年代,腹腔镜在儿科泌尿外科医师中仅被广泛接受用于诊断目的。下一阶段的腹腔镜手术出现在20世纪90年代,仿效成人外科实践,更多复杂的腹腔镜手术开始出现。1993年,Kavoussi 描述了首例腹腔镜肾盂成形术,患者为一名24岁女性。两年后,Craig Peters 报道了一名男孩右侧肾盂输尿管连接部梗阻的首例分离式腹腔镜肾盂成形术。3 腹腔镜肾盂成形术显著缩短了住院时间并改善了术后疼痛控制。此后,Karl Storz Endocsopy、Richard Wolf 等多家公司开始与儿科泌尿外科医师合作,开发并改进腹腔镜器械。
在过去的几十年里,腹腔镜手术已成为儿科泌尿外科实践的重要组成部分。在某些情况下,它已经取代了传统的开放手术,并且在若干情况下被公认为金标准的手术方式。腹腔镜手术具有相当的疗效,同时还能将手术切口缩小为3 mm和5 mm的穿刺孔位。为实现无瘢痕的目标,甚至经自然腔道内镜手术(NOTES)和单孔腹腔镜手术也是可行的,并已在一些中心开展。4
2000年,FDA批准了由Intuitive Surgical开发的一种名为达芬奇手术系统的机器人手术系统。它旨在便于开展腹腔镜手术,并由外科医生在手术室的控制台进行操控。其优势包括稳定、放大的3D视野、震颤过滤和运动缩放,以实现精准的体内暴露与缝合。过去二十年来,机器人辅助手术已广泛应用于泌尿外科、妇科、普通外科和小儿外科。达芬奇手术系统已从第一代S型号发展到Si,最近又发展到Xi以及单孔SP系统。

图 1 达芬奇手术系统的演变
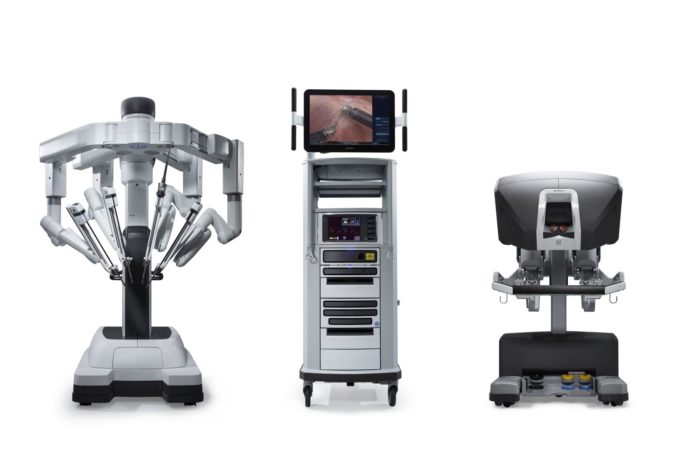
图 2 达芬奇Xi手术系统
2001年,Meininger 报道了首例在一名儿科患者中实施机器人辅助 Nissen 胃底折叠术的病例。5 这一工作推动了小儿外科的发展。2004年,Olsen 和 Jorgensen 报道了在小儿泌尿外科领域使用达芬奇平台开展的首例手术——机器人辅助腹腔镜肾盂成形术(RALP)。6 2005年,Atug 介绍了他们对7名年龄范围为6至15岁的儿科患者实施 RALP 的经验。7 2006年,Lee 通过按年龄和性别匹配,对33例患者比较了 RALP 与开放肾盂成形术(OP)的结果。8 他们发现,RALP 组的平均手术时间为219分钟,而开放手术组仅为181分钟。完成15例后,RALP 的手术时间显著缩短。RALP 队列显示住院时间更短、镇痛药物需求更低,且成功率为93.9%。9 鉴于 RALP 的高成功率和低并发症发生率,一些泌尿外科医生已将该方法推广至婴儿。近期,Andolfi 发布了其婴儿 RALP 病例系列,表明 RALP 是治疗婴儿肾盂输尿管连接部梗阻(UPJO)的一个有吸引力的管理选择,因为其具有良好的疗效、可缩短住院时间并改善美容效果。10 Higganbotham 团队甚至为一名双侧隐睾男童实施了机器人辅助腹腔镜睾丸固定术。11
当今,腹腔镜下睾丸固定术、腹腔镜下鞘状突高位结扎术已成为全球的常规治疗。机器人辅助腹腔镜手术在美国、欧洲和亚洲也已广泛开展。许多其他公司尝试开发手术机器人系统,以挑战达芬奇手术系统的主导地位。这些系统包括 TransEnterix 的 Senhance surgical system、Titan Medical 的 Single Port Orifce Robotic Technology (SPORT)、Medicaroid 的 Hinotori Surgical Robot System、Meere Company 的 REVO‑I Robotic Surgical System、Edge Medical Robotics 的 Edge surgical system 等。数十种手术机器人系统仍在开发过程中。12 对机器人辅助手术的需求仍在增加。新技术可进一步促进微创治疗的开展,并提升既有系统的能力。仍需未来研究在手术室中进一步评估各类手术机器人设备与平台的优势与不足。13
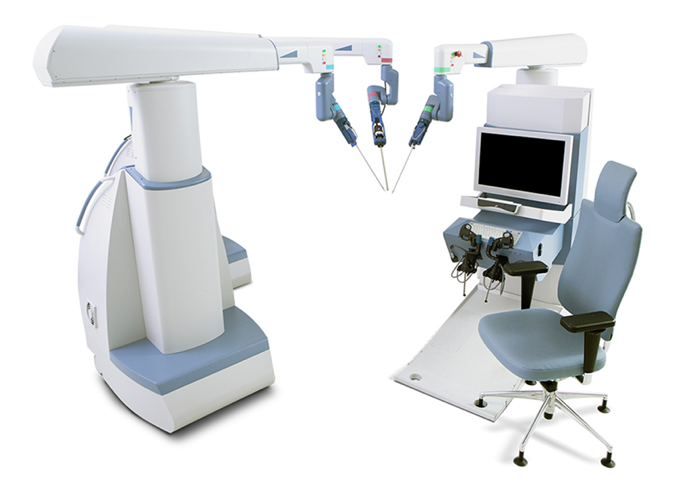
图 3 Senhance 手术系统
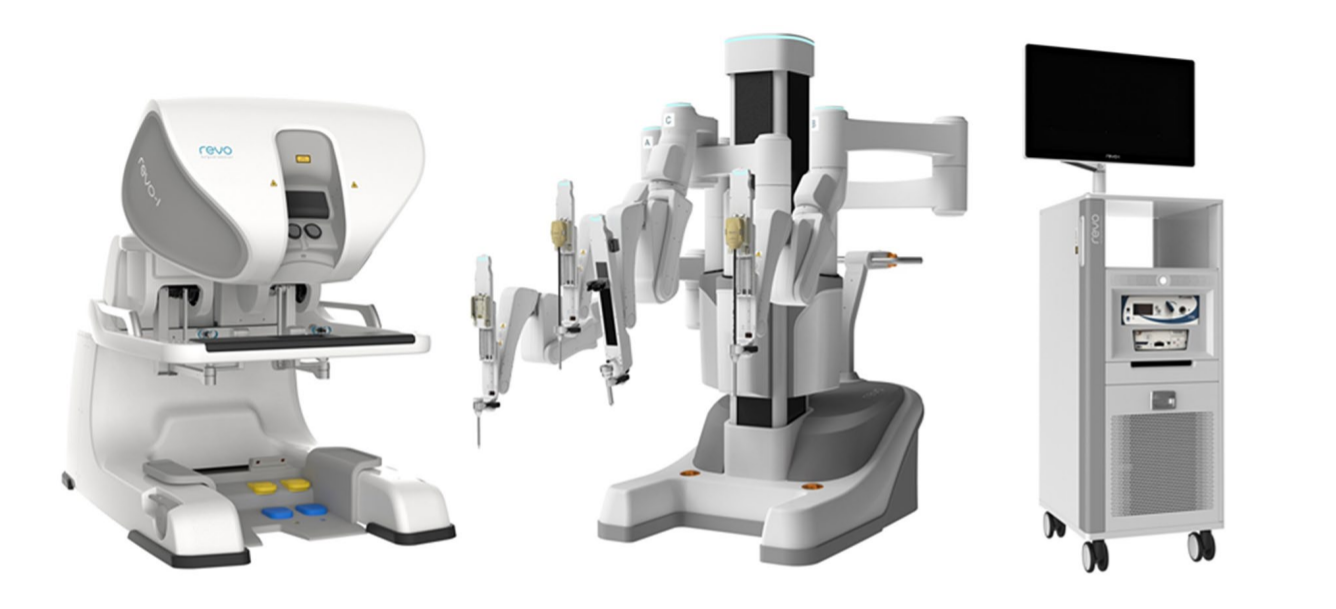
图4 REVO-I 机器人系统

图 5 Hinotori 机器人系统
腹腔镜与机器人手术应用中的器械
小儿泌尿外科腹腔镜手术的器械配置
气腹设备
气腹设备由气腹机、CO2钢瓶、气体输出管路和穿刺器械组成。气腹机可调节气腹压力(6–10 mmHg)和气体流量。现今的气腹机可自动调节腹腔内压力、快速充气,并监测CO2消耗量,并配备钢瓶内CO2压力不足或腹腔内压力超出预设范围的报警装置,使术者能及时发现问题,从而提高手术安全性。现代气腹机 (图6) 可实现: ① 自动循环过滤烟雾,确保清晰的手术视野; ② 实时监测气腹压力,保持气腹压力恒定; ③ 部分气腹充气设备配备气体加温系统,以避免患者体温下降. ④ 消除烟雾排入手术间,保障术者和护士的健康。

图 6 现代气腹机
电动推车
动力推车(图7)将监视器、气腹机、摄像系统、光源系统和电刀整合为一体,置于同一推车上,便于推动,术者可随时方便地调整其位置。

图 7 电源推车
光学系统
目前,腹腔镜多采用杆镜,具有传光性能好、图像无畸变、平场成像、超广角、亮度均匀、景深长、立体感强等特点。直径为5–10 mm,工作长度为31 cm,视场角有0˚、30˚和45˚(图8)。直径5 mm的30˚腹腔镜是小儿泌尿外科最常用的腹腔镜,优点包括可改变手术视野、减少盲区、从不同角度观察同一结构、便于术者形成三维印象,并减少腹腔镜与器械之间的相互干扰。
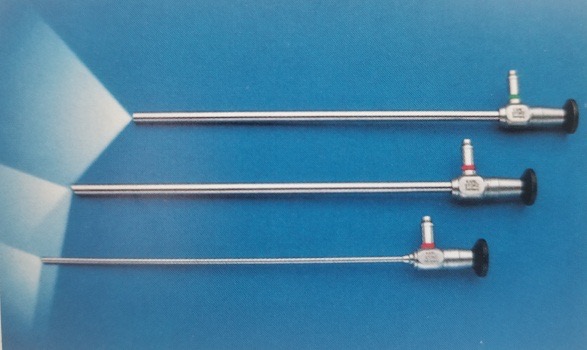
图 8 0°、30°和45°的腹腔镜。
冷光源和光纤探头
冷光源 (图 7) 提供等比例的红、蓝、绿三种波长的光以形成白光,是腹腔镜手术中最常用的光源类型。许多设备目前使用氙气灯(300 W),或采用氙气灯结合LED技术并配备自动亮度调节,以在手术过程中提供可靠的光源。灯泡的平均寿命可达3,000小时。这种光源经济、耐用且高效。镜体内的光纤探头 (图 8) 由可弯曲的导光纤维束构成,具有高质量的光传输性能。在镜体偏折或弯曲时,这些纤维可能发生断裂,需要维修或更换。
摄像系统
腹腔镜摄像系统 (图 9) 已从标清发展到高清、超高清,最近则为 4K 摄像系统。随着分辨率的提升,它能够为术者提供更清晰的手术视野。当前已有 3D 腹腔镜技术,但其仅有直径为 10 mm 的规格,因此在小儿泌尿外科中较为少见。
图 9 腹腔镜摄像系统
电外科系统
包括电动清创器和电凝系统、超声刀(Harmonic scalpel)、能量平台和Ligasure。这些设备提供多种能量类型,包括单极电凝、双极电凝、超声能量,以及它们的组合,以协助外科医生(图 10、图 11、图 12和图 13)。

图 10 电外科设备

图 11 超声刀

图 12 能量平台

图 13 Ligasure
其他器械
常用器械包括 Veress针、穿刺套管针、Hem-o-Lok夹施夹器、钛夹施夹器、抓持钳、持针器、剪刀等(图 14, 图 15, 图 16)。

图 14 常用器械
图 15 穿刺器

图 16 Veress 针

图 17 Hem-o-lok 夹施夹器
达芬奇机器人辅助手腹腔镜手术的器械
达芬奇手术系统主要由三部分组成:术者控制台、床旁机械臂系统(Patient Cart)和三维成像系统(Vision Cart),如图18所示。
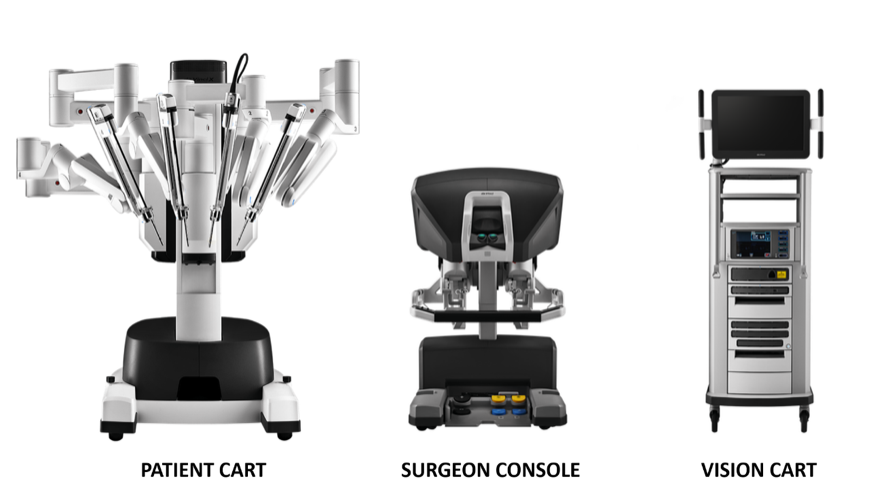
图 18 构成达芬奇系统的三个组成部分
手术控制台:该控制台可放置在手术室无菌区的门外。主要依靠外科医生的双手和脚踏板来控制手术机械臂和3D高清内镜。
床旁机械臂系统(患者端推车): 该系统是机器人的执行部分,主要为器械臂和摄像臂提供支撑。通常包含2~3个操作臂,每个操作臂可配备持针器、剪刀、抓钳等。其位置可根据术中需要互换调整,且机械臂数量可增可减。
3D成像系统(Vision Cart): 该系统内置核心处理器和图像处理设备,可插接至辅助手术设备(充气系统),并以双通道信号提供三维手术视野的立体图像,使术中视野更接近裸眼视觉效果。该Vision Cart包括一对摄像控制器、一对光源以及左右眼视频信号同步器。内镜摄像头含双镜头,通过双镜头采集的图像在视频信号同步器的作用下形成3D图像,有助于术者识别组织关系。
达芬奇机器人在儿童手术中常用的设备包括如下。 机器人穿刺器、控制台、患者端小车。 内镜摄像头通道使用直径为8 mm (Xi) 或8.5 mm (Si) 的工作通道,其他器械通道使用其8 mm或5 mm (Si) 的工作通道。 专用的达芬奇机器人系统套管在腹腔端带有“两细一粗”的标识线。 插入腹壁的深度比传统腹腔镜更浅。
一次性使用无菌机械臂套装,配有适配器。它是机械臂与手术器械之间的”桥梁”。
手术器械: 每个手术器械由三部分组成:盘片、杆身和腕关节。小儿泌尿外科常用的机器人手术器械分为8 mm手术器械和5mm手术器械,包括单极弯曲剪刀、无损伤钳、大号持针器、开窗双极钳、电外科电极刀、手术弯曲剪刀、持针器以及超声刀(Xi)。器械的EndoWrist关节机构可提供±90°的腕部关节活动范围、运动比例缩放以及手部震颤消除,从而实现精确控制。标准腹腔镜器械在两个轴上具有四个自由度(向内、向外、顺时针和逆时针运动)。
患者体位、穿刺器放置与初始入路
上尿路手术
对于腹腔镜上尿路手术,我们通常选择仰卧斜位,向健侧倾斜,患侧垫高约45˚~60˚,尽可能靠近床缘,距离床缘约1 cm。
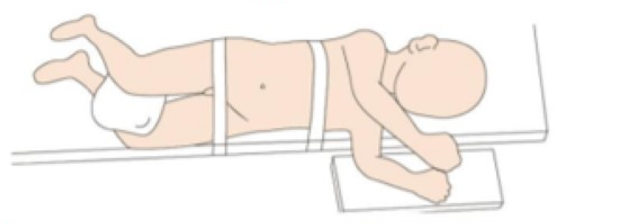
图 19 腹腔镜上尿路患者体位
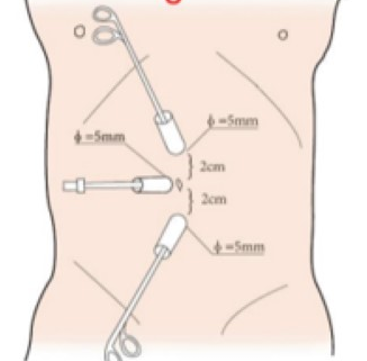
图 20 腹腔镜上尿路穿刺套管位置
对于机器人辅助手术的上尿路腹腔镜手术中患者体位的选择,我们有四条原则:首先,患者取肾位,以提供操作空间并避免与机械臂发生干涉。其次,将患者尽量靠近手术台边缘放置,以缩短与助手的距离。配合手术台旋转,我们倾向于采用80˚侧卧位。最后,手术室的温度管理非常重要。婴儿手术应使用暖风机和保温毯。
所有套管均在直视下放置,包括1个8.5 mm镜套管、1个8 mm套管和1个5 mm套管。为提高缝合效率,于Pfannenstiel切口线中点外侧3 cm处另行放置1或2个3 mm辅助套管。
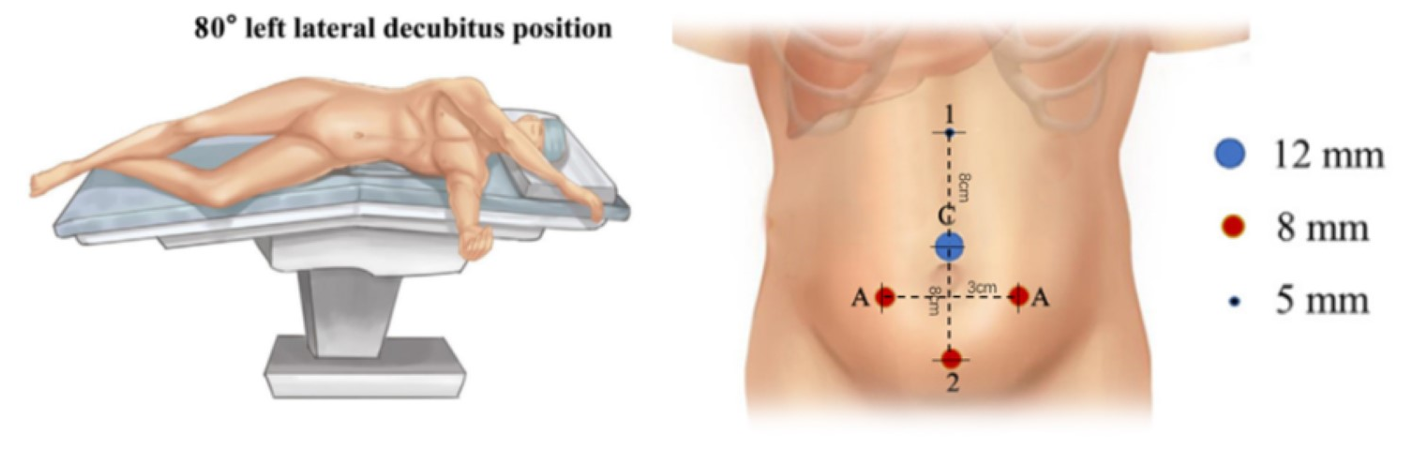
图 21 机器人辅助腹腔镜上尿路手术的患者体位与穿刺器位置
下尿路手术
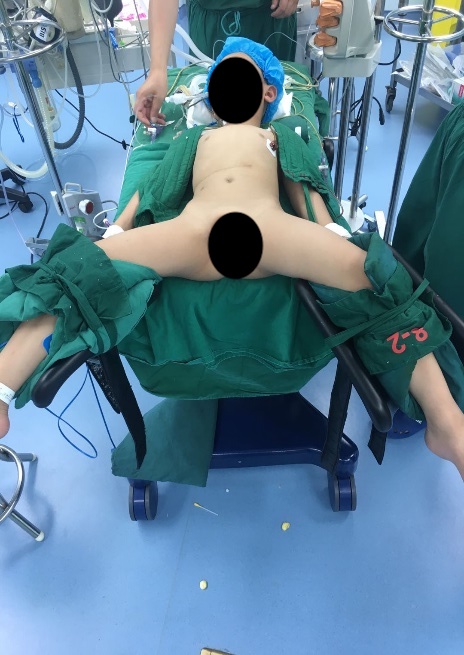
图 22 用于下尿路手术的改良截石位
对于下尿路手术,无论腹腔镜还是机器人辅助腹腔镜,我们采用改良截石位,头低位30–45˚。腹腔镜或机器人手术的端口放置包括:经脐置入1个镜头穿刺器,另在脐平面放置两个穿刺器,彼此间距4–6 cm。
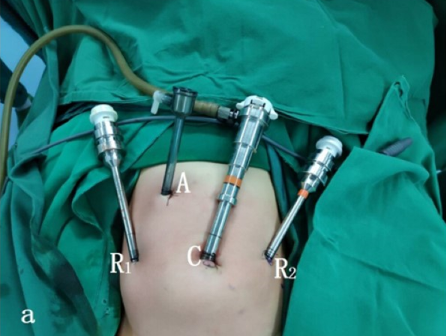
图 23 下尿路手术的穿刺器位置
腹腔镜及机器人技术的应用
肾盂成形术
已有充分证据表明,腹腔镜肾盂成形术或RALP不仅其成功率与开放肾盂成形术相当,而且还具有微创、美容效果更佳、术后疼痛更轻、住院时间缩短以及更快恢复等优势。Anderson-Hynes离断式肾盂成形术是各种手术入路的金标准。
腹腔镜肾盂成形术
对于腹腔镜肾盂成形术,经腹膜或经后腹膜入路均可获得满意的手术视野。但对于机器人辅助手术,后腹膜腔的空间过小。因此,我们对腹腔镜肾盂成形术同时介绍经腹膜和经后腹膜入路,而对 RALP 则介绍经腹膜入路。
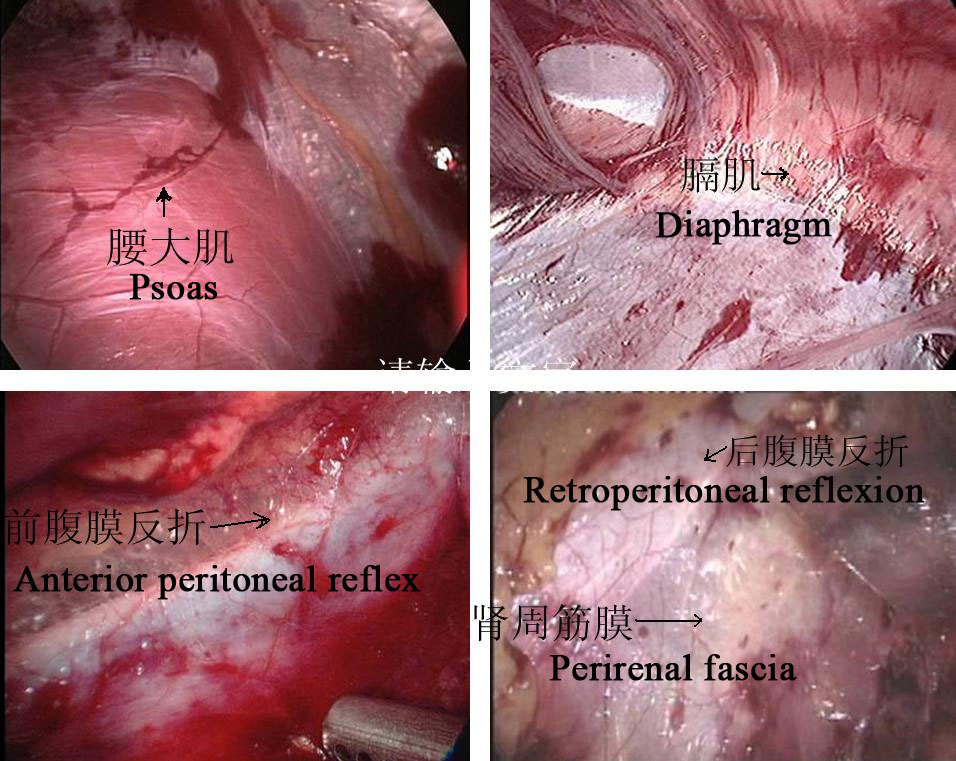
图 24 腹膜后解剖标志
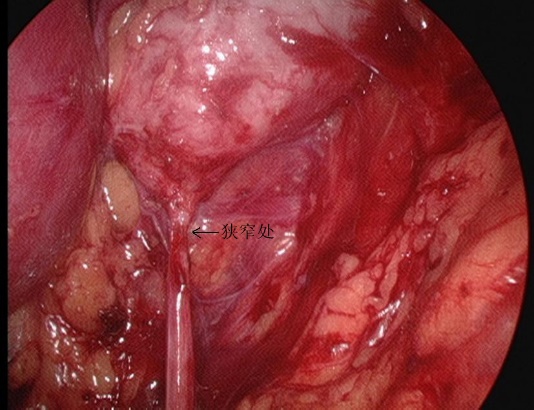
图25 从腹膜后视野观察到的UPJ狭窄部位
后腹膜入路
- 在后腋线上第12肋骨尖端下方1.5–2.0 cm处纵行切开皮肤。以血管钳钝性分离腹横肌起始腱膜及腰背筋膜,进入肾周间隙。以食指钝性分离肾周间隙后置入球囊建立后腹膜手术间隙,充气压力维持在8–14 mmHg,平均10 mm Hg。
- 用超声刀纵行切开肾周筋膜,暴露肾下极背侧,分离肾盂及上段输尿管,显露狭窄部位及原因。分离肾中下极背侧,游离并充分显露肾盂及上段输尿管,明确UPJO。
- 切开肾盂。保留肾盂内侧部分不完全分离,仍与输尿管相连,并纵行劈开输尿管,超过狭窄段1.0至2.0 cm。
- 用5-0可吸收缝线将肾盂瓣与输尿管最低点缝合。
- 在狭窄段近端约0.5 cm处分离并离断输尿管,并进一步完成肾盂切开,切除UPJ狭窄段及部分扩张肾盂。
- 按序缝合吻合口后壁,每缝2针加1次锁边缝合。
- 继续缝合多余的肾盂瓣切口,不剪断缝线。
- 顺行经吻合口置入双J支架。
- 间断缝合吻合口前壁。
- 如存在异位血管压迫,将血管置于肾盂输尿管背侧行褶裥固定,降低充气压力,确认术野无活动性出血,经髂嵴处穿刺套管针留置1根后腹膜引流管,关闭切口。
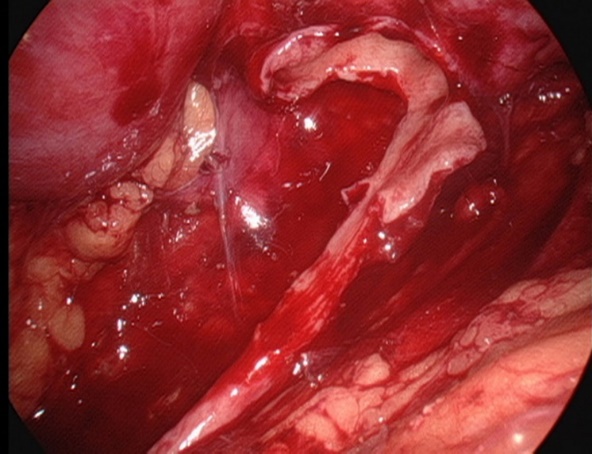
图 26 保持肾盂的内侧部分不完全切离,仍与输尿管相连
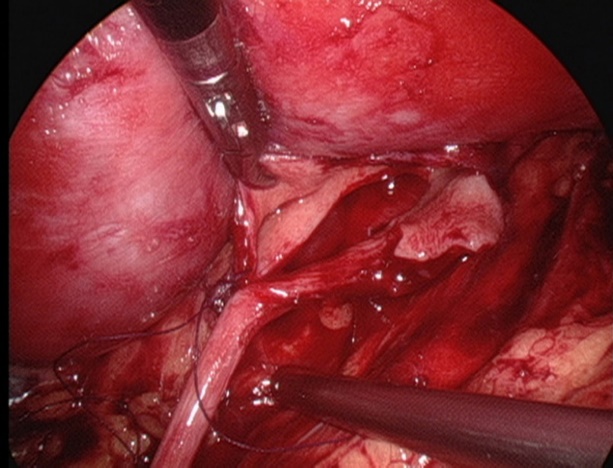
图 27 缝合输尿管的最低点
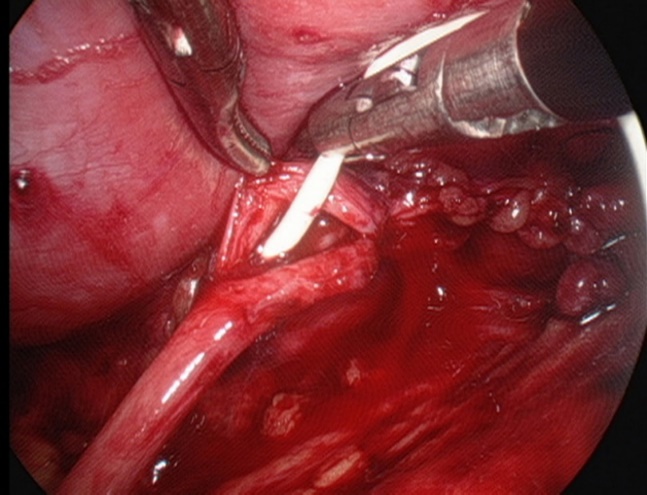
图 28 双J管置入
经腹膜入路
- 建立常规Trocar通道后,将气腹压维持在8–14 mmHg,平均为10 mmHg。
- 沿结肠旁沟外侧切开侧腹膜以充分游离结肠,将结肠向内推移以识别生殖静脉和输尿管。对于左侧肾盂成形术,沿肠系膜间隙的无血管区切开,游离肾周脂肪后显露肾盂及输尿管上段。
- 通过向下牵拉与钝性分离,使肾盂与肾门血管充分分离;随后在背侧继续游离肾盂,以扩大暴露范围,并观察是否有迷走血管跨越肾盂输尿管连接部,以明确狭窄部位。
- 以2-0 mousse 线将肾盂上角悬吊于腹壁。随后自后方向下再向上切开肾盂,形成漏斗状;再沿纵轴切开输尿管,越过狭窄段1~2 cm。
- 以5-0可吸收线将肾盂瓣与输尿管的最低点缝合。
- 于狭窄段远端约0.5 cm处分离输尿管,并进一步完成肾盂切开,切除肾盂输尿管连接部狭窄段及部分扩张的肾盂。
- 吻合口后壁顺序缝合,每缝2针加1个锁结。
- 继续缝合多余肾盂瓣的切口,不剪断缝线。
- 置入双J支架。
- 连续缝合吻合口前壁,仔细彻底止血,并以温热生理盐水冲洗术野。
- 间断缝合侧腹膜或肠系膜间隙。
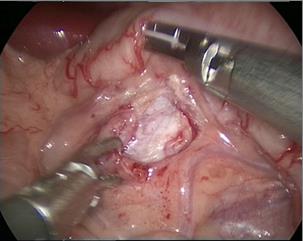
图 29 经肠系膜途径
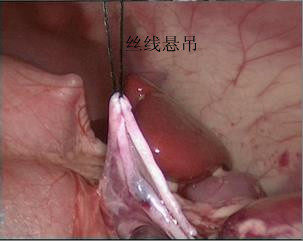
图 30 肾盂的上角被悬吊
机器人辅助腹腔镜肾盂成形术
- 对于左侧病例,采用经肠系膜入路,扩张的肾盂位于降结肠内侧。对于右侧病例,选择结肠旁沟入路。
- 随后仔细游离近端输尿管和肾盂,同时保护输尿管的血供。
- 在梗阻组织上方切开肾盂,并通过经皮牵拉缝线进行修整与稳定,以利于吻合。
- 切除梗阻段后,我们将远端输尿管鱼口状切开,并用连续 6-0 PDS-II 将无蠕动输尿管段的最低点与肾盂端缝合。
- 随后以连续缝合法缝合输尿管后壁。在以第二根连续 6-0 PDS II 缝线开始前壁吻合之前,顺行置入双J输尿管支架(COOK,USI-512,爱尔兰)。
- 最后,使用 5-0 可吸收缝线关闭肠系膜或腹膜。
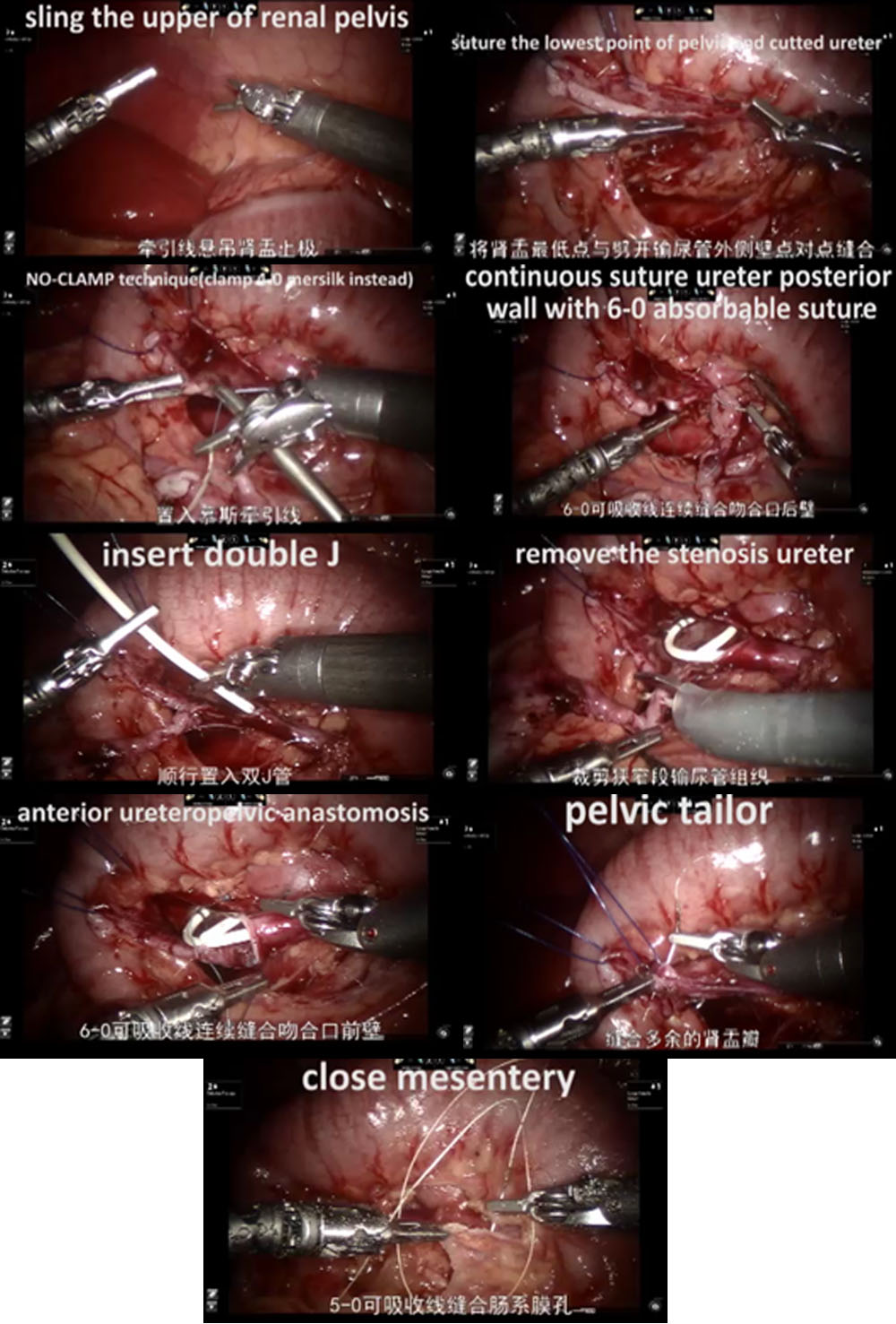
图 31 RALP 的手术步骤
输尿管再植术
输尿管再植术是治疗膀胱输尿管返流和输尿管狭窄的金标准。传统上,该手术采用开放入路完成。可采用多种不同术式:膀胱内Cohen再植术、经膀胱Polino-Leadbetter再植术、膀胱外Lich-Gregoir再植术。上述所有术式均可通过腹腔镜、气膀胱腹腔镜或机器人入路实施。在此我们介绍气膀胱腹腔镜下Cohen氏再植术(横向黏膜下膀胱隧道输尿管-膀胱吻合)以及膀胱外Lich-Gregoir再植术。
建立膀胱气腔
- 通过尿道置入膀胱镜。随后经膀胱镜注入 CO2 气体,直至膀胱扩张至脐平面。在膀胱镜直视下经皮行充盈膀胱牵引。将充盈的膀胱顶部固定于腹部正中脐下位置,于牵引线下缘切开皮肤。牵引固定后立即穿刺置入 Trocar。于左右两侧分别置入 3-5 mm 操作用 Trocar。随后退出膀胱镜。经光学 Trocar 注入 CO2 气体。
- 定位双侧输尿管开口。
- 在患侧输尿管开口处缝合一针牵引线。用电钩环沿输尿管开口切开黏膜。以电刀或超声刀紧贴膀胱壁内段游离输尿管。将游离的输尿管向膀胱内牵拉约 5.0 cm,至可无张力牵引至对侧输尿管开口顶端的输尿管扩张段。男性患者游离输尿管时须保护输精管。
- 于输尿管远端扩张段与狭窄段的交界处切开一小口以引流液体。对于输尿管直径大于 12 mm 者,应对扩张的输尿管行折叠或切割处理。
- 于对侧输尿管开口上方约 2.0 cm 处切开黏膜层,然后用剪刀或血管钳分离黏膜下层,建立通向输尿管开口的黏膜下隧道。
- 经黏膜下隧道将输尿管牵至对侧,切除输尿管开口处的狭窄病变组织,并用 5-0 或 6-0 Vicryl 缝线以 6-8 针将整个输尿管固定于膀胱黏膜,并与膀胱肌层缝合 2 针。
- 用 5-0 Vicryl 缝线将原输尿管开口处的膀胱肌层与输尿管肌层缝合关闭。
- 通过 Trocar 留置双J支架。
- 取出各 Trocar,缝合皮下组织及皮肤。
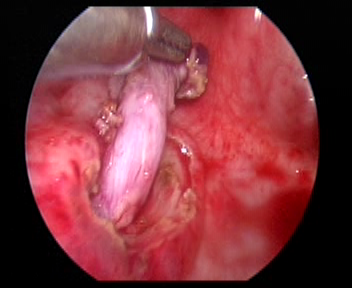
图 32 游离输尿管
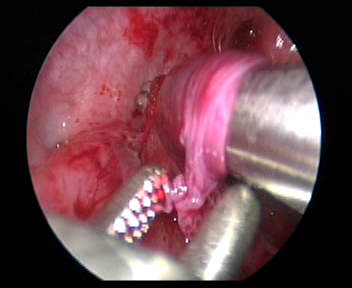
图 33 制作一条通向输尿管口的黏膜下隧道。
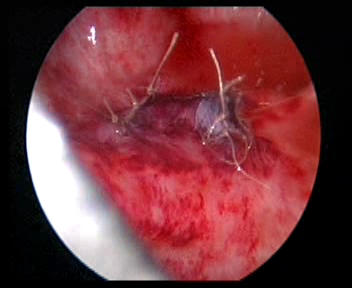
图 34 关闭原有输尿管口
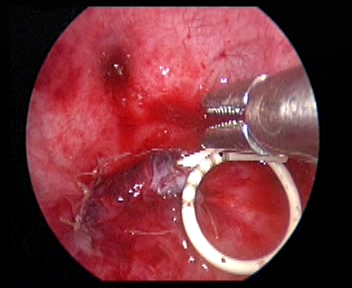
图 35 留置双J管
机器人辅助 Lich-Gregoir 再植术
- 在搏动的髂外动脉处打开外侧腹膜,找到跨越髂外动脉的输尿管,并将输尿管尽可能向远端游离至输尿管膀胱连接处,以充分显露输尿管狭窄。
- 向膀胱注入60 ml生理盐水,使膀胱轻度充盈。在膀胱后外侧壁做一处5 cm切口。随后切开膀胱直达膀胱黏膜下层。
- 在输尿管膀胱连接处分离输尿管,将远端输尿管修整至正常口径。扩大该处膀胱黏膜切口。随后用6/0可吸收缝线将修整后的输尿管与膀胱黏膜切口缝合固定。先完成后壁吻合,并留置双J管后继续完成前壁吻合(对于反流病例,于术前置入双J管)。
- 用可吸收缝线关闭膀胱外侧壁腹膜及盆段输尿管周围腹膜。撤除机器人系统,放置引流管,缝合皮肤切口。
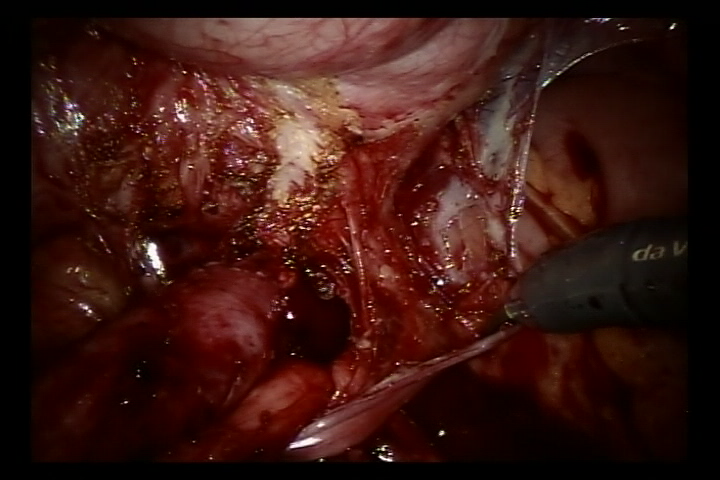
图 36 游离输尿管
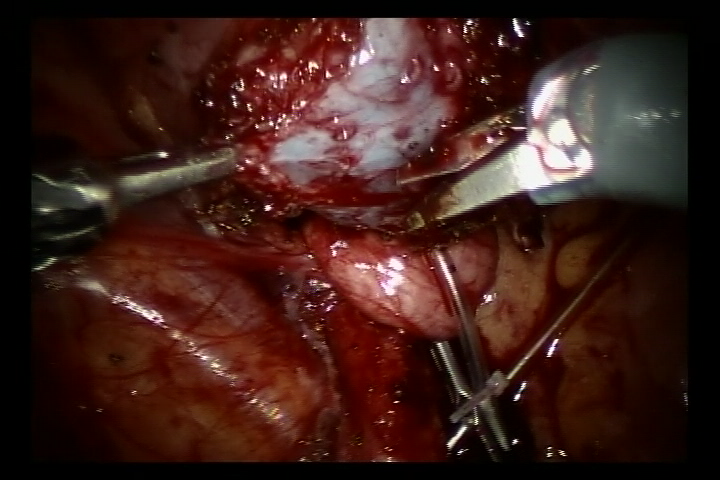
图 37 将膀胱切开至膀胱黏膜下层
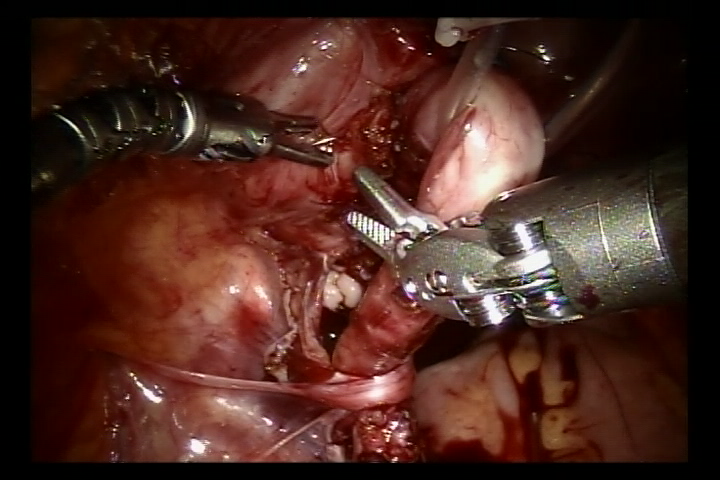
图 38 将质地松软的肌层两侧缝合以形成黏膜下隧道
膀胱横纹肌肉瘤
横纹肌肉瘤(RMS)是儿童最常见的软组织肉瘤。为切除肿瘤,应行根治性或部分膀胱切除术。在此介绍我们关于机器人辅助根治性膀胱切除术联合乙状结肠原位新膀胱重建及双侧输尿管再植术(Politano-Leadbetter 技术)的经验。
- 在距耻骨联合约6 cm处放置一个用于镜头的10 mm套管孔。为#1and #2机械臂在距镜头套管孔6 cm、位于锁骨中线且前上棘上方的位置放置两个8 mm机器人操作孔。在右侧锁骨中线、靠近肋缘下方放置两个5 mm助手孔。
- 在对膀胱肿瘤进行仔细而准确的根治性切除
-
以及对骨盆周围淋巴结的切除之后,我们游离并截取约20 cm的乙状结肠,将其去管化为球形,以重建最终可以
- 可容纳约100 mL.
- 随后,我们经黏膜下隧道,采用 Politano-Leadbetter 技术行双侧输尿管抗反流再植术
- 最后,我们通过腹股沟切口(比基尼线)取出标本。
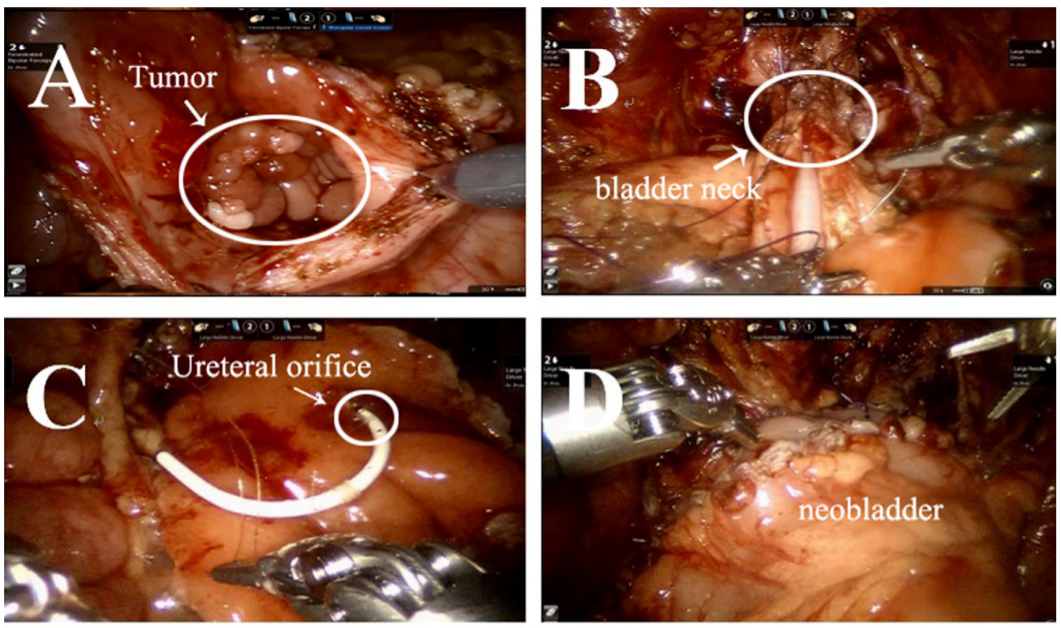
图 39 根治性膀胱切除术联合乙状结肠原位新膀胱重建及双侧输尿管再植的手术步骤
其他应用
我们还开展了机器人辅助腹腔镜手术,用于肾母细胞瘤的肾切除术或肾单位保留手术、神经母细胞瘤切除术、前列腺包膜切开术以及输精管重建术。对于复杂性肾积水病例,可实施Yang-Monti技术、阑尾或口腔黏膜输尿管替代术。随着器械与技术的不断改进,微创外科的前景可期。
注意事项
在再植术中,应游离出足够长度的输尿管,以充分去除输尿管病变,并尽可能确保无张力吻合。由于机器人辅助系统缺乏力反馈,应避免对输尿管组织过度夹持,并尽量保留输尿管周围组织及其血供。在进行输尿管膀胱再植时,应注意保持缝线对称,以防止输尿管扭转或成角。
若在膀胱排空状态下输尿管的直径超过1.5 cm,应予以截窄,否则难以建立抗返流结构。膀胱黏膜下隧道的长度应约为输尿管直径的5倍,以保持一把相对固定的钳子作为支撑,从而获得令人满意的抗返流效果。
对于肾盂成形术,应更充分游离肾盂,以降低吻合口张力,而上段输尿管应尽可能少游离,以尽量减少机器人系统器械对输尿管的直接夹持并保护输尿管血供。第一针最为重要。如果先将肾盂与输尿管完全分离再行吻合,容易发生输尿管扭曲。因此,术中应准确判断肾轴方向。以及肾盂下瓣。肾盂的最低点应与纵行切开的输尿管侧壁行吻合。
参考文献
- WE. KJ. The evolution of laparoscopy and the revolution in surgery in the decade of the. 1990; 2 (4): 51.
- Cortesi N, Ferrari P, Zambarda E, Manenti A, Baldini A, Pignatti Morano F. Diagnosis of Bilateral Abdominal Cryptorchidism by Laparoscopy. Endoscopy 1976; 08 (01): 33–34. DOI: 10.1055/s-0028-1098372.
- Peters CA, Schlussel RN, Retik AB. Pediatric Laparoscopic Dismembered Pyeloplasty. J Urol 1995; 53 (6): 1962–1965. DOI: 10.1016/S0022-5347(01)67378-6.
- Blanco FC, Kane TD. Single-Port Laparoscopic Surgery in Children: Concept and Controversies of the New Technique. Minim Invasive Surg 2012; 2012 (232347): 1–5. DOI: 10.1155/2012/232347.
- Meininger DD, Byhahn C, Heller K, Gutt CN, Westphal K. Totally endoscopic Nissen fundoplication with a robotic system in a child. Surg Endosc 2001; 15 (11): 1360–1360. DOI: 10.1007/s00464-001-4200-3.
- OLSEN LH, JORGENSEN TM. Computer Assisted Pyeloplasty In Children: The Retroperitoneal Approach. J Urol 2004; 171 (6 Part 2): 2629–2631. DOI: 10.1097/01.ju.0000110655.38368.56.
- ATUG FATIH, WOODS MICHAEL, BURGESS SCOTTV, CASTLE ERIKP, THOMAS RAJU. Robotic Assisted Laparoscopic Pyeloplasty In Children. J Urol 2005; 174 (4 Part 1): 1440–1442. DOI: 10.1097/01.ju.0000173131.64558.c9.
- Lee RS, Retik AB, Borer JG, Peters CA. Pediatric Robot Assisted Laparoscopic Dismembered Pyeloplasty: Comparison With a Cohort of Open Surgery. Yearbook of Urology 2006; 2006 (2): 273–274. DOI: 10.1016/s0084-4071(08)70423-8.
- Hollis MV, Cho PS, Yu RN. Robot-Assisted Laparoscopic Pyeloplasty. Pediatric Robotic Urology 2015; 1: 109–121. DOI: 10.1007/978-1-60327-422-7_8.
- Andolfi C, Rodríguez VM, Galansky L, Gundeti MS. Infant Robot-assisted Laparoscopic Pyeloplasty: Outcomes at a Single Institution, and Tips for Safety and Success. Eur Urol 2021; 80 (5): 621–631. DOI: 10.1016/j.eururo.2021.06.019.
- Higganbotham C, Cook G, Rensing A. Bilateral Robot-Assisted Laparoscopic Orchiopexy for Undescended Testes. Urology 2021; 148 (314): 314. DOI: 10.1016/j.urology.2020.10.044.
- Rao PP. Robotic surgery: new robots and finally some real competition! World J Urol 2018; 36 (4): 537–541. DOI: 10.1007/s00345-018-2213-y.
- Peters BS, Armijo PR, Krause C, Choudhury SA, Oleynikov D. Review of emerging surgical robotic technology. Surg Endosc 2018; 32 (4): 1636–1655. DOI: 10.1007/s00464-018-6079-2.
最近更新时间: 2025-09-22 08:00