6: 儿童全身麻醉的注意事项
阅读本章大约需要 10 分钟。
引言
儿科泌尿外科手术涉及广泛的患儿类型、手术方式,以及多样化的麻醉需求与方式。麻醉方案可能各不相同:既包括为健康且仅有单纯泌尿系统问题的患儿实施的日间门诊手术麻醉,也可能更为繁琐且复杂。
对于医学情况复杂的患者,或涉及多个阶段外科干预的患者,其麻醉管理除全身麻醉外,可能还包括多模式镇痛、各种椎管内或区域麻醉阻滞技术,并且可能需要住院以便提供术后急性疼痛服务。医学情况复杂的患者可从就诊术前麻醉评估门诊或术前优化门诊中获益,以确保所有随访信息均为最新(例如,先天性心脏病患者的超声心动图和心内科手术许可),并便于及时完成任何必要的实验室检查或影像学检查。
手术团队与麻醉团队之间的良好术前沟通是理想状态,并且可能包括围手术期的任何特殊需求、预期的术后入院安排或疼痛问题。
家长可能已经在网上查阅了有关麻醉的信息,或者他们可能有关于麻醉药物的问题想向泌尿科医生咨询。这些家长通常可以得到安慰:他们将在手术当日与麻醉科医生进行交流,或者可以向他们提供麻醉团队的联系方式以便进一步咨询。
术前评估
抗焦虑
儿童术前焦虑可导致显著的不良结局,并引起术后行为改变。来自美国和欧洲的数据表明,手术后两周内,最多可有54%的患儿出现一般性焦虑、噩梦、夜间啼哭、遗尿、分离焦虑以及发脾气。一些儿童在手术后6个月至1年仍持续存在不良适应性行为改变。其就医体验的质量对限制术后行为改变并降低后续就诊时的焦虑至关重要。有多种方法可用于帮助降低患儿的术前焦虑并改善其围手术期体验。1
药物和分散注意力技术均可对焦虑的儿童产生良好效果。2 分离焦虑通常在约1岁时开始。情境性焦虑在学龄前儿童中达到高峰。因此,我们在吸入麻醉诱导前15–30分钟于术前候诊区给予口服的抗焦虑药(如咪达唑仑口服液,0.5–0.75 mg/kg),以确保药物在最佳时间起效。经鼻和肌内给药也是抗焦虑药给药的其他选择。
在我们机构,发育正常的儿童在年满7岁后通常能够在术前等待区坐着配合进行静脉(IV)导管置入,因此对较大儿童更常提供静脉麻醉诱导,尽管在某些患儿中吸入麻醉诱导可能仍更可行。儿童生活专员(在就医过程中接受训练以为儿童提供分散注意力和安慰的人员)可教授应对技能、提供游戏活动、讲解诱导过程并协助进行静脉置管。还可使用其他装置,例如喷射给药的缓冲利多卡因(利用加压的利多卡因、无需针头在皮肤上形成一块麻木的风团),经此处可置入静脉导管,疼痛极小。如时间允许,也可在皮肤上使用局部麻醉剂,以减轻置入静脉通路时的疼痛。3
在麻醉诱导时允许父母在场也有助于减轻焦虑并提高家长满意度。一些家长可能不论孩子年龄多大都希望在场。某些患者群体(例如被诊断为自闭症谱系障碍者)在父母或照护者等熟悉个体在场时有时更易配合。尽管在诱导期允许父母在场可能是合适的,但研究表明,用于治疗焦虑的药物性术前用药优于父母在场。高度焦虑的家长或具有扰乱性行为的家长可能会妨碍麻醉诱导过程。此外,诱导期父母在场并不会影响术后行为改变;而口服咪达唑仑已被证实可减少幼儿术后即刻的不良行为结局。是否邀请家长进入手术区域的最终决定,应由麻醉团队在术前访谈并讨论麻醉方案后作出。总体而言,在当前的疫情期间,除非在极为特殊的情况下,不鼓励在诱导期允许父母在场。1
急性疾病
传染性疾病
呼吸道感染
在小儿麻醉实践中,一个常见的难题是:面对身体状况良好与不佳的患儿,如何决策是否进行麻醉。某些病原体及其引起的气道黏膜反应性可导致麻醉并发症。在伴咳嗽的感冒或单纯的上呼吸道感染(URI)之后,气道反应性可能在数周内持续升高。我们的政策是将择期手术推迟至上呼吸道感染(URI)症状完全消失后4周,或下呼吸道感染(LRI,如呼吸道合胞病毒(RSV)、流感或肺炎)症状消失后6周再进行。这样可以使气道反应性恢复到基线水平,并降低术中麻醉并发症(如支气管痉挛、喉痉挛、低氧)以及术后非计划性入院的风险。7,8
通常,上、下呼吸道感染(URI 和 LRI)的症状会在术前筛查电话中被识别出来,这样在手术安排上就有足够时间取消病例并填补手术日程的空档。但对于已经来到术前候诊区准备手术、却“刚刚”出现流涕、发热、咳嗽或一系列新症状的患儿,该如何处理?上呼吸道感染的某些表现(例如绿色鼻涕、肺部听诊可闻哮鸣音,或48小时内出现发热)会显著增加气道事件的相对风险,足以使手术当日取消成为容易的决定。9 然而,情况并非总是如此明晰;例如,仅有清水样流涕、偶发干咳等孤立症状时。患儿可能已完成术前检查;父母可能已请假;孩子也可能已按要求禁食禁饮;手术当日取消对所有相关方都不便。我们的做法是以安全为首要目标,逐例评估每位患儿,排除活动性发热等明显急性疾病征象,并综合考虑手术的紧迫性及任何酌情因素,例如:家属长途跋涉而来;患儿经常生病,以至于几乎不可能找到连续四周的无症状恢复期;或父母照护假期有限,导致改期尤其困难。我们也将父母纳入决策过程,告知他们:尽管总体绝对风险较低,但在活动性上呼吸道感染背景下实施麻醉,比在健康儿童中风险更高。文献支持根据症状类型与持续时间以及患者危险因素(如被动吸烟暴露、年龄、哮喘)进行风险分层;总体建议是:对低风险患者的轻微症状可以继续手术;对高风险患者的明显症状则应改期。1
严重急性呼吸综合征冠状病毒2型
在一家大型学术型儿童医院进行的一项回顾性队列研究显示,与匹配对照组相比,在手术前10天内SARS-CoV-2检测阳性的每位儿童其呼吸系统并发症发生率高得多(11.8% vs 1.0%,95% CI 1.6-19.8%,p = 0.003)。鉴于对周围其他患者和医务人员存在额外的传染风险,我们建议术前对每位患者常规进行SARS-CoV-2检测,并在出现新的COVID-19检测阳性结果时重新安排择期手术。10
哮喘
对于症状控制不佳的患者,应将择期手术推迟,直至其治疗得到优化。对于急性哮喘加重的患者,手术应在病情缓解并恢复至基线后延迟4周进行。患者应在麻醉前的数周及数天内持续使用其预防性哮喘药物。11,12
医学合并症
根据疾病状态的临床表现(急性、亚急性、慢性)以及手术的紧急程度,小儿泌尿外科患者可能表现为完全健康,或者伴有一系列血流动力学紊乱、电解质失衡及器官功能障碍。
具有复杂医学合并症的患者应在术前门诊就诊,以确保在手术前其医学状况得到最佳控制。尽早转诊至术前门诊可留出充足时间,以有效启动优化方案并管理可改变的风险。因慢性医学状况而接受维持用药的患者应在围手术期继续使用这些药物。13,14
术前禁食指南
对于接受会降低保护性气道反射的药物的患者,已有降低肺部误吸风险的指南。美国麻醉医师协会建议患者在手术前8小时起禁食高脂肪固体食物。对于清淡餐、任何非清澈饮品、非人乳以及人工肠内营养,禁食时间为6小时。母乳应在麻醉前4小时停止,清澈液体应在麻醉前2小时停止。15 加拿大麻醉医师协会提出了类似指南,但加拿大小儿麻醉学会现鼓励儿童在手术前1小时内仍可饮用清澈液体。16 欧洲麻醉学会的禁食指南规定术前6小时禁止进食固体食物,并鼓励成人患者在术前2小时内可饮用清澈液体、儿科患者在术前1小时内可饮用清澈液体。17
人们担心关于清流质禁食的指南可能过于僵化,并可能导致不良结局。由于手术室安排具有不可预测性,规定“清流质禁食2小时”在实际中往往变成更长的禁食时段。延长禁食会增加不适,并造成不利的生理和代谢影响。对年幼儿童来说,执行禁食指南也很困难。胃超声的倡导者认为,与仅依赖禁食指示相比,测量胃内容物可能更可靠。在因违反NPO(禁食)而考虑取消或延迟手术之前,应进行胃超声检查。
麻醉注意事项
全身麻醉与脊髓麻醉
脊髓麻醉的应用
脊髓麻醉是进行脐以下手术患者的一种良好麻醉选择。18 从技术上讲,脊髓麻醉没有年龄限制。然而,超出新生儿和婴儿期,鉴于患者的认知发育以及难以配合脊髓麻醉穿刺与手术操作,如果不使用抗焦虑药或镇静,单纯脊髓麻醉成功的可能性不大。既往早产儿常有早产儿呼吸暂停、支气管肺发育不良和慢性肺病的病史。与足月出生的婴儿相比,其术后呼吸暂停风险进一步升高。19 在可行的情况下,脊髓麻醉有助于降低与全身麻醉相关的潜在风险,如神经毒性、呼吸暂停以及不良心肺事件。对于全身麻醉可能增加风险的患者,应考虑脊髓麻醉,例如存在面部畸形、困难气道、肌营养不良或有恶性高热家族史者。
成人常见的由脊髓或硬膜外麻醉引起的交感阻滞所致的血流动力学改变在年幼儿童中并不出现。儿童的交感神经系统相对不成熟,维持血压对血管运动张力的依赖性较低。此外,他们下肢静脉容量较小,因此血液淤积较少。
脊髓麻醉禁忌症
脊髓麻醉一般仅用于持续90分钟或以下的手术。与成人相比,儿童的脑脊液(CSF)容量更大且更替速度更快。鉴于这一差异,与新生儿和婴儿相比,脊髓麻醉在较大儿童和成人中的持续时间通常更长。单次注射的脊髓麻醉通常可维持60-90分钟;若与骶管阻滞联合应用,持续时间可延长至120分钟。
禁忌证包括凝血功能障碍、全身性感染或穿刺部位的局部感染、未纠正的低血容量、监护人拒绝以及患者不合作。诸如脊柱裂和颅内压增高等神经系统异常也是脊髓麻醉的禁忌证。
并发症
蛛网膜下腔麻醉后的并发症包括创伤性穿刺导致的出血、疼痛以及对穿刺部位周围结构的损伤。在严格无菌操作下,诸如脑膜炎等严重感染性并发症的发生率极低。20 高位蛛网膜下腔麻醉可导致呼吸和心血管功能不全。神经系统损伤和局部麻醉药中毒分别可由注射错误的溶液或错误的局部麻醉药剂量引起。硬膜穿刺后头痛是蛛网膜下腔麻醉的另一并发症。然而,由于在较小年龄儿童中评估头痛存在困难,PDPH 的发生率尚不明确。
腹腔镜与机器人手术的考虑事项
机器人和腹腔镜泌尿外科手术方式的应用正在增加。21 这些手术方式在手术过程中会对通气、静脉回流、血流动力学以及腹盆腔器官灌注产生独特的影响。对于这类手术,需要实施气管插管全身麻醉,因为清醒患者无法耐受腹腔充气。此外,腹腔镜手术通常需要肌松以优化手术条件。气腹常导致可逆性少尿或无尿,并引起与成人腹腔镜手术中所见相似的血流动力学和呼吸改变。
表 1 腹腔镜手术相关的生理学改变。CVP: 中心静脉压; CO: 心输出量; MAP: 平均动脉压; SVR: 全身血管阻力; FRC, 功能残气量; TLV, 总肺容积; VTE, 静脉血栓栓塞。来源:Miller RD 等。Miller’s Anesthesia 第7版。章:腹腔镜手术的麻醉(第68章)第2185-2193页。22
| 器官系统 | 干预 | 影响 | 处理 |
|---|---|---|---|
| 心血管系统 | 头低位体位 | CVP 升高,CO 增加 | 减少倾斜 |
| 头高位体位 | CVP、MAP 降低 | 减少倾斜 | |
| 充气 | 压力感受器反射 → 反射性心动过缓或心搏停止 | 减少或停止充气,处理心率异常 | |
| SVR 增加 | 减少头高位倾斜,使用血管扩张剂,加深麻醉 | ||
| 呼吸系统 | 充气、头低位体位 | 肺不张 → FRC、TLV、肺顺应性降低 → 低氧血症,高碳酸血症 | 提高通气参数,降低充气压力,减少头低位倾斜 |
| 神经系统 | 头低位体位 | 在颅内顺应性差的患者中,颅内压和眼内压升高 | 减少向下倾斜 |
| 肾脏系统 | 充气 | 少尿、无尿 | 一旦解除充气,通常可逆且为一过性 |
| 内分泌系统 | 充气 | 儿茶酚胺、应激激素升高 | 加深麻醉,充分处理疼痛刺激 |
| 血管系统 | 体位(尤其截石位)与充气 | 下肢静脉淤积 → VTE 风险增加 | 使用抗 VTE 装置,定期变换体位 |
区域麻醉
硬膜外单次注射
骶管麻醉是一种成熟的技术,具有长期的安全性记录(Polaner 等人—PRAN 研究)。骶管麻醉的益处包括减少术中和术后镇痛药物的需要、降低应激激素反应,以及提高整体的患儿和家长满意度。23
尾管阻滞是通过骶裂进入硬膜外腔注射局部麻醉药的一种方法。骶裂的骨性标志在年幼的儿科患者中通常可触及,或可通过超声显示。
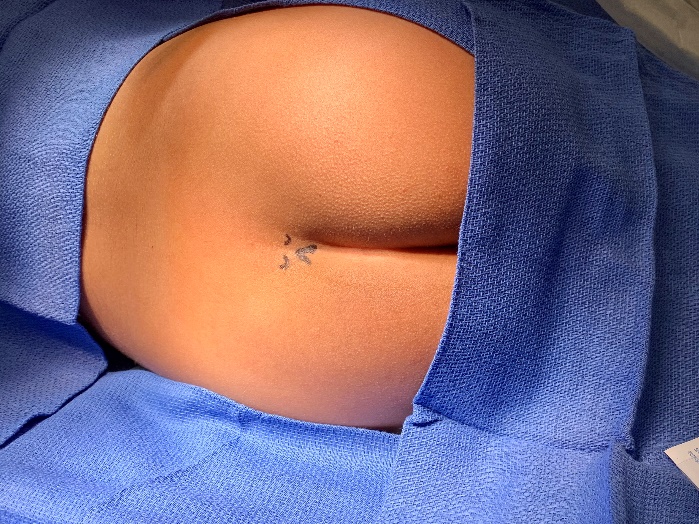
图 1 通过触诊骨性标志的解剖学方法进行骶管阻滞。 采用解剖学方法时对骨性标志进行触诊。体表解剖:骶角与骶裂孔。
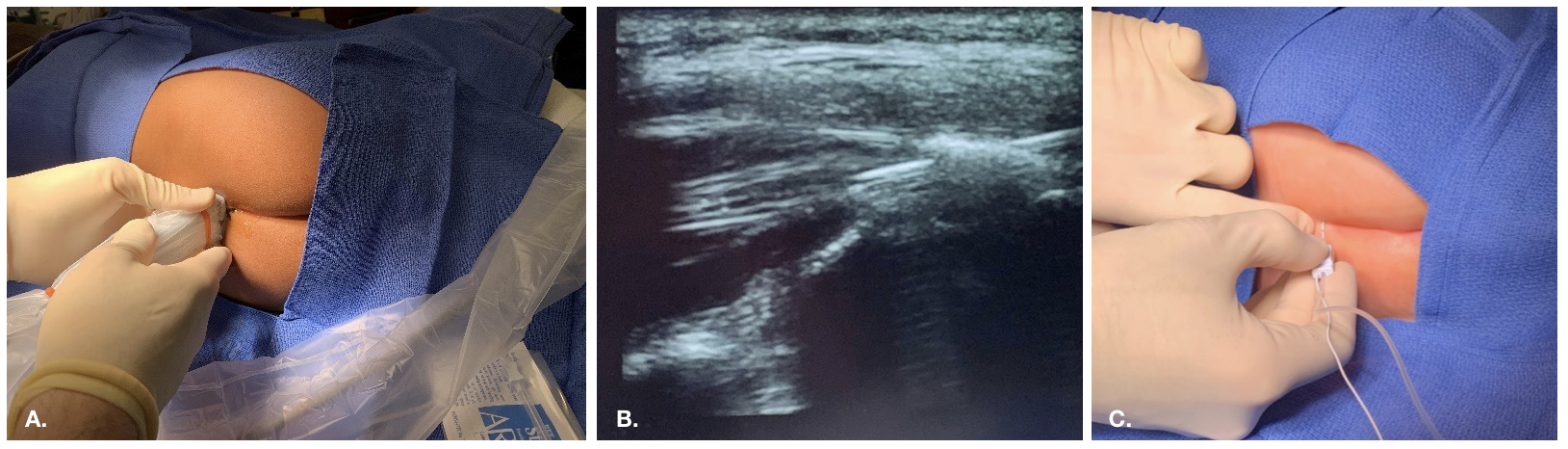
图2 超声引导下骶管阻滞的入路
图 3 解剖条件复杂且存在术后改变的患者在透视引导下行硬膜外导管置入
骶管阻滞的禁忌证
禁忌证包括脊柱裂性畸形(例如,脊髓栓系)、注射部位感染或骶尾部藏毛囊肿、患者拒绝,以及(相对)出血风险增加。
骶管阻滞虽然总体上简单、技术不复杂且成功率高,但即便由经验丰富的操作者实施,仍然存在一定的失败率。失败最常见的原因是注入药液位于不恰当的解剖部位(例如,皮下、血管内),这在初期可能不易被察觉。
骶管阻滞并发症
风险包括出血、感染、神经损伤、意外硬膜穿刺及硬膜穿刺后头痛、过敏反应以及局部麻醉药毒性。最常见的不良事件是无法实施阻滞或阻滞失败。20
年龄限制
尽管有些中心将骶管阻滞限定用于非行走(婴儿)人群,骶管阻滞在较大龄儿童中同样可以安全且有效。在我们的儿科实践中,我们常根据体型在较大龄儿童中实施骶管阻滞,适用于需要达至骶段水平镇痛的手术(如包皮环切术)。在体型更大(超过 50 kg)或年龄更大的儿童中,在相应节段行单次腰硬膜外注射通常较为直接,但由于骶神经根相对较粗大,可能出现骶段保留,因此更理想地用于提供腰段水平的镇痛(如用于 Pfannenstiel 切口)。2,24 成人研究提示,在进行确认性的骶管硬膜外造影时,意外血管内注射的发生率高于预期。25 体型的解剖学改变、骶尾膜骨化以及硬膜外腔的改变,也可能使在较大龄、体型更大的儿童和成人进行椎管内阻滞时,更倾向选择腰椎或胸椎作为入路点。
尿道下裂并发症发生率
尿道下裂修复术是年轻男性中常见的泌尿外科手术。已发表的报告主要关注手术技术和缺陷严重程度对手术并发症发生率的影响。近年来,关于麻醉技术对术后并发症(如尿道皮肤瘘或龟头裂开)发生率影响的报告存在争议。
在一项比较阴茎神经阻滞与骶管麻醉在尿道下裂修复术中疗效的随机研究中,Kundra 等人 偶然注意到,接受骶管阻滞的患者尿道皮肤瘘的发生率更高。26 需要注意的是,该研究的样本量较小(N=54),且受试儿童年龄为4至12岁;高于当前尿道下裂修复术的推荐年龄。有些研究发现,较大的患者年龄是并发症的危险因素。27,28 此外,手术由泌尿外科医师和整形外科医师实施,且与阴茎神经阻滞组相比,骶管阻滞组所采用的手术技术也不同。
Taicher et al., 在对2001-2014年间由一名外科医生实施的原发性尿道下裂修复进行回顾时,发现并发症与骶管阻滞、近端型尿道下裂、手术时间延长以及外科医生执业早期年份有关。29 通过多因素Logistic回归分析校正混杂因素后,他们得出结论:骶管阻滞和近端型尿道下裂均仍与术后并发症高度相关。作者确实指出,他们的外科医生在除最轻度龟头型病例外的所有病例中常规使用含肾上腺素的利多卡因。然而,由于其数据库未能一致记录皮下注射肾上腺素的使用情况,他们无法评论其是否在研究发现中起到作用。
Zaidi et al 发现,尿道口的位置(近端 >远端阴茎体)与尿道皮肤瘘的发生呈强相关。与 Taicher et al. 相比,他们对接受远端尿道口管状化修复的一个亚组的分析显示,瘘形成与骶管阻滞的使用无关联,但与皮下肾上腺素的使用有关。29,30 同样,Barga et al 在多变量分析后仅发现近端型尿道下裂与瘘形成存在关联。31
对非随机观察性研究进行的系统综述和荟萃分析未发现骶管阻滞与术后并发症之间存在关联。32 荟萃分析的优势在于其能够增加观察数量,从而提升统计效能。但我们必须牢记,荟萃分析受制于来源数据的偏倚和局限性。
与阴茎神经阻滞(PNB)相比,骶管阻滞被发现具有更低的尿道下裂再手术率,尽管早期报道提示相反的结果。33
骶管阻滞可能导致术后并发症的机制尚不清楚。已有假说认为,继发于交感神经切除样效应的血液淤积会导致阴茎充血、术后水肿以及伤口愈合不良。26 另一些人则认为,骶管阻滞所致动脉血流增加可减少组织缺血。33
硬膜外导管
对于需要住院的疼痛性手术,或对于适合实施较长期椎管内(神经轴)镇痛的特定患者,置入骶管或硬膜外导管可有利于延长区域镇痛的持续时间。在本院,许多患者在计划性修复(例如开放性输尿管再植术)后会被”快速通道”管理(如术后第一天即出院),因此更常给予单次注射的骶管阻滞,并联合佐剂以延长阻滞时间。对于需要进行更复杂修复且术后住院时间更长的患者,或既往存在疼痛控制问题者,将在术前由泌尿科与麻醉科急性疼痛团队共同讨论,并置入硬膜外导管。这使得术后可以持续输注局部麻醉药。为评估患者在出院前能否通过口服方案控制疼痛,可暂停硬膜外输注。若试停成功,则可拔除导管,通常在出院前一天。
躯干神经阻滞
当因年龄、解剖学困难或患者拒绝而不适合行骶管阻滞时,髂腹股沟神经阻滞可作为单侧腹股沟-阴囊部位手术的一个选择。切口前实施阻滞更为优选,因为这有助于减少术中静脉镇痛药的使用。然而,局部麻醉药的浸润可能会使外科医生所见的解剖结构发生扭曲。
用于区域阻滞的药物及佐剂
我们的小儿区域麻醉实践中最常用的局部麻醉药是罗哌卡因和布比卡因,两者均以 0.125–0.25% 的浓度使用,通常按 1 cc/kg 给药以获得骶段镇痛平面。一般而言,我们至少使用肾上腺素作为佐剂,它也可用于提示是否发生了意外的血管内注射。当肾上腺素佐剂进入血管内时,在”test dose”期间会使患者心率增加,并且偶尔会引起 EKG 改变(即先注射少量含肾上腺素的局麻药,然后短暂等待以观察是否出现任何 EKG 或生命体征变化)。
为了获得更高的阻滞平面,可通过稀释局部麻醉药的浓度来使用额外的注射液体积(例如,局部麻醉药 1 cc/kg 加 0.5 cc/kg 稀释剂,如不含防腐剂的生理盐水)。
我们在临床实践中最常与局部麻醉药合用的佐剂是可乐定(一般为 1 mcg/kg)、芬太尼(1 mcg/kg)和氢吗啡酮(5–10 mcg/kg)。已注意到骶管内阿片类药物的使用与术后恶心和呕吐增加相关联。34 将可乐定与吗啡(不含防腐剂)作为佐剂相比,在作用持续时间或不良事件方面无显著差异。因此,我们将阿片类作为佐剂(有无可乐定联合均可)的使用限制在术后恶心和呕吐发生风险较低、且能够从延长阻滞持续时间中获益更大的患者(例如,切口较大、疼痛更明显的手术)。由于担心呼吸暂停和心动过缓,通常在新生儿人群中避免使用可乐定。
将右美托咪定作为骶管麻醉的辅助用药与更高的镇静评分和更高的心动过缓发生率相关。35
多模式镇痛
多模式镇痛将神经阻滞、阿片类和非阿片类镇痛药物的使用相结合,以优化疼痛控制。
非甾体抗炎药
尽管缺乏关于其疗效的强有力的大规模证据,酮咯酸可能是安全的,目前在围手术期被广泛使用。36 酮咯酸适用于急性疼痛状况,仅用于短期治疗。其不适用于轻度疼痛,并且对晚期肾脏疾病患者以及血容量复苏不足者为禁用。采用最低有效剂量(例如静脉注射0.5 mg/kg或更低)可获得与较高剂量相当的镇痛效果,同时副作用最小。对于出血高风险或胃肠道溃疡性疾病的患者也应避免使用酮咯酸。麻醉科医师的实践各不相同,但近期文献表明,在健康的新生儿(至少满3周龄且非早产儿)和婴儿中使用,并不与不良反应增加相关。37,38
对乙酰氨基酚
对乙酰氨基酚是儿科人群用于治疗轻至中度疼痛的最常用非阿片类镇痛药。其具有多种剂型和浓度,可经口服、直肠及静脉给予。剂量因给药途径、患儿年龄及可用的静脉制剂而异。对乙酰氨基酚发生严重不良反应的风险较低。肝毒性是其主要的严重不良反应,最常与过量有关,包括有意和无意的过量。39 对于有长期呕吐、长期禁食、脱水或肝功能受损的患儿,应避免使用。40
术后注意事项
术后恶心呕吐
手术和麻醉的一种常见且可能预防的不良反应是术后恶心呕吐(PONV)。PONV 可导致明显不适并降低患者满意度。41 联合治疗比单药治疗更有效。为降低 PONV 风险的麻醉学考虑包括采用区域麻醉和多模式镇痛以减少围术期阿片类药物的需求、通过尽量缩短禁食时间以确保充分的术前水化、术中充分水化、避免使用挥发性麻醉剂,以及通过药物进行预防性治疗。42,43
表 2 儿科患者术后恶心和呕吐的危险因素。主要危险因素以粗体显示,且已被证明具有相加效应。44
| 患者 | 手术 | 麻醉 |
|---|---|---|
| 青春期后女性 | 斜视矫正术 | 使用挥发性麻醉剂 |
| 有PONV或晕动症病史 | 耳部手术 | 使用一氧化二氮 |
| 年龄 > 3 岁 | 扁桃体切除术/腺样体切除术 | 使用阿片类药物 |
| 睾丸固定术 | 麻醉持续时间 > 30 分钟 | |
| 疝修补术 |
表3 术后恶心和呕吐预防的药物。昂丹司琼和地塞米松是儿科人群中最常用的两种药物。42 东莨菪碱透皮贴剂通常不用于12岁以下儿童。《英国儿童国家处方集》建议1个月至3岁使用一贴的四分之一,3–10岁使用一贴的一半。甲氧氯普胺也可引起迟发性运动障碍。
| 药物 | 作用机制 | 剂量 | 不良反应 |
|---|---|---|---|
| 昂丹司琼 | 5-羟色胺3型(5-HT3)受体拮抗剂 | 0.1–0.15mg/kg 静脉注射 (最大 4 mg) | QT 间期延长 |
| 地塞米松 | 作用机制尚不明确 | 0.15 mg/kg 静脉注射 | 肿瘤溶解综合征 |
| 东莨菪碱 | 乙酰胆碱 M1 受体拮抗剂 | 1.5 mg 经皮贴片 | 口干、视觉障碍、镇静 |
| 阿瑞匹坦 | 神经激肽-1 受体拮抗剂 | 1 mg/kg 口服 (最大 40 mg) | 罕见 |
| 劳拉西泮 | GABA 受体激动剂 | 0.05 mg/kg 静脉注射 (最大 2 mg) | 镇静 |
| 苯海拉明 | 组胺 H1 受体拮抗剂 | 1 mg/kg 静脉注射 (最大 50 mg) | 镇静 |
| 甲氧氯普胺 | 多巴胺 D2 受体拮抗剂 | 0.1–0.25 mg/kg 静脉注射 (最大 20 mg) | QT 间期延长 |
呼吸暂停
既往早产儿被发现术后呼吸暂停的风险增加。出生时胎龄越大,呼吸暂停的风险越低。Cote 等人 在其奠基性研究中发现,呼吸暂停的发生率与胎龄和受孕后年龄密切相关,并且在受孕后年龄超过43周后总体发生率显著降低。对于胎龄为35周出生的患儿,呼吸暂停发生率在受孕后年龄超过48周后降至低于5%,在超过54周后降至低于1%。对于胎龄为32周出生的患儿,他们观察到在受孕后年龄分别达到50周和56周时,呼吸暂停的发生率分别降至低于5%和低于1%。19
全身麻醉可能会揭示通气调节的异常,从而也会暴露出此前在既往早产儿甚至足月婴儿中未曾注意到的呼吸暂停倾向。全身麻醉会降低肌张力,导致上气道阻塞,从而促成呼吸暂停;因此,合理推断脊髓麻醉会降低呼吸暂停的风险。Davidson 等 同样发现,早产是呼吸暂停的最强预测因素。他们观察到,与全身麻醉相比,清醒脊髓麻醉在前30分钟内的呼吸暂停事件减少,血氧饱和度下降的程度降低,且应对呼吸暂停发作所需的干预水平也较低。他们未发现迟发性呼吸暂停(麻醉后30分钟至12小时内出现的呼吸暂停)的发生率存在差异。尽管如此,他们的试验并未纳入极早产儿(胎龄小于26周)或合并有显著合并症的婴儿。在这些人群中,脊髓麻醉对呼吸暂停的益处可能会有所不同。45
鉴于上述情况,接受需要麻醉(镇静、脊髓麻醉和全身麻醉)的操作的婴儿应入院观察。麻醉后应至少观察23小时,并应行持续脉搏血氧监测。各机构的收住院要求有所不同。本机构出于保守考虑,规定对有早产史(出生时胎龄 < 37 周)且受孕后年龄小于60周的婴儿,麻醉后需收住院观察。对于其他健康的足月婴儿,受孕后年龄超过44周者,麻醉后不需住院。合并有重要共病的儿童应逐例评估。
意外并发症
家长应始终为可能的入院做好准备,尤其是受孕后周龄小于60周的患儿。此外,近期或目前有轻度呼吸道症状的患儿由于气道高反应性,可能需要入院。
儿科麻醉与神经毒性的最新进展
关于麻醉在发育中大脑中诱发神经毒性的担忧仍在持续。我们如何在麻醉相关的潜在风险与手术干预的最佳时机之间取得平衡?在动物模型中,包括非人灵长类,暴露于常用的全身麻醉药(如卤代挥发性麻醉剂、丙泊酚和氯胺酮)会导致一系列形态学和功能学改变。研究发现,暴露的动物出现神经元细胞凋亡、胶质细胞死亡、神经发生受损以及异常的轴突形成。在部分个体中,婴幼期的暴露与行为改变以及学习和记忆形成受损相关,并可持续至成年早期。这种暴露效应似乎呈剂量、暴露时长及性别依赖性。与雌性同类相比,雄性啮齿动物即使在神经元细胞死亡程度相当的情况下,仍表现出情境学习和记忆受损。46然而,将动物模型的结果外推至人类存在困难,因为这些研究所用的剂量显著高于人类临床通常使用的剂量。47
来自队列研究和回顾性研究的证据不一,显示暴露于麻醉的幼儿发生不良神经发育结局的风险增加。一些研究提示,多次暴露与行为发育障碍的风险增加相关,但单次暴露则不然。DiMaggio et al 对2008年至2012年发表的选定研究进行了荟萃分析,并得出结论:结果提示风险虽幅度不大但升高。48
O’Leary et al 在加拿大安大略省开展了一项基于人群的队列研究,方法是将省级卫生行政数据库与采用早期发展评估工具(EDI)测量的儿童发育结局相链接。完成EDI之前(5至6岁)接受手术的儿童与未接受手术的儿童进行匹配。主要结局为早期发育脆弱性,定义为EDI任一领域处于人群的最低十分位(最低10%)。根据首次手术年龄(<2岁与≥2岁)以及手术次数进行了亚组分析。作者得出结论:在小学入学前接受手术的儿童发生早期发育脆弱性的风险增加,但暴露组与未暴露组之间差异的幅度较小。首次暴露年龄<2岁以及多次手术暴露并非不良发育结局的危险因素。49
澳大利亚的一项基于人群的研究同样发现,在无已知既存神经发育障碍的儿童中,4岁之前接受过全身麻醉者在三年级的阅读和计算(数学)成绩较低,并且在入学时更可能被认为属于发育高风险(在两个或更多领域的得分处于第10th 百分位及以下)。当分析仅限于一次全身麻醉和一次住院时,他们观察到与发育不良和阅读成绩差之间的关联减弱,但计算能力方面的不良结局仍然存在。与 O’Leary et al., 相反,他们确实发现暴露次数与不良发育结局之间存在关联。50
PANDA 研究是一项同胞匹配的队列研究,比较了105名在36个月龄前为腹股沟疝修补术而接受全身麻醉的儿童与其未暴露同胞的神经发育结局。神经心理学测试在8-15岁时进行。他们的数据表明,在36个月龄前单次麻醉暴露的健康儿童与其未暴露的健康同胞之间的 IQ 分数无统计学显著差异。51 同样,MASK 队列研究也未发现3岁前单次麻醉暴露的儿童与未接受麻醉暴露的儿童之间测试成绩存在差异的证据。然而,该研究确实发现,多次麻醉者在处理速度和精细运动方面出现缺陷的风险增加。多次暴露组家长报告与执行功能、行为和阅读相关的问题增多。52
全身麻醉与脊髓麻醉比较研究,或 “GAS 研究”,是一项国际、前瞻性、多中心、随机、对照试验,旨在评估在受孕后年龄小于60周时接受疝修补术患儿于2岁和5岁时的神经发育结局。婴儿按研究中心和出生时胎龄分层,并以1:1随机分配接受清醒状态的区域麻醉或以七氟烷为主的全身麻醉。若存在既有的神经损伤危险因素则予以排除。结果显示,婴儿期不到1小时的七氟烷全身麻醉暴露并未增加2岁时不良神经发育结局的风险。53 该试验同样显示,在以男性为主的研究人群中,5岁时测得的韦氏学前和小学智力量表第三版(WPPSI-III)全量表智商得分存在等效性的证据。54
根据现有数据,我们可以让自己和家长放心:在其他方面健康的年幼儿童中,单次、短时的全身麻醉暴露不会导致更差的神经认知发育。尽管如此,全身麻醉并非完全无害的过程。有证据表明反复暴露可能带来不良影响,但关于长时间暴露和易感亚群体的数据仍然有限。大多数动物研究发现,较长时间的暴露(≥3小时;非人灵长类≥5小时)更可能引起神经毒性。然而,我们并不清楚动物暴露时间与人类的等效关系。55 此外,我们尚不清楚哪种情况更糟:多次短时暴露还是一次长时间暴露。即便如此,我们仍不知道从何种年龄起,全身麻醉不再对儿童的神经认知发育构成威胁。对于合适的患儿和手术,采用椎管内麻醉以减少潜在的全身麻醉暴露次数可能是明智之举。如果必须进行全身麻醉,联合区域麻醉与全身麻醉的技术有助于减少为维持该手术良好麻醉水平所需的静脉和吸入麻醉药用量。
结论
儿科麻醉具有挑战性,因为我们面对的患者不仅存在不同的合并症,还处于不同的神经认知发育阶段。我们才刚开始了解麻醉药物对神经炎症、围手术期应激和神经发育的影响。目前,有证据表明,在健康的年幼患儿中,短时间的单次全身麻醉暴露不会导致不良的神经认知结局。对于需要长时间手术和多次操作的患者,其不良结局究竟是由麻醉药物本身、与手术诱发应激相关的改变所致,还是提示一种对神经毒性易感的表型标志,仍难以阐明。现实情况很可能是多因素所致。泌尿外科与麻醉团队就特定患者和病例需求进行良好的术前沟通,有助于实现最佳、个体化的患者照护。
要点
- 健康的年轻患者仅一次、短时间暴露于全身麻醉并不会增加发生神经认知发育缺陷的风险
- 骶管阻滞、硬膜外阻滞或躯干阻滞可为门诊泌尿外科手术提供安全且有效的镇痛
- 在疼痛性手术后需要较长期住院的患者,可能获益于置入骶管或硬膜外导管以提供更长期镇痛
- 腹腔镜和机器人手术会引发生理改变,麻醉团队通常可部分加以缓解
- 若为择期手术,患病儿童应改期;如症状轻微,可逐例评估
- 有术后呼吸暂停风险的儿童应收入院观察
- 泌尿外科与麻醉团队就特定患者与病例需求进行良好的术前沟通,可实现最佳的个体化患者照护
参考文献
- Davis PJ, Cladis F. Smith’s Anesthesia for Infants and Children. 2017; 9. DOI: 10.1213/00000539-199009000-00032.
- Sola C, Lefauconnier A, Bringuier S, Raux O, Capdevila X, Dadure C. Childhood preoperative anxiolysis: Is sedation and distraction better than either alone? A prospective randomized study. Paediatr Anaesth 2017; 27 (8): 827–834. DOI: 10.1111/pan.13180.
- Auerbach M, Tunik M, Mojica M. A Randomized, Double-blind Controlled Study of Jet Lidocaine Compared to Jet Placebo for Pain Relief in Children Undergoing Needle Insertion in the Emergency Department. Acad Emerg Med 2009; 16 (5): 388–393. DOI: 10.1111/j.1553-2712.2009.00401.x.
- Disease Control C for, Prevention. Chickenpox (Varicella). 2021. DOI: 10.1016/b978-1-4831-8407-4.50023-7.
- Kimberlin DW, Barnett ED, Lynfield R, Sawyer MH. Red book: report of the Committee on Infectious Diseases. vol. 2021, American Academy of Pediatrics; , DOI: 10.1111/j.1651-2227.2009.01642.x.
- Disease Control C for, Prevention. Hand, Foot, and Mouth Disease (HFMD). 2021. DOI: 10.3329/bjch.v40i2.31567.
- Mallory MD, Travers C, McCracken CE, Hertzog J, Cravero JP. Upper Respiratory Infections and Airway Adverse Events in Pediatric Procedural Sedation. Pediatrics 2017; 140 (1). DOI: 10.1542/peds.2017-0009.
- Lee LK, Bernardo MKL, Grogan TR, Elashoff DA, Ren WHP. Perioperative respiratory adverse event risk assessment in children with upper respiratory tract infection: Validation of the COLDS score. Paediatr Anaesth 2018; 28 (11): 1007–1014. DOI: 10.1111/pan.13491.
- Lema GF, Berhe YW, Gebrezgi AH, Getu AA. Evidence-based perioperative management of a child with upper respiratory tract infections (URTIs) undergoing elective surgery; A systematic review. Int J Surg Open 2018; 12: 17–24. DOI: 10.1016/j.ijso.2018.05.002.
- Saynhalath R, Alex G, Efune PN, Szmuk P, Zhu H, Sanford EL. Anesthetic Complications Associated With Severe Acute Respiratory Syndrome Coronavirus 2 in Pediatric Patients. Anesth Analg 2021; 133 (2): 483–490. DOI: 10.1213/ane.0000000000005606.
- Woods BD, Sladen RN. Perioperative considerations for the patient with asthma and bronchospasm. Br J Anaesth 2009; 103: i57–i65. DOI: 10.1093/bja/aep271.
- Dones F, Foresta G, Russotto V. Update on Perioperative Management of the Child with Asthma. Pediatr Rep 2012; 4 (2): e19. DOI: 10.4081/pr.2012.e19.
- Aronson S, Murray S, Martin G, Blitz J, Crittenden T, Lipkin ME, et al.. Roadmap for Transforming Preoperative Assessment to Preoperative Optimization. Anesth Analg 2020; 130 (4): 811–819. DOI: 10.1213/ane.0000000000004571.
- Shah NN, Vetter TR. Comprehensive Preoperative Assessment and Global Optimization. Anesthesiol Clin 2018; 36 (2): 259–280. DOI: 10.1016/j.anclin.2018.01.006.
- Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures. Anesthesiology 2017; 90 (3): 896–905. DOI: 10.1097/00000542-199903000-00034.
- Dobson G, Chow L, Flexman A. Practice Guidelines for Ophthalmic Anesthesia. Practice Guidelines in Anesthesia-2 2019; 6 (1): 175–175. DOI: 10.5005/jp/books/14207_19.
- Smith I, Kranke P, Murat I, Smith A, OʼSullivan G, Sreide E, et al.. Perioperative fasting in adults and children. Eur J Anaesthesiol 2011; 28 (8): 556–569. DOI: 10.1097/eja.0b013e3283495ba1.
- Dadure C, Sola C, Capdevila X. Preoperative nutrition through a prehabilitation program: A key component of transfusion limitation in paediatric scoliosis surgery. Anaesth Crit Care Pain Med 2015; 34 (6): 311–312. DOI: 10.1016/j.accpm.2015.12.004.
- Cote CJ, Zaslavsky A, Downes JJ, Kurth CD, Welborn LG, Warner LO, et al.. Postoperative Apnea in Former Preterm Infants After Inguinal Herniorrhaphy. Survey of Anesthesiology 1995; 40 (3): 163. DOI: 10.1097/00132586-199606000-00031.
- Polaner DM, Taenzer AH, Walker BJ. Faculty Opinions recommendation of Pediatric Regional Anesthesia Network (PRAN): a multi-institutional study of the use and incidence of complications of pediatric regional anesthesia. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2012; 15 (6): 353–1364. DOI: 10.3410/f.717968230.793467936.
- Sheth KR, Batavia JP, Bowen DK, Koh CJ, Srinivasan AK. Complications in Pediatric Urology Minimally Invasive Surgery. Minimally Invasive and Robotic-Assisted Surgery in Pediatric Urology 2018; 5 (4): 381–404. DOI: 10.1007/978-3-030-57219-8_26.
- Joris JL. Anesthesia for Laparoscopic Surgery. Miller’s Anesthesia. Churchill Livingstone, Philadelphia, 2185-2202. 2010.
- Cyna AM, Middleton P. Caudal epidural block versus other methods of postoperative pain relief for circumcision in boys. Cochrane Database Syst Rev 2008; 2008 (4). DOI: 10.1002/14651858.cd003005.pub2.
- Wiegele M, Marhofer P, Lönnqvist P-A. Caudal epidural blocks in paediatric patients: a review and practical considerations. Br J Anaesth 2019; 122 (4): 509–517. DOI: 10.1016/j.bja.2018.11.030.
- Fukazawa K, Matsuki Y, Ueno H, Hosokawa T, Hirose M. Risk factors related to accidental intravascular injection during caudal anesthesia. J Anesth 2014; 28 (6): 940–943. DOI: 10.1007/s00540-014-1840-8.
- Kundra P, Yuvaraj K, Agrawal K, Krishnappa S, Kumar LT. Surgical outcome in children undergoing hypospadias repair under caudal epidural vs penile block. Paediatr Anaesth 2012; 22 (7): 707–712. DOI: 10.1111/j.1460-9592.2011.03702.x.
- Yildiz T, Tahtali IN, Ates DC, Keles I, Ilce Z. Age of patient is a risk factor for urethrocutaneous fistula in hypospadias surgery. J Pediatr Urol 2013; 9 (6): 900–903. DOI: 10.1016/j.jpurol.2012.12.007.
- Zhang J, Zhu S, Zhang L, Fu W, Hu J, Zhang Z, et al.. The association between caudal block and urethroplasty complications of distal tubularized incised plate repair: experience from a South China National Children’s Medical Center. Transl Androl Urol 2021; 10 (5): 2084–2090. DOI: 10.21037/tau-21-355.
- Taicher BM, Routh JC, Eck JB, Ross SS, Wiener JS, Ross AK. The association between caudal anesthesia and increased risk of postoperative surgical complications in boys undergoing hypospadias repair: Comment on data sparsity. Paediatr Anaesth 2017; 27 (9): 974–974. DOI: 10.1111/pan.13207.
- Zaidi RH, Casanova NF, Haydar B, Voepel-Lewis T, Wan JH. Urethrocutaneous fistula following hypospadias repair: regional anesthesia and other factors. Paediatr Anaesth 2015; 25 (11): 1144–1150. DOI: 10.1111/pan.12719.
- Braga LH, Jegatheeswaran K, McGrath M, Easterbrook B, Rickard M, DeMaria J, et al.. Cause and Effect versus Confounding–Is There a True Association between Caudal Blocks and Tubularized Incised Plate Repair Complications? J Urol 2017; 197 (3 Part 2): 845–851. DOI: 10.1016/j.juro.2016.08.110.
- Zhu C, Wei R, Tong Y, Liu J, Song Z, Zhang S. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Ngoo A, Borzi P, McBride CA, Patel B. Penile nerve block predicts higher revision surgery rate following distal hypospadias repair when compared with caudal epidural block: A consecutive cohort study. J Pediatr Urol 2020; 16 (4): 439.e1–439.e6. DOI: 10.1016/j.jpurol.2020.05.150.
- Goyal S, Sharma A, Goswami D, Kothari N, Goyal A, Vyas V, et al.. Clonidine and Morphine as Adjuvants for Caudal Anaesthesia in Children: A Systematic Review and Meta-Analysis of Randomised Controlled Trials. Turk J Anaesthesiol Reanim 2020; 48 (4): 265–272. DOI: 10.5152/tjar.2020.29863.
- Wang X-xue, Dai J, Dai L, Guo H-jing, Zhou A-guo, Pan D-bo. Caudal dexmedetomidine in pediatric caudal anesthesia. Medicine (Baltimore) 2020; 99 (31): e21397. DOI: 10.1097/md.0000000000021397.
- Rowe E, Cooper TE, McNicol ED. Ketorolac for postoperative pain in children. Cochrane Database Syst Rev 2018; 7:cd012294. DOI: 10.1002/14651858.cd012294.
- Aldrink JH, Ma M, Wang W, Caniano DA, Wispe J, Puthoff T. Safety of ketorolac in surgical neonates and infants 0 to 3 months old. J Pediatr Surg 2011; 46 (6): 1081–1085. DOI: 10.1016/j.jpedsurg.2011.03.031.
- Stone SB. Ketorolac in Postoperative Neonates and Infants: A Systematic Review. J Pediatr Pharmacol Ther 2021; 26 (3): 240–247. DOI: 10.5863/1551-6776-26.3.240.
- Anesthesia BBP. Non-Opioid Analgesic Agents. People’s Medical Publishing House; 2011, DOI: 10.1016/j.mpaic.2007.11.012.
- Drugs C on. Acetaminophen Toxicity in Children. Pediatrics 2001; 108 (4): 1020–1024. DOI: 10.1542/peds.108.4.1020.
- Chandrakantan A. Postoperative Nausea and Vomiting in Children. Case Studies in Pediatric Anesthesia 2014; 7 (3): 24–25. DOI: 10.1017/9781108668736.006.
- Urits I, Orhurhu V, Jones MR. Postoperative nausea and vomiting in paediatric strabismus surgery. Br J Anaesth 2020; 105 (4): 550–551. DOI: 10.1093/bja/aeq219.
- Gan TJ, Diemunsch P, Habib AS, Kovac A, Kranke P, Meyer TA, et al.. Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg 2014; 118 (1): 85–113. DOI: 10.1213/ane.0000000000000002.
- Eberhart LHJ, Geldner G, Kranke P. Development and validation of a risk score to predict the probability of postoperative vomiting in pediatric patients: the VPOP score. Paediatr Anaesth 2004; 25 (3): 330–330. DOI: 10.1111/pan.12596.
- Davidson AJ, Morton NS, Arnup SJ. Faculty Opinions recommendation of Apnea after Awake Regional and General Anesthesia in Infants: The General Anesthesia Compared to Spinal Anesthesia Study–Comparing Apnea and Neurodevelopmental Outcomes, a Randomized Controlled Trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2015; 23 (1): 8–54. DOI: 10.3410/f.725508900.793507986.
- Lee BH, Chan JT, Kraeva E, Peterson K, Sall JW. Isoflurane exposure in newborn rats induces long-term cognitive dysfunction in males but not females. Neuropharmacology 2014; 83: 9–17. DOI: 10.1016/j.neuropharm.2014.03.011.
- Vutskits L, Xie Z. Lasting impact of general anaesthesia on the brain: mechanisms and relevance. Nat Rev Neurosci 2016; 17 (11): 705–717. DOI: 10.1038/nrn.2016.128.
- DiMaggio C, Sun LS, Ing C, Li G. Pediatric Anesthesia and Neurodevelopmental Impairments. J Neurosurg Anesthesiol 2012; 24 (4): 376–381. DOI: 10.1097/ana.0b013e31826a038d.
- O’Leary JD, Janus M, Duku E, Wijeysundera DN, To T, Li P, et al.. A Population-based Study Evaluating the Association Between Surgery in Early Life and Child Development at Primary School Entry. Obstetric Anesthesia Digest 2016; 37 (2): 78–79. DOI: 10.1097/01.aoa.0000515748.52953.0b.
- Schneuer FJ, Bentley JP, Davidson AJ, Holland AJA, Badawi N, Martin AJ, et al.. The impact of general anesthesia on child development and school performance: a population-based study. Paediatr Anaesth 2018; 28 (6): 528–536. DOI: 10.1111/pan.13390.
- Sun LS, Li G, Miller TLK, Salorio C, Byrne MW, Bellinger DC, et al.. Association Between a Single General Anesthesia Exposure Before Age 36 Months and Neurocognitive Outcomes in Later Childhood. Jama 2016; 315 (21): 2312. DOI: 10.1001/jama.2016.6967.
- Warner DO, Zaccariello MJ, Katusic SK. Faculty Opinions recommendation of Neuropsychological and Behavioral Outcomes after Exposure of Young Children to Procedures Requiring General Anesthesia: The Mayo Anesthesia Safety in Kids (MASK) Study. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2018; 29 (1): 9–105. DOI: 10.3410/f.733078932.793559248.
- Davidson AJ, Disma N, Graaff JC de, Withington DE, Dorris L, Bell G, et al.. Neurodevelopmental outcome at 2 years of age after general anaesthesia and awake-regional anaesthesia in infancy (GAS): an international multicentre, randomised controlled trial. Lancet 2016; 387 (10015): 239–250. DOI: 10.1016/s0140-6736(15)00608-x.
- McCann ME, Graaff JC, Dorris L. Faculty Opinions recommendation of Neurodevelopmental outcome at 5 years of age after general anaesthesia or awake-regional anaesthesia in infancy (GAS): an international, multicentre, randomised, controlled equivalence trial. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2019; 93 (10172): 64–677. DOI: 10.3410/f.735131691.793559701.
- Creeley C, Dikranian K, Dissen G, Martin L, Olney J, Brambrink A. Propofol-induced apoptosis of neurones and oligodendrocytes in fetal and neonatal rhesus macaque brain. Br J Anaesth 2013; 110: i29–i38. DOI: 10.1093/bja/aet173.
最近更新时间: 2025-09-22 08:00