44: Tumores Testiculares e Paratesticulares em Crianças
Este capítulo levará aproximadamente 22 minutos para ler.
Introdução
Os tumores testiculares e paratesticulares são incomuns em crianças. Podem ser primários ou secundários, benignos ou malignos. Este capítulo apresenta uma visão geral do espectro de lesões encontradas clinicamente em crianças. As lesões intratesticulares são consideradas, por relevância clínica, em dois grupos etários pediátricos:
- A criança pré-púbere
- O adolescente e o adulto jovem (AYA)
Em ambos esses grupos etários, os tumores testiculares apresentam características próprias a serem consideradas, com impacto no manejo e nos desfechos. A cirurgia poupadora do testículo (TSS) pode ser planejada para a maioria das lesões testiculares benignas pré-puberais; ao passo que a maioria dos tumores AYA é suspeita de malignidade desde o início, e a orquiectomia radical é o tratamento cirúrgico padrão para malignidade intratesticular ou paratesticular primária.
Embriologia
O testículo fetal desenvolve-se a partir da gônada mesodérmica indiferenciada após 6 semanas. Em um feto masculino, o ducto de Müller regride em resposta ao AMH secretado pelo testículo em desenvolvimento. O sistema wolffiano desenvolve-se em resposta à testosterona secretada pelo testículo em desenvolvimento. As células de Leydig produtoras de testosterona originam-se do mesoderma gonadal e são encontradas no interstício do testículo maduro. Os cordões sexuais estromais mesodérmicos desenvolvem-se em túbulos seminíferos e células epiteliais de suporte dão origem às células de Sertoli. As células somáticas do testículo derivam do mesoderma da crista gonadal, mas as células germinativas primordiais originam-se do epiblasto/saco vitelino após cerca de 8 dias de desenvolvimento embrionário, e migram para a crista gonadal, estabelecendo-se em estreita proximidade com o mesoderma gonadal.1
Esta derivação de células de diferentes origens embriológicas no testículo em desenvolvimento subjaz à miríade de possíveis tumores, com comportamentos distintos, que podem apresentar-se no testículo pediátrico.
Epidemiologia
Os tumores testiculares em crianças representam 1-2% de todos os tumores pediátricos sólidos.2 A incidência é estimada em 0,5-2 por 100.000 crianças.3 No grupo etário pediátrico, há um pico de incidência na adolescência, com um pico menor em crianças com menos de 3 anos de idade.4
Agora está muito claro que a maioria dos tumores intratesticulares em crianças na fase pré-puberal é benigna. 60-70% dos tumores intratesticulares pré-puberais são relatados como benignos.5,6 75% dos tumores intratesticulares em AYA pós-puberais são malignos.7 O tumor benigno mais comum na faixa etária pré-puberal é o teratoma, apresentando-se com idade mediana de 13 meses.8 Os tumores do saco vitelino são o tumor testicular maligno mais comum na faixa etária pré-puberal, com idade mediana de apresentação em torno de 16 meses.9 Esses dois tumores de origem de células germinativas compõem uma grande proporção do pico inicial de incidência de tumores testiculares em menores de 3 anos.
Os tumores de células germinativas mistos constituem a neoplasia maligna testicular mais comum no grupo AYA.10 O seminoma puro é raro em AYA. Ao contrário das crianças pré-púberes, que predominantemente apresentam tumores do saco vitelino puros, os tumores de células germinativas em AYA são não seminomatosos e geralmente de histologia mista, incluindo o carcinoma embrionário como o subtipo histológico mais comum.10 O teratoma que se apresenta em AYA é geralmente maligno, ao contrário do que ocorre em crianças pré-púberes.7
Patogênese e Visão Geral dos Tipos de Tumores Testiculares e Paratesticulares em Crianças
Os tumores testiculares primários podem originar-se de células germinativas (Tumores de células germinativas, GCTs) ou de células estromais (Tumores dos cordões sexuais/estromais) do testículo. Os GCTs são muito mais comuns do que os tumores estromais .
GCTs são classificados de acordo com a classificação de 2016 da Organização Mundial da Saúde - ou derivados de neoplasia de células germinativas in situ (derivados de GCNIS), que são principalmente pós-puberais na apresentação; ou não derivados de neoplasia de células germinativas in situ (não derivados de GCNIS), que se apresentam principalmente no período pré-puberal.11
O grupo de TCGs não derivadas de GCNIS inclui tumores do saco vitelino pré-puberais, teratoma do tipo pré-puberal incluindo cistos dermoides e epidermoides, e tumor espermatocítico (que ocorre principalmente em adultos). Carcinoma in situ ou neoplasia intratubular de células germinativas é quase inexistente na faixa etária pré-puberal, ao contrário do que ocorre em AYA e em adultos mais velhos.12,13
O grupo de GCTs derivados de GCNIS inclui teratoma do tipo pós-puberal, tumor do saco vitelino, carcinoma embrionário, tumores trofoblásticos incluindo coriocarcinoma, todos os quais podem se apresentar no grupo AYA; e seminoma, que é mais comum em adultos mais velhos.
Os tumores testiculares dos cordões sexuais e do estroma são raros em crianças. Os tumores de células de Leydig são quase sempre benignos em crianças pré-púberes.14,15 Os tumores juvenis de células da granulosa são geralmente benignos no grupo pré-púbere.16 Os tumores de células de Sertoli são em sua maioria benignos, mas podem ser malignos em cerca de 10%, especialmente em crianças mais velhas.17 Os tumores de células de Sertoli podem estar associados a síndromes como a síndrome de Carney e a síndrome de Peutz-Jeghers.
O gonadoblastoma é uma neoplasia maligna singular da gônada na infância. As células do gonadoblastoma englobam tanto células estromais quanto células germinativas da gônada. O gonadoblastoma quase sempre se apresenta no contexto de diferenças ou variações do desenvolvimento sexual.18
Anomalias raras do desenvolvimento do testículo, como a displasia da rete testis, podem apresentar-se como uma massa do testículo pré-púbere. A displasia da rete testis está quase sempre associada à agenesia renal ipsilateral.19 Cistos testiculares simples e cistos epididimários também podem manifestar-se na infância como massas testiculares ou escrotais.
Os tumores paratesticulares na infância podem ser benignos ou malignos. Os tumores paratesticulares benignos são raros e incluem lesões como hemangioma, leiomioma e lipoma.2 Os tumores paratesticulares malignos incluem o rabdomiossarcoma, que é a neoplasia maligna paratesticular mais comum em crianças.2 e o raro tumor neuroectodérmico melanótico da infância, que é em sua maioria benigno, mas pode apresentar comportamento maligno.20
Deve lembrar-se de que, na infância, o testículo é um sítio frequente de neoplasia maligna metastática ou infiltrativa, como leucemia ou linfoma metastáticos.7
Embora a criptorquidia seja um fator de risco conhecido para malignidade testicular, a maioria dos tumores testiculares infantis relatados não está associada à criptorquidia. A criptorquidia está associada a um aumento do risco de malignidade pós-puberal, bilateralmente, de 2 a 5 vezes em relação à população geral.21 Esse risco parece ser reduzido pela orquidopexia realizada precocemente na infância.22 O tipo de malignidade que ocorre mais frequentemente na criptorquidia não corrigida ou operada tardiamente é o seminoma.23
Microlitíase testicular, geralmente detectada incidentalmente em ultrassonografia em crianças, não foi demonstrada estar associada a um risco aumentado de tumores testiculares na infância . A microlitíase testicular pode estar associada a um aumento do risco de malignidade testicular na vida adulta, especialmente se associada a outros fatores de risco, como a criptorquidia. Assim, recomenda-se o autoexame testicular pós-puberal para facilitar a detecção precoce.24
Avaliação e diagnóstico
O modo mais comum de apresentação de tumor testicular ou paratesticular é uma massa escrotal indolor, observada pela criança ou pelo cuidador. Por vezes, pode estar presente uma hidrocele reativa. A tumefação escrotal pode motivar avaliação e investigação e, ocasionalmente, a massa pode ser detetada incidentalmente após apresentação por traumatismo, ou numa ecografia (USS). Podem ser observadas poucas outras características clínicas distintivas quando se palpa um nódulo escrotal. No entanto, os tumores de células de Leydig podem estar associados a sinais de puberdade precoce, e 10% dos tumores de células de Sertoli também podem apresentar sinais de puberdade precoce.25
A ultrassonografia do escroto e do testículo é um exame inicial muito útil. Geralmente fornece uma indicação clara da localização e do tamanho da massa, se sólida ou cística, se difusa ou bem delimitada, se intratesticular ou paratesticular, sua vascularização e se é uni- ou multifocal. Algumas lesões pré-puberais apresentam características típicas na ultrassonografia, tais como as camadas em ‘casca de cebola’ de um cisto epidermoide (Figura 1), o aspecto lobulado do cisto dermoide (Figura 2) e o aspecto cístico característico da displasia da rete testis (Figura 3).26 Os teratomas podem apresentar um aspecto heterogêneo cístico/sólido (Figura 4). As lesões benignas tendem a apresentar baixa vascularização na ultrassonografia. As lesões malignas são geralmente hipoecoicas, sólidas e homogêneas na ultrassonografia.
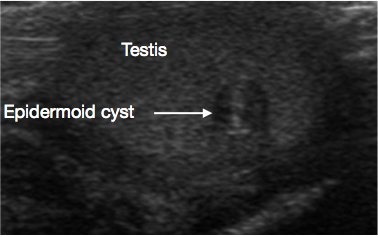
Figura 1 Ultrassonografia de cisto epidermoide testicular, aspecto em casca de cebola (Seta)
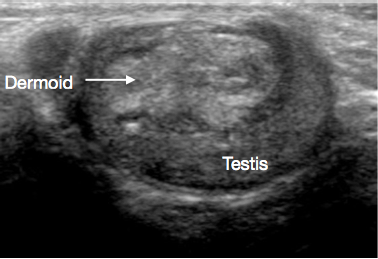
Figura 2 Ultrassonografia de cisto dermoide testicular, cisto lobulado preenchido por detritos
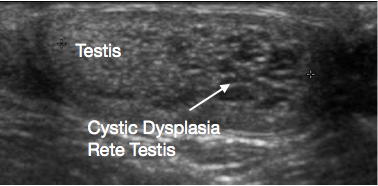
Figura 3 Ultrassonografia da displasia cística da rete testis; testículo à esquerda e displasia cística à direita da imagem
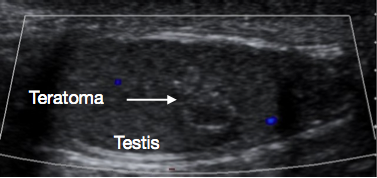
Figura 4 Ultrassonografia de teratoma testicular pré-puberal, aspecto heterogêneo
Marcadores tumorais séricos podem ser úteis para distinguir lesões benignas de malignas. Para tumores testiculares, a alfa-fetoproteína (AFP), a beta-gonadotrofina coriônica humana (BHCG) e a desidrogenase lática (LDH) são os marcadores mais comumente utilizados. A BHCG geralmente não é útil na avaliação de tumores pré-puberal, pois o coriocarcinoma e o carcinoma embrionário, que podem secretar BHCG, quase nunca são observados nessa faixa etária.7,27 No entanto, a BHCG é muito importante no grupo AYA pós-puberal, onde essas lesões podem ocorrer. A AFP é o marcador mais importante na faixa etária pré-puberal, pois está acentuadamente elevada em quase todos os tumores do saco vitelino, comumente observados nessa faixa etária.9 O teratoma pode apresentar AFP discretamente elevada, mas níveis de AFP acima de 100ng/mL não foram relatados em teratoma pré-puberal.9 Essa diferença acentuada nos níveis de AFP entre o teratoma benigno e o tumor maligno do saco vitelino também auxilia no planejamento para TSS versus orquiectomia radical. Deve-se observar, ao interpretar os níveis de AFP, que lactentes de até 8 meses de idade podem apresentar níveis séricos de AFP naturalmente elevados.28
As características clínicas, as características de imagem da lesão e os níveis séricos de marcadores tumorais ajudarão a orientar a conduta subsequente. Se houver suspeita de que a lesão seja maligna, seria importante realizar tomografia computadorizada (TC) de estadiamento do abdome/pelve e do tórax para avaliar a disseminação locorregional e metástases. 20% dos tumores do saco vitelino pré-puberais apresentam metástases pulmonares na apresentação.29
Uma lesão com características clínicas e de USS de um tumor benigno, e sem elevação nos níveis séricos de marcadores tumorais, geralmente não requer TC de estadiamento antes da ressecção.
Resumo dos tumores testiculares em crianças pré-púberes
Tabela 1 Tumores Testiculares e Paratesticulares na Infância
| Classificação | Tipo | Subtipo | Benigno | Predominantemente benigno, pode ser maligno | Maligno |
|---|---|---|---|---|---|
| Tumores testiculares/gonadais primários | Tumores testiculares pré-puberais | Tumor de células germinativas - não derivado de GCNIS | Teratoma pré-puberal | Tumor do saco vitelino | |
| Cisto epidermoide | |||||
| Cisto dermoide | |||||
| Tumores dos cordões sexuais/estromais | Tumor de células da granulosa juvenil | Tumor de células de Leydig | |||
| Tumor de células de Sertoli | |||||
| Anomalias do desenvolvimento e cistos simples | Displasia cística da rete testis | ||||
| Cisto testicular | |||||
| Cisto epididimário | |||||
| Tumores testiculares em adolescentes e adultos jovens (AYA) | Tumor de células germinativas - derivado de GCNIS | Teratoma pós-puberal | |||
| Carcinoma embrionário | |||||
| Tumor do saco vitelino | |||||
| Coriocarcinoma | |||||
| Tumores de células germinativas mistos | |||||
| Seminoma | |||||
| Tumor gonadal em Diferenças do Desenvolvimento Sexual (DSD) | Gonadoblastoma | ||||
| Metástases/infiltração testiculares secundárias | Leucemia, por exemplo, leucemia linfoblástica aguda | ||||
| Linfoma, por exemplo, linfoma de Burkitt | |||||
| Tumores paratesticulares | Hemangioma | Tumor neuroectodérmico melanótico da infância | Rabdomiossarcoma paratesticular | ||
| Leiomioma | |||||
| Lipoma | |||||
GCT=Tumor de células germinativas, GCNIS=Neoplasia de células germinativas in situ
Tumores Primários Testiculares/Gonadais
Tumores testiculares benignos de células germinativas (não derivados de GCNIS)
Teratoma
Estes são quase sempre benignos quando se apresentam no período pré-puberal.8 A idade mediana de apresentação é de 13 meses.2 Frequentemente apresentam um aspecto heterogêneo na ultrassonografia (Figura 4) porque os teratomas podem conter elementos de qualquer uma ou de todas as três camadas germinativas embrionárias - endoderma, mesoderma e ectoderma. Os teratomas geralmente contêm elementos maduros nessa faixa etária, com elementos imaturos ocasionalmente relatados. Mesmo na presença de elementos imaturos, o desfecho após TSS é geralmente bom nessa faixa etária.30 A TSS é geralmente viável para teratoma pré-puberal e, após excisão bem-sucedida e confirmação histológica de natureza benigna, geralmente não é necessário seguimento adicional.27
Cisto epidermoide
São cistos benignos de origem ectodérmica, revestidos por epitélio que produz queratina. O cisto apresenta um aspecto em camadas tipo ‘casca de cebola’ na ultrassonografia (USS) (Figura 1).11 São facilmente enucleados, portanto a TSS é o padrão de tratamento. A vigilância de rotina a longo prazo não é necessária após a excisão, mas recorrência rara é relatada.26
Cisto dermoide
Cistos dermoides compreendem elementos do tipo cutâneo, incluindo anexos como folículos pilosos e glândulas sebáceas. São benignos. Os achados de USS frequentemente mostram lesões císticas de parede espessa, com contornos lisos, com detritos ecogênicos avasculares (Figura 2).31,32 TSS é o padrão de tratamento, e o seguimento rotineiro após a excisão geralmente não é necessário.27
Tumores malignos de células germinativas testiculares (não derivados de GCNIS)
Tumor de células do saco vitelino
Esta é a neoplasia intratesticular maligna mais comum na criança pré-púbere. A idade habitual de apresentação é no pico precoce abaixo de 3 anos, com mediana de 16 meses de idade.9 Os tumores são geralmente sólidos e homogêneos, geralmente na USS. A AFP sérica está acentuadamente elevada. 80% dos tumores do saco vitelino pré-púberes são estágio 1 na apresentação.33 20% apresentam metástases pulmonares na apresentação.2 Se houver suspeita de tumor do saco vitelino, deve-se realizar TC de estadiamento de tórax, abdome e pelve e planejar orquiectomia radical. A dissecção radical de linfonodos (RLND) não é realizada rotineiramente para tumor do saco vitelino pré-púbere, pois a disseminação hematogênica sem disseminação locorregional é comum nesse tumor; algo que a RLND, com seu risco significativo de morbidade, não irá abordar.34
Para doença em Estádio 1 confirmada, com normalização da AFP sérica após a cirurgia, a quimioterapia geralmente não é necessária. As taxas de recidiva são de aproximadamente 20% . Assim, recomenda-se vigilância oncológica pós-cirúrgica regular com monitorização dos níveis de AFP, além de exames de imagem como ressonância magnética, e as taxas de sucesso do tratamento de resgate após a recidiva são excelentes.2,35 Para doença em estádio clínico 2 com acometimento linfonodal e doença metastática, a quimioterapia é indicada na maioria dos protocolos. A quimioterapia à base de platina é altamente eficaz para tumor do saco vitelino. A RLND é reservada para doença residual ou recorrente locorregional.2,33
Tumores dos cordões sexuais e do estroma testicular
Tumores de células da granulosa juvenis
Esses tumores geralmente benignos costumam ocorrer em lactentes e são os tumores testiculares neonatais mais comuns. Histologicamente, são compostos por lençóis de células semelhantes às da granulosa, frequentemente com alterações císticas.16,36 A TSS é geralmente bem-sucedida e curativa; não há relatos de recorrências e o acompanhamento de longo prazo após a excisão geralmente não é necessário.27
Tumores de células de Leydig
Em crianças, os tumores de células de Leydig são geralmente benignos, embora possam ser malignos em adultos. Os tumores de células de Leydig geralmente ocorrem em crianças por volta dos 5-10 anos de idade.14,15 A maioria apresenta-se como uma massa testicular indolor. No entanto, os tumores de células de Leydig podem manifestar-se com puberdade precoce devido à produção de testosterona . Além disso, 10-15% das crianças com tumores de células de Leydig podem apresentar sinais de feminização, como ginecomastia, devido à secreção de estradiol.2 O aspecto intraoperatório dos tumores de células de Leydig é o de nódulos amarelos homogéneos. Em crianças pré-púberes, recomenda-se TSS, pois os tumores de células de Leydig são quase sempre benignos nesse grupo etário. Se a puberdade precoce for uma característica associada, aconselha-se avaliação pela endocrinologia e seguimento. As alterações puberais não se revertem após a excisão do tumor, pois o eixo hormonal puberal foi ativado.2
Tumores de células de Sertoli
Apresentam-se em idade mediana precoce de 6 meses, embora possam ocorrer em qualquer idade pré-puberal. Um terço está associado a síndromes como Peutz-Jeghers ou síndrome de Carney. 10% apresentam alterações de puberdade precoce por serem hormonalmente ativos; ou até ginecomastia, devido à secreção tumoral de aromatase, resultando na conversão de androstenediona em estrona.37 São em sua maioria benignos, mas podem ser malignos em crianças mais velhas. Assim, uma TC de estadiamento pré-operatória seria prudente, especialmente em crianças com mais de 5 anos de idade. As diretrizes atuais recomendam considerar TSS para tumores de células de Sertoli em crianças.27
Anomalias do desenvolvimento e cistos
A displasia cística da rete testis é uma anomalia do desenvolvimento rara que se apresenta como uma massa testicular. Está quase sempre associada à agenesia renal ipsilateral. A ultrassonografia mostra que a lesão é cística, geralmente no polo superior do testículo, com compressão do tecido testicular normal adjacente (Figura 3). Tradicionalmente, recomendava-se TSS para a lesão. Têm sido relatadas taxas significativas de recorrência após TSS. Com a aparência característica na ultrassonografia e a anomalia renal ipsilateral associada, sua natureza benigna e os relatos crescentes de regressão da lesão ao longo do tempo, tem sido sugerido agora um manejo conservador poupador do testículo, com vigilância. Pode-se considerar biópsia da lesão, se houver alguma dúvida quanto ao diagnóstico antes do manejo conservador.38,39
Cistos epididimários simples e cistos intratesticulares podem ocorrer na infância. Ocasionalmente são sintomáticos. Geralmente são passíveis de enucleação ou de destelhamento se necessário.
Resumo dos Tumores Testiculares em AYA
Os tumores testiculares em AYA são geralmente malignos e, geralmente, GCTs, principalmente derivados de GCNIS. Os GCTs testiculares correspondem a 14% das neoplasias malignas em adolescentes e são o tumor sólido mais comum nesta faixa etária .
Histologicamente, na maioria, tendem a ser carcinomas embrionários, com componentes mistos de TCG não seminomatosos. Frequentemente apresentam-se com doença metastática e têm uma taxa de recidiva mais elevada. A avaliação de malignidades suspeitas inclui exames de imagem com ultrassonografia (USS), marcadores tumorais - AFP, BHCG e LDH, e TC de estadiamento do tórax, abdome e pelve.10 O teratoma pós-puberal também é derivado de GCNIS, ao contrário do seu homólogo pré-puberal. Metástases ocorrem em 22-37% dos teratomas em AYA.40 Também deve ser observado que tumores testiculares malignos em AYA podem não apresentar, necessariamente, elevação dos marcadores tumorais.41
O padrão de tratamento para uma suspeita de neoplasia maligna testicular em AYA é a orquiectomia radical por via inguinal. Para doença localizada, a orquiectomia radical é geralmente curativa. AYAs que apresentam doença em estádio clínico 1 após a orquiectomia geralmente são submetidos à vigilância ativa para detecção de recorrência; 20-30% terão recorrência clínica, e a sobrevida com quimioterapia de resgate é excelente.10 Essa abordagem conservadora limita o sobretratamento da maioria com doença em estádio clínico 1 e limita a exposição aos efeitos colaterais da quimioterapia à base de platina, ao direcionar o tratamento para aqueles que têm doença recorrente demonstrável. Tumores >4cm, invasão linfovascular e um componente crescente de carcinoma embrionário estão associados a um maior risco de doença metastática.42
Adolescentes e adultos jovens com doença em estádios clínicos II e III geralmente recebem quimioterapia. A RLND é utilizada seletivamente para aqueles com doença residual ou massa pós-quimioterapia, apesar de os marcadores tumorais estarem negativos, pois a lesão residual pode ser teratoma, geralmente menos responsiva à quimioterapia.10
Resumo dos Tumores Paratesticulares em Crianças
A TSS com excisão focal da lesão é geralmente considerada para lesões paratesticulares benignas raras, como lipoma.
O tumor neuroectodérmico melanótico da infância é um tumor raro que acomete a região epididimária e paratesticular.20 Geralmente é benigno, mas diferenciá-lo histologicamente de neoplasias malignas de pequenas células redondas azuis na biópsia pode ser um desafio. Sendo tipicamente benigno, a orquiectomia é geralmente curativa; porém, 10% podem apresentar comportamento maligno com recidiva e/ou metástases. Após a cirurgia, recomenda-se vigilância no seguimento com exames de imagem de secção transversal, como a ressonância magnética.2
O rabdomiossarcoma paratesticular é a neoplasia maligna paratesticular mais comumente encontrada na infância. Corresponde a 5% de todas as neoplasias malignas intraescrotais e a 40% de todas as neoplasias malignas paratesticulares.43 Há um pico bimodal de incidência, um no grupo AYA e outro em lactentes com menos de 6 meses de idade. O tumor origina-se dos elementos mesenquimatosos dos tecidos paratesticulares. A apresentação costuma ser com uma massa escrotal indolor, e uma proporção significativa apresenta doença metastática na apresentação. A ultrassonografia geralmente mostra uma lesão paratesticular sólida (Figura 5). É necessária TC de estadiamento de abdome, pelve e tórax para avaliar a disseminação locorregional e metastática. Os marcadores tumorais geralmente são negativos.
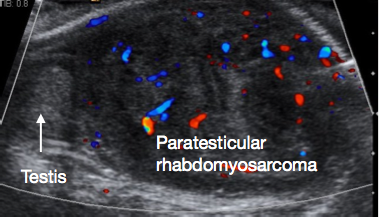
Figura 5 Ultrassonografia de rabdomiossarcoma paratesticular, testículo normal à esquerda da imagem, grande massa paratesticular à direita da imagem
Uma declaração de consenso do Children’s Oncology Group (COG), do European paediatric Soft tissue sarcoma Study Group (EpSSG) e da Cooperative Weichteilsarkom Studiengruppe (CWS) sobre o manejo cirúrgico do rabdomiossarcoma paratesticular foi recentemente publicada.44 A orquiectomia radical com ressecção em bloco do tumor, do testículo e do cordão espermático até o anel inguinal interno é o tratamento cirúrgico atualmente recomendado para o rabdomiossarcoma paratesticular. A abordagem escrotal para ressecção é contraindicada, pois dificulta a limpeza proximal ao nível do anel inguinal interno; a biópsia transescrotal também deve ser evitada, pois aumenta o risco de derrame tumoral.
A maioria dos rabdomiossarcomas paratesticulares na infância é histologicamente embrionária. Se a lesão for embrionária, então, para crianças com mais de 10 anos, recomenda-se a avaliação dos linfonodos retroperitoneais em qualquer estágio clínico; mas, para meninos com menos de 10 anos, a avaliação dos linfonodos retroperitoneais é realizada apenas se houver evidência de disseminação local ou linfonodos aumentados. Se houver linfonodos aumentados nos exames de imagem e não for realizada a avaliação linfonodal, a recomendação é tratar com quimioterapia como se os linfonodos estivessem acometidos.44
Para o rabdomiossarcoma histologicamente alveolar, recomenda-se a avaliação dos linfonodos retroperitoneais para todos os pacientes, independentemente dos achados de imagem. Se os linfonodos forem positivos, então quimioterapia e radioterapia estão indicadas.44
Os desfechos após o tratamento do rabdomiossarcoma paratesticular são melhores para o grupo pré-puberal do que para o grupo AYA. Há uma sobrevida livre de falha de 90% no grupo etário pré-puberal versus 63% em adolescentes.45
Metástases ou malignidade infiltrativa nos testículos na infância
Os testículos são um sítio comum de infiltração na leucemia e no linfoma - como leucemia linfoblástica aguda, linfoma folicular ou linfoma de Burkitt em crianças. A apresentação geralmente é de aumento testicular significativo, unilateral ou bilateral. Os achados da ultrassonografia frequentemente evidenciam um testículo aumentado, difusamente hipoecoico, com hipervascularidade.46
TSS e orquiectomia radical
As diretrizes clínicas agora recomendam fortemente a TSS para tumores testiculares pré-puberais com forte suspeita de benignidade na investigação diagnóstica.27 A TSS é realizada por via inguinal. O clampeamento atraumático dos vasos do cordão espermático antes da mobilização e dissecção testicular é considerado uma técnica oncológica padrão e permite minimizar o sangramento e otimizar a visualização da dissecção no órgão pré-puberal, geralmente pequeno. (Figura 6).
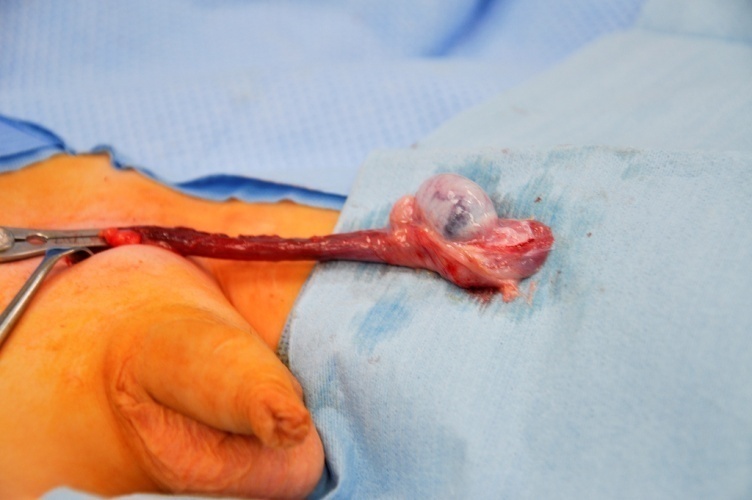
Figura 6 TSS - Pinça vascular atraumática no cordão espermático, tumor de células de Leydig no polo inferior do testículo
A avaliação intraoperatória por congelação é útil para ajudar a confirmar que a lesão é benigna e que as margens estão livres. Em muitos centros experientes, o exame por congelação atualmente não é realizado de rotina para lesões pré-puberais com marcadores tumorais negativos e características clínicas e ultrassonográficas benignas.41 Se houver dúvida ou suspeita de malignidade apesar das etapas da TSS, a TSS é abandonada e realiza-se orquidectomia radical. Se a TSS for realizada com sucesso, a túnica albugínea é fechada com sutura após a resseção da lesão, e o testículo é recolocado no escroto.
Em todas as crianças com suspeita clínica de malignidade testicular e paratesticular, deve ser realizado estadiamento pré-operatório para disseminação locorregional e metastática. O padrão de cuidado para lesões malignas é a orquiectomia radical, realizada por via inguinal e com clampeamento vascular antes da mobilização do testículo e da lesão. O cordão espermático deve ser ligado e ressecado ao nível do anel inguinal interno. Para lesões paratesticulares, o tumor deve ser ressecado em bloco com o testículo e o cordão espermático; se houver invasão da pele escrotal, a pele escrotal acometida também deve ser ressecada em bloco com a lesão.44
Estadiamento clínico de tumores malignos
O Children’s Oncology Group (COG) utiliza um sistema de estadiamento clínico em Estádios I–IV para malignidades testiculares em pré-púberes (Tabela 2). O Estádio I corresponde essencialmente a doença localizada ao testículo no momento da ressecção.
Tabela 2 Estadiamento do Children’s Oncology Group para Tumores Testiculares
| Estádio | Descrição |
|---|---|
| I | Limitada ao testículo, completamente ressecada por orquiectomia inguinal alta; sem evidência clínica, radiográfica ou histológica de doença além dos testículos |
| Pacientes com marcadores tumorais normais ou desconhecidos no diagnóstico devem ter uma RPLND ipsilateral negativa para confirmar doença em estádio I se a imagem demonstrar linfonodos >2 cm | |
| Pacientes que se submeteram a orquiectomia escrotal com ligadura alta do cordão são estádio I” | |
| II | “Biópsia transescrotal; doença microscópica no escroto ou alta no cordão espermático (<5 cm da extremidade proximal) |
| Falha dos marcadores tumorais em normalizar ou diminuir com uma meia-vida apropriada” | |
| III | Biópsia transescrotal; doença microscópica no escroto ou alta no cordão espermático (<5 cm da extremidade proximal) |
| Linfonodos >4 cm por TC ou 2–4 cm com comprovação por biópsia” | |
| IV | Metástases à distância, incluindo fígado |
| III | Comprometimento de linfonodos retroperitoneais, mas sem comprometimento visceral ou extra-abdominal |
O Comitê Americano Conjunto sobre Câncer (AJCC) geralmente utiliza o sistema Tumor (T), Linfonodos (N) e Metástases (M), com uma categoria S para marcadores tumorais pós-cirúrgicos (Tabela 3).
Tabela 3 Estadiamento AJCC
| T-Tumor primário | N-LNs regionais | M-Metástase à distância | S-Marcadores tumorais séricos |
|---|---|---|---|
| pT0 – nenhuma evidência de tumor primário | cN0 – sem metástase em LN regionais | M0 – sem metástase à distância | S0 – níveis dos marcadores dentro dos limites da normalidade |
| pTis – neoplasia de células germinativas intratubular (carcinoma in situ) | pN0 – sem metástase em LN regionais | M1 – metástase à distância | S1 - LDH < 1.5 X N e hCG (mIU/mL) <5000 e AFP (ng/mL) <1000 |
| pT1 – tumor limitado ao testículo e epidídimo sem LVI; o tumor pode invadir a túnica albugínea, mas não a túnica vaginal | cN1 – metástase com massa de LN≤ 2 cm ou múltiplos LNs, nenhum>2 cm | M1a – metástase nodal não regional ou pulmonar | S2 LDH 1.5–10 X N ou hCG (mIU/mL) 5000–50,000 ou AFP (ng/mL) 1000–10,000 |
| pT2 – tumor limitado ao testículo e epidídimo com LVI, ou tumor que se estende através da túnica albugínea com envolvimento da túnica vaginal | pN1 – metástase com massa de LN≤2 cm e ≤5 LNs positivos, nenhum >2 cm | M1b – metástase à distância diferente de LNs não regionais e pulmão | S3 LDH >10 x N ou hCG (mIU/mL) >50,000 ou AFP (ng/mL) >10,000 |
| pT3 – tumor invade o cordão espermático com ou sem LVI | cN2 – metástase com massa de LN 2–5 cm ou múltiplos LNs, qualquer um>2 cm mas não >5 cm | ||
| pT4 –tumor invade o escroto com ou sem LVI | pN2 – metástase com massa de LN 2–5 cm, ou >5 LNs positivos, nenhum >5 cm, ou evidência de extensão tumoral extranodal | ||
| cN3 – metástase com massa de LN >5 cm | |||
| pN3 – metástase com massa de LN>5 cm |
AFP: alfa-fetoproteína; hCG : gonadotrofina coriônica humana beta; LDH: desidrogenase do lactato; LN: linfonodo; LVI: invasão linfovascular; N: normal; c: clínico; p: patológico; T: tumor primário; N: linfonodos regionais; M: metástase; S: marcadores tumorais séricos.
Os agora substituídos Estudos Intergrupais de Rabdomiossarcoma (IRS) estabeleceram tanto um sistema de ‘agrupamento’ baseado na ressecabilidade cirúrgica quanto um sistema de estadiamento TNM modificado pelo IRS para rabdomiossarcoma paratesticular.
Complicações do Tratamento
Tanto a TSS quanto a orquidectomia radical são procedimentos associados a uma boa recuperação, com pequenos riscos associados de hemorragia com hematoma escrotal, infecção e recidiva da lesão. A atrofia testicular é rara após a TSS.41
Nos últimos anos, o foco da abordagem dos tumores testiculares e paratesticulares pediátricos tem sido reduzir os riscos e os efeitos negativos a longo prazo da quimioterapia e da radioterapia, por meio da estratificação do risco tumoral, oferecendo tratamento adicional apenas às crianças que preencham os critérios exigidos. Atualmente, à maioria das crianças com doença em estádio I será proposta vigilância ativa após a ressecção do tumor, e apenas aquelas com doença recorrente demonstrada necessitarão de quimioterapia.
Efeitos colaterais da quimioterapia, tais como nefrotoxicidade da cisplatina e neuropatia periférica, e fibrose pulmonar após bleomicina, são bem documentados.
Os efeitos negativos a longo prazo da quimioterapia e da radioterapia incluem comprometimento da fertilidade e malignidades secundárias.
Seguimento e vigilância sugeridos após o tratamento
Lesões benignas confirmadas com margens livres, como o teratoma pré-púbere, geralmente não necessitam de acompanhamento de rotina a longo prazo após TSS. No entanto, diretrizes clínicas sugerem seguimento pós-cirúrgico inicial com ultrassonografia a cada 3-6 meses durante o primeiro ano pós-operatório.27
Todas as crianças com neoplasia maligna testicular e paratesticular necessitam de seguimento e vigilância apropriados por alguns anos, de acordo com os protocolos oncológicos. Isso visa manter vigilância ativa para recidiva da doença e monitorar os efeitos a longo prazo após a cirurgia e o tratamento com quimioterapia e /ou radioterapia.
Pontos-chave
- A maioria dos tumores testiculares pré-puberais são benignos
- A maioria dos tumores testiculares pré-puberais malignos são tumores do seio endodérmico puros
- Tumores testiculares dos cordões sexuais / estromais são raros na infância e, em grande parte, tendem a ser benignos
- A maioria dos tumores testiculares em AYA são malignos
- O rabdomiossarcoma paratesticular é a malignidade paratesticular mais comum em crianças, mas permanece raro
Conclusões
A maioria dos tumores testiculares pré-puberais é benigna. A TSS é segura de ser considerada e é recomendada para tumores testiculares pré-puberais com características clínicas e de USS de lesão benigna, e marcadores tumorais negativos.
A maioria dos tumores testiculares malignos em pré-púberes são tumores puros do saco vitelino. A AFP está acentuadamente elevada na maioria dos tumores do saco vitelino. Após o estadiamento com TC, o tratamento é a orquiectomia radical. A maioria apresenta doença em Estádio I, restrita ao testículo, e a cirurgia é curativa. A quimioterapia é reservada para crianças com doença em Estádio II ou superior, ou para aquelas com Estádio I que apresentem recidiva após a cirurgia.
A maioria dos tumores testiculares em AYA é maligna. Tendem a ser carcinomas embrionários e tumores de células germinativas mistos.
Os tumores testiculares dos cordões sexuais/estromais são raros na infância e, em sua maioria, tendem a ser benignos e passíveis de TSS.
O rabdomiossarcoma paratesticular é a malignidade paratesticular mais comum em crianças. Após estadiamento e investigação adequados, o tratamento geralmente é orquiectomia radical em bloco com a massa tumoral paratesticular, por via inguinal. Se a lesão for embrionária na histologia, recomenda-se avaliação dos linfonodos retroperitoneais para crianças com mais de 10 anos, independentemente do estágio; e para meninos com menos de 10 anos que apresentem evidência de doença locorregional ou recidiva linfonodal. Se a lesão for alveolar na histologia, recomenda-se avaliação dos linfonodos retroperitoneais para todos, independentemente dos achados de imagem.
Referências
- Silber S. Testis Development, Embryology, and Anatomy. 2018. In: Fundamentals of Male Infertility \[Internet\]. Springer; , DOI: 10.1007/978-3-319-76523-5_1.
- Ahmed HU, Arya M, Muneer A, Mushtaq I, Sebire NJ. Testicular and paratesticular tumours in the prepubertal population. Lancet Oncol 2010; 11 (5): 476–483. DOI: 10.1016/s1470-2045(10)70012-7.
- Coppes MJ, Rackley R, Kay R. Primary testicular and paratesticular tumors of childhood. Med Pediatr Oncol 1994; 22 (5): 329–340. DOI: 10.1002/mpo.2950220506.
- Schneider DT, Calaminus G, Koch S, Teske C, Schmidt P, Haas RJ. Epidemiologic analysis of 1,442 children and adolescents registered in the German germ cell tumor protocols. Pediatr Blood Cancer 2004; 42 (2): 169–175. DOI: 10.1002/pbc.10321.
- Nerli RB, Ajay G, Shivangouda P, Pravin P, Reddy M, Pujar VC. Prepubertal testicular tumors: our 10 years experience. Indian J Cancer 2010; 47 (3): 292–295. DOI: 10.4103/0019-509x.64730.
- Woo LL, Ross JH. Partial orchiectomy vs. radical orchiectomy for pediatric testis tumors. Transl Androl Urol 2020; 9 (5): 2400–2407. DOI: 10.21037/tau-19-815.
- Jarvis H, Cost NG, Saltzman AF. Testicular tumors in the pediatric patient. Semin Pediatr Surg 2021; 30 (4). DOI: 10.1016/j.sempedsurg.2021.151079.
- Grady RW, Ross JH, Kay R. Epidemiological features of testicular teratoma in a prepubertal population. J Urol 1997; 158 (3 Pt 2): 1191–1192. DOI: 10.1097/00005392-199709000-00129.
- Ross JH, Rybicki L, Kay R. Clinical behavior and a contemporary management algorithm for prepubertal testis tumors: a summary of the Prepubertal Testis Tumor Registry. J Urol 2002; 168 (4 Pt 2): 8–9. DOI: 10.1097/00005392-200210020-00004.
- Saltzman AF, Cost NG. Adolescent and Young Adult Testicular Germ Cell Tumors: Special Considerations. Adv Urol 2018; 2018 (2375176). DOI: 10.1155/2018/2375176.
- Williamson D SR, B M-G, C A, F E, L U, T.M.. The World Health Organization 2016 classification of testicular germ cell tumours: a review and update from the International Society of Urological Pathology Testis Consultation Panel. Histopathology 2017; 70: 335–346. DOI: 10.1111/his.13102.
- Renedo DE, Trainer TD. Intratubular germ cell neoplasia (ITGCN) with p53 and PCNA expression and adjacent mature teratoma in an infant testis. An immunohistochemical and morphologic study with a review of the literature. Am J Surg Pathol 1994; 18 (9): 947–952. DOI: 10.1097/00000478-199409000-00010.
- Hawkins E, Heifetz SA, Giller R, Cushing B. The prepubertal testis (prenatal and postnatal): its relationship to intratubular germ cell neoplasia: a combined Pediatric Oncology Group and Childrenś Cancer Study Group. Hum Pathol 1997; 28 (4): 404–410. DOI: 10.1016/s0046-8177(97)90027-7.
- Agarwal PK, Palmer JS. Testicular and paratesticular neoplasms in prepubertal males. J Urol 2006; 176 (3): 875–881. DOI: 10.1016/j.juro.2006.04.021.
- Luckie TM, Danzig M, Zhou S, Wu H, Cost NG, Karaviti L. A Multicenter Retrospective Review of Pediatric Leydig Cell Tumor of the Testis. J Pediatr Hematol Oncol 2019; 41 (1): 74–76. DOI: 10.1097/mph.0000000000001124.
- Grogg JB, Schneider K, Bode PK, Kranzbuhler B, Eberli D, Sulser T. Risk factors and treatment outcomes of 239 patients with testicular granulosa cell tumors: a systematic review of published case series data. J Cancer Res Clin Oncol 2020; 146 (11): 2829–2841. DOI: 10.1007/s00432-020-03326-3.
- Talon I, Moog R, Kauffmann I, Grandadam S, Becmeur F. Sertoli cell tumor of the testis in children: reevaluation of a rarely encountered tumor. J Pediatr Hematol Oncol 2005; 27 (9): 491–494.
- Chung JM, Lee SD. Overview of pediatric testicular tumors in Korea. Korean J Urol 2014; 55 (12): 789–796. DOI: 10.4111/kju.2014.55.12.789.
- Ulbright TM, Young RH. Testicular and paratesticular tumors and tumor-like lesions in the first 2 decades. Semin Diagn Pathol 2014; 31 (5): 323–381. DOI: 10.1053/j.semdp.2014.07.003.
- Calabrese F, Danieli D, Valente M. Melanotic neuroectodermal tumor of the epididymis in infancy: case report and review of the literature. Urology 1995; 46 (3): 415–418. DOI: 10.1016/s0090-4295(99)80234-9.
- Pettersson A, Richiardi L, Nordenskjold A, Kaijser M, Akre O. Age at surgery for undescended testis and risk of testicular cancer. N Engl J Med 2007; 356 (18): 1835–1841. DOI: 10.1016/j.urolonc.2007.08.002.
- Schneuer FJ, Milne E, Jamieson SE, Pereira G, Hansen M, Barker A. Association between male genital anomalies and adult male reproductive disorders: a population-based data linkage study spanning more than 40 years. Lancet Child Adolesc Health 2018; 2 (10): 736–743. DOI: 10.1016/s2352-4642(18)30254-2.
- Wood HM, Elder JS. Cryptorchidism and testicular cancer: separating fact from fiction. J Urol 2009; 181 (2): 452–461. DOI: 10.1016/s0084-4071(09)79277-2.
- LAt H, NR B, C R, HS D, RJM N, J Q. The prognostic value of testicular microlithiasis as an incidental finding for the risk of testicular malignancy in children and the adult population: A systematic review. On Behalf of the EAU Pediatric Urology Guidelines Panel Epub Ahead of Print Journal of Pediatric Urology 2021. DOI: 10.1016/j.jpurol.2021.06.013.
- Thomas JC, Ross JH, Kay R. Stromal testis tumors in children: a report from the prepubertal testis tumor registry. J Urol 2001; 166 (6): 2338–2340. DOI: 10.1016/s0022-5347(05)65583-8.
- Friend J, Barker A, Khosa J, Samnakay N. Benign scrotal masses in children - some new lessons learned. J Pediatr Surg 2016; 51 (10): 1737–1742. DOI: 10.1016/j.jpedsurg.2016.07.016.
- Stein R, Quaedackers J, Bhat NR, Dogan HS, Nijman RJM, Rawashdeh YF. EAU-ESPU pediatric urology guidelines on testicular tumors in prepubertal boys. J Pediatr Urol 2021; 17 (4): 529–533. DOI: 10.1016/j.jpurol.2021.06.006.
- Wu JT, Book L, Sudar K. Serum alpha fetoprotein (AFP) levels in normal infants. Pediatr Res 1981; 15 (1): 50–52. DOI: 10.1203/00006450-198101000-00012.
- Haas RJ, Schmidt P, Gobel U, Harms D. Testicular germ cell tumors, an update. Results of the German cooperative studies 1982-1997. Klin Padiatr 1999; 211 (4): 300–304.
- A DB, GC M, R P, P H, FG H-C, JW O. Influence of tumor site and histology on long-term survival in 193 children with extracranial germ cell tumors. Eur J Pediatr Surg 2008; 18 (1): 1–6. DOI: 10.1055/s-2007-989399.
- Ulbright TM, Srigley JR. Dermoid cyst of the testis: a study of five postpubertal cases, including a pilomatrixoma-like variant, with evidence supporting its separate classification from mature testicular teratoma. Am J Surg Pathol 2001; 25 (6): 788–793.
- P GA, LM HF, M JG, C SF, D SA, S NL. \[Mature cystic teratoma of the testis (dermoid cyst. Case Report and Literature Review\] Arch Esp Urol 2009; 62 (9): 747–751.
- Grady RW. Current management of prepubertal yolk sac tumors of the testis. Urol Clin North Am 2000; 27 (3): 503–508. DOI: 10.1016/s0094-0143(05)70097-5.
- Grady RW, Ross JH, Kay R. Patterns of metastatic spread in prepubertal yolk sac tumor of the testis. J Urol 1995; 153 (4): 1259–1261. DOI: 10.1097/00005392-199504000-00068.
- Ye YL, Zheng FF, Chen D, Zhang J, Liu ZW, Qin ZK. Relapse in children with clinical stage I testicular yolk sac tumors after initial orchiectomy. Pediatr Surg Int 2019; 35 (3): 383–389. DOI: 10.1007/s00383-018-04426-5.
- Kao CS, Cornejo KM, Ulbright TM, Young RH. Juvenile granulosa cell tumors of the testis: a clinicopathologic study of 70 cases with emphasis on its wide morphologic spectrum. Am J Surg Pathol 2015; 39 (9): 1159–1169. DOI: 10.1016/j.juro.2016.07.011.
- Dursun F, Su Dur SM, Sahin C, Kirmizibekmez H, Karabulut MH, Yoruk A. A Rare Cause of Prepubertal Gynecomastia: Sertoli Cell Tumor. Case Rep Pediatr 2015; 2015 (439239). DOI: 10.1155/2015/439239.
- Gelas T, Margain Deslandes L, Mestrallet G, Pracros JP, Mouriquand P. Spontaneous regression of suspected cystic dysplasia of the rete testis in three neonates. J Pediatr Urol 2016; 12 (6): 1–4. DOI: 10.1016/j.jpurol.2016.05.032.
- Helman T, Epelman M, Ellsworth P. Cystic Dysplasia of the Rete Testis: Does Pathophysiology Guide Management? Urology 2020; 141: 150–153. DOI: 10.1016/j.urology.2020.03.026.
- Farci F, Teratoma SST. StatPearls. .
- Bois JI, Vagni RL, Badiola FI, Moldes JM, Losty PD, Lobos PA. Testis-sparing surgery for testicular tumors in children: a 20 year single center experience and systematic review of the literature. Pediatr Surg Int 2021; 37 (5): 607–616. DOI: 10.1007/s00383-020-04850-6.
- Vergouwe Y, Steyerberg EW, Eijkemans MJ, Albers P, Habbema JD. Predictors of occult metastasis in clinical stage I nonseminoma: a systematic review. J Clin Oncol 2003; 21 (22): 4092–4099. DOI: 10.1016/j.urolonc.2004.02.005.
- Shapiro E, Strother D. Pediatric genitourinary rhabdomyosarcoma. J Urol 1992; 148 (6): 1761–1768. DOI: 10.1016/s0022-5347(17)37023-4.
- Rogers TN, Seitz G, Fuchs J, Martelli H, Dasgupta R, Routh JC. Surgical management of paratesticular rhabdomyosarcoma: A consensus opinion from the Childrenś Oncology Group, European paediatric Soft tissue sarcoma Study Group, and the Cooperative Weichteilsarkom Studiengruppe. Pediatr Blood Cancer 2021; 68 (4). DOI: 10.1002/pbc.28938.
- Crist WM, Anderson M JR, JL F, C R, RB R, F.B.. Intergroup rhabdomyosarcoma study-IV: results for patients with nonmetastatic disease. J Clin Oncol 2001; 19 (12): 3091–3102. DOI: 10.1200/jco.2001.19.12.3091.
- Sanguesa C, Veiga D, Llavador M, Serrano A. Testicular tumours in children: an approach to diagnosis and management with pathologic correlation. Insights Imaging 2020; 11 (1). DOI: 10.1186/s13244-020-00867-6.
Ultima atualização: 2025-09-21 13:35