43: Neoplasias malignas da bexiga
Este capítulo levará aproximadamente 13 minutos para ler.
Introdução
O carcinoma de células uroteliais (UCC) na população pediátrica é muito raro, com uma incidência de aproximadamente 0,1%-0,4%. Uma revisão de 2019 identificou apenas 243 casos documentados de UCC em pacientes <18 anos de idade, com idade média de 12,5 anos, e há predominância do sexo masculino (3:1). De modo geral, considera-se que a recorrência do UCC na população pediátrica seja baixa (8,6%), e a morte é muito incomum, <4%. Dada a sua raridade, não existem diretrizes publicadas sobre o diagnóstico e o manejo do UCC na população pediátrica. Este capítulo tem como objetivo delinear a etiologia e a patogênese, a avaliação e o diagnóstico, o manejo e o seguimento do UCC pediátrico na literatura atualmente publicada.
Etiologia/Patogênese
Existem fatores de risco bem definidos para o desenvolvimento de UCC em adultos, incluindo tabagismo, exposições a diversos produtos químicos ocupacionais, como corantes de anilina e produtos químicos da indústria têxtil, fenacetina e exposições à quimioterapia ou à radiação. Condições genéticas também têm sido associadas ao desenvolvimento de UCC da bexiga em adultos, a saber: síndrome de Lynch, doença de Cowden e presença de UCC em parente de primeiro grau. Em crianças, os fatores de risco genéticos e ambientais não são bem estudados, mas extrapolados a partir de adultos. Exposição precoce ao tabaco, síndromes de predisposição ao câncer (por exemplo, síndrome de Costello), desenvolvimento anormal da bexiga, exposição à radiação, exposição à ciclofosfamida e infecções parasitárias têm sido fatores de risco implicados para o desenvolvimento de UCC em crianças. Apesar desses, porém, nenhum fator de risco conhecido evidente pode estar presente em quase 87% dos pacientes pediátricos com UCC.
Os fatores de risco para recorrência e morte relacionada ao câncer de bexiga na população pediátrica incluem história familiar de UCC, histologia de alto grau e tumores maiores no momento do diagnóstico. Recorrência e morte são raras, portanto, novamente, esses fatores são geralmente extrapolados da literatura de adultos.
Avaliação e Diagnóstico
Apresentação do Paciente
Semelhante ao que ocorre em adultos, pacientes pediátricos frequentemente apresentam hematúria macroscópica indolor (90%), embora sintomas irritativos miccionais, como disúria, aumento da frequência urinária (polaquiúria) e urgência, também possam ser comuns. O atraso no diagnóstico de pelo menos 1 ano foi relatado em até 26% dos pacientes, devido à raridade desse diagnóstico em crianças e aos diagnósticos diferenciais geralmente benignos para hematúria macroscópica em uma criança (por exemplo, uretrorragia benigna, trauma, infecções do trato urinário, anomalias urológicas congênitas, doença renal intrínseca, disfunção miccional, etc.).
O UCC geralmente se apresenta como um tumor vesical solitário em crianças, em comparação com a multifocalidade em adultos (94% vs. 6%). 93.4% dos tumores são de baixo grau (pTa ou pT1), e geralmente não há evidência de envolvimento linfonodal ou metástase. Tabela 1 descreve o estadiamento do câncer de bexiga do Comitê Americano Conjunto sobre Câncer (AJCC).
Tabela 1 Estadiamento do carcinoma urotelial da AJCC
| Estágio T | Descrição |
|---|---|
| Ta | Carcinoma papilífero não invasivo |
| Tis | Carcinoma in situ (CIS) |
| T1 | Tumor invade a lâmina própria |
| T2 | Tumor invade a muscular própria |
| T2a | Tumor invade a muscular própria superficial (metade interna) |
| T2b | Tumor invade a muscular própria profunda (metade externa) |
| T3 | Tumor invade o tecido/gordura perivesical |
| T3a | Tumor invade o tecido/gordura perivesical microscopicamente |
| T3b | Tumor invade o tecido gorduroso perivesical macroscopicamente (massa extravesical) |
| T4 | Tumor invade a próstata, útero, vagina, parede pélvica ou parede abdominal |
| T4a | Tumor invade órgãos adjacentes (útero, ovários, estroma da próstata) |
| T4b | Tumor invade a parede pélvica e/ou a parede abdominal |
Avaliação Inicial
As diretrizes da AUA de 2020 sobre UCC não músculo-invasivo estipulam recomendações claras para a avaliação de pacientes adultos com hematúria macroscópica, incluindo cistoscopia, exames de imagem do trato urinário superior com urografia por TC ou por RM e, ocasionalmente, o uso de citologia urinária. Dada a evolução natural do UCC em pacientes pediátricos, ou seja, tumores geralmente de baixo grau que não recorrem, a investigação inicial de um paciente pediátrico com hematúria macroscópica costuma ser conduzida de forma menos agressiva.
A avaliação deve começar com a história clínica e o exame físico. Modalidades investigativas adicionais na primeira consulta incluem análise de urina (com atenção especial à presença/quantidade de hemácias e a indicadores de infecção, como esterase leucocitária, nitritos e bactérias), urocultura e ultrassonografia vesical/renal.
O exame de urina pode confirmar hematúria microscópica persistente e ajudar a excluir outras causas potenciais de hematúria, incluindo doença renal intrínseca ou infecção. A urocultura confirmaria a ausência de infecção. A ultrassonografia vesical/renal pode determinar a anatomia do trato urinário superior e inferior e avaliar causas potenciais de hematúria macroscópica. Dado o menor porte corporal das crianças, essa modalidade pode ser muito sensível na detecção de pequenos tumores intraluminais.
Exames de imagem, cistoscopia e citologia
Na população adulta, a cistoscopia é o padrão-ouro para a detecção de tumores vesicais e a avaliação por imagem das vias urinárias superiores na forma de urografia por TC ou RM é o padrão para visualizar as vias urinárias superiores. Na população pediátrica, há considerações que devem ser ponderadas, incluindo a necessidade de anestesia geral para cistoscopia, sedação para exames de imagem com TC ou RM, e exposição à radiação com a TC.
Houve alguns estudos que avaliaram a sensibilidade e a especificidade da ultrassonografia na avaliação dos tratos urinários superior e inferior para detecção de massas em crianças. A ultrassonografia vesical apresentou sensibilidade de 83-93% na detecção de tumores vesicais, com especificidade de 93-100%, e detectou lesões vesicais tão pequenas quanto 5 mm. Ao considerar a dose cumulativa de radiação que um paciente pediátrico pode receber ao longo de muitos anos de vigilância do UCC, a ultrassonografia torna-se uma modalidade atraente tanto como exame de triagem inicial na apresentação com hematúria macroscópica quanto para vigilância de recorrência de massa após ressecção.
A cistoscopia é indicada para pacientes em que uma lesão vesical foi detectada na ultrassonografia ou para aqueles com hematúria persistente sem outra explicação. Em pacientes pediátricos, os tumores são geralmente solitários, não invasivos, e aproximadamente 52% deles são encontrados nas paredes laterais (Figura 1) A cistoscopia em crianças requer anestesia, assim, a cistoscopia é frequentemente realizada com ressecção transuretral de tumor de bexiga (TURBT) como parte esperada do procedimento. É necessário tecido para estabelecer o diagnóstico e a profundidade de invasão (estágio T). Este também é o tratamento inicial para remover todo o tumor.
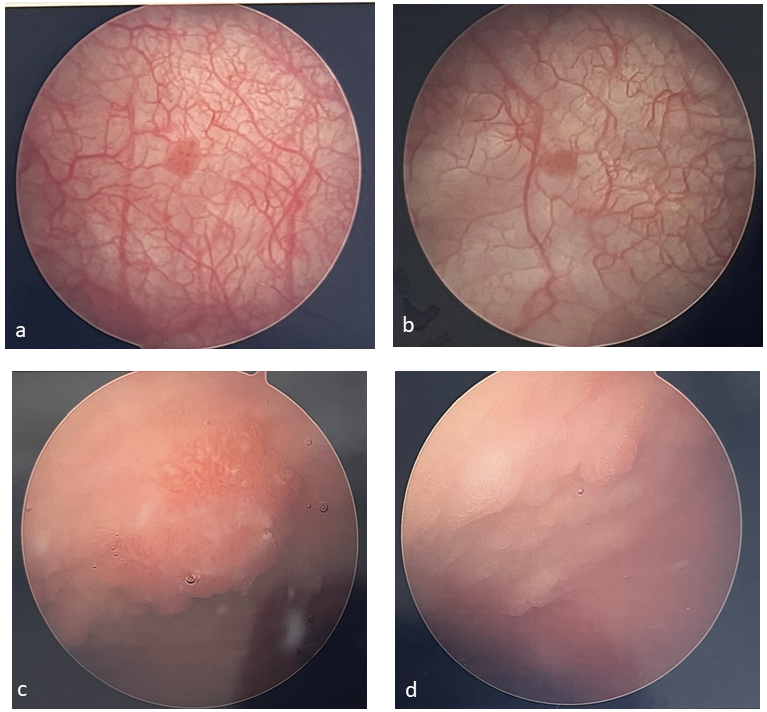 Figura 1 Exemplos de tumores vesicais. Tumores vesicais são frequentemente solitários e papilares (a, b) e podem ser mais difíceis de identificar em pacientes que foram submetidos a aumento vesical (c, d).
Figura 1 Exemplos de tumores vesicais. Tumores vesicais são frequentemente solitários e papilares (a, b) e podem ser mais difíceis de identificar em pacientes que foram submetidos a aumento vesical (c, d).
A citologia urinária tem papel mínimo em pacientes pediátricos, pois esses tumores vesicais são tipicamente de baixo grau e a sensibilidade da citologia para tumores de baixo grau é bastante baixa.
Manejo
A recorrência do câncer de bexiga na população pediátrica é baixa e as taxas de sobrevivência em 5 anos são favoráveis, de 97,3%. Por causa dessas diferenças, a abordagem difere significativamente da dos adultos. Há, no entanto, algumas semelhanças entre ambas as populações e, assim, há alguns aspectos da abordagem que são compartilhados.
Ressecção transuretral de tumor de bexiga (TURBT)
Como nos adultos, a ressecção transuretral é tanto diagnóstica quanto terapêutica. Isso exige a ressecção de todo o tumor macroscópicamente evidente, com profundidade suficiente para obter amostragem do músculo detrusor subjacente. Isso é necessário para reduzir o risco de recidiva, mas também para um estadiamento adequado. TURBTs que requerem um ressectoscópio podem ser proibitivas em pacientes pequenos, pois as alças do ressectoscópio podem ser muito difíceis de manipular em endoscópios menores. Algumas crianças podem necessitar de biópsia com pinça fria e fulguração da base do tumor, embora seja necessário cuidado para obter biópsias de tecido profundo para amostragem do detrusor. O exame bimanual da bexiga também deve ser realizado no momento da TURBT para completar o estadiamento.
Terapia intravesical
De um modo geral, a instilação de quimioterapia no período perioperatório não é utilizada em doentes pediátricos. Doentes pediátricos que apresentem tumores de grau e estádio mais elevados tendem a comportar-se de forma mais semelhante ao UCC do adulto e, assim, poderão ser melhor tratados como tal, embora não existam estudos prospetivos deste cenário raro. Estes doentes podem necessitar de quimioterapia intravesical e de protocolos de vigilância como os dos adultos delineados pelas organizações AUA e NCCN. Existem alguns relatos da utilização pós-TURBT de instilação intravesical de BCG, mitomicina ou epirrubicina em doentes pediátricos com cancro da bexiga. Em geral, as doses e os esquemas têm sido os descritos em adultos, com poucos eventos adversos graves. A terapêutica intravesical é tipicamente reservada para doentes com doença de alto grau ou recidivante, mas os dados estão limitados a relatos de caso, pelo que não existem dados claros para estabelecer um papel bem definido neste momento.
Acompanhamento e Vigilância
As diretrizes para adultos têm protocolos agressivos, claros e estabelecidos para vigilância e manejo das recorrências, pois isso é frequente. Para crianças, no entanto, não há recomendações claras devido à raridade deste tumor e à recorrência, ainda mais rara. Uma revisão de 2019 relatou apenas uma taxa de recorrência de 8,6%, uma diferença significativa em relação aos adultos.
De modo geral, o tipo e o momento do acompanhamento devem ser individualizados com base no risco de recorrência da criança. Devem ser considerados o número de lesões, o estadiamento e o grau patológicos, o tamanho do tumor, o histórico de recorrência e a idade. A realização regular de ultrassonografia é uma opção razoável para crianças com diagnóstico de câncer de bexiga, devido à sua alta sensibilidade e natureza não invasiva. A cistoscopia pode ser realizada posteriormente se uma lesão for detectada. A cistoscopia de vigilância de rotina, apesar de ultrassonografias normais, pode ser necessária em pacientes pediátricos de maior risco (p. ex., múltiplas lesões, lesões de alto grau, recorrência, idade mais avançada, etc.). De modo semelhante ao momento do diagnóstico, é pouco provável que a citologia urinária traga grande benefício, visto que as crianças tipicamente apresentam tumores de baixo grau e bem diferenciados.
Ao contrário dos protocolos para adultos, não há dados que orientem a duração do seguimento para crianças com UCC. Uma grande revisão da literatura constatou que, se viesse a ocorrer recorrência ou óbito relacionados a UCC de baixo grau/estádio, é provável que isso ocorra no primeiro ano após o diagnóstico inicial. O tempo médio até a recorrência ou óbito foi de 8,6 meses.
Tabela 2 Esquema de vigilância para UCC de bexiga de baixo grau e baixo estádio em pacientes pediátricos (adaptado por Rezaee et al)1
| 0-12 meses | 18-24 meses | 36-48 meses | >60 meses | |
|---|---|---|---|---|
| Ultrassonografia | A cada 3 meses | A cada 6 meses | Anualmente | A critério do profissional de saúde |
| Urinálise | A cada 3 meses | A cada 6 meses | Anualmente | A critério do profissional de saúde |
| Cistoscopia | A cada 3 meses | A cada 6 meses | +/- Anualmente | A critério do profissional de saúde |
| Citologia | — | — | — | — |
Além disso, é muito improvável que ocorra uma recorrência ou óbito após três anos do diagnóstico e tratamento iniciais. A recorrência mais tardia publicada ocorreu 32 meses após o diagnóstico inicial. Um possível esquema de seguimento para UCC de baixo grau e baixo estádio foi delineado por Rezaee et al. com base numa coorte de revisão da literatura de 2019, e isto está resumido na Tabela 2. É importante salientar que este esquema de seguimento não foi rigorosamente estudado por um estudo prospectivo randomizado que comprove a sua segurança e é apresentado como ponto de partida apenas para doença de baixo grau/estádio.
Tumores vesicais na população com bexiga neurogênica
O seguimento a longo prazo de doentes com bexiga neurogénica congénita (isto é, espinha bífida, extrofia vesical, etc.) identificou esta população como tendo um risco singularmente mais elevado para o desenvolvimento de cancro da bexiga (incidência estimada de cerca de 4%). Ao contrário do cancro da bexiga na população com bexiga não neurogénica, esta coorte é habitualmente diagnosticada de forma incidental e tem uma maior incidência de adenocarcinoma (50%). A grande maioria dos doentes apresenta doença localmente avançada ou disseminada (>70%) e a sobrevivência é baixa. O diagnóstico é frequentemente feito em fases tardias da doença e os desfechos são desfavoráveis.
A hipótese inicial para esse risco aumentado de câncer de bexiga focava-se na cistoplastia de aumento como um fator de risco. Embora segmentos gástricos certamente aumentem o risco subsequente de malignidade, a ampliação com outros segmentos intestinais não parece aumentar o risco de malignidade. Por meio de vários estudos retrospectivos, agora parece que o risco de malignidade se deve à própria bexiga congênita, e não à cistoplastia de aumento.
Quando as primeiras descrições de neoplasias malignas avançadas e letais nessa população foram publicadas, uma variedade de medidas foi sugerida e então estudada com o objetivo de detecção mais precoce desses tumores. Infelizmente, nenhuma se mostrou benéfica. A cistoscopia anual tem baixo rendimento e, mesmo em pacientes com rastreamento normal, desenvolveu-se câncer de bexiga avançado. Sugeriu-se que, se a cistoscopia pudesse detectar todas as neoplasias malignas, seria necessário realizar 980 procedimentos para diagnosticar um único caso de câncer ao longo de 10 anos de acompanhamento. A citologia urinária tem pouco valor nessa população devido à piúria crônica, cateterizações intermitentes e à esperada descamação de células entéricas, além de também apresentar alta taxa de falsos-positivos. Ao incluir a efetividade das medidas de rastreamento acima, parece que o aumento na expectativa de vida foi de apenas 2,3 meses e o custo ao longo da vida foi de >$55,000 per capita. Isso é principalmente impulsionado pelas baixas taxas de neoplasia maligna e pelo grande número de testes de rastreamento necessários para detectar um único caso de neoplasia maligna, independentemente do estágio no diagnóstico.
O protocolo de Husmann tem sido amplamente adotado para orientar o seguimento de pacientes com bexiga neurogênica, tanto para detecção de malignidade quanto para avaliação de rotina de pacientes com ou sem reconstrução vesical (Figura 2) Isso envolve uma avaliação anual de infecções do trato urinário, hematúria, dor vesical/pélvica/de flanco e início recente de incontinência. Se houver quaisquer anormalidades ou alterações em relação ao basal, deve-se considerar urocultura, cistoscopia, TC ± urodinâmica. Todos os pacientes devem realizar, anualmente, creatinina/cistatina C, eletrólitos, nível sérico de vitamina B12 e sumário de urina. Da mesma forma, se houver <50 RBCs/hpf, deve ser solicitada ultrassonografia renal/vesical. Se a ultrassonografia for anormal, se houver hematúria macroscópica ou ≥50 RBCs/hpf, então deve-se considerar urocultura, cistoscopia, TC ± urodinâmica. Para pacientes com segmentos colônicos, a cistoscopia de rotina para rastreio de câncer de cólon deve iniciar aos 50 anos.
Figura 2 Protocolo de Husmann para vigilância do câncer de bexiga em pacientes com ampliação vesical.2
Pontos-chave
- O câncer de bexiga em pacientes pediátricos é raro
- Atualmente não há fatores de risco bem definidos para o desenvolvimento de câncer de bexiga pediátrico, mas os fatores de risco dos adultos são extrapolados e frequentemente aplicados a essa população
- A maioria dos pacientes pediátricos com câncer de bexiga apresenta hematúria macroscópica indolor ou sintomas miccionais irritativos
- A maioria dos UCC pediátricos é de baixo grau, baixo estádio e não recidiva
- A avaliação inicial deve começar com anamnese e exame físico, análise de urina, urocultura e ultrassonografia vesical/renal
- A ultrassonografia vesical tem excelente sensibilidade e especificidade para detecção de tumores vesicais e deve ser considerada como modalidade de rastreamento
- Não há papel para citologia urinária, pois a maioria dos UCC pediátricos é de baixo grau
- Se uma lesão for encontrada à ultrassonografia, deve-se realizar cistoscopia com TURBT
- A ressecção transuretral de tumor vesical deve incluir amostragem do detrusor para estadiamento adequado
- O papel da quimioterapia intravesical é incerto, mas é uma consideração razoável para pacientes com doença de alto estádio, alto grau ou recorrente
- Pacientes pediátricos com UCC devem ser submetidos a vigilância pelo menos nos primeiros 3 anos após o diagnóstico, mas vigilância além disso pode ser desnecessária
- Pacientes com bexiga neurogênica congênita (CNB) apresentam maior risco de câncer de bexiga e esse risco não está associado ao aumento vesical, exceto quando com segmentos gástricos; a patologia geralmente é adenocarcinoma
- Pacientes com CNB apresentam-se incidentalmente com tumores de estádio mais alto e localmente avançados, com baixa sobrevida
- O rastreamento de rotina com cistoscopia e citologia urinária não é benéfico e não é recomendado
- O protocolo de Husmann é preconizado para seguimento de pacientes com CNB, com o objetivo de identificação direcionada dos pacientes com maior risco de malignidade (hematúria, aumento de infecções do trato urinário, dor, nova incontinência, exames laboratoriais/de imagem anormais)
Conclusão
O câncer de bexiga em pacientes pediátricos é raro e, em geral, tem bom prognóstico. A maioria dos tumores é solitária, de baixo grau e não recidiva. A investigação deve começar com anamnese e exame físico, exame de urina, urocultura e ultrassonografia vesical/renal, com subsequente cistoscopia e ressecção transuretral do tumor vesical. A quimioterapia intravesical pode, muitas vezes, ser evitada, dada a patologia de baixo grau. Em tumores de alto grau ou em estágios mais avançados, ou em tumores recorrentes, pode-se considerar quimioterapia intravesical; entretanto, atualmente não há diretrizes baseadas em evidências para seu uso em crianças. Os pacientes devem ser monitorados por pelo menos 3 anos com uma combinação de exames de urina periódicos, ultrassonografias vesicais/renais e cistoscopia. A vigilância além de 3 anos pode não ser necessária, mas deve-se utilizar a tomada de decisão compartilhada para determinar essa duração.
Vídeos recomendados
Referências
- Karatzas A, Tzortzis V. Lower urinary tract symptoms and bladder cancer in children: The hidden scenario. Urol Ann 2019; 11 (1): 102–104. DOI: 10.4103/UA.UA_60_18.
- Rezaee ME, Dunaway CM, Baker ML, Penna FJ, Chavez DR. Urothelial cell carcinoma of the bladder in pediatric patients: a systematic review and data analysis of the world literature. Journal of Pediatric Urology 2019; 15 (4): 309–314. DOI: 10.1016/j.jpurol.2019.06.013.
- Lerena J, Krauel L, García-Aparicio L, Vallasciani S, Suñol M, Rodó J. Transitional cell carcinoma of the bladder in children and adolescents: Six-case series and review of the literature. Journal of Pediatric Urology 2010; 6 (5): 481–485. DOI: 10.1016/j.jpurol.2009.11.006.
- Egbers L, Grotenhuis AJ, Aben KK, Alfred Witjes J, Kiemeney LA, Vermeulen SH. The prognostic value of family history among patients with urinary bladder cancer. Int J Cancer 2015; 136 (5): 1117–1124. DOI: 10.1002/ijc.29062.
- Wild P, Giedl J, Stoehr R. Genomic aberrations are rare in urothelial neoplasms of patients 19 years or younger. The Journal of Pathology 2007; 211 (1): 18–25. DOI: 10.1002/path.2075.
- Fine SW, Humphrey PA, Dehner LP, Amin MB, Epstein JI. Urothelial Neoplasms In Patients 20 Years or Younger: A Clinicopathological Analysis Using The World Health Organization 2004 Bladder Consensus Classification. Journal of Urology 2005; 174 (5): 1976–1980. DOI: 10.1097/01.ju.0000176801.16827.82.
- Paner GP, Zehnder P, Amin AM, Husain AN, Desai MM. Urothelial Neoplasms of the Urinary Bladder Occurring in Young Adult and Pediatric Patients: A Comprehensive Review of Literature With Implications for Patient Management. Adv Ant Pathol 18 (1): 79–89.
- Bladder Cancer: Non-Muscle Invasive Guideline - American Urological Association. .
- Gharibvand MM, Kazemi M, Motamedfar A, Sametzadeh M, Sahraeizadeh A. The role of ultrasound in diagnosis and evaluation of bladder tumors. J Family Med Prim Care 2017; 6 (4): 840–843. DOI: 10.4103/jfmpc.jfmpc_186_17.
- Berretini A, Castagnetti M, Salerno A. Bladder urothelial neoplasms in pediatric age: Experience at three tertiary centers. Journal of Pediatric Urology 2015; 11: 26 1–26 5. DOI: 10.1016/j.jpurol.2014.08.008.
- D DC, A F, K P. Management and follow-up of urothelial neoplasms of the bladder in children: A report from the TREP project. Pediatric Blood & Cancer 2015; 62 (6): 1000–1003. DOI: 10.1002/pbc.25380.
- ElSharnoby O, Fraser N, Williams A, Scriven S, Shenoy M. Bladder urothelial cell carcinoma as a rare cause of haematuria in children: Our experience and review of current literature. Journal of Pediatric Surgery Published Online September 2021; 17. DOI: 10.1016/j.jpedsurg.2021.09.007.
- Saltsman JA, Malek MM, Reuter VE. Urothelial neoplasms in pediatric and young adult patients: A large single-center series. Journal of Pediatric Surgery 2018; 53 (2): 306–309. DOI: 10.1016/j.jpedsurg.2017.11.024.
- Rague JT, High-grade LRSM. Nonmuscle Invasive Urothelial Carcinoma in a Prepubertal Patient With TURBT and Intravesical BCG. Urology 2019; 124: 257–259. DOI: 10.1016/j.urology.2018.10.028.
- Peard L, Stark T, Ziada A, Saltzman AF. Recurrent Bladder Cancer in a Teenage Male. Urology 2020; 141: 135–138. DOI: 10.1016/j.urology.2020.04.031.
- Soergel TM, Cain MP, Misseri R, Gardner TA, Koch MO, Rink RC. TRANSITIONAL CELL CARCINOMA OF THE BLADDER FOLLOWING AUGMENTATION CYSTOPLASTY FOR THE NEUROPATHIC BLADDER. The Journal of Urology 2004; 172 (4, Supplement): 1649–1652. DOI: 10.1097/01.ju.0000140194.87974.56.
- Austin JC, Elliott S, Cooper CS. Patients With Spina Bifida and Bladder Cancer: Atypical Presentation, Advanced Stage and Poor Survival. The Journal of Urology 2007; 178 (3): 798–801. DOI: 10.1016/j.juro.2007.05.055.
- Rove K, Higuchi T. Monitoring and malignancy concerns in patients with congenital bladder anomalies. Current Opinion in Urology 2016; 26 (4): 344–350. DOI: 10.1097/MOU.0000000000000297.
- Husmann D, Fox J, Higuchi T. Malignancy following bladder augmentation:recommendations for long-term follow-up and cancer screening. AUA Update Ser 2011; 30 (24): 222–227.
- Higuchi TT, Fox JA, Husmann DA. Annual Endoscopy and Urine Cytology for the Surveillance of Bladder Tumors After Enterocystoplasty for Congenital Bladder Anomalies. The Journal of Urology 2011; 186 (5): 1791–1795. DOI: 10.1016/j.juro.2011.07.028.
- Hamid R, Greenwell TJ, Nethercliffe JM, Freeman A, Venn SN, Woodhouse CRJ. Routine surveillance cystoscopy for patients with augmentation and substitution cystoplasty for benign urological conditions: is it necessary? BJU International 2009; 104 (3): 392–395. DOI: 10.1111/j.1464-410X.2009.08401.x.
- Kokorowski PJ, Routh JC, Borer JG, Estrada CR, Bauer SB, Nelson CP. Screening for Malignancy After Augmentation Cystoplasty in Children With Spina Bifida: A Decision Analysis. The Journal of Urology 2011; 186 (4): 1437–1443. DOI: 10.1016/j.juro.2011.05.065.
Ultima atualização: 2025-09-21 13:35