31: Hipospádia distal
Este capítulo levará aproximadamente 22 minutos para ler.
Introdução
Na literatura grega antiga, Aristóteles foi o primeiro a descrever a disfunção urinária resultante de uma malformação peniana.1 O médico grego Galeno é creditado por cunhar o termo hypospadias nos anos 100 d.C.1 Tal como os seus primeiros descritores, a etimologia do termo hypospadias é grega, derivando das raízes hypo (sob) e spadon (rasgo, fissura).
A hipospádia é uma das anomalias congênitas mais comuns em recém-nascidos do sexo masculino. Caracteriza-se por posicionamento ventral da abertura uretral com desenvolvimento interrompido da porção ventral do pênis, da uretra e do prepúcio.2 Devido a esse desenvolvimento interrompido, há tubulização uretral incompleta, o que resulta em uma abertura uretral ectópica na face ventral do pênis. Dependendo da gravidade, a hipospádia frequentemente está associada a chordee ventral (curvatura peniana) e deficiência de prepúcio ventral, resultando em um prepúcio “em capuz dorsal”. A localização anatômica do orifício uretral é tipicamente usada para a classificação da hipospádia. O meato hipospádico pode estar localizado em qualquer ponto desde a glande até o períneo. Cerca de 50% das hipospádias são distais (glande, coronal e subcoronal), 30% são médias (corpo peniano) e 20% são proximais (penoescrotal, escrotal e perineal) (Figura 1).3,4 Este capítulo se concentrará na embriologia, epidemiologia, etiologia, diagnóstico, avaliação, reparo, seguimento e complicações da hipospádia distal. A hipospádia proximal é considerada uma apresentação mais grave e será abordada em outro capítulo.
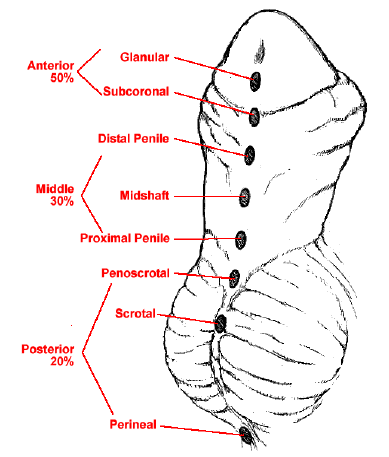
Figura 1 Espectro das apresentações da hipospádia.4
Embriologia
O desenvolvimento da genitália externa masculina começa em um estágio ambissexual durante a quinta semana gestacional.5 Até as semanas gestacionais 7 e 8, o tubérculo genital, a prega urogenital e as pregas lábio-escrotais são idênticos.5,6 A diferenciação sexual começa nas semanas gestacionais 8 e 9, quando a expressão do gene SRY inicia a diferenciação gonadal masculina e, assim, a produção de andrógenos.5 No entanto, o desenvolvimento peniano ocorre por meio de eventos independentes de andrógenos e dependentes de andrógenos.7,8 Os eventos independentes de andrógenos são comuns a ambos os sexos e incluem a formação do tubérculo genital, placa uretral, sulco uretral, glande, prepúcio e corpo cavernoso.7 Os eventos dependentes de andrógenos incluem a tubularização uretral, o desenvolvimento circunferencial do prepúcio e o alongamento peniano.6,7,8
A uretra masculina desenvolve-se por meio de um mecanismo de “duplo zíper” que começa na 8ª semana de gestação.9,10 Nesse processo, o zíper inicial de abertura envolve a canalização distal da placa uretral para formar o sulco uretral. Um zíper de fechamento segue no sentido proximal para distal, à medida que as margens mediais das pregas uretrais endodérmicas se fundem para formar uma uretra tubular. O zíper continua a avançar distalmente até que o meato uretral esteja na ponta da glande. Esse processo, juntamente com o desenvolvimento circunferencial do prepúcio, é impulsionado por estimulação androgênica e geralmente se completa por volta da 17ª semana de gestação.7,8
A interrupção desse processo embriológico causa uma falha na fusão adequada das pregas uretrais, resultando em uma abertura uretral na face ventral do pênis.11 Além disso, essa interrupção impede que o prepúcio se desenvolva de forma circunferencial, o que se apresenta como capuz prepucial dorsal na hipospádia.12
Epidemiologia
A hipospádia é uma das anomalias congênitas mais comuns em indivíduos do sexo masculino, ocorrendo em cerca de 1:200-300 nascidos vivos nos EUA, 1:500 em toda a Europa e 1:2,000-3,000 em toda a Ásia.5,10,13 Embora a incidência de hipospádia varie em todo o mundo, vários estudos de bancos de dados mostraram um aumento drástico da incidência na história recente. Houve uma duplicação da taxa (de 0,2 para 0,4 por cento) nos EUA durante as décadas de 1970 e 1980.14 É improvável que esse aumento se deva a melhorias na detecção, pois houve um aumento desproporcional nos casos graves em comparação com os mais leves. Em vez disso, influências multifatoriais, como disrupção endócrina, exposições ambientais e predisposição genética, podem contribuir para esse aumento da taxa.11,15 Outros inquéritos populacionais também encontraram aumentos drásticos na incidência de hipospádia durante o final do século XX, incluindo estudos do Canadá, Austrália, Inglaterra, Noruega, Dinamarca, Finlândia, Japão e Itália, entre outros.3,16 Um estudo de banco de dados de Washington constatou que idade materna avançada (>40 anos de idade), diabetes materno pré-existente e raça branca estavam, cada um, independentemente associados a um risco aumentado de ter um recém-nascido com hipospádia.15
Etiologia/Patogênese
A patogênese da hipospádia provavelmente se deve à desregulação do metabolismo de andrógenos e da resposta aos andrógenos durante a gestação, uma vez que a estimulação androgênica é responsável por processos-chave no desenvolvimento peniano.6,7,8 Essas alterações provavelmente são multifatoriais, originando-se tanto de predisposição genética quanto de exposições ambientais.17
Genética
Evidências que apoiam uma predisposição genética incluem o agrupamento familiar relatado na hipospádia, pois cerca de 7% dos pacientes afetados têm outro familiar de 1º, 2º ou 3º grau também afetado, especialmente no tipo “anterior” ou distal.18 Também foi relatada história familiar positiva para hipospádia em quase um quarto dos meninos com hipospádia.19 História paterna de hipospádia esteve presente em cerca de 31% dos meninos afetados.19
Genes que têm sido associados a risco aumentado de hipospádia estão relacionados a defeitos no seu equilíbrio hormonal androgênico durante o desenvolvimento. Especificamente, genes que afetam enzimas metabolizadoras de andrógenos, receptores androgênicos e receptores de estrogênio.20,21,22,23,24,25,26 Por exemplo, a expressão de receptores androgênicos foi localizada ao epitélio uretral ventral e a de 5-alfa-redutase tipo 2, ao estroma, respectivamente, durante o desenvolvimento.26 Defeitos em sua atividade podem levar a uma remodelação uretral anormal e resultar em hipospádia.26 Algumas síndromes de anomalias congênitas que também podem se apresentar com hipospádia incluem as síndromes WAGR, Denys-Drash, Smith-Lemli-Opitz, Opitz G e Frasier, entre quase 200 outras.5,18,27
Ambiental
Existe uma hipótese de dois acertos em relação ao desenvolvimento da hipospádia, na qual a exposição ambiental a desreguladores endócrinos pode potencializar os efeitos da predisposição genética à hipospádia.17 Algumas das exposições identificadas que podem aumentar o risco de hipospádia incluem uso materno de progestinas durante a gestação, éteres difenílicos polibromados (retardantes de chama), tabagismo materno, uso paterno de medicamentos prescritos, exposição materna ao dietilestilbestrol, suplementação materna de ferro e exposição paterna a pesticidas.28,29,30 Dentre essas, apenas o uso materno de progestinas, os éteres difenílicos polibromados, o tabagismo materno e o uso paterno de medicamentos prescritos demonstraram significância estatística em estudos.
Diagnóstico e Avaliação
A hipospádia deve ser diagnosticada ao nascimento durante um exame físico neonatal minucioso. A realização de circuncisão neonatal é contraindicada nesses pacientes porque o prepúcio é frequentemente interposto durante a reconstrução uretral, seja como retalho vascularizado ou como enxerto livre. Portanto, estabelecer o diagnóstico no período neonatal é essencial para evitar a remoção do tecido prepucial disponível e útil por meio de uma circuncisão. Um exame geniturinário minucioso de um paciente com hipospádia mostrará duas aberturas uretrais: 1) uma fosseta uretral cega na localização glandar normal e 2) uma abertura do meato uretral verdadeiro na face ventral do pênis (Figura 2). Outras características clássicas associadas à hipospádia, que podem ou não estar presentes, incluem um prepúcio em capuz dorsal como resultado de deficiência de prepúcio ventral e chordee ventral, ou curvatura peniana. Uma vez estabelecido o diagnóstico, o médico deve avaliar adicionalmente o paciente em busca de outras anomalias congênitas associadas relacionadas a causas sindrômicas.31 Entretanto, aproximadamente 90% dos casos são hipospádias isoladas.31 A presença concomitante de criptorquidia bilateral e hipospádia é sugestiva de um distúrbio do desenvolvimento sexual (DSD), embora isso seja considerado mais comum em meninos com hipospádia proximal.32 Independentemente disso, qualquer paciente com hipospádia e criptorquidia bilateral deve ser avaliado com cariótipo, ultrassonografia pélvica e eletrólitos séricos, para rastrear perda salina secundária à hiperplasia adrenal congênita (CAH).
Durante a consulta urológica, vários fatores devem ser considerados ao se planejar a correção. Deve ser realizado um exame geniturinário minucioso por um urologista pediátrico experiente para determinar a localização do meato uretral, o volume da glande, o comprimento peniano, o grau de curvatura peniana (chordee), a presença de transposição penoescrotal e a profundidade e a largura da placa uretral. Exames de imagem do trato urinário não estão indicados nem são necessários na hipospádia isolada.31 Essas características operatórias, além da preferência e da experiência do cirurgião, influenciam o planejamento da correção. Por fim, os riscos e benefícios da cirurgia devem ser discutidos de forma abrangente com os pais para permitir a tomada de decisão compartilhada.
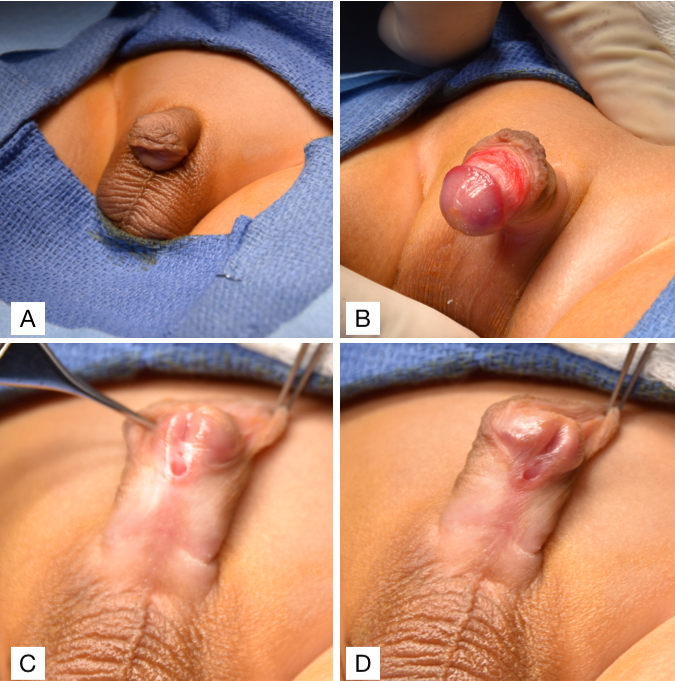
Figura 2 (A) Encurvamento ventral com prepúcio em capuz dorsal. (B) Encurvamento ventral. (C e D) Hipospádia subcoronal com prepúcio em capuz dorsal.
Planejamento e Manejo Pré-operatórios
Na maioria das hipospádias distais, a correção cirúrgica não é necessária, especialmente na hipospádia glandular, em que o jato urinário é reto. Muitos desses meninos têm micção normal e função sexual futura normal do pênis. A localização meatal “normal” é amplamente considerada como a extremidade distal da glande. Grande variação da localização do meato foi relatada, com preservação da função sexual e miccional ao longo da vida adulta em homens com hipospádia não tratada.33,34 Uma pesquisa constatou que homens com hipospádia “mais leve” ou distal não tratada relatam dificuldades na relação sexual associadas à curvatura, mas sem problemas urinários significativos em comparação com homens “normais”.35 Isso sugere que a correção da hipospádia distal deve focar na correção da curvatura peniana e evitar a uretroplastia e suas complicações associadas.43 Além disso, a infertilidade é considerada um problema na hipospádia proximal, não na distal.34 No entanto, pacientes com hipospádia coronal e médio-peniana podem apresentar pulverização urinária ou desvio do jato de urina que os levam a sentar-se para urinar, ou questões estéticas que acarretam implicações psicosexuais futuras. Assim, muitos pais optam pela correção cirúrgica da hipospádia distal de seus filhos.
Quanto ao momento da cirurgia, a maioria dos urologistas pediátricos concorda que a correção pode ser realizada a partir dos 6 meses de idade. Isso coincide com as diretrizes de 1996 do comitê de ação da Seção de Urologia da American Academy of Pediatrics, que indicam 6–12 meses como uma idade aceitável para a correção de hipospádia.44 Ao optar por procedimentos em múltiplos estágios, embora isso seja incomum na hipospádia distal, recomenda-se um intervalo de 6 meses entre os procedimentos para permitir a adequada cicatrização da ferida. Notadamente, esforços devem ser feitos para limitar o tempo da criança sob anestesia, pois a literatura emergente expressa preocupação com o efeito da anestesia prolongada no desenvolvimento cerebral em crianças menores de 3 anos de idade.36
Há debate entre urologistas pediátricos sobre o uso de estimulação androgênica pré-operatória em meninos com hipospádia. Muitos urologistas defendem seu uso em meninos com hipospádia grave, a fim de aumentar o comprimento do falo, a circunferência da glande, a vascularização peniana e a robustez tecidual, para otimizar as características penianas para a correção. No entanto, uma revisão sistemática sugere que a estimulação hormonal pré-operatória está associada a maiores taxas de complicações pós-operatórias em pacientes com hipospádia proximal, embora não tenha alcançado significância estatística.37 Quando considerado necessário, utilizamos duas doses de 25 mg de injeções intramusculares de depo-testosterone com um intervalo de seis semanas entre as doses.
Profilaxia antibiótica e analgésica
A profilaxia antibiótica é comumente utilizada entre urologistas pediátricos com o objetivo de minimizar o risco de infecções do sítio cirúrgico e do trato urinário, especialmente em correções com stent.38 No entanto, preocupações com o aumento das taxas de resistência a antibióticos levantaram questões quanto à eficácia da profilaxia antibiótica. Estudos retrospectivos não encontraram diferença significativa em infecções do sítio cirúrgico e do trato urinário com e sem o uso de profilaxia antibiótica pré-operatória na correção de hipospádia.39,40 Contudo, estudos adicionais com tamanhos de amostra maiores seriam úteis para esclarecer melhor a eficácia dessa prática. Na nossa instituição, usamos cefazolina (30 mg/kg) por via intravenosa como profilaxia antibiótica pré-operatória no momento da indução anestésica. Quanto à profilaxia antibiótica pós-operatória, relata-se que 91% dos urologistas pediátricos prescrevem antibióticos pós-operatórios quando um cateter uretral é mantido no lugar.38 Entretanto, uma metanálise recente que avaliou os efeitos da profilaxia antibiótica pós-operatória após a correção de hipospádia encontrou utilidade limitada na prevenção de complicações infecciosas e de cicatrização de feridas, embora o risco de viés fosse alto em muitos dos estudos.41 Atualmente, está em andamento um ensaio clínico randomizado, internacional e multi-institucional, avaliando a profilaxia pós-operatória.42 Na nossa instituição, prescrevemos TMP-SMX oral 2 mg/kg ao dia durante a permanência do cateter.
Proporcionar aos pacientes analgesia adequada é especialmente importante nessa população, uma vez que muitos meninos que se submetem à correção de hipospádia são jovens demais para se comunicar verbalmente. Diversas técnicas analgésicas são utilizadas na correção de hipospádia, incluindo bloqueio caudal e bloqueios de nervos periféricos (bloqueio do nervo dorsal do pênis e bloqueio do nervo pudendo). Há um debate contínuo sobre a eficácia dessas diferentes técnicas e seus efeitos nos desfechos pós-operatórios. Uma meta-análise de ensaios clínicos randomizados e estudos observacionais que compara bloqueios caudais versus bloqueios de nervos periféricos não encontrou diferença significativa no uso adicional de analgésicos nas 24 horas após a cirurgia, mas observou escores de dor mais baixos 24 horas após a cirurgia com bloqueio caudal.43 Os autores também relatam não haver risco adicional de complicações pós-operatórias com bloqueios caudais.43 Pelo contrário, uma meta-análise diferente encontrou uma associação significativa entre analgesia com bloqueio caudal e complicações pós-operatórias após a correção de hipospádia, embora esses dados provavelmente tenham sido confundidos pela gravidade da hipospádia.44 São necessários dados adicionais para esclarecer qual é a técnica analgésica mais eficaz e segura. Em nossa instituição, o cirurgião prefere um bloqueio caudal pré-operatório para controle da dor.
Correção de hipospádia distal
A correção da hipospádia deve visar alcançar três objetivos principais: capacidade de urinar confortavelmente em posição ortostática, jato miccional adequado e aparência e função penianas “normais”.45 Embora exista variação normal na aparência peniana, a meta típica é criar um meato vertical, em fenda, na ponta distal da glande.46 A maioria, senão todas, as correções de hipospádia distal conseguem cumprir esses objetivos quando se utiliza a técnica da placa uretral incisa tubularizada (TIP).47,48 A técnica original de correção de Thiersch-Duplay foi complementada e popularizada pela técnica TIP descrita por Snodgrass em 1994.47,49 Sua modificação consistiu numa incisão longitudinal mediana profunda da placa uretral dorsal, o que permite o alargamento da placa uretral para facilitar a tubularização. Estes são os passos realizados em nossa instituição, que constituem uma variação da técnica TIP (Vídeo recomendado, (Figura 3), e (Figura 4)50,51
- Inserir sonda de alimentação 5-Fr através do meato hipospádico, colocar pontos de reparo em ambos os lados do futuro meato distal e colocar o torniquete peniano.
- Realizar incisões verticais em cada borda da placa uretral, em seguida, uma incisão transversal proximal ao meato conectando-as.
- Separar o retalho da glande e realizar uma incisão dorsal na linha média da placa uretral.
- A uretroplastia é realizada utilizando fio PDS 6-0 para um fechamento subepitelial em uma camada, com suturas contínuas sobre a sonda de alimentação 5-Fr.
- Confeccionar um retalho de dartos lateral e utilizá-lo para cobrir a linha de sutura.
- A glanuloplastia é concluída reaproximando ventralmente os retalhos da glande.
- Desenluvar o pênis até a base.
- Circuncidar o excesso de pele prepucial e medir o grau de encurvamento (chordee).
- Reaproximar a pele ventral do corpo peniano.
- Fixar a sonda de alimentação à glande e aplicar um filme hidrocoloide fino, compressivo, impermeável e estéril, seguido de um curativo adesivo envolvente transparente, fino, impermeável e estéril para manter o pênis elevado (Figura 3)
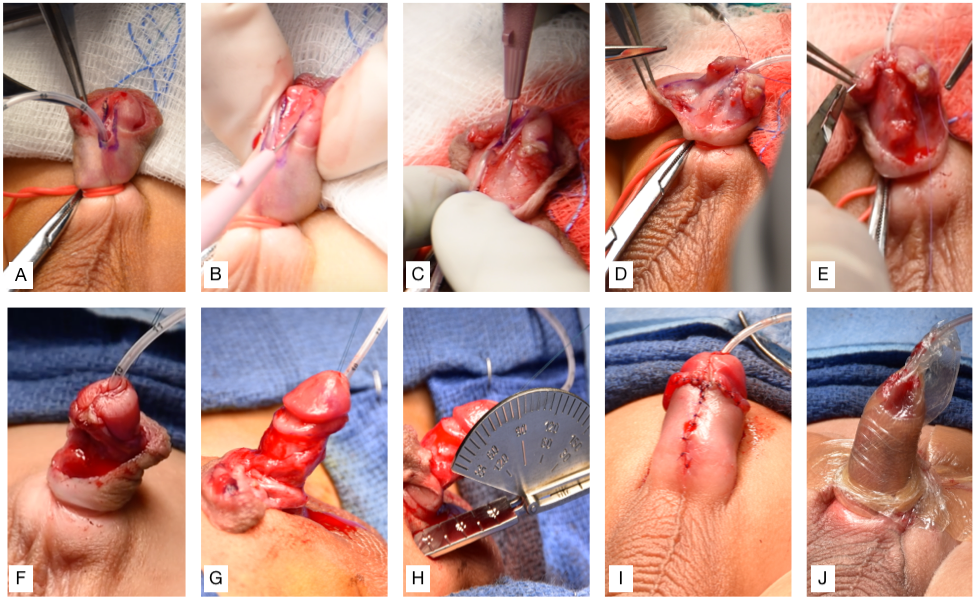
Figura 3 (A) Inserção de sonda de alimentação 5-Fr através do meato hipospádico, colocação de pontos de reparo em ambos os lados do futuro meato distal e aplicação do torniquete peniano. (B) Incisões verticais em cada borda da placa uretral, seguidas de incisão transversal conectando-as. (C) Separação do retalho da glande e incisão mediana da placa uretral. (D) Uretroplastia. (E) O retalho de Dartos é utilizado para cobrir a linha de sutura. (F) A glansplastia é concluída pela reaproximação do retalho da glande. (G) Desenluvamento do pênis. (H) Circuncisão e avaliação do grau de curvatura (chordee) usando um goniômetro. (I) Reaproximação da pele ventral. (J) Fixação da sonda de alimentação à glande e curativo aplicado para manter o pênis elevado.
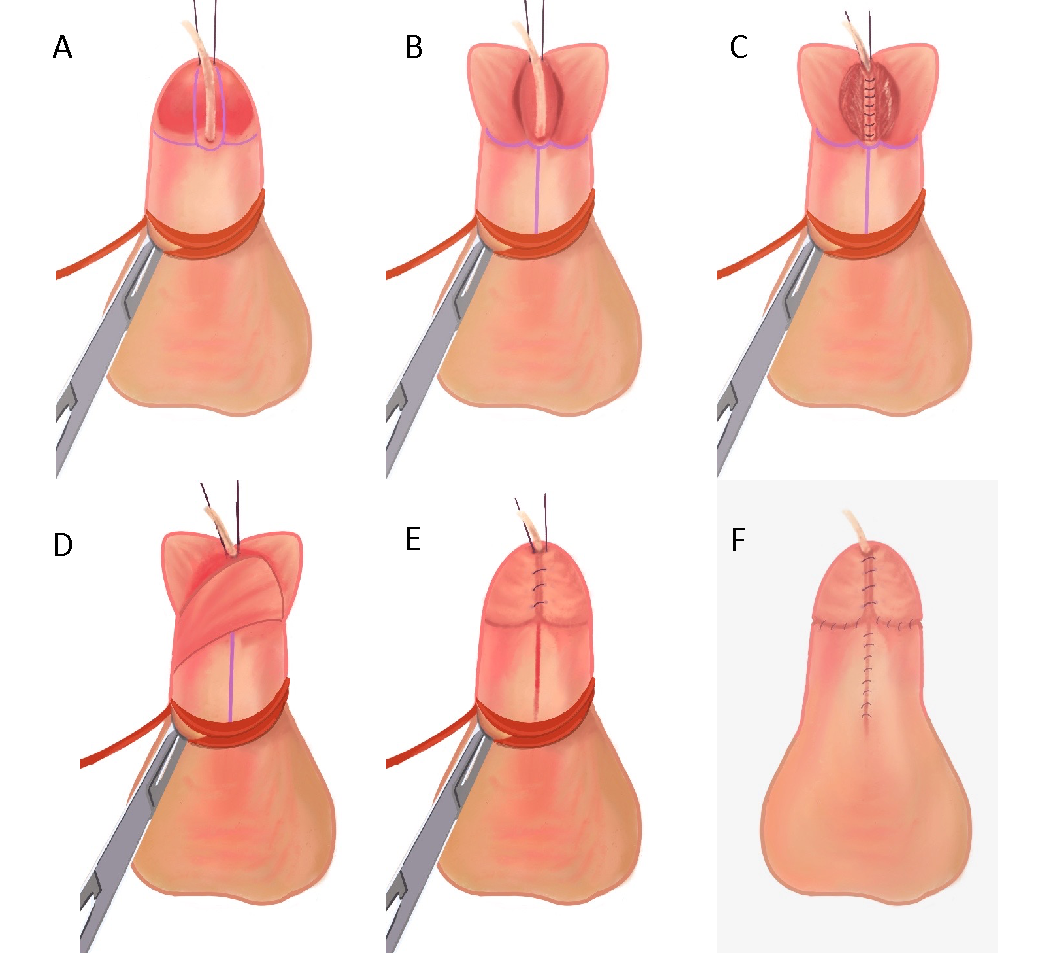
Figura 4 (A) Sonda de alimentação 5-Fr inserida através do meato hipospádico, pontos de reparo colocados em ambos os lados do futuro meato distal e torniquete peniano em posição. (B) Incisões verticais em cada borda da placa uretral, seguidas de incisão transversal conectando as duas. Os retalhos da glande são separados e a placa uretral na linha média é incisada. (C) Uretroplastia realizada com fio PDS 6-0 para fechamento subepitelial em uma única camada, com suturas contínuas sobre a sonda de alimentação 5-French. (D) Retalho de dartos é utilizado para cobrir a linha de sutura. (E) A glanuloplastia é concluída reaproximando-se o retalho da glande. (F) Reaproximação da pele ventral após desenluvamento e circuncisão.
A técnica da placa incisa e tubularizada (TIP) é amplamente aceita como o método de escolha para a correção da hipospádia distal. As correções de hipospádia em nossa instituição são realizadas utilizando uma variação da técnica TIP, na qual o retalho de dartos é colhido do aspecto lateral, e não do dorsal, do pênis, por ser nosso método preferido. Outras técnicas, como o procedimento de Mathieu, o reparo com retalho em ilha onlay de Duckett e o MAGPI, também são opções. Contudo, a abordagem TIP tem sido consistentemente relatada como apresentando baixas taxas de complicações, especialmente entre cirurgiões com alto volume de casos.52,53 Além das baixas taxas de complicações, os resultados estéticos após TIP foram avaliados e classificados como melhores quando comparados aos reparos com o procedimento de Mathieu e com o retalho em ilha onlay de Duckett.46 A cosmese favorável da abordagem TIP é atribuída à criação de um orifício uretral em fenda vertical, em oposição a um orifício uretral circular no procedimento de Mathieu. Há também variações nas técnicas de sutura da uretroplastia dentro do procedimento TIP, que podem ser realizadas com suturas interrompidas ou contínuas. Estudos comparativos de técnicas de uretroplastia com sutura interrompida versus contínua na correção de hipospádia distal não encontraram diferença significativa nas taxas de complicações, deixando, portanto, a escolha à preferência do cirurgião.48,54
Vídeo recomendado
Cuidados Pós-Operatórios e Acompanhamento
A correção de hipospádia na nossa instituição é realizada como procedimento ambulatorial e os pacientes recebem alta no mesmo dia. Cateterizamos todos os nossos pacientes com uma sonda de alimentação 5-French macia e a fixamos à glande com um ponto de fixação, que permanece no lugar por 5–7 dias. Há discussão sobre se a correção de hipospádia deve ser realizada com stent, como classicamente se faz para derivação urinária, ou sem stent, para prevenir espasmo vesical e o desconforto da retirada do stent. Uma meta-análise de ensaios clínicos randomizados e estudos de coorte comparou as taxas de complicações precoces (espasmo vesical, disúria, ITU, falha do stent, extravasamento de urina, sangramento, retenção urinária, etc.) e tardias (estenose meatal, estenose uretral, fístula, divertículo, deiscência da glande e outras taxas de reoperação) após correção TIP de hipospádia distal com stent vs sem stent.55 Não houve diferenças significativas nas taxas de complicações precoces ou tardias entre as correções TIP com e sem stent na meta-análise geral e no conjunto de ECR; no entanto, a evidência foi considerada de qualidade baixa a moderada. São necessários mais ECR para realmente determinar seu impacto na correção de hipospádia distal.
Curativos são frequentemente usados para otimizar a cicatrização pós-operatória, promovendo imobilização, proteção do local cirúrgico, adesão tecidual e compressão.56 Atualmente, não há consenso sobre o tipo de curativo mais eficaz, ou mesmo se a aplicação de um curativo traz algum benefício. Um ensaio randomizado não encontrou diferença significativa nas taxas de complicações ou nos desfechos clínicos ao comparar pacientes com e sem curativo após correção de hipospádia.56 Vale notar que houve aumento significativo de ligações pós-operatórias por parte dos pais no grupo sem curativo. Aplicamos um curativo hidrocoloide compressivo seguido de uma faixa adesiva que mantém o pênis elevado para minimizar o edema. No caso de pacientes que ainda não são treinados para o toalete, recomendamos fraldas duplas enquanto o cateter estiver no lugar. Fazemos um orifício na fralda interna para permitir a passagem do cateter e a drenagem para a fralda externa. O cateter e o curativo são removidos na primeira consulta de seguimento pós-operatório do paciente, após 5–7 dias. Se o paciente é treinado para o toalete, mantemos a sonda de alimentação e drenamos para fraldas de treinamento (pull-ups) ou usamos um cateter suprapúbico para drenagem urinária, mas nunca colocamos um cateter de Foley. Prescrevemos TMP-SMX oral 2 mg/kg ao dia durante o período de uso do cateter. Também prescrevemos oxibutinina 0.2 mg/kg duas vezes ao dia até a retirada do cateter para prevenir espasmos vesicais.
O bloqueio caudal pré-operatório ajuda a atenuar a dor pós-operatória. O controle adicional da dor é geralmente obtido com baixas doses de analgésicos anti-inflamatórios não esteroides (AINEs). Embora haja variação na prescrição de opioides para crianças após correção de hipospádia, os urologistas pediátricos têm-se afastado dessa prática. Uma iniciativa de melhoria da qualidade utilizando educação e um esquema analgésico não opioide predeterminado teve sucesso em reduzir as prescrições de opioides após correção de hipospádia.57 Observaram desfechos equivalentes de dor e de função usando paracetamol e ibuprofeno em alternância, sugerindo que os opioides podem ser omitidos com segurança, ainda assim alcançando um controle pós-operatório da dor adequado.57 Nenhum dos nossos pacientes recebe opioides, pois buscamos minimizar a exposição a opioides em crianças.
Nosso cronograma de seguimento pós-operatório prevê retorno à clínica com uma semana (para retirada do curativo) e, depois, novamente com um, três, seis e doze meses. Os pacientes também são agendados para retornar à clínica pelo menos uma vez após o treinamento esfincteriano. Enfatizamos aos pais a importância do seguimento pós-operatório para otimizar os desfechos e a satisfação do paciente, especialmente porque complicações podem se manifestar muitos anos após o reparo.58
Complicações
A maioria dos pacientes que se submetem à correção de hipospádia distal obtém desfechos cirúrgicos bem-sucedidos. No entanto, alguns pacientes podem desenvolver complicações pós-operatórias que podem exigir reintervenção. Complicações precoces que podem ocorrer incluem sangramento, infecção, deiscência, deslocamento do cateter e obstrução urinária. Complicações tardias que podem se desenvolver incluem fístula uretrocutânea, estenose meatal, deiscência da glande, estenose da neouretra, divertículo uretral e balanite xerótica obliterante (BXO).50
Uma revisão sistemática composta por 1872 pacientes que foram submetidos à correção de hipospádia distal usando a técnica TIP em 15 séries de casos encontrou uma taxa de fístula uretrocutânea de 3.8%, taxa de estenose meatal de 3.1% e taxa de estenose da neouretra de 0%.59 Outra revisão sistemática de 624 pacientes que foram submetidos à correção de hipospádia distal usando a técnica TIP em 16 estudos encontrou uma taxa de fístula uretrocutânea de 11.1%, taxa de estenose meatal de 6.7% e taxa de deiscência de 4.2%.60 Complicações como essas muitas vezes exigem reintervenção cirúrgica para evitar a piora da gravidade do problema. Notadamente, as correções distais primárias apresentam menores taxas de reoperação quando comparadas às correções secundárias e às correções proximais primárias.61 Ao planejar uma reoperação, é importante aguardar pelo menos 6 meses após a operação inicial para permitir uma cicatrização tecidual adequada.
Pontos-chave
- A hipospádia é uma das anomalias congênitas mais comuns em recém-nascidos do sexo masculino, ocorrendo em cerca de 1:200-300 nascidos vivos.
- A fusão interrompida das pregas uretrais resulta no meato uretral localizado na face ventral do pênis.
- Hipótese dos dois golpes: a exposição ambiental a disruptores endócrinos potencializa os efeitos da predisposição genética para hipospádia.
- Duas aberturas uretrais ao exame: 1) uma fosseta uretral cega na localização glandar normal e 2) uma abertura do meato uretral verdadeiro na face ventral do pênis.
- Outras características clássicas associadas à hipospádia incluem prepúcio em capuz dorsal e curvatura peniana ventral.
- A correção da hipospádia pode ser realizada a partir dos 6 meses de idade.
- A técnica da placa uretral incisada tubularizada (TIP) é amplamente aceita como o método de escolha para a correção da hipospádia distal.
- As complicações mais comuns da correção da hipospádia incluem fístula uretrocutânea, estenose meatal, deiscência da glande e estenose da neouretra, embora as taxas sejam baixas nas correções distais.
Conclusão
A hipospádia é uma das anomalias congénitas mais comuns em recém-nascidos do sexo masculino. Deve-se a um desenvolvimento peniano interrompido que resulta em falha na fusão adequada das pregas uretrais. A hipospádia é atribuída a uma etiologia multifatorial derivada de predisposição genética e exposições ambientais. Uma história clínica detalhada e um exame físico minucioso devem ser realizados para estabelecer adequadamente o diagnóstico de hipospádia e avaliar as características de risco do doente. A correção cirúrgica pode ser realizada a partir dos 6 meses de idade e é habitualmente efetuada usando a técnica da placa incisa tubularizada. Embora a correção da hipospádia distal seja consistentemente reportada como tendo excelentes resultados, é necessário seguimento a longo prazo para monitorizar complicações e assegurar a satisfação do doente.
Recursos para Pacientes
Leituras recomendadas
- HJR H, LL W. Hypospadias, all there is to know. Eur J Pediatr 2017; 176 (4): 435–441. DOI: 10.1007/s00431-017-2864-5.
- Baskin L. What Is Hypospadias? Clin Pediatr (Phila. 2017; 56 (5): 409–418.
- Snodgrass WT, Bush NC, Wein AJ, Kavoussi LR, Partin AW, Peters C. Chapter 147. Hypospadias. Eleventh, Philadelphia, PA: Elsevier; 2016.
Referências
- Laios K, Karamanou M, Androutsos G. A unique representation of hypospadias in ancient Greek art. Can Urol Assoc J 2012; 6 (1). DOI: 10.5489/cuaj.382.
- Baskin LS, Ebbers MB. Hypospadias: anatomy, etiology, and technique. Journal of Pediatric Surgery 2006; 41 (3): 463–472. DOI: 10.1016/j.jpedsurg.2005.11.059.
- Schneuer FJ, Holland AJA, Pereira G, Bower C, Nassar N. Prevalence, repairs and complications of hypospadias: an Australian population-based study. Arch Dis Child 2015; 100 (11): 1038–1043. DOI: 10.1136/archdischild-2015-308809.
- Newborn Clinical Guideline - Hypospadias [Internet. .
- Blaschko SD, Cunha GR, Baskin LS. Molecular Mechanisms of External Genitalia Development. Differentiation 2012; 84 (3): 261–268. DOI: 10.1016/j.diff.2012.06.003.
- Baskin L, Shen J, Sinclair A. Development of the Human Penis and Clitoris. Differentiation 2018; 103: 74–85. DOI: 10.1016/j.diff.2018.08.001.
- Cunha GR, Liu G, Sinclair A. Androgen-independent events in penile development in humans and animals. Differentiation 2020; 111: 98–114. DOI: 10.1016/j.diff.2019.07.005.
- Liu X, Liu G, Shen J. Human Glans and Preputial Development. Differentiation 2018; 103: 86–99. DOI: 10.1016/j.diff.2018.08.002.
- Li Y, Sinclair A, Cao M. Canalization of the Urethral Plate Precedes Fusion of the Urethral Folds during Male Penile Urethral Development: The Double Zipper Hypothesis. J Urol 2015; 193 (4): 1353–1360. DOI: 10.1016/j.juro.2014.09.108.
- Baskin LS, Erol A, Jegatheesan P, Li Y, Liu W, Cunha GR. Urethral seam formation and hypospadias. Cell Tissue Res 2001; 305 (3): 379–387. DOI: 10.1007/s004410000345.
- Baskin LS, Himes K, Colborn T. Hypospadias and endocrine disruption: is there a connection? Environ Health Perspect 2001; 109 (11): 1175–1183. DOI: 10.1289/ehp.011091175.
- Baskin L. What Is Hypospadias? Clin Pediatr (Phila. 2017; 56 (5): 409–418.
- Bergman J, Loane M, Vrijheid M. Epidemiology of hypospadias in Europe: a registry-based study. World Journal of Urology 2015; 33. DOI: 10.1007/s00345-015-1507-6.
- Li Y, Mao M, Dai L. Time trends and geographic variations in the prevalence of hypospadias in China. Birth Defects Research Part A: Clinical And Molecular Teratology 2012; 94 (1): 36–41. DOI: 10.1002/bdra.22854.
- S CK, S KK, Y PH. Trends in the incidence of cryptorchidism and hypospadias of registry-based data in Korea: a comparison between industrialized areas of petrochemical estates and a non-industrialized area. Asian J Androl 2011; 13 (5): 715–718. DOI: 10.1038/aja.2010.53.
- Springer A, Heijkant M, Baumann S. Worldwide prevalence of hypospadias. Journal of Pediatric Urology 2016; 12 (3). DOI: 10.1016/j.jpurol.2015.12.002.
- Paulozzi LJ, Erickson JD, Jackson RJ. Hypospadias Trends in Two US Surveillance Systems. Pediatrics 1997; 100 (5): 831–834. DOI: 10.1016/s0022-5347(01)63643-7.
- Porter MP, Faizan MK, Grady RW, Mueller BA. Hypospadias in Washington State: maternal risk factors and prevalence trends. Pediatrics 2005; 115 (4). DOI: 10.1542/peds.2004-1552.
- Brouwers MM, Feitz WFJ, Roelofs LAJ, Kiemeney LALM, Gier RPE, Roeleveld N. Risk factors for hypospadias. Eur J Pediatr 2007; 166 (7): 671–678. DOI: 10.1007/s00431-006-0304-z.
- Carmichael SL, Shaw GM, Laurent C, Croughan MS, Olney RS, Lammer EJ. Maternal progestin intake and risk of hypospadias. Arch Pediatr Adolesc Med 2005; 159 (10): 957–962. DOI: 10.1016/s0084-4071(08)70428-7.
- Baskin LS. Can we prevent hypospadias? Journal of Pediatric Urology 2007; 3 (6): 420–425. DOI: 10.1016/j.fertnstert.2007.12.024.
- Carmichael SL, Ma C, Choudhry S, Lammer EJ, Witte JS, Shaw GM. Hypospadias and genes related to genital tubercle and early urethral development. J Urol 2013; 190 (5): 1884–1892. DOI: 10.1016/j.juro.2013.05.061.
- Ollivier M, Paris F, Philibert P. Family History is Underestimated in Children with Isolated Hypospadias: A French Multicenter Report of 88 Families. J Urol 2018; 200 (4): 890–894. DOI: 10.1016/j.juro.2018.04.072.
- LFM Z, LM, WFJ F, B F, M KNV, N R. Aetiology of hypospadias: a systematic review of genes and environment. Hum Reprod Update 2012; 18 (3): 260–283. DOI: 10.1093/humupd/dms002.
- HJR H, LL W. Hypospadias, all there is to know. Eur J Pediatr 2017; 176 (4): 435–441. DOI: 10.1007/s00431-017-2864-5.
- Paulozzi LJ. International trends in rates of hypospadias and cryptorchidism. Environ Health Perspect 1999; 107 (4): 297–302. DOI: 10.1289/ehp.99107297.
- Lund L, Engebjerg MC, Pedersen L, Ehrenstein V, Nørgaard M, Sørensen HT. Prevalence of hypospadias in Danish boys: a longitudinal study, 1977-2005. Eur Urol 2009; 55 (5): 1022–1026. DOI: 10.1016/s8756-5005(09)79126-7.
- Abdullah NA, Pearce MS, Parker L, Wilkinson J JR, B MN, R.J.Q.. Birth prevalence of cryptorchidism and hypospadias in northern England, 1993-2000. Arch Dis Child 2007; 92 (7): 576–579. DOI: 10.1136/adc.2006.102913.
- Nassar N, Bower C, Barker A. Increasing prevalence of hypospadias in Western Australia, 1980-2000. Arch Dis Child 2007; 92 (7): 580–584. DOI: 10.1136/adc.2006.112862.
- Choudhry S, Baskin LS, Lammer EJ. Genetic polymorphisms in ESR1 and ESR2 genes, and risk of hypospadias in a multiethnic study population. J Urol 2015; 193 (5): 1625–1631. DOI: 10.1016/j.juro.2014.11.087.
- Kalfa N, Liu B, Klein O, Wang M-H, Cao M, Baskin LS. Genomic variants of ATF3 in patients with hypospadias. J Urol 2008; 180 (5): 2188.
- Liu B, Wang Z, Lin G. Activating transcription factor 3 is up-regulated in patients with hypospadias. Pediatr Res 2005; 58 (6): 1280–1283. DOI: 10.1203/01.pdr.0000187796.28007.2d.
- Wang Z, Liu BC, Lin GT. Up-Regulation of Estrogen Responsive Genes in Hypospadias: Microarray Analysis. The Journal of Urology 2007; 177 (5): 1939–1946. DOI: 10.1016/j.juro.2007.01.014.
- Qiao L, Tasian GE, Zhang H. Androgen receptor is overexpressed in boys with severe hypospadias, and ZEB1 regulates androgen receptor expression in human foreskin cells. Pediatr Res 2012; 71 (4 Pt 1): 393–398. DOI: 10.1016/j.yuro.2012.07.021.
- Kojima Y, Koguchi T, Mizuno K. Single Nucleotide Polymorphisms of HAAO and IRX6 Genes as Risk Factors for Hypospadias. J Urol 2019; 201 (2): 386–392.
- Kim K, Liu W, Cunha GR. Expression of the androgen receptor and 5α-reductase type 2 in the developing human fetal penis and urethra. Cell Tissue Res 2002; 307 (2): 145–153. DOI: 10.1007/s004410100464.
- Edery P. Genetics of hypospadias. Dialogues Pediatr Urol 2007; 28: 3–6. DOI: 10.1016/j.jpurol.2007.01.087.
- Poon S, Koren G, Carnevale A. Association of In Utero Exposure to Polybrominated Diphenyl Ethers With the Risk of Hypospadias. JAMA Pediatr 2018; 172 (9): 851–856. DOI: 10.1001/jamapediatrics.2018.1492.
- Snodgrass WT, Bush NC, Wein AJ, Kavoussi LR, Partin AW, Peters C. Chapter 147. Hypospadias. Eleventh, Philadelphia, PA: Elsevier; 2016.
- Tasian GE, Zaid H, Cabana MD, Baskin LS. Proximal hypospadias and risk of acquired cryptorchidism. J Urol 2010; 184 (2): 715–720. DOI: 10.1016/j.juro.2010.03.056.
- Fichtner J, Filipas D, Mottrie AM, Voges GE, Hohenfellner R. Analysis of meatal location in 500 men: wide variation questions need for meatal advancement in all pediatric anterior hypospadias cases. J Urol 1995; 154 (2 Pt 2): 833–834. DOI: 10.1016/s0022-5347(01)67177-5.
- Dodds PR, Batter SJ, Shield DE, Serels G SR, FA M, P.K.. Adaptation of Adults to Uncorrected Hypospadias. Urology 2008; 71 (4): 682–685. DOI: 10.1016/j.urology.2007.07.078.
- Schlomer B, Breyer B, Copp H, Baskin L, DiSandro M. Do adult men with untreated hypospadias have adverse outcomes? A pilot study using a social media advertised survey. J Pediatr Urol 2014; 10 (4): 672–679. DOI: 10.1016/j.jpurol.2014.01.024.
- Timing of elective surgery on the genitalia of male children with particular reference to the risks, benefits, and psychological effects of surgery and anesthesia. American Academy of Pediatrics; 1996, DOI: 10.1542/peds.97.4.590.
- Adler AC, Chandrakantan A, Sawires Y. Analysis of 1478 Cases of Hypospadias Repair. The Incidence of Requiring Repeated Anesthetic Exposure as Well as Exploration of the Involvement of Trainees on Case Duration. Anesth Analg 2019.
- Wright I, Cole E, Farrokhyar F, Pemberton J, Lorenzo AJ, Braga LH. Effect of preoperative hormonal stimulation on postoperative complication rates after proximal hypospadias repair: a systematic review. J Urol 2013; 190 (2): 652–659. DOI: 10.1016/j.juro.2013.02.3234.
- Hsieh MH, Wildenfels P, Gonzales ET. Surgical antibiotic practices among pediatric urologists in the United States. Journal of Pediatric Urology 2011; 7 (2): 192–197. DOI: 10.1016/j.jpurol.2010.05.001.
- Smith J, Patel A, Zamilpa I. Analysis of preoperative antibiotic prophylaxis in stented, distal hypospadias repair. Can J Urol 2017; 24 (2): 8765–8769.
- Baillargeon E, Duan K, Brzezinski A. The role of preoperative prophylactic antibiotics in hypospadias repair. Can Urol Assoc J 2014; 8 (7-8): 236–240. DOI: 10.5489/cuaj.1838.
- Chua ME, Kim JK, Rivera KC. The use of postoperative prophylactic antibiotics in stented distal hypospadias repair: a systematic review and meta-analysis. Journal of Pediatric Urology 2019; 15 (2): 138–148. DOI: 10.1016/j.jpurol.2018.10.012.
- Cheng EY, Faasse MA. Trimethoprim-sulfamethoxazole vs. Placebo After Hypospadias Repair: a Multicenter, Double-blind. Randomized Trial [Internet] Clinicaltrialsgov 2018.
- Zhu C, Wei R, Tong Y. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Tanseco PP, Randhawa H, Chua ME. Postoperative complications of hypospadias repair in patients receiving caudal block vs. non-caudal anesthesia: A meta-analysis. Can Urol Assoc J 2019; 13 (8). DOI: 10.5489/cuaj.5688.
- Deibert CM, Hensle TW. The psychosexual aspects of hypospadias repair: A review. Arab J Urol 2011; 9 (4): 279–282. DOI: 10.1016/j.aju.2011.10.004.
- Ververidis M, Dickson AP, Gough DCS. An objective assessment of the results of hypospadias surgery. BJU Int 2005; 96 (1): 135–139. DOI: 10.1111/j.1464-410x.2005.05582.x.
- Snodgrass W. Tubularized, incised plate urethroplasty for distal hypospadias. J Urol 1994; 151 (2): 464–465. DOI: 10.1016/s0022-5347(17)34991-1.
- Snodgrass WT, Bush N, Cost N. Tubularized incised plate hypospadias repair for distal hypospadias. Journal of Pediatric Urology 2010; 6 (4): 408–413. DOI: 10.1016/j.jpurol.2009.09.010.
- Snodgrass WT. Snodgrass technique for hypospadias repair. BJU Int 2005; 95 (4): 683–693. DOI: 10.1111/j.1464-410x.2005.05384.x.
- Barashi NS, Gundeti MS. Chapter 15. Surgical Reconstructions of Distal Hypospadias: The University of Chicago Experience. Gundeti MS. Surgical Techniques in Pediatric and Adolescent Urology. Jaypee Brothers,Medical Publishers Pvt. Limited; 2019.
- Herrera O, Mostafa S, Lomba T. A 10-step procedure for distal hypospadias repair with 50% resident involvement is safe and effective. Urology Video Journal 2021; 11 (100094). DOI: 10.1016/j.urolvj.2021.100094.
- Nguyen MT, Snodgrass WT, Zaontz MR. Effect of urethral plate characteristics on tubularized incised plate urethroplasty. J Urol 1262; 2004;171(3):1260-2. DOI: 10.1097/01.ju.0000110426.32005.91.
- Braga LHP, Lorenzo AJ, Salle JLP. Tubularized incised plate urethroplasty for distal hypospadias: A literature review. Indian J Urol 2008; 24 (2): 219–225. DOI: 10.4103/0970-1591.40619.
- Gupta A, Gupta R, Srivastav P. Comparison of interrupted- and continuous-suture urethroplasty in tubularised incised-plate hypospadias repair: A prospective study. Arab J Urol 2017; 15 (4): 312–318. DOI: 10.1016/j.aju.2017.10.004.
- Chua M, Welsh C, Amir B. Non-stented versus stented urethroplasty for distal hypospadias repair: A systematic review and meta-analysis. Journal of Pediatric Urology 2018; 14 (3): 212–219. DOI: 10.1016/j.jpurol.2017.11.023.
- JG S, LG P, BL S. A prospective randomized trial of dressings versus no dressings for hypospadias repair. Journal of Urology 2000; 164 (3 Part 2): 981–983. DOI: 10.1016/s0022-5347(05)67231-x.
- O’Kelly F, Pokarowski M, DeCotiis KN. Structured opioid-free protocol following outpatient hypospadias repair - A prospective SQUIRE 2.0-compliant quality improvement initiative. Journal of Pediatric Urology 2020; 16 (5). DOI: 10.1016/j.jpurol.2020.06.012.
- Lucas J, Hightower T, Weiss DA. Time to Complication Detection after Primary Pediatric Hypospadias Repair: A Large, Single Center, Retrospective Cohort Analysis. J Urol 2020; 204 (2): 338–344. DOI: 10.1097/ju.0000000000000762.
- Wilkinson DJ, Farrelly P, Kenny SE. Outcomes in distal hypospadias: A systematic review of the Mathieu and tubularized incised plate repairs. Journal of Pediatric Urology 2012; 8 (3): 307–312. DOI: 10.1016/j.jpurol.2010.11.008.
- Zhang Y, Shen Z, Zhou X. Comparison of meatal-based flap (Mathieu) and tubularized incised-plate (TIP) urethroplasties for primary distal hypospadias: A systematic review and meta-analysis. Journal of Pediatric Surgery 2020. DOI: 10.1016/j.jpedsurg.2020.03.013.
- Pfistermuller KLM, McArdle AJ, Cuckow PM. Meta-analysis of complication rates of the tubularized incised plate (TIP) repair. J Pediatr Urol 2015; 11 (2): 54–59. DOI: 10.1016/j.jpurol.2014.12.006.
Ultima atualização: 2025-09-21 13:35