28: Testículo não descido
Este capítulo levará aproximadamente 18 minutos para ler.
Introdução
Testículo não descido (TND) refere-se à condição em que o testículo não se encontra no escroto, mas em uma localização anormal, como na cavidade abdominal da virilha (Figura 1) Os testículos se formam e permanecem na cavidade abdominal por um período durante a vida fetal e, então, descem gradualmente até o escroto. A criptorquidia inclui testículos não descidos localizados em qualquer ponto do trajeto normal do processo de descida e testículos ectópicos, que não seguem o trajeto habitual da descida testicular. O testículo não descido deve ser diferenciado do testículo retrátil. Um testículo retrátil é um testículo localizado abaixo do anel inguinal externo, mas que pode ser manipulado para a porção superior do escroto e tem tendência a ascender à sua posição original e/ou é um testículo que concluiu seu processo normal de descida e pode permanecer no escroto, mas que se desloca facilmente para frente e para trás entre o escroto e a virilha (Vídeo 1).
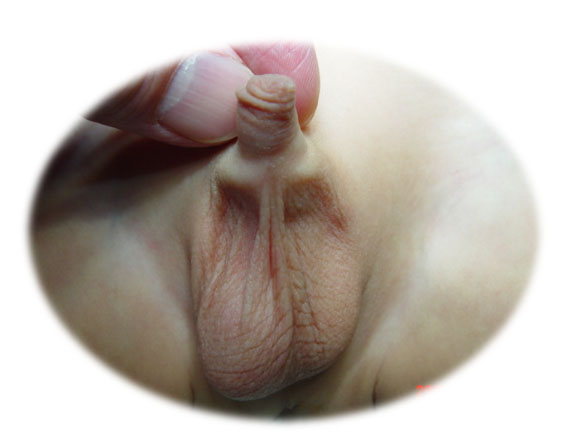
Figura 1 Escroto vazio no lado esquerdo em um paciente com testículo não descido.
Vídeo 1 Demonstração de um testículo retrátil.
Epidemiologia
O testículo não descido é uma das anomalias congênitas mais comuns do recém-nascido do sexo masculino. O risco de testículos não descidos é 3.5 vezes maior em indivíduos do sexo masculino com um irmão com testículos não descidos, e 2.3 vezes maior naqueles com um pai com a condição.1 A incidência em neonatos a termo é relatada como 1.0–4.5% e os casos unilaterais são 2 vezes mais comuns do que os bilaterais.2 Cerca de 70% dos criptorquidas apresentam descida aos 3 meses de idade sob a influência da minipuberdade e a incidência de testículo não descido diminui para 0.8-1.2% com 1 ano de idade.3,4
Etiologia
Não há fatores de risco claros associados a (UDT), contudo o tabagismo materno durante a gestação, medidas ao nascimento, incluindo peso ao nascer e idade gestacional, história familiar de testículo não descido e variantes genéticas raras, como mutações em INSL3, têm sido associados ao testículo não descido. A descida testicular normal depende de um eixo hipotálamo-hipófise-gônadas (HPG) íntegro. Embora a etiologia exata ainda seja desconhecida, fatores genéticos, hormonais (disfunção do eixo HPG, hipogonadismo congênito, displasia testicular) e anatômicos (ducto deferente curto e vasos espermáticos) estão implicados. Peso ao nascer <2.5 kg, pequeno para a idade gestacional, prematuridade, baixos níveis maternos de estrogênio e insuficiência placentária, secreção reduzida de gonadotrofina coriônica humana (hCG) foram sugeridos como fatores de risco para testículo não descido. Além disso, a exposição a fatores ambientais, como exposição contínua a compostos organoclorados, monoésteres de ftalatos, tabagismo materno e diabetes materna, tem sido relatada como fator de risco para distúrbios do desenvolvimento em homens. No entanto, nenhum desses fatores foi considerado isoladamente responsável pela patogênese do testículo não descido.
Descida Testicular Normal
Os mamíferos podem ser divididos entre os que têm escroto e os que não têm. A hipótese geral para a evolução do escroto em alguns mamíferos é que ele fornece um ambiente mais frio, abaixo da temperatura corporal central, propício a uma melhor espermatogênese. No entanto, não há dados para apoiar ou refutar a hipótese térmica, porque alguns mamíferos conseguem reproduzir-se com testículos internos e algumas espécies sem escroto possuem mecanismos de resfriamento testicular.5,6 Uma taxa reduzida de mutações em células germinativas em temperaturas corporais mais baixas pode ter sido um fator impulsionador do desenvolvimento do escroto nos mamíferos. Alguns animais cujos testículos permanecem próximos ao rim na cavidade abdominal estendem o epidídimo para uma localização subcutânea, o que pode proporcionar um efeito de resfriamento durante o armazenamento e a maturação dos espermatozoides.7 Nesse caso, as localizações testiculares podem ter seguido a localização do epidídimo. Em humanos, a temperatura escrotal é mantida em um nível ótimo para a espermatogênese, cerca de 2,7 ℃ abaixo da temperatura corporal central.8
Embora os testículos e os ovários se originem dos mesmos tecidos embrionários adjacentes ao rim, os testículos empreendem a longa jornada para fora da cavidade abdominal.9 A descida testicular normal envolve uma fase transabdominal e uma fase inguinoescrotal, ambas ocorrendo no período pré-natal no ser humano. A descida transabdominal ocorre na 12ª semana de gestação, quando o testículo se desloca em direção ao anel inguinal profundo. Isso ocorre como uma combinação alternada de forças de empurrão e tração.10 Antes do início da descida, a gônada em desenvolvimento é ancorada pelo ligamento suspensor craniano e pelo ligamento gênito-inguinal caudal, ou gubernáculo.11 O gubernáculo distal aumenta de tamanho durante a fase transabdominal da descida, tornando o gubernáculo masculino curto e espesso. Essa reação de tumefação ancora o testículo ao canal inguinal (Figura 2) Os músculos da parede inguinal diferenciam-se ao redor do gubernáculo tumefeito, também chamado de bulbo, para formar o canal inguinal. Sabe-se que o hormônio semelhante à insulina 3 (INSL3) é o hormônio regulador da reação de tumefação.12,13,14 As células de Leydig do testículo secretam INSL3 para estimular a reação de tumefação e manter o testículo próximo à parede abdominal inguinal à medida que o abdome fetal cresce.14 Sugere-se também que o hormônio anti-Mülleriano (AMH), secretado pelas células de Sertoli do testículo, tenha um papel na descida testicular. Em crianças com mutações no gene do AMH ou em seu receptor, há criptorquidia com persistência de útero e trompas de Falópio infantis, conhecida como síndrome da persistência dos ductos müllerianos (PMDS).14
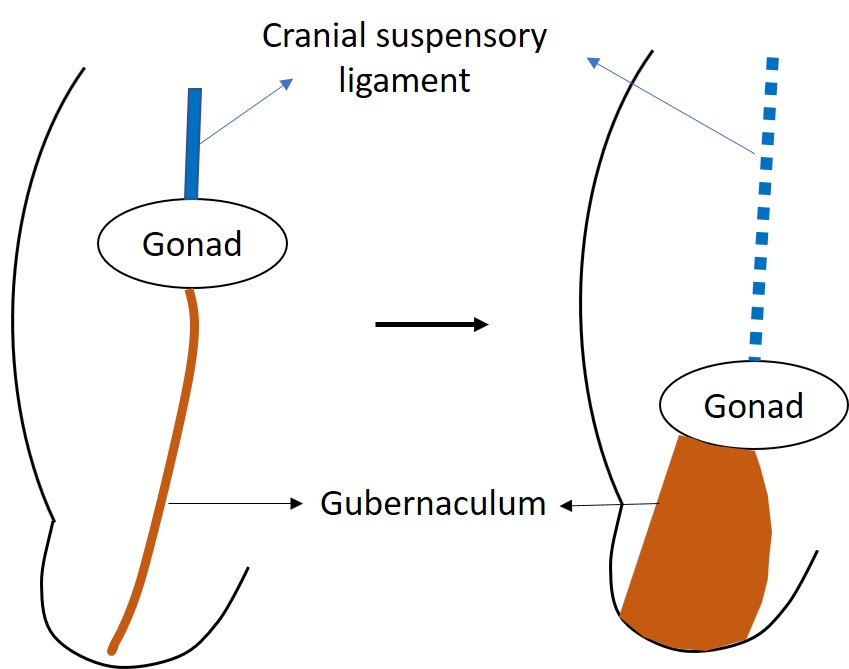
Figura 2 A gônada indiferenciada está inicialmente localizada alta no abdome, ancorada pelo ligamento suspensor craniano. INSL3 provoca o intumescimento e o aumento de volume do gubernáculo para tracionar o testículo em desenvolvimento em direção à região inguinal.
A fase inguinoescrotal da descida ocorre entre 25 e 35 semanas. O processo geral é bastante semelhante na maioria dos mamíferos.15 Durante essa etapa, os testículos atravessam o canal inguinal para finalmente se alojarem no escroto. O gubernáculo alonga-se em direção ao escroto juntamente com o processo vaginal. Após o gubernáculo atingir o escroto, o bulbo sofre reabsorção, deixando um remanescente fibroso aderido à face interna do escroto. A porção proximal do processo vaginal fecha-se para prevenir hérnia inguinal ou hidrocele no ser humano. Muitos outros mamíferos, como camundongos e ratos, apresentam um processo vaginal pérvio ao longo de toda a vida. No ser humano, o processo vaginal finalmente involui completamente e permite que o cordão espermático se alongue normalmente após o nascimento. A fase inguinoescrotal da descida testicular é controlada por andrógenos. Em modelos animais, constatou-se que, dependendo da ação androgênica, os ramos sensoriais do nervo genitofemoral controlam o desenvolvimento do gubernáculo, o qual é modulado pelo peptídeo relacionado ao gene da calcitonina (CGRP).
Classificação dos testículos não descidos
Em geral, os testículos não descendidos são classificados como palpáveis ou não palpáveis. O fato de os testículos serem ou não palpáveis determina os exames diagnósticos e a estratégia de tratamento, assim como o prognóstico. Os testículos são móveis pela contração do músculo cremáster. Portanto, a localização exata dos testículos deve ser avaliada antes dos 6 meses de idade, quando o reflexo cremastérico é fraco, ou sob anestesia geral. Cerca de 80% dos testículos não descendidos são palpáveis na região inguinal. Caso o testículo não seja palpável, ele pode localizar-se na cavidade abdominal ou corresponder a agenesia, atrofia ou testículo evanescente.
Patologia Associada
Desenvolvimento Anormal das Células Germinativas
O desenvolvimento histológico dos testículos criptorquídicos pré-púberes tem sido estudado em muitos estudos observacionais. Esses estudos fornecem evidências sólidas de que o desenvolvimento anormal das células germinativas está frequentemente presente após os primeiros meses de vida em testículos criptorquídicos. O número de espermatogônias por túbulo é reduzido após o período lactente e não aumenta normalmente com a idade em testículos criptorquídicos e, em menor grau, nos testículos escrotais contralaterais.16 Relata-se que a transformação de gonócitos em espermatogônias está prejudicada em testículos criptorquídicos. A proporção de gonócitos para espermatogônias parece ser normal em testículos criptorquídicos por volta de 1,5 meses de idade; observa-se atraso no desaparecimento dos gonócitos e no aparecimento de espermatogônias adultas escuras nos testículos criptorquídicos em comparação com os testículos escrotais contralaterais. Foi relatado que o testículo criptorquídico não é significativamente menor ao nascimento, mas cresce menos do que o testículo escrotal.17
Infertilidade
É bem conhecido que um antecedente de criptorquidia está associado à subfertilidade. Em uma série de estudos caso-controle bem desenhados sobre fertilidade na criptorquidia, que analisaram uma grande coorte de homens submetidos à orquidopexia e um grupo controle de idade semelhante, 65% dos com criptorquidia bilateral prévia, 90% dos com criptorquidia unilateral prévia e 93% dos controles alcançaram a paternidade.18,19 De acordo com os estudos que relataram a histologia testicular no momento da orquidopexia, o potencial de fertilidade foi maior quando a orquidopexia foi realizada antes de 1 ano de idade.20,21,22 Portanto, recomenda-se que a orquidopexia seja realizada antes de 1 ano de idade.
Risco de malignidade
O risco de tumor de células germinativas testicular em homens com história de criptorquidia é sabidamente aumentado. O risco relativo de transformação maligna em um testículo não descido é de 2.5 a 8 no geral e de 2 a 3 em meninos submetidos à orquidopexia pré-puberal.23 Cerca de 10% dos homens que apresentam tumor de células germinativas testicular têm história de criptorquidia. Em uma revisão da patologia tumoral em casos de criptorquidia tratada versus não tratada, o seminoma é mais comumente associado ao testículo persistentemente criptorquídico e o tumor de células germinativas não seminomatoso predomina nos testículos escrotais.23 Hoje foi demonstrado que isso não está relacionado, o autoexame testicular é recomendado para o rastreamento do câncer testicular, e deve ser ensinado a todos os pacientes com história de criptorquidia após atingirem a puberdade.
Hérnia
Mais de 90% dos casos de criptorquidia estão associados a processo vaginal pérvio e a hérnia pode ocorrer em 25%.
Anomalia do epidídimo
A prevalência de anomalias epididimárias na criptorquidia é relatada entre 32% e 72%.24 As anomalias epididimárias podem ocorrer devido à involução anormal do ducto mesonéfrico adjacente ao testículo normal.25 As anomalias de fusão epidídimo-testicular são relatadas como fortemente associadas a uma posição mais proximal do testículo. As anomalias epididimárias podem resultar em fertilidade comprometida devido a dificuldades no transporte e na maturação dos espermatozoides.26
Diagnóstico de Testículo Não Descido
Antes do exame físico, é essencial perguntar sobre parto prematuro, se a mãe está a usar hormonas femininas ou exposição a hormonas femininas, lesões do sistema nervoso central e antecedentes de cirurgias prévias na região inguinal. Deve investigar-se história familiar de outras anomalias congénitas ou infertilidade que acompanhem a criptorquidia. Como a palpabilidade na criptorquidia é mais importante do que a localização dos testículos, um exame físico cuidadoso é essencial. Em caso de dúvida, recomenda-se repetir o exame ou encaminhar para um especialista. Em particular, nos casos não palpáveis, é importante examinar sob anestesia antes da cirurgia. Para o método de exame físico, o ambiente deve estar aquecido. Depois, com o doente na posição de rã, verificar primeiro o tamanho, a localização e a superfície do testículo contralateral e, em seguida, com a mão aquecida, varrer da crista ilíaca do lado afetado até à sínfise púbica para determinar a presença e a localização do testículo. Se o testículo for palpável, deve também verificar-se se ele desce para o escroto.27 Se for difícil palpar, como num lactente rechonchudo ou numa criança obesa, coloque-o sentado com as pernas cruzadas ou em cócoras para o exame e aplique gel lubrificante nas mãos para melhor palpação dos testículos. Na ausência de um testículo, pode observar-se hipertrofia compensatória do testículo contralateral. Uma vez palpáveis os testículos, não há necessidade de exames adicionais, porque a exatidão diagnóstica da ecografia, tomografia computorizada ou ressonância magnética (RM) não é tão alta quanto a de urologistas experientes, e o tratamento raramente é diferente em função dos resultados dos exames de imagem. Os estudos de imagem não conseguem verificar com certeza se um testículo está presente ou não.28 Na prática clínica, ecografia ou RM só são recomendadas em casos selecionados com suspeita de DSD.29
Para testículos não palpáveis que não podem ser confirmados por exame físico e exame radiológico, realiza-se laparoscopia diagnóstica ou cirurgia exploratória por incisão inguinal ou escrotal. Convencionalmente, se um testículo ou um remanescente testicular fossem encontrados por exploração inguinal, procedia-se a orquiopexia ou orquiectomia. Com o advento da laparoscopia, tornou-se possível verificar a presença ou ausência de testículos, a sua localização e o estado do ducto deferente e dos vasos gonadais. Nos achados laparoscópicos, se os vasos testiculares terminam em fundo cego, pode-se diagnosticar como testículo evanescente e nenhuma conduta adicional é necessária. Se se observar que os vasos espermáticos penetram no anel inguinal interno, deve-se proceder a exploração inguinal ou escrotal.
Em caso de testículos não palpáveis bilaterais com qualquer sinal de DSD, como ambiguidade genital ou hipospádia grave, é obrigatória avaliação endocrinológica e genética adicional.30 Em crianças com menos de 3 meses de idade, dosam-se hormônio luteinizante (LH), hormônio folículo-estimulante (FSH) e testosterona. Em crianças com 3 meses de idade ou mais, recomenda-se o teste de estimulação com gonadotrofina coriônica humana (hCG). Se a testosterona for mal mensurável e LH e FSH estiverem elevados, pode-se avaliar como anorquidismo. No teste de estimulação com hCG, após injeção intramuscular de 2.000 UI de hCG por 3 dias, a testosterona sérica é medida no 5º dia. Contudo, devido à possibilidade de falso negativo, a confirmação cirúrgica é necessária para todas as crianças cujos níveis de gonadotrofinas estejam dentro da faixa normal sem palpação de ambos os testículos, independentemente de responderem ao teste de estimulação com hCG.
Tratamento do Testículo Não Descido
O objetivo do tratamento dos testículos não descidos é reduzir o risco de infertilidade, minimizando a degeneração histológica dos testículos por meio do posicionamento precoce dos testículos no escroto e facilitar a detecção do câncer testicular, cuja incidência é maior do que em testículos normalmente descendidos. Além disso, o objetivo secundário é corrigir as lesões associadas, prevenir complicações como a torção testicular, aliviar o impacto psicológico no paciente e melhorar o resultado estético. Até o momento, tem sido reconhecido que a orquidopexia não previne o câncer testicular, mas, recentemente, tem sido relatado que a cirurgia precoce pode reduzir o risco de câncer testicular. O momento do tratamento dos testículos não descidos é importante. A orquidopexia deve ser realizada após os 6 meses de idade e dentro do ano subsequente e, no mais tardar, até os dezoito meses de idade.31 A justificativa para essa cirurgia precoce é que a descida espontânea dos testículos após os 6 meses de idade é improvável, não há diferença significativa nos riscos da anestesia geral ou na técnica cirúrgica, e a possibilidade de dano histológico aos testículos aumenta após essa idade.31,32 E há também preocupações em relação a crianças com mais de 18 meses de idade que podem apresentar acentuada ansiedade de separação e medo de castração devido à cirurgia, o que pode impactar a saúde mental das crianças.
O tratamento cirúrgico, a orquidopexia, é o tratamento padrão para testículos não descidos, e a terapia hormonal pode ser utilizada seletivamente dependendo da localização e da condição dos testículos não descidos. Quando os testículos degeneram ou desaparecem e apenas remanescentes ou cotos testiculares são visíveis, ou quando testículos não descidos em adultos são anatomicamente e morfologicamente anormais, ou quando a fixação testicular é impossível, os testículos são removidos. A orquiectomia deve ser cuidadosamente indicada apenas quando o testículo contralateral é normal, e a orquidopexia contralateral é realizada simultaneamente para prevenir torção testicular. Como o testículo retrátil é uma variante normal, recomenda-se acompanhamento anual até a puberdade ou até que os testículos não migrem mais para cima.
Terapia hormonal para a descida testicular
A terapia hormonal para a descida testicular é um assunto controverso. No entanto, utilizam-se principalmente hCG, agonistas do hormônio liberador de LH (LHRH) ou agonistas do hormônio liberador de gonadotrofinas (GnRH). A justificativa para a terapia hormonal baseia-se em resultados experimentais de que testículos não descendidos resultam de uma anormalidade no eixo hipotálamo-hipófise-gonadal, que a descida testicular é regulada pelos andrógenos e que altas concentrações de metabólitos ativos sintetizados nos testículos estão envolvidas na patogênese da criptorquidia. A hCG atua diretamente sobre as células de Leydig, como o LH de origem hipofisária, ao passo que o GnRH aumenta a produção de testosterona no testículo por meio da secreção de LH através de estimulação hipotalâmica. Presume-se que o hormônio afete o cordão espermático e o músculo cremáster para induzir a descida natural dos testículos e aprimorar a fertilidade. No entanto, a taxa de sucesso da terapia hormonal com hCG ou GnRH é de apenas 20% e quase 20% desses testículos que desceram podem reascender posteriormente.33,34
Terapia hormonal para fertilidade
A terapia hormonal pode melhorar os índices de fertilidade e pode servir como complemento à orquidopexia.35,36 Relatou-se que homens tratados com GnRH na infância apresentaram melhores resultados no espermograma em comparação com homens submetidos apenas à orquidopexia ou ao tratamento com placebo.35 Por outro lado, há relatos de que a terapia com hCG pode ser prejudicial à espermatogénese futura, por aumentar a apoptose das células germinativas, provocar alterações inflamatórias nos testículos e reduzir o volume testicular na idade adulta.37 Ainda faltam evidências sobre o efeito a longo prazo do tratamento hormonal para a criptorquidia, e é difícil selecionar o melhor candidato com testículo não descido que possa beneficiar da terapia hormonal.
Tratamento Cirúrgico
Testículo Palpável
Na maioria dos casos de testículos não descendidos palpáveis, a orquidopexia é realizada por meio de uma incisão inguinal. O ponto mais importante na orquidopexia é assegurar comprimento suficiente para abaixar o testículo ao escroto sem tensão. A operação consiste nas seguintes quatro etapas. Primeiro, o testículo e o cordão espermático são separados dos tecidos adjacentes para garantir mobilidade. Em segundo lugar, realiza-se a ligadura alta para fechar o processo vaginal. E, em terceiro lugar, para abaixar o testículo ao fundo do escroto sem tensão, às vezes é necessária dissecção retroperitoneal adicional para separar o ducto deferente. Por fim, confecciona-se uma bolsa sub-dartos rasa no escroto ipsilateral, e os testículos são acomodados e fixados. Se o comprimento do cordão espermático não for suficiente com essas técnicas básicas, requer-se o método de Prentiss para reduzir a distância até o escroto, seccionando o vaso epigástrico inferior na porção inferior do canal inguinal ou passando o cordão espermático por baixo dele. Não tipicamente no UDT palpável, foi relatado o autotransplante do testículo utilizando técnica microcirúrgica para anastomosar a artéria testicular à artéria epigástrica (ver abaixo).
Testículo não palpável
Como a presença e a condição dos testículos são importantes na cirurgia de testículos não palpáveis, os testículos devem ser examinados novamente sob anestesia. Se continuarem não palpáveis, realiza-se exploração inguinal aberta ou laparoscopia diagnóstica. Os achados laparoscópicos de testículos não palpáveis são: primeiro, o vaso testicular desce através do anel inguinal interno. Nesse caso, realiza-se uma incisão na pele inguinal ou escrotal para explorar a presença do testículo. Se os testículos forem considerados normais, realiza-se orquidopexia. O segundo cenário é aquele em que o vaso testicular termina em fundo cego na cavidade abdominal, próximo ao anel inguinal interno, o que sugere testículo evanescente; assim, a operação é interrompida sem cirurgia adicional. Por fim, quando um testículo é encontrado na cavidade abdominal, a decisão cirúrgica é tomada com base no tamanho do testículo, na sua localização na cavidade abdominal, no comprimento dos vasos testiculares, na idade do paciente, no testículo contralateral e na experiência do cirurgião. Sabe-se que a taxa global de sucesso cirúrgico é de 67-84%.
A orquiopexia é realizada de uma entre três maneiras
Orquidopexia de Fowler-Stephens
Este é um procedimento que assegura o comprimento do cordão espermático por meio da ressecção do vaso sanguíneo espermático interno que contém a artéria testicular, e a sobrevivência do testículo passa a depender do suprimento sanguíneo da artéria cremastérica e da artéria do ducto deferente. A técnica em tempo único consiste na ressecção dos vasos espermáticos internos e na fixação dos testículos ao mesmo tempo. Na orquidopexia de Fowler-Stephens em dois tempos, os vasos espermáticos internos são ligados como operação primária, aumenta-se o aporte de vasos colaterais da cavidade abdominal para os testículos por pelo menos 6 meses e, então, os testículos são descidos para o escroto por uma operação secundária. A orquidopexia de Fowler-Stephens em tempo único ou em dois tempos pode ser realizada laparoscopicamente.
Orquiopexia laparoscópica
Como a cirurgia laparoscópica é realizada com um campo de visão ampliado, ela tem a vantagem de poder minimizar lesões aos vasos sanguíneos ao dissecar extensamente e de assegurar o trajeto mais curto de mobilização testicular (Figura 3) e (Vídeo 1). A orquidopexia laparoscópica inclui tanto um método em que o testículo é descido ao escroto preservando os vasos espermáticos internos quanto os métodos de Fowler-Stephens (Vídeo 2). Com o auxílio da laparoscopia, pode-se realizar autotransplante microcirúrgico.
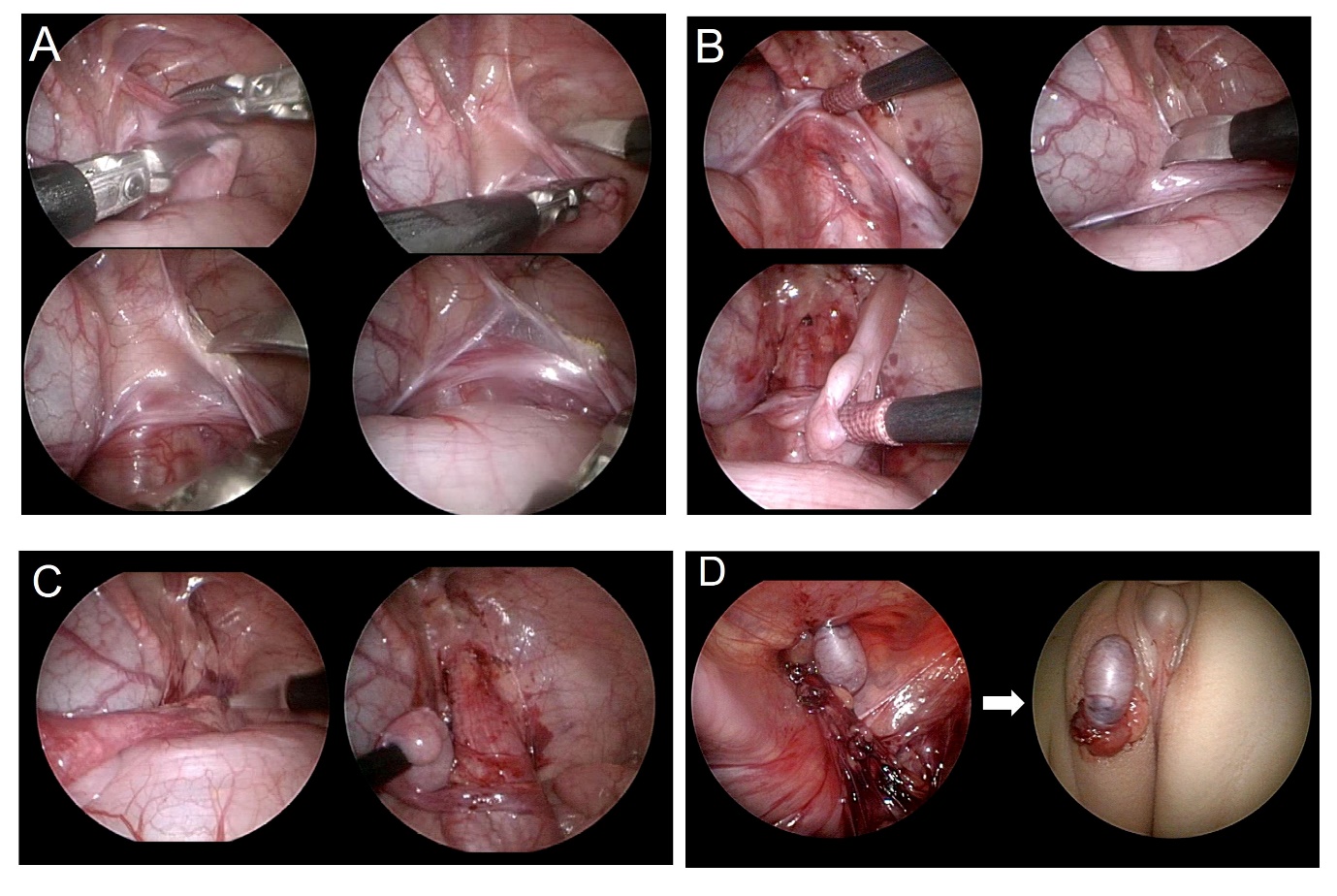
Figura 3 Imagens explicativas passo a passo da orquiopexia laparoscópica. (A) secção do gubernáculo, (B) dissecção do peritônio paralela ao ducto deferente, (C) incisão do peritônio paralela ao vaso espermático interno, (D) formação de neo-hiato e exteriorização do testículo do abdome para a bolsa escrotal.
Vídeo 2 Demonstração da orquidopexia de Fowler-Stephens.
Autotransplante utilizando microcirurgia
Este procedimento é realizado em casos especiais em que os testículos estão localizados profundamente na cavidade abdominal. Primeiro, os testículos e os cordões espermáticos são excisados, fixados no escroto e, em seguida, os vasos sanguíneos testiculares são conectados aos vasos sanguíneos da parede abdominal inferior por meio de microcirurgia para restabelecer o fluxo sanguíneo. Embora a taxa de sucesso seja relativamente alta, não é um método de escolha fácil, pois requer alto nível de habilidade e esforço para a conexão vascular por microcirurgia e exige um tratamento pós-operatório cuidadoso.
Orquiectomia
A orquiectomia é realizada quando não se pode esperar função testicular devido à atrofia testicular grave ou a anomalias morfológicas.
Complicações da Orquidopexia e Reoperação
As complicações da orquidopexia incluem retração testicular, hematoma, lesão do nervo ílioinguinal, torção do cordão espermático, lesão do ducto deferente ou atrofia testicular. A atrofia testicular é a complicação mais grave e ocorre após dissecção excessiva do cordão espermático ou uso excessivo de eletrocautério, torção dos vasos espermáticos, ou orquidopexia de Fowler Stephens quando o testículo é forçado para baixo sob tensão, comprometendo o suprimento sanguíneo. A retração testicular é geralmente causada por dissecção retroperitoneal insuficiente, e o testículo é tracionado para cima, acima do escroto, sob o anel inguinal externo ou próximo ao tubérculo púbico. Para reoperação, deve-se ter cuidado para evitar o sítio cirúrgico prévio e realizar uma incisão, abordar o tecido cicatricial a partir do tecido normal e remover o tecido cicatricial duro, incluindo tecido normal, de modo que os vasos espermáticos não sejam lesados, e então realizar a fixação testicular.
Pontos-chave
- Diretriz da AUA para criptorquidia afirma que a cirurgia para UDT é melhor realizada antes de 1 ano de idade
- A campanha Choosing Wisely, em cooperação com a AUA, optou por enfatizar que exames de imagem para UDT não devem ser realizados rotineiramente, pois a confirmação da posição testicular é melhor feita pelo exame físico ou, se necessário no caso de testículo não palpável, por laparoscopia.
- A orquiopexia inguinal ou escrotal tem alta taxa de sucesso e baixa taxa de complicações
- A orquiopexia laparoscópica está associada a taxas mais altas de atrofia testicular
Referências
- Hutson JM, Balic A, T N. Cryptorchidism. Semin Pediatr Surg 2010; 19: 215. DOI: 10.1002/bjs.1800760203.
- Ashley RA, JS B, Kolon TF. Cryptorchidism: pathogenesis, diagnosis, treatment and prognosis. Urol Clin North Am 2010; 37: 183. DOI: 10.1016/j.ucl.2010.03.002.
- Elder JS. The undescended testis. Hormonal and Surgical Management Surg Clin North Am 1988; 68: 983. DOI: 10.1515/iupac.88.1460.
- Sijstermans K, Hack WW, RW M. The frequency of undescended testis from birth to adulthood: a review. Int J Androl 2008; 31: 1. DOI: 10.1111/j.1365-2605.2008.00883.x.
- Werdelin L, Nilsonne A. The evolution of the scrotum and testicular descent in mammals: a phylogenetic view. J Theor Biol 1999; 196: 61. DOI: 10.1006/jtbi.1998.0821.
- Lovegrove BG. Cool sperm. why some placental mammals have a scrotum. J Evol Biol 2014; 27: 801. DOI: 10.1111/jeb.12373.
- Bedford JM. Anatomical evidence for the epididymis as the prime mover in the evolution of the scrotum. Am J Anat 1978; 152: 483. DOI: 10.1002/aja.1001520404.
- Momen MN, Ananian FB, IM F. Effect of high environmental temperature on semen parameters among fertile men. Fertil Steril 2010; 93: 1884. DOI: 10.1016/j.fertnstert.2008.12.065.
- Hutson JM, S H, Heyns CF. Anatomical and functional aspects of testicular descent and cryptorchidism. Endocr Rev 1997; 18: 259. DOI: 10.1210/er.18.2.259.
- Costa WS, Sampaio FJ, LA F. Testicular migration: remodeling of connective tissue and muscle cells in human gubernaculum testis. J Urol 2002; 167: 2171. DOI: 10.1097/00005392-200205000-00065.
- P S, W E. Perinatal development of gubernacular cones in rats and rabbits: effect of exposure to anti-androgens. Anat Rec 1993; 236: 399. DOI: 10.1002/ar.1092360214.
- Nef S, Parada LF. Cryptorchidism in mice mutant for Insl3. Nat Genet 1999; 22: 295. DOI: 10.1038/10364.
- Zimmermann S, Steding G, JM E. Targeted disruption of the Insl3 gene causes bilateral cryptorchidism. Mol Endocrinol 1999; 13: 681. DOI: 10.1210/mend.13.5.0272.
- Hutson JM, Li R, BR S. Regulation of testicular descent. Pediatr Surg Int 2015; 31: 317. DOI: 10.1007/s00383-015-3673-4.
- Hutson JM, Baskin LS, G R. The power and perils of animal models with urogenital anomalies: handle with care. J Pediatr Urol 2014; 10: 699. DOI: 10.1016/j.jpurol.2014.03.003.
- Gracia J, Sanchez Zalabardo J, J SG. Clinical, physical, sperm and hormonal data in 251 adults operated on for cryptorchidism in childhood. BJU Int 2000; 85: 1100. DOI: 10.1046/j.1464-410x.2000.00662.x.
- Kollin C, Hesser U, EM R. Testicular growth from birth to two years of age, and the effect of orchidopexy at age nine months: a randomized, controlled study. Acta Paediatr 2006; 95: 318. DOI: 10.1080/08035250500423812.
- Miller KD, MT C, Lee PA. Fertility after unilateral cryptorchidism. Paternity, time to conception, pretreatment testicular location and size, hormone and sperm parameters. Horm Res 2001; 55: 249.
- Lee PA, Coughlin MT. Fertility after bilateral cryptorchidism. Evaluation by paternity, hormone, and semen data. Horm Res 2001; 55: 28.
- Park KH, Lee JH, JJ H. Histological evidences suggest recommending orchiopexy within the first year of life for children with unilateral inguinal cryptorchid testis. Int J Urol 2007; 14: 616. DOI: 10.1111/j.1442-2042.2007.01788.x.
- Kogan SJ, Tennenbaum S, B G. Efficacy of orchiopexy by patient age 1 year for cryptorchidism. J Urol 1990; 144: 508. DOI: 10.1016/s0022-5347(17)39505-8.
- Tasian GE, Hittelman AB, GE K. Age at orchiopexy and testis palpability predict germ and Leydig cell loss: clinical predictors of adverse histological features of cryptorchidism. J Urol 2009; 182: 704. DOI: 10.1590/s1677-55382009000500033.
- Wood HM, Elder JS. Cryptorchidism and testicular cancer: separating fact from fiction. J Urol 2009; 181: 452. DOI: 10.1016/s0084-4071(09)79277-2.
- Caterino S, Lorenzon L, M C. Epididymal-testicular fusion anomalies in cryptorchidism are associated with proximal location of the undescended testis and with a widely patent processus vaginalis. J Anat 2014; 225: 473. DOI: 10.1111/joa.12222.
- Mollaeian M, V M, Elahi B. Significance of epididymal and ductal anomalies associated with undescended testis: study in 652 cases. Urology 1994; 43: 857. DOI: 10.1016/0090-4295(94)90152-x.
- Kim SO, Na SW, HS Y. Epididymal anomalies in boys with undescended testis or hydrocele: Significance of testicular location. BMC Urol 2015; 15: 108. DOI: 10.1186/s12894-015-0099-1.
- Cendron M, Huff DS, MA K. Anatomical, morphological and volumetric analysis: a review of 759 cases of testicular maldescent. J Urol 1993; 149: 570. DOI: 10.1016/s0022-5347(17)36151-7.
- Hrebinko RL, Bellinger MF. The limited role of imaging techniques in managing children with undescended testes. J Urol 1993; 150: 458. DOI: 10.1016/s0022-5347(17)35510-6.
- Tasian GE, Copp HL. Diagnostic performance of ultrasound in nonpalpable cryptorchidism: a systematic review and meta-analysis. Pediatrics 2011; 127: 119. DOI: 10.1016/j.yuro.2011.05.011.
- Elert A, Jahn K, A H. Population-based investigation of familial undescended testis and its association with other urogenital anomalies. J Pediatr Urol 2005; 1: 403. DOI: 10.1016/j.jpurol.2005.04.005.
- Engeler DS, Hosli PO, H J. Early orchiopexy: prepubertal intratubular germ cell neoplasia and fertility outcome. Urology 2000; 56: 144. DOI: 10.1016/s0090-4295(00)00560-4.
- Wenzler DL, DA B, Park JM. What is the rate of spontaneous testicular descent in infants with cryptorchidism? J Urol 2004; 171: 849. DOI: 10.1097/01.ju.0000106100.21225.d7.
- Pyorala S, NP H, Uhari M. A review and meta-analysis of hormonal treatment of cryptorchidism. J Clin Endocrinol Metab 1995; 80: 2795. DOI: 10.1210/jc.80.9.2795.
- Rajfer J, Walsh PC. The incidence of intersexuality in patients with hypospadias and cryptorchidism. J Urol 1976; 116: 769. DOI: 10.1016/0022-3468(77)90475-4.
- Hagberg S, Westphal O. Treatment of undescended testes with intranasal application of synthetic LH-RH. Eur J Pediatr 1982; 139: 285. DOI: 10.1007/bf00442181.
- Hadziselimovic F, Herzog B. Treatment with a luteinizing hormone-releasing hormone analogue after successful orchiopexy markedly improves the chance of fertility later in life. J Urol 1997; 158: 1193. DOI: 10.1097/00005392-199709000-00132.
- Cortes D, J T, Visfeldt J. Hormonal treatment may harm the germ cells in 1 to 3-year-old boys with cryptorchidism. J Urol 2000; 163: 1290. DOI: 10.1097/00005392-200004000-00070.
Ultima atualização: 2025-09-21 13:35