21: Complexo de Extrofia Vesical e Epispádias
Este capítulo levará aproximadamente 38 minutos para ler.
Introdução
A extrofia vesical é uma malformação geniturinária rara que, de forma simples, refere-se à eversão da bexiga para o exterior do corpo (Figura 1). Trata-se de uma malformação geniturinária rara cujo manejo ainda representa um desafio para a urologia pediátrica. De forma mais abrangente, o Complexo extrofia-epispádia engloba várias anomalias que vão desde epispádia isolada masculina ou feminina, extrofia vesical clássica e até extrofia cloacal.
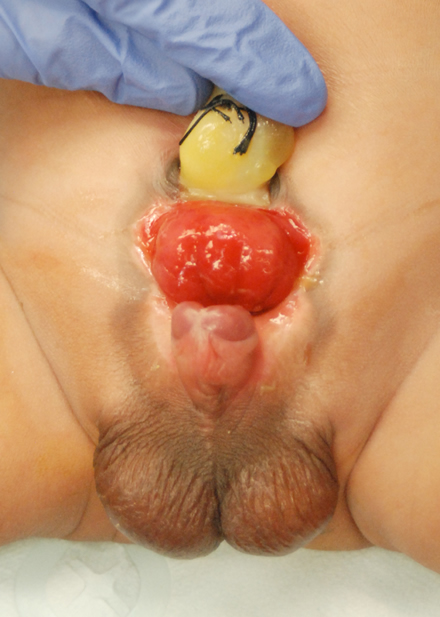
Figura 1 Recém-nascido do sexo masculino com extrofia vesical clássica.
Incidência
A incidência de extrofia vesical foi originalmente estimada entre 1:10.000 e 1:50.000 nascidos vivos. No entanto, dados mais recentes do sistema de monitoramento da International Clearinghouse for Birth Defects e da Healthcare Cost and Utilization Project Nationwide Inpatient Sample dos Estados Unidos estimaram a incidência em 2,15–3,3 por 100.000 nascidos vivos. Há predominância do sexo masculino, e a razão de homens para mulheres foi relatada entre 2,3–6:1.
Embriologia
A proliferação mesodérmica entre as camadas ectodérmica e endodérmica da membrana cloacal bilaminar resulta na formação da musculatura abdominal inferior e dos ossos pélvicos. Após ocorrer a proliferação mesenquimal, o crescimento descendente do septo urorretal divide a cloaca em bexiga anteriormente e reto posteriormente. Os tubérculos genitais migram medialmente e fundem-se na linha média, cranialmente à membrana dorsal, antes de sua perfuração. A membrana cloacal está sujeita a ruptura prematura, dependendo da extensão do defeito infraumbilical. O estágio do desenvolvimento em que a ruptura da membrana ocorre determina se resultará em extrofia vesical, extrofia cloacal ou epispádia.
A teoria mais relacionada ao desenvolvimento embrionário na extrofia, defendida por Marshall e Muecke, descreve o defeito básico como um hiperdesenvolvimento inferior anormal da membrana cloacal, que impede a migração medial do tecido mesenquimal. Portanto, não ocorre o desenvolvimento adequado da parede abdominal. O momento da ruptura desse defeito cloacal determina a gravidade da anomalia. Perfurações centrais que resultam em extrofia clássica têm a maior incidência (60%), enquanto variantes de extrofia correspondem a 30% e a extrofia cloacal a 10%.
Outras teorias são propostas acerca da causa do complexo extrofia-epispádias. Ambrose e O’Brian postularam que um desenvolvimento anormal dos tubérculos genitais, com fusão na linha média abaixo, e não acima, da membrana cloacal, resulta no defeito de extrofia.1 Outra hipótese descreve uma inserção caudal anormal do pedículo corporal com falha da interposição do tecido mesenquimal na linha média. Devido a essa falha, não ocorre a translocação da cloaca para as porções profundas da cavidade abdominal. Uma membrana cloacal que permanece em posição infraumbilical superficial representa um estado embrionário instável com forte tendência à desintegração. Nenhuma teoria parece elucidar todos os aspectos do complexo observado clinicamente e estudos adicionais estão em andamento para descrever completamente o processo de desenvolvimento que, em última análise, forma o complexo extrofia-epispádias.
Herança
Há evidências de predisposição genética para extrofia e epispádias. O risco de recorrência de extrofia vesical em uma determinada família é de aproximadamente 1 em 100, muito maior do que na população geral. Há muitos relatos de gêmeos com extrofia. Ao mesmo tempo, porém, há também relatos de gêmeos idênticos em que ambos apresentavam extrofia e outro par em que apenas um foi afetado. Há inúmeros casos de gêmeos não idênticos em que apenas um dos irmãos foi afetado. Esses pares de gêmeos foram encontrados tanto em pares masculinos quanto femininos.2,3 Análises de concordância de gêmeos com o complexo extrofia-epispádias vesical também sugerem uma etiologia genética. Um relatório de 151 famílias com o complexo extrofia-epispádias identificou 4 famílias multiplex, para uma taxa de 2,7%. A probabilidade de um progenitor com extrofia ter um filho com extrofia é de cerca de 1:70 nascidos vivos, ou 500 vezes o risco para a população geral.3
Muitos esforços têm sido feitos para compreender as possíveis etiologias do complexo extrofia-epispádias. O ambiente hormonal do desenvolvimento inicial associado à fertilização in vitro tem sido postulado como envolvido com base em estudos que mostraram um aumento de 7,5 vezes na extrofia e na extrofia cloacal associadas ao uso de tecnologia de reprodução assistida, como a injeção intracitoplasmática de espermatozoides. Outro estudo epidemiológico mostrou uma taxa aumentada de nascimentos com o complexo extrofia-epispádias em mulheres que se submeteram à fertilização in vitro. Um estudo mais recente, de um estudo caso-controle sueco de abrangência nacional, constatou que, em geral, a extrofia vesical é vista como uma malformação isolada, sem malformações maiores adicionais. Pacientes com extrofia vesical tenderam a estar associados a baixo peso ao nascer (< 1.500 gramas) e idade materna elevada (≥ 35 anos).
O gene CASPR3 no cromossomo 9 foi implicado por Boyadjiev e colegas como associado ao complexo de extrofia. Outro conjunto de genes no cromossomo 9 foi identificado como associado à extrofia vesical. Estudos genéticos estão tentando determinar onde e se podem ser encontrados fatores genéticos específicos relacionados ao complexo extrofia-epispádias. Vários outros possíveis lócus gênicos foram identificados, mas não confirmados.
Diagnóstico pré-natal
Apesar da magnitude do defeito na parede abdominal inferior e no desenvolvimento dos órgãos pélvicos, a extrofia vesical ainda é difícil de diagnosticar de forma confiável pela ultrassonografia pré-natal. Isso provavelmente se deve à sua baixa incidência e ao fato de ser frequentemente confundida com diagnósticos mais comuns de onfalocele ou gastrosquise. Vários grupos descreveram achados ultrassonográficos importantes no diagnóstico pré-natal da extrofia. Em uma revisão de 25 ultrassonografias pré-natais com posterior nascimento de um recém-nascido com extrofia vesical clássica, Gearhart et al descreveram os principais critérios para o diagnóstico pré-natal da extrofia. Esses critérios incluíram a ausência de enchimento vesical, massa no abdome inferior que se torna mais protuberante à medida que a gestação avança, umbigo de implantação baixa, separação dos ramos púbicos e dificuldade em determinar o sexo do bebê.2,4,3,5 Um estudo retrospectivo mais recente, da Alemanha, constatou que a idade gestacional mediana era de cerca de 24 semanas. Novamente, todos os fetos apresentaram os achados patognomônicos de não visualização da bexiga fetal e massa abdominal protrusa abaixo do cordão umbilical inserção. Ao analisar esses dados, a extrofia vesical deve sempre ser suspeitada com base na não visualização da bexiga.
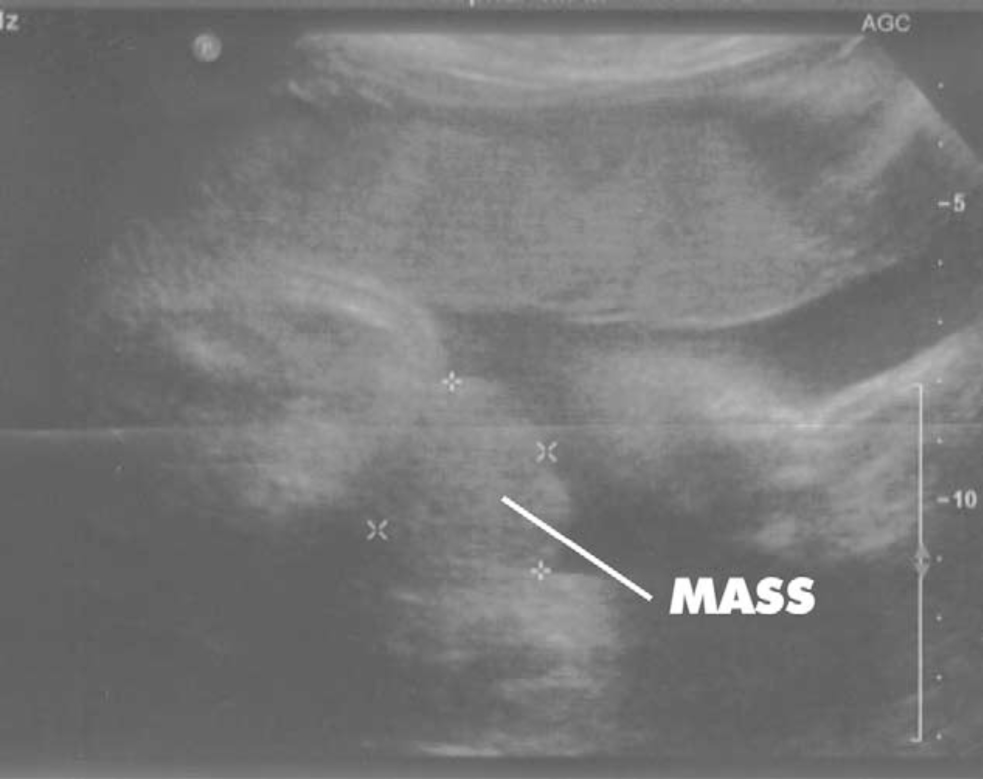
Figura 2 Ultrassonografia às 30 semanas de gestação demonstrando ausência de visualização da bexiga e uma massa no abdome inferior.
Acredita-se que a ultrassonografia 3-D e o uso crescente de RM fetal melhorarão a capacidade de diagnosticar extrofia vesical e cloacal. O diagnóstico pré-natal permite o aconselhamento pré-natal e a realização de providências para o parto em um centro especializado em extrofia. Isso permite uma abordagem multidisciplinar por equipes com experiência em lidar com a natureza singular do complexo extrofia-epispádias. Isso inclui a disponibilidade de equipes reconstrutivas no período neonatal imediato e apoio psicossocial aos pais e às famílias. Com a RM fetal, pode ser possível distinguir entre extrofia vesical clássica e extrofia cloacal por RM. Isso pode auxiliar no aconselhamento pré-natal da gestante.
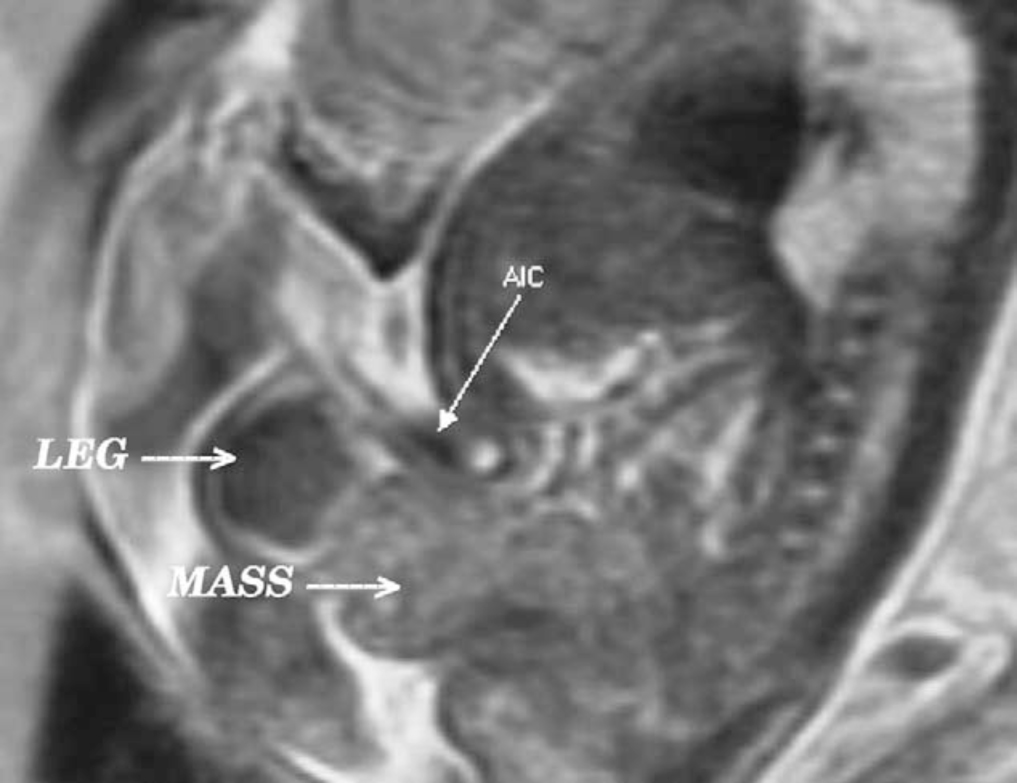
Figura 3 Vista sagital de extrofia vesical (massa) abaixo da inserção abdominal do cordão umbilical (AIC) na RM pré-natal ponderada em T2.
O diagnóstico de extrofia vesical é feito (ou confirmado) ao nascimento com a visualização da placa vesical caracteristicamente protrusa sob o cordão umbilical, com músculos retos abdominais divergentes em ambos os lados, levando a ossos púbicos amplamente separados.
Anomalias Associadas
Defeitos esqueléticos
O defeito esquelético mais evidente é a separação dos ossos púbicos, causada pela rotação externa dos ossos inominados, eversão dos ramos púbicos e um déficit de 30% de osso no ramo púbico.6 Reconstruções de TC 3D determinaram rotação externa média de 12˚ do aspecto posterior da pelve em cada lado, retroversão do acetábulo e rotação externa média de 18˚ da porção anterior da pelve. O uso adicional de exames de TC 3D mostrou que o ângulo da articulação SI (antes do fechamento) era 10˚ maior na pelve com extrofia em comparação a controles pareados por idade e 10˚ mais voltado para o plano coronal do que para o sagital. A pelve óssea também estava rotacionada inferiormente em 14,7˚. O sacro era 42,6% maior por medidas de volume e tinha 23,5% mais área de superfície. Em conjunto, essas deformidades levam a uma diástase púbica média de 4,2 cm ao nascimento, aumentando para 14,2 cm em adultos. Em comparação, a largura da sínfise é de 0,6 cm em indivíduos controle. Essas deformidades dos ossos pélvicos contribuem para o falo encurtado, marcha anserina e rotação externa dos membros inferiores em pacientes com extrofia. Um estudo com 299 crianças com extrofia de bexiga indicou que variações espinhais ocorrem sem significância clínica: espinha bífida oculta, lombarização ou sacralização de vértebras em 11%, escoliose não complicada em 2,7% e disrafismo espinhal em 4%, incluindo mielomeningocele, lipomeningocele, sacro em cimitarra e hemivértebras. Apenas um paciente apresentou evidência de disfunção neurológica.7
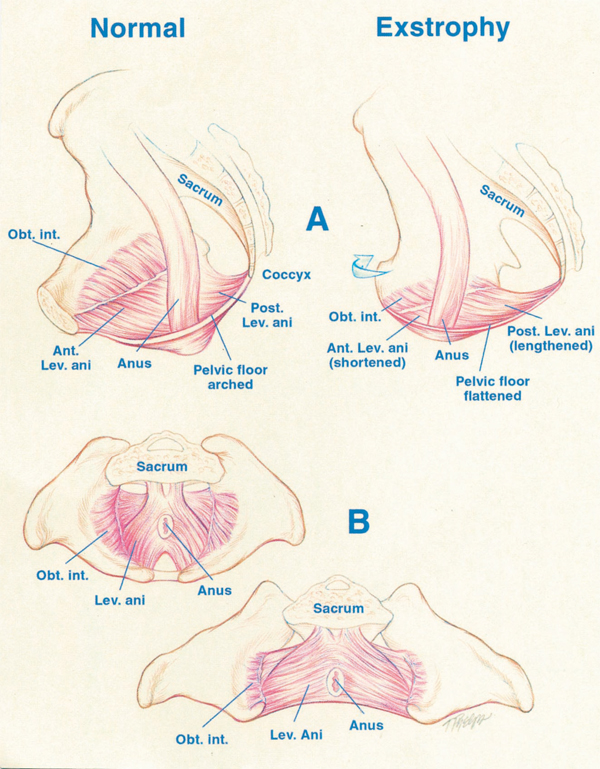
Figura 4 A, deslocamento do levantador (Lev.) do ânus para uma posição mais posterior (Post.) em paciente com extrofia, ou seja, 68% posterior ao ânus em comparação aos controles normais. Observe também o segmento anterior (Ant.) encurtado do levantador do ânus na extrofia: 32% anterior ao ânus versus 48% nos controles. Obt. int., obturador interno. B, maior rotação para fora de 15.1˚ do obturador interno no grupo com extrofia em comparação aos controles. Observe também que a área delimitada pelo puborretal é o dobro da dos controles e mais achatada.
Defeitos do Assoalho Pélvico
Dados de Stec et al utilizando imagens de TC 3D demonstraram que as alças puborretais em pacientes com extrofia vesical clássica sustentam o dobro da cavidade corporal em comparação com controles normais pareados por idade.4 Enquanto o grupo muscular levantador do ânus em controles normais está uniformemente distribuído de posterior para anterior (52% a 48%) em relação ao reto, há uma distribuição desigual de 68% a 32% de posterior para anterior na pelve com extrofia. Há também um achatamento significativo dos músculos levantadores do ânus. Observa-se uma diminuição de 31.7 graus na inclinação entre as metades direita e esquerda do levantador do ânus e da alça puborretal. Consequentemente, o ânus é anteriorizado e às vezes patuloso, como parte da extensão posterior do defeito miofascial. Essas malformações musculoesqueléticas explicam a maior taxa de prolapso retal, especialmente na população feminina com extrofia vesical.
Estudos adicionais do assoalho pélvico foram realizados com RM 3D e impactaram a compreensão da pelve na extrofia para a reconstrução. Williams et al demonstraram que o grupo levantador do ânus era menos em forma de cúpula e mais irregular na população com extrofia antes do fechamento, quando comparado a controles normais.8 Também não se observou relação entre o grau de diástase púbica e a extensão da curvatura desproporcional do grupo muscular levantador do ânus. A revisão, por RM, de pelves após o fechamento revelou que, naqueles com algum grau de continência, observou-se que a distância intra-sinfisária era a mais curta, o ângulo de divergência do levantador do ânus o mais agudo e o colo vesical o mais profundamente posicionado na pelve. Gargollo relatou RM antes e após o fechamento da extrofia, observando que o ângulo puborretal naqueles com intervalos secos estava diminuído em comparação com o anterior ao fechamento.9 Novos relatos do uso de ultrassonografia perineal 3D para avaliar o assoalho pélvico de mulheres adultas com extrofia mostraram que os achados ultrassonográficos correlacionaram-se bem com os achados de RM. Esses relatos reforçam a necessidade de dissecção agressiva e posicionamento posterior da uretra posterior e da bexiga, juntamente com boa reaproximação do púbis no momento do fechamento. Osteotomias e fixação pélvica devem ser utilizadas se a reconstrução não for realizada no período neonatal imediato.
Defeitos da Parede Abdominal
Há um defeito triangular devido à ruptura prematura da membrana cloacal anômala na parede abdominal, e ele é ocupado pela bexiga extrofiada e pela uretra posterior. Esse defeito na fáscia é limitado inferiormente pela banda intrasinfisária que representa o diafragma urogenital divergente e conecta o colo vesical e a uretra posterior aos ramos púbicos. Wakim e Barbet investigaram a relação do músculo reto abdominal e da fáscia com o diafragma urogenital e não encontraram evidência macroscópica ou histológica do esfíncter estriado.10 Eles encontraram evidências de musculatura vesical estendendo-se lateralmente até o púbis, onde se interdigita com fibras da fáscia do reto abdominal para formar o diafragma urogenital fibroso. A importância da incisão radical dessas fibras lateralmente à placa uretral até o nível do ramo púbico inferior e do hiato do levantador para o posicionamento da bexiga e da uretra posterior profundamente na pelve foi demonstrada por Gearhart e colegas, usando dados de fechamentos de extrofia malsucedidos em que essas fibras estavam intactas no momento do novo fechamento.11
No limite cefálico do defeito fascial triangular encontra-se o umbigo. A distância entre o umbigo e o ânus está encurtada na extrofia vesical porque o umbigo se encontra bem abaixo da linha horizontal da crista ilíaca. Embora uma hérnia umbilical geralmente esteja presente, ela costuma ser de tamanho insignificante e é corrigida no momento do fechamento inicial da extrofia.
As hérnias inguinais são comuns. Devem-se à falta de obliquidade do canal inguinal combinada com anéis inguinais interno e externo alargados e persistência do conduto peritoneovaginal. Connolly e colaboradores relataram uma incidência de hérnia inguinal de 81.8% em pacientes do sexo masculino e de 10.5% em pacientes do sexo feminino.12 Recomenda-se explorar os canais inguinais no momento do fechamento da extrofia e excisar o saco herniário com reparo da fáscia transversalis e do defeito muscular para prevenir recorrência ou hérnia direta, independentemente de abordagem em estágios ou de reparo primário completo. Além disso, no contexto de fechamento concomitante da extrofia e reparo da hérnia inguinal, a taxa de recorrência de hérnia inguinal é superior a 30 % (muito maior em pacientes do sexo masculino), refletindo uma fraqueza inata da parede abdominal e a falta de obliquidade do canal inguinal. Isso é especialmente evidente nos primeiros 6 meses após o fechamento vesical inicial por CPRE.
Defeitos anorretais
No paciente com extrofia, o períneo é curto e amplo e o ânus situa-se diretamente atrás do diafragma urogenital. Ele está deslocado anteriormente e corresponde ao limite posterior do defeito da fáscia triangular. O complexo do esfíncter anal também está deslocado anteriormente e deve ser preservado íntegro. Esses fatores anatômicos contribuem para graus variados de incontinência anal e prolapso retal. O prolapso retal ocorre frequentemente em pacientes com extrofia não tratados e com a sínfise amplamente separada. Geralmente, isso é transitório, de fácil redução e desaparece após o fechamento da bexiga ou cistectomia/desvio urinário. O aparecimento de prolapso do reto também é uma indicação para prosseguir com o manejo definitivo da bexiga extrofiada. Se ocorrer a qualquer momento após o fechamento da extrofia, deve-se suspeitar de obstrução da uretra posterior/saída vesical e realizar avaliação imediata do trato de saída por cistoscopia.
As implicações da extrofia cloacal (complexo OEIS) sobre o intestino posterior serão abordadas mais adiante neste capítulo.
Defeitos genitais masculinos
Os defeitos genitais masculinos são graves e desafiadores no momento da reconstrução. O falo é curto devido a uma deficiência de 50% no comprimento anterior dos corpos cavernosos, com preservação do comprimento posterior dos corpos cavernosos quando comparado a controles pareados por idade por RM.3 O diâmetro do segmento posterior dos corpos cavernosos era maior do que nos controles normais. A diástase da sínfise púbica aumentou as distâncias intra-sinfisárias e intracorporais, mas o ângulo entre os corpos cavernosos permaneceu inalterado porque os corpos cavernosos estavam separados de maneira paralela. Isso resulta em um pênis que parece curto por causa da diástase e da acentuada deficiência congênita de tecido corporal anterior. A liberação da curvatura dorsal, o alongamento do sulco uretral e a mobilização das cruras na linha média para alongar um pouco o pênis podem resultar em um falo funcional e esteticamente adequado.
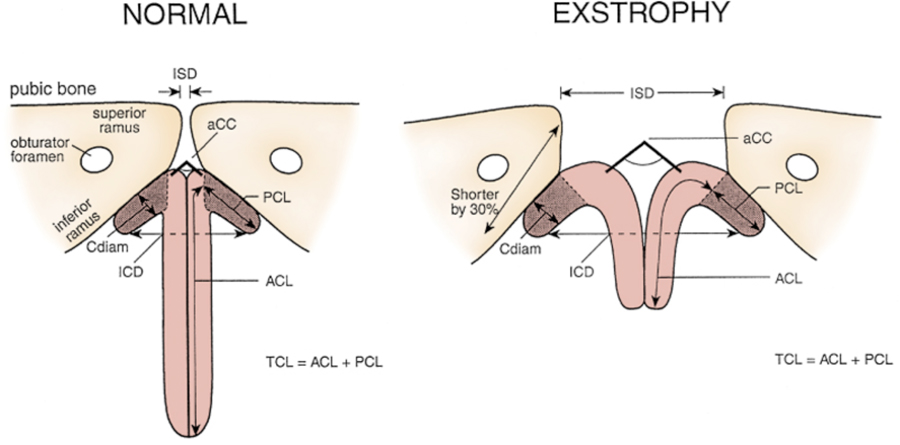
Figura 5 Medidas penianas e pélvicas em homens normais e pacientes com extrofia. ZSD, distância intersinfisária. UCC, ângulo subtendido pelos corpos cavernosos. Cdiam, diâmetro do corpo cavernoso. PCL, comprimento dos corpos cavernosos posterior. ZCD, distância intercorporal. ACL, comprimento dos corpos cavernosos anterior. EL, comprimento total dos corpos cavernosos
Epispádias é geralmente observado em conjunto com a extrofia vesical clássica. No entanto, raramente, é observado como um defeito congênito isolado em 1 em 117.000 homens e 1 em 150.000 a 300.000 mulheres. Caracteriza-se pela falha da placa uretral em se tubularizar no dorso, com o defeito variando de localização glandular a penopúbica. A maioria dos pacientes do sexo masculino também apresenta algum grau de curvatura dorsal peniana. Algumas pacientes do sexo feminino apresentam clitóris bífido. Nos homens, a probabilidade de incontinência urinária pode depender da gravidade do defeito de epispádias. No entanto, mesmo aqueles com epispádias glandular foram descritos como tendo incontinência devido a “um defeito de campo” que compromete a contratilidade e a coaptação da bexiga e da uretra. Em contraste, quase todas as pacientes do sexo feminino com epispádias apresentam incontinência urinária, dada a alta probabilidade de um defeito concomitante do colo vesical.
Gearhart e colaboradores utilizaram ressonância magnética para demonstrar, em 13 homens adultos com extrofia vesical, que o volume, o peso e a área máxima de secção transversal da próstata pareciam normais em comparação com controles publicados.13 No entanto, constataram que, em nenhum dos pacientes avaliados, a próstata se estendia circunferencialmente ao redor da uretra, e a uretra era anterior à próstata em todos os pacientes. Os níveis de PSA livre e total em homens adultos com extrofia vesical foram mensuráveis, porém abaixo dos limites superiores dos intervalos de referência específicos por idade estabelecidos para homens normais.13 Há um único relato de um paciente de 56 anos com epispádia apresentando câncer de próstata, com PSA de 4.2 no momento da biópsia.14
Os ductos deferentes e os ductos ejaculatórios são normais no paciente com extrofia, desde que não sejam lesionados iatrogenicamente durante o fechamento ou a reconstrução. O comprimento médio das vesículas seminais foi considerado normal.
Os nervos autonômicos que inervam os corpos cavernosos (nervos cavernosos) estão deslocados lateralmente em pacientes com extrofia, e esses nervos são preservados em quase todos os pacientes com extrofia, já que a potência é preservada após a cirurgia. Observa-se ejaculação retrógrada após o fechamento da bexiga e a reconstrução do colo vesical.
Os testículos frequentemente parecem ser retráteis, mas têm comprimento adequado do cordão espermático para alcançar o escroto plano e largo sem necessidade de orquidopexia. Os testículos não foram estudados em um grande grupo de pacientes com extrofia no período pós-puberal, mas acredita-se, de modo geral, que não estejam comprometidos. D’Hauwers et al relataram o uso de aspiração percutânea de espermatozoides e injeção intracitoplasmática de espermatozoides, e afirmam que, em 3 pacientes com extrofia, obtiveram bons resultados na obtenção de espermatozoides.(missing reference)
Defeitos Genitais Femininos
Em meninas, o monte pubiano, o clitóris e os lábios estão separados e o orifício vaginal está deslocado anteriormente e é estenótico. O clitóris é bífido e a vagina é mais curta do que em controles normais, mas de calibre normal. O colo uterino encontra-se na parede vaginal anterior porque o útero entra na vagina superiormente. As trompas de Falópio e os ovários geralmente são normais. O clitóris bífido deve ser reaproximado com as duas extremidades dos pequenos lábios para formar uma comissura posterior no momento do fechamento primário. Comumente, dilatação vaginal ou uma episiotomia pode ser necessária para permitir relações sexuais satisfatórias na mulher madura. Um estudo associado à Association for the Bladder Exstrophy Community e à mídia social identificou 13- mulheres adultas com histórico de extrofia vesical. Destas, 28,5% foram tratadas por prolapso uterino. 36,2 % relataram gestações e, destas, 68% relataram complicações na gestação.15 A maioria das mulheres adultas requer intervenções, médicas e cirúrgicas, para questões ginecológicas após a menarca.16
Ainda assim, apesar de a extrofia vesical ser uma condição grave, gestações saudáveis são relatadas com consequências a longo prazo para a continência e a saúde sexual.17
Defeitos Urinários
A mucosa vesical exposta é suscetível a alterações císticas ou metaplásicas e, portanto, deve ser irrigada frequentemente com soro fisiológico e protegida de trauma superficial e da exposição por uma membrana protetora até que o fechamento cirúrgico da bexiga possa ser realizado. Comumente, filme plástico (isto é, Saran Wrap) é suficiente. A mucosa ao nascimento pode apresentar um segmento de mucosa intestinal ectópica, uma alça intestinal isolada ou, mais comumente, pólipos hamartomatosos.
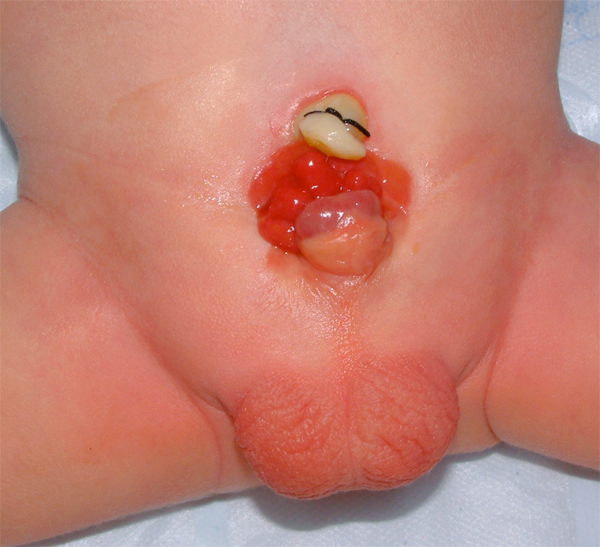
Figura 6 Recém-nascido com extrofia vesical clássica. Observe múltiplos pólipos na placa vesical.
Shapiro e colegas caracterizaram a função neuromuscular da bexiga. Eles mostraram que a densidade dos receptores colinérgicos muscarínicos e a afinidade de ligação eram semelhantes em indivíduos com extrofia e controles.18 Biópsias da bexiga de 12 recém-nascidos com extrofia vesical, comparadas a controles pareados por idade, constataram um aumento na relação colágeno/músculo liso nas bexigas com extrofia.19 Os tipos de colágeno foram analisados e uma distribuição normal de colágeno tipo I estava presente, mas foi encontrado um aumento três vezes maior de colágeno tipo III. Posteriormente, observou-se que aqueles pacientes que demonstraram crescimento vesical, medido pela capacidade após fechamento bem-sucedido, e que estavam livres de infecção, apresentavam uma relação colágeno/músculo liso marcadamente reduzida. Culturas primárias de células de músculo liso de bexigas com extrofia mostraram características de crescimento semelhantes às previamente relatadas em células sem extrofia, indicando que provavelmente mantêm seu potencial de crescimento e função. Mathews e colaboradores encontraram que o número médio de pequenas fibras nervosas mielinizadas por campo estava significativamente reduzido nas bexigas com extrofia em comparação com controles.20 Observou-se preservação de fibras nervosas maiores, o que levou o estudo a levantar a hipótese de que a extrofia vesical em um recém-nascido representava um estágio mais precoce do desenvolvimento vesical. Múltiplos marcadores imunocitoquímicos e histoquímicos, peptídeo intestinal vasoativo (VIP), neuropeptídeo Y (NPY), substância P (SP), produto relacionado ao gene da calcitonina (CGRP), produto do gene da proteína (PGP) 9.5 e diaforase da nicotinamida adenina dinucleotídeo fosfato (NADPHd) foram estudados, e não houve evidência morfológica de desinervação do músculo vesical em nenhum caso de extrofia vesical. Contudo, casos de extrofia vesical após reconstrução fracassada apresentaram deficiências de inervação muscular que aumentaram as inervações subepitelial e intraepitelial. A análise por micromatriz do músculo liso de bexigas com extrofia em comparação com controles ‘saudáveis’ mostrou o que parece ser um achado de imaturidade do desenvolvimento no músculo liso da bexiga com extrofia. Portanto, considera-se que, embora a bexiga em um paciente com extrofia possa ser imatura, ela tem potencial para desenvolvimento normal após um fechamento inicial bem-sucedido.
Os pólipos da placa vesical foram classificados em dois tipos, com achados sobrepostos: fibrosos e edematosos. Ambos estavam associados a metaplasia escamosa sobrejacente em 50% dos casos. Foram observados graus variados de ninhos de von Brunn, cistite cística e cistite glandular. A cistite glandular foi observada em uma porcentagem mais elevada de fechamentos secundários. Recomenda-se o acompanhamento futuro desses pacientes com cistite glandular, dado o risco potencial de adenocarcinoma. Isso pode ser feito com citologia urinária e cistoscopia à medida que entram na vida adulta.21
A placa vesical pode invaginar-se ou protruir através de um pequeno defeito fascial ao nascimento, mas a avaliação fidedigna da placa vesical não pode ser realizada completamente até que o recém-nascido esteja sob anestesia e totalmente relaxado. Uma bexiga pequena, fibrosada, inelástica e/ou uma que esteja coberta por pólipos pode tornar o reparo funcional desafiador e potencialmente impossível.
Foram obtidos cistometrogramas normais em 70–90% dos avaliados em um grupo de pacientes com extrofia continentes e bexigas reflexas normais.22 Uma avaliação de 30 pacientes com extrofia em várias fases do reparo moderno em estágios, antes da reconstrução do colo vesical, constatou que 80% apresentavam bexigas complacentes e estáveis após a reconstrução do colo vesical. Aproximadamente metade manteve complacência vesical normal e menos mantiveram estabilidade normal. Os autores daquele estudo consideraram que 25% dos pacientes com extrofia poderiam manter função detrusora normal após a reconstrução.23 A microestrutura da bexiga de pacientes com extrofia em vários momentos do reparo moderno em estágios apresentou cavéolas diferentes (estruturas intracelulares importantes para a sinalização célula-célula). Essas cavéolas foram consideradas normais naqueles com fechamento bem-sucedido e melhora da capacidade vesical, mas ausentes naqueles que necessitaram de cistoplastia de aumento. Observou-se que a ultraestrutura das células também era anormal no grupo que falhou no fechamento inicial.
O restante do trato urinário geralmente é normal, mas anomalias podem ocorrer. Rim em ferradura, rim pélvico, rim hipoplásico, rim único e displasia com megauréteres podem ser encontrados. O trajeto do uréter é anormal no que diz respeito à sua terminação. Como o fundo de saco peritoneal de Douglas, entre a bexiga e o reto, está aumentado e excepcionalmente profundo, o uréter é forçado inferior e lateralmente em seu trajeto através da pelve verdadeira. O segmento distal aproxima-se da bexiga inferiormente e lateralmente ao orifício. Isso resulta em refluxo vesicoureteral em 100% dos casos de extrofia. Reimplantes ureterais são realizados no momento do reparo do colo vesical, mas às vezes são necessários antes. Se houver problemas com infecções e resistência excessiva da via de saída, o reimplante ureteral pode ser necessário antes da reconstrução do colo vesical ou a qualquer momento se se desenvolverem refluxo vesicoureteral grave e problemas do trato urinário superior.
Avaliação e Manejo ao Nascimento
Na sala de parto, o cordão umbilical deve ser ligado com fio de seda 2-0, próximo à parede abdominal, para que a pinça umbilical não irrite nem traumatize a mucosa vesical exposta. A mucosa vesical deve ser irrigada frequentemente com soro fisiológico morno e sempre coberta com um filme plástico transparente protetor até o momento do fechamento. A bexiga deve ser irrigada, e o filme plástico trocado a cada troca de fraldas.
Uma abordagem multidisciplinar é importante. A equipe deve incluir, mas não se limitar a, um urologista pediátrico, cirurgião ortopédico pediátrico, anestesiologista pediátrico, neonatologista, psiquiatra pediátrico (com especialização e experiência em anomalias genitais) e assistentes sociais. Estudos demonstraram que os pais de pacientes com extrofia vivenciam um nível significativo de estresse. O estresse dos pais não deve ser negligenciado durante o cuidado inicial e de longo prazo do paciente.24 Os pais devem ser tranquilizados de que crianças com extrofia vesical clássica são, em geral, lactentes saudáveis e robustos, com perspectiva de levar uma vida muito normal. Pode-se esperar uma reconstrução eficaz que permita armazenamento, drenagem e controle urinários, com aparência cosmética aceitável. O apoio de psicólogos, enfermeiros e pais de outras crianças com extrofia é inestimável.
Um neonatologista deve avaliar o paciente do ponto de vista pediátrico geral e cardiopulmonar, tendo em vista a probabilidade de uma cirurgia de grande porte nas primeiras 48 horas de vida. Um ecocardiograma é comumente realizado para excluir anomalias cardiopulmonares significativas que impediriam a reconstrução precoce. Deve-se obter uma ultrassonografia renal para avaliar as vias urinárias superiores. Um KUB é realizado para avaliar a anatomia óssea da pelve e uma ultrassonografia da coluna vertebral para excluir um disrafismo espinhal associado.
É essencial que um cirurgião geniturinário pediátrico, com experiência e interesse no complexo extrofia-epispádias, avalie o paciente recém-nascido com extrofia, pois o impacto de uma malformação congênita maior é significativamente agravado por um manejo inicial inadequado.25,26,27
Nos pacientes com genitália ambígua, além de extrofia vesical, os pais devem ser educados e aconselhados por uma equipe multidisciplinar de distúrbios da diferenciação sexual, mas devem compreender que a necessidade de mudar o sexo de criação na extrofia vesical clássica é quase inexistente no lactente do sexo masculino com os resultados reconstrutivos atuais.
Como muitos desses casos ainda ficam sem diagnóstico até o momento do parto, a maioria necessitará de transporte para um centro especializado em extrofia vesical logo após o nascimento. Durante o transporte, a bexiga deve ser protegida por uma membrana plástica transparente e mantida úmida para proteger a delicada mucosa vesical.
Reconstrução Cirúrgica
Os objetivos da reconstrução cirúrgica no paciente com extrofia são corrigir os defeitos urogenitais, fornecendo um reservatório adequado para armazenamento urinário a baixas pressões, com capacidade de esvaziar completamente sem comprometer a função renal, criar genitália externa funcional e esteticamente aceitável e maximizar a qualidade de vida do paciente.
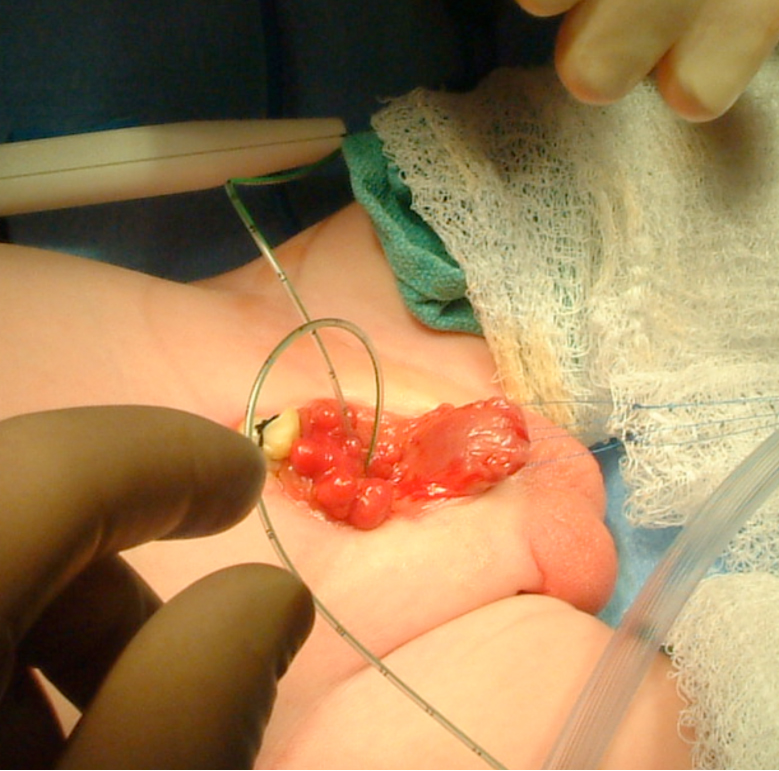
Figura 7 Intubação dos orifícios ureterais bilaterais em preparação para a dissecção.
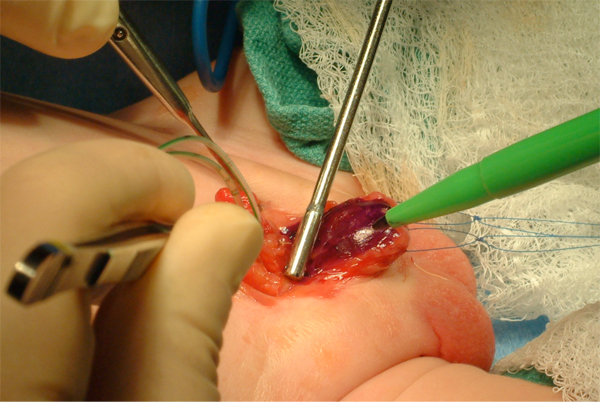
Figura 8 Marcação da placa uretral. Observe duas suturas de tração em cada hemiglande.
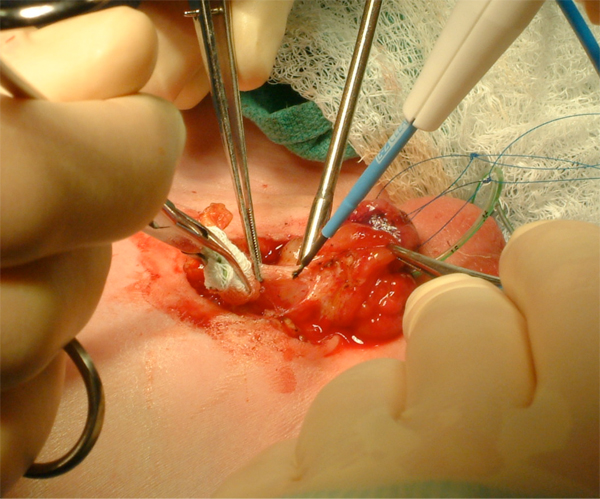
Figura 9 Mobilização agressiva da bexiga, incluindo o umbigo.
As tentativas iniciais de reconstrução da extrofia vesical foram malsucedidas e os pacientes tinham expectativa de vida curta. Portanto, por muitos anos, o manejo da extrofia consistiu na remoção da bexiga extrofiada e na derivação urinária, comumente por ureterosigmoidostomia. Diversos reparos em etapas começaram a mostrar sucesso inicial na década de 1950.Na década de 1970, foram introduzidos os modelos preliminares de reparo em etapas que são utilizados hoje. Isso evoluiu para a reconstrução moderna em estágios da extrofia, que é comumente utilizada atualmente.28 No final da década de 1980, iniciou-se uma abordagem anatômica para o reparo da extrofia, que foi modificada até o que agora é referido como reparo primário completo da extrofia ou técnica de Mitchell.29 Atualmente, a maioria dos pacientes é tratada com reparo primário completo da extrofia (CPRE) ou reconstrução moderna em estágios da extrofia (MSRE).28 Continua havendo muita discussão sobre o tratamento ideal da extrofia no período neonatal. Com isso em mente, a ureterosigmoidostomia permanece uma reconstrução popular e preferida em muitas partes do mundo, pois obtém continência urinária de forma confiável e é relativamente segura para aqueles sem acesso a instalações de saúde confiáveis ou a um centro especializado em extrofia.
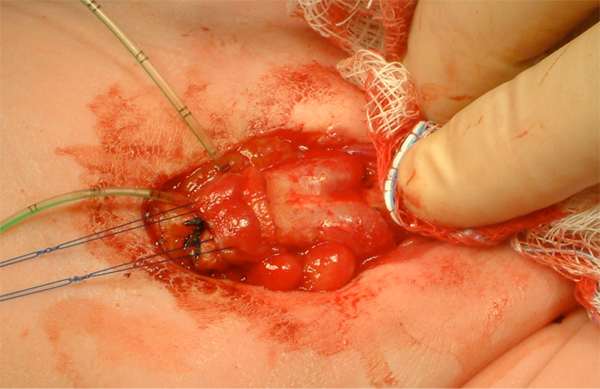
Figura 10 Identificação dos corpos cavernosos bilaterais após desenluvamento do falo.
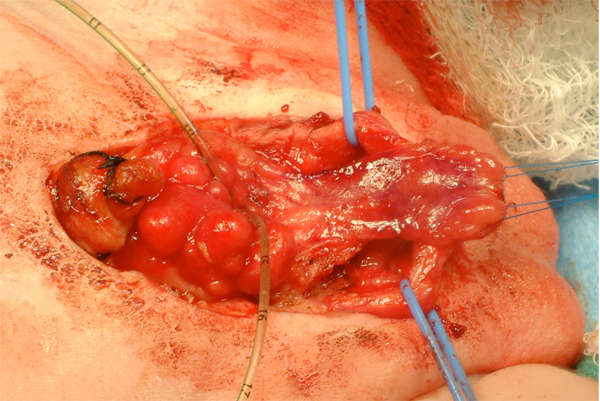
Figura 11 Após a separação dos corpos cavernosos e a mobilização da placa uretral.
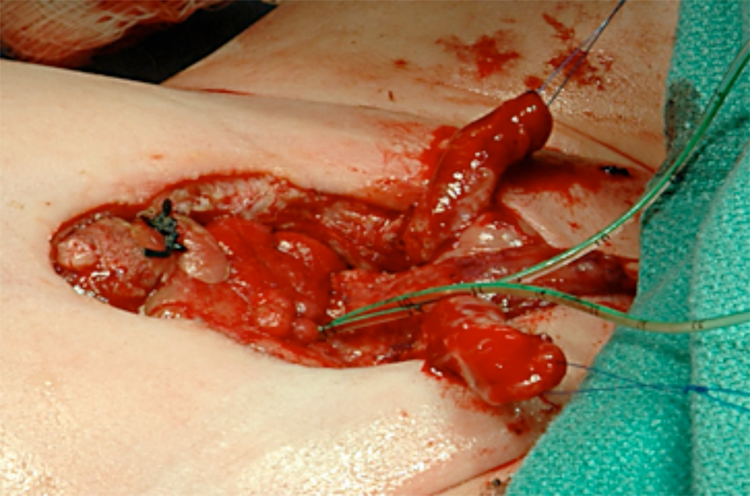
Figura 12 Após a separação completa dos corpos cavernosos e da glande.
Reparo Primário Completo da Extrofia
A CPRE é o desenvolvimento mais recente no manejo cirúrgico de pacientes com extrofia, introduzido pelo Dr. Mitchell em 1989.30 Essa abordagem foi adotada e reproduzida por múltiplos centros de excelência no manejo da extrofia. Na CPRE, uma abordagem anatômica de reconstrução inclui o fechamento da bexiga com remodelação do colo vesical e uma técnica de desmontagem para o reparo do epispádias, com ou sem osteotomias, em um único tempo. Acredita-se que isso permita a ciclagem vesical e um crescimento e desenvolvimento mais ‘normais’, porque a bexiga experimenta resistência à saída. A técnica de desmontagem para o reparo do epispádias também permite a secção dos ligamentos intersinfisários e o posicionamento anatômico adequado do colo vesical e da uretra posterior profundamente na pelve, em sua posição ortotópica.Quando realizado nas primeiras 72 horas de vida, a pelve é suficientemente maleável para ser fechada sem osteotomias. Os pacientes ainda necessitam de tração de Bryant por aproximadamente 1 semana e, em seguida, imobilização gessada dos membros inferiores por 3 semanas para evitar tensão sobre o fechamento da pelve. A incidência de deiscência e prolapso vesical é rara na era moderna.
A CPRE é defendida como uma abordagem para permitir o desenvolvimento máximo da bexiga e identificar aqueles pacientes cujas bexigas crescerão e se desenvolverão mais precocemente do que os manejados de forma escalonada. A normalização da anatomia no fechamento inicial logo após o nascimento pode ter outros benefícios, como minimizar o trauma psicossocial da família. Pacientes cuja bexiga de fato se desenvolve provavelmente serão submetidos a menos procedimentos do que em uma abordagem em etapas.
A continência após CPRE tem sido relatada em 76%, definida como intervalos secos superiores a 2 horas e micção espontânea sem cateterizações. No entanto, uma porcentagem significativa de pacientes provavelmente ainda necessitará de um procedimento formal no colo vesical para alcançar a continência. Em outra série, 75% dos pacientes após CPRE estavam continentes, com intervalos de 4 horas e secos à noite, com 31,3% necessitando de CIC.
Preocupações com a CPRE estão relacionadas ao potencial de deterioração renal associado a um sistema urinário inferior de alta pressão, ao risco de lesão peniana ou perda do pênis com a desmontagem em idade tão precoce e à necessidade de múltiplos procedimentos apesar do nome ‘reparo completo.’ O acompanhamento rigoroso das vias urinárias superiores é importante na extrofia, independentemente do reparo. Hidronefrose, pielonefrite e cicatrizes renais são observadas após a CPRE e devem ser manejadas de forma agressiva com antibióticos profiláticos, já que o refluxo vesicoureteral é esperado no pós-operatório. O seguimento de longo prazo na série de Seattle mostra que hidronefrose leve (45%), moderada (17,8%) e grave (7,1%) é observada após a CPRE. Mas, em metade dos casos com hidronefrose, e em todos com hidronefrose grave, ela foi transitória. Borer e colaboradores relataram uma incidência de pielonefrite de 28% e cicatrizes renais à DMSA de 19% após a CPRE.31 A necessidade de reimplante ureteral bilateral após a CPRE, excluindo aqueles realizados no momento da reconstrução do colo vesical, é de 25–34%.31,32,33
Aproximadamente 36–68% dos pacientes ficarão com hipospádia após CPRE e necessitarão de cirurgia peniana adicional.30,34,31,32,33 Necrose da glande, perda da pele peniana e/ou perda de tecido peniano foram relatadas após CPRE, mas são bastante raras quando a CPRE é realizada em centros de excelência em extrofia.
Uma revisão sistemática recente examinou os resultados de dez grupos utilizando a técnica CPRE com 236 pacientes. A correção de hipospádia foi necessária para a maioria dos meninos que tiveram desmontagem peniana completa (22.7–68 %). O reimplante ureteral foi necessário como procedimento separado em 48–66%. A maioria das crianças, eventualmente, também necessitou de reconstrução do colo vesical para continência. No geral, micção, sem BNR, foi observada em 16–37 % das crianças nas séries relatadas.
Comparar o número de procedimentos a que um paciente poderá ser submetido é um tema controverso ao se comparar o CPRE e o MSRE. Os relatos variam amplamente quanto ao número e aos tipos de procedimentos, e estão repletos de potenciais vieses, o que torna difícil tirar conclusões fidedignas sobre esse assunto. No entanto, aceita-se que pacientes manejados com uma abordagem CPRE ou MSRE provavelmente necessitarão de múltiplos procedimentos e que os desfechos são melhores se manejados em um centro de excelência para extrofia.
Em 2013, o Consórcio Multiinstitucional de Extrofia Vesical (MIBEC) foi estabelecido para aperfeiçoar o CPRE, reduzir complicações e melhorar os desfechos. Desde então, o MIBEC conseguiu reunir seus desfechos (tanto antes quanto depois do consórcio) a fim de estudar melhor essa condição relativamente rara e avaliar criticamente sua técnica. Por meio do consórcio, urologistas pediátricos trabalham de forma colaborativa como “treinadores cirúrgicos” na instituição anfitriã para combinar a experiência de múltiplos especialistas.
Outros grupos adotaram essa abordagem colaborativa para o tratamento cirúrgico da extrofia vesical. Por exemplo, a Pediatric Urology Midwest Alliance (PUMA) reuniu seus resultados para avaliar os desfechos de aumento vesical/desvio urinário e a necessidade de cateterismo intermitente limpo.
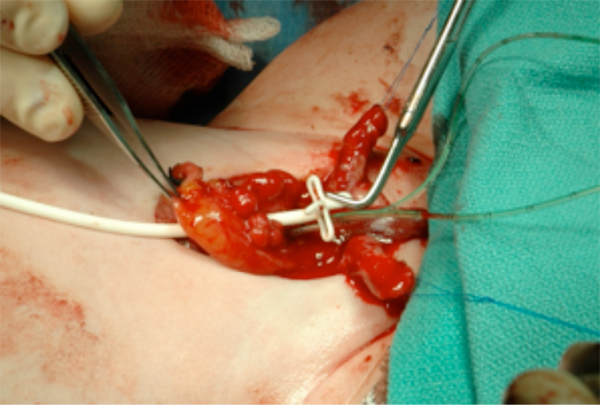
Figura 13 Posicionamento do cateter suprapúbico antes do fechamento vesical. Este sairá do abdome pelo umbigo.
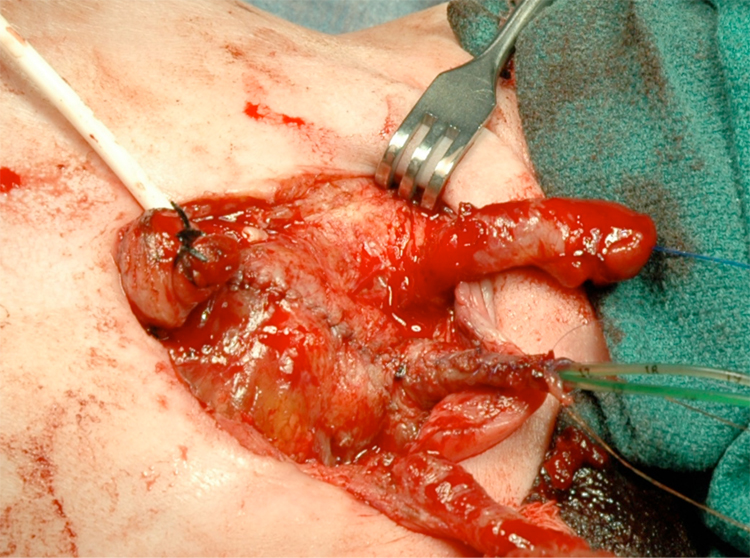
Figura 14 Bexiga e uretra fechadas em 2 camadas como uma unidade única. Observe os cateteres ureterais bilaterais saindo pelo meato uretral.
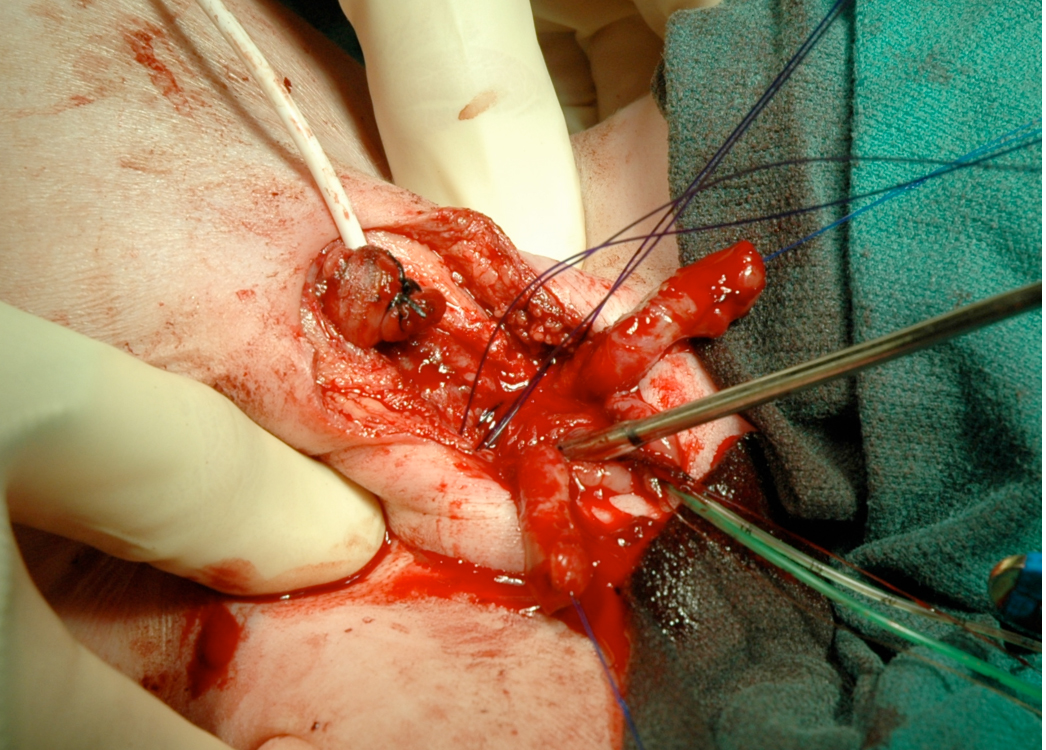
Figura 15 A rotação interna da pelve para reaproximar o púbis pode ser realizada quando a reconstrução é feita nas primeiras 72 horas de vida.
Reconstrução moderna em estágios da extrofia
A MSRE, como atualmente praticada, evoluiu a partir do trabalho original de Cendron e Jeffs.25,26 O grupo de Hopkins, liderado pelo Dr. Gearhart, atualmente possui a maior população de pacientes com extrofia e publica a maior parte da literatura sobre a MSRE. Na MSRE, o objetivo na reconstrução inicial é converter a bexiga extrofiada em um epispádias completo. Osteotomias pélvicas são realizadas em conjunto com o fechamento vesical quando indicado. Acredita-se que isso permita proteção contra disfunção renal, pois o paciente ainda é incontinente, mas também pode estimular o crescimento vesical, já que agora existe alguma resistência da via de saída vesical. A correção do epispádias é realizada entre 6 e 12 meses de idade, e a estimulação com testosterona é fornecida no pré-operatório. O reparo do colo vesical para continência é realizado entre 4 e 5 anos de idade se houver capacidade vesical adequada e se forem considerados prontos para participar de um programa miccional pós-operatório.35 Se esses critérios não forem atendidos, o paciente permanece incontinente até que a bexiga cresça e a maturidade melhore ou é submetido a derivação, com ampliação vesical e criação de um canal cateterizável, e fechamento do colo vesical, quando necessário.
As taxas de continência após MSRE foram relatadas por Gearhart como sendo, nos homens, de 70% e, nas mulheres, de 74%, com períodos sem perda superiores a 3 horas com micção espontânea e permanecendo secos à noite sem CIC.35 Concluíram que uma capacidade vesical de 100 ml prediz sucesso no momento da reconstrução do colo vesical utilizando a técnica de Young-Dees-Leadbetter modificada. Isso aumentou a chance de continência e o tempo para alcançar a continência em suas revisões.35,36 Se essa capacidade de 100 ml não for alcançada, considera-se que devem ser submetidos a uma ampliação no momento da reconstrução para continência. Também constataram que as mulheres tinham maior probabilidade de alcançar continência e em um prazo mais curto após a reconstrução do colo vesical.36 Seus relatos também mostram taxas de complicações igualmente baixas. Nos homens, após fechamento vesical, correção de epispádia e reconstrução do colo vesical, a taxa total de complicações foi de 41.7% com um caso de falha do fechamento primário.35 Nas mulheres, após fechamento vesical e reconstrução do colo vesical, a taxa total de complicações foi de 19.5%.36 Em sua série moderna, se ocorrer crescimento vesical bem-sucedido, 19.4% dos homens e 17% das mulheres falharam na reconstrução do colo vesical e foram submetidos ou necessitarão de uma ampliação com um estoma cateterizável e fechamento do colo vesical, conforme indicado.35,36
No MSRE, se a capacidade vesical de um paciente não se desenvolve até o nível que prevê sucesso com a reconstrução do colo vesical, o paciente é submetido diretamente a uma ampliação vesical para continência. Isso é razoável, mas obscurece as comparações entre MSRE e CPRE. O MSRE relata aqueles que completam a série. Como o CPRE realiza um procedimento de continência no fechamento inicial, eles estão incluindo aqueles pacientes cujas bexigas podem não ter se desenvolvido e que nunca teriam sido candidatos a uma reconstrução do colo vesical se tivessem sido manejados pelo MSRE. Além disso, é difícil determinar quantas, se alguma, dessas bexigas que não atingiram capacidade de 100 ml na idade de continência teriam crescido se tivessem feito um CPRE no fechamento inicial, com maior resistência de saída disponível para promover o desenvolvimento. Também pode haver um determinado subconjunto de bexigas com extrofia que são ‘ruins’ e não crescerão independentemente da técnica de fechamento, mas que não podem ser identificadas ao nascimento. Esses fatores dificultam definir sucesso e fracasso ao comparar técnicas. Análises prospectivas de longo prazo precisam continuar de forma imparcial e aberta para promover o intercâmbio de ideias que, idealmente, conduzam às próximas inovações no manejo da extrofia, as quais continuarão a melhorar a qualidade de vida desses pacientes.
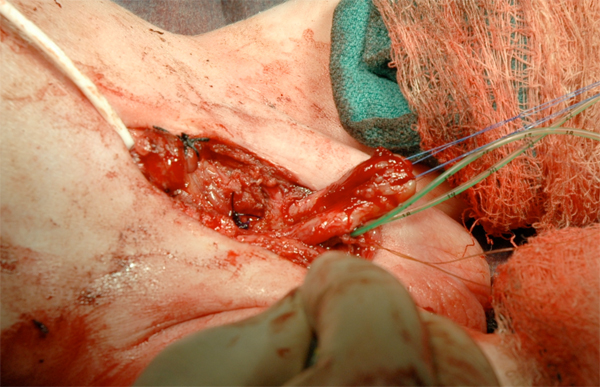
Figura 16 Reconstrução do falo.
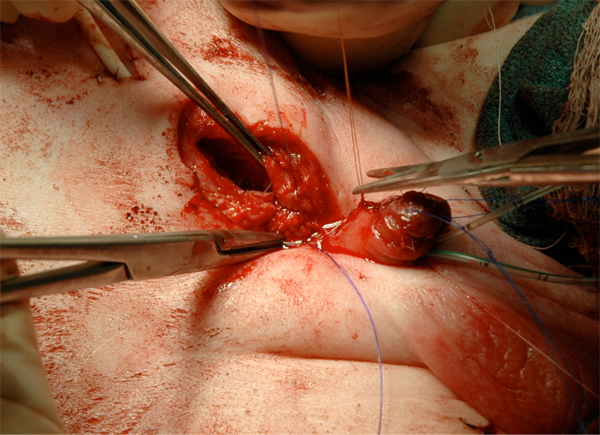
Figura 17 Fechamento fascial.
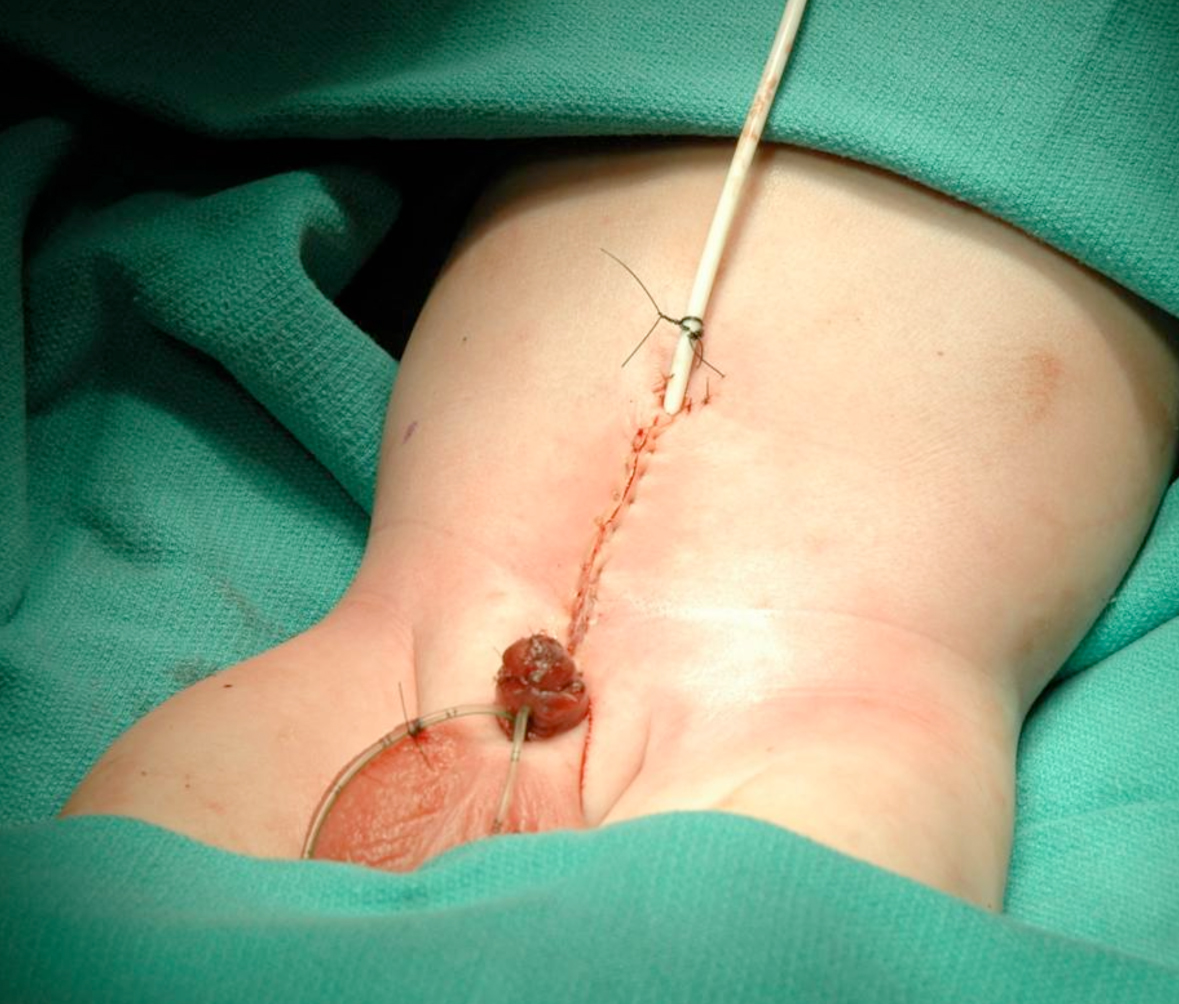
Figura 18 Fechamento da parede abdominal.
Resumo dos Princípios Acordados de Reconstrução Cirúrgica
- O manejo deve ser realizado em um centro de excelência em extrofia e com uma equipe multidisciplinar com a experiência e o interesse necessários para cuidar desses pacientes a longo prazo.
- A placa vesical deve ser mantida úmida e coberta com filme plástico após o nascimento até o fechamento
- O fechamento primário precoce bem-sucedido é fundamental para alcançar continência posteriormente
- Osteotomias são necessárias se a pelve for fechada com > 72 horas de vida
- Acompanhamento estreito das vias urinárias superiores é importante após o fechamento vesical
- São necessários múltiplos procedimentos para alcançar continência e reconstruir a anatomia
- Aumento vesical com ou sem estoma cateterizável e fechamento do colo vesical podem ser necessários naqueles que não alcançam continência ou uma bexiga com capacidade > 100 mL antes da reconstrução do colo vesical.
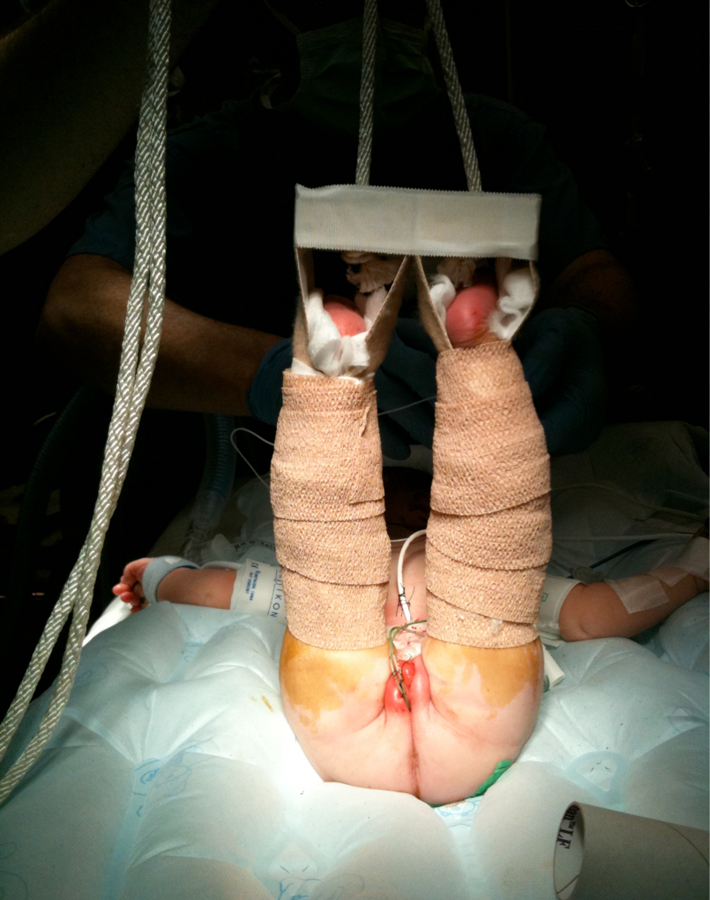
Figura 19 Tração de Bryant modificada.
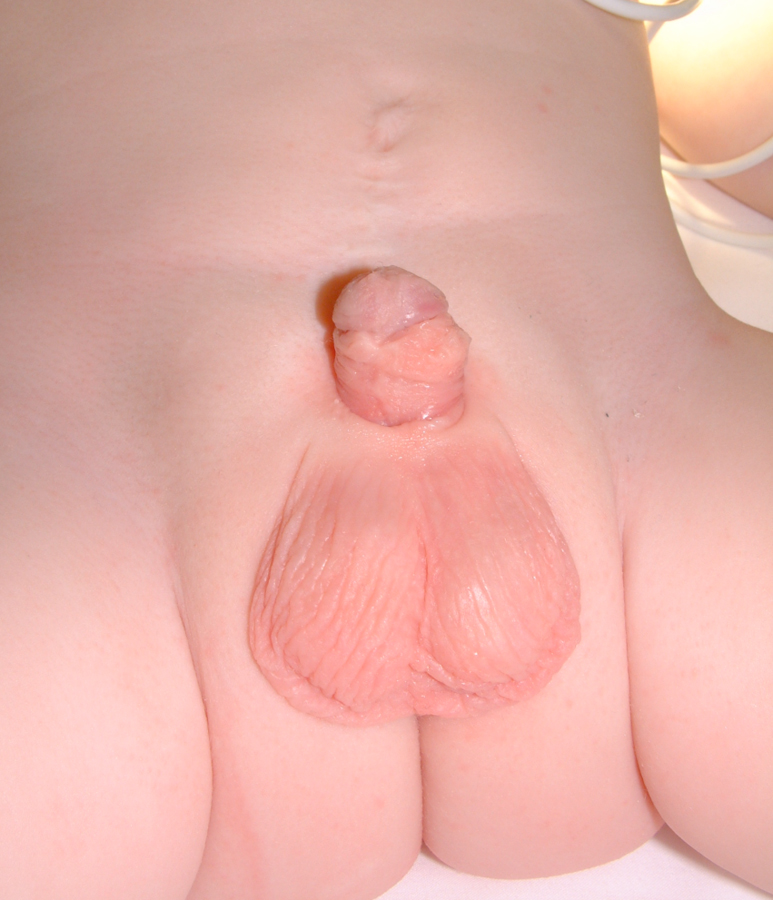
Figura 20 Pós-operatório.
Função sexual no paciente com extrofia
Há relatos de pacientes do sexo masculino adultos com extrofia que tiveram filhos ou iniciaram uma gestação. Isso mostra que a fertilidade é possível nesses pacientes, embora possa não ser comum. Na grande série de Shapiro, com 2.500 pacientes, foram documentados apenas 38 homens que haviam tido filhos.3 Estudos de análise do sêmen comparando homens submetidos ao fechamento primário aos submetidos à derivação por ureterossigmoidostomia encontraram contagem de espermatozoides normal em apenas um de oito no grupo de fechamento e em quatro de oito no grupo derivado. Essas diferenças foram atribuídas à ejaculação retrógrada e à lesão iatrogênica durante o fechamento funcional da bexiga. Outro estudo constatou que nenhum de seus pacientes reconstruídos conseguia ejacular normalmente, nem havia tido filhos. Cinco pacientes que não haviam sido submetidos à reconstrução apresentavam ejaculação normal e dois haviam tido filhos. Isso leva à conclusão de que o paciente do sexo masculino apresenta alto risco de infertilidade após a reconstrução. O uso de reprodução assistida, de qualquer forma, mostrou-se bem-sucedido em 13 homens com extrofia, segundo Bastuba e colaboradores, resultando em gestação bem-sucedida sem incidência de extrofia na prole.37
Woodhouse relatou que a função sexual e a libido do paciente com extrofia são normais.38 Vários relatos mostram que a função erétil é mantida na grande maioria após reconstrução uretral e fálica, e que a ejaculação frequentemente não é normal, mas geralmente está presente. A maioria relatou orgasmos satisfatórios e descreveu os relacionamentos íntimos como sérios e duradouros.39 No entanto, um estudo recente, utilizando uma pesquisa anônima em mídias sociais aplicada a homens da Association for the Bladder Exstrophy Communities, relatou que o Penile Perception Score e o International Index of Erectile Function foram inferiores aos dos controles publicados. Curiosamente, um Penile Perception Score mais alto correlacionou-se com uma pontuação IIEF-15 (satisfação sexual) mais alta. Estudos recentes de Rubenwolf et al demonstram que a satisfação sexual de homens e mulheres adultos após uma derivação urinária continente parece ser comparável à daqueles em que a bexiga é preservada, com a maioria em relacionamentos estáveis.40
A genitália externa feminina agora é rotineiramente totalmente reconstruída no momento do fechamento da extrofia. Anteriormente, essa reconstrução consistia em uma reaproximação estética do clitóris bífido e dos lábios anteriores para formar a fúrcula, mas não abordava a anormalidade anatômica inerente da localização e do ângulo da vagina em relação ao abdome e ao períneo em pacientes do sexo feminino com extrofia. Uma reconstrução adicional durante a adolescência, antes do início da atividade sexual ou do uso de absorventes internos em algumas pacientes com extrofia do sexo feminino, não era incomum. Aplicou-se a mobilização total do complexo urogenital, o que resultou em correção bem-sucedida da localização e do ângulo da vagina em pacientes do sexo feminino com extrofia.18 Relações sexuais bem-sucedidas foram relatadas em todas as pacientes em um estudo e dispareunia foi relatada em uma minoria.19 Uma grande série também relatou que pacientes do sexo feminino com extrofia maiores de 18 anos de idade tinham desejos sexuais normais e muitas eram sexualmente ativas com orgasmos normais. Algumas pacientes sentiam-se constrangidas e limitavam sua atividade sexual por causa da aparência estética de sua genitália externa. A monsplastia é uma parte importante da reconstrução em mulheres e o uso de pele e gordura com pelos para cobrir o defeito na linha média é rotineiro. Uma reparação tardia com o uso de retalhos romboides foi relatada com bom sucesso.41
Implicações Obstétricas e Ginecológicas
Muitas mulheres com extrofia vesical tiveram com sucesso filhos saudáveis (45 mulheres com 49 filhos em um relato).Outro estudo mostrou 40 mulheres, com idades de 19 a 36 anos, que foram tratadas por extrofia vesical quando lactentes e, dessas 40 mulheres, foram relatadas 14 gestações em 11 mulheres. Dentre essas 14 gestações, houve 9 partos normais, 3 abortos espontâneos e 2 abortos eletivos. Prolapso uterino ocorreu em 7 das 11 pacientes durante a gestação. Observa-se que é muito comum essas mulheres apresentarem prolapso cervical e uterino após a gestação e o parto.42 Nesses relatos iniciais, todas as mulheres aparentemente haviam sido submetidas previamente a derivações urinárias permanentes, mas relatos mais recentes mostram que gestações bem-sucedidas foram documentadas em mulheres que se submeteram a derivações urinárias continentes. Cesarianas foram realizadas em mulheres com fechamentos vesicais funcionais para eliminar o estresse sobre o assoalho pélvico e evitar lesão traumática do mecanismo do esfíncter urinário.42
Como mencionado anteriormente, o prolapso de órgãos pélvicos parece ser um problema significativo em pacientes do sexo feminino com extrofia. É comumente observado durante e após a gravidez ou o parto, possivelmente em até metade das pacientes.19 Pode ocorrer em idades jovens e sem atividade sexual ou gravidez prévias.19,43 O deslocamento anterior do introito vaginal e o acentuado deslocamento posterior da alça dorsorretal e de seu compartimento anterior deficiente foram propostos como causas para achados significativos de prolapso.44 Acredita-se que reconstruções mais modernas do assoalho pélvico, o reposicionamento anatômico da bexiga na pelve e o uso de osteotomias possam melhorar esse problema preocupante. Relatos anteriores mostraram que a suspensão uterina foi apenas modestamente bem-sucedida na prevenção de prolapso recorrente.44 No entanto, Stein relatou que a fixação uterina por sacrocolpopexia corrigiu o prolapso em 13 mulheres com mais de 25 anos de seguimento.
Referências
- Hsieh K, O’Loughlin MT, Ferrer FA. Bladder exstrophy and phenotypic gender determination on fetal magnetic resonance imaging. Urology 2005; 65 (5): 998–999. DOI: 10.1016/j.urology.2004.12.060.
- Stec AA, Pannu HK, Tadros YE, Sponseller PD, Fishman EK, Gearhart JP. Pelvic Floor Anatomy In Classic Bladder Exstrophy Using 3-dimensional Computerized Tomography: J Urol 2001; 166 (1444): 1444–1449. DOI: 10.1097/00005392-200110000-00066.
- Silver RI, Partin AW, Epstein JI, Chan DW, Carter HB, Jeffs RD, et al.. Prostate-specific antigen in men born with bladder exstrophy. Urology 1997; 49 (2): 253–256. DOI: 10.1016/s0090-4295(96)00438-4.
- Purves JT, Gearhart JP. The Bladder Exstrophy–epispadias–cloacal Exstrophy Complex. J Pediatr Urol 1999; 22 (8): 386–415. DOI: 10.1016/b978-1-4160-3204-5.00030-x.
- Schober JM, Carmichael PA, Hines M, Ransley PG. The Ultimate Challenge Of Cloacal Exstrophy. J Urol 2002; 167 (300): 300–304. DOI: 10.1097/00005392-200201000-00088.
- Lee RS, Grady R, Joyner B, Casale P, Mitchell M. Can a Complete Primary Repair Approach be Applied to Cloacal Exstrophy? J Urol 2006; 176 (6): 2643–2648. DOI: 10.1016/j.juro.2006.08.052.
- Ben-Chaim J, Peppas DS, Sponseller PD, Jeffs RD, Gearhart JP. Applications of Osteotomy in the Cloacal Exstrophy Patient. J Urol 1995; 5 (1): 865–867. DOI: 10.1097/00005392-199508000-00146.
- Silver RI, Sponseller PD, Gearhart JP. Staged Closure Of The Pelvis In Cloacal Exstrophy: First Description Of A New Approach. J Urol 1999; 161 (1): 263–266. DOI: 10.1016/s0022-5347(01)62128-1.
- Adams MC, Mitchell ME, Rink RC. Gastrocystoplasty: An Alternative Solution to the Problem of Urological Reconstruction in the Severely Compromised Patient. J Urol 1988; 140 (5 Part 2): 1152–1156. DOI: 10.1016/s0022-5347(17)41986-0.
- Hendren WH. Ileal Nipple for Continence in Cloacal Exstrophy. J Urol 1992; 148 (2 Part 1): 372–379. DOI: 10.1016/s0022-5347(17)36601-6.
- Tank ES, Lindenauer SM. Principles of management of exstrophy of the cloaca. Am J Surg 1970; 119 (1): 95–98. DOI: 10.1016/0002-9610(70)90018-8.
- Gearhart JP, Jeffs RD. Techniques to Create Urinary Continence in the Cloacal Exstrophy Patient. J Urol 1991; 146 (2 Part 2): 616–618. DOI: 10.1016/s0022-5347(17)37871-0.
- Ricketts RR, Woodard JR, Zwiren GT, Andrews HG, Broecker BH. Modern treatment of cloacal exstrophy. J Pediatr Surg 1991; 26 (4): 444–450. DOI: 10.1016/0022-3468(91)90993-4.
- Austin PF, Homsy YL, Gearhart JP, Porter K, Guidi C, Madsen K, et al.. The Prenatal Diagnosis Of Cloacal Exstrophy. J Urol 1998; 160 (1179): 1179–1181. DOI: 10.1097/00005392-199809020-00061.
- Hamada H, Takano K, Shiina H, Sakai T, Sohda S, Kubo T. New Ultrasonographic Criterion For The Prenatal Diagnosis Of Cloacal Exstrophy: Elephant Trunk-like Image. J Urol 1999; 162 (6): 2123–2124. DOI: 10.1016/s0022-5347(05)68138-4.
- Husmann DA, McLorie GA, Churchill BM. Phallic Reconstruction in Cloacae Exstrophy. J Urol 1989; 142 (2 Part 2): 563–564. DOI: 10.1016/s0022-5347(17)38816-x.
- Mathews, Perlman, Marsh, Gearhart. Gonadal morphology in cloacal exstrophy: implications in gender assignment. BJU Int 1999; 84 (1): 99–100. DOI: 10.1046/j.1464-410x.1999.00148.x.
- Reiner WG. Psychosexual development in genetic males assigned female: the cloacal exstrophy experience. Child Adolesc Psychiatr Clin N Am 2004; 13 (3): 657–674. DOI: 10.1016/j.chc.2004.02.009.
- Baker Towell DM, Towell AD. A Preliminary Investigation Into Quality of Life, Psychological Distress and Social Competence in Children With Cloacal Exstrophy. J Urol 2003; 169 (5): 1850–1853. DOI: 10.1097/01.ju.0000062480.01456.34.
- Taghizadeh A, Qteishat A, Cuckow PM. Restoring Hindgut Continuity in Cloacal Exstrophy: A Valuable Method of Optimising Bowel Length. Eur J Pediatr Surg 2009; 19 (03): 141–144. DOI: 10.1055/s-0029-1192048.
- Husmann DA, McLorie GA, Churchill BM. Closure of the Exstrophic Bladder: An Evaluation of the Factors Leading to its Success and its Importance on Urinary Continence. J Urol 1989; 142 (2 Part 2): 522–524. DOI: 10.1016/s0022-5347(17)38803-1.
- Levitt MA, Mak GZ, Falcone RA, Peña A. Cloacal exstrophy–pull-through or permanent stoma? J Pediatr Surg 2008; 43 (1): 164–170. DOI: 10.1016/j.jpedsurg.2007.09.039.
- Hurwitz RS, Manzoni GAM, Ransley PG, Stephens FD. Cloacal Exstrophy: A Report of 34 Cases. J Urol 1987; 138 (4 Part 2): 1060–1064. DOI: 10.1016/s0022-5347(17)43502-6.
- Thauvin-Robinet C, Faivre L, Cusin V, Khau Van Kien P, Callier P, Parker KL, et al.. Cloacal exstrophy in an infant with 9q34.1-qter deletion resulting from a de novo unbalanced translocation between chromosome 9q and Yq. Am J Med Genet 2004; 126a (3): 303–307. DOI: 10.1002/ajmg.a.20596.
- Rickham PP. Vesicointestinal Fissure. Anorectal Malformations in Children 1960; 35 (97): 239–249. DOI: 10.1007/978-3-540-31751-7_14.
- Mathews R, Jeffs RD, Reiner WG, Docimo SG, Gearhart JP. Cloacal Exstrophy-improving The Quality Of Life. J Urol 1998; 160 (2452): 2452–2456. DOI: 10.1097/00005392-199812020-00017.
- M K. OEIS Complex (Omphalocele, Exstrophy of Bladder, Imperforate Anus and Spine Defects). Journal of Human Anatomy 2001; 2 (1). DOI: 10.23880/jhua-16000122.
- Appignani BA, Jaramillo D, Barnes PD, Poussaint TY. Dysraphic myelodysplasias associated with urogenital and anorectal anomalies: prevalence and types seen with MR imaging. AJR Am J Roentgenol 1994; 163 (5): 1199–1203. DOI: 10.2214/ajr.163.5.7976901.
- McLaughlin KP, Rink RC, Kalsbeck JE, Keating MA, Adams MC, King SJ, et al.. Cloacal Exstrophy: The Neurological Implications. J Urol 1995; 154 (2): 782–784. DOI: 10.1016/s0022-5347(01)67162-3.
- Karrer FM, Flannery AM, Nelson MD, McLone DG, Raffensperger JG. Anorectal malformations: Evaluation of associated spinal dysraphic syndromes. J Pediatr Surg 1988; 23 (1): 45–48. DOI: 10.1016/s0022-3468(88)80538-4.
- Dick EA, Bruyn R de, Patel K, Owens CM. Spinal Ultrasound in Cloacal Exstrophy. Clin Radiol 2001; 56 (4): 289–294. DOI: 10.1053/crad.2000.0648.
- Husmann DA, Vandersteen DR, Mclorie GA, Churchill BM. Urinary Continence After Staged Bladder Reconstruction For Cloacal Exstrophy: The Effect Of Coexisting Neurological Abnormalities On Urinary Continence. J Urol 1999; 161 (5): 1598–1602. DOI: 10.1016/s0022-5347(05)68990-2.
- Schlegel PN, Gearhart JP. Neuroanatomy of the Pelvis in an Infant with Cloacal Exstrophy: A Detailed Microdissection with Histology. J Urol 1989; 141 (3 Part 1): 583–585. DOI: 10.1016/s0022-5347(17)40901-3.
- Cohen AR. The Mermaid Malformation: Cloacal Exstrophy and Occult Spinal Dysraphism. Neurosurgery 1991; 28 (6): 834–843. DOI: 10.1227/00006123-199106000-00008.
- Sponseller PD, Bisson LJ, Gearhart JP, Jeffs RD, Magid D, Fishman E. The anatomy of the pelvis in the exstrophy complex. J Bone Joint Surg Am 1995; 77 (2): 177–189. DOI: 10.2106/00004623-199502000-00003.
- Stec AAJ, Wakim A, Barbet P, McCarthy EF, Lakshmanan Y, Sponseller PD, et al.. Fetal bony pelvis in the bladder exstrophy complex: normal potential for growth? Urology 2003; 62 (2): 337–341. DOI: 10.1016/s0090-4295(03)00474-6.
- Williams AM, Solaiyappan M, Pannu HK, Bluemke D, Shechter G, Gearhart JP. 3-dimensional Magnetic Resonance Imaging Modeling Of The Pelvic Floor Musculature In Classic Bladder Exstrophy Before Pelvic Osteotomy. J Urol 2004; 172 (4 Part 2): 1702–1705. DOI: 10.1097/01.ju.0000140212.56826.4c.
- Sugar EC, Firlit CF. Management of cloacal exstrophy. Urology 1990; 32 (4): 320–322. DOI: 10.1016/0090-4295(88)90234-8.
- Greene WB, Dias LS, Lindseth RE, Torch MA. Musculoskeletal problems in association with cloacal exstrophy. J Bone Joint Surg Am 1991; 73 (4): 551–560. DOI: 10.2106/00004623-199173040-00012.
- Baird AD, Nelson CP, Gearhart JP. Modern staged repair of bladder exstrophy. J Pediatr Urol 2007; 3 (311). DOI: 10.18591/bjuik.0243.
- Purves JT, Baird AD, Gearhart JP. The modern staged repair of bladder exstrophy in the female: A contemporary series. J Pediatr Urol 2008; 4 (2): 150–153. DOI: 10.1016/j.jpurol.2007.08.003.
- Hanna MK, Williams DI. Genital Function In Males With Vesical Exstrophy And Epispadias. Br J Urol 1969; 44 (2): 169–174. DOI: 10.1111/j.1464-410x.1972.tb10062.x.
- Stein R, Stöckle M, Fisch M, Nakai H, Müller SC, Hohenfellner R. The Fate Of The Adult Exstrophy Patient. J Urol 1994; 152 (5 Part 1): 1413–1416. DOI: 10.1016/s0022-5347(17)32433-3.
- Bastuba MD, Alper MM, Oates RD. Fertility and the use of assisted reproductive techniques in the adult male exstrophy/epispadias patient. Fertil Steril 1993; 60 (4): 733–736. DOI: 10.1016/s0015-0282(16)56234-7.
- Woodhouse CRJ. Sexual function in boys born with exstrophy, myelomeningocele, and micropenis. Urology 1998; 52 (1): 3–11. DOI: 10.1016/s0090-4295(98)00121-6.
- Ben-Chaim J, Jeffs RD, Reiner WG, Gearhart JP. The Outcome of Patients with Classic Bladder Exstrophy in Adult Life. The Exstrophy–Epispadias Complex 1996; 155 (1251): 169–173. DOI: 10.1007/978-1-4757-3056-2_26.
- Kropp BP, Cheng EY. Total Urogenital Complex Mobilization In Female Patients With Exstrophy. J Urol 2000; 164 (1035): 1035–1039. DOI: 10.1097/00005392-200009020-00028.
- Woodhouse CRJ. The gynaecology of exstrophy. BJU Int 1999; 83 (S3): 34–38. DOI: 10.1046/j.1464-410x.1999.0830s3034.x.
- Mathews RI, Gan M, Gearhart JP. Urogynaecological and obstetric issues in women with the exstrophy-epispadias complex. BJU Int 2003; 91 (9): 845–849. DOI: 10.1046/j.1464-410x.2003.04244.x.
- Canalichio KL, Ahn J, Artigas P, Amies Oelschlager A-ME, Rowe C, Merguerian P, et al.. Patient-reported outcomes in adult females with bladder exstrophy: A study of long-term sexual, reproductive and urinary outcomes using social media. J Pediatr Urol 2020; 16 (5): 567.e1–567.e7. DOI: 10.1016/j.jpurol.2020.06.020.
- Canalichio KL, Ahn J, Hwang C, Amies AM, Merguerian P, Shnorhavorian M. Faculty Opinions recommendation of Long-term urological and gynecological outcomes following complete primary repair in females with bladder exstrophy. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2021; 7 (5): 08 1–608 8. DOI: 10.3410/f.740664374.793590655.
- Giron AM, Passerotti CC, Nguyen H, Cruz JASda, Srougi M. Bladder exstrophy: reconstructed female patients achieving normal pregnancy and delivering normal babies. Int Braz J Urol 2011; 37 (5): 605–610. DOI: 10.1590/s1677-55382011000500006.
- Kramer SA, Jackson IT. Bilateral Rhomboid Flaps for Reconstruction of the External Genitalia in Epispadias-Exstrophy. Plast Reconstr Surg 1986; 77 (4): 621–629. DOI: 10.1097/00006534-198604000-00019.
- Krisiloff M, Puchner PJ, Tretter W, Macfarlane MT, Lattimer JK. Pregnancy in Women with Bladder Exstrophy. J Urol 1978; 119 (4): 478–479. DOI: 10.1016/s0022-5347(17)57522-9.
- Burbige KA, Hensle TW, Chambers WJ, Leb R, Jeter KF. Pregnancy and sexual function in women with bladder exstrophy. Urology 1986; 28 (1): 12–14. DOI: 10.1016/0090-4295(86)90172-x.
- Kennedy WA, Hensle TW, Reiley EA, Fox HE, Haus T. Pregnancy after orthotopic continent urinary diversion. Int J Gynaecol Obstet 1993; 46 (1): 88–89. DOI: 10.1016/0020-7292(94)90337-9.
- Stein R, Fisch M, Bauer H, Friedberg V, Hohenfellner R. Operative Reconstruction of the External and Internal Genitalia in Female Patients with Bladder Exstrophy or Incontinent Epispadias. J Urol 1995; 154 (1002): 1002–1007. DOI: 10.1097/00005392-199509000-00026.
- Mednick L, Gargollo P, Oliva M, Grant R, Borer J. Stress and Coping of Parents of Young Children Diagnosed With Bladder Exstrophy. J Urol 2009; 181 (3): 1312–1317. DOI: 10.1016/j.juro.2008.10.051.
- Meldrum KK, Mathews RI, Nelson CP, Gearhart JP. Subspecialty training and surgical outcomes in children with failed bladder exstrophy closure. J Pediatr Urol 2005; 1 (2): 95–99. DOI: 10.1016/j.jpurol.2005.01.002.
- Nelson CP, North AC, Ward MK, Gearhart JP. Economic Impact of Failed or Delayed Primary Repair of Bladder Exstrophy: Differences in Cost of Hospitalization. J Urol 2008; 179 (2): 680–683. DOI: 10.1016/j.juro.2007.09.093.
- Nelson CP, Dunn RL, Wei JT, Gearhart JP. Surgical Repair Of Bladder Exstrophy In The Modern Era: Contemporary Practice Patterns And The Role Of Hospital Case Volume. J Urol 2005; 174 (3): 1099–1102. DOI: 10.1097/01.ju.0000169132.14799.33.
- Bethell G, Johal N, Cuckow P. Cloacal Exstrophy Repair with Primary Closure of Bladder Exstrophy: A Case Report and Review of Literature. Case Rep Pediatr 1952; 2016 (654): 1–3. DOI: 10.1155/2016/8538935.
- Cendron l., Zanotti G, Percudani R, Ramazzina I, Puggioni V, Maccacaro E, et al.. Crystal structure of allantoin racemase from Pseudomonas fluorescens AllR. Ann Chir Infant 1971; 12 (371). DOI: 10.2210/pdb5lfd/pdb.
- Jeffs RD, Charrios R, Mnay M. Primary closure of the exstrophied bladder. In: Scott R, editor. Current Controversies in Urologic Management. Philadelphia:WB Saunders; 1972. DOI: 10.1097/00006534-195701000-00025.
- Landes RR, Melnick I, Klein R. Vesical exstrophy with epispadias twenty-year follo-up. Urology 1973; 9 (1): 53–56. DOI: 10.1016/0090-4295(77)90285-0.
- Gearhart JP, Jeffs RD. State-of-the-Art Reconstructive Surgery for Bladder Exstrophy at The Johns Hopkins Hospital. Arch Pediatr Adolesc Med 1989; 143 (12): 1475. DOI: 10.1001/archpedi.1989.02150240097026.
- Grady RW, Mitchell ME. Complete Primary Repair Of Exstrophy. J Urol 1999; 162 (4): 1415–1420. DOI: 10.1016/s0022-5347(05)68327-9.
- Chan DY, Jeffs RD, Gearhart JP. Determinants of continence in the bladder exstrophy population: predictors of success? Urology 2001; 57 (4): 774–777. DOI: 10.1016/s0090-4295(00)01102-x.
- Stein R, Fisch M, Black P, Hohenfellner R. Strategies For Reconstruction After Unsuccessful Or Unsatisfactory Primary Treatment Of Patients With Bladder Exstrophy Or Incontinent Epispadias. J Urol 1999; 161 (1934): 1934–1941. DOI: 10.1097/00005392-199906000-00066.
- Grady RW, Mitchell ME. Surgical techniques for one-stage reconstruction of the exstrophy-epispadias complex. In: Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA, editors. Campbell-Walsh Urology. Philadelphia: Saunders; 2007.
- Husmann DA. Surgery Insight: advantages and pitfalls of surgical techniques for the correction of bladder exstrophy. Nat Clin Pract Urol 2006; 3 (2): 95–100. DOI: 10.1038/ncpuro0407.
- Kibar Y, Roth CC, Frimberger D, Kropp BP. Our initial experience with the technique of complete primary repair for bladder exstrophy. J Pediatr Urol 2009; 5 (3): 186–189. DOI: 10.1016/j.jpurol.2008.11.005.
- Mitchell ME. Bladder exstrophy repair: Complete primary repair of exstrophy. Urology 2005; 65 (1): 5–8. DOI: 10.1016/j.urology.2004.07.030.
- Gargollo PC, Borer JG, Diamond DA, Hendren WH, Rosoklija I, Grant R, et al.. Prospective Followup in Patients After Complete Primary Repair of Bladder Exstrophy. J Urol 2008; 180 (4s): 1665–1670. DOI: 10.1016/j.juro.2008.05.076.
- Shnorhavorian M, Grady RW, Anderson A. Long-Term Followup of Complete Primary Repair of Exstrophy: The Seattle Experience. Yearbook of Urology 2008; 2009 (1615): 214–215. DOI: 10.1016/s0084-4071(09)79240-1.
- Hafez AT, El-Sherbiny MT. Complete Repair Of Bladder Exstrophy: Management Of Resultant Hypospadias. J Urol 2005; 173 (3): 958–961. DOI: 10.1097/01.ju.0000147012.49955.6f.
- Gearhart JP, Baird AD. The Failed Complete Repair Of Bladder Exstrophy: Insights And Outcomes. J Urol 2005; 174 (4 Part 2): 1669–1673. DOI: 10.1097/01.ju.0000175994.35468.2f.
- Gargollo PC, Borer JG. Contemporary outcomes in bladder exstrophy. Curr Opin Urol 2007; 17 (4): 272–280. DOI: 10.1097/mou.0b013e3281ddb32f.
- Shapiro E, Jeffs RD, Gearhart JP, Lepor H. Muscarinic Cholinergic Receptors in Bladder Exstrophy: Insights Into Surgical Management. J Urol 1985; 134 (2): 308–310. DOI: 10.1016/s0022-5347(17)47139-4.
- Lee BR, Perlman EJ, Partin AW, Jeffs RD, Gearhart JP. Evaluation of Smooth Muscle and Collagen Subtypes in Normal Newborns and Those With Bladder Exstrophy. J Urol 1996; 156 (203): 2034–2036. DOI: 10.1097/00005392-199612000-00042.
- Peppas DS, Tchetgen M-B, Lee BR, Jeffs RD, Gearhart JP. A Quantitative Histological Analysis of the Bladder in Classical Bladder Exstrophy in Various Stages of Reconstruction Utilizing Color Morphometry. The Exstrophy–Epispadias Complex 1999; 1999 (41): 41–47. DOI: 10.1007/978-1-4757-3056-2_7.
- Lais A, Paolocci N, Ferro F, Bosman C, Boldrini R, Caione P. Morphometric Analysis of Smooth Muscle in the Exstrophy-Epispadias Complex. J Urol 1996; 156 (819): 819–821. DOI: 10.1097/00005392-199608001-00074.
- Orsola A, Estrada CR, Nguyen HT, Retik AB, Freeman MR, Peters CA, et al.. Growth and stretch response of human exstrophy bladder smooth muscle cells: molecular evidence of normal intrinsic function. BJU Int 2005; 95 (1): 144–148. DOI: 10.1111/j.1464-410x.2004.05267.x.
- Mathews R, Wills M, Perlman E, Gearhart JP. Neural Innervation Of The Newborn Exstrophic Bladder. J Urol 1999; 162 (506): 506–508. DOI: 10.1097/00005392-199908000-00076.
- Rösch W, Christl A, Strauss B, Schrott K-M, Neuhuber WL. Comparison of Preoperative Innervation Pattern and Postreconstructive Urodynamics in the Exstrophy-Epispadias Complex. Urol Int 1997; 59 (1): 6–15. DOI: 10.1159/000283009.
- Hipp J, Andersson K-E, Kwon TG, Kwak EK, Yoo J, Atala A. Microarray analysis of exstrophic human bladder smooth muscle. BJU Int 2008; 0 (0): 070916224627009–??? DOI: 10.1111/j.1464-410x.2007.07211.x.
- Novak TE, Lakshmanan Y, Frimberger D, Epstein JI, Gearhart JP. Polyps In The Exstrophic Bladder. A Cause For Concern? J Urol 2005; 174 (4 Part 2): 1522–1526. DOI: 10.1097/01.ju.0000179240.25781.1b.
- Toguri AG, Churchill BM, Schillinger JF, Jeffs RD. Continence in Cases of Bladder Exstrophy. J Urol 1987; 119 (4): 538–540. DOI: 10.1016/s0022-5347(17)57541-2.
- Diamond DA, Bauer SB, Dinlenc C, Hendren WH, Peters CA, Atala A, et al.. Normal Urodynamics In Patients With Bladder Exstrophy: Are They Achievable? J Urol 1999; 162 (3 Part 1): 841–845. DOI: 10.1097/00005392-199909010-00072.
- Mathews R, Gosling JA, Gearhart JP. Ultrastructure Of The Bladder In Classic Exstrophy: Correlation With Development Of Continence. J Urol 2004; 172 (4 Part 1): 1446–1449. DOI: 10.1097/01.ju.0000138248.43831.27.
- Wakim A, Barbet JP. Connections of the bladder plate and bladder neck with the bony pelvis in a fetus with classic bladder exstrophy. Urology 2002; 60 (1): 142–146. DOI: 10.1016/s0090-4295(02)01715-6.
- Gearhart JP, Mathews R. The Failed Exstrophy Closure. The Exstrophy–Epispadias Complex 1991; 18 (687): 93–96. DOI: 10.1007/978-1-4757-3056-2_15.
- Connolly JA, Peppas DS, Jeffs RD, Gearhart JP. Prevalence and Repair of Inguinal Hernias in Children with Bladder Exstrophy. J Urol 1995; 154 (1900): 1900–1901. DOI: 10.1097/00005392-199511000-00093.
- Baker LA, Gearhart JP. The staged approach to bladder exstrophy closure and the role of osteotomies. World J Urol 1998; 16 (3): 205–211. DOI: 10.1007/s003450050054.
- Silver RI, Yang A, Ben-Chaim J, Jeffs RD, Gearhart JP. Penile Length in Adulthood after Exstrophy Reconstruction. The Exstrophy–Epispadias Complex 1997; 158 (999): 117–125. DOI: 10.1007/978-1-4757-3056-2_19.
- Gearhart JP, Yang A, Leonard MP, Jeffs RD, Zerhouni EA. Prostate Size and Configuration in Adults with Bladder Exstrophy. J Urol 1993; 149 (2): 308–310. DOI: 10.1016/s0022-5347(17)36064-0.
- Berkowitz J, Carter HB, Gearhart JP. Prostate Cancer in Patients with the Bladder Exstrophy-Epispadias Complex: Insights and Outcomes. Urology 2008; 71 (6): 1064–1066. DOI: 10.1016/j.urology.2007.12.069.
- D’Hauwers KWM, Feitz WFJ, Kremer JAM. Bladder exstrophy and male fertility: pregnancies after ICSI with ejaculated or epididymal sperm. Fertil Steril 2008; 89 (2): 387–389. DOI: 10.1016/j.fertnstert.2007.03.005.
- Cadeddu JA, Benson JE, Silver RI, Lakshmanan Y, Jeffs RD, Gearhart JP. Spinal abnormalities in classic bladder exstrophy. BJU Int 1997; 79 (6): 975–978. DOI: 10.1046/j.1464-410x.1997.00190.x.
- Halachmi S, Farhat W, Konen O, Khan A, Hodapp J, Bagli DJ, et al.. Pelvic Floor Magnetic Resonance Imaging after Neonatal Single Stage Reconstruction in Male Patients With Classic Bladder Exstrophy. J Urol 2003; 170 (4 Part 2): 1505–1509. DOI: 10.1097/01.ju.0000087463.92231.b1.
- Gargollo PC, Borer JG, Retik AB, Peters CA, Diamond DA, Atala A, et al.. Magnetic Resonance Imaging Of Pelvic Musculoskeletal And Genitourinary Anatomy In Patients Before And After Complete Primary Repair Of Bladder Exstrophy. J Urol 2005; 174 (4 Part 2): 1559–1566. DOI: 10.1097/01.ju.0000175997.60933.fe.
- Ebert AK, Falkert A, Brandl R, Hirschfelder H, Koller M, RÃ\textparagraphsch WH. Pelvic-floor imaging using three-dimensional ultrasonography and magnetic resonance imaging in the long term follow-up of the bladder-exstrophy-epispadias complex. BJU Int 2010; 105 (2): 248–253. DOI: 10.1111/j.1464-410x.2009.08736.x.
- Ives E, Coffey R, Carter CO. A family study of bladder exstrophy. J Med Genet 1980; 17 (2): 139–141. DOI: 10.1136/jmg.17.2.139.
- Reutter H, Qi L, Gearhart JP, Boemers T, Ebert A-K, Rösch W, et al.. Concordance analyses of twins with bladder exstrophy–epispadias complex suggest genetic etiology. Am J Med Genet A 2007; 143a (22): 2751–2756. DOI: 10.1002/ajmg.a.31975.
- Boyadjiev SA, Dodson JL, Radford CL, Ashrafi GH, Beaty TH, Mathews RI, et al.. Clinical and molecular characterization of the bladder exstrophy-epispadias complex: analysis of 232 families. BJU Int 2004; 94 (9): 1337–1343. DOI: 10.1111/j.1464-410x.2004.05170.x.
- Wood HM, Trock BJ, Gearhart JP. In Vitro Fertilization and the Cloacal-Bladder Exstrophy-Epispadias Complex: Is there an Association? J Urol 2003; 169 (4): 1512–1515. DOI: 10.1097/01.ju.0000054984.76384.66.
- Wood HM, Babineau D, Gearhart JP. In vitro fertilization and the cloacal/bladder exstrophy–epispadias complex: A continuing association. J Pediatr Urol 2007; 3 (4): 305–310. DOI: 10.1016/j.jpurol.2006.10.007.
- Boyadjiev SA, South ST, Radford CL, Patel A, Zhang G, Hur DJ, et al.. A reciprocal translocation 46,XY,t(8;9)(p11.2;q13) in a bladder exstrophy patient disrupts CNTNAP3 and presents evidence of a pericentromeric duplication on chromosome 9. Genomics 2004; 85 (5): 622–629. DOI: 10.1016/j.ygeno.2005.01.002.
- Reutter H, Thauvin-Robinet C, Boemers TM, Rösch WH, Ludwig M. Bladder exstrophy–epispadias complex: Investigation of suppressor of variegation, enhancer of zeste and Trithorax (SET) as a candidate gene in a large cohort of patients. Scand J Urol Nephrol 2006; 40 (3): 221–224. DOI: 10.1080/00365590600621204.
- Ludwig M, Ruschenforf F, Saar K, Hubner N, Siekmann L, Boyadjiev SA, et al.. Genome-wide linkage scan for bladder exstrophy-epispadias complex. Birth Defects Res A Clin Mol Teratol. 2009; 5 (2): 74–78.
- Gearhart J, Benchaim J, Jeffs R, Sanders R. Criteria for the prenatal diagnosis of classic bladder exstrophy. Obstet Gynecol 1995; 85 (6): 961–964. DOI: 10.1016/0029-7844(95)00069-4.
- Gobbi D, Fascetti Leon F, Tregnaghi A, Gamba PG, Midrio P. Early Prenatal Diagnosis of Cloacal Exstrophy with Fetal Magnetic Resonance Imaging. Fetal Diagn Ther 2008; 24 (4): 437–439. DOI: 10.1159/000174570.
- Lattimer JK, Vernon Smith MJ. Exstrophy Closure: a Followup on 70 Cases. J Urol 1966; 95 (3): 356–359. DOI: 10.1016/s0022-5347(17)63460-8.
- Birth Defects Monitoring Systems IC for. Epidemiology of bladder exstrophy and epispadias: A communication from the international clearinghouse for birth defects monitoring systems. Teratology 1987; 36 (2): 221–227. DOI: 10.1002/tera.1420360210.
- Nelson CP, Dunn RL, Wei JT. Contemporary Epidemiology Of Bladder Exstrophy In The United States. J Urol 2005; 173 (5): 1728–1731. DOI: 10.1097/01.ju.0000154821.21521.9b.
- Ambrose SS, O’Brien DP. Surgical Embryology of the Exstrophy-Epispadias Complex. Surg Clin North Am 1974; 54 (6): 1379–1390. DOI: 10.1016/s0039-6109(16)40493-7.
- Marshall VF, Muecke C. Congenital abnormalities of the bladder. Handbuch der Urologie. New York: Springer Verlag; 1968. DOI: 10.1007/978-3-642-87399-7_4.
- Mildenberger H, Kluth D, Dziuba M. Embryology of bladder exstrophy. J Pediatr Surg 1988; 23 (2): 166–170. DOI: 10.1016/s0022-3468(88)80150-7.
- Johnson JH, Kogan SJ. The exstrophic anomalies and their surgical reconstruction. Curr Prob Surg 1974 (August):1-3. DOI: 10.1016/s0011-3840(74)80011-0.
- Rubenwolf P, Thomas C, Thüroff JW, Stein R. Sexual Function and Fertility of Women with Classic Bladder Exstrophy and Continent Urinary Diversion. J Urol 2016; 196 (1): 140–145. DOI: 10.1016/j.juro.2015.12.099.
Ultima atualização: 2025-09-21 13:35