14: Hidronefrose e Obstrução da Junção Ureteropélvica
Este capítulo levará aproximadamente 26 minutos para ler.
Introdução
A hidronefrose é definida como dilatação asséptica da pelve renal com ou sem os cálices. Se ocorrer antes do nascimento, isso é chamado de hidronefrose antenatal (ANH). A presença de hidronefrose infectada denota pionefrose, enquanto a presença de ureter dilatado com a pelve renal dilatada é chamada de hidroureteronefrose (HUN).
A relevância da ANH é atribuída ao fato de ser a anomalia do trato urinário fetal mais frequentemente detectada pela ultrassonografia.1 A maioria dos casos de ANH é temporária e resolve-se espontaneamente. As demais causas patológicas de ANH podem ser obstrutivas ou não obstrutivas. As causas obstrutivas podem ocorrer em qualquer parte do trato urinário, mas a patologia mais comum é a obstrução da junção ureteropélvica (UPJO). As etiologias não obstrutivas incluem refluxo vesicoureteral (VUR), megaureter não obstrutivo e não refluxivo, síndrome de Prune-Belly, etc.
Muitas ferramentas são usadas por urologistas pediátricos para medir a gravidade da ANH. A escola norte-americana baseia-se principalmente no sistema de classificação da Society of Fetal Urology (SFU), enquanto a medição do APRPD é preferida na Europa.2
UPJO é definida como o comprometimento do fluxo de urina da pelve renal para o ureter, com dilatação subsequente do sistema pielocalicinal. A presença de pelve renal dilatada com ureter não dilatado na RBUS levanta a suspeita de UPJO.
Este capítulo abordará a embriologia, epidemiologia, etiologia, diagnóstico, avaliação, opções de tratamento, seguimento e complicações de ANH e UPJO. As demais causas de ANH serão abordadas em outros capítulos.
Embriologia
Os rins desenvolvem-se a partir de três estruturas sequenciais sobrepostas; o pronefro, o mesonefro e o metanefro, que são todos derivados de uma região do mesoderma intermediário conhecida como crista urogenital.3 Na quarta semana de gestação, o pronefro surge na região cervical. Em seguida, partes segmentadas do mesoderma intermediário conectam-se para formar o ducto pronéfrico, que se estende da região cervical até a extremidade distal do embrião (cloaca). O pronefro é não funcional e regride completamente até o final da quarta semana gestacional.
Após isso, o mesonefro emerge caudal ao pronefro, e a persistência do ducto pronéfrico induz a formação de túbulos mesonéfricos a partir do mesoderma intermediário, que se abrem no ducto pronéfrico, formando o ducto mesonéfrico (de Wolff). O broto ureteral origina-se do aspecto posterior do ducto mesonéfrico.
O metanéfro surge na quinta semana do desenvolvimento. Após isso, o broto ureteral une-se ao blastema metanéfrico. O broto ureteral dá origem à mucosa do ureter, à pelve renal, aos cálices maiores e menores e aos ductos coletores. O mesênquima ao redor do broto ureteral forma a lâmina própria, a musculosa e a adventícia do ureter e da pelve renal. O desenvolvimento adequado do ureter e da pelve renal depende de sinalização recíproca entre seus componentes mesenquimais e epiteliais. Sinalização anormal resulta em desenvolvimento e ramificação inadequados do broto ureteral. A duplicação ureteral completa resulta do desenvolvimento de dois brotos ureterais no mesmo lado, enquanto a duplicação ureteral incompleta decorre de bifurcação precoce do broto ureteral. No caso de bifurcação tardia do broto ureteral, forma-se uma pelve renal bífida. A lei de Weigert-Meyer descreve a relação entre os dois ureteres na duplicação ureteral completa. O ureter do polo superior insere-se na bexiga inferomedialmente, e é o local de obstrução por uma ureterocele ou um ureter ectópico. Por outro lado, o ureter do polo inferior insere-se superolateralmente na bexiga, tornando-o suscetível a VUR devido ao curto túnel intramural. Além disso, pode ser acometido por UPJO.
Por fim, a canalização ureteral e a maturação da parede ureteral ocorrem no final da embriogênese. No entanto, esta última continua além do nascimento e isso pode explicar a resolução espontânea de muitos casos diagnosticados com ANH. O rim fetal começa a produzir urina entre a quinta e a nona semana de gestação. A urina representa cerca de 90% do líquido amniótico, que, por sua vez, é responsável pela expansão dos alvéolos pulmonares. Assim, o oligoidrâmnio está associado à hipoplasia pulmonar, que se apresenta clinicamente como desconforto respiratório. O seio urogenital dá origem à bexiga e à uretra entre a 10ª e a 12ª semana de gestação.
Epidemiologia
ANH é a anomalia mais comum do trato urinário detectada pela ultrassonografia fetal. Afeta de um a cinco por cento de todas as gravidezes. Felizmente, até 80% dos casos são temporários e resolvem-se espontaneamente. UPJO é a causa mais comum de ANH patológica e é tipicamente tratada por intervenção cirúrgica. Afeta os meninos duas vezes mais do que as meninas e o lado esquerdo é acometido duas vezes mais do que o direito. UPJO pode afetar ambos os rins em 10% a 30% dos casos.
UPJO é geralmente esporádica, mas seis casos com história familiar foram relatados na literatura.4 UPJO pode ocorrer com outras anomalias urológicas (por exemplo, VUR, rim displásico multicístico (MCDK), rim em ferradura ou rim duplicado em que a porção inferior é mais frequentemente o sítio afetado).
Etiologia/Patogênese
A maioria dos casos de ANH é temporária e melhora espontaneamente com o tempo. Causas patológicas que não se resolvem no período pós-natal podem dever-se a causas obstrutivas ou não obstrutivas. As causas obstrutivas incluem; UPJO, megaureter obstrutivo, ureterocele, ureter ectópico, válvula uretral posterior (PUV), atresia uretral, além de bexiga neurogênica. As etiologias não obstrutivas compreendem; VUR, megaureter não obstrutivo não refluxivo, síndrome de Prune-Belly.
Segundo Josephson et al., a obstrução é acompanhada por redução do fluxo sanguíneo renal (RBF), da taxa de filtração glomerular (GFR) e da excreção de potássio, e apenas uma ínfima porcentagem desse dano é mitigada por intervenção precoce.5
Causas da UPJO
A OJUP primária pode ser causada por causas intrínsecas, extrínsecas ou intraluminais.6 A obstrução intrínseca deve-se a um segmento aperistáltico resultante de musculatura anormal ou de desenvolvimento neurológico anormal. Isso resulta em fluxo urinário inadequado da pelve renal para o ureter. Outras causas de obstrução intrínseca incluem segmento estenótico causado por deposição excessiva de colágeno e pregas ureterais congênitas.
A obstrução extrínseca é causada por um vaso aberrante cruzado que passa à frente da junção ureteropélvica (UPJ). Esse tipo de obstrução geralmente é intermitente e se apresenta mais tardiamente, aos sete anos de idade ou mais. A obstrução intraluminal deve-se a um pólipo fibroepitelial. Essa patologia pode acometer qualquer segmento do trato urinário, desde a UPJ até a uretra.7 A UPJO secundária decorre de cirurgia prévia, VUR, cálculo impactado e estenose pós-inflamatória.
As anomalias associadas à UPJO incluem; UPJO contralateral (10-30%), displasia renal contralateral, MCDK contralateral, agenesia renal unilateral (5%), sistema coletor duplicado em que a UPJO geralmente ocorre na porção inferior, rim em ferradura, rim ectópico, VUR (20-40%) e síndrome VACTERL.8,9
Para evitar o aumento progressivo da pressão intrapiélica, a pelve renal se dilata para acomodá-la, prevenindo dano renal. No entanto, a obstrução prolongada, com falha dos mecanismos compensatórios e perda de complacência, resulta em aumento da pressão intrarrenal, com subsequente dano renal. Quanto mais precoce for a obstrução durante a vida fetal, maior é o dano renal esperado. A crise de Dietl é uma dor abdominal intermitente decorrente da distensão do sistema pielocalicial e geralmente é causada por um vaso cruzado provocando obstrução da junção ureteropélvica (JUP) em crianças com mais de cinco anos.10
Avaliação e diagnóstico
O diagnóstico de ANH baseia-se na mensuração do APRPD, que é de cinco mm ou mais no segundo trimestre e de sete mm ou mais no terceiro.11 A interpretação do RBUS fetal envolve os seguintes itens; sexo fetal, índice de líquido amniótico (AFI), idade gestacional, anomalias congênitas associadas, hidronefrose unilateral ou bilateral, grau de hidronefrose, APRPD, estado parenquimatoso em termos de espessura do parênquima e ecogenicidade, dilatação ureteral, repleção e ciclagem vesicais, além da espessura de sua parede, e dilatação uretral (Tabela 1).
Tabela 1 As dez perguntas a serem abordadas para a avaliação da hidronefrose antenatal.
| 10 Perguntas | Pergunta |
|---|---|
| 1 pergunta relacionada ao líquido amniótico | Índice de líquido amniótico (AFI) |
| 3 perguntas relacionadas ao feto | Masculino ou feminino |
| Idade gestacional | |
| Outras anomalias congênitas | |
| 3 perguntas relacionadas ao rim | Grau e lateralidade da hidronefrose |
| Dilatação do ureter superior | |
| Parênquima renal (espessura parenquimatosa e ecogenicidade) | |
| 3 perguntas relacionadas ao restante do trato urinário | Dilatação do ureter inferior |
| Bexiga (repleção vesical e espessura da parede vesical) | |
| Dilatação da uretra posterior |
Uma espessura da parede da bexiga cheia de mais de dois mm indica parede vesical espessada, independentemente da idade gestacional.12 A incapacidade de visualizar a bexiga em várias ocasiões é um sinal de extrofia vesical. Em PUV, pode-se observar uma bexiga cheia com uretra posterior dilatada, resultando no “sinal do buraco da fechadura”.
No segundo trimestre, a ANH é classificada em leve, moderada e grave quando o APRPD é de quatro a seis mm, sete a dez mm e mais de dez mm, respectivamente. No terceiro trimestre, a hidronefrose pré-natal é classificada nos mesmos graus anteriores quando o APRPD mede sete a nove mm, dez a 15 mm e mais de 15 mm, respectivamente (Tabela 2).11
Tabela 2 Categorias de hidronefrose antenatal.
| Grau | 2º trimestre | 3º trimestre | % de HNA |
|---|---|---|---|
| leve | 4-7 mm | 7-9 mm | 56-88% |
| moderada | 7-10 mm | 9-15 mm | 10-30% |
| grave | >10 mm | >15 mm | 2-13% |
O bebê deve ser reavaliado de três a sete dias após o nascimento e não antes, para evitar resultados falso-negativos causados por oligúria transitória do recém-nascido, especialmente nas primeiras 48 horas de vida. Ainda assim, a RBUS é realizada imediatamente após o parto em casos de hidronefrose bilateral de alto grau, rim único, oligoâmnio ou quando há suspeita de PUV.
Na América do Norte, o sistema de classificação SFU é utilizado para classificar a hidronefrose, enquanto o APRPD é utilizado na Europa. A classificação SFU da hidronefrose está ilustrada na Tabela 3.13
Tabela 3 Sistema de classificação da SFU.
| Grau SFU | Descritores |
|---|---|
| Grau 0 | sem dilatação, as paredes caliciais estão justapostas |
| Grau 1 (leve) | dilatação da pelve renal sem dilatação dos cálices (pode também ocorrer na pelve extrarrenal) |
| sem atrofia parenquimatosa | |
| Grau 2 (leve) | dilatação da pelve renal (leve) e dos cálices (o padrão pielocalicial está preservado) |
| sem atrofia parenquimatosa | |
| Grau 3 (moderada) | dilatação moderada da pelve renal e dos cálices |
| embotamento dos forníces e achatamento das papilas | |
| pode-se observar afinamento cortical leve | |
| Grau 4 (grave) | dilatação acentuada da pelve renal e dos cálices, que apresentam aspecto balonado |
| perda dos limites entre a pelve renal e os cálices | |
| atrofia renal evidenciada como afinamento cortical |
A desvantagem do sistema de classificação da SFU é ser um tanto subjetivo por não utilizar as medidas da APRPD, o que dificulta sua correlação com as medidas de ANH. Com base na APRPD, a hidronefrose é graduada em leve, moderada e acentuada, em que a APRPD mede 7-10 mm, 10-15 mm e acima de 15 mm, respectivamente.14 A limitação dessa classificação é depender de apenas um único parâmetro para graduar a hidronefrose e negligenciar outros parâmetros, como a espessura do parênquima e a dilatação calicial periférica.
Portanto, foi proposta uma nova classificação da hidronefrose para evitar as desvantagens dos dois sistemas de graduação anteriores. O sistema de classificação da dilatação do trato urinário (UTD) baseia-se em seis achados de RBUS; APRPD, dilatação calicial com a distinção entre dilatação calicial central e periférica no período pós-natal, espessura do parênquima renal, aspecto do parênquima renal, anormalidades vesicais e anormalidades ureterais. Este sistema de graduação distingue se os achados de RBUS foram pré-natais (normal, A1, A2, A3) ou pós-natais (normal, P1, P2, P3).15
Se o RBUS estiver sem alterações significativas, deve ser repetido após quatro a seis semanas. No caso de grau 0 da SFU, com APRPD inferior a sete mm, como resultado do RBUS realizado entre a quarta e a sexta semana, não é necessário acompanhamento adicional. O efeito do grau de hidronefrose sobre a taxa de resolução foi estudado por.16
Se a hidronefrose pós-natal for detectada na presença de dilatação ureteral ou suspeita de bexiga anormal, deve ser solicitada cistouretrografia miccional (VCUG) para excluir VUR, PUV em meninos (Figura 1), disfunção vesical neuropática ou não neuropática.
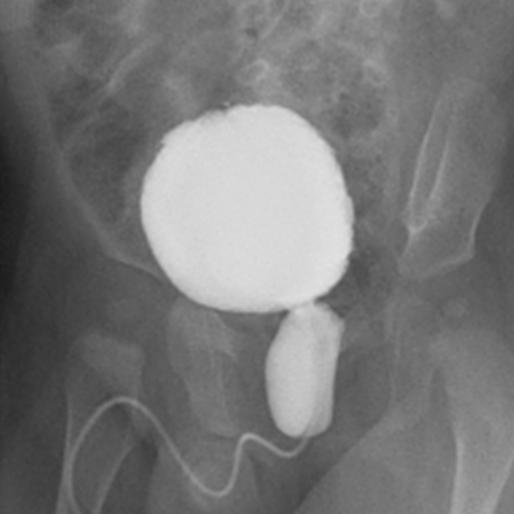
Figura 1 Cistouretrografia miccional mostrando o aspecto clássico da valva uretral posterior.
Na presença de hidronefrose pós-natal grau 1 a 2 pela SFU ou APRPD inferior a 15 mm, sem dilatação ureteral ou bexiga anormal, em um lactente assintomático, o RBUS deve ser realizado a cada três a seis meses e, depois, a cada seis a doze meses.17 A resolução espontânea da hidronefrose geralmente é esperada nos primeiros dois anos de vida.
Por outro lado, hidronefrose grau 3 a 4 da SFU ou APRPD de 15 mm ou mais indica a necessidade de um seguimento mais próximo. Nessa situação, é necessária uma VCUG para excluir VUR, PUV ou patologia vesical. Se a VCUG não mostrar alterações, recomenda-se um renograma dinâmico, especialmente MAG3, para avaliar a função renal diferencial e a presença de obstrução.
A UPJO se apresenta no período pré-natal ou após o nascimento. No que diz respeito ao período pré-natal, a UPJO é a causa mais comum de ANH patológica 18. No período pós-natal, o paciente pode ser assintomático, com hidronefrose descoberta incidentalmente, ou pode apresentar febre alta devido a rim obstruído e infectado ou dor no flanco em crianças mais velhas. Em crianças com mais de cinco anos com obstrução intermitente, deve-se suspeitar de vaso cruzado aberrante.
Hematúria é uma apresentação incomum e geralmente ocorre após trauma no flanco, porque o rim hidronefrótico é mais suscetível a trauma do que o rim normal. Massa palpável no flanco é raramente encontrada na era da ultrassonografia.
O RBUS por si só pode fornecer um diagnóstico provisório da patologia subjacente que causa ANH. Uma pelve renal dilatada com ureter não dilatado indica UPJO (Figura 2) enquanto um ureter dilatado pode dever-se a VUR ou megaureter. Na MCDK, os cistos renais não estão conectados entre si e o parênquima renal não é preservado, ao passo que os cistos renais são geralmente bilaterais e comunicantes com parênquima renal preservado. A ureterocele aparece como um cisto dentro de um cisto (a bexiga), e está associada ao polo superior de sistemas renais duplicados em 80% dos casos enquanto os 20% restantes são ureteroceles de sistema único que necessitam de punção para descompressão do sistema. A aparência em ‘buraco de fechadura’ da bexiga dilatada e da uretra posterior em meninos é diagnóstica de PUV.
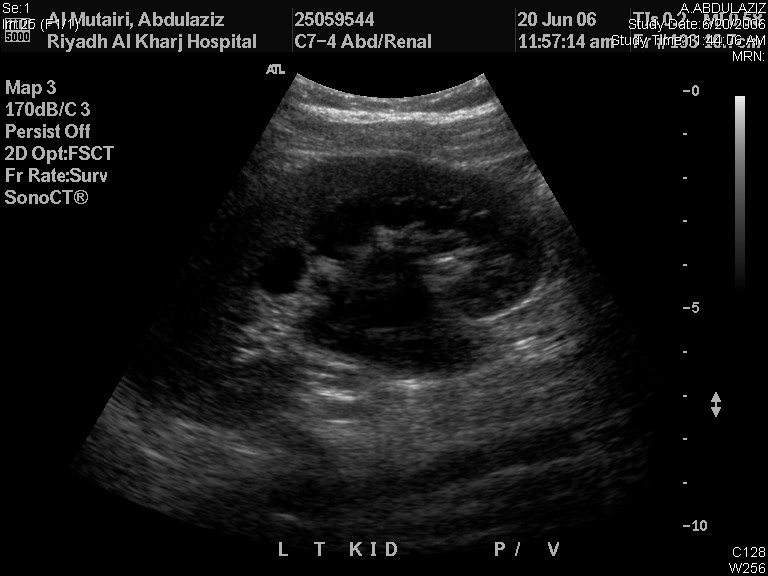
Figura 2 Ultrassonografia renal e vesical mostrando UPJO à esquerda
O papel da cintilografia renal não pode ser negligenciado. São utilizados três tipos de cintilografia renal: ácido mercaptoacetiltriglicina (MAG3), ácido dietilenotriaminopentacético (DTPA) e ácido dimercaptossuccínico (DMSA).18 Todos eles são marcados com tecnécio-99 metastável (99mTc). O MAG3 apresenta excreção tanto tubular quanto glomerular. O DTPA é filtrado apenas pelos glomérulos; por isso, não deve ser solicitado em caso de insuficiência renal. O DMSA se liga apenas aos túbulos renais proximais. A meia-vida (t1/2) do 99mTc é de seis horas. Muitos centros norte-americanos têm disponibilidade limitada do radiofármaco DMSA, o que restringe a capacidade de realizar esse tipo de estudo de medicina nuclear.
MAG3 e DTPA são estudos dinâmicos e funcionais, em contraste com o DMSA. Eles fornecem informações sobre a função renal diferencial e a presença de obstrução, por meio de imagens seriadas ao longo do tempo avaliando captação, excreção e drenagem. Entretanto, o MAG3 é preferido em crianças. O DMSA é uma cintilografia estática que pode detectar não apenas a função diferencial, mas também a presença de cicatrizes renais. A renografia é realizada da quarta à sexta semana para assegurar que a maturação renal tenha sido alcançada.19
Se a cintilografia renal for feita antes da maturação renal, o exame pode mostrar alta atividade cortical residual, retendo até 50% ou mais do pico. MAG3 ou DTPA são solicitados quando se suspeita de UPJO ou UVJ, enquanto DMSA pode ser realizado em casos de VUR como parte de uma abordagem top-down (Figura 3) Renogramas têm três fases. A primeira é a fase vascular, que reflete o fluxo sanguíneo renal e dura até dez segundos. A segunda é a fase parenquimatosa, que representa a captação renal e ocorre do 10º segundo ao 5º minuto após a injeção do isótopo. Por fim, segue-se a fase excretória, representando a excreção do radioisótopo para a pelve renal.
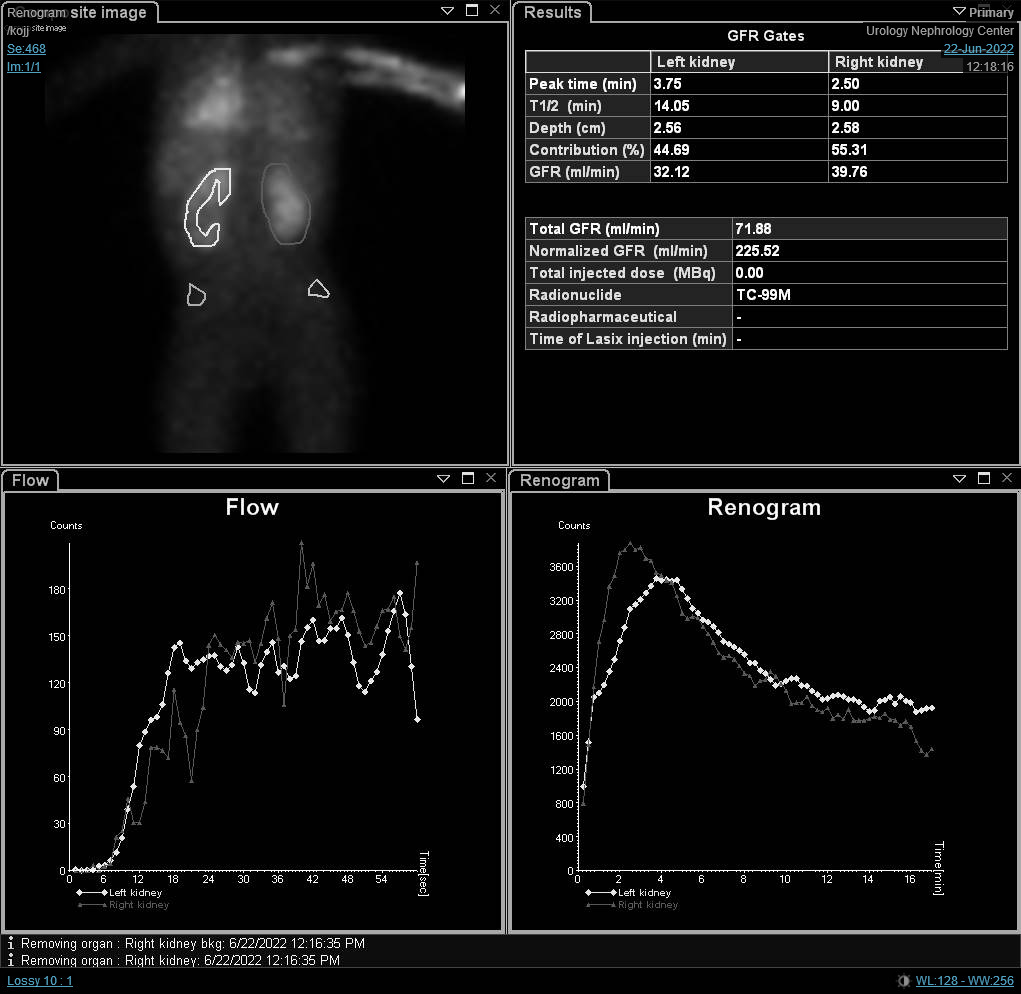
Figura 3 Cintilografia renal com DMSA mostrando captação reduzida do radioisótopo com cicatrizes renais no lado esquerdo
Algumas precauções são consideradas antes da cintilografia renal, por exemplo, hidratação adequada ou até infusão intravenosa de soro fisiológico a uma taxa de 10 mL/ kg com manutenção de 4 mL/kg /hora e cateterização uretral para esvaziamento da bexiga, a fim de evitar resultados falso-positivos de obstrução. Não há consenso quanto ao momento da administração do diurético. Rotineiramente, ele é administrado 20 minutos após o isótopo radioativo (F+20). Para evitar acúmulo do isótopo em sistemas pielocaliciais dilatados, recomenda-se administrar furosemida 15 minutos antes do material radioativo (F-15). Outros autores defendem administrar furosemida ao mesmo tempo que o isótopo radioativo (F+0). A dose de furosemida (Lasix) é de 1 mg/kg na lactência precoce e 0,5 mg/ kg posteriormente, com dose máxima de 40 mg.
Embora a função renal diferencial seja a variável mais significativa na cintilografia renal, as curvas renográficas e o t1/2 podem indicar um diagnóstico provisório de obstrução. O’Reilly descreveu quatro curvas para o renograma dinâmico; curva tipo I representando captação e excreção normais (curva em forma de sino) (Figura 4), curva tipo II representando padrão obstrutivo sem resposta ao diurético (Figura 5) e Figura 6), curva tipo IIIa que inicialmente se eleva e depois cai após a injeção de diurético, curva tipo IIIb que inicialmente se eleva e depois nem cai nem continua a subir (equívoca), e tipo IV na qual ocorre uma descompensação tardia 15 minutos após a injeção de furosemida.20
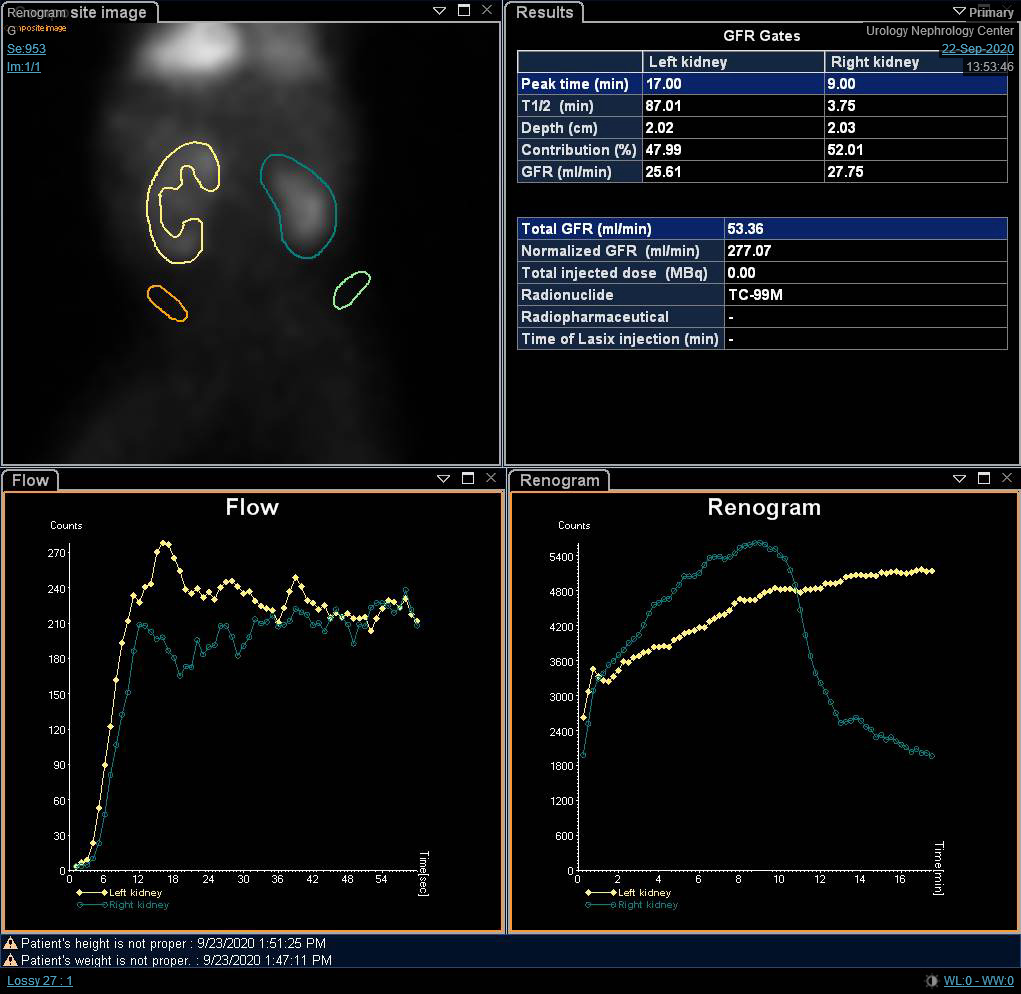
Figura 4 Renograma com DTPA mostrando curva em forma de sino não obstrutiva
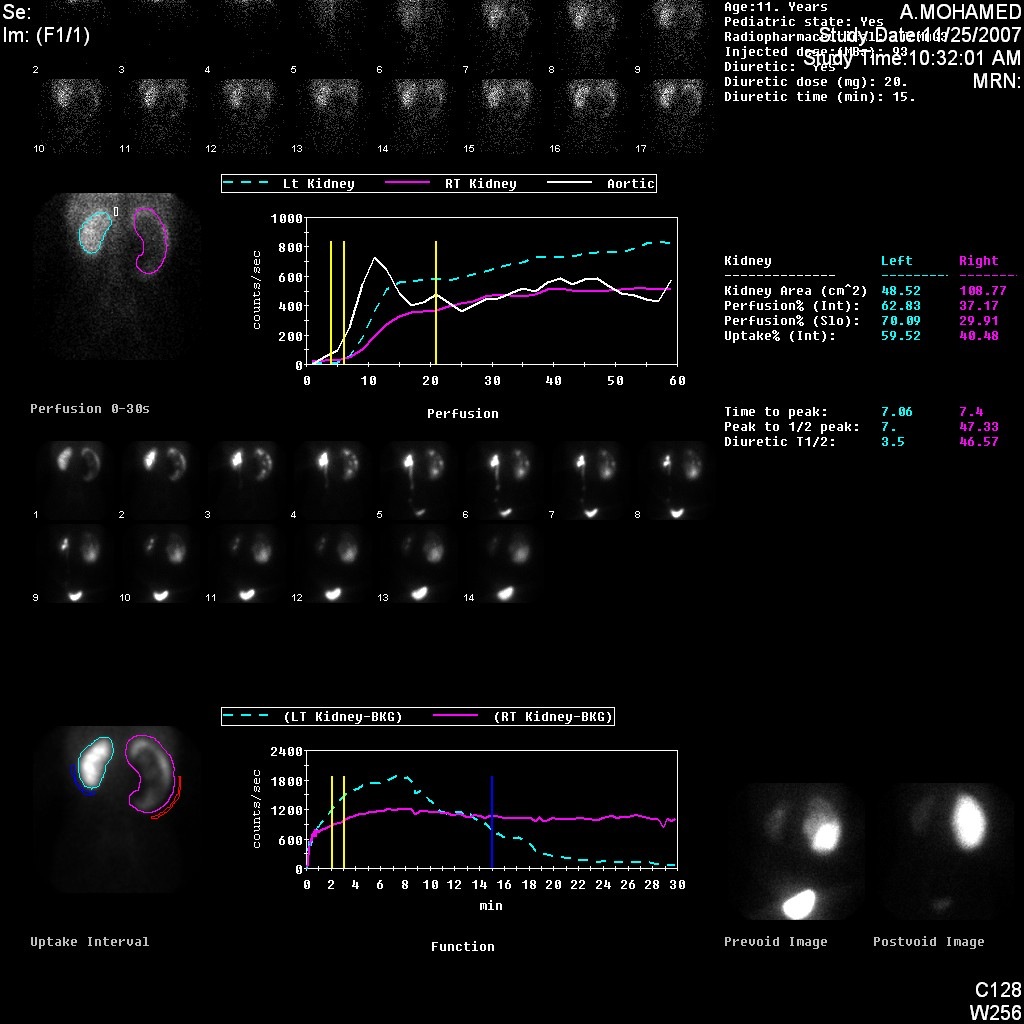
Figura 5 Cintilografia renal com DTPA demonstrando curva obstrutiva do rim esquerdo
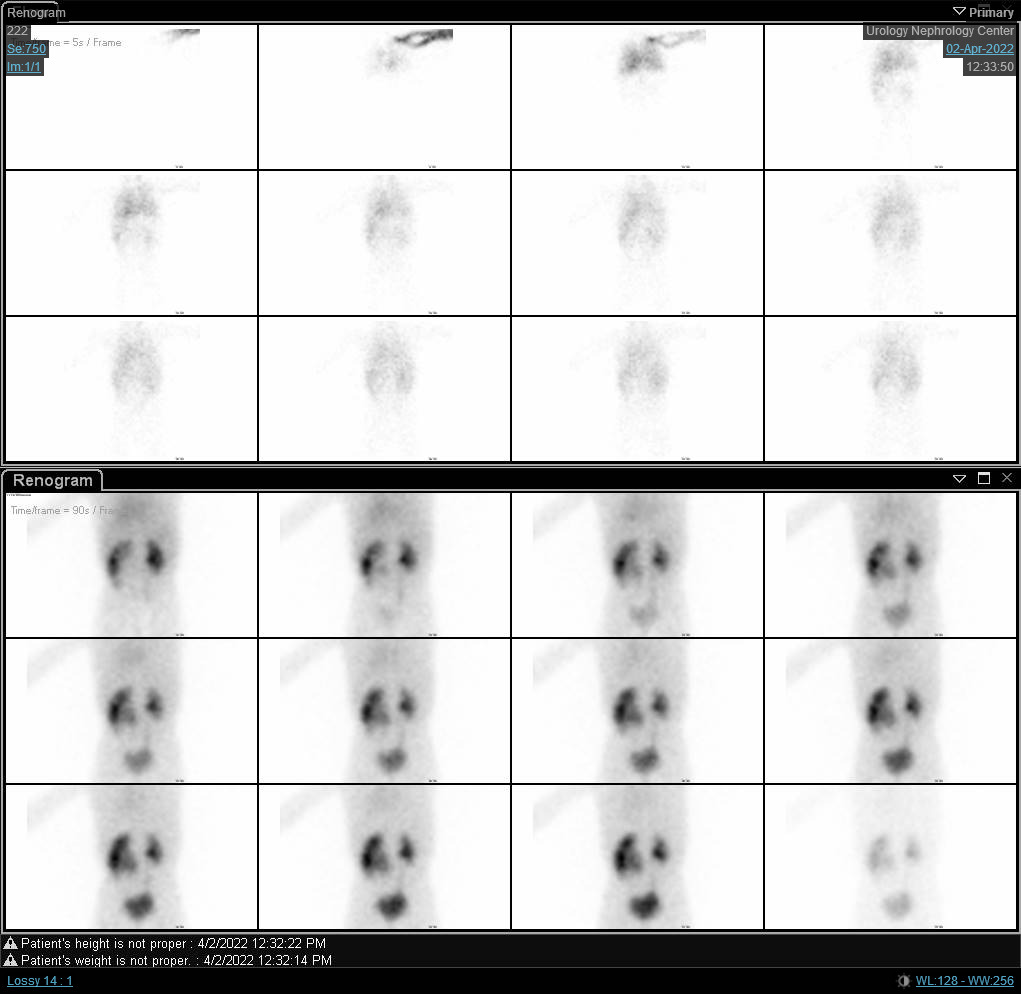
Figura 6 Cintilografia com DTPA mostrando curva obstrutiva do rim direito com t1/2 prolongado.
Um T1/2 inferior a 10 minutos é normal, enquanto um t1/2 superior a 20 minutos indica obstrução. Valores intermediários são considerados inconclusivos. No entanto, muitos defendem que não se use exclusivamente o valor de t1/2 para determinar se há obstrução, pois a altura e a forma da curva, o estado de hidratação do paciente, a drenagem da bexiga e a função renal global podem influenciar esse valor.
Para confirmar o diagnóstico de UPJO, a RBUS é realizada seguida de cintilografia renal para fornecer informações tanto estruturais quanto funcionais (Figura 7) Em casos duvidosos, pode ser solicitada urografia por ressonância magnética (MRU). A VCUG não é necessária desde que o ureter não esteja dilatado, enquanto a urografia intravenosa é obsoleta na urologia pediátrica moderna.
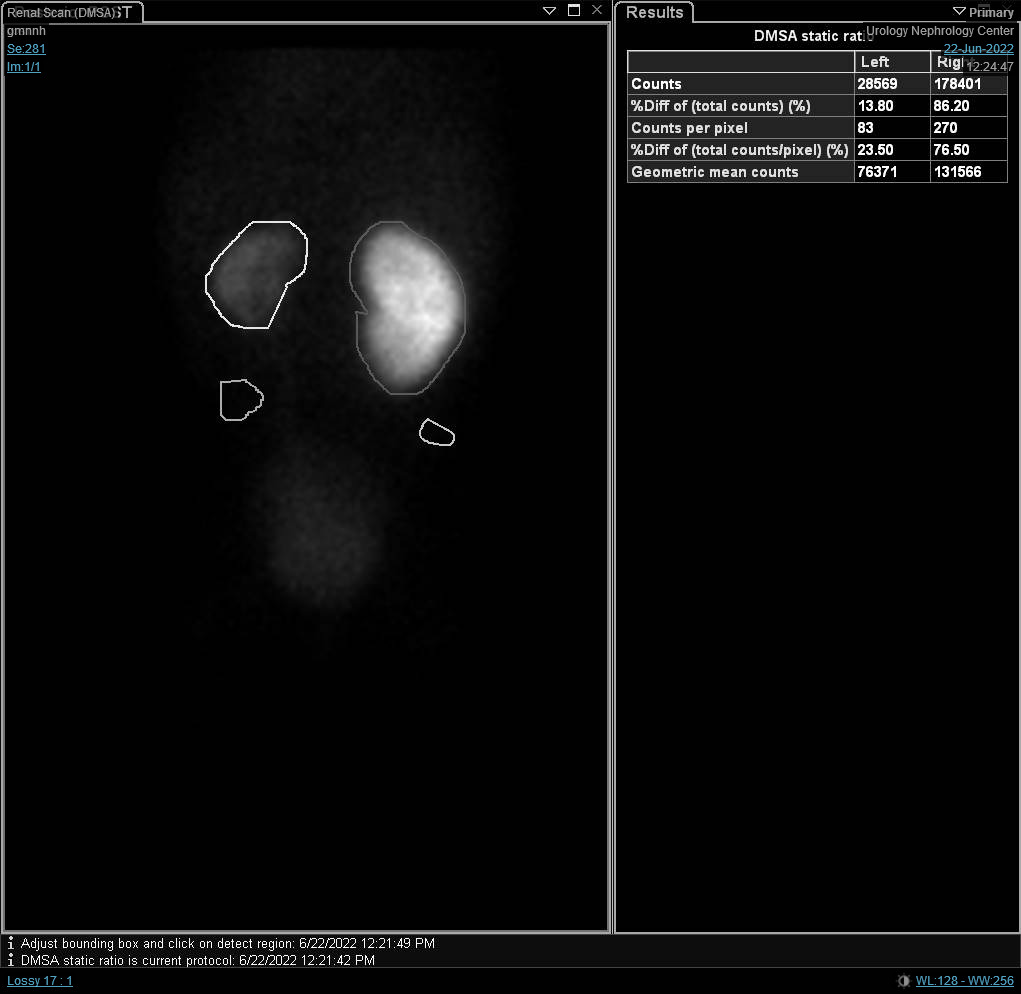
Figura 7 Cintilografia com DTPA mostrando drenagem retardada do rim esquerdo causada por UPJO à esquerda
Por meio de RBUS, observa-se pelve renal dilatada com ureter não dilatado. Como mencionado anteriormente, o APRPD deve ser medido e, se for superior a 30 mm, deve ser solicitada cintilografia renal, pois a incidência de deterioração da função renal é elevada nesse grau de hidronefrose.
O uso da ultrassonografia duplex para sugerir obstrução não pode ser negligenciado, embora a acurácia desses achados possa não ser muito alta. A presença de jatos ureterais do uréter para a bexiga exclui obstrução ureteral. Índice de resistência (RI) de 0.7 ou mais indica obstrução. O RI é medido subtraindo-se a velocidade diastólica final (EDV) da artéria renal de sua velocidade sistólica de pico (PSV) e dividindo-se o resultado pela PSV. O fundamento do uso do RI é que a uropatia obstrutiva é, em última análise, acompanhada por diminuição do fluxo sanguíneo renal. VCUG não é solicitado no contexto de UPJO, a menos que haja dilatação da porção distal do uréter em casos de UPJO secundária a VUR.
Embora a tomografia computadorizada com contraste seja geralmente evitada em crianças devido à radiação ionizante nociva, ela pode ser utilizada para detectar a presença de um vaso cruzado na fase arterial (córtico-medular). A urografia intravenosa (IVU) não é mais recomendada na urologia pediátrica moderna. Todos os estudos com contraste devem ser evitados, a menos que os testes de função renal estejam dentro dos valores normais.
A RM pode ser realizada em casos equívocos nos quais a RBUS não é conclusiva. A RM dinâmica com gadolínio ganhou atenção nos últimos anos devido à sua capacidade de fornecer informações não apenas sobre o diagnóstico anatômico, mas também sobre a função. Ela pode avaliar a função renal diferencial medindo o volume do parênquima realçado, usando um software especial por um físico médico para realizar esse cálculo. Além disso, o cálculo do tempo de trânsito renal, que é a diferença de tempo entre o realce cortical e o aparecimento do ureter, pode ser usado para confirmar a obstrução.
A ureteropielografia retrógrada pode ser utilizada no pré-operatório para confirmar o diagnóstico em casos duvidosos ou se o cirurgião estiver planejando uma lumbotomia dorsal para excluir estenose ureteral concomitante. Por último, mas não menos importante, alguns marcadores bioquímicos têm sido usados para detectar lesão tubular renal decorrente de obstrução, p.ex., β2-microglobulina, N-acetil-β-D-glicosaminidase (NAG) e fator de crescimento transformador beta 1 (TGF-β1).
Opções de tratamento e seus desfechos
Manejo pré-natal da ANH
A intervenção pré-natal raramente é necessária atualmente e só é considerada naqueles com obstrução grave do trato urinário inferior, por exemplo, hidronefrose bilateral de alto grau com oligodrâmnio.21 Na ausência de condições que ameacem a vida após a 20ª semana de gestação, a gestação não deve ser interrompida, nem os planos de parto devem ser influenciados (por exemplo, indução precoce do trabalho de parto).
Manejo pós-natal da ANH
O exame físico não pode ser negligenciado nos casos diagnosticados com ANH. Por exemplo; pode-se palpar massa abdominal em UPJO ou MCDK, enquanto testículo não descido e musculatura deficiente da parede abdominal anterior são encontrados na síndrome de Prune- Belly, além de bexiga palpável em PUV.
A profilaxia antibiótica contínua (CAP) é recomendada na hidronefrose graus 3 e 4 da SFU ou APRPD de 15 mm ou mais para reduzir a taxa de ITUs nos primeiros dois anos de vida.17 No entanto, há numerosos estudos sobre ANH (na ausência de refluxo ou megaureter/hidroureter) que não mostram benefício da CAP em pacientes com hidronefrose isolada de alto grau (grau 3-4).22
CAP nos primeiros dois meses consiste em amoxicilina e trimetoprima nas doses de 10 a 20 mg/kg uma vez ao dia e 2 mg/kg uma vez ao dia, respectivamente. Após essa idade, nitrofurantoína e trimetoprim-sulfametoxazol (TMP/SMX) são prescritos na dose de mg/ kg/ dia. A prescrição precoce de nitrofurantoína pode causar anemia hemolítica ou síndrome do desconforto respiratório, enquanto o sulfametoxazol nos primeiros dois meses causa kernicterus.
Efeitos colaterais comuns da nitrofurantoína incluem distúrbios gastrointestinais e reações cutâneas. Eventos adversos associados ao TMP/SMX devem-se principalmente ao componente sulfametoxazol, sendo mais frequentes as reações cutâneas. A exposição a antibióticos durante o primeiro ano de vida está associada a um risco aumentado de desenvolver doenças atópicas, incluindo eczema, asma e alergia posteriormente.23 Esse achado é atribuído à hipótese da higiene, que propõe que crescer em um ambiente extremamente higiênico, com exposição microbiana mínima, pode aumentar as respostas imunes atópicas. Outro demérito da CAP é o desenvolvimento de resistência a antibióticos.
O principal desafio para os urologistas pediátricos é distinguir a UPJO que irá se resolver espontaneamente daquela que causará deterioração da função renal. A primeira necessita de seguimento, enquanto a segunda requer intervenção.
Indicações de intervenção definitiva incluem a presença de sintomas (dor, ITU febril), rim palpável e APRPD superior a 40 mm.24 Outras indicações incluem; hidronefrose progressiva durante o seguimento, função renal diferencial inferior a 40% e deterioração da função diferencial em 10% ou mais.25 Em casos de UPJO sintomática negligenciada com função renal diferencial inferior a 10%, a nefrectomia é preconizada. No entanto, alguns urologistas pediátricos preferem drenagem precoce por tubo de nefrostomia ou stent ureteral interno e então reavaliação.
A pieloplastia desmembrada de Anderson-Hynes (AHDP) continua a ser a operação padrão-ouro para o tratamento definitivo da UPJO.17 Nesta técnica, o segmento dinâmico ou estenótico é excisado, o ureter é espatulado em direção ao polo inferior do rim, seguido de anastomose da pelve renal ao ureter espatulado sobre um stent transanastomótico. Para um ureter de inserção alta, a plastia em Y-V de Foley era anteriormente preferida, mas foi em grande parte substituída pela AHDP. A pieloplastia em Y-V de Foley pode ser apropriada para UPJO no contexto de rim em ferradura.
A técnica do hitch vascular ainda tem um papel na urologia pediátrica moderna porque é menos exigente e menos demorada do que a AHDP. Além disso, sua taxa de sucesso é de até 90%, com menores taxas de complicações (por exemplo, extravasamento urinário e estenose anastomótica). Envolve a elevação do vaso cruzado anteriormente, afastando-o da UPJ. No entanto, uma obstrução intrínseca concomitante deve ser excluída por meio de teste diurético para evitar falha técnica.
O paciente é colocado em posição de flanco lateral, com o lado-alvo voltado para cima. A incisão é feita subcostal anterior (Figura 8) com uma abordagem extraperitoneal. Após separar ou dividir os músculos oblíquo externo, oblíquo interno e transverso do abdome, com retração medial do peritônio e da gordura extraperitoneal (pararrenal), as duas camadas da fáscia de Gerota são abertas. A junção pieloureteral (UPJ) é identificada e dois pontos de reparo são colocados proximal e distal à UPJ antes de seccioná-la.
Figura 8 Incisão lombar anterior à frente da ponta da última costela para pieloplastia aberta à esquerda
A JUP é desmembrada entre os dois pontos de reparo. A pieloplastia redutora é realizada apenas nos casos de pelve renal marcadamente redundante, nos quais o excesso de pelve renal é ressecado. Por outro lado, outros autores concluíram que a excisão da pelve renal (pieloplastia redutora) não é necessária na maioria dos casos de pieloplastia desmembrada.26 Eles constataram que os casos com ou sem pieloplastia redutora apresentaram desfechos cirúrgicos semelhantes. O próximo passo é anastomosar as duas bordas da pelve renal às duas bordas do ureter espatulado.
A primeira sutura a ser realizada é a do ângulo, seguida pela linha de sutura posterior, inserindo o stent transanastomótico e completando a linha de sutura anterior. Os dois bordos remanescentes da pelve renal são suturados entre si. As suturas utilizadas são vicryl 6-0 (ou outro fio monofilamentar absorvível), em técnica contínua ou interrompida. No início da curva de aprendizado, comece com pontos interrompidos até dominar a técnica.
Outra abordagem para a pieloplastia aberta, além da abordagem lombar anterior, é a lombotomia posterior ou dorsal (DL) (Figura 9)27 É a abordagem mais antiga utilizada para obter acesso ao rim e ao ureter superior. No entanto, atualmente não é utilizada em larga escala, especialmente em crianças. A DL pode ser realizada por meio de uma das seguintes incisões cutâneas; incisão vertical de Gil-Vernet ao longo da borda lateral do músculo sacroespinal, modificação de Lurz com incisão vertical seguindo a borda lateral do músculo quadrado lombar, ou incisão transversal seguindo as linhas de Langer.
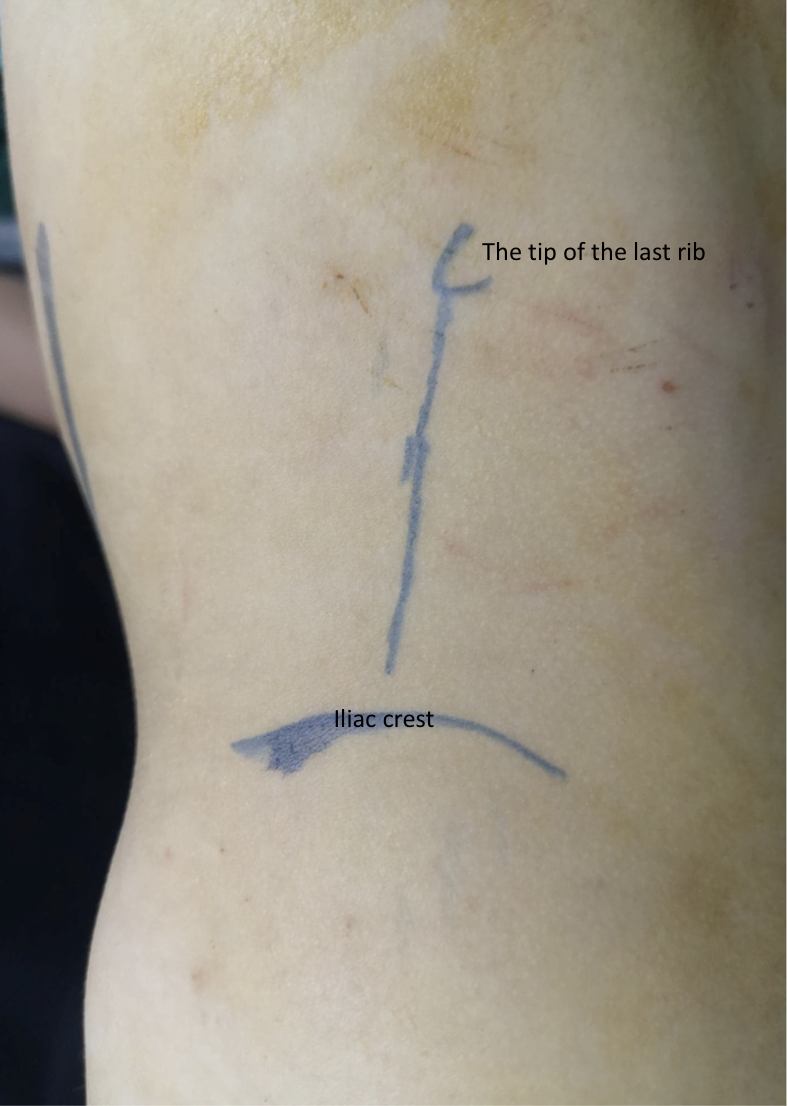
Figura 9 Incisão de lombotomia dorsal para pieloplastia aberta à esquerda
A principal vantagem da DL é o acesso fácil ao retroperitônio por meio de duas incisões simples, sem secção muscular. Um rim hidronefrótico volumoso já não é considerado uma contraindicação para DL porque os rins geralmente são mais móveis em crianças. No entanto, a DL deve ser evitada em casos de malrotação ou malposição renal.
Embora a pieloplastia aberta seja a técnica padrão em pacientes jovens, com taxa de sucesso de 95%, as técnicas laparoscópicas e assistidas por robô apresentam taxas de sucesso comparáveis.28 As técnicas minimamente invasivas têm a vantagem de menor dor, menor tempo de internação pós-operatória e cicatrizes mínimas nos sítios dos trocartes. No entanto, exigem um armamentário especial, com consequentes custos mais elevados, além de uma curva de aprendizagem relativamente mais longa. O uso do sistema robótico da Vinci® tornou a sutura intracorpórea mais fácil do que antes.
A pieloplastia laparoscópica e assistida por robô pode ser realizada por via transperitoneal ou retroperitoneal.28 A abordagem transperitoneal é mais comumente utilizada devido aos marcos anatômicos evidentes e ao espaço de trabalho relativamente amplo. No entanto, apresenta mais complicações do que a retroperitoneal, na forma de lesão de órgãos e obstrução intestinal. Para reduzir o tempo operatório e a manipulação intestinal na pieloplastia laparoscópica transperitoneal, utiliza-se a abordagem transmesocólica para mobilizar diretamente a JUP esquerda sem reflexão do cólon.29
Na pieloplastia laparoscópica, utilizam-se pelo menos três portais, um no umbigo por método aberto para a câmera, e dois portais de trabalho. O primeiro portal de trabalho situa-se na linha subcostal, enquanto o segundo fica na linha espino-umbilical, e, preferencialmente, ambos na linha pararretal (Figura 10) Na pieloplastia robótica, o portal da câmera fica imediatamente acima do umbigo enquanto os dois portais de trabalho ficam no ponto médio entre o umbigo e a espinha ilíaca ântero-superior, e a um dedo abaixo da margem costal na linha pararretal. O portal do assistente é colocado no ponto médio entre o umbigo e o xifoesterno (Figura 11)
Figura 10 Distribuição dos portais para pieloplastia desmembrada de Anderson-Hynes laparoscópica à direita
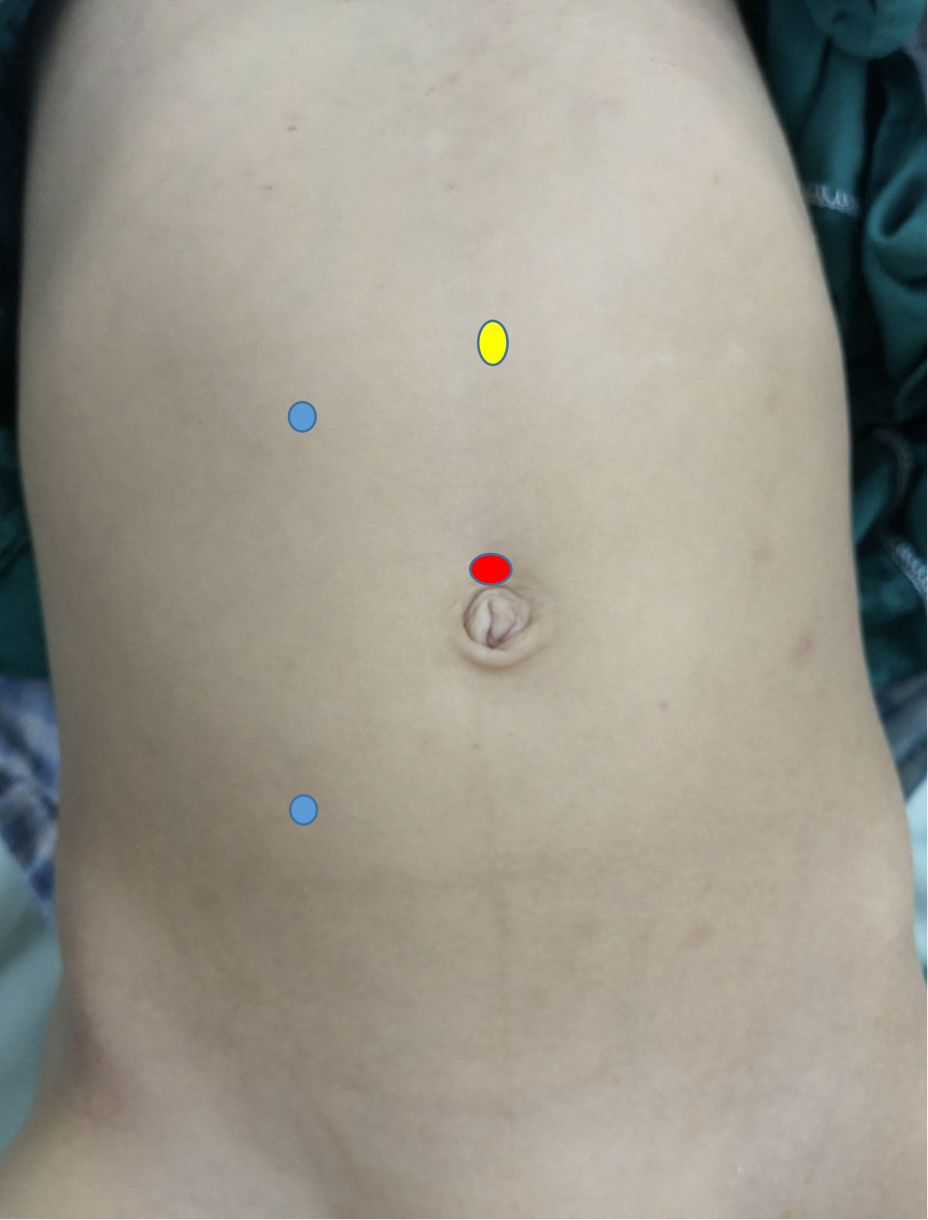
Figura 11 Disposição dos portais para pieloplastia robótica do lado direito
Independentemente da abordagem utilizada, o principal objetivo da pieloplastia é obter uma anastomose patente, dependente, em forma de funil, estanque e sem tensão entre o ureter e a pelve renal. O stent transanastomótico pode ser externo, interno ou pode não ser utilizado.30
O stent externo é exteriorizado através do parênquima renal ou da pelve renal e geralmente é mantido por dez a quatorze dias. É crucial assegurar que haja pelo menos um orifício no interior da pelve renal para evitar a obstrução do stent pelo próprio ureter. Além disso, evite deixar orifícios fora do sistema pielocalicial por receio de extravasamento urinário no pós-operatório.
Uma das melhores maneiras de confirmar que a espira inferior do stent pigtail duplo (duplo J) alcançou a bexiga é preencher a bexiga por meio de uma sonda uretral previamente fixada e verificar o refluxo. Outra dica para a colocação é usar o stent de menor diâmetro disponível e posicioná-lo sobre um fio-guia hidrofílico. Isso tem menor chance de ficar impactado na junção ureterovesical e causar lesão local, o que já foi relatado. Um stent interno é mantido por uma a quatro semanas e depois removido por meio de cistoscopia. A necessidade de uma sessão adicional de anestesia é uma desvantagem do stent interno. Deixar um dreno tubular não é prática de rotina, exceto em casos difíceis ou recorrentes.
Muitos cirurgiões preferem o uso de stent externo mesmo em abordagens laparoscópicas e assistidas por robô para evitar uma segunda anestesia geral para remoção do stent interno.31,32 O stent pieloureteral de Salle externalizado, utilizado na pieloplastia intraoperatória, é outra alternativa eficaz ao stent interno, pois seu custo é inferior ao de uma segunda sessão de anestesia geral.32
Nos casos de pelve renal redundante com defeito de segmento longo, recomendam-se o retalho em espiral de Culp-DeWeerd ou o retalho vertical de Scardino-Prince. Se a pelve renal for insuficiente para confeccionar um retalho que transponha o espaço entre a pelve renal e o uréter, a ureterocalicostomia pode ser uma opção. Na ureterocalicostomia, o uréter é anastomosado ao cálice inferior após a amputação do polo inferior do rim.
Endopielotomia endoscópica é uma opção para estenose de segmento curto (menos de dois cm) em um rim passível de salvamento, após excluir a presença de vaso cruzado.33 Pode ser realizada em casos primários ou recorrentes, por via anterógrada ou retrógrada, utilizando lâmina fria ou laser de hólmio. Apresenta taxas de sucesso menores em comparação com AHDP (70% Vs 95%, respectivamente). É contraindicada na presença de infecção ativa do trato urinário, vaso cruzado e diátese hemorrágica. Para pieloplastias malsucedidas, a pieloplastia de revisão apresenta taxas de sucesso mais altas (95-99%) em comparação com a endopielotomia endoscópica (39%), especialmente em crianças pequenas e em segmentos de estenose com mais de um centímetro.33
Complicações
Se não tratada, a UPJO pode resultar em deterioração da função do rim afetado até perda completa da função. A hipertensão secundária é uma complicação incomum. As complicações da pieloplastia são classificadas como precoces ou tardias. As complicações precoces incluem extravasamento urinário pela ferida ou pelo dreno, com ou sem coleção, stent externo não drenante, stent interno deslocado, hematúria, febre e infecção da ferida. As complicações tardias envolvem falha técnica ou reestenose.34
O extravasamento urinário é tratado por meio de derivação urinária na forma de nefrostomia percutânea ou colocação retrógrada de stent interno. Às vezes, pode ser atribuído à presença de poros do stent fora do rim, com subsequente extravasamento para o retroperitônio. No caso de coleção perinefrética de grande volume, um dreno percutâneo é preconizado. Um stent externo não drenante pode dever-se a um coágulo sanguíneo obstruindo o stent ou à ausência de poros na parte do stent situada dentro da pelve renal, enquanto o restante dos orifícios de drenagem está obstruído pelo ureter. A primeira causa é tratada com lavagem do stent, enquanto a segunda é tratada com retração do stent.
Hematúria é geralmente manejada de forma conservadora por meio de hidratação adequada, com ou sem uso de hemostáticos, ao passo que a infecção da ferida é tratada com antimicrobianos guiados por cultura, além de curativos frequentes. Em caso de febre, a obstrução persistente deve ser excluída por meio de RBUS, seguida de antibióticos intravenosos.
O manejo da pieloplastia malsucedida depende principalmente da função renal diferencial. Em rim obstruído sintomático e com baixa função, com função renal diferencial inferior a 10-15%, considera-se nefrectomia. Em um rim potencialmente recuperável, realiza-se re-pieloplastia ou, às vezes, flebotomia endoscópica. O momento da intervenção é de pelo menos três meses após a cirurgia primária.
Seguimento sugerido
Em casos com ANH unilateral, a RBUS deve ser realizada uma vez no terceiro trimestre. Se a ANH for bilateral, a RBUS deve ser realizada mensalmente até o parto, dependendo da presença de sinais sugestivos de obstrução do trato urinário inferior, por exemplo, hidronefrose progressiva, oligodrâmnio ou parede vesical espessada.11
O manejo conservador de dilatações da pelve renal assintomáticas, com função renal diferencial superior a 40%, é geralmente preconizado, pois a maioria dos casos apresenta resolução espontânea. Hidronefrose progressiva ou deterioração da função renal durante o acompanhamento é uma indicação aceita de intervenção definitiva para prevenir danos adicionais subsequentes.
Não há consenso quanto ao seguimento após pieloplastia e o que está publicado na literatura é opinião de especialistas ou experiência anedótica.35 No nosso instituto, o paciente é reavaliado clinicamente após duas semanas no caso de colocação de stent externo ou após seis semanas no caso de fixação de stent interno. Três meses após a cirurgia, solicita-se RBUS, e observam-se o grau de hidronefrose e o APRPD. Se houver melhora dos parâmetros supracitados, o próximo seguimento será um ano após a cirurgia, utilizando RBUS. Em caso de RBUS sem alteração, o próximo seguimento será três meses depois com RBUS. Se for notada hidronefrose progressiva ou se o paciente estiver sintomático, deve ser solicitada cintilografia com MAG3.
Leituras sugeridas
- Han HH, Ham WS, Kim JH, Hong CH, Choi YD, Han SW. Transmesocolic approach for left side laparoscopic pyeloplasty: Comparison with laterocolic approach in the initial learning period. Yonsei Medical Journal 2013; 54 (1): 197–203. DOI: 10.3349/ymj.2013.54.1.197.
- Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction. Pediatric Nephrology 2018; 33 (4): 553–571. DOI: 10.1007/s00467-017-3629-0.
- Gopal M, Peycelon M, Caldamone A, Chrzan R, El-Ghoneimi A, Olsen H. Management of ureteropelvic junction obstruction in children—a roundtable discussion. Journal of Pediatric Urology 2019; 15 (4): 322–329. DOI: 10.1016/j.jpurol.2019.05.010.
- Chertin B, Pollack A, Koulikov D, Rabinowitz R, Hain D, Hadas-Halpren I. Conservative treatment of ureteropelvic junction obstruction in children with antenatal diagnosis of hydronephrosis: lessons learned after 16 years of follow-up. European Urology 2006; 49 (4): 734–739. DOI: 10.1016/s0084-4071(08)70420-2.
- Värelä S, Omling E, Börjesson A, Salö M. Resolution of hydronephrosis after pyeloplasty in children. Journal of Pediatric Urology 2021; 17 (1): 1–7. DOI: 10.1016/j.jpurol.2020.10.031.
- Sarihan H, Comert HSY, İmamoğlu M, Basar D. Reverse tubularized pelvis flap method for the treatment of long segment ureteropelvic junction obstruction. Medical Principles and Practice 2020; 29 (2): 128–133. DOI: 10.1159/000502028.
Pontos-chave
- Pelve renal dilatada com ureter não dilatado na ultrassonografia renal e vesical é altamente sugestiva de UPJO.
- Considere intervenção em um dos seguintes cenários; UPJO sintomática (sepse, dor significativa ou formação de cálculos) APRPD superior a 5 centímetros Hidronefrose progressiva Deterioração da função renal superior a 10% em cintilografias renais seriadas. Função renal diferencial inferior a 40% com t1/2 prolongado.
- Espatule o ureter contra o polo inferior do rim durante a pieloplastia desmembrada de Anderson-Hynes.
- Evite a manipulação do ureter durante a confecção da anastomose pieloureteral.
- Certifique-se de que todos os orifícios externos do stent estejam dentro do sistema pielocalicial para evitar extravasamento urinário.
Referências
- Oliveira EA, Oliveira MCL, Mak RH. Evaluation and management of hydronephrosis in the neonate. Current Opinion in Pediatrics 2016; 28 (2): 195–201. DOI: 10.1097/mop.0000000000000321.
- Onen A. An alternative grading system to refine the criteria for severity of hydronephrosis and optimal treatment guidelines in neonates with primary UPJ-type hydronephrosis. Journal of Pediatric Urology 2007; 3 (3): 200–205. DOI: 10.1016/j.jpurol.2006.08.002.
- Shapiro E. Clinical implications of genitourinary embryology. Current Opinion in Urology 2009; 19 (4): 427–433. DOI: 10.1097/mou.0b013e32832c90ff.
- Beksaç S, Balcı S, Yapıcı Z, Özyüncü Ö. Prenatally Diagnosed Ureteropelvic Junction Obstruction in Three Siblings of one Family: A Case Report. Gynecology Obstetrics & Reproductive Medicine 2008; 14 (3): 193–195.
- Josephson S. Antenatally detected, unilateral dilatation of the renal pelvis: a critical review. 1. Postnatal non-operative treatment 20 years on\–is it safe? Scandinavian Journal of Urology and Nephrology 2002; 36 (4): 243–250. DOI: 10.1080/003655902320248191.
- Krajewski W, Wojciechowska J, Dembowski J, Zdrojowy R, Szydełko T. Hydronephrosis in the course of ureteropelvic junction obstruction: An underestimated problem? Current opinions on the pathogenesis, diagnosis and treatment. Advances in Clinical and Experimental Medicine: Official Organ Wroclaw Medical University 2017; 26 (5): 857–864. DOI: 10.17219/acem/59509.
- Atwa AM, Abdelhalim A, Edwan M, Soltan M, Hashim A, Abdelhameed M. Holmium Laser En Bloc Resection of Urethral Polyps in Children: A Case Series. Journal of Endourology Case Reports 2020; 6 (4): 457–460. DOI: 10.1089/cren.2020.0099.
- Houat AP, Guimarães CT, Takahashi MS, Rodi GP, Gasparetto TP, Blasbalg R. Congenital anomalies of the upper urinary tract: a comprehensive review. Radiographics 2021; 41 (2): 462–486. DOI: 10.1148/rg.2021219009.
- Alagiri M, Polepalle SK. Dietlś crisis: an under-recognized clinical entity in the pediatric population. International Braz j Urol 2006; 32: 451–453. DOI: 10.1590/s1677-55382006000400012.
- Yalçınkaya F, Özçakar ZB. Management of antenatal hydronephrosis. Pediatric Nephrology 2020; 35 (12): 2231–2239. DOI: 10.1201/b13478-107.
- Has R, Sarac Sivrikoz T. Prenatal diagnosis and findings in ureteropelvic junction type hydronephrosis. Frontiers in Pediatrics 2020; 8 (492). DOI: 10.3389/fped.2020.00492.
- Hodhod A, Capolicchio J-P, Jednak R, El-Sherif E, El-Doray AE-A, El-Sherbiny M. Evaluation of urinary tract dilation classification system for grading postnatal hydronephrosis. The Journal of Urology 2016; 195 (3): 725–730. DOI: 10.1016/j.juro.2015.10.089.
- ElSheemy MS. Postnatal management of children with antenatal hydronephrosis. African Journal of Urology 2020; 26 (1): 1–14. DOI: 10.1186/s12301-020-00097-8.
- Chow JS, Koning JL, Back SJ, Nguyen HT, Phelps A, Darge K. Classification of pediatric urinary tract dilation: the new language. Pediatric Radiology 2017; 47 (9): 1109–1115. DOI: 10.1007/s00247-017-3883-0.
- Elmaci AM, Dönmez Mİ. Time to resolution of isolated antenatal hydronephrosis with anteroposterior diameter≤ 20 mm. European Journal of Pediatrics 2019; 178 (6): 823–828. DOI: 10.1007/s00431-019-03359-y.
- Engin MMN. Management of Infants Diagnosed with Antenatal Hydronephrosis and Determining the Need for Surgical Intervention. 2020. DOI: 10.33309/2639-9164.030202.
- Hashim H, Woodhouse CR. Ureteropelvic junction obstruction. European Urology Supplements 2012; 11 (2): 25–32. DOI: 10.1007/978-1-62703-206-3_4.
- Riccabona M. Assessment and management of newborn hydronephrosis. World Journal of Urology 2004; 22 (2): 73–78. DOI: 10.1007/s00345-004-0405-0.
- Taghavi R, Ariana K, Arab D. Diuresis renography for differentiation of upper urinary tract dilatation from obstruction F+ 20 and F-15 methods. 2007. DOI: 10.1016/j.urology.2007.06.721.
- Clayton DB, Brock JW. Current state of fetal intervention for lower urinary tract obstruction. Current Urology Reports 2018; 19 (1): 1–8. DOI: 10.1007/s11934-018-0760-9.
- Chamberlin JD, Braga LH, Davis-Dao CA, Herndon CA, Holzman SA, Herbst KW. Continuous antibiotic prophylaxis in isolated prenatal hydronephrosis. Journal of Pediatric Urology 2022. DOI: 10.1016/j.jpurol.2022.03.027.
- Ahmadizar F, Vijverberg SJ, Arets HG, Boer A, Lang JE, Garssen J. Early‐life antibiotic exposure increases the risk of developing allergic symptoms later in life: a meta‐analysis. Allergy 2018; 73 (5): 971–986. DOI: 10.1111/all.13332.
- Dhillon H. Prenatally diagnosed hydronephrosis: the Great Ormond street experience: Perinatal Urology. British Journal of Urology Supplement 1998; 81 (2): 39–44. DOI: 10.1046/j.1464-410x.1998.0810s2039.x.
- Hafez AT, McLorie G, Bägli D, Khoury A. Analysis of trends on serial ultrasound for high grade neonatal hydronephrosis. The Journal of Urology 2002; 168 (4 Part 1): 1518–1521. DOI: 10.1097/00005392-200210010-00072.
- Morsi HA, Mursi K, Abdelaziz AY, ElSheemy MS, Salah M, Eissa MA. Renal pelvis reduction during dismembered pyeloplasty: is it necessary? Journal of Pediatric Urology 2013; 9 (3): 303–306. DOI: 10.1016/j.jpurol.2012.03.002.
- Braga LH, Lorenzo AJ, Bägli DJ, Mahdi M, Salle JLP, Khoury AE. Comparison of flank, dorsal lumbotomy and laparoscopic approaches for dismembered pyeloplasty in children older than 3 years with ureteropelvic junction obstruction. The Journal of Urology 2010; 183 (1): 306–311. DOI: 10.1016/j.juro.2009.09.008.
- Başataç C, Boylu U, Önol FF, Gümüş E. Comparison of surgical and functional outcomes of open, laparoscopic and robotic pyeloplasty for the treatment of ureteropelvic junction obstruction. Turkish Journal of Urology 2014; 40 (1). DOI: 10.5152/tud.2014.06956.
- Han HH, Ham WS, Kim JH, Hong CH, Choi YD, Han SW. Transmesocolic approach for left side laparoscopic pyeloplasty: Comparison with laterocolic approach in the initial learning period. Yonsei Medical Journal 2013; 54 (1): 197–203. DOI: 10.3349/ymj.2013.54.1.197.
- Yiee JH, Baskin LS. Use of internal stent, external transanastomotic stent or no stent during pediatric pyeloplasty: a decision tree cost-effectiveness analysis. The Journal of Urology 2011; 185 (2): 673–681. DOI: 10.1016/j.juro.2010.09.118.
- Helmy T, Blanc T, Paye-Jaouen A, El-Ghoneimi A. Preliminary experience with external ureteropelvic stent: alternative to double-j stent in laparoscopic pyeloplasty in children. The Journal of Urology 2011; 185 (3): 1065–1070. DOI: 10.1016/j.juro.2010.10.056.
- Chu DI, Shrivastava D, Batavia JP, Bowen DK, Tong CC, Long CJ. Outcomes of externalized pyeloureteral versus internal ureteral stent in pediatric robotic-assisted laparoscopic pyeloplasty. Journal of Pediatric Urology 2018; 14 (5): 1–. DOI: 10.1016/j.jpurol.2018.04.012.
- Lucas JW, Ghiraldi E, Ellis J, Friedlander JI. Endoscopic management of ureteral strictures: an update. Current Urology Reports 2018; 19 (4): 1–7. DOI: 10.1007/s11934-018-0773-4.
- Khemchandani SI. Outcome analysis of pediatric pyeloplasty in varied presentation in developing countries. Urological Science 2019; 30 (6). DOI: 10.4103/uros.uros_31_19.
- Gopal M, Peycelon M, Caldamone A, Chrzan R, El-Ghoneimi A, Olsen H. Management of ureteropelvic junction obstruction in children—a roundtable discussion. Journal of Pediatric Urology 2019; 15 (4): 322–329. DOI: 10.1016/j.jpurol.2019.05.010.
- Freilich DA, Nguyen HT, Borer J, Nelson C, Passerotti CC. Concurrent management of bilateral ureteropelvic junction obstruction in children using robotic-assisted laparoscopic surgery. International Braz j Urol 2008; 34: 198–205. DOI: 10.1590/s1677-55382008000200010.
- Jackson L, Woodward M, Coward RJ. The molecular biology of pelvi-ureteric junction obstruction. Pediatric Nephrology 2018; 33 (4): 553–571. DOI: 10.1007/s00467-017-3629-0.
- Chertin B, Pollack A, Koulikov D, Rabinowitz R, Hain D, Hadas-Halpren I. Conservative treatment of ureteropelvic junction obstruction in children with antenatal diagnosis of hydronephrosis: lessons learned after 16 years of follow-up. European Urology 2006; 49 (4): 734–739. DOI: 10.1016/s0084-4071(08)70420-2.
- Värelä S, Omling E, Börjesson A, Salö M. Resolution of hydronephrosis after pyeloplasty in children. Journal of Pediatric Urology 2021; 17 (1): 1–7. DOI: 10.1016/j.jpurol.2020.10.031.
- Sarihan H, Comert HSY, İmamoğlu M, Basar D. Reverse tubularized pelvis flap method for the treatment of long segment ureteropelvic junction obstruction. Medical Principles and Practice 2020; 29 (2): 128–133. DOI: 10.1159/000502028.
Ultima atualização: 2025-09-21 13:35