5: Diagnóstico Pré-natal e Cirurgia Fetal
Este capítulo levará aproximadamente 24 minutos para ler.
Introdução
Uma avaliação anatômica fetal abrangente no segundo trimestre tornou-se padrão no cuidado pré-natal. A ultrassonografia pré-natal detecta 84,4–97% de todas as malformações do trato urinário fetal, e essas anomalias podem ser identificadas já a partir de 12–14 semanas de gestação.1,2 Antes do rastreamento pré-natal de rotina, crianças sintomáticas com anomalias urológicas eram identificadas após o nascimento, apresentando sintomas como urosepse, dor, hematúria, massa palpável ou falha de crescimento, frequentemente necessitando de intervenção cirúrgica. O advento da ultrassonografia pré-natal de rotina deslocou o escopo do cuidado urológico pediátrico de um modelo intervencionista/cirúrgico para um papel de aconselhamento pré-natal.
Hidronefrose antenatal é observada em 1–5% de todas as gestações e representa o diagnóstico pré-natal mais frequente.3 A maioria desses pacientes apresenta dilatação leve da pelve renal que se resolve espontaneamente; entretanto, a hidronefrose pode ser secundária à obstrução do trato urinário, a qual pode ou não se beneficiar de intervenção pré-natal. Assim, é necessário conhecimento abrangente da fisiopatologia das possíveis malformações do trato urinário que podem ser detectadas por meio do rastreamento pré-natal e de suas possíveis manifestações pré-natais e intervenção pré-natal.
Embriologia
Embriologia Renal
Os tratos urinário e genital derivam do mesoderma intermediário. Na quarta semana após a concepção, o mesonefro é formado a partir de duas tumefações alongadas de mesoderma. Esse sistema rudimentar produz urina temporariamente entre 6 e 10 semanas de gestação e posteriormente regride. Em 5–6 semanas de gestação, o broto ureteral origina-se de uma evaginação do ducto mesonéfrico (de Wolff). O broto ureteral cresce em direção cefálica e penetra o blastema metanéfrico na semana 7. Isso resulta na indução tecidual do mesênquima indiferenciado, transformando-o em néfrons funcionais do rim metanéfrico (Figura 1) A interação entre o broto ureteral e o blastema metanéfrico é crucial para a formação de rins funcionais e, na ausência desse evento, ocorre agenesia renal.
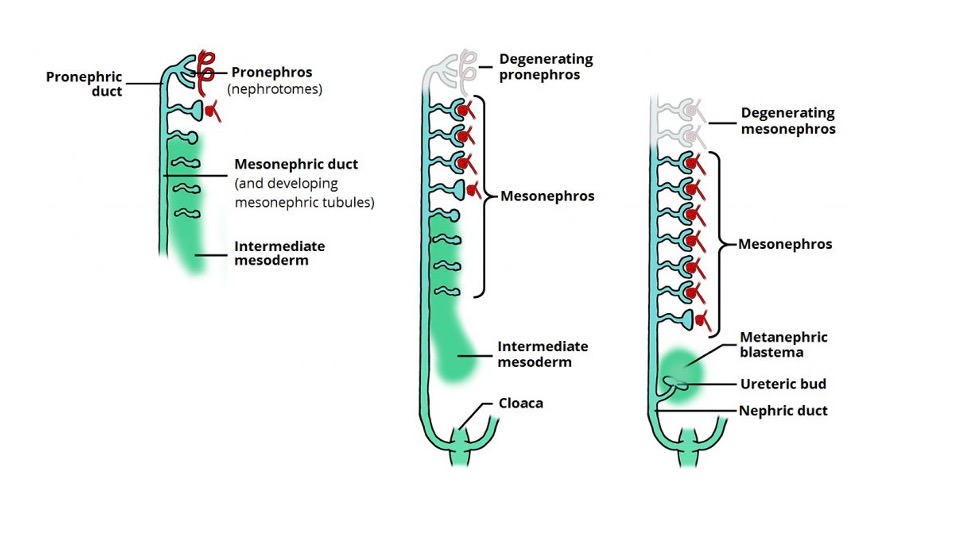
Figura 1 O desenvolvimento e a degeneração sequenciais do pronéfron e do mesonéfron e a indução do broto ureteral e do blastema metanéfrico levando ao desenvolvimento renal. Imagem obtida de Teach Me Anatomy.
O córtex renal e os néfrons desenvolvem-se a partir do blastema metanéfrico, e os túbulos coletores, ductos papilares, cálices, a pelve renal e o ureter têm origem no broto ureteral. O ureter forma um cordão sólido de tecido até a sexta semana de gestação e sofre canalização, que se inicia no segmento médio do ureter e se estende bidirecionalmente. A junção ureteropélvica e a junção ureterovesical são os últimos segmentos a sofrer canalização. A membrana que se desenvolve durante a canalização, chamada membrana de Chwalla, pode contribuir para hidronefrose e hidroureteronefrose transitórias/fisiológicas se houver atraso na sua perfuração.4 Durante a décima semana, os néfrons se conectam ao ducto coletor e inicia-se a produção de urina. Se os néfrons e o sistema coletor não se unirem adequadamente, pode ocorrer um processo obstrutivo precoce, o que pode resultar no desenvolvimento de um rim displásico multicístico.5
Entre a sexta e a nona semana de gestação, os rins ascendem à sua localização final na região lombar. Ectopia renal ocorre quando os rins não migram, sendo a pelve a localização ectópica mais comum. Além disso, a fusão dos polos inferiores dos rins pode resultar em um rim em ferradura. Com o rim em ferradura, a ascensão para o abdome é limitada pela artéria mesentérica inferior, resultando em sua localização ectópica. Um vídeo que mostra o desenvolvimento renal pré-natal normal está disponível (Vídeo 1).
Vídeo 1. Representação do desenvolvimento renal pré-natal normal.
Até a décima semana de gestação, o néfron está maduro e a produção de urina se inicia. Os rins são capazes de remover sódio e concentrar ureia entre a 12ª e a 14ª semanas de gestação e, após 18 semanas de vida intrauterina, quase todo o líquido amniótico é urina fetal. Essa capacidade dos rins de produzir urina e manter volumes adequados de líquido amniótico tem influência profunda sobre o crescimento e o desenvolvimento do feto e desempenha um papel fundamental no desenvolvimento pulmonar fetal.
Embriologia da bexiga
O desenvolvimento da parede abdominal anterior, da bexiga e do septo uroretal também está inter-relacionado. Entre a quinta e a sexta semana de gestação, o septo uroretal inicialmente divide a cloaca em canal anorretal dorsal e seio urogenital ventral. Anomalias da membrana cloacal levam a malformações anorretais. O seio urogenital forma a bexiga e a uretra, e o alantoide é o precursor embrionário do remanescente do úraco.
Os ductos mesonéfricos (de Wolff) fundem-se com a cloaca pouco antes de sua subdivisão pelo septo uroretal. A entrada dos ductos mesonéfricos distingue o canal vesicouretral cefálico do seio urogenital caudal. O canal vesicouretral forma a bexiga e a uretra pélvica. A porção caudal do seio urogenital forma a uretra fálica nos homens e os vestíbulos uretral e vaginal nas mulheres. Essas divisões normais da cloaca estão representadas na (Figura 2) Um vídeo detalhado que descreve o desenvolvimento normal da bexiga está disponível (Vídeo 2).
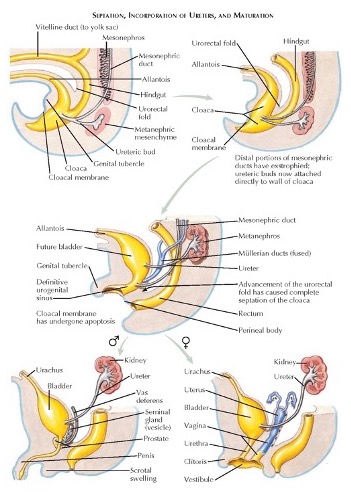
Figura 2 Divisão embriológica normal da cloaca e desenvolvimento do sistema geniturinário.
Vídeo 2. Descrição do desenvolvimento normal da bexiga.
A membrana cloacal define originalmente a parede ventral do septo urogenital. À medida que a membrana regride, durante a 6ª semana gestacional, as cristas mesodérmicas migram em direção à linha média para formar a parede ventral final. A extrofia vesical ocorre quando a membrana cloacal não regride e não permite a migração do mesoderma. A extrofia cloacal ocorre quando a membrana cloacal regride antes do desenvolvimento do septo urorretal e tanto a bexiga quanto o intestino ficam expostos.
Função Renal e Líquido Amniótico
O prognóstico das anomalias renais é pior quando o volume de líquido amniótico é inadequado Este prognóstico mais desfavorável ocorre porque o líquido amniótico é vital para o desenvolvimento pulmonar. Antes de 16 semanas de gestação, o âmnio transporta ativamente solutos e a água difunde-se passivamente através de sua membrana. Inicialmente, durante o primeiro e o segundo trimestres, os eletrólitos e a osmolaridade da urina fetal são semelhantes aos do sangue fetal e materno. Mais tarde na gestação, à medida que o rim fetal começa a absorver sódio e cloreto com a maturação da função tubular, a urina e o líquido amniótico tornam-se mais hipotônicos.6 O resultado é uma composição urinária de baixo teor de eletrólitos e alto teor de creatinina, muito semelhante à observada no período pós-natal. Rins que sofreram lesão pré-natal produzem urina isotônica, pois perderam a capacidade de reabsorver eletrólitos e proteínas.
Antes das 16 semanas de gestação, a quantidade de líquido amniótico pode ser relativamente normal, mesmo com função renal comprometida, pois a maior parte do líquido amniótico é produzida por fontes não renais. Após 16 semanas de gestação, os rins passam a ser os principais responsáveis pela maior parte do volume do líquido amniótico. No terceiro trimestre, a produção horária de urina fetal chega a 30–40 mL/hora e corresponde a cerca de 90% do líquido amniótico.7
O líquido amniótico há muito é reconhecido por desempenhar um papel importante no desenvolvimento pulmonar fetal. A redução do volume do líquido amniótico resulta em graus variados de hipoplasia pulmonar. Não está claro se o líquido amniótico desempenha apenas um papel mecânico no desenvolvimento pulmonar fetal ou se fornece fatores de crescimento de origem renal. O que está claro é a sua importância na prevenção da hipoplasia pulmonar, que, quando grave, é fatal. A síndrome de Potter (hipoplasia pulmonar grave associada à agenesia renal bilateral), é fatal e ocorre quando há uma anomalia renal grave ou obstrução urinária, resultando em oligodrâmnio grave no início da gestação.8
Epidemiologia
As anomalias congênitas do rim e do trato urinário9 ocorrem em 1/500 nascidos vivos e a incidência de óbito neonatal por CAKUT é de aproximadamente 1/2000 nascidos vivos.9,10 A hidronefrose é a anomalia urinária pré-natal mais comum identificada, ocorrendo em 1–5% de todas as gestações, com o risco de qualquer patologia pós-natal aumentando conforme o grau de hidronefrose (11.9% para leve, 45.1% para moderada e 88.3% para hidronefrose grave).11 A maioria das anomalias urológicas obstrutivas ocorre no sexo masculino, com uma razão masculino:feminino de 4:1, com predileção pelo acometimento do rim esquerdo,12,13
Patogénese
Uropatia fetal pode ser causada por alterações genéticas, como a doença renal poliquística autossómica recessiva, ou por problemas associados à nefrogénese e à obstrução do trato urinário. Nefrogénese defeituosa pode resultar em agenesia renal, bem como em displasia renal. A displasia renal pode resultar de uma interação defeituosa entre o botão ureteral e o mesênquima metanéfrico, de defeitos intrínsecos de diferenciação, assim como de obstrução. As anomalias congénitas do rim e do trato urinário incluem agenesia renal, rim multiquístico, displasia renal, anomalias de duplicação renal, obstrução da junção ureteropélvica, megauréteres, válvulas da uretra posterior e refluxo vesicoureteral. CAKUT frequentemente resulta em displasia renal e uma possível causa genética tem sido considerada, dado que anomalias renais foram identificadas em familiares próximos de 10% dos doentes com CAKUT.9,10 Numerosas mutações genéticas, tais como anomalias na sinalização de HNF1β, PAX2 e RET, têm sido consideradas, mas nenhum padrão claro de herança foi identificado,14,15
Avaliação e Diagnóstico
Como mencionado anteriormente, a ultrassonografia pré-natal detecta 84,4–97% de todas as malformações do trato urinário fetal e essas anomalias podem ser detectadas já entre 12–14 semanas de gestação.1,2 Muitas dessas anomalias podem ser diagnosticadas por ultrassonografia, com a ressonância magnética fetal fornecendo maior detalhamento. Além disso, muitas dessas condições geniturinárias apresentam achados sobrepostos nos exames de imagem iniciais.
Ultrassonografia Pré-natal
A ultrassonografia pré-natal é agora regularmente utilizada como rastreamento e vigilância do crescimento e desenvolvimento fetal no segundo trimestre. A detecção de anomalias urológicas antes do nascimento é relativamente sensível, com até 88% das anormalidades do trato urinário diagnosticadas no período pré-natal.16 Os rins geralmente não são vistos ao ultrassom até a semana 15 de gestação (Figura 3) Diâmetro anteroposterior da pelve renal (APRPD) inferior a 4 mm entre as semanas 16–27 de gestação e inferior a 7 mm na semana 28 ou mais são considerados dentro da faixa fisiológica normal.17 Se os ureteres não estiverem dilatados, não devem ser visíveis na ultrassonografia pré-natal. A bexiga geralmente pode ser vista na 10ª semana de gestação, mas deve ser visualizada até a 12ª semana. A parede vesical normal não é mais espessa que 3 mm.2
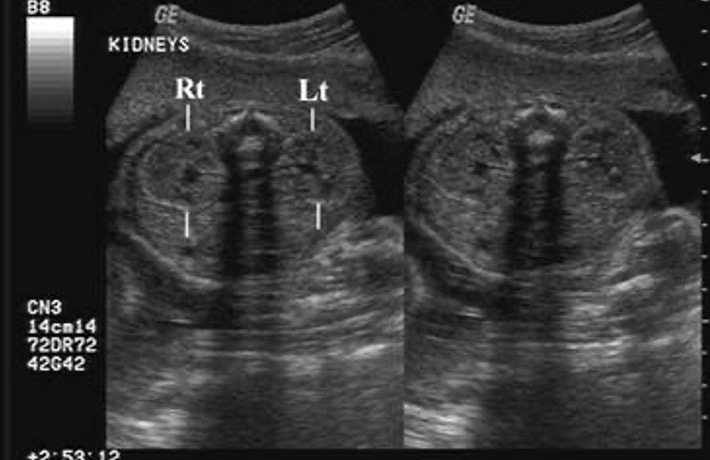
Figura 3 Ultrassonografia pré-natal mostrando rins esquerdo e direito normais.
Ressonância magnética fetal
A ressonância magnética fetal é comumente utilizada para fornecer mais detalhes anatômicos de anomalias congênitas inicialmente detectadas na ultrassonografia. Em um estudo, a sensibilidade diagnóstica global foi de 96% para a ressonância magnética fetal em comparação a 58% para a ultrassonografia.18 A ressonância magnética fetal também fornece informações diagnósticas adicionais, particularmente na avaliação da anatomia ureteral. Os benefícios da ressonância magnética fetal incluem maior contraste de tecidos e avaliação da morfologia, além da capacidade de detectar anomalias adicionais e avaliar a função renal fetal.19 À medida que a imagem fetal se torna mais avançada, técnicas como a cistoscopia virtual 3D estão sendo utilizadas para elucidar ainda mais as anomalias urogenitais.20
Na RM, a bexiga aparecerá como uma estrutura arredondada/ovoide com sinal de alta intensidade uniforme, e sua parede deve ser lisa e de espessura uniforme. Os rins estarão localizados paravertebralmente no abdome superior e são vistos como estruturas ovoides com sinal intermediário em sequência ponderada em T2. Devem ser avaliados quanto ao tamanho, alterações displásicas, pieloectasia e ureteroectasia.
Anomalias pré-natais
Dilatação do trato urinário superior
A hidronefrose é detectada em 1–5% das ultrassonografias pré-natais.21 A dilatação do trato urinário superior precisa ser considerada em conjunto com outros achados, como o aspecto do parênquima renal, o volume de líquido amniótico, a dilatação ureteral, ou o aspecto da bexiga fetal e a dilatação uretral.22,23 As três anomalias mais comuns relacionadas à dilatação pré-natal do trato urinário superior são as anomalias da junção ureteropélvica (JUP), as anomalias da junção ureterovesical (JUV) e o refluxo vesicoureteral (RVU).
Sistemas de classificação da hidronefrose
Para ajudar a delinear melhor o grau de hidronefrose, foram desenvolvidos diferentes sistemas de classificação. Os principais sistemas de classificação utilizados para hidronefrose são os da Sociedade de Urologia Fetal (SFU)24 e os de dilatação do trato urinário (UTD).25 O APRPD também tem sido utilizado como complemento a esses sistemas de classificação.26
Sistema de classificação Sfu
No sistema SFU, a graduação da hidronefrose é baseada no grau de dilatação da pelve renal e dos cálices renais. (Figura 4) ilustra o sistema de graduação SFU. É importante ressaltar que a graduação SFU não foi originalmente concebida para avaliação pré-natal e não tem sido amplamente adotada fora da urologia pediátrica
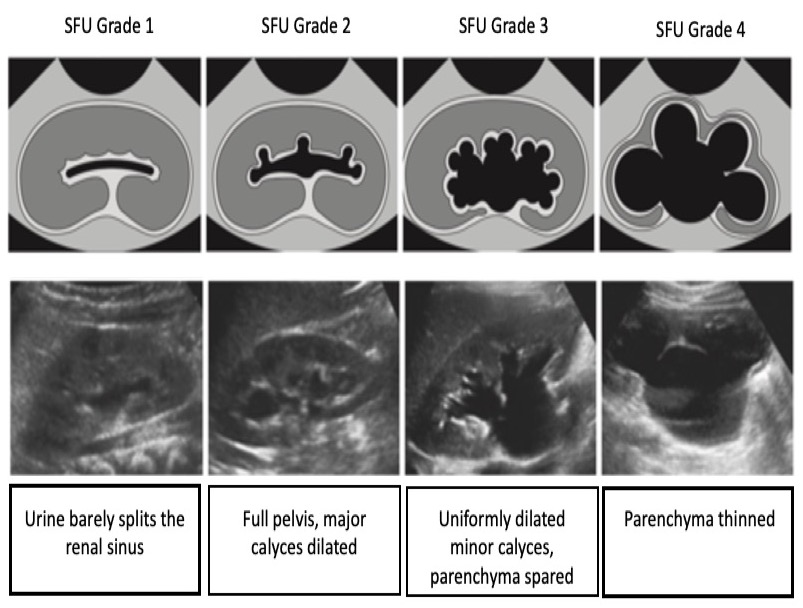
Figura 4 Sistema de classificação da hidronefrose da SFU.
Sistema Utd de graduação da hidronefrose
Este sistema é baseado em seis categorias que são rotineiramente identificadas na ultrassonografia: diâmetro ântero-posterior da pelve renal (APRPD), dilatação dos cálices renais, espessura do parênquima renal, aspecto do parênquima renal, anormalidades vesicais e anormalidades ureterais. Este sistema de graduação também é estratificado por idade gestacional. Para hidronefrose pré-natal, a hidronefrose pode ser classificada como UTD A1: baixo risco se houver dilatação central ou calicinal, mas todos os parâmetros supracitados estiverem normais. UTD A2–3 é usado se houver risco aumentado para uropatias pós-natais. Aqui, os grupos de risco intermediário (A2) e alto (A3) estão agrupados em uma única categoria (Figura 5)
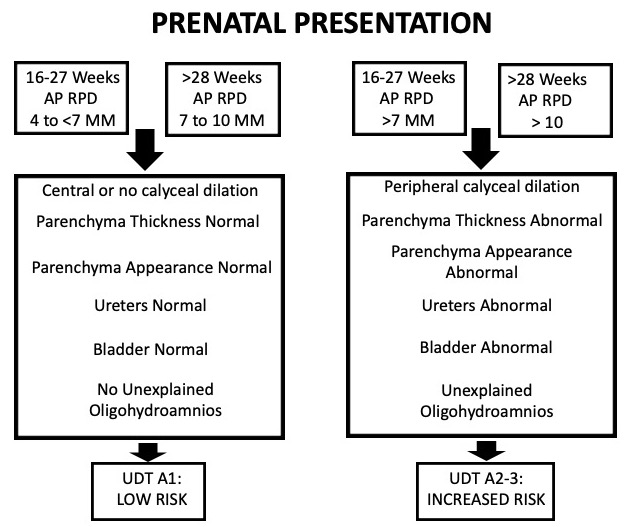
Figura 5 Tabela que descreve o sistema de classificação UTD quando a hidronefrose se apresenta no período pré-natal.
Hidronefrose/Junção ureteropélvica
Na maioria dos casos de hidronefrose antenatal isolada, esse achado é sugestivo de um processo transitório e não patológico.11 A obstrução da junção ureteropélvica (JUP) pode ser sugerida pelo grau de hidronefrose. O risco de qualquer patologia pós-natal aumenta significativamente com base na gravidade da hidronefrose pré-natal. O risco de patologia pós-natal para hidronefrose pré-natal leve, moderada e grave foi relatado como sendo de 11.9%, 45.1% e 88.3%, respectivamente.11 A obstrução da junção ureterovesical (JUV) também pode ser sugerida diante do achado de hidronefrose e dilatação ureteral.
A necessidade de exames de imagem pré-natais adicionais pode ser baseada no diâmetro ântero-posterior da pelve renal. Em um estudo, nenhum lactente com APRPD <7 mm no segundo trimestre necessitou de intervenção pós-natal e nenhum desenvolveu insuficiência renal.27 Outro estudo sugeriu que uma dilatação da pelve renal de 15 mm era um limiar significativo para suspeitar de obstrução em 80% dos fetos, com sensibilidade e especificidade de 73% e 82%, respectivamente.28 Além disso, verificou-se que um ponto de corte de 18 mm para dilatação pélvica fetal apresentou uma razão de chances diagnóstica de 97.7 para identificar lactentes que necessitaram de pieloplastia.29
Refluxo Vesicoureteral
No relatório de síntese do painel das Diretrizes de 2010 sobre Refluxo Vesicoureteral Pediátrico, os autores observaram que, entre os 6.579 lactentes com hidronefrose pré-natal, o RVU estava presente em 4.756 (72%).30 Apesar dessas descobertas, os exames de imagem pré-natais têm baixa sensibilidade para detectar RVU. Mesmo que o diâmetro da pelve renal (DPR) aumente na ultrassonografia pré-natal, o aumento do DPR não é preditivo de RVU.31,32 Outro estudo identificou que a alteração na forma/tamanho da pelve renal e do ureter nas imagens pré-natais ocorreu em apenas 17,2% dos fetos que foram diagnosticados com RVU no pós-natal, tornando isso um fraco preditor de refluxo urinário.32
Obstrução do Trato Urinário Inferior
A obstrução do trato urinário inferior constitui um grupo de anomalias urogenitais que resultam em obstrução uretral. A apresentação pré-natal dessas condições é semelhante e geralmente assume a forma de bexiga distendida e hidroureteronefrose.
Identificar LUTO é importante por causa de seu potencial impacto a longo prazo na função renal, bem como no desenvolvimento pulmonar pré-natal, especialmente se houver oligohidrâmnio associado. Ultrassonografia e características do paciente que podem ser preditivas de LUTO são megacistia grave (definida como volume vesical >35 mm3), dilatação ureteral bilateral, oligo/anhidrâmnio e sexo fetal masculino.33 A RM pode auxiliar na avaliação do parênquima renal, do tamanho dos rins, da quantidade de líquido amniótico e do grau de distensão ureteral e vesical.34 Além disso, a mensuração da área parenquimatosa pode correlacionar-se com a função renal pós-natal, com 8 cm2 e maiores durante o terceiro trimestre, como o melhor preditor do desenvolvimento de doença renal terminal.35
Válvulas Uretrais Posteriores
As válvulas uretrais posteriores (PUV) podem se manifestar como hidronefrose, hidroureteronefrose ou megacístis na ultrassonografia pré-natal. Entretanto, o achado sonográfico característico da PUV é uma bexiga em forma de fechadura, com leve dilatação da uretra proximal (Figura 6) Os achados ultrassonográficos pré-natais mais preditivos do diagnóstico de PUV incluem uretra posterior dilatada (o achado ultrassonográfico de maior poder discriminatório), parede vesical espessada e anidrâmnio.32
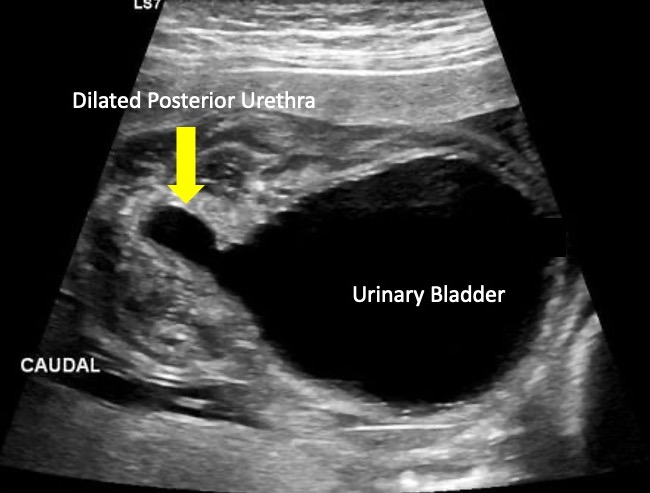
Figura 6 Imagem ultrassonográfica mostrando o “sinal de buraco de fechadura” comumente observado nas válvulas uretrais posteriores.
Síndrome da Barriga de Ameixa Seca
Como a gravidade da PBS é variável, seu diagnóstico pré-natal é difícil. De modo geral, os rins aparecem hiperecogênicos e displásicos, com dilatação dos uréteres e parede vesical espessada. Anhidrâmnio e conteúdos abdominais e torácicos comprimidos também podem ser observados.36,37 Quanto mais cedo a suspeita de PBS surgir nas imagens pré-natais, pior o prognóstico. A ressonância magnética pode ainda delinear melhor a extensão das anomalias geniturinárias, incluindo hipoplasia renal, displasia, dilatação ureteral, megacistia, uretra prostática dilatada e hipoplasia prostática.34
Atresia uretral e anomalias uretrais anteriores
A atresia uretral é apenas uma condição dentro do espectro das anomalias uretrais anteriores, que também inclui as válvulas uretrais anteriores e o divertículo uretral. A atresia uretral e as anomalias uretrais anteriores são raras, mas podem ser suspeitadas quando se encontram hidroureteronefrose, bexiga dilatada e espessada, oligoidrâmnio, bem como uretra dilatada em exames de imagem pré-natais. Anomalias congênitas adicionais do rim e do trato urinário aumentam a probabilidade de desenvolver doença renal crônica.38
Rim displásico multicístico
A doença renal cística pré-natal é difícil de identificar e diferenciar apenas com ultrassonografia. Frequentemente, pode ser difícil distinguir MCDK de uma obstrução grave da UPJ na ultrassonografia pré-natal. A ressonância magnética fetal tem sido utilizada para complementar os achados iniciais da ultrassonografia sugestivos de MCDK. Classicamente, o rim será completamente substituído por cistos de diferentes tamanhos que não se comunicam (Figura 7) Tipicamente, não se observa uma pelve renal normal, devido à falta de desenvolvimento da ramificação tubular, e pode ser um achado característico de MCDK.39 Além de MCDK, cistos renais encontrados em exames de imagem pré-natais também podem ser indicativos de displasia/doença renal cística.
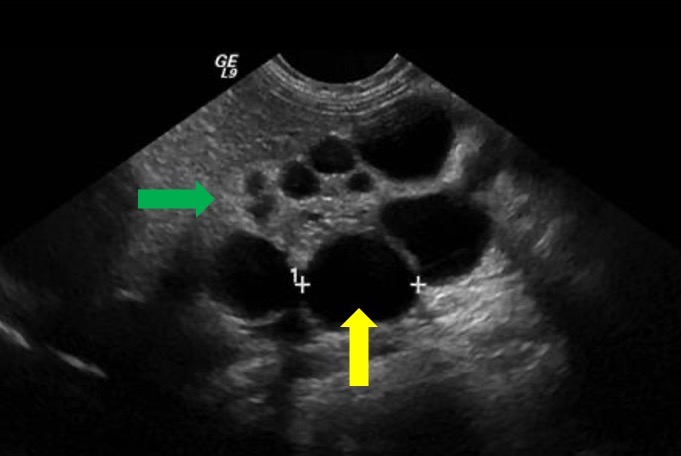
Figura 7 Imagem de ultrassom mostrando MCDK. Seta amarela indica cisto renal. Seta verde indica parênquima renal afinado e ecogênico sugestivo de displasia renal.
Anomalias de duplicação
A acurácia diagnóstica da ultrassonografia pré-natal na identificação de sistemas coletores duplos isolados é de até 90%.40 Quando há duplicação ureteral, uma ureterocele pode estar associada à porção do polo superior. Embora a maioria das anomalias de duplicação possa ser diagnosticada por ultrassonografia (Figura 8), a ressonância magnética pode ser útil em casos específicos.41 Um estudo relatou que, em pacientes com diagnóstico pré-natal de sistema coletor duplo isolado, ureterocele e megauréter estavam associados a 70.7% e 36.6% dos casos, respectivamente.40
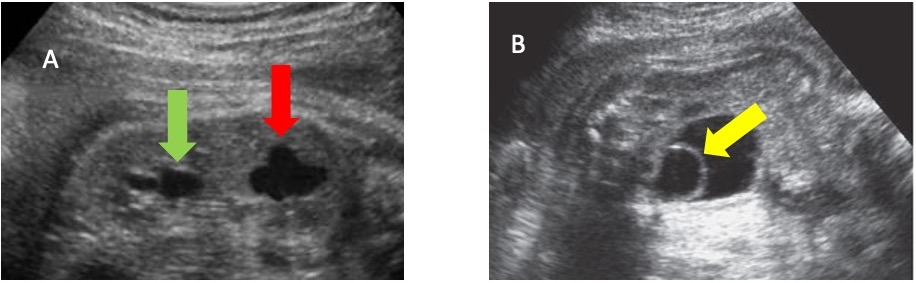
Figura 8 A. Imagem de ultrassonografia mostrando rim duplicado com hidronefrose no polo inferior (seta verde) e no polo superior (seta vermelha). B. Imagem de ultrassonografia mostrando bexiga urinária com ureterocele em seu interior (seta amarela).
Extrofia Vesical, Cloaca, Seio Urogenital
A extrofia vesical e a extrofia cloacal também podem ser observadas em exames de imagem pré-natais. A diferenciação correta entre extrofia vesical e extrofia cloacal pode ser realizada identificando-se a localização da inserção do cordão umbilical em relação ao defeito da parede abdominal (superior vs. médio vs. inferior), o que pode ser feito tanto por ultrassonografia fetal quanto por ressonância magnética.42 Se o defeito na parede abdominal for visto inferior ao cordão, sem uma bexiga cheia, o diagnóstico provavelmente é extrofia vesical. Por outro lado, se o defeito estiver ao nível do cordão ou superior a ele, o diagnóstico é mais provavelmente uma onfalocele.
Na RM, a exstrofia vesical será observada como uma massa infraumbilical da parede abdominal, com inserção baixa do cordão umbilical. Como os rins e os ureteres devem ser normais, haverá quantidade normal de líquido amniótico. A diástase da sínfise púbica também pode ser observada.
Entre os achados da ultrassonografia pré-natal sugestivos de malformações cloacais clássicas estão um ou dois cistos adjacentes visíveis na pelve fetal feminina, ascite transitória e posição alta do reto com dilatação da porção superior e afunilamento distal com extremidade romba ou em bico, bem como hidronefrose e megacistis. As características mais específicas que sustentam o diagnóstico de malformação cloacal são um cólon dilatado repleto de líquido com enterólitos e a presença de mecônio no trato urinário. Achados adicionais na RM fetal sugestivos de extrofia cloacal incluem ausência de bexiga com volume normal de líquido amniótico, contorno pélvico anterior protuberante, ausência de mecônio no intestino e onfalocele.43 A RM fetal também pode contribuir para a identificação do número e da localização dos orifícios perineais.
No seio urogenital persistente, a ultrassonografia fetal pode mostrar hidrometrocolpos como uma lesão oblonga, anecóica e septada localizada atrás da bexiga fetal.44 Na RM, um seio urogenital apresentará reto e cólon de calibre normal. O sinal do mecônio também será normal. O orifício anoperineal estará em sua localização fisiológica. Haverá um canal urogenital comum com um orifício no períneo onde a uretra deveria estar localizada.45
Opções de Tratamento
Do ponto de vista urológico, a maioria das intervenções pré-natais é realizada para obstrução do trato urinário inferior. As intervenções são realizadas para aliviar a obstrução, na tentativa de maximizar a função renal e normalizar os níveis de líquido amniótico a fim de prevenir danos associados ao oligohidrâmnio.
Existem duas intervenções atualmente amplamente aceitas para LUTO pré-natal: colocação de derivação vesicoamniótica e cistoscopia fetal. A intervenção fetal tem como foco principal a descompressão do trato urogenital superior para prevenir dano contínuo ao parênquima renal e a restauração do volume do líquido amniótico para o desenvolvimento pulmonar. Antes de considerar qualquer intervenção pré-natal, é necessária uma avaliação para estimativa de risco da intervenção e ela deve começar com duas vesicocenteses consecutivas.46,47,48,49 Em conjunto com o aspecto sonográfico dos rins, a aplicação dos critérios de Glick pode ser utilizada como fator prognóstico para novas intervenções fetais, em adição à intervenção terapêutica (Tabela 1).50 Vale ressaltar que essa prognosticação não é ajustada para a idade fetal e não necessariamente reflete a função pós-natal.48
Tabela 1 Critérios prognósticos para o feto com uropatia obstrutiva
| Função prevista | Estado do líquido amniótico no momento da apresentação inicial | Aparência ultrassonográfica dos rins | Urina fetal – sódio (mEq/mL) | Urina fetal – cloreto (mEq/mL) | Urina fetal – osmolaridade (mOsm) | Débito urinário fetal (mL/hora) |
|---|---|---|---|---|---|---|
| Ruim | Moderadamente a severamente reduzido | Ecogênico a cístico | > 100 | > 90 | > 210 | < 2 |
| Boa | Normal a moderadamente reduzido | Normal a ecogênico | < 100 | < 90 | < 210 | > 2 |
Derivação vesicoamniótica
A derivação vesicoamniótica é realizada com anestesia local sob orientação por ultrassonografia bidimensional em tempo real.51,52 Sob técnica estéril, um cateter vesicoamniótico é inserido percutaneamente, com posicionamento ideal em que a extremidade distal da derivação fica na bexiga fetal e a extremidade proximal na cavidade amniótica (Figura 9)52 Modelos iniciais descrevem o uso de cateteres pigtail de duas pontas, enquanto estudos mais recentes exploraram cateteres de cesto duplo como modalidade alternativa. Foram relatados desfechos variáveis, com taxas de sobrevida variando de 41% a 80%, dependendo da seleção dos pacientes,53,54 O ensaio randomizado mais recente, PLUTO, enfrentou problemas significativos de recrutamento de pacientes, levando à interrupção precoce do estudo enquanto tentava fornecer maior clareza sobre a utilidade da derivação vesicoamniótica.52 Este estudo, juntamente com outras pequenas análises retrospectivas e evidências anedóticas, demonstrou uma melhora na sobrevida perinatal,53,54,55 embora os desfechos em longo prazo permaneçam incertos. Todos os estudos destacam a necessidade de estudos prospectivos, controlados e randomizados adicionais para essa intervenção.
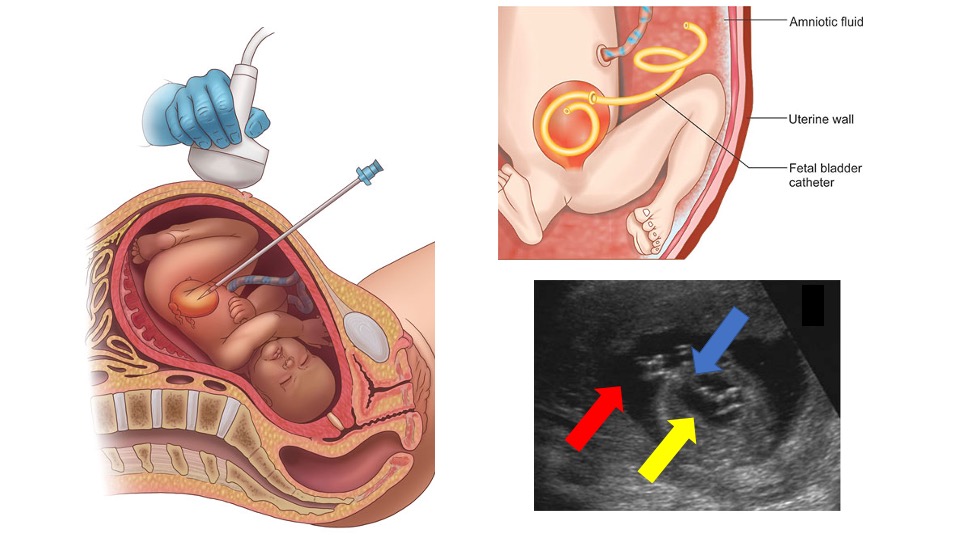
Figura 9 Representação da orientação ultrassonográfica para a colocação de uma derivação vesicoamniótica, do posicionamento final da derivação e de um exame de ultrassom mostrando a derivação (seta azul) no interior da bexiga urinária (seta amarela) e do espaço amniótico (seta vermelha).
Cistoscopia
A cistoscopia fetal in útero foi relatada pela primeira vez em 1995.56 Embora tecnicamente mais desafiadora do que a derivação vesicoamniótica, essa intervenção permite visualização direta, determinação de um diagnóstico específico e possível tratamento no momento do diagnóstico. Utiliza-se um trocarte maior do que o usado para a derivação vesicoamniótica e um fetoscópio de 1,0–1,3 mm em bainha curva, com campo de visão de pelo menos 70°.57 Uma das anomalias mais comuns observadas na cistoscopia fetal é a presença de válvulas uretrais posteriores (VUP). Se uma estrutura membranosa for observada na cistoscopia e for feito o diagnóstico de VUP, fulguração a laser, hidroablação ou perfuração com fio-guia podem ser utilizadas como métodos de intervenção imediata (Figura 10)58 A estenose uretral é um diagnóstico cistoscópico intraoperatório que pode ser tratada com sucesso com a colocação de um stent uretral sobre um fio-guia.57 Se, em vez disso, for diagnosticada atresia uretral, não se tenta a perfuração da uretra e a VAS é realizada.59
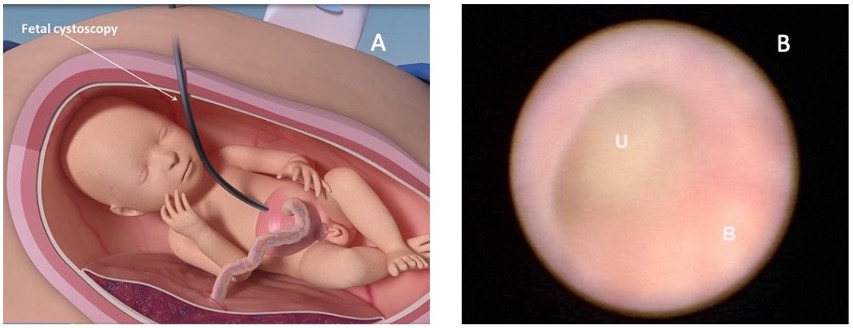
Figura 10 A imagem A mostra como a cistoscopia fetal é realizada. A imagem B mostra uma imagem cistoscópica fetal no interior da bexiga (B) e o ponto de obstrução na uretra (U). Imagem obtida de: Intervenções fetoscópicas regenerativas pré-natais para anomalias congênitas. SBRE 2020.
Um vídeo que apresenta a intervenção fetal para LUTO está disponível (Vídeo 3). Além disso, um podcast que revisa as intervenções pré-natais para LUTO está disponível.
Vídeo 3. Ilustração de intervenção fetal para LUTO.
Complicações
Intervenções pré-natais para LUTO não estão isentas de risco e possíveis complicações. Um dos riscos associados tanto ao VAS quanto à cistoscopia fetal intrauterina é a rotura prematura das membranas, o que pode levar a trabalho de parto prematuro.60 As complicações da derivação vesicoamniótica incluem risco de obstrução do shunt e deslocamento, ambos podendo resultar em óbito fetal.55 Além disso, há relatos de posicionamento incorreto do shunt em órgãos intra-abdominais circundantes.61 A cistoscopia fetal com ablação a laser tem sido associada a uma taxa de fístula de 10%, a qual variou conforme a idade gestacional, bainhas curvas versus semicurvas, tipo e configurações do laser, bem como a experiência do operador, de maneira estatisticamente significativa.62
Conclusões
As anomalias urológicas são comumente detectadas na avaliação anatômica fetal abrangente realizada de rotina no segundo trimestre do pré-natal. A anomalia mais comum identificada é a hidronefrose pré-natal, que geralmente é transitória. No entanto, outras anomalias geniturinárias detectadas no pré-natal podem ter pior desfecho. Em particular, a obstrução do trato urinário inferior pode levar a importante morbidade e mortalidade fetais. Em alguns casos, pode ser indicado tratamento pré-natal na tentativa de preservar a função renal e prevenir a hipoplasia pulmonar.
Pontos-chave
- A hidronefrose antenatal é observada em 1–5% de todas as gestações e representa o diagnóstico pré-natal mais frequente.
- O diâmetro ântero-posterior da pelve renal ( APRPD) pré-natal menor que 4 mm entre as semanas 16–27 de gestação e menor que 7 mm na semana 28 ou mais de gestação são considerados dentro da faixa fisiológica.
- Existem muitas condições e anomalias urogenitais que são detectadas por meio de imagem pré-natal. Muitas delas podem ser diagnosticadas por ultrassonografia, com a ressonância magnética fetal fornecendo maior esclarecimento.
- A obstrução do trato urinário inferior sem intervenção pode levar a morbidade e mortalidade marcadas no feto. Embora existam várias modalidades de tratamento, são necessários estudos em larga escala para determinar a eficácia em preservar a função renal e prevenir a hipoplasia pulmonar.
Leituras recomendadas
- Lee RS, Cendron M, Kinnamon DD, Nguyen HT. Antenatal Hydronephrosis as a Predictor of Postnatal Outcome: A Meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/peds.2006-0120.
- Mallik M, Watson AR. Antenatally detected urinary tract abnormalities: more detection but less action. Pediatr Nephrol 2008; 23 (6): 897–904. DOI: 10.1007/s00467-008-0746-9.
- Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: Introduction to the system used by the society for fetal urology. Pediatr Radiol 1993; 23 (6): 478–480. DOI: 10.1007/bf02012459.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B, et al.. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 0 (6): 82–98. DOI: 10.3410/f.725257762.793506733.
- Haeri S. Fetal Lower Urinary Tract Obstruction (LUTO): a practical review for providers. Matern Health Neonatol Perinatol 0AD; 1 (1). DOI: 10.1186/s40748-015-0026-1.
Referências
- Bronshtein M, Yoffe N, Brandes JM, Blumenfeld Z. First and early second-trimester diagnosis of fetal urinary tract anomalies using transvaginal sonography. Prenat Diagn 1990; 10 (10): 653–666. DOI: 10.1002/pd.1970101005.
- Corteville JE, Gray DL, Crane JP. Congenital hydronephrosis: Correlation of fetal ultrasonographic findings with infant outcome. Am J Obstet Gynecol 1991; 165 (2): 384–388. DOI: 10.1016/0002-9378(91)90099-d.
- Mallik M, Watson AR. Antenatally detected urinary tract abnormalities: more detection but less action. Pediatr Nephrol 2008; 23 (6): 897–904. DOI: 10.1007/s00467-008-0746-9.
- Alcaraz A, Vinaixa F, Tejedo-Mateu A, Forés MM, Gotzens V, Mestres CA, et al.. Obstruction and Recanalization of the Ureter during Embryonic Development. J Urol 1991; 145 (2): 410–416. DOI: 10.1016/s0022-5347(17)38354-4.
- Saphier CJ, Gaddipati S, Applewhite LE, Berkowitz RL. Prenatal Diagnosis And Management Of Abnormalities In The Urologic System. Clin Perinatol 2000; 27 (4): 921–945. DOI: 10.1016/s0095-5108(05)70058-0.
- Glibert WM, Moore TR, Brace RA. Amniotic fluid volume dynamics. Fetal Matern Med Rev 1991; 3 (2): 89–104. DOI: 10.1017/s0965539500000486.
- Rabinowitz R, Peters MT, Vyas S, Campbell S, Nicolaides KH. Measurement of fetal urine production in normal pregnancy by real-time ultrasonography. Am J Obstet Gynecol 1989; 161 (5): 1264–1266. DOI: 10.1016/0002-9378(89)90679-0.
- Pitkin R. Potter EL. Bilateral absence of ureters and kidneys: a report of 50 cases. Obstet Gynecol 1965;25:3–12. Obstet Gynecol 0AD; 101 (6): 1159. DOI: 10.1016/s0029-7844(02)02394-3.
- Renkema KY, Winyard PJ, Skovorodkin IN, Levtchenko E, Hindryckx A, Jeanpierre C, et al.. Congenital anomalies of the kidney and urinary tract (CAKUT). Lijec Vjesn 2011; 144 (Supp 1): 843–851. DOI: 10.26800/lv-144-supl1-26.
- Hogan J, Dourthe M-E, Blondiaux E, Jouannic J-M, Garel C, Ulinski T. Renal outcome in children with antenatal diagnosis of severe CAKUT. Pediatr Nephrol 2012; 27 (3): 497–502. DOI: 10.1007/s00467-011-2068-6.
- Lee RS, Cendron M, Kinnamon DD, Nguyen HT. Antenatal Hydronephrosis as a Predictor of Postnatal Outcome: A Meta-analysis. Pediatrics 2006; 118 (2): 586–593. DOI: 10.1542/peds.2006-0120.
- Shih VE, Laframboise R, Mandell R, Pichette J. Neonatal form of the hyperornithinaemia, hyperammonaemia, and homocitrullinuria (HHH) syndrome and prenatal diagnosis. Prenat Diagn 0AD; 12 (9): 717–723. DOI: 10.1002/pd.1970120905.
- Harrison MR, Golbus MS, Filly RA, Nakayama DK, Callen PW, Lorimier AAde, et al.. Management of the fetus with congenital hydronephrosis. J Pediatr Surg 1982; 17 (6): 728–742. DOI: 10.1016/s0022-3468(82)80437-5.
- Paces-Fessy M, Fabre M, Lesaulnier C, Cereghini S. Hnf1b and Pax2 cooperate to control different pathways in kidney and ureter morphogenesis. Hum Mol Genet 2012; 21 (14): 3143–3155. DOI: 10.1093/hmg/dds141.
- Allison SJ. Ret signaling reveals insights into the pathogenesis of CAKUT. Nat Rev Nephrol 2012; 8 (8): 432–432. DOI: 10.1038/nrneph.2012.119.
- Clayton DB, Brock JW. Prenatal Ultrasound and Urological Anomalies. Pediatr Clin North Am 0AD; 59 (4): 739–756. DOI: 10.1016/j.pcl.2012.05.003.
- Grignon A, Filion R, Filiatrault D, Robitaille P, Homsy Y, Boutin H, et al.. Urinary tract dilatation in utero: classification and clinical applications. Radiology 1986; 160 (3): 645–647. DOI: 10.1148/radiology.160.3.3526402.
- Kajbafzadeh A-M, Payabvash S, Sadeghi Z, Elmi A, Jamal A, Hantoshzadeh Z, et al.. Comparison of magnetic resonance urography with ultrasound studies in detection of fetal urogenital anomalies. J Pediatr Urol 2008; 4 (1): 32–39. DOI: 10.1016/j.jpurol.2007.07.005.
- Chalouhi GE, Millischer A-É, Mahallati H, Siauve N, Melbourne A, Grevent D, et al.. The use of fetal MRI for renal and urogenital tract anomalies. Prenat Diagn 2020; 40 (1): 100–109. DOI: 10.1002/pd.5610.
- Werner H, Lopes J, Ribeiro G, Jésus NR, Santos GR, Alexandria HAF, et al.. Three-dimensional virtual cystoscopy: Noninvasive approach for the assessment of urinary tract in fetuses with lower urinary tract obstruction. Prenat Diagn 2020; 37 (13): 1350–1352. DOI: 10.1002/pd.5188.
- Swenson DW, Darge K, Ziniel SI, Chow JS. Characterizing upper urinary tract dilation on ultrasound: a survey of North American pediatric radiologists’ practices. Pediatr Radiol 2015; 45 (5): 686–694. DOI: 10.1007/s00247-014-3221-8.
- Mure P-Y, Mouriquand P. Upper urinary tract dilatation: Prenatal diagnosis, management and outcome. Semin Fetal Neonatal Med 2008; 13 (3): 152–163. DOI: 10.1016/j.siny.2007.09.010.
- Mouriquand PDE, Whitten M, Pracros J-P. Pathophysiology, diagnosis and management of prenatal upper tract dilatation. Prenat Diagn 2001; 21 (11): 942–951. DOI: 10.1002/pd.207.
- Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: Introduction to the system used by the society for fetal urology. Pediatr Radiol 1993; 23 (6): 478–480. DOI: 10.1007/bf02012459.
- Nguyen HT, Benson CB, Bromley B, Campbell JB, Chow J, Coleman B, et al.. Faculty Opinions recommendation of Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2014; 0 (6): 82–98. DOI: 10.3410/f.725257762.793506733.
- Onen A. Grading of Hydronephrosis: An Ongoing Challenge. Front Pediatr 0AD; 8 (458). DOI: 10.3389/fped.2020.00458.
- Roo R de, Voskamp BJ, Kleinrouweler CE, Mol BW, Pajkrt E, Bouts AHM. Determination of threshold value for follow-up of isolated antenatal hydronephrosis detected in the second trimester. J Pediatr Urol 2017; 13 (6): 594–601. DOI: 10.1016/j.jpurol.2017.06.001.
- Coplen DE, Austin PF, Yan Y, Blanco VM, Dicke JM. The Magnitude of Fetal Renal Pelvic Dilatation can Identify Obstructive Postnatal Hydronephrosis, and Direct Postnatal Evaluation and Management. Yearbook of Urology 2006; 2007 (2): 237–238. DOI: 10.1016/s0084-4071(08)70187-8.
- Dias CS, Silva JM, Pereira AK, Marino VS, Silva LA, Coelho AM, et al.. Faculty Opinions recommendation of Diagnostic accuracy of renal pelvic dilatation for detecting surgically managed ureteropelvic junction obstruction. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2013; 90 (2): 61–66. DOI: 10.3410/f.718084698.793482695.
- Skoog SJ, Peters CA, Arant BS Jr., Copp HL, Elder JS, Hudson RG, et al.. Pediatric Vesicoureteral Reflux Guidelines Panel Summary Report: Clinical Practice Guidelines for Screening Siblings of Children With Vesicoureteral Reflux and Neonates/Infants With Prenatal Hydronephrosis. Yearbook of Urology 2010; 2011 (3): 205–207. DOI: 10.1016/j.yuro.2010.12.022.
- Dias CS, Bouzada MCF, Pereira AK, Barros PS, Chaves ACL, Amaro AP, et al.. Predictive Factors for Vesicoureteral Reflux and Prenatally Diagnosed Renal Pelvic Dilatation. J Urol 2009; 182 (5): 2440–2445. DOI: 10.1016/j.juro.2009.07.058.
- Chitrit Y, Bourdon M, Korb D, Grapin-Dagorno C, Joinau-Zoulovits F, Vuillard E, et al.. Posterior urethral valves and vesicoureteral reflux: can prenatal ultrasonography distinguish between these two conditions in male fetuses? Prenat Diagn 2016; 36 (9): 831–837. DOI: 10.1002/pd.4868.
- Fontanella F, Duin LK, Scheltema PN Adama van, Cohen-Overbeek TE, Pajkrt E, Bekker M, et al.. Prenatal diagnosis of LUTO: improving diagnostic accuracy. Ultrasound Obstet Gynecol 2018; 52 (6): 739–743. DOI: 10.1002/uog.18990.
- Chauvin NA, Epelman M, Victoria T, Johnson AM. Complex Genitourinary Abnormalities on Fetal MRI: Imaging Findings and Approach to Diagnosis. AJR Am J Roentgenol 2012; 199 (2): W222–w231. DOI: 10.2214/ajr.11.7761.
- Moscardi PRM, Katsoufis CP, Jahromi M, Blachman-Braun R, DeFreitas MJ, Kozakowski K, et al.. Re: Prenatal Renal Parenchymal Area as a Predictor of Early End-Stage Renal Disease in Children with Vesicoamniotic Shunting for Lower Urinary Tract Obstruction. J Urol 2018; 204 (5): 1083–1083. DOI: 10.1097/ju.0000000000001254.
- Alkhamis WH, Abdulghani SH, Altaki A. Challenging diagnosis of prune belly syndrome antenatally: a case report. J Med Case Rep 2019; 13 (1): 98. DOI: 10.1186/s13256-019-2120-x.
- Ome M, Wangnapi R, Hamura N, Umbers AJ, Siba P, Laman M, et al.. A case of ultrasound-guided prenatal diagnosis of prune belly syndrome in Papua New Guinea – implications for management. BMC Pediatr 0AD; 13 (1). DOI: 10.1186/1471-2431-13-70.
- Perlman S, Borovitz Y, Ben-Meir D, Hazan Y, Nagar R, Bardin R, et al.. Prenatal diagnosis and postnatal outcome of anterior urethral anomalies. Prenat Diagn 2020; 40 (2): 191–196. DOI: 10.1002/pd.5582.
- Meyers ML, Treece AL, Brown BP, Vemulakonda VM. Imaging of fetal cystic kidney disease: multicystic dysplastic kidney versus renal cystic dysplasia. Pediatr Radiol 2020; 50 (13): 1921–1933. DOI: 10.1007/s00247-020-04755-5.
- Bascietto F, Khalil A, Rizzo G, Makatsariya A, Buca D, Silvi C, et al.. Prenatal imaging features and postnatal outcomes of isolated fetal duplex renal collecting system: A systematic review and meta-analysis. Prenat Diagn 2020; 40 (4): 424–431. DOI: 10.1002/pd.5622.
- Sozubir S, Lorenzo AJ, Twickler DM, Baker LA, Ewalt DH. Prenatal diagnosis of a prolapsed ureterocele with magnetic resonance imaging. Urology 2003; 62 (1): 144. DOI: 10.1016/s0090-4295(03)00152-3.
- Weiss DA, Oliver ER, Borer JG, Kryger JV, Roth EB, Groth TW, et al.. Key anatomic findings on fetal ultrasound and MRI in the prenatal diagnosis of bladder and cloacal exstrophy. J Pediatr Urol 2020; 16 (5): 665–671. DOI: 10.1016/j.jpurol.2020.07.024.
- Clements MB, Chalmers DJ, Meyers ML, Vemulakonda VM. Prenatal Diagnosis of Cloacal Exstrophy: A Case Report and Review of the Literature. Urology 2014; 83 (5): 1162–1164. DOI: 10.1016/j.urology.2013.10.050.
- Giuliani M, Gui B, Laino M, Zecchi V, Rodolfino E, Ninivaggi V, et al.. Persistent Urogenital Sinus: Diagnostic Imaging for Clinical Management. What Does the Radiologist Need to Know? Am J Perinatol 2016; 33 (05): 425–432. DOI: 10.1055/s-0035-1565996.
- Capito C, Belarbi N, Paye Jaouen A, Leger J, Carel J-C, Oury J-F, et al.. Prenatal pelvic MRI: Additional clues for assessment of urogenital obstructive anomalies. J Pediatr Urol 2014; 10 (1): 162–166. DOI: 10.1016/j.jpurol.2013.07.020.
- Craparo FJ, Rustico M, Tassis B, Coviello D, Nicolini U. Fetal Serum \ensuremathβ2-Microglobulin Before and After Bladder Shunting: A 2-Step Approach to Evaluate Fetuses With Lower Urinary Tract Obstruction. J Urol 2007; 178 (6): 2576–2579. DOI: 10.1016/j.juro.2007.08.052.
- FISK NM, RONDEROS-DUMIT D, TANNIRANDORN Y, NICOLINI U, TALBERT D, RODECK CH. Normal amniotic pressure throughout gestation. Bjog 1992; 99 (1): 18–22. DOI: 10.1111/j.1471-0528.1992.tb14385.x.
- Nicolini U, Tannirandorn Y, Vaughan J, Fisk NM, Nicolaidis P, Rodeck CH. Further predictors of renal dysplasia in fetal obstructive uropathy: Bladder pressure and biochemistry of ‘fresh’ urine. Prenat Diagn 1991; 11 (3): 159–166. DOI: 10.1002/pd.1970110305.
- Johnson MP, Freedman AL. Fetal uropathy. Curr Opin Obstet Gynecol 1999. 0AD; 1 (2): 85–94. DOI: 10.1097/00001703-199904000-00011.
- Glick PL, Harrison MR, Golbus MS, Adzick NS, Filly RA, Callen PW, et al.. Management of the Fetus With Congenital Hydronephrosis II: Prognostic Criteria and Selection for Treatment. J Urol 1985; 135 (2): 444–445. DOI: 10.1016/s0022-5347(17)45673-4.
- Kilby MD, Morris RK. Fetal therapy for the treatment of congenital bladder neck obstruction. Nat Rev Urol 2014; 11 (7): 412–419. DOI: 10.1038/nrurol.2014.132.
- Morris RK, Malin GL, Quinlan-Jones E, Middleton LJ, Diwakar L, Hemming K, et al.. The Percutaneous shunting in Lower Urinary Tract Obstruction (PLUTO) study and randomised controlled trial: evaluation of the effectiveness, cost-effectiveness and acceptability of percutaneous vesicoamniotic shunting for lower urinary tract obstruction. Health Technol Assess 2013; 17 (59): –232. DOI: 10.3310/hta17590.
- Manning FA, Harrison MR, Rodeck C, International Fetal Medicine of the, Surgery Society M. Catheter Shunts for Fetal Hydronephrosis and Hydrocephalus. N Engl J Med 1986; 315 (5): 336–340. DOI: 10.1056/nejm198607313150532.
- Won H-S, Kim S-K, Shim J-Y, Ryang Lee P, Kim A. Vesicoamniotic shunting using a double-basket catheter appears effective in treating fetal bladder outlet obstruction. Acta Obstet Gynecol Scand 2006; 85 (7): 879–884. DOI: 10.1080/00016340500449923.
- Morris RK, Malin GL, Quinlan-Jones E, Middleton LJ, Hemming K, Burke D, et al.. Faculty of 1000 evaluation for Percutaneous vesicoamniotic shunting versus conservative management for fetal lower urinary tract obstruction (PLUTO): a randomised trial. F1000 - Post-Publication Peer Review of the Biomedical Literature 2013; 82 (9903): 496–506. DOI: 10.3410/f.718077679.793484579.
- Quintero RA, Johnson MP, Romero R, Cotton DB, Evans MI, Smith C, et al.. In-utero percutaneous cystoscopy in the management of fetal lower obstructive uropathy. Lancet 1995; 346 (8974): 537–540. DOI: 10.1016/s0140-6736(95)91381-5.
- Ruano R, Yoshizaki CT, Giron AM, Srougi M, Zugaib M. Cystoscopic placement of transurethral stent in a fetus with urethral stenosis. Ultrasound Obstet Gynecol 2014; 44 (2): 238–240. DOI: 10.1002/uog.13293.
- Haeri S. Fetal Lower Urinary Tract Obstruction (LUTO): a practical review for providers. Matern Health Neonatol Perinatol 0AD; 1 (1). DOI: 10.1186/s40748-015-0026-1.
- Ruano R, Sananes N, Sangi-Haghpeykar H, Hernandez-Ruano S, Moog R, Becmeur F, et al.. Fetal intervention for severe lower urinary tract obstruction: a multicenter case-control study comparing fetal cystoscopy with vesicoamniotic shunting. Ultrasound Obstet Gynecol 2015; 45 (4): 452–458. DOI: 10.1002/uog.14652.
- Crombleholme TM, Harrison MR, Langer JC, Longaker MT, Anderson RL, Slotnick NS, et al.. Early experience with open fetal surgery for congenital hydronephrosis. J Pediatr Surg 1988; 23 (12): 1114–1121. DOI: 10.1016/s0022-3468(88)80325-7.
- Mann S, Johnson MP, Wilson RD. Fetal thoracic and bladder shunts. Semin Fetal Neonatal Med 2010; 15 (1): 28–33. DOI: 10.1016/j.siny.2009.06.001.
- Sananes N, Favre R, Koh CJ, Zaloszyc A, Braun MC, Roth DR, et al.. Urological fistulas after fetal cystoscopic laser ablation of posterior urethral valves: surgical technical aspects. Ultrasound Obstet Gynecol 2015; 45 (2): 183–189. DOI: 10.1002/uog.13405.
Ultima atualização: 2025-09-21 13:35