1: Embriologia do Trato Urinário
Este capítulo levará aproximadamente 22 minutos para ler.
Introdução
Apesar das diferenças funcionais entre o trato urinário e o sistema reprodutor, as origens embriológicas e o desenvolvimento desses sistemas estão integrados entre si. O trato urinário é composto pelos rins, uréteres, bexiga e uretra. Esse sistema tem a função de excretar resíduos e manter o equilíbrio hídrico e eletrolítico. Os rins também produzem hormônios que regulam a pressão arterial, a produção de eritropoietina e a síntese de vitamina D. O sistema genital é composto por gônadas, vias reprodutivas e genitália externa. Esse sistema sintetiza e recebe hormônios para o crescimento e o desenvolvimento, produz e transporta espermatozoides e oócitos e, nas mulheres, sustenta e apoia o desenvolvimento fetal.
A compreensão do desenvolvimento embriológico do trato geniturinário fornece uma base para entender a função anatômica e fisiológica desses órgãos, assim como a fisiopatologia das estruturas malformadas. Embora a embriologia relativa a várias condições geniturinárias seja apresentada em detalhes em outros capítulos, o objetivo deste capítulo é fornecer uma visão geral da embriologia do trato geniturinário.
Nesta visão geral, usamos “masculino” para nos referirmos à genitália interna e externa mais tipicamente observada em pessoas com o genótipo 46,XY e “feminino” para nos referirmos à genitália interna e externa mais tipicamente observada em pessoas com o genótipo 46,XX.
Rins e Trato Urinário Superior
O desenvolvimento do rim e do trato urinário superior progride ao longo das etapas propostas de pronefro, mesonefro e metanefro (Figura 1) O desenvolvimento de cada unidade renal acaba por dar origem ao parênquima renal funcional (composto por cerca de 250.000 a 3 milhões de néfrons1,2), e ao sistema coletor: cálices menores e maiores, pelve renal e ureter.
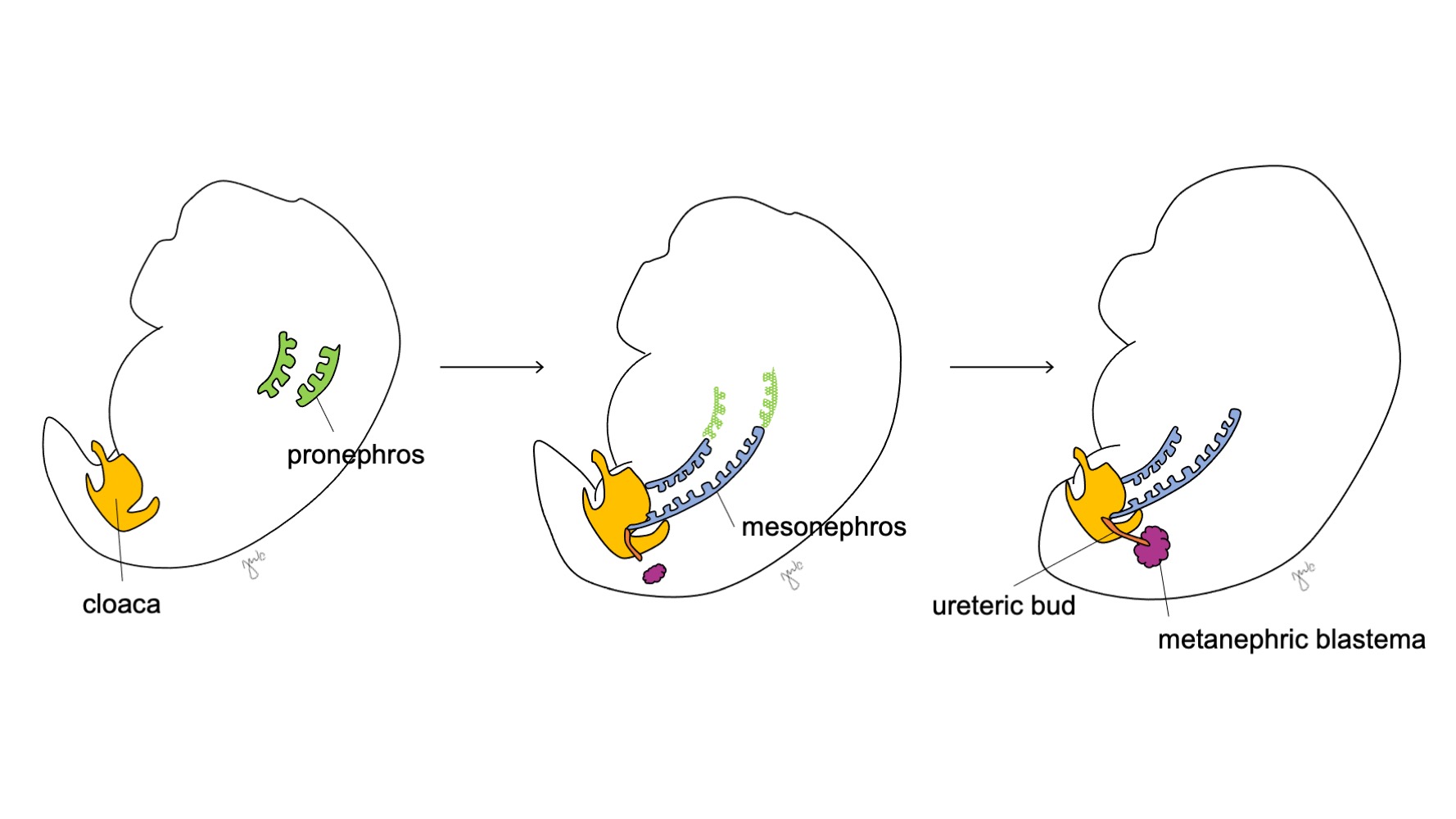
Figura 1 Estágios do desenvolvimento do rim e do trato urinário superior. O rim progride pelo pronefro na semana 3 (verde), pelo mesonefro a partir da semana 4 (azul) e pelo metanefro a partir da semana 5 de gestação. À medida que o mesonefro se conecta à cloaca, o broto ureteral (laranja) surge adjacente a essa junção e funde-se com o blastema metanéfrico (bordô).
Na 3ª semana de gestação, o mesoderma intermediário nas regiões cervicais e torácicas superiores condensa-se para formar o pronefro. O pronefro é uma estrutura primitiva e não funcional composta por esferas ocas de tecido e, aparentemente, desempenha um papel transitório no desenvolvimento embriológico do rim. Os ductos pronefróticos estendem-se caudalmente para dar origem aos ductos mesonéfricos e degeneram até o final da quarta semana de gestação. À luz do conceito de que a ontogenia recapitula a filogenia (isto é, o desenvolvimento embriológico progride por etapas da evolução das espécies), propõe-se o papel transitório do pronefro humano com base na sua função no rim embriológico de diversos cordados.3 No entanto, pouco se sabe sobre o pronefro humano e estruturas pronefróticas não foram detectáveis na avaliação de embriões humanos com 3-4 semanas de desenvolvimento.3
O mesonefro origina-se ao nível da vértebra torácica com aproximadamente 4 semanas de gestação.3 Perto do final da quarta semana, o mesonefro estende-se caudalmente para se ligar à cloaca. O mesonefro funciona como um rim primitivo que filtra o sangue por meio de túbulos. Embora os túbulos degenerem e o mesonefro diminua em relação ao tamanho do embrião em crescimento, os ductos mesonéfricos (wolffianos) persistem bilateralmente e contribuem ainda para o desenvolvimento do trato urinário (trígono vesical e ureteres) e do trato reprodutor masculino (ducto deferente, epidídimo, vesícula seminal, apêndice do epidídimo).4
Após o mesonefro aderir à cloaca, o broto ureteral origina-se da porção póstero-distal do ducto mesonéfrico, próximo à sua junção com a cloaca, na 5ª semana de gestação.3 O blastema metanéfrico surge concomitantemente como uma massa de tecido mesenquimal agregada derivada do mesoderma intermediário. Em conjunto, o broto ureteral e o blastema metanéfrico formam o metanefro, que é o estágio final do desenvolvimento renal e do trato urinário superior. O blastema metanéfrico e o broto ureteral coinduzem-se mutuamente a se desenvolver: o blastema metanéfrico encapsula e se funde com o broto ureteral, e o broto ureteral penetra o blastema metanéfrico e começa a bifurcar-se. À medida que o broto ureteral se alonga para formar o ureter, ele se bifurca para formar a pelve renal e os cálices maiores, que então se ramificam para formar os cálices menores, a pirâmide renal e, por fim, os túbulos coletores do néfron (Figura 2) Enquanto isso, à medida que o broto ureteral se alonga e se bifurca, o blastema metanéfrico forma as estruturas do néfron (Figura 3) O fator de crescimento endotelial vascular-2 (VEGF-2) inicia a vascularização no blastema metanéfrico.5 Túbulos excretores em forma de S adquirem capilares para formar glomérulos, cada um com uma cápsula de Bowman envolvente. Esses túbulos excretores alongam-se para formar o túbulo contorcido proximal, a alça de Henle e o túbulo contorcido distal. O túbulo contorcido distal une-se ao ducto coletor (derivado do broto ureteral) para formar o néfron.
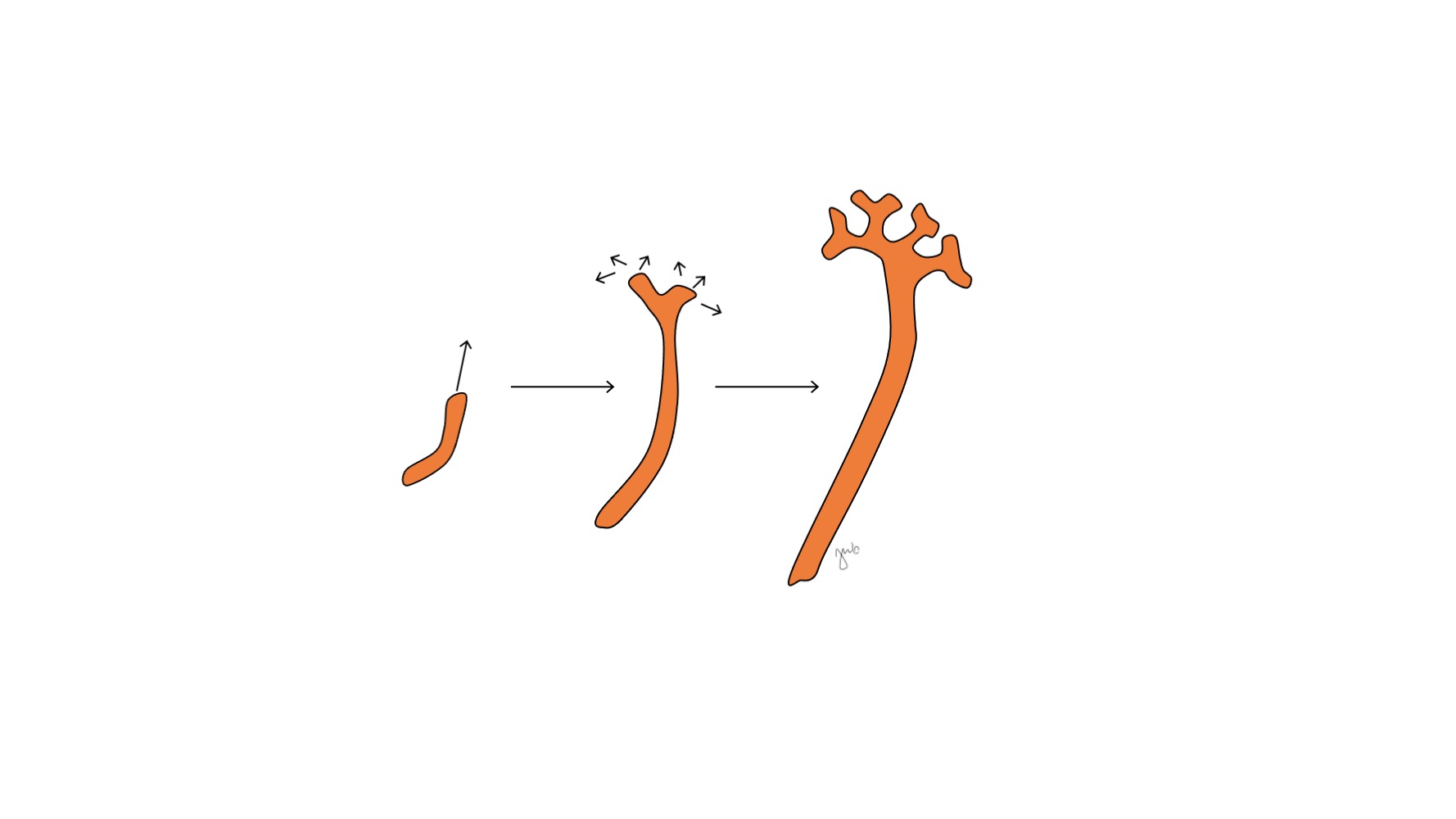
Figura 2 Broto ureteral. O broto ureteral alonga-se e ramifica-se para formar a pelve renal, os cálices maiores e menores e o ducto coletor do néfron.
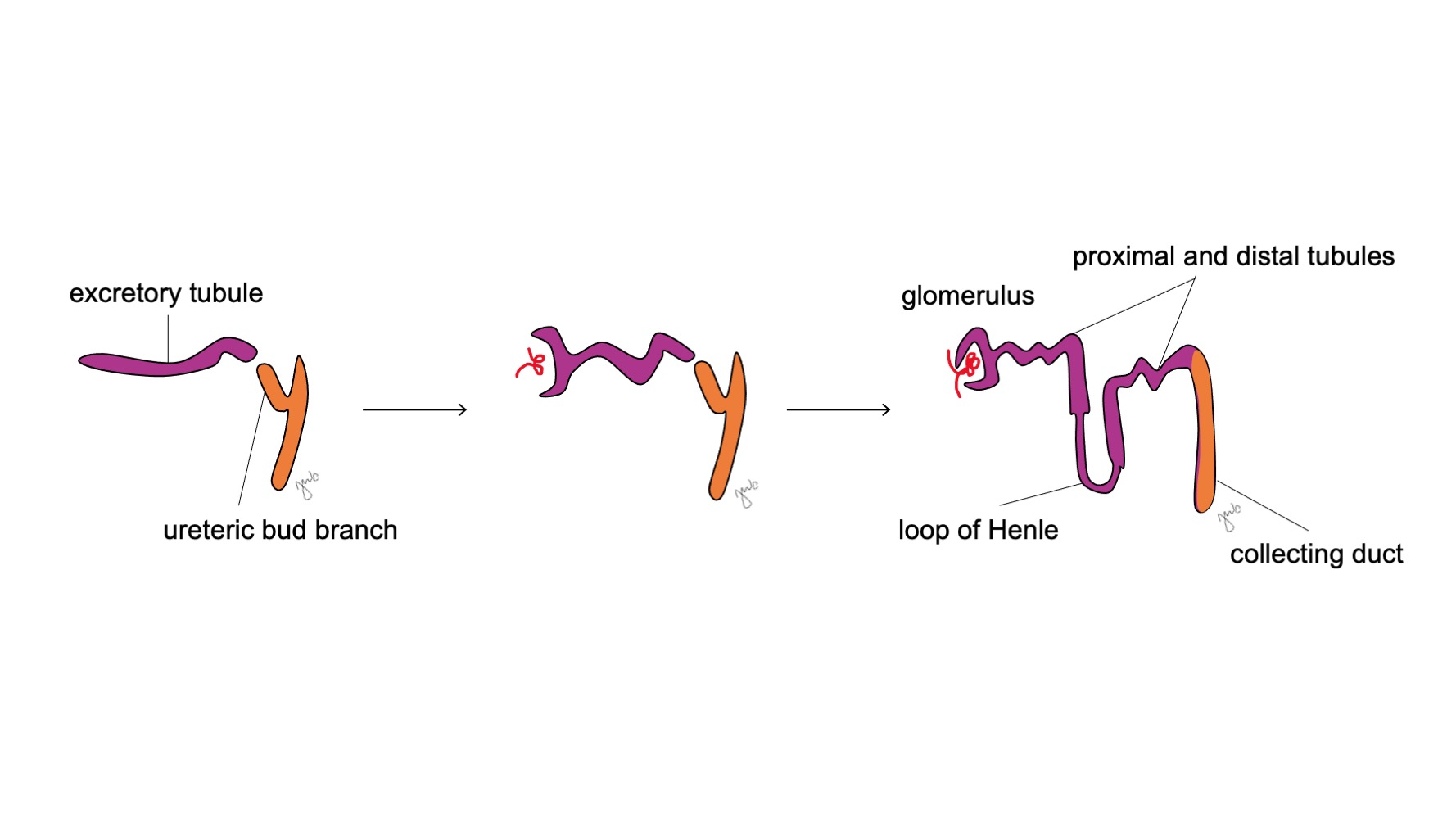
Figura 3 Desenvolvimento do néfron. Túbulos excretores em forma de S (roxo; provenientes do blastema metanéfrico) adquirem capilares para formar glomérulos, alongam-se para formar os túbulos proximais e distais e as alças de Henle, e se unem aos ductos coletores oriundos do broto ureteral (laranja; dos ductos mesonéfricos) para, por fim, formar néfrons.
O broto ureteral e o blastema metanéfrico induzem reciprocamente o crescimento por meio de diversos fatores e interações moleculares que contribuem para o desenvolvimento do metanefro. A proteína morfogenética óssea BMP-4 é expressa no mesênquima e exerce funções duais ao inibir a brotação ureteral e promover o alongamento ureteral.6 A expressão local do antagonista de BMP, gremlin (grem1), permite que a brotação ureteral se inicie.6,7 Após o início da brotação ureteral, a BMP-4 posteriormente promove o alongamento e parece estar envolvida em promover o desenvolvimento de músculo liso periureteral.6,8 A BMP-7, proveniente do blastema metanéfrico e do broto ureteral, mantém e sensibiliza os progenitores de néfron aos sinais do broto ureteral.6 O blastema metanéfrico secreta o fator neurotrófico derivado de células gliais (GDNF), que também induz o broto ureteral a ramificar-se e alongar-se.9 A glicoproteína WNT11 é expressa na ponta do broto ureteral em ramificação e ajuda a manter a expressão de GDNF.10,11 Há interação recíproca entre WNT11, GDNF e o receptor tirosina quinase RET no desenvolvimento do metanefro, pois mutações em WNT11 e RET resultam em defeitos de ramificação e hipoplasia renal.11 Os ligantes do fator de crescimento de fibroblastos (FGF) e seus receptores correspondentes (FGFR) também contribuem para o padrão do mesênquima metanéfrico, a indução do broto ureteral, a ramificação do broto ureteral e a nefrogênese.12 Além disso, o contato direto com o mesênquima também promove o alongamento do broto ureteral e o padrão de ramificação.13
O metanéfros desenvolve-se no rim funcional e anatomicamente posicionado, com produção urinária precoce, ascensão renal e revascularização, e rotação renal. A produção de urina fetal começa nas semanas 10-11 de gestação e torna-se o componente predominante do líquido amniótico.14 Os rins estão inicialmente em estreita proximidade entre si na região sacral do embrião.15,16 À medida que o embrião cresce longitudinalmente, cada rim ascende nas semanas 6-9 de sua localização pélvica inicial para o retroperitônio superior na região torácica inferior e lombar superior (Figura 4) Vasos sanguíneos transitórios se desenvolvem e degeneram conforme os rins ascendem até que alcancem seu destino final no retroperitônio superior e as artérias e veias renais definitivas se desenvolvem. Os rins rotacionam de modo que a pelve renal passa de uma orientação anterior para medial.16
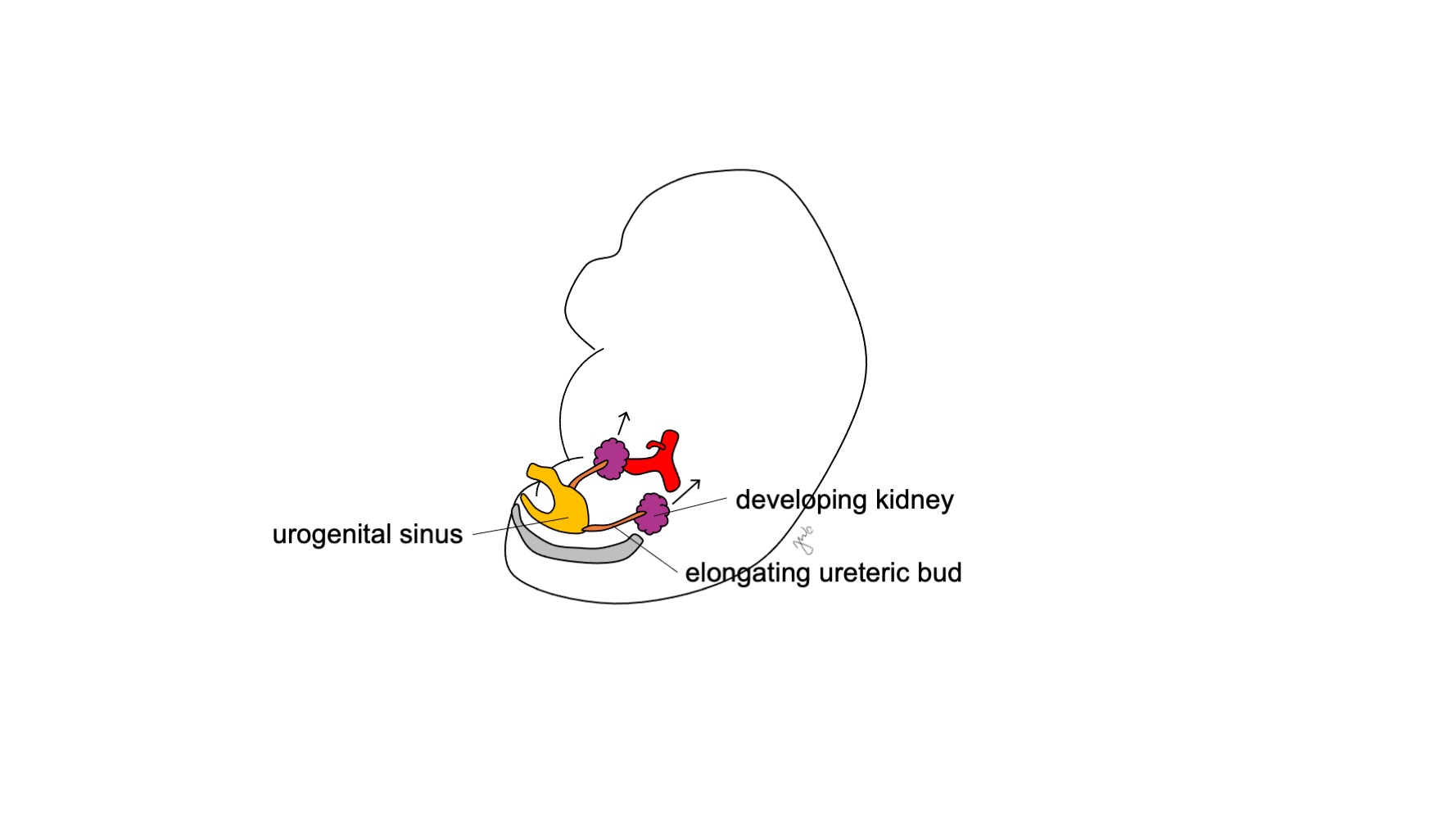
Figura 4 Ascensão renal. O rim em desenvolvimento ascende de sua localização pélvica para o retroperitônio superior.
Pontos-chave
O rim e o trato urinário superior em desenvolvimento evoluem ao longo dos estágios de pronefro, mesonefro e metanefro. O metanefro é composto pelo blastema metanéfrico e pelo broto ureteral, que se desenvolvem, respectivamente, em parênquima renal e sistema coletor. O mesonefro persiste e contribui para o desenvolvimento do trígono vesical, do sistema coletor do trato urinário superior e do sistema reprodutor masculino.
Trato Urinário Inferior
A cloaca atua como uma câmara comum para os tratos urogenital e anorretal, pois se conecta ao alantoide (saco vitelino) e ao intestino posterior. É uma combinação de ectoderma revestida por endoderma que se abre em um único orifício no aspecto caudal do embrião em desenvolvimento. À medida que o mesonefro se fixa à cloaca e o trato urinário superior se desenvolve como o metanefro, o trato urinário inferior se desenvolve a partir da cloaca para formar a bexiga e a uretra.
Por volta da 7ª semana de gestação, o septo urorretal cresce caudalmente, separando a cloaca em seio urogenital anterior e canal anorretal posterior, e, por fim, torna-se o corpo perineal (Figura 5)17 Em seguida, o seio urogenital subdivide-se cranial e caudalmente para formar, respectivamente, a bexiga e a uretra.
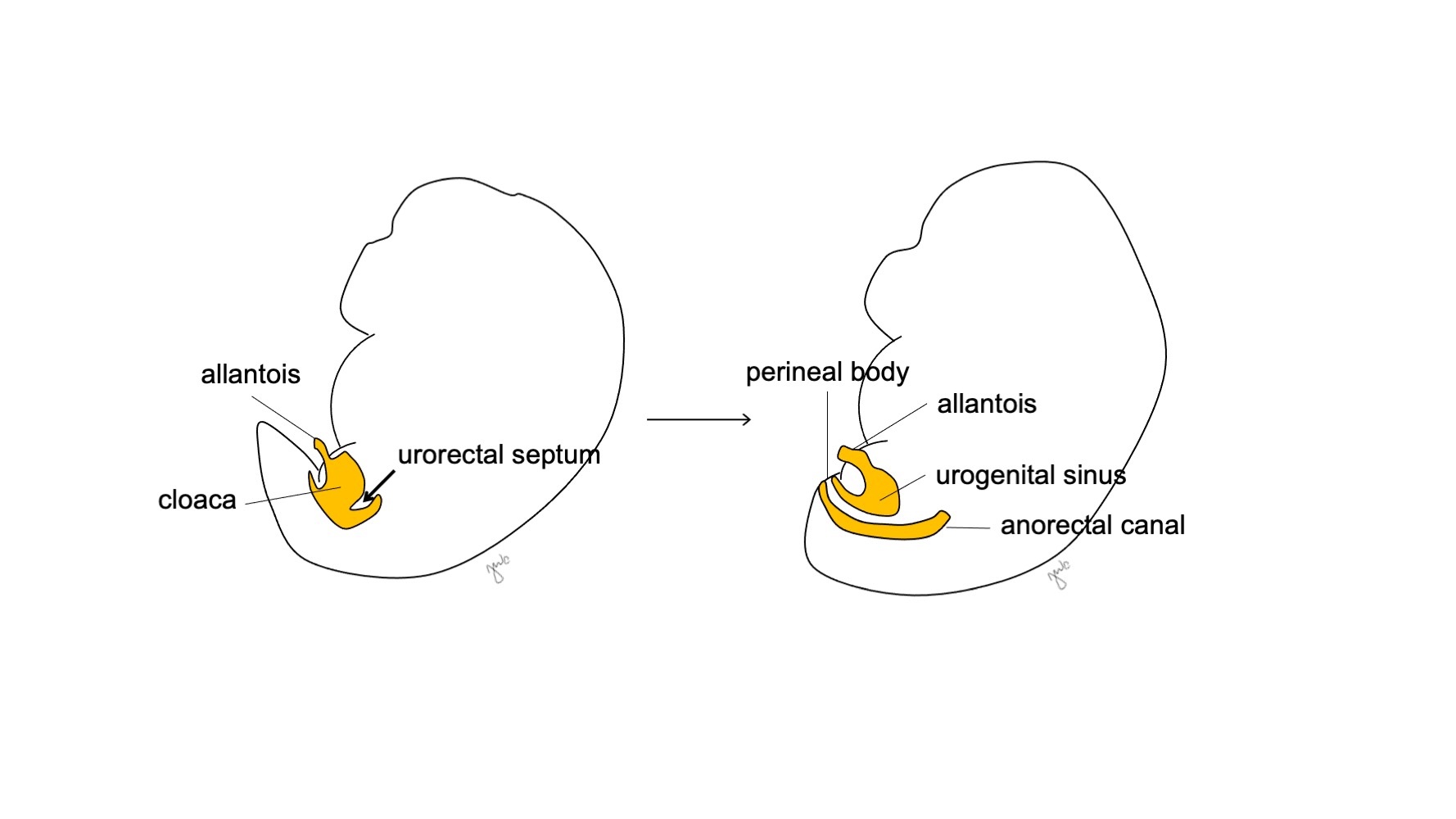
Figura 5 Divisão cloacal. O septo urorretal divide a cloaca em seio urogenital e canal anorretal. Em seguida, o septo urorretal dá origem ao corpo perineal.
O aspecto cranial do seio urogenital aumenta e torna-se a bexiga, que é inicialmente contínua com o alantoide (Figura 6) Enquanto o endoderma da antiga cloaca dá origem ao revestimento urotelial da bexiga.18 a diferenciação do músculo liso da bexiga depende de interações mesenquimais-epiteliais.19 O ducto mesonéfrico que anteriormente se ligava à cloaca permanece ligado à bexiga em desenvolvimento; ele regride e é absorvido caudalmente no trígono vesical e nos óstios ureterais. A apoptose induzida pela vitamina A dos ductos mesonéfricos, as interações entre a bexiga e o músculo liso ureteral e origens endodérmicas são outros mecanismos propostos que contribuem para o desenvolvimento do trígono.20,21,22
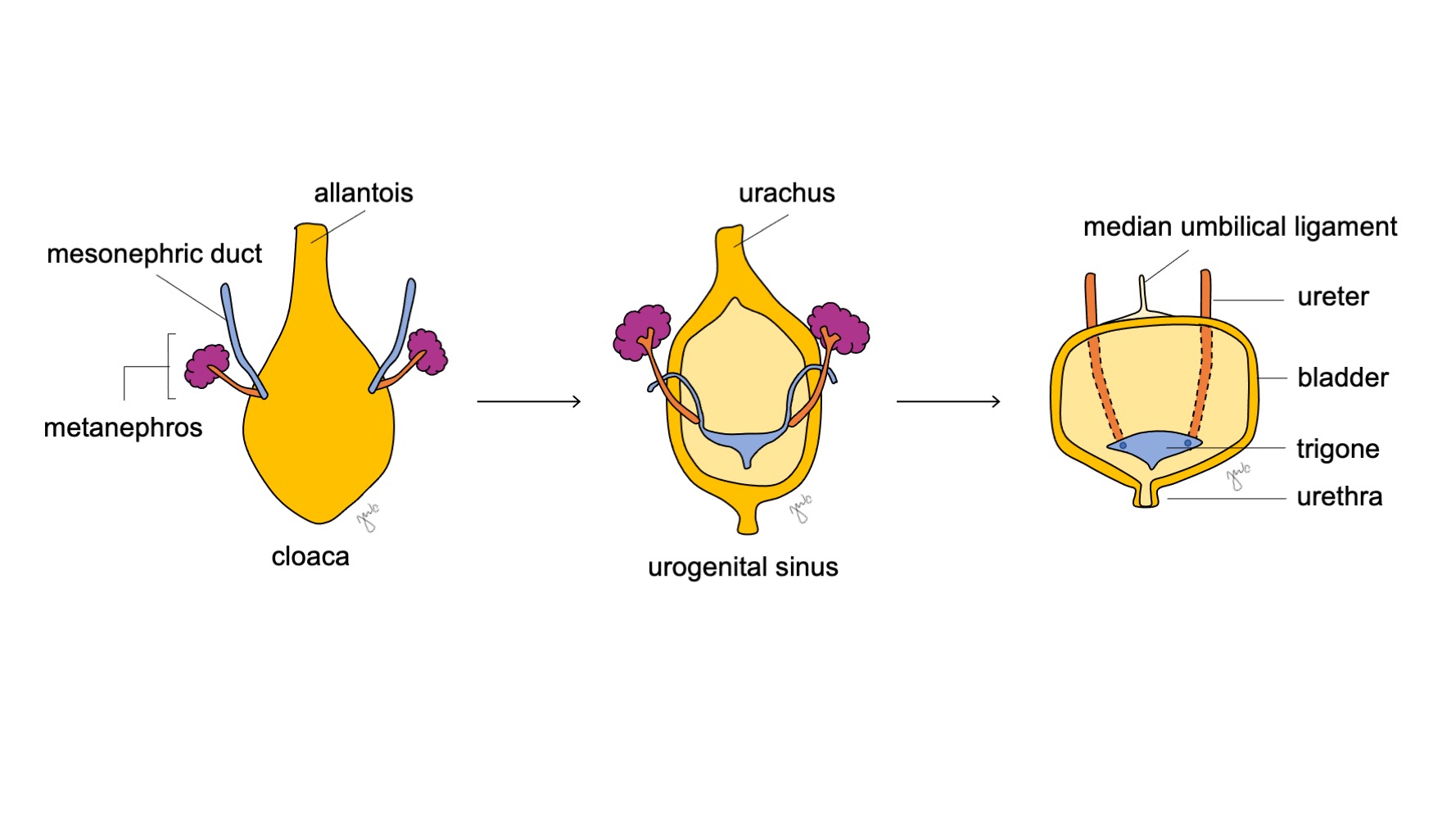
Figura 6 Desenvolvimento da bexiga. A porção cranial do seio urogenital dilata-se para formar a bexiga. O ducto mesonéfrico (azul) regride e é incorporado ao trígono vesical e aos óstios ureterais. Enquanto isso, a alantoide involui e torna-se o úraco, que então se fibrosa e constitui o ligamento umbilical mediano.
O remanescente dos ductos mesonéfricos posteriormente se desenvolve no trato reprodutivo masculino (discutido na seção gônadas e tratos reprodutivos). Os derivados dos ductos mesonéfricos afastam-se entre si à medida que o embrião continua a crescer: os óstios ureterais deslocam-se craniolateralmente enquanto os tratos reprodutivos masculinos se deslocam caudal e medialmente. O deslocamento do broto ureteral em relação à localização do ducto mesonéfrico pode afetar a localização final do óstio ureteral e o desenvolvimento do rim correspondente.23,24 Um deslocamento mais leve pode resultar em posição craniolateral ou caudomedial do óstio ureteral, ao passo que um deslocamento grave pode resultar em um uréter ectópico que se insere fora da bexiga e/ou em displasia renal.23,24
À medida que a bexiga se desenvolve, o alantoide involui e torna-se o úraco que conecta a cúpula da bexiga ao umbílico. Após o nascimento, o remanescente do úraco torna-se mais fibroso e torna-se o ligamento umbilical mediano.25
O aspecto inferocaudal do seio urogenital forma a uretra prostática e membranosa nos indivíduos do sexo masculino e a uretra e o vestíbulo vaginal nos indivíduos do sexo feminino.25 Semelhante à bexiga, o revestimento urotelial da uretra é derivado do endoderma.18 Nos indivíduos do sexo masculino, o seio urogenital se estende até o tubérculo genital para formar a uretra prostática e membranosa, ao passo que as suas pregas urogenitais associadas formam a uretra peniana.18,26 Ramificações adicionais e brotamentos a partir da uretra prostática formam as glândulas prostáticas por volta de 9-10 semanas de gestação.27 O estroma da próstata origina-se do mesênquima e se desenvolve sob a influência de andrógenos e de sinalização parácrina de múltiplos fatores, incluindo FGF, sonic hedgehog (SHH), o fator de transcrição Nkx3.1, genes homeobox (HOX), fatores de transcrição forkhead box (FOX), o fator de transcrição SRY-box (SOX-9), BMP e WNT.27,28,29,30,31 Embora a testosterona possa contribuir para o desenvolvimento prostático, a di-hidrotestosterona (DHT) tem um efeito muito mais potente sobre a próstata.27 O mesênquima prostático forma o tecido estromal e o músculo liso que circunda as glândulas e os ductos prostáticos. As glândulas bulbouretrais (de Cowper) nos indivíduos do sexo masculino formam-se por brotamento a partir da uretra. A uretra peniana é formada quando a placa uretral se tubulariza18,26 (discutido na seção genitália externa). O desenvolvimento da porção glandular da uretra é atualmente debatido e pode se formar a partir da tubularização com subsequente diferenciação endodérmica em epitélio escamoso com base em estudos mais recentes.18,32,33
Nas mulheres, o seio urogenital forma toda a uretra e a porção distal da vagina. Homólogas às glândulas prostáticas masculinas, a porção cranial da uretra forma as glândulas parauretrais (de Skene). Homólogas às glândulas bulbouretrais (de Cowper) masculinas, as glândulas de Bartholin formam-se por evaginação a partir da uretra.
Pontos-chave
A cloaca é inicialmente uma câmara comum que é dividida pelo septo uroretal para formar o seio urogenital e o canal anorretal. O seio urogenital subsequentemente expande-se cranialmente para formar a bexiga e contribui para a uretra em ambos os sexos. A alantoide, concomitantemente, involui para formar o úraco, que mais tarde se torna o ligamento umbilical mediano.
Gônadas e Tratos Reprodutivos
As gônadas e o trato reprodutor interno dos sexos masculino e feminino são inicialmente indiferenciados. A influência de fatores genéticos e hormonais determina o desenvolvimento para formar ou os testículos e as estruturas mesonéfricas (de Wolff) associadas, ou os ovários e as estruturas paramesonéfricas (de Müller) associadas.
Durante a 5ª semana de gestação, a proliferação e a condensação do epitélio germinativo e do mesênquima formam a crista gonadal adjacente ao mesonefro. Células germinativas primordiais são incorporadas a aglomerados de epitélio chamados cordões sexuais. Os cordões sexuais invaginam o tecido mesenquimal local e permitem a migração das células germinativas primordiais através da cavidade do saco vitelino até a crista gonadal na 6ª semana.34 À medida que as células germinativas e os cordões sexuais se agrupam na crista gonadal, desenvolvem-se as regiões cortical e medular da gônada.35,36 Os fatores WNT4 e SOX-9 são expressos nas cristas gonadais e variam em sua expressão na determinação do sexo humano.37 A formação da gônada também é regulada por fatores de transcrição, incluindo Wilms tumor 1 (WT1), LIM homeobox 9 (LHX9) e fator 1 da esteroidogênese (SF1).38
As gônadas indiferenciadas são bipotenciais (Figura 7) e as células germinativas primordiais têm a capacidade de se diferenciar em espermatogônias no sexo masculino ou em oogônias no sexo feminino até a sétima semana de gestação.38 Ductos mesonéfricos (de Wolff) e ductos paramesonéfricos (de Müller) também são bipotenciais neste ponto.
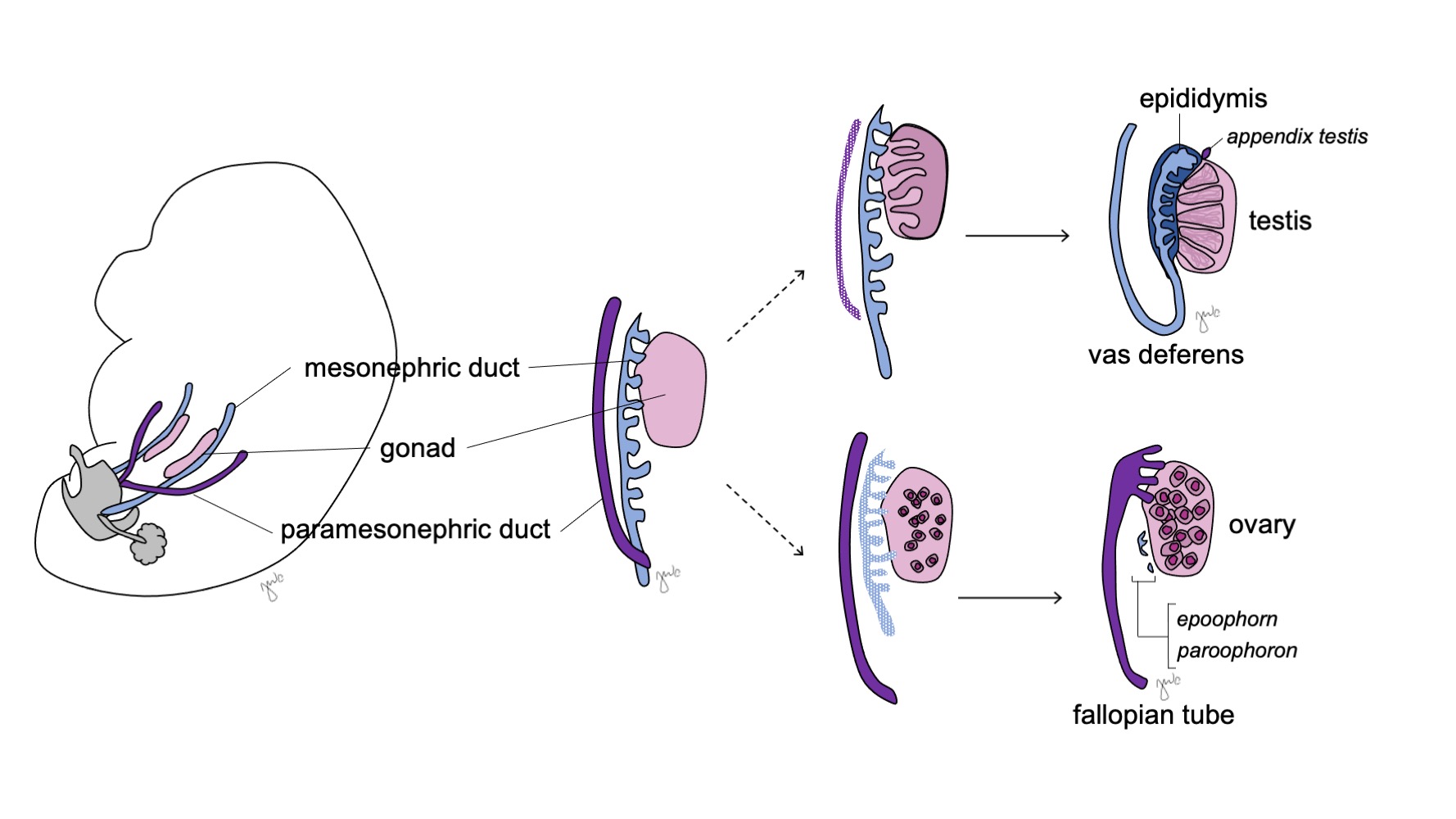
Figura 7 Diferenciação gonadal. A gônada (rosa) tipicamente se diferencia em testículo com estruturas correspondentes do ducto mesonéfrico (azul) ou em ovário com estruturas correspondentes do ducto paramesonéfrico (roxo).
A Gônada Masculina e o Trato Reprodutivo
Nos indivíduos do sexo masculino, a gônada indiferenciada diferencia-se em testículo e os ductos mesonéfricos (de Wolff) dão origem ao epidídimo, ao apêndice do epidídimo, ao ducto deferente, à vesícula seminal e ao ducto ejaculatório.
O gene SRY (sexo-determinante região do Y-cromossomo) (também conhecido como fator determinante do testículo [TDF]) está localizado no braço curto do cromossomo Y em Yp11.3 e inicia a diferenciação sexual masculina.39,40 A proteína SRY correspondente e os fatores de transcrição dos genes SOX-9, DAX-1, WT1 e SF1 influenciam a diferenciação gonadal,.% cite mcelreavey1995a vilain1998a –file 01-01 %} Verificou-se que SRY regula positivamente SOX-9 para ativar a expressão de SF1 e promover a diferenciação das células de Sertoli e de Leydig.37,41,42 Os cordões sexuais gonadais primitivos organizam-se na rete testis e em cordões seminíferos. As células de Sertoli e de Leydig desenvolvem-se entre os cordões seminíferos e iniciam a produção hormonal que promove a diferenciação masculina (discutido abaixo). A túnica albugínea encapsula esses cordões para formar o testículo. Os cordões seminíferos acabam por desenvolver um lúmen e tornam-se os túbulos seminíferos na puberdade.
As células de Sertoli e de Leydig subsequentemente iniciam a produção de hormonas testiculares que resulta numa cascata de processos de masculinização. As células de Sertoli secretam o fator inibidor de Müller (MIF) ou hormona anti-mülleriana (AMH) sob a influência de SOX-9, SF1, WT1 e DAX1, bem como da hormona folículo-estimulante (FSH).43 A hormona anti-mülleriana subsequentemente provoca a degeneração dos ductos paramesonéfricos (de Müller), tendo como remanescentes o apêndice do testículo e o utrículo prostático.40,43,44 SOX-9 e SF1 interagem para aumentar o efeito da AMH e provocar a regressão mülleriana. As células de Leydig respondem simultaneamente à hormona luteinizante (LH) e à gonadotrofina coriónica humana (hCG) de estrutura análoga para iniciar a produção de testosterona na semana 8-9. A testosterona induz a diferenciação do ducto mesonéfrico (Figura 8) em epidídimo, apêndice do epidídimo, canal deferente, ducto ejaculador e vesícula seminal44 bem como a masculinização dos genitais externos por conversão em DHT.
Após o desenvolvimento, a descida testicular começa na semana 10 e depende da pressão intra-abdominal, de influências hormonais e da tensão do gubernáculo.45 À medida que o testículo penetra no anel inguinal profundo (interno) e forma o canal inguinal, uma camada de peritônio forma a túnica vaginal. O testículo atravessa o canal inguinal entre as semanas 20-28 e sai pelo anel inguinal superficial (externo) para entrar no escroto. O músculo oblíquo externo, o músculo oblíquo interno e a fáscia transversalis da parede abdominal anterior fornecem as respectivas camadas escrotais que recobrem o testículo na forma de fáscia espermática externa, fáscia e músculo cremastéricos e fáscia espermática interna.45
A Gônada Feminina e o Trato Reprodutor Feminino
Em indivíduos do sexo feminino, a gônada indiferenciada origina o ovário e o ducto paramesonéfrico (mülleriano) origina a tuba uterina, o útero, o colo do útero e a porção proximal da vagina.
Os ovários se desenvolvem na ausência do gene SRY naqueles com genótipos 46,XX ou com genótipos 46,XY, mas com perda do gene SRY.46 O córtex ovariano prolifera e forma cordões sexuais primários que se estendem até a medula gonadal. Aos 4 meses, os cordões se dividem e formam folículos primordiais compostos por oogônias e células foliculares. As oogônias sofrem mitose e os ovócitos primários ficam arrestados na prófase I no momento do nascimento, como reserva de folículos para a reprodução futura.42 Em comparação com a descida testicular, os ovários descem para a pelve em um período de tempo mais curto.45
O desenvolvimento gonadal feminino foi anteriormente considerado o mecanismo “padrão” que ocorre na ausência de influência do gene SRY. No entanto, o desenvolvimento ovariano não parece ser um processo passivo simples. Ele é ativamente promovido pelas influências genéticas e moleculares de WNT4 e DAX-1.37,40,41,42 Ambos os genes têm efeitos anti-testiculares e WNT4 tem sido considerado o “gene determinante do ovário”.37,40 WNT4 regula positivamente a expressão de DAX-1 para suprimir a atividade transcricional de SF1, inibir a função de SOX-9 e, por fim, promover o desenvolvimento ovariano.41,42
Antes da diferenciação sexual, os ductos paramesonéfricos (müllerianos) surgem como invaginações epiteliais laterais aos ductos mesonéfricos (wolffianos).47 A ausência de AMH no início do desenvolvimento embrionário permite que os ductos paramesonéfricos (müllerianos) se desenvolvam nas trompas de Falópio, útero, colo do útero e vagina proximal (Figura 8).42,44,48 As porções laterais desses ductos formam as trompas de Falópio. As porções mediais dos ductos paramesonéfricos (müllerianos) fundem-se na linha média para formar o útero e a extremidade distal dos ductos combinados entra em contato com o seio urogenital para unir as porções proximal e distal da vagina (Figura 9).44,47,49 O mesênquima circundante dá origem ao endométrio e ao miométrio do útero.48 De forma homóloga ao fato de os ductos paramesonéfricos (müllerianos) degenerarem em apêndice testicular no sexo masculino, os ductos mesonéfricos degeneram no sexo feminino para formar o epoóforo, o paroóforo e o ducto de Gartner adjacente à vagina.44
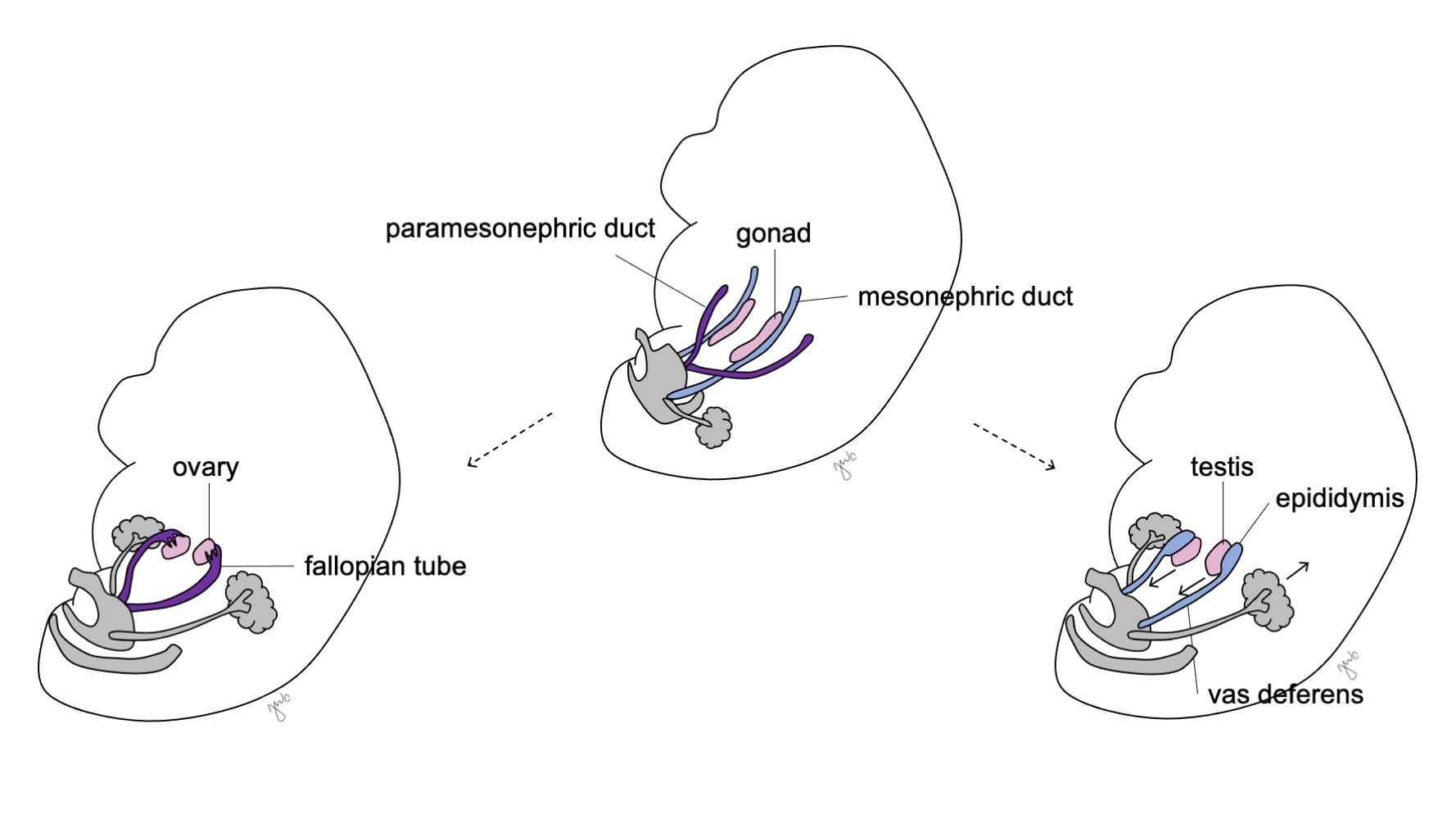
Figura 8 Diferenciação dos ductos mesonéfricos e paramesonéfricos. Nos homens, o ducto mesonéfrico (azul) diferencia-se em epidídimo, ducto deferente, ducto ejaculatório e vesícula seminal. Nas mulheres, o ducto paramesonéfrico (roxo) diferencia-se em trompa de Falópio, útero, colo do útero e vagina proximal.
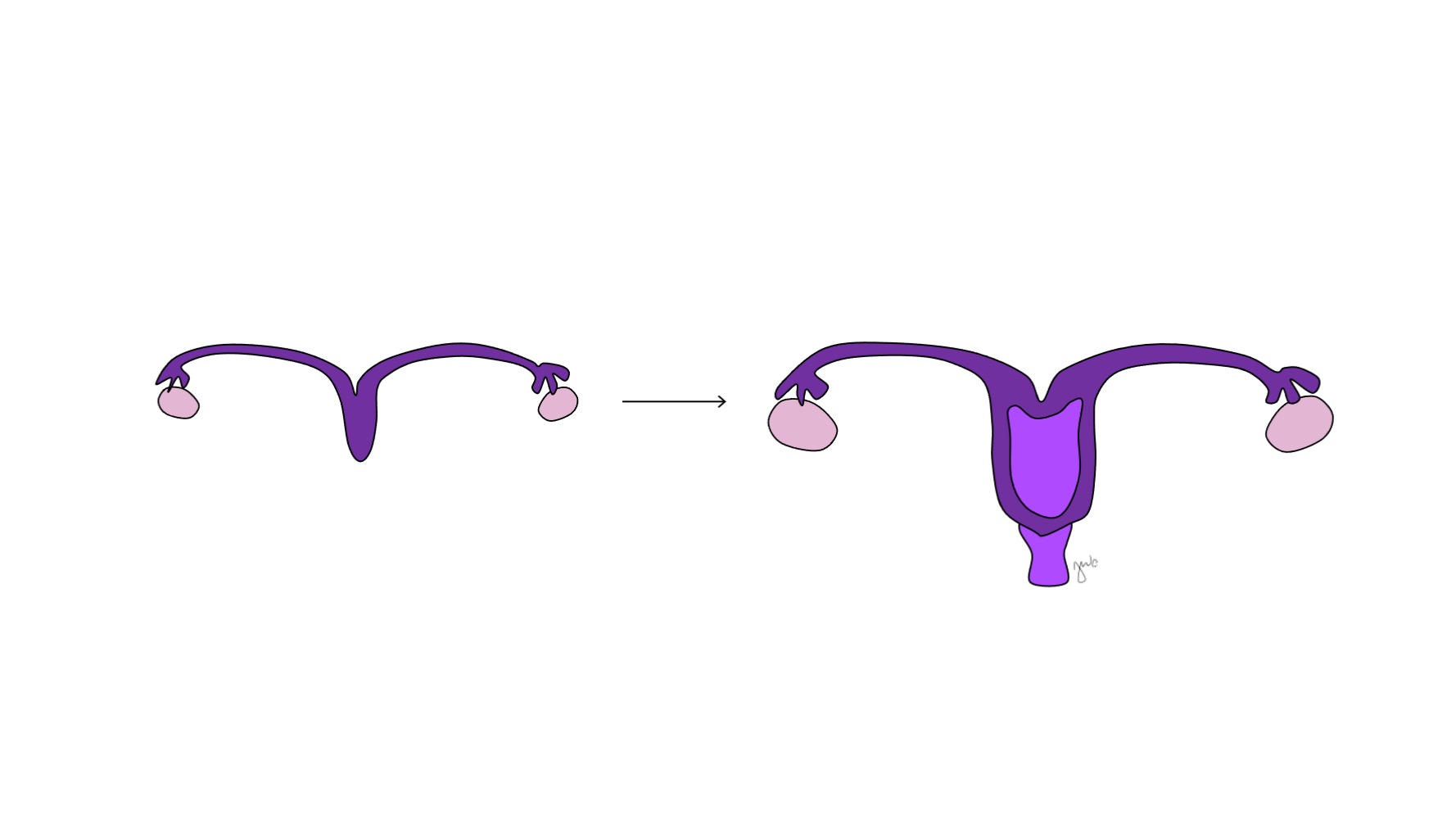
Figura 9 Fusão dos ductos paramesonéfricos. As porções mediais dos ductos paramesonéfricos fundem-se na linha média para formar o útero. A extremidade distal dessa união forma o colo do útero e a vagina proximal, que então se conecta caudalmente com o seio urogenital.
Semelhante ao desenvolvimento gonadal, o desenvolvimento do trato reprodutivo feminino também não é um mecanismo passivo “padrão”, pois a sinalização WNT4 é essencial para o desenvolvimento e a diferenciação do ducto mülleriano, bem como para suprimir a diferenciação masculina.42,48 Os genes Homeobox contribuem para o alinhamento ântero-posterior das estruturas paramesonéfricas (müllerianas).48 Semelhante às células de Sertoli do testículo, as células da granulosa ovariana por fim secretam AMH, mas o fazem mais tardiamente no desenvolvimento fetal, após as estruturas paramesonéfricas (müllerianas) terem se desenvolvido.43
Pontos-chave
A diferenciação gonadal e ductal é descrita na Tabela 1. A gônada indiferenciada e as células germinativas primordiais podem desenvolver-se em testículo, com espermatogônias, ou em ovário, com oogônias. A subsequente secreção hormonal dessas gônadas determina a diferenciação do ducto mesonéfrico (de Wolff) em epidídimo, apêndice do epidídimo, ducto deferente, ducto ejaculatório e vesícula seminal, ou do ducto paramesonéfrico (de Müller) em tuba uterina, útero, colo do útero e vagina proximal.
Genitália Externa
A genitália externa é inicialmente bipotencial para ambos os sexos até a sétima semana de gestação. À medida que a cloaca sofre separação em seio urogenital e canal anorretal (discutido anteriormente na seção trato urinário inferior), desenvolvem-se pregas em ambos os lados da cloaca. Após o septo uroretal completar a divisão cloacal, as pregas laterais tornam-se as pregas urogenitais e as porções anteriores das pregas fundem-se para formar o tubérculo genital. Tumefações laterais ao tubérculo genital constituem as tumefações lábio-escrotais. O tubérculo genital, as pregas urogenitais e as tumefações lábio-escrotais (Figura 10) diferenciam-se sob a influência hormonal das gônadas que se desenvolvem concomitantemente.
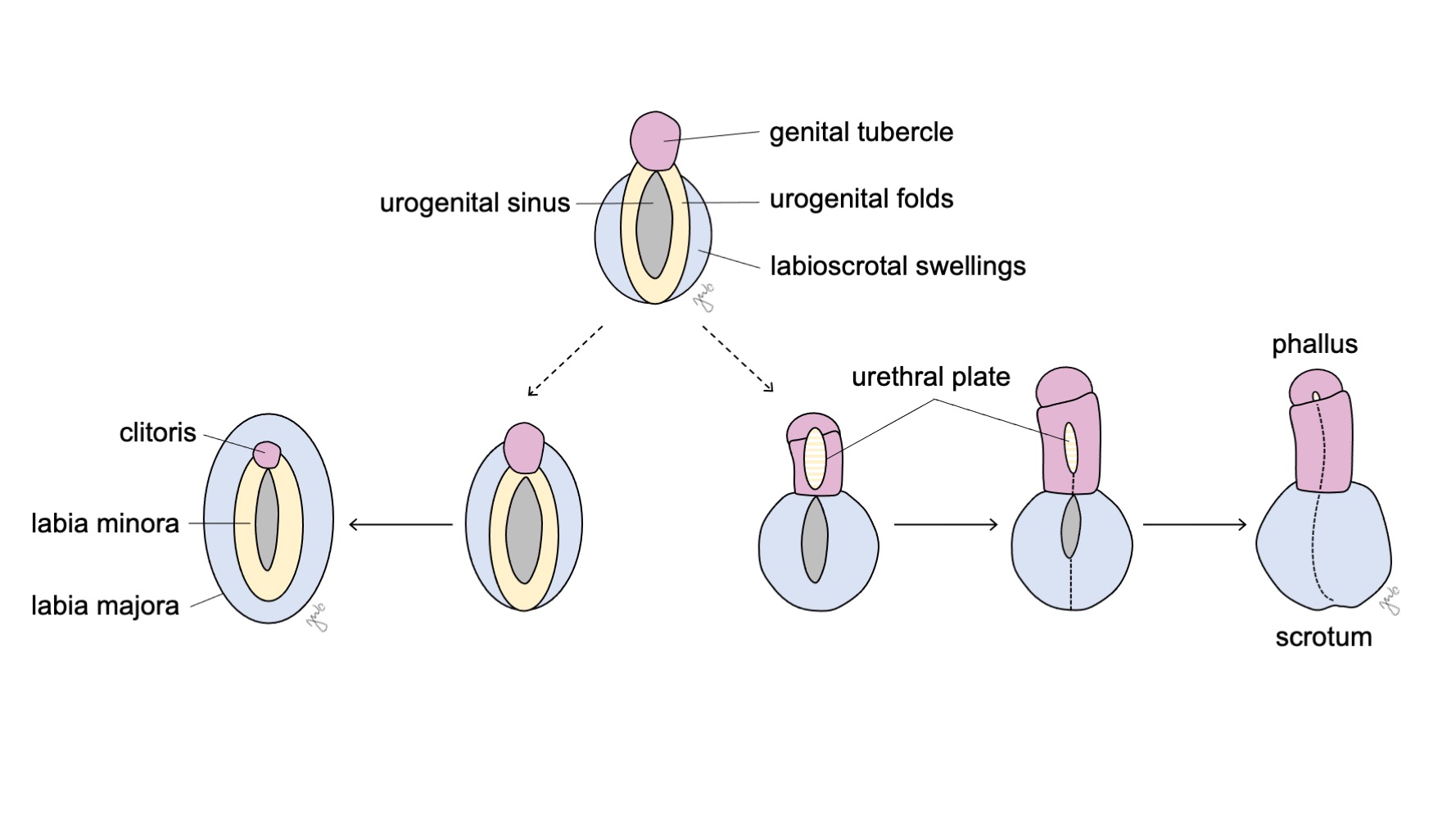
Figura 10 Diferenciação da genitália externa. O tubérculo genital (rosa), as pregas urogenitais (amarelo) e as tumefações lábio-escrotais (azul) diferenciam-se, respectivamente, em clitóris, lábios menores e lábios maiores no sexo feminino, ou em falo, placa uretral e escroto no sexo masculino.
Genitália Externa Masculina
A influência androgênica da testosterona e da dihidrotestosterona (DHT) causa a masculinização do seio urogenital e da genitália externa em pênis e escroto (Figura 10).34,44
A exposição a andrógenos faz com que o tubérculo genital se alongue entre 8-12 semanas, com crescimento linear subsequente iniciando-se na 14ª semana de gestação e detecção ultrassonográfica da estrutura fálica a partir de 18 semanas.34,50,51 SHH é expresso no tubérculo genital e no epitélio da placa uretral e pode facilitar a influência dos andrógenos na formação peniana e em outras formas de masculinização genital.34,52 As condensações mesenquimais penianas formam os corpos cavernosos e o corpo esponjoso.53 A curvatura ventral do pênis tem sido identificada em fetos até a 20ª semana de gestação, com resolução gradual ao longo do restante da gestação.54
As dobras urogenitais fundem-se na linha média para formar a placa uretral como parte do desenvolvimento da uretra peniana. Um sulco na linha média da placa uretral aprofunda-se e as bordas epiteliais da placa fundem-se para formar um tubo.33,55 A linha epitelial formada por essa fusão é então remodelada e substituída por células mesenquimais.55 Enquanto a uretra peniana proximal se funde caudalmente com a uretra prostática proveniente do seio urogenital, a tubularização progride distalmente e ventralmente. Como discutido anteriormente, o desenvolvimento da uretra da glande é objeto de debate. Embora esse aspecto da uretra tenha sido anteriormente atribuído à invaginação ectodérmica a partir da ponta da glande peniana, estudos mais recentes propuseram que a uretra da glande se forma por meio de tubularização com subsequente diferenciação endodérmica em epitélio escamoso.18,32,33 À medida que o falo se alonga e a placa uretral se tubulariza, as intumescências lábio-escrotais fundem-se na linha média na rafe mediana para formar o escroto.56
Genitália Feminina Externa
Embora a ausência de andrógenos evite a masculinização, o desenvolvimento da genitália externa feminina não é o processo “padrão”, pois dois cromossomos X, o desenvolvimento ovariano e o estrogênio contribuem para o processo. A importância das influências genéticas, gonadais e hormonais sobre o desenvolvimento pode ser demonstrada pela genitália externa hipoplásica em pacientes com síndrome de Turner que apresentam ausência de um cromossomo X ou em relatos de translocação do cromossomo X.57,58
O seio urogenital e a genitália externa desenvolvem-se em clitóris, grandes lábios e pequenos lábios, e porção inferior da vagina sob a influência de estrogênios e na ausência de andrógenos (Figura 10) O tubérculo genital regride na ausência de andrógenos e forma o clitóris. O seio urogenital (formado inicialmente após a divisão cloacal) dá origem a toda a uretra feminina e à vagina distal. A vagina distal funde-se cranialmente com os ductos paramesonéfricos. As células centrais degeneram-se para formar o lúmen vaginal e a parede posterior invagina-se para formar o hímen. As pregas urogenitais tornam-se os pequenos lábios, com fusão posterior mínima para formar a comissura posterior. As saliências lábio-escrotais permanecem não fundidas na fêmea, tornando-se os grandes lábios.
Tabela 1 Diferenciação e desenvolvimento sexuais.
| Masculino | Feminino | |
|---|---|---|
| Gônadas | ||
| Células germinativas primordiais | Espermatogônias | Oogônias |
| Cordões sexuais | Cordões seminíferos | Folículos primordiais |
| Ductos mesonéfricos (de Wolff) | Epidídimo, apêndice do epidídimo, ducto deferente, vesícula seminal, ducto ejaculatório | Ducto de Gartner, epoóforo, paraóforo |
| Ductos paramesonéfricos (de Müller) | Apêndice do testículo, utrículo prostático | Trompa de Falópio, útero, colo do útero, vagina proximal |
| Seio urogenital | Bexiga, uretra proximal, possivelmente a uretra distal da glande | Bexiga, uretra, vagina distal |
| Genitália externa | ||
| Tubérculo genital | Pênis | Clitóris |
| Pregas urogenitais | Placa uretral | Lábios menores |
| Saliências lábio-escrotais | Escroto | Lábios maiores |
Pontos-chave
A diferenciação da genitália externa também é descrita na Tabela 1. O tubérculo genital torna-se o falo no sexo masculino e o clitóris no sexo feminino. As pregas urogenitais tornam-se a placa uretral no sexo masculino e os lábios menores no sexo feminino. As tumefações lábio-escrotais originam o escroto no sexo masculino e os lábios maiores no sexo feminino. Como parte do desenvolvimento do trato urinário inferior, o seio urogenital forma a uretra proximal e suas pregas urogenitais formam a placa uretral para a uretra distal no sexo masculino. Em contraste, o seio urogenital forma toda a uretra no sexo feminino, assim como a porção distal da vagina.
Conclusão
O desenvolvimento dos tratos urinário e reprodutor é integrado por meio de suas origens e interações embriológicas. O rim em desenvolvimento progride pelos estágios de pronefro, mesonefro e metanefro. A interação entre o mesonefro e a cloaca dá origem ao broto ureteral e ao blastema metanéfrico que, em última análise, se desenvolvem no rim e no trato urinário superior. A cloaca divide-se concomitantemente, e o seio urogenital anterior desenvolve-se na bexiga e contribui para a uretra masculina e feminina. As gônadas, os ductos mesonéfricos (de Wolff) e paramesonéfricos (de Müller) e a genitália externa têm o potencial de se desenvolver ao longo do espectro da diferenciação sexual masculina e feminina: influências genéticas e hormonais influenciam, respectivamente, a função gonadal e a aparência fenotípica do embrião em desenvolvimento. Várias alterações nos genes, nas interações moleculares ou nos tecidos em desenvolvimento envolvidos nesses processos podem afetar a anatomia e a função a longo prazo de suas respectivas estruturas.
Referências
- Bertram JF, Douglas-Denton RN, Diouf B, Hughson MD, Hoy WE. Human nephron number: implications for health and disease. Pediatr Nephrol 2011; 26 (9): 1529–1533. DOI: 10.1007/s00467-011-1843-8.
- Tryggvason K, Kouvalainen K. Number of Nephrons in Normal Human Kidneys and Kidneys of Patients with the Congenital Nephrotic Syndrome. Nephron 1975; 15 (1): 62–68. DOI: 10.1159/000180493.
- Bakker BS de, Hoff MJB van den, Vize PD, Oostra RJ. The Pronephros; a Fresh Perspective. Integr Comp Biol 2019; 59 (1): 29–47. DOI: 10.1093/icb/icz001.
- Ludwig KS, Landmann L. Early development of the human mesonephros. Anat Embryol (Berl) 2005; 209 (6): 439–447. DOI: 10.1007/s00429-005-0460-3.
- Nagata M. Glomerulogenesis and the role of endothelium. Curr Opin Nephrol Hypertens 2018; 27 (3): 159–164. DOI: 10.1097/mnh.0000000000000402.
- Nishinakamura R, Sakaguchi M. BMP signaling and its modifiers in kidney development. Pediatr Nephrol 2014; 29 (4): 681–686. DOI: 10.1007/s00467-013-2671-9.
- Michos O, Panman L, Vintersten K, Beier K, Zeller R, Zuniga A. Gremlin-mediated BMP antagonism induces the epithelial-mesenchymal feedback signaling controlling metanephric kidney and limb organogenesis. Development 2004; 131 (14): 3401–3410. DOI: 10.1242/dev.01251.
- Wang GJ, Brenner-Anantharam A, Vaughan ED, Herzlinger D. Antagonism of BMP4 Signaling Disrupts Smooth Muscle Investment of the Ureter and Ureteropelvic Junction. J Urol 2009; 181 (1): 401–407. DOI: 10.1016/j.juro.2008.08.117.
- Sajithlal G, Zou D, Silvius D, Xu P-X. Eya1 acts as a critical regulator for specifying the metanephric mesenchyme. Dev Biol 2005; 284 (2): 323–336. DOI: 10.1016/j.ydbio.2005.05.029.
- Yu J, McMahon AP, Valerius MT. Recent genetic studies of mouse kidney development. Curr Opin Genet Dev 2004; 14 (5): 550–557. DOI: 10.1016/j.gde.2004.07.009.
- Majumdar A, Vainio S, Kispert A, McMahon J, McMahon AP. Wnt11andRet/Gdnfpathways cooperate in regulating ureteric branching during metanephric kidney development. Development 2003; 130 (14): 3175–3185. DOI: 10.1242/dev.00520.
- Walker KA, Sims-Lucas S, Bates CM. Fibroblast growth factor receptor signaling in kidney and lower urinary tract development. Pediatr Nephrol 2016; 31 (6): 885–895. DOI: 10.1007/s00467-015-3151-1.
- Qiao J, Sakurai H, Nigam SK. Branching morphogenesis independent of mesenchymal–epithelial contact in the developing kidney. Proc Natl Acad Sci U S A 1999; 96 (13): 7330–7335. DOI: 10.1073/pnas.96.13.7330.
- Underwood MA, Gilbert WM, Sherman MP. Amniotic Fluid: Not Just Fetal Urine Anymore. J Perinatol 2005; 25 (5): 341–348. DOI: 10.1038/sj.jp.7211290.
- Taghavi K, Kirkpatrick J, Mirjalili SA. The horseshoe kidney: Surgical anatomy and embryology. J Pediatr Urol 2016; 12 (5): 275–280. DOI: 10.1016/j.jpurol.2016.04.033.
- Friedland GW, De Vries P. Renal ectopia and fusion. Urology 1975; 5 (5): 698–706. DOI: 10.1016/0090-4295(75)90137-5.
- Kruepunga N, Hikspoors JP, Mekonen HK, Mommen GM, Meemon K, Weerachatyanukul W, et al.. Faculty Opinions recommendation of The development of the cloaca in the human embryo. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2018; 33 (6): 24–39. DOI: 10.3410/f.734193252.793568763.
- Seifert AW, Harfe BD, Cohn MJ. Cell lineage analysis demonstrates an endodermal origin of the distal urethra and perineum. Dev Biol 2008; 318 (1): 143–152. DOI: 10.1016/j.ydbio.2008.03.017.
- Baskin LS, Hayward SW, Young P, Cunha GR. Role of Mesenchymal-Epithelial Interactions in Normal Bladder Development. J Urol 1996; 56 (5): 1820–1827. DOI: 10.1097/00005392-199611000-00101.
- Batourina E, Tsai S, Lambert S, Sprenkle P, Viana R, Dutta S, et al.. Faculty Opinions recommendation of Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2005; 7 (10): 082–089. DOI: 10.3410/f.1029077.343528.
- Viana R, Batourina E, Huang H, Dressler GR, Kobayashi A, Behringer RR, et al.. The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134 (20): 3763–3769. DOI: 10.1242/dev.011270.
- Tanaka ST, Ishii K, Demarco RT, Pope JC, Brock JW, Hayward SW. Endodermal Origin of Bladder Trigone Inferred From Mesenchymal-Epithelial Interaction. J Urol 2010; 183 (1): 386–391. DOI: 10.1016/j.juro.2009.08.107.
- Mackie GG, Stephens FD. Duplex Kidneys: A Correlation of Renal Dysplasia with Position of the Ureteral Orifice. J Urol 1975; 114 (2): 274–280. DOI: 10.1016/s0022-5347(17)67007-1.
- Wen JG, Frøkiaer J, Zhao JB, Ringgaard S, Jørgensen TM, Djurhuus JC. Severe partial ureteric obstruction in newborn rats can produce renal dysplasia. BJU Int 1981; 89 (7): 740–745. DOI: 10.1046/j.1464-410x.2002.02747.x.
- Parada Villavicencio C, Adam SZ, Nikolaidis P, Yaghmai V, Miller FH. Imaging of the Urachus: Anomalies, Complications, and Mimics. Radiographics 2016; 36 (7): 2049–2063. DOI: 10.1148/rg.2016160062.
- Krishnan A, Souza A de, Konijeti R, Baskin LS. The Anatomy and Embryology of Posterior Urethral Valves. J Urol 2006; 175 (4): 1214–1220. DOI: 10.1016/s0022-5347(05)00642-7.
- Cunha GR, Vezina CM, Isaacson D, Ricke WA, Timms BG, Cao M, et al.. A comparison of prostatic development in xenografts of human fetal prostate and human female fetal proximal urethra grown in dihydrotestosterone-treated hosts. Differentiation 2018; 115 (24-45): 37–52. DOI: 10.1016/j.diff.2020.06.001.
- Thomson AA. Role of androgens and fibroblast growth factors in prostatic development. Reproduction 2001; 21 (2): 187–195. DOI: 10.1530/rep.0.1210187.
- LASNITZKI ILSE, MIZUNO TAKEO. Prostatic Induction: Interaction Of Epithelium And Mesenchyme From Normal Wild-type Mice And Androgen-insensitive Mice With Testicular Feminization. J Endocrinol 1980; 85 (3): 423–np. DOI: 10.1677/joe.0.0850423.
- Meeks JJ, Schaeffer EM. Genetic Regulation of Prostate Development. J Androl 2011; 32 (3): 210–217. DOI: 10.2164/jandrol.110.011577.
- Marker PC, Donjacour AA, Dahiya R, Cunha GR. Hormonal, cellular, and molecular control of prostatic development. Dev Biol 2003; 253 (2): 165–174. DOI: 10.1016/s0012-1606(02)00031-3.
- Kurzrock EA, Baskin LS, Cunha GR. Ontogeny of the male urethra: Theory of endodermal differentiation. Differentiation 1999; 64 (2): 115–122. DOI: 10.1046/j.1432-0436.1999.6420115.x.
- Hadidi AT, Roessler J, Coerdt W. Development of the human male urethra: A histochemical study on human embryos. J Pediatr Surg 2014; 49 (7): 1146–1152. DOI: 10.1016/j.jpedsurg.2014.01.009.
- Blaschko SD, Cunha GR, Baskin LS. Molecular mechanisms of external genitalia development. Differentiation 2012; 84 (3): 261–268. DOI: 10.1016/j.diff.2012.06.003.
- Satoh M. Histogenesis and organogenesis of the gonads in human embryos. Med Electron Microsc 1991; 27 (3-4): 254–256. DOI: 10.1007/bf02349668.
- McKay DG, Hertig AT, Adams EC, Danziger S. Histochemical observations on the germ cells of human embryos. Anat Rec 1953; 117 (2): 201–219. DOI: 10.1002/ar.1091170206.
- Hanley NA, Hagan DM, Clement-Jones M, Ball SG, Strachan T, Salas-Cortés L, et al.. SRY, SOX9, and DAX1 expression patterns during human sex determination and gonadal development. Mech Dev 2000; 91 (1-2): 403–407. DOI: 10.1016/s0925-4773(99)00307-x.
- Yao HH-C. The pathway to femaleness: current knowledge on embryonic development of the ovary. Mol Cell Endocrinol 2005; 230 (1-2): 87–93. DOI: 10.1016/j.mce.2004.11.003.
- Berta P, Hawkins JB, Sinclair AH, Taylor A, Griffiths BL, Goodfellow PN, et al.. Genetic evidence equating SRY and the testis-determining factor. Nature 1990; 348 (6300): 448–450. DOI: 10.1038/348448a0.
- Rey RA, Grinspon RP. Normal male sexual differentiation and aetiology of disorders of sex development. Best Pract Res Clin Endocrinol Metab 2011; 25 (2): 221–238. DOI: 10.1016/j.beem.2010.08.013.
- McElreavey K, Barbaux S, Ion A, Fellous M. The genetic basis of murine and human sex determination: a review. Heredity (Edinb) 1995; 75 (6): 599–611. DOI: 10.1038/hdy.1995.179.
- Vilain E, McCabe ERB. Mammalian Sex Determination: From Gonads to Brain. Mol Genet Metab 1998; 65 (2): 74–84. DOI: 10.1006/mgme.1998.2749.
- Sinisi AA, Pasquali D, Notaro A, Bellastella A. Sexual Differentiation. Encyclopedic Dictionary of Genetics, Genomics and Proteomics 2003; 26 (3 Suppl): 473–494. DOI: 10.1002/0471684228.egp11478.
- Biason-Lauber A, Chaboissier M-C. Ovarian development and disease: The known and the unexpected. Semin Cell Dev Biol 2015; 45 (59-67): 59–67. DOI: 10.1016/j.semcdb.2015.10.021.
- Rey R, Lukas-Croisier C, Lasala C, Bedecarrás P. AMH/MIS: what we know already about the gene, the protein and its regulation. Mol Cell Endocrinol 2003; 211 (1-2): 21–31. DOI: 10.1016/j.mce.2003.09.007.
- Sajjad Y. Development of the genital ducts and external genitalia in the early human embryo. J Obstet Gynaecol Res 2010; 36 (5): 929–937. DOI: 10.1111/j.1447-0756.2010.01272.x.
- Barteczko KJ, Jacob MI, Jacob MI. Development, Shape and Fate of Gubernaculum Hunteri and Processus Vaginalis Peritonei - Own Phases of Testicular Descent. Adv Anat Embryol Cell Biol 2000; 156:iii-x: 17–72. DOI: 10.1007/978-3-642-58353-7_4.
- Hawkins JR, Taylor A, Berta P, Levilliers J, Auwera B Van der, Goodfellow PN. Mutational analysis of SRY: nonsense and missense mutations in XY sex reversal. Hum Genet 1992; 88 (4): 471–474. DOI: 10.1007/bf00215684.
- Spencer TE, Dunlap KA, Filant J. Comparative developmental biology of the uterus: Insights into mechanisms and developmental disruption. Mol Cell Endocrinol 2012; 354 (1-2): 34–53. DOI: 10.1016/j.mce.2011.09.035.
- Kobayashi A, Behringer RR. Developmental genetics of the female reproductive tract in mammals. Nat Rev Genet 2003; 4 (12): 969–980. DOI: 10.1038/nrg1225.
- Cunha GR. The dual origin of vaginal epithelium. Am J Anat 1975; 143 (3): 387–392. DOI: 10.1002/aja.1001430309.
- Feldman KW, Smith DW. Fetal phallic growth and penile standards for newborn male infants. J Pediatr 1975; 86 (3): 395–398. DOI: 10.1016/s0022-3476(75)80969-3.
- Zalel Y, Pinhas-Hamiel O, Lipitz S, Mashiach S, Achiron R. The development of the fetal penis-anin uterosonographic evaluation. Ultrasound Obstet Gynecol 2001; 17 (2): 129–131. DOI: 10.1046/j.1469-0705.2001.00216.x.
- Miyagawa S, Matsumaru D, Murashima A, Omori A, Satoh Y, Haraguchi R, et al.. The Role of Sonic Hedgehog-Gli2 Pathway in the Masculinization of External Genitalia. Endocrinology 2011; 152 (7): 2894–2903. DOI: 10.1210/en.2011-0263.
- BASKIN LS, LEE YT, CUNHA GR. Neuroanatomical ontogeny of the human fetal penis. BJU Int 1997; 79 (4): 628–640. DOI: 10.1046/j.1464-410x.1997.00119.x.
- Kaplan GW, Lamm DL. Embryogenesis of Chordee. J Urol 1975; 114 (5): 769–772. DOI: 10.1016/s0022-5347(17)67140-4.
- Baskin L, Erol A, Jegatheesan P, Li Y, Liu W, Cunha G. Urethral seam formation and hypospadias. Cell Tissue Res 2001; 305 (3): 379–387. DOI: 10.1007/s004410000345.
- Kluth D, Fiegel HC, Geyer C, Metzger R. Embryology of the distal urethra and external genitals. Semin Pediatr Surg 2011; 20 (3): 176–187. DOI: 10.1053/j.sempedsurg.2011.03.003.
- Omar HA, Hummel M, Jones EA, Perkins KC. Hypoplastic external genitalia in association with X;autosome chromosome translocation. J Pediatr Adolesc Gynecol 1999; 12 (3): 161–164. DOI: 10.1016/s1038-3188(99)00011-x.
- Ferguson-Smith MA. Karyotype-phenotype Correlations in Gonadal Dysgenesis and Their Bearing on the Pathogenesis of Malformations. J Med Genet 1965; 2 (2): 142–155. DOI: 10.1136/jmg.2.2.142.
Ultima atualização: 2025-09-21 13:35