51: Développements futurs dans la prise en charge des calculs urinaires
Ce chapitre prendra environ 20 minutes de lecture.
Introduction
Au cours des deux dernières décennies, on a observé une hausse spectaculaire de l’incidence des calculs rénaux pédiatriques, les adolescents représentant la tranche d’âge à la croissance la plus rapide parmi toutes celles touchées par cette maladie.1 Étant donné que les enfants et les jeunes adultes sont confrontés à des défis spécifiques en matière de prestation des soins, de risques liés aux traitements et de processus pathologiques sous-jacents, les progrès dans le domaine de la lithiase rénale, notamment la miniaturisation des équipements, la réduction de l’exposition aux rayonnements ionisants et l’amélioration de la prise en charge des patients présentant une prédisposition génétique à la lithiase urinaire, pourraient bénéficier de façon préférentielle aux patients pédiatriques. Ce chapitre passera en revue les avancées non seulement en matière d’équipements chirurgicaux, mais aussi de diagnostic, de thérapeutique et de prestation des soins.
Diagnostic et évaluation initiale
Bien que l’échographie (US) demeure la stratégie d’imagerie de première intention privilégiée pour la plupart des enfants chez lesquels on suspecte une néphrolithiase, cette modalité d’imagerie présente des limites en termes de dépendance à l’opérateur, de disponibilité et de précision diagnostique.2,3 Parallèlement, la tomodensitométrie (CT) est la modalité d’imagerie de référence en matière de précision diagnostique, mais elle entraîne des risques élevés d’exposition aux rayonnements ionisants, risques encore accrus dans la population pédiatrique.4 Les innovations dans le domaine de l’imagerie diagnostique incluent l’amélioration de la précision de l’US, la réduction de l’exposition aux rayonnements liée au CT, et l’ajout de fonctionnalités supplémentaires telles que la propulsion des calculs.
Précision de l’US
L’US s’appuie sur les propriétés échographiques à l’interface calcul-urine pour produire l’image classique d’un foyer échogène en US en mode B. De plus, la déflexion des ondes acoustiques au niveau des foyers échogènes peut produire une ombre acoustique postérieure, tandis que l’application de réglages Doppler peut créer un artéfact de scintillement au-dessus du calcul.5 Ces deux techniques peuvent améliorer la précision de l’imagerie US.6 En outre, l’ombre acoustique postérieure pourrait fournir une estimation de taille plus précise du calcul urinaire.7 Cependant, à l’heure actuelle, ni les modalités d’imagerie visant à capter et à renforcer ces observations, ni l’identification et le compte rendu de ces mesures ne sont bien standardisés, et des évaluations supplémentaires sont nécessaires pour optimiser les technologies actuelles et la compréhension des constatations en US. Au-delà de l’optimisation des technologies d’imagerie actuelles, des modifications des propriétés acoustiques de l’équipement ultrasonore peuvent produire des caractéristiques d’imagerie plus distinctes des calculs urinaires. Un exemple, actuellement utilisé sur une plateforme de recherche, est l’imagerie ultrasonore Stone-Mode (c.-à-d., “S-mode™”). L’imagerie S-mode™ repose sur une sonde haute fréquence pour optimiser l’interface visuelle entre le calcul et les tissus environnants et accentuer l’apparence de l’ombre acoustique. L’utilisation d’algorithmes de post-traitement qui ont tendance à estomper l’image entre le calcul dense et l’ombre postérieure est minimisée, ce qui se traduit par une image plus nette du calcul au prix d’une imagerie des tissus mous diminuée.8
Scanners à faible dose
Bien que l’amélioration de l’imagerie échographique soit attrayante pour minimiser l’exposition aux rayonnements ionisants chez les enfants atteints de néphrolithiase, la TDM restera vraisemblablement une modalité d’imagerie clé dans le diagnostic de la néphrolithiase pour les années à venir. Plusieurs composantes des protocoles de TDM dédiés aux calculs, telles que le courant du tube, la tension du tube et le temps de rotation de la gantry, peuvent être réduites afin de diminuer la dose de rayonnement ionisant au cours de ces examens.9 Bien que la TDM à faible dose puisse difficilement être classée comme une “future technology”, compte tenu de l’abondante littérature soutenant actuellement son utilisation, il est clair que l’avenir de la prise en charge des calculs pourrait être amélioré en renforçant l’adoption de cette technologie.10 Dans ce sens, l’accent pour la TDM à faible dose devrait porter sur des stratégies visant à améliorer la formation des prescripteurs et les outils d’aide à la décision intégrés au dossier médical électronique. Des stratégies similaires ont été utilisées pour instaurer des pratiques durables de gestion responsable de l’irradiation au sein des services d’urgences pédiatriques.11
Propulsion de l’imagerie
L’utilisation de la propulsion par ultrasons dans la lithiase rénale a été rapportée pour la première fois dans des essais chez l’homme en 2016.12,13 Cette technologie, qui exploite une énergie acoustique focalisée au moyen d’une sonde transcutanée, est capable de propulser des calculs rénaux au sein du système collecteur rénal (Figure 1). Les applications de cette technologie comprennent le repositionnement de calculs rénaux obstructifs à distance de la jonction pyélo-urétérale, le repositionnement des calculs vers un site de traitement plus favorable (c.-à-d., du pôle inférieur vers le pôle supérieur), la distinction entre un petit amas de calculs et un calcul volumineux dominant, et favoriser le passage de petits fragments après le traitement. Des essais de faisabilité chez l’homme ont noté un déplacement de calculs chez 14 des 15 participants, dont un a rapporté un soulagement immédiat après le repositionnement d’un calcul partiellement obstructif.12 L’utilisation peropératoire de cette technologie a confirmé visuellement, lors de l’urétéroscopie, le déplacement des calculs, confirmant une preuve de principe pour le repositionnement des calculs en vue de faciliter le traitement endoscopique.14 Bien que cette technologie n’ait pas, au moment de la rédaction, été appliquée chez des patients pédiatriques, l’absence de rayonnements ionisants et les possibilités d’améliorer les approches diagnostiques et thérapeutiques en font une technologie d’avenir attrayante dans le domaine de la néphrolithiase pédiatrique.
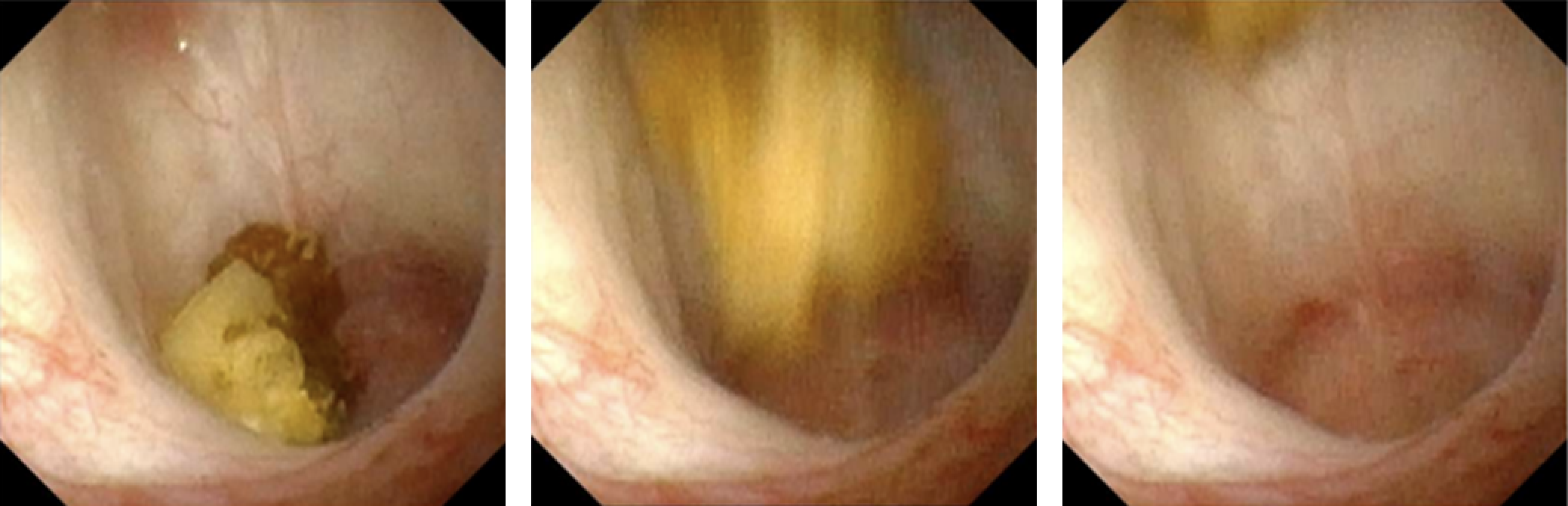
Figure 1 Image urétéroscopique en temps réel de la propulsion in vivo d’un calcul caliciel de 7 mm au moyen d’une propulsion extracorporelle. Figure reproduite avec l’aimable autorisation de Michael Bailey et Barbrina Dunmire de l’Université de Washington.
Évaluation métabolique et génétique
Bien qu’il y ait eu peu de progrès dans les évaluations traditionnelles du risque de calculs rénaux et de la pathologie sous-jacente (c.-à-d., bilans sanguins ou urinaires), les avancées du séquençage génétique ont élargi les possibilités de tests génétiques dans le domaine des lithiases rénales d’apparition précoce. Les tests génétiques ne sont pas requis pour le diagnostic de certaines maladies monogéniques responsables de calculs rénaux avec des calculs pathognomoniques (c.-à-d., la cystinurie ou l’adénine phosphoribosyltransférase).15 Cependant, il a été montré que les tests génétiques détectent des causes monogéniques potentielles de lithiase rénale chez jusqu’à 20 % des enfants adressés dans un centre tertiaire spécialisé dans les calculs rénaux.16 Les questions pratiques entourant la stratégie diagnostique des tests génétiques incluent les informations exploitables à utiliser en fonction des résultats des tests et l’interprétation des variantes de signification incertaine. Concernant ce premier point, de nombreux gènes présents sur les panels multigéniques les plus couramment référencés (souvent > 30) se manifestent de manière multisystémique, de sorte que le diagnostic peut être suspecté, voire connu, avant les tests génétiques. En outre, dans la majorité de ces maladies monogéniques responsables de calculs rénaux, il n’existe pas de traitement ciblé et la prise en charge est surtout guidée par le contexte clinique. Néanmoins, des affections à dépistage précoce telles que l’hyperoxalurie primitive peuvent justifier un test dans des situations où l’indice de suspicion est élevé, comme chez les patients plus jeunes ou ceux ayant de forts antécédents familiaux de néphrolithiase.17 À noter, environ un tiers des mutations rapportées sont inédites, ce qui soulève à la fois des questions sur les implications pathologiques de ces variantes de signification incertaine ainsi que la possibilité d’élargir davantage les connaissances sur les lithiases rénales d’origine génétique. Dans de tels cas, des analyses de bioinformatique, y compris des modélisations logicielles visant à prédire la structure protéique et la pathogénicité potentielle, peuvent éclairer l’interprétation de résultats incertains.18 En résumé, les évaluations génétiques peuvent être utiles, en particulier lors de la recherche de sources potentiellement traitables de lithiases monogéniques dans des populations à haut risque, et la collaboration avec des généticiens peut s’avérer inestimable lors de la gestion des variantes de signification incertaine ou pour le conseil génétique.
Prévention
Technologies de rappel
Indépendamment des nouveaux développements thérapeutiques pour la prévention secondaire des calculs rénaux, les mesures diététiques et d’apport hydrique demeurent les pierres angulaires des stratégies préventives.19 Cependant, cliniciens et patients reconnaissent les difficultés de respect de ces recommandations, en particulier des volumes élevés d’hydratation quotidienne. Plusieurs technologies nouvelles, telles que des bouteilles d’eau “intelligentes” capables d’envoyer aux familles des alertes électroniques en temps opportun, ont été proposées comme outils pour améliorer les apports hydriques. Fait notable, seuls 20 % des adolescents équipés de cette technologie n’ont malgré tout atteint leurs objectifs d’apport hydrique que pendant la majeure partie d’une période d’étude d’une semaine.20 D’autres auteurs ont testé des applications pour smartphone et/ou des dispositifs portables afin d’améliorer les apports hydriques, avec des résultats mitigés.21,22 Une piste prometteuse pour renforcer les technologies de rappel est le recours à l’accompagnement comportemental, actuellement exploré dans l’essai Prevention of Urinary Stones with Hydration (PUSH). Au moment de la rédaction, l’essai PUSH avait finalisé l’inclusion des participants, mais les résultats étaient en attente.23 À noter qu’il existe un bras adolescent dans l’étude, offrant une opportunité d’explorer spécifiquement l’expérience pédiatrique. Bien que la véritable valeur et l’impact des technologies de rappel pour améliorer l’observance de la prévention secondaire des calculs rénaux demeurent incertains, il convient de considérer que l’utilisation de ces technologies pourrait encore évoluer en termes de format ou d’interface, tandis que les changements générationnels dans l’adoption des technologies pourraient encore élargir les possibilités de tirer parti de telles innovations.
Prévention médicale
Les avancées les plus prometteuses en matière de prévention médicale de la lithiase rénale comprennent de nouvelles thérapeutiques sous forme de traitements ciblés ainsi que des voies innovantes d’intervention pharmaceutique. L’approbation récente par la Food and Drug Association du lumasiran pour l’hyperoxalurie primitive de type 1 constitue une avancée majeure, à la fois comme premier traitement ciblé pour cette maladie et comme premier médicament d’ARNi approuvé pour une utilisation dans une maladie néphro-urologique.24 Le médicament cible l’ARN messager codant pour l’oxydase du glycolate, inhibant ainsi la conversion du glycolate en oxalate. Il est administré par voie sous-cutanée tous les 1–3 mois et a été approuvé pour l’ensemble de la population pédiatrique, avec une posologie fondée sur le poids indiquée pour les enfants plus jeunes, les patients pesant moins de 10 kilogrammes recevant des injections mensuelles après une phase de charge et ceux pesant plus de 10 kilogrammes recevant des injections tous les trois mois. Les effets indésirables fréquents comprennent des réactions au site d’injection (20%) et des douleurs abdominales (15%), bien que peu de participants aux essais aient interrompu leur participation en raison des effets indésirables.
Prise en charge chirurgicale
Parmi la multitude d’avancées récentes dans la prise en charge chirurgicale de la maladie lithiasique urologique, plusieurs sont particulièrement pertinentes pour les patients pédiatriques. Des dimensions corporelles plus réduites, y compris celles de l’uretère lui-même, et une sensibilité accrue à l’exposition aux rayonnements ne sont que quelques-unes des particularités de la lithiase pédiatrique qui diffèrent de la prise en charge chez l’adulte. Les nouvelles technologies laser visent à diminuer la rétropulsion des calculs et à augmenter la vitesse d’ablation, ce qui pourrait se traduire par des temps opératoires plus courts lors de l’urétéroscopie pédiatrique (URS). L’instrumentation miniaturisée pour la néphrolithotomie percutanée (PCNL) peut se traduire par une morbidité et des saignements moindres chez les patients pédiatriques. En outre, la lithotripsie par ondes en salves est une nouvelle technologie qui permet de traiter la lithiase en consultation, épargnant aux enfants une anesthésie et une convalescence plus difficile.
Avancées dans la technologie laser
Plusieurs avancées récentes ont été réalisées dans la technologie des lasers, y compris des optimisations du pilier de la lithotritie au laser, le système holmium:YAG, ainsi qu’un nouveau laser à fibre de thulium (TFL) montrant des résultats préliminaires prometteurs. Les avancées plus récentes de la technologie des lasers à holmium réduisent le déplacement des calculs ciblés lors de la fragmentation laser et permettent de délivrer davantage d’énergie, tandis que le TFL offre des bénéfices similaires et, en outre, pourrait permettre l’utilisation de fibres laser plus fines.
Modifications de l’Holmium:YAG
Le système holmium:YAG est l’étalon-or pour la lithotripsie laser depuis son introduction, en raison de sa facilité d’utilisation et de son profil de sécurité favorable.25 Les modifications plus récentes de cette technologie, Moses et les modes à longue impulsion, modifient cette approche à impulsion unique et de durée fixe. Les modes à longue impulsion délivrent la même quantité d’énergie sur une durée plus longue, généralement comprise entre 500–1000 µs, réduisant la rétropulsion au prix d’une diminution du transfert d’énergie.26,27,28,29 L’effet Moses décrit un phénomène physique qui se produit lorsqu’un laser à holmium est déclenché dans un milieu liquide (Figure 2). Cette énergie émise est fortement absorbée par l’eau, entraînant la formation d’un tunnel de vapeur. Dans une impulsion unique standard d’un laser à holmium, ce transfert d’énergie n’atteint pas l’interface du calcul. La technologie Moses permet de délivrer l’énergie en deux impulsions ; la première délivre une petite quantité d’énergie, provoquant la formation d’un canal de vapeur, tandis que la seconde délivre la majeure partie de l’énergie qui peut désormais circuler à travers le canal de vapeur formé jusqu’au calcul cible.26 Il a été démontré que la technologie Moses réduit le temps opératoire en contexte clinique grâce à une diminution de la rétropulsion et à une efficacité accrue de fragmentation des calculs.30,31
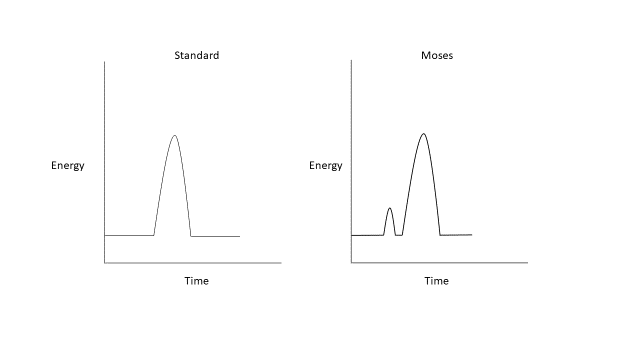
Figure 2 Formes d’onde du laser holmium:YAG standard et Moses.
Fibre au thulium
Le TFL génère un faisceau laser plus efficacement que l’holmium:YAG, s’appuyant sur un laser à diode qui émet une lumière au sein du pic d’absorption des ions de thulium, excitant ainsi les ions de thulium dans une fine fibre de silice avec une perte d’énergie minimale sous forme de chaleur, ce qui permet des gammes de fréquences plus élevées et des plages d’énergie d’impulsion plus larges.25,32 Des exemples de paramètres utilisés pour la fragmentation d’un calcul rénal, ainsi que le générateur TFL, sont visibles dans la Figure 3. Des fibres laser de plus petit diamètre, aussi fines que 150 µm et 50 µm en développement in vitro, permettent d’améliorer le débit d’irrigation et offrent la possibilité de miniaturiser davantage les urétéroscopes.33 Le TFL émet une lumière à une longueur d’onde de 1940 nm, encore plus proche du pic d’absorption de l’eau à 1910 nm que la lumière émise par les lasers à holmium:YAG. Cela se traduit par un profil de sécurité favorable, la profondeur de pénétration étant réduite.34

Figure 3 Exemples de réglages du TFL, utilisés pour le traitement d’un calcul rénal (exemple présenté ici lors d’une lithotripsie chez l’adulte).
De multiples études in vitro suggèrent que le TFL peut produire des vitesses d’ablation plus rapides et potentiellement une meilleure élimination des calculs que le système à holmium:YAG.35,36 Cependant, un débat persiste quant au caractère cliniquement significatif de ces différences. Jaeger et al ont comparé le TFL à l’holmium:YAG lors d’URS chez 125 patients pédiatriques, dont 32 ont été traités par TFL. Les patients traités par TFL étaient moins susceptibles de présenter un fragment lithiasique résiduel, sans différence significative de la durée opératoire ou du taux de complications, mais avec un temps de lasérisation plus long dans le groupe TFL.37 Une méta-analyse d’études cliniques chez l’adulte incluant près de 1 700 patients a montré plusieurs avantages du TFL par rapport à l’holmium:YAG, notamment des durées opératoires plus courtes, des temps d’utilisation du laser plus courts, une rétropulsion réduite et une meilleure élimination des calculs. Aucune différence n’a été observée concernant l’efficacité d’ablation, l’énergie totale utilisée ou la durée d’hospitalisation.38
Du fait que l’énergie émise est très proche du pic d’absorption de l’eau et de la possibilité de fonctionner à des réglages de puissance et de fréquence plus élevés, la chaleur et les lésions thermiques constituent une préoccupation plus importante avec le TFL qu’avec un laser à holmium. En outre, des modèles simulés ont montré que les patients plus jeunes, ayant des reins plus petits, pourraient être plus susceptibles de lésions thermiques pendant l’urétéroscopie pour calculs rénaux. Toutefois, ces effets peuvent être atténués par l’utilisation d’une gaine d’accès et d’une irrigation continue sous pression39
Miniaturisation de la PCNL
L’expérience initiale de la PCNL chez les patients pédiatriques a été compliquée par des taux d’hémorragie plus élevés et une plus grande proportion de patients nécessitant des transfusions sanguines après leurs interventions, en raison de l’utilisation d’instruments plus volumineux, de taille adulte (jusqu’à 30 Fr).40,41 Des avancées significatives dans la miniaturisation des instruments nécessaires à la réalisation de la PCNL ont conduit à une utilisation accrue de la PCNL dans la population pédiatrique, avec des taux de complications plus faibles.42 La Mini-PCNL a été décrite pour la première fois en 1998 par Jackman et al dans le but de développer une technique de PCNL moins invasive qui réduirait la morbidité chez les jeunes enfants.42 Fait notable, cette innovation initialement décrite chez l’enfant s’est également imposée au sein de la population adulte.
Des efforts supplémentaires visant à miniaturiser la PCNL ont abouti à la PCNL ultra-mini (UMP) (11–13 Fr) et à la micro-PCNL (4.8 Fr). L’UMP peut être réalisée avec un néphroscope ou un urétéroscope en recourant à la fragmentation au laser et a montré des taux sans calcul équivalents à ceux de la mini-PCNL, au prix de durées opératoires plus longues.43,44 La micro-PCNL représente le plus petit trajet d’accès actuellement rapporté pour les procédures de PCNL miniaturisées, utilisant une “all-seeing needle” mesurant 4.85 Fr et dotée d’une lumière pouvant accueillir une fibre laser de 200 microns.45 Il est important de noter que cette technique ne permet pas le retrait en quantité significative de fragments de calcul directement par le trajet d’accès.
Réduire la taille de l’instrumentation en PCNL présente plusieurs avantages, notamment : diminution des saignements, diminution des traumatismes du parenchyme rénal et diminution de la douleur liée au trajet d’accès. Une revue systématique récente a cherché à évaluer l’efficacité et les complications des techniques de PCNL mini-invasives chez les patients pédiatriques.46 Au total, 14 études incluant 456 patients ayant subi une micro-PCNL ou une UMP ont été incluses. La taille moyenne des calculs variait de 12 à 16,5 mm. Le taux d’absence de calcul variait de 80–100% et des complications ont été observées chez 14% des patients. 77% des complications étaient de grade I ou II selon Clavien-Dindo. Les complications comprenaient l’hématurie, la fièvre, une fuite d’urine, une infection urinaire, la nécessité d’une transfusion et 3 patients présentant une perforation du bassinet rénal. Globalement, le taux de transfusion dans cette revue systématique était de 2,1%. La PCNL mini-invasive s’est avérée sûre pour les patients pédiatriques. Cependant, il existe certains inconvénients, notamment une diminution de la clarté visuelle et l’impossibilité de retirer les calculs par le trajet d’accès pour la micro-PCNL. Il existe également des preuves d’une augmentation de la pression intrarénale lors de la mini-PCNL.47 Avec un éventail croissant d’options pour la prise en charge chirurgicale de la lithiase rénale pédiatrique, l’UMP et la micro-PCNL représentent une option attrayante qui doit être envisagée chez les patients présentant une charge lithiasique rénale modérée.
Avancées dans la fragmentation ultrasonore des calculs: lithotripsie par ondes en rafales
Bien que, historiquement, la SWL ait été utilisée comme traitement de première intention pour fragmenter les calculs dans la population pédiatrique, la procédure nécessite une anesthésie générale et, avec les avancées plus récentes des techniques endoscopiques, elle est tombée en défaveur dans de nombreuses situations : en particulier chez les patients présentant une charge lithiasique plus importante, des compositions de calculs plus dures, une distance peau-calcul accrue et une lithiase au pôle inférieur du rein.48 La SWL consiste à délivrer un cycle unique d’énergie à un rythme lent (0,5–3 Hz) pour fragmenter les calculs. La lithotripsie par ondes en rafales (BWL) est une modalité relativement nouvelle à l’étude qui utilise des salves sinusoïdales multicycles d’impulsions ultrasonores focalisées pour fracturer les calculs, plutôt que le cycle unique de compression/traction créé par la SWL (Figure 4). La BWL offre une thérapie potentielle qui pourrait être utilisée en cabinet ou en salle de sédation sans nécessité d’anesthésie générale, ce qui serait une option attrayante pour de nombreux patients pédiatriques.13
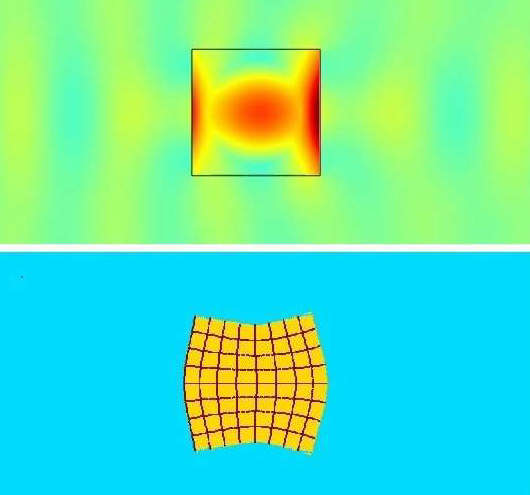
Figure 4 Simulation de la lithotripsie par ondes en salves (BWL) à travers l’interface d’un calcul. L’image du haut montre les ondes de pression jaunes et bleu-vert se déplaçant à travers le calcul, avec une amplification centrale des contraintes par un facteur 5 à l’intérieur du calcul due aux multiples cycles d’impulsions de la BWL. L’image du bas illustre une représentation exagérée de la déformation du calcul induite par les contraintes en raison de l’amplification des contraintes décrite précédemment. Image avec l’aimable autorisation d’Oleg Sapozhnikov de l’Université de Washington.
Il existe plusieurs différences importantes dans les propriétés générées par la BWL par rapport à la SWL traditionnelle. Pour la SWL, une impulsion d’environ 5 µs se répète toutes les 0,33 à 2 secondes, ce qui se traduit par 180 ondes de choc par minute. La BWL est administrée par séries de 10–100 cycles à la fois et a été étudiée dans une gamme de 300–500 kHz chez l’humain.13 L’amplitude de crête d’une onde de SWL est environ 10 fois supérieure à celle de la BWL. Cependant, la BWL peut délivrer la même quantité d’énergie grâce au nombre beaucoup plus important de cycles qu’elle utilise par rapport à l’unique impulsion d’énergie de la SWL. En outre, tandis que la SWL crée un nuage de cavitation dans une zone focale susceptible de provoquer des lésions tissulaires, avec la BWL, la croissance des bulles de cavitation est plus modérée. Les nuages de bulles sont plus diffus et ne subissent généralement pas un effondrement violent, ce qui peut réduire les lésions cellulaires.49 Bien qu’il existe des données suggérant que les nuages de bulles plus diffus générés par la BWL peuvent entraîner un écranage du calcul ciblé vis-à-vis des impulsions ultérieures, la BWL pourrait surmonter cette limitation en modulant la délivrance de l’énergie.50 Un modèle a montré que l’utilisation de fréquences spécifiques selon la taille des calculs peut amplifier, au sein d’un calcul, la contrainte interne générée par la BWL, une option qui n’est pas disponible avec la SWL standard.51
Il existe des données limitées sur l’utilisation de la BWL en contexte clinique, et il convient de noter que ce traitement n’a pas encore été étudié chez les enfants.52 Les expériences cliniques actuelles sont résumées dans le Tableau 1. Le plus grand essai rapporté à ce jour, portant sur 19 patients, a traité des calculs < 12 mm pendant jusqu’à 10 minutes au moyen de la BWL. Une médiane de 90 % du volume des calculs a été entièrement comminutée en 10 minutes et 39 % des calculs ciblés ont été fragmentés avec tous les fragments <2 mm en 10 minutes.53 Une autre étude a traité 13 patients éveillés et non anesthésiés par propulsion ultrasonore et BWL, avec une clairance des calculs rapportée de 70 % et un score moyen de douleur de 1,2/10 pendant le traitement.54
Tableau 1 Synthèse de la recherche PubMed sur les évaluations de la lithotritie par ondes en salves dans des essais cliniques chez l’humain.
| Année | Auteur | Titre | Résultats clés | |
|---|---|---|---|---|
| 2021 | Harper | Première lithotripsie à ondes en salves chez l’humain pour la fragmentation de calculs rénaux : deux premières études de cas54 | Le patient A a bénéficié d’une BWL réussie pour un calcul rénal observé par URS. Le patient B a bénéficié d’une BWL à l’état d’éveil pour un calcul de 7,5 mm à l’UVJ, a bien toléré la procédure, le calcul a été expulsé au JPO 15. | |
| 2022 | Harper | Fragmentation des calculs par lithotripsie à ondes en salves chez les 19 premiers patients10 | 21 des 23 calculs fragmentés. Comminution médiane des calculs de 90 %. Fragmentation complète en <10 minutes pour 9/23 calculs. | |
| 2022 | Hall | Première série utilisant la propulsion ultrasonore et la lithotripsie à ondes en salves pour traiter les calculs urétéraux11 | 13 patients traités par BWL en association avec la propulsion ultrasonore. 70 % des patients ayant subi une BWL à l’état d’éveil ont expulsé le calcul. Score moyen de douleur pendant la BWL : 1,2/10. |
Conclusions
À bien des égards—tels que des stratégies d’imagerie optimisées, des inhibiteurs d’ARN pour l’hyperoxalurie primaire et des avancées chirurgicales en technologie laser et en PCNL miniaturisée—l’avenir de la prise en charge des calculs rénaux pédiatriques est déjà là. Cependant, ces technologies doivent être mieux comprises quant aux modalités d’utilisation clinique les plus efficaces, des questions qui se prêtent bien à la recherche sur l’efficacité comparative. D’autres avancées technologiques, telles que la propulsion par imagerie et la BWL, restent à l’horizon de la prise en charge, mais offrent des voies prometteuses vers des traitements chez l’enfant au cours des prochaines décennies.
Références
- Tasian GE, Ross ME, Song L, Sas DJ, Keren R, Denburg MR, et al.. Annual Incidence of Nephrolithiasis among Children and Adults in South Carolina from 1997 to 2012. Clin J Am Soc Nephrol 2016; 11 (3): 488–496. DOI: 10.2215/cjn.07610715.
- Roberson NP, Dillman JR, O’Hara SM, DeFoor WR, Reddy PP, Giordano RM, et al.. Comparison of ultrasound versus computed tomography for the detection of kidney stones in the pediatric population: a clinical effectiveness study. Pediatr Radiol 2018; 48 (7): 962–972. DOI: 10.1007/s00247-018-4099-7.
- Ellison JS, Thakrar P. The Role of Imaging in Management of Stone Disease. Diagnosis and Management of Pediatric. Nephrolithiasis: Springer; 2022. DOI: 10.1007/978-3-031-07594-0\\_8.
- Frush DP. Pediatric CT: practical approach to diminish the radiation dose. Pediatr Radiol 2002; 32 (10): 714–717. DOI: 10.1007/s00247-002-0797-1.
- Dai JC, Bailey MR, Sorensen MD, Harper JD. Innovations in Ultrasound Technology in the Management of Kidney Stones. Urol Clin North Am 2019; 46 (2): 273–285. DOI: 10.1016/j.ucl.2018.12.009.
- Masch WR, Cohan RH, Ellis JH, Dillman JR, Rubin JM, Davenport MS. Clinical Effectiveness of Prospectively Reported Sonographic Twinkling Artifact for the Diagnosis of Renal Calculus in Patients Without Known Urolithiasis. AJR Am J Roentgenol 2016; 206 (2): 326–331. DOI: 10.2214/ajr.15.14998.
- Verhagen MV, Watson TA, Hickson M, Smeulders N, Humphries PD. Acoustic shadowing in pediatric kidney stone ultrasound: a retrospective study with non-enhanced computed tomography as reference standard. Pediatr Radiol 2019; 49 (6): 777–783. DOI: 10.1007/s00247-019-04372-x.
- Simon JC, Dunmire B, Bailey MR, Sorensen MD. Developing Complete Ultrasonic Management of Kidney Stones for Spaceflight. J Space Saf Eng 2016; 3 (2): 50–57. DOI: 10.1016/s2468-8967(16)30018-0.
- Lira D, Padole A, Kalra MK, Singh S. Tube Potential and CT Radiation Dose Optimization. AJR Am J Roentgenol 2015; 204 (1): W4–w10. DOI: 10.2214/ajr.14.13281.
- Niemann T, Kollmann T, Bongartz G. Diagnostic Performance of Low-Dose CT for the Detection of Urolithiasis: A Meta-Analysis. AJR Am J Roentgenol 2008; 191 (2): 396–401. DOI: 10.2214/ajr.07.3414.
- Ellison JS, Crowell CS, Clifton H, Whitlock K, Haaland W, Chen T, et al.. A clinical pathway to minimize computed tomography for suspected nephrolithiasis in children. J Pediatr Urol 2019; 15 (5): 518.e1–518.e7. DOI: 10.1016/j.jpurol.2019.06.014.
- Harper JD, Cunitz BW, Dunmire B. Faculty Opinions recommendation of First in human clinical trial of ultrasonic propulsion of kidney stones. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2016; 195: 956, DOI: 10.3410/f.725901820.793511249.
- Raskolnikov D, Bailey MR, Harper JD. Recent Advances in the Science of Burst Wave Lithotripsy and Ultrasonic Propulsion. BME Front 2022; 2022. DOI: 10.34133/2022/9847952.
- Dai JC, Sorensen MD, Chang HC, Samson PC, Dunmire B, Cunitz BW, et al.. Quantitative Assessment of Effectiveness of Ultrasonic Propulsion of Kidney Stones. J Endourol 2019; 33 (10): 850–857. DOI: 10.1089/end.2019.0340.
- Goldstein R, Goldfarb DS. Early Recognition and Management of Rare Kidney Stone Disorders. Urol Nurs 2017; 37 (2): 81. DOI: 10.7257/1053-816x.2017.37.2.81.
- Daga A, Majmundar AJ, Braun DA, Gee HY, Lawson JA, Shril S, et al.. Whole exome sequencing frequently detects a monogenic cause in early onset nephrolithiasis and nephrocalcinosis. Kidney Int 2018; 93 (1): 204–213. DOI: 10.1016/j.kint.2017.06.025.
- Langman CB. A rational approach to the use of sophisticated genetic analyses of pediatric stone disease. Kidney Int 2018; 93 (1): 15–18. DOI: 10.1016/j.kint.2017.08.023.
- Ma Y, Lv H, Wang J, Tan J. Heterozygous mutation of SLC34A1 in patients with hypophosphatemic kidney stones and osteoporosis: a case report. J Int Med Res 2020; 48 (3): 030006051989614. DOI: 10.1177/0300060519896146.
- Tasian GE, Copelovitch L. Evaluation and Medical Management of Kidney Stones in Children. J Urol 2014; 192 (5): 1329–1336. DOI: 10.1016/j.juro.2014.04.108.
- Tasian GE, Ross M, Song L. Ecological Momentary Assessment of Factors Associated with Water Intake Among Adolescents with Kidney Stone Disease. 2018. DOI: 10.1016/j.juro.2018.07.064.
- Conroy DE, West AB, Brunke-Reese D, Thomaz E, Streeper NM. Just-in-time adaptive intervention to promote fluid consumption in patients with kidney stones. Health Psychol 2020; 39 (12): 1062–1069. DOI: 10.1037/hea0001032.
- Wright HC, Alshara L, DiGennaro H, Kassis YE, Li J, Monga M, et al.. The impact of smart technology on adherence rates and fluid management in the prevention of kidney stones. Urolithiasis 2022; 50 (1): 29–36. DOI: 10.1007/s00240-021-01270-6.
- Scales CD, Desai AC, Harper JD, Lai HH, Maalouf NM, Reese PP, et al.. Prevention of Urinary Stones With Hydration (PUSH): Design and Rationale of a Clinical Trial. Am J Kidney Dis 2020; 77 (6): 898–906.e1. DOI: 10.1053/j.ajkd.2020.09.016.
- Garrelfs SF, Frishberg Y, Hulton SA. Lumasiran, an RNAi Therapeutic for Primary Hyperoxaluria Type 1. N Engl J Med 2021; 385 (20): e69. DOI: 10.1056/nejmc2107661.
- Traxer O, Keller EX. Thulium fiber laser: the new player for kidney stone treatment? A comparison with Holmium:YAG laser. World J Urol 2020; 38 (8): 1883–1894. DOI: 10.1007/s00345-019-02654-5.
- Aldoukhi AH, Black KM, Ghani KR. Emerging Laser Techniques for the Management of Stones. Urol Clin North Am 2019; 46 (2): 193–205. DOI: 10.1016/j.ucl.2018.12.005.
- Kang HW, Lee H, Teichman JMH, Oh J, Kim J, Welch AJ. Dependence of calculus retropulsion on pulse duration during HO: YAG laser lithotripsy. Lasers Surg Med 2006; 38 (8): 762–772. DOI: 10.1002/lsm.20376.
- Bell JR, Penniston KL, Nakada SY. In Vitro Comparison of Holmium Lasers: Evidence for Shorter Fragmentation Time and Decreased Retropulsion Using a Modern Variable-pulse Laser. Urology 2017; 107: 37–42. DOI: 10.1016/j.urology.2017.06.018.
- Kronenberg P, Traxer O. Update on lasers in urology 2014: current assessment on holmium:yttrium–aluminum–garnet (Ho:YAG) laser lithotripter settings and laser fibers. World J Urol 2015; 33 (4): 463–469. DOI: 10.1007/s00345-014-1395-1.
- Wang M, Shao Q, Zhu X, Wang Z, Zheng A. Efficiency and Clinical Outcomes of Moses Technology with Flexible Ureteroscopic Laser Lithotripsy for Treatment of Renal Calculus. Urol Int 2021; 105 (7-8): 587–593. DOI: 10.1159/000512054.
- Ibrahim A, Fahmy N, Carrier S, Elhilali M, Andonian S. Double-blinded prospective randomized clinical trial comparing regular and moses modes of holmium laser lithotripsy: Preliminary results. European Urology Supplements 2020; 17 (2): e1390. DOI: 10.1016/s1569-9056(18)31815-3.
- Panthier F, Doizi S, Berthe L, Traxer O. In vitro comparison of ablation rates between superpulsed thulium fiber laser and ho:Yag laser for endocorporeal lithotripsy. Eur Urol Open Sci 2020; 19: e1884–e1885. DOI: 10.1016/s2666-1683(20)33870-2.
- Khusid JA, Khargi R, Seiden B, Sadiq AS, Atallah WM, Gupta M. Thulium fiber laser utilization in urological surgery: A narrative review. Investig Clin Urol 2021; 62 (2): 136. DOI: 10.4111/icu.20200467.
- Taratkin M, Azilgareeva C, Cacciamani GE, Enikeev D. Thulium fiber laser in urology: physics made simple. Curr Opin Urol 2022; 32 (2): 166–172. DOI: 10.1097/mou.0000000000000967.
- Andreeva V, Vinarov A, Yaroslavsky I, Kovalenko A, Vybornov A, Rapoport L, et al.. Preclinical comparison of superpulse thulium fiber laser and a holmium:YAG laser for lithotripsy. World J Urol 2020; 38 (2): 497–503. DOI: 10.1007/s00345-019-02785-9.
- Jiang P, Okhunov Z, Afyouni AS, Ali SN, Sharifi H, Bhatt R, et al.. Comparison of Superpulse Thulium Fiber Laser vs. Holmium Laser for Ablation of Renal Calculi in an In-Vivo Porcine Model. J Endourol 2022. DOI: 10.1089/end.2022.0445.
- Jaeger CD, Nelson CP, Cilento BG, Logvinenko T, Kurtz MP. Comparing Pediatric Ureteroscopy Outcomes with SuperPulsed Thulium Fiber Laser and Low-Power Holmium:YAG Laser. J Urol 2022; 208 (2): 426–433. DOI: 10.1097/ju.0000000000002666.
- Chua ME, Bobrowski A, Ahmad I. Thulium fibre laser vs holmium: yttrium-aluminium-garnet laser lithotripsy for urolithiasis: meta-analysis of clinical studies. 2022. DOI: 10.1111/bju.15921.
- Ellison JS, MacConaghy B, Hall TL, Roberts WW, Maxwell AD. A simulated model for fluid and tissue heating during pediatric laser lithotripsy. J Pediatr Urol 2020; 16 (5): 626.e1–626.e8. DOI: 10.1016/j.jpurol.2020.07.014.
- Quhal F, Al Faddagh A, Silay MS, Straub M, Seitz C. Paediatric stone management: innovations and standards. Curr Opin Urol 2022; 32 (4): 420–424. DOI: 10.1097/mou.0000000000001004.
- Zeren S, Satar N, Bayazit Y, Bayazit AK, Payasli K, Özkeçeli R. Percutaneous Nephrolithotomy in the Management of Pediatric Renal Calculi. J Endourol 2002; 16 (2): 75–78. DOI: 10.1089/089277902753619546.
- Jackman SV, Hedican SP, Peters CA, Docimo SG. Percutaneous nephrolithotomy in infants and preschool age children: experience with a new technique. Urology 1998; 52 (4): 697–701. DOI: 10.1016/s0090-4295(98)00315-x.
- Wright A, Rukin N, Smith D, Rosette J De la, Somani BK. ‘Mini, ultra, micro’ – nomenclature and cost of these new minimally invasive percutaneous nephrolithotomy (PCNL) techniques. Ther Adv Urol 2016; 8 (2): 142–146. DOI: 10.1177/1756287215617674.
- Mishra DK, Bhatt S, Palaniappan S, Reddy TVK, Rajenthiran V, Sreeranga YL, et al.. Mini versus ultra-mini percutaneous nephrolithotomy in a paediatric population. Asian J Urol 2022; 9 (1): 75–80. DOI: 10.1016/j.ajur.2021.06.002.
- Desai MR, Sharma R, Mishra S, Sabnis RB, Stief C, Bader M. Single-Step Percutaneous Nephrolithotomy (Microperc): The Initial Clinical Report. J Urol 2011; 186 (1): 140–145. DOI: 10.1016/j.juro.2011.03.029.
- Jones P, Bennett G, Aboumarzouk OM, Griffin S, Somani BK. Role of Minimally Invasive Percutaneous Nephrolithotomy Techniques–Micro and Ultra-Mini PCNL (<15F) in the Pediatric Population: A Systematic Review. J Endourol 2017; 31 (9): 816–824. DOI: 10.1089/end.2017.0136.
- Loftus CJ, Hinck B, Makovey I, Sivalingam S, Monga M. Mini Versus Standard Percutaneous Nephrolithotomy: The Impact of Sheath Size on Intrarenal Pelvic Pressure and Infectious Complications in a Porcine Model. J Endourol 2018; 32 (4): 350–353. DOI: 10.1089/end.2017.0602.
- Silay MS, Ellison JS, Tailly T, Caione P. Update on Urinary Stones in Children: Current and Future Concepts in Surgical Treatment and Shockwave Lithotripsy. Eur Urol Focus 2017; 3 (2-3): 164–171. DOI: 10.1016/j.euf.2017.07.005.
- Maeda K, Colonius T. Bubble cloud dynamics in an ultrasound field. J Fluid Mech 2019; 862: 1105–1134. DOI: 10.1017/jfm.2018.968.
- Maeda K, Maxwell AD, Colonius T. Investigation of the Energy Shielding of Kidney Stones by Cavitation Bubble Clouds during Burst Wave Lithotripsy. Proceedings of the 10th International Symposium on Cavitation (CAV2018) 2018; 144: 626–630. DOI: 10.1115/1.861851_ch119.
- Sapozhnikov OA, Maxwell AD, Bailey MR. Maximizing mechanical stress in small urinary stones during burst wave lithotripsy. J Acoust Soc Am 2021; 150 (6): 4203–4212. DOI: 10.1121/10.0008902.
- Harper JD, Metzler I, Hall MK. Faculty Opinions recommendation of First In-Human Burst Wave Lithotripsy for Kidney Stone Comminution: Initial Two Case Studies. Faculty Opinions – Post-Publication Peer Review of the Biomedical Literature 2020. DOI: 10.3410/f.738685997.793585856.
- Harper JD, Lingeman JE, Sweet RM. Re: Fragmentation of Stones by Burst Wave Lithotripsy in the First 19 Humans. Eur Urol 2022; 82 (5): 569. DOI: 10.1016/j.eururo.2022.07.012.
- Hall MK, Thiel J, Dunmire B. First Series Using Ultrasonic Propulsion and Burst Wave Lithotripsy to Treat Ureteral Stones. Letter. J Urol 2022; 209 (2): 325–326. DOI: 10.1097/ju.0000000000003060.
Dernière mise à jour: 2025-09-22 07:59