43: Tumeurs malignes de la vessie
Ce chapitre prendra environ 14 minutes de lecture.
Introduction
Le carcinome urothélial (UCC) dans la population pédiatrique est très rare, avec une incidence comprise entre 0,1 % et 0,4 %. Une revue de 2019 n’a trouvé que 243 cas documentés d’UCC chez des patients <18 ans, l’âge moyen étant de 12,5 ans, avec une prédominance masculine (3:1). Globalement, la récidive de l’UCC dans la population pédiatrique est considérée comme faible (8,6 %), et les décès très peu fréquents, <4 %. Compte tenu de sa rareté, il n’existe pas de recommandations publiées concernant le diagnostic et la prise en charge de l’UCC dans la population pédiatrique. Ce chapitre vise à présenter l’étiologie et la pathogénie, l’évaluation et le diagnostic, la prise en charge et le suivi de l’UCC pédiatrique selon la littérature actuellement publiée.
Étiologie/Pathogénie
Il existe des facteurs de risque bien définis pour le développement de l’UCC chez l’adulte, notamment le tabagisme, l’exposition à divers produits chimiques professionnels tels que les colorants à l’aniline et les produits chimiques des usines textiles, la phénacétine, ainsi que l’exposition à la chimiothérapie ou à la radiothérapie. Des affections génétiques ont également été liées au développement de l’UCC vésical chez l’adulte, à savoir le syndrome de Lynch, la maladie de Cowden et la présence d’UCC chez un parent du premier degré. Chez l’enfant, les facteurs de risque génétiques et environnementaux sont peu étudiés, mais extrapolés à partir des adultes. Une exposition précoce au tabac, des syndromes de prédisposition au cancer (p. ex., le syndrome de Costello), un développement anormal de la vessie, une exposition aux rayonnements, une exposition à la cyclophosphamide et des infections parasitaires ont été identifiés comme des facteurs de risque du développement de l’UCC chez l’enfant. Malgré cela, aucun facteur de risque évident connu n’est retrouvé chez près de 87 % des patients pédiatriques atteints d’UCC.
Les facteurs de risque de récidive et de décès liés au cancer de la vessie dans la population pédiatrique comprennent des antécédents familiaux d’UCC, une histologie de haut grade et des tumeurs de plus grande taille au moment du diagnostic. La récidive et le décès sont rares; ainsi, encore une fois, ces facteurs sont généralement extrapolés à partir de la littérature adulte.
Évaluation et diagnostic
Présentation du patient
À l’instar des adultes, les patients pédiatriques présentent souvent une hématurie macroscopique indolore (90 %), bien que des symptômes mictionnels irritatifs tels que la dysurie, la pollakiurie et l’urgenturie puissent également être fréquents. Un délai diagnostique d’au moins 1 an a été rapporté chez jusqu’à 26 % des patients, compte tenu de la rareté de ce diagnostic chez l’enfant et du caractère généralement bénin des diagnostics différentiels d’une hématurie macroscopique chez l’enfant (p. ex. urétrorragie bénigne, traumatisme, infections urinaires, anomalies urologiques congénitales, maladies rénales intrinsèques, troubles mictionnels, etc.).
UCC se présente généralement comme une tumeur vésicale unique chez les enfants, contrairement à la multifocalité chez les adultes (94 % contre 6 %). 93,4 % des tumeurs sont de bas grade (pTa ou pT1), et il n’y a généralement aucune preuve d’atteinte ganglionnaire ni de métastases. Tableau 1 décrit la stadification du cancer de la vessie selon l’American Join Committee on Cancer (AJCC).
Tableau 1 Stadification du carcinome urothélial selon l’AJCC
| Stade T | Description |
|---|---|
| Ta | Carcinome papillaire non invasif |
| Tis | Carcinome in situ (CIS) |
| T1 | La tumeur envahit le chorion |
| T2 | La tumeur envahit la musculeuse propre |
| T2a | La tumeur envahit la musculeuse propre superficielle (moitié interne) |
| T2b | La tumeur envahit la musculeuse propre profonde (moitié externe) |
| T3 | La tumeur envahit le tissu/la graisse périvésical |
| T3a | La tumeur envahit le tissu/la graisse périvésical microscopiquement |
| T3b | La tumeur envahit le tissu adipeux périvésical macroscopiquement (masse extravésicale) |
| T4 | La tumeur envahit la prostate, l’utérus, le vagin, la paroi pelvienne ou la paroi abdominale |
| T4a | La tumeur envahit des organes adjacents (utérus, ovaires, stroma prostatique) |
| T4b | La tumeur envahit la paroi pelvienne et/ou la paroi abdominale |
Évaluation initiale
Les recommandations 2020 de l’AUA concernant le carcinome urothélial (UCC) non infiltrant le muscle stipulent des recommandations claires pour l’évaluation des patients adultes présentant une hématurie macroscopique, incluant la cystoscopie, l’imagerie du haut appareil urinaire par urographie au scanner (TDM) ou à l’IRM, et, occasionnellement, le recours à la cytologie urinaire. Compte tenu de l’évolution naturelle de l’UCC chez les patients pédiatriques, c’est-à-dire des tumeurs généralement de bas grade qui ne récidivent pas, le bilan initial d’un patient pédiatrique présentant une hématurie macroscopique est souvent abordé de manière moins agressive.
L’évaluation doit commencer par une anamnèse et un examen clinique. Lors de la première consultation, les examens complémentaires comprennent une analyse d’urine (avec une attention particulière portée à la présence/quantité d’hématies et aux indicateurs d’infection tels que l’estérase leucocytaire, les nitrites et les bactéries), une culture d’urine et une échographie réno-vésicale.
L’analyse d’urines peut confirmer une hématurie microscopique persistante et aider à exclure d’autres causes potentielles d’hématurie, notamment une néphropathie médicale ou une infection. L’uroculture permettrait de confirmer l’absence d’infection. L’échographie réno-vésicale peut préciser l’anatomie des voies urinaires supérieures et inférieures et évaluer les causes potentielles d’hématurie macroscopique. Compte tenu de la corpulence plus faible des enfants, cette modalité peut être très sensible pour détecter de petites tumeurs intraluminales.
Imagerie, cystoscopie et cytologie
Dans la population adulte, la cystoscopie constitue l’étalon-or pour la détection des tumeurs vésicales, et l’imagerie des voies urinaires supérieures sous forme d’urographie par TDM ou IRM est la norme pour explorer les voies urinaires supérieures. Dans la population pédiatrique, plusieurs considérations doivent être prises en compte, notamment la nécessité d’une anesthésie générale pour la cystoscopie, d’une sédation pour l’imagerie par TDM ou IRM, et l’exposition aux rayonnements ionisants avec la TDM.
Quelques études ont évalué la sensibilité et la spécificité de l’échographie dans l’évaluation des voies urinaires supérieures et inférieures pour la détection de masses chez l’enfant. L’échographie vésicale a montré une sensibilité de 83 à 93 % pour la détection des tumeurs vésicales, avec une spécificité de 93 à 100 %, et a permis de détecter des lésions vésicales aussi petites que 5 mm. Compte tenu de la dose d’irradiation cumulée qu’un patient pédiatrique peut recevoir au cours de nombreuses années pour la surveillance de l’UCC, l’échographie devient une modalité attrayante, tant comme test de dépistage initial lors d’une présentation avec hématurie macroscopique que pour la surveillance d’une récidive de masse après résection.
La cystoscopie est indiquée chez les patients chez lesquels une lésion vésicale a été détectée à l’échographie ou chez ceux présentant une hématurie persistante sans autre explication. Chez les patients pédiatriques, les tumeurs sont généralement uniques, non invasives, et environ 52 % d’entre elles sont localisées sur les parois latérales (Figure 1) La cystoscopie chez l’enfant nécessite une anesthésie ; ainsi, la cystoscopie est souvent réalisée en même temps qu’une résection transurétrale de tumeur vésicale (TURBT) en tant qu’élément prévu de la procédure. Un prélèvement tissulaire est nécessaire pour établir le diagnostic et la profondeur d’invasion (stade T). Il s’agit également du traitement initial visant à retirer la tumeur dans son intégralité.
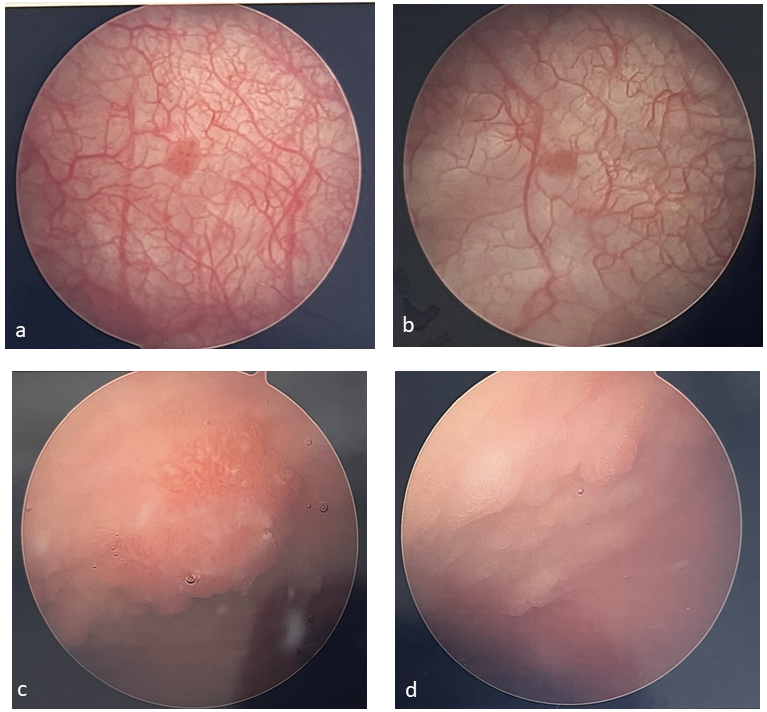 Figure 1 Exemples de tumeurs vésicales. Les tumeurs vésicales sont souvent solitaires et papillaires (a, b) et peuvent être plus difficiles à identifier chez les patients ayant subi une augmentation vésicale (c, d).
Figure 1 Exemples de tumeurs vésicales. Les tumeurs vésicales sont souvent solitaires et papillaires (a, b) et peuvent être plus difficiles à identifier chez les patients ayant subi une augmentation vésicale (c, d).
Le rôle de la cytologie urinaire est très limité chez les patients pédiatriques, car ces tumeurs vésicales sont généralement de bas grade et la sensibilité de la cytologie pour les tumeurs de bas grade est assez faible.
Prise en charge
Le taux de récidive du cancer de la vessie dans la population pédiatrique est faible et les taux de survie à 5 ans sont favorables, à 97,3 %. En raison de ces différences, la prise en charge diffère de manière significative de celle des adultes. Il existe toutefois certaines similitudes entre les deux populations et, par conséquent, certains aspects de la prise en charge sont communs.
Résection transurétrale de tumeur de la vessie (RTUV)
Comme chez l’adulte, la résection transurétrale est à la fois diagnostique et thérapeutique. Cela nécessite la résection de toute la tumeur macroscopiquement évidente, avec une profondeur suffisante pour obtenir un prélèvement du muscle détrusor sous-jacent. Ceci est nécessaire pour réduire le risque de récidive, mais aussi pour une stadification adéquate. Les TURBT nécessitant un résectoscope peuvent être prohibitives chez les petits patients, car les anses du résectoscope peuvent être très difficiles à manipuler sur des endoscopes de petit calibre. Certains enfants peuvent nécessiter une biopsie à cupule froide et une fulguration de la base de la tumeur, bien qu’il faille veiller à obtenir des biopsies tissulaires profondes pour l’échantillonnage du détrusor. Un examen bimanuel de la vessie doit également être réalisé au moment de la TURBT pour compléter la stadification.
Traitement intravésical
En règle générale, l’instillation de chimiothérapie périopératoire n’est pas utilisée chez les patients pédiatriques. Les patients pédiatriques chez qui l’on découvre des tumeurs de grade et de stade plus élevés sont susceptibles de se comporter plus comme l’UCC de l’adulte et pourraient donc être mieux traités comme tels, même s’il n’existe pas d’études prospectives pour ce scénario rare. Ces patients peuvent nécessiter une chimiothérapie intravésicale et des protocoles de surveillance tels que ceux pour adultes décrits par les organisations AUA et NCCN. Il existe quelques rapports sur l’utilisation, en post-TURBT, d’instillations intravésicales de BCG, de mitomycine ou d’épirubicine chez des patients pédiatriques atteints d’un cancer de la vessie. De manière générale, les doses et les schémas ont été ceux décrits chez l’adulte, avec peu d’événements indésirables graves. Le traitement intravésical est généralement réservé aux patients présentant une maladie de haut grade ou récidivante, mais les données se limitent à des rapports de cas, de sorte qu’il n’existe pas, à ce jour, de données claires permettant d’en établir précisément le rôle.
Suivi et surveillance
Chez l’adulte, les recommandations comportent des protocoles agressifs, clairs et bien établis pour la surveillance et la prise en charge des récidives, car celles-ci sont fréquentes. En revanche, chez l’enfant, il n’existe pas de recommandations claires en raison de la rareté de cette tumeur et des récidives, plus rares encore. Une revue de 2019 a rapporté un taux de récidive de seulement 8,6 %, une différence notable par rapport aux adultes.
De manière générale, les modalités et le calendrier de la surveillance doivent être adaptés en fonction du risque de rechute de l’enfant. Le nombre de lésions, le stade et le grade pathologiques, la taille tumorale, les antécédents de récidive et l’âge doivent tous être pris en compte. Un dépistage régulier par échographie constitue une option raisonnable chez les enfants chez qui un cancer de la vessie a été diagnostiqué, en raison de sa sensibilité élevée et de sa nature non invasive. Une cystoscopie peut ensuite être réalisée si une lésion est détectée. Une cystoscopie de surveillance systématique, malgré des échographies normales, peut être nécessaire chez les patients pédiatriques à plus haut risque (p. ex., lésions multiples, lésions de haut grade, récidive, âge plus avancé, etc.). Comme au moment du diagnostic, la cytologie urinaire est peu susceptible d’apporter un bénéfice important, étant donné que les enfants présentent généralement des tumeurs de bas grade bien différenciées.
Contrairement aux protocoles chez l’adulte, il n’existe pas de données permettant de guider la durée du suivi chez les enfants atteints d’UCC. Une vaste revue de la littérature a constaté que, si une récidive ou un décès en lien avec une UCC de bas grade/bas stade devait survenir, cela se produirait probablement au cours de la première année suivant le diagnostic initial. Le délai moyen jusqu’à la récidive ou au décès était de 8,6 mois.
Tableau 2 Calendrier de surveillance pour l’UCC vésical de bas grade, à un stade peu avancé, chez les patients pédiatriques (adapté par Rezaee et al)1
| 0-12 mois | 18-24 mois | 36-48 mois | >60 mois | |
|---|---|---|---|---|
| Échographie | Tous les 3 mois | Tous les 6 mois | Annuellement | À la discrétion du clinicien |
| Analyse d’urines | Tous les 3 mois | Tous les 6 mois | Annuellement | À la discrétion du clinicien |
| Cystoscopie | Tous les 3 mois | Tous les 6 mois | +/- annuellement | À la discrétion du clinicien |
| Cytologie | — | — | — | — |
De plus, il est très improbable qu’un événement de récidive ou de décès survienne au-delà de trois ans après le diagnostic et le traitement initiaux. La récidive la plus tardive publiée a été observée 32 mois après le diagnostic initial. Un schéma de surveillance potentiel pour l’UCC de bas grade et de bas stade a été décrit par Rezaee et al. sur la base d’une cohorte issue d’une revue de la littérature de 2019, et celui-ci est résumé dans Tableau 2. Il est important de noter que ce schéma de surveillance n’a pas été étudié de manière rigoureuse par une étude prospective randomisée démontrant sa sécurité et qu’il est proposé uniquement comme point de départ pour les formes de bas grade/bas stade.
Tumeurs vésicales dans la population atteinte de vessie neurologique
Le suivi à long terme de patients atteints d’une vessie neurogène congénitale (c.-à-d. spina bifida, exstrophie vésicale, etc.) a identifié cette population comme présentant un risque particulièrement élevé de développer un cancer de la vessie (incidence estimée à environ 4%). Contrairement au cancer de la vessie dans la population à vessie non neurogène, cette cohorte est généralement diagnostiquée fortuitement et présente une incidence plus élevée d’adénocarcinome (50%). La grande majorité des patients se présentent avec une maladie localement avancée ou disséminée (>70%) et la survie est médiocre. Le diagnostic est souvent posé à un stade avancé et les résultats sont médiocres.
L’hypothèse initiale quant à cette augmentation du risque de cancer de la vessie reposait sur l’idée que la cystoplastie d’augmentation constituait un facteur de risque. Bien que les segments gastriques augmentent certainement le risque ultérieur de malignité, l’augmentation à l’aide d’autres segments intestinaux ne semble pas accroître le risque de malignité. Au vu de diverses études rétrospectives, il apparaît désormais que le risque de malignité est dû à la vessie congénitale elle-même plutôt qu’à l’augmentation.
Lorsque les premières descriptions de tumeurs malignes avancées et mortelles dans cette population ont été publiées, diverses mesures ont été proposées puis étudiées dans le but de détecter plus précocement ces tumeurs. Malheureusement, aucune ne s’est révélée bénéfique. La cystoscopie annuelle a un faible rendement diagnostique et, même chez des patients ayant un dépistage normal, un cancer de la vessie à un stade avancé s’est tout de même développé. Il a été suggéré que si la cystoscopie permettait de détecter chaque tumeur maligne, il faudrait en réaliser 980 pour diagnostiquer un seul cas de cancer sur 10 ans de suivi. La cytologie urinaire a peu d’intérêt dans cette population en raison de la pyurie chronique, des cathétérismes intermittents et de la desquamation attendue de cellules entériques; elle présente également un taux élevé de faux positifs. En tenant compte de l’efficacité des mesures de dépistage ci-dessus, il apparaît que l’augmentation de l’espérance de vie n’était que de 2,3 mois et que le coût à vie était de >$55,000 par personne. Cela s’explique principalement par la faible incidence des tumeurs malignes et le grand nombre de tests de dépistage nécessaires pour détecter un seul cas de tumeur maligne, indépendamment du stade au moment du diagnostic.
Le protocole de Husmann a été largement adopté pour guider le suivi des patients ayant une vessie neurogène, tant pour la détection de malignité que pour l’évaluation de routine chez les patients avec ou sans reconstruction vésicale (Figure 2) Cela implique une évaluation annuelle des infections urinaires, de l’hématurie, de la douleur vésicale/pelvienne/du flanc et de toute nouvelle incontinence. En cas d’anomalies ou de modifications par rapport à l’état initial, il convient d’envisager une culture d’urine, une cystoscopie, un scanner ± un bilan urodynamique. Tous les patients devraient bénéficier annuellement d’un dosage de la créatinine/cystatine C, des électrolytes, du taux sérique de vitamine B12 et d’une analyse d’urines. De même, s’il y a <50 hématies/hpf, une échographie rénale/vésicale doit être prescrite. Si l’échographie est anormale, s’il existe une hématurie macroscopique ou ≥50 hématies/hpf, il convient d’envisager une culture d’urine, une cystoscopie, un scanner ± un bilan urodynamique. Pour les patients porteurs de segments coliques, une cystoscopie de routine pour le dépistage du cancer du côlon doit débuter à l’âge de 50 ans.
Figure 2 Protocole de Husmann pour la surveillance du cancer de la vessie chez les patients ayant bénéficié d’une cystoplastie d’agrandissement.2
Points clés
- Le cancer de la vessie chez les patients pédiatriques est rare
- Il n’existe actuellement pas de facteurs de risque bien définis pour le développement d’un cancer vésical pédiatrique, mais les facteurs de risque des adultes sont extrapolés et souvent appliqués à cette population
- La plupart des patients pédiatriques atteints d’un cancer vésical se présentent avec une hématurie macroscopique indolore ou des symptômes mictionnels irritatifs
- La plupart des UCC pédiatriques sont de bas grade, de bas stade, et ne récidivent pas
- L’évaluation initiale doit commencer par l’anamnèse et l’examen clinique, une analyse d’urines, une culture d’urines, et une échographie vésicale/rénale
- L’échographie vésicale a une excellente sensibilité et spécificité pour la détection des tumeurs vésicales et devrait être envisagée comme modalité de dépistage
- Il n’y a pas de place pour la cytologie urinaire, car la plupart des UCC pédiatriques sont de bas grade
- Si une lésion est trouvée à l’échographie, une cystoscopie avec TURBT doit être réalisée
- La résection transurétrale de tumeur de vessie doit inclure un prélèvement du muscle détrusor pour une stadification appropriée
- Le rôle de la chimiothérapie intravésicale est incertain, mais elle constitue une option raisonnable chez les patients ayant une maladie de haut stade, de haut grade, ou récidivante
- Les patients pédiatriques atteints d’UCC doivent bénéficier d’une surveillance au moins pendant les 3 premières années après le diagnostic, mais une surveillance au-delà de cette période peut être inutile
- Les patients présentant une vessie neurologique congénitale (VNC) ont un risque accru de cancer vésical, et ce risque n’est pas associé à l’augmentation vésicale, à l’exception des segments gastriques; l’histologie est habituellement un adénocarcinome
- Les patients avec VNC se présentent fortuitement à un stade plus élevé avec des tumeurs localement avancées, et une survie médiocre
- Un dépistage systématique par cystoscopie et cytologie urinaire n’est pas bénéfique et n’est pas recommandé
- Le protocole de Husmann est préconisé pour le suivi des patients avec VNC, dans le but d’identifier de manière ciblée les patients à plus haut risque de malignité (hématurie, augmentation des infections urinaires, douleur, nouvelle incontinence, anomalies des examens biologiques/imagerie)
Conclusion
Le cancer de la vessie chez les patients pédiatriques est rare et, globalement, de bon pronostic. La plupart des tumeurs sont solitaires, de bas grade et ne récidivent pas. Le bilan doit commencer par l’anamnèse et l’examen clinique, une analyse d’urine, une culture d’urine et une échographie vésicale/rénale, avec, dans un second temps, une cystoscopie et une TURBT de la lésion vésicale. La chimiothérapie intravésicale peut souvent être évitée compte tenu d’une histologie de bas grade. En cas de tumeurs de haut grade ou de stade plus élevé, ou en cas de tumeurs récidivantes, une chimiothérapie intravésicale peut être envisagée; toutefois, il n’existe à l’heure actuelle aucune recommandation fondée sur des données probantes concernant son utilisation chez l’enfant. Les patients doivent être surveillés pendant au moins 3 ans au moyen d’une combinaison d’analyses d’urine périodiques, d’échographies vésicales/rénales et de cystoscopie. Une surveillance au-delà de 3 ans peut ne pas être nécessaire, mais il convient de recourir à une prise de décision partagée pour déterminer cette durée.
Vidéos recommandées
Références
- Karatzas A, Tzortzis V. Lower urinary tract symptoms and bladder cancer in children: The hidden scenario. Urol Ann 2019; 11 (1): 102–104. DOI: 10.4103/UA.UA_60_18.
- Rezaee ME, Dunaway CM, Baker ML, Penna FJ, Chavez DR. Urothelial cell carcinoma of the bladder in pediatric patients: a systematic review and data analysis of the world literature. Journal of Pediatric Urology 2019; 15 (4): 309–314. DOI: 10.1016/j.jpurol.2019.06.013.
- Lerena J, Krauel L, García-Aparicio L, Vallasciani S, Suñol M, Rodó J. Transitional cell carcinoma of the bladder in children and adolescents: Six-case series and review of the literature. Journal of Pediatric Urology 2010; 6 (5): 481–485. DOI: 10.1016/j.jpurol.2009.11.006.
- Egbers L, Grotenhuis AJ, Aben KK, Alfred Witjes J, Kiemeney LA, Vermeulen SH. The prognostic value of family history among patients with urinary bladder cancer. Int J Cancer 2015; 136 (5): 1117–1124. DOI: 10.1002/ijc.29062.
- Wild P, Giedl J, Stoehr R. Genomic aberrations are rare in urothelial neoplasms of patients 19 years or younger. The Journal of Pathology 2007; 211 (1): 18–25. DOI: 10.1002/path.2075.
- Fine SW, Humphrey PA, Dehner LP, Amin MB, Epstein JI. Urothelial Neoplasms In Patients 20 Years or Younger: A Clinicopathological Analysis Using The World Health Organization 2004 Bladder Consensus Classification. Journal of Urology 2005; 174 (5): 1976–1980. DOI: 10.1097/01.ju.0000176801.16827.82.
- Paner GP, Zehnder P, Amin AM, Husain AN, Desai MM. Urothelial Neoplasms of the Urinary Bladder Occurring in Young Adult and Pediatric Patients: A Comprehensive Review of Literature With Implications for Patient Management. Adv Ant Pathol 18 (1): 79–89.
- Bladder Cancer: Non-Muscle Invasive Guideline - American Urological Association. .
- Gharibvand MM, Kazemi M, Motamedfar A, Sametzadeh M, Sahraeizadeh A. The role of ultrasound in diagnosis and evaluation of bladder tumors. J Family Med Prim Care 2017; 6 (4): 840–843. DOI: 10.4103/jfmpc.jfmpc_186_17.
- Berretini A, Castagnetti M, Salerno A. Bladder urothelial neoplasms in pediatric age: Experience at three tertiary centers. Journal of Pediatric Urology 2015; 11: 26 1–26 5. DOI: 10.1016/j.jpurol.2014.08.008.
- D DC, A F, K P. Management and follow-up of urothelial neoplasms of the bladder in children: A report from the TREP project. Pediatric Blood & Cancer 2015; 62 (6): 1000–1003. DOI: 10.1002/pbc.25380.
- ElSharnoby O, Fraser N, Williams A, Scriven S, Shenoy M. Bladder urothelial cell carcinoma as a rare cause of haematuria in children: Our experience and review of current literature. Journal of Pediatric Surgery Published Online September 2021; 17. DOI: 10.1016/j.jpedsurg.2021.09.007.
- Saltsman JA, Malek MM, Reuter VE. Urothelial neoplasms in pediatric and young adult patients: A large single-center series. Journal of Pediatric Surgery 2018; 53 (2): 306–309. DOI: 10.1016/j.jpedsurg.2017.11.024.
- Rague JT, High-grade LRSM. Nonmuscle Invasive Urothelial Carcinoma in a Prepubertal Patient With TURBT and Intravesical BCG. Urology 2019; 124: 257–259. DOI: 10.1016/j.urology.2018.10.028.
- Peard L, Stark T, Ziada A, Saltzman AF. Recurrent Bladder Cancer in a Teenage Male. Urology 2020; 141: 135–138. DOI: 10.1016/j.urology.2020.04.031.
- Soergel TM, Cain MP, Misseri R, Gardner TA, Koch MO, Rink RC. TRANSITIONAL CELL CARCINOMA OF THE BLADDER FOLLOWING AUGMENTATION CYSTOPLASTY FOR THE NEUROPATHIC BLADDER. The Journal of Urology 2004; 172 (4, Supplement): 1649–1652. DOI: 10.1097/01.ju.0000140194.87974.56.
- Austin JC, Elliott S, Cooper CS. Patients With Spina Bifida and Bladder Cancer: Atypical Presentation, Advanced Stage and Poor Survival. The Journal of Urology 2007; 178 (3): 798–801. DOI: 10.1016/j.juro.2007.05.055.
- Rove K, Higuchi T. Monitoring and malignancy concerns in patients with congenital bladder anomalies. Current Opinion in Urology 2016; 26 (4): 344–350. DOI: 10.1097/MOU.0000000000000297.
- Husmann D, Fox J, Higuchi T. Malignancy following bladder augmentation:recommendations for long-term follow-up and cancer screening. AUA Update Ser 2011; 30 (24): 222–227.
- Higuchi TT, Fox JA, Husmann DA. Annual Endoscopy and Urine Cytology for the Surveillance of Bladder Tumors After Enterocystoplasty for Congenital Bladder Anomalies. The Journal of Urology 2011; 186 (5): 1791–1795. DOI: 10.1016/j.juro.2011.07.028.
- Hamid R, Greenwell TJ, Nethercliffe JM, Freeman A, Venn SN, Woodhouse CRJ. Routine surveillance cystoscopy for patients with augmentation and substitution cystoplasty for benign urological conditions: is it necessary? BJU International 2009; 104 (3): 392–395. DOI: 10.1111/j.1464-410X.2009.08401.x.
- Kokorowski PJ, Routh JC, Borer JG, Estrada CR, Bauer SB, Nelson CP. Screening for Malignancy After Augmentation Cystoplasty in Children With Spina Bifida: A Decision Analysis. The Journal of Urology 2011; 186 (4): 1437–1443. DOI: 10.1016/j.juro.2011.05.065.
Dernière mise à jour: 2025-09-22 07:59