34: Autres anomalies péniennes
Ce chapitre prendra environ 18 minutes de lecture.
Introduction
Ce chapitre se propose d’aborder d’autres affections péniennes pouvant être rencontrées (en dehors de l’hypospadias) et susceptibles de justifier une intervention ou une correction chirurgicales. Il s’agit notamment de la chordée, de la torsion pénienne, du pénis enfoui et du mégaprépuce congénital.
La chordée et la torsion pénienne peuvent être associées à l’hypospadias ou à d’autres affections urologiques ; ou constituer une entité isolée. Le terme chordée congénitale a été utilisé de manière interchangeable dans la littérature pour désigner la chordée sans hypospadias, l’urètre court congénital et la courbure pénienne congénitale. Snodgrass a proposé que ‘chordée sans hypospadias’ soit remplacée par ‘courbure pénienne congénitale’ et ce terme sera employé ainsi tout au long de ce chapitre.1 Il existe différents degrés de courbure pénienne congénitale. Celle-ci peut être ventrale, dorsale et latérale, ou une combinaison des trois.
La torsion pénienne est une rotation anormale de la hampe pénienne qui survient le plus souvent dans le sens inverse des aiguilles d’une montre. La courbure pénienne congénitale et la torsion pénienne ont également été rapportées comme survenant simultanément.2
Il existe des présentations variées du pénis enfoui ou du mégaprépuce congénital. Ces affections se présentent selon un spectre variable et sont souvent confondues avec un micropénis; toutefois, la taille du pénis est généralement normale. Le motif de consultation peut être une difficulté à uriner liée au piégeage urinaire chez les garçons présentant un mégaprépuce congénital. De nombreux termes et descripteurs ont été utilisés pour décrire cette affection : caché, dissimulé, peu apparent, invisible, enclavé, et pénis enfoui, entre autres. Ces termes génériques englobants correspondent à la description de l’aspect du pénis mais ne définissent pas nécessairement la cause anatomique.3 Comme pour sa nomenclature, de nombreuses approches pour sa correction ont été décrites.
Embryologie
Au cours de sa croissance, les organes génitaux externes se développent rapidement, ce qui peut entraîner d’importantes variations morphologiques.4 Entre la 4e et la 7e semaine de gestation, le tubercule génital se forme par migration du mésenchyme d’origine mésodermique vers la région crâniale de la membrane cloacale. La région caudale de la membrane cloacale forme les plis urogénitaux. La membrane cloacale est une structure à double couche, comportant un endoderme et un ectoderme. À partir de la 7e semaine de gestation, la différenciation génitale externe du sexe masculin survient. Elle s’achève vers 16–17 semaines de gestation. Le gène SRY sur le chromosome Y oriente le développement des cordons sexuels primitifs vers la formation des testicules. Les cellules de Leydig au sein des testicules produisent de la testostérone, qui est convertie en dihydrotestostérone pour favoriser le développement des organes génitaux externes mâles.5
Chez le fœtus mâle, les androgènes induisent la différenciation du mésoderme du tubercule génital en corps caverneux et en gland du pénis. L’urètre pénien proximal résulte de la tubularisation de l’endoderme. À l’inverse, l’urètre pénien distal résulte d’une recanalisation.6 Au cours de la 8e semaine de gestation, l’ectoderme se différencie en peau pénienne et en prépuce. Bellinger et Kaplan ont démontré que la courbure pénienne constitue un état normal du développement, se résolvant au plus tard à la 16e semaine de gestation,7,8
Courbure congénitale de la verge
Historique
Nesbit a décrit pour la première fois trois cas de courbure pénienne congénitale en 1965. Il a suggéré que cette affection était secondaire à des longueurs fasciales disproportionnées entourant les corps caverneux.9
La torsion pénienne congénitale a été décrite pour la première fois par Verneuil en 1857. À l’époque, l’intervention chirurgicale était déconseillée, car les tentatives de mobiliser la peau ne permettaient pas de corriger l’alignement hélicoïdal des corps caverneux. En 1947, Fevre a décrit une technique de correction de la torsion pénienne, consistant à désinsérer les piliers des corps caverneux du pubis et à les réinsérer en position normale.10,11
Épidémiologie
Les premières publications ont indiqué que la courbure pénienne congénitale survient chez 4–10% des hommes.12,13 L’incidence de la courbure dorsale est faible en l’absence d’hypospadias, des taux de ~5% ayant été rapportés.14
L’incidence de la torsion pénienne congénitale varie de 1,5–27 %.15,16 Une torsion pénienne significative de plus de 90 degrés est moins fréquente, touchant 0,7 % des nouveau-nés de sexe masculin.16
Pathogénie
En 1937, Young a émis l’hypothèse que la courbure pénienne était secondaire à un urètre congénitalement court. Un développement anormal du fascia périurétral a été proposé par Devine et Horton comme cause.17 Kramer a proposé que la disproportion des corps caverneux était à l’origine de la courbure pénienne.13 Dans leur série, Donnahoo a noté une courbure pénienne secondaire au bridage de la peau et du dartos comme cause la plus fréquente (65%), une disproportion des corps caverneux (28%) et un urètre congénitalement raccourci (7%). Cette étude a rapporté des taux de courbure ventrale (84%), dorsale (11%) et latérale (5%).12 L’étude histopathologique de la plaque urétrale a démontré l’absence de fibrose et de dysplasie dans des prélèvements effectués en peropératoire.18 Ces données, toutefois, réfutent la théorie selon laquelle des brides fibreuses seraient responsables de la courbure pénienne. Un arrêt du développement pénien alors que le pénis présente une courbure physiologique a également été proposé comme cause de la persistance de la courbure pénienne.7
Une courbure dorsale acquise peut survenir à la suite d’une rétraction cicatricielle ou d’une cicatrisation anormale après une circoncision.19
L’étiologie exacte de la torsion pénienne congénitale est inconnue. Les théories proposées incluent une fixation cutanée anormale, un développement asymétrique des corps caverneux, et un défaut de rotation des corps caverneux ou du gland.11,20
Évaluation et diagnostic
Chez le garçon atteint d’hypospadias, la présence d’une courbure pénienne congénitale et d’une torsion est fréquemment évaluée en peropératoire à la suite d’une épreuve d’érection artificielle.
Chez les enfants sans hypospadias, c’est souvent l’observation parentale qui attire l’attention sur une courbure pénienne. Pendant l’adolescence, la courbure pénienne devient évidente lors des érections naturelles. Une autre circonstance pouvant conduire à la détection de ces affections est leur découverte fortuite lors d’un examen médical de routine. Une torsion peut être suspectée si le raphé pénien s’écarte de la ligne médiane. La présence de ces affections est toutefois moins évidente chez les enfants présentant un phimosis physiologique. L’évaluation en consultation peut également être limitée par une faible coopération du patient et par l’habitus corporel.19 L’évaluation peropératoire de la courbure pénienne est réalisée par un test d’érection artificielle.
Une classification opératoire de la courbure pénienne congénitale a été proposée par Devine et Horton en trois catégories. Groupe I, secondaire à une insuffisance du corps spongieux, du dartos et du fascia de Buck ; Groupe II dû à une déficience du dartos et du fascia de Buck ; et Groupe III ne concernait que le fascia de Dartos.17 Ce système de classification a été étendu pour inclure le Groupe IV, représentatif d’une disproportion des corps caverneux.13 Une autre classification opératoire, proposée par Donnahoo et al, décrivait trois types de courbure pénienne congénitale ; le Type I est une courbure secondaire à un bridage cutané (Figure 1) et (Figure 2) le Type II est dû à une chordée fasciale, et le Type III résulte d’une disproportion des corps caverneux.12
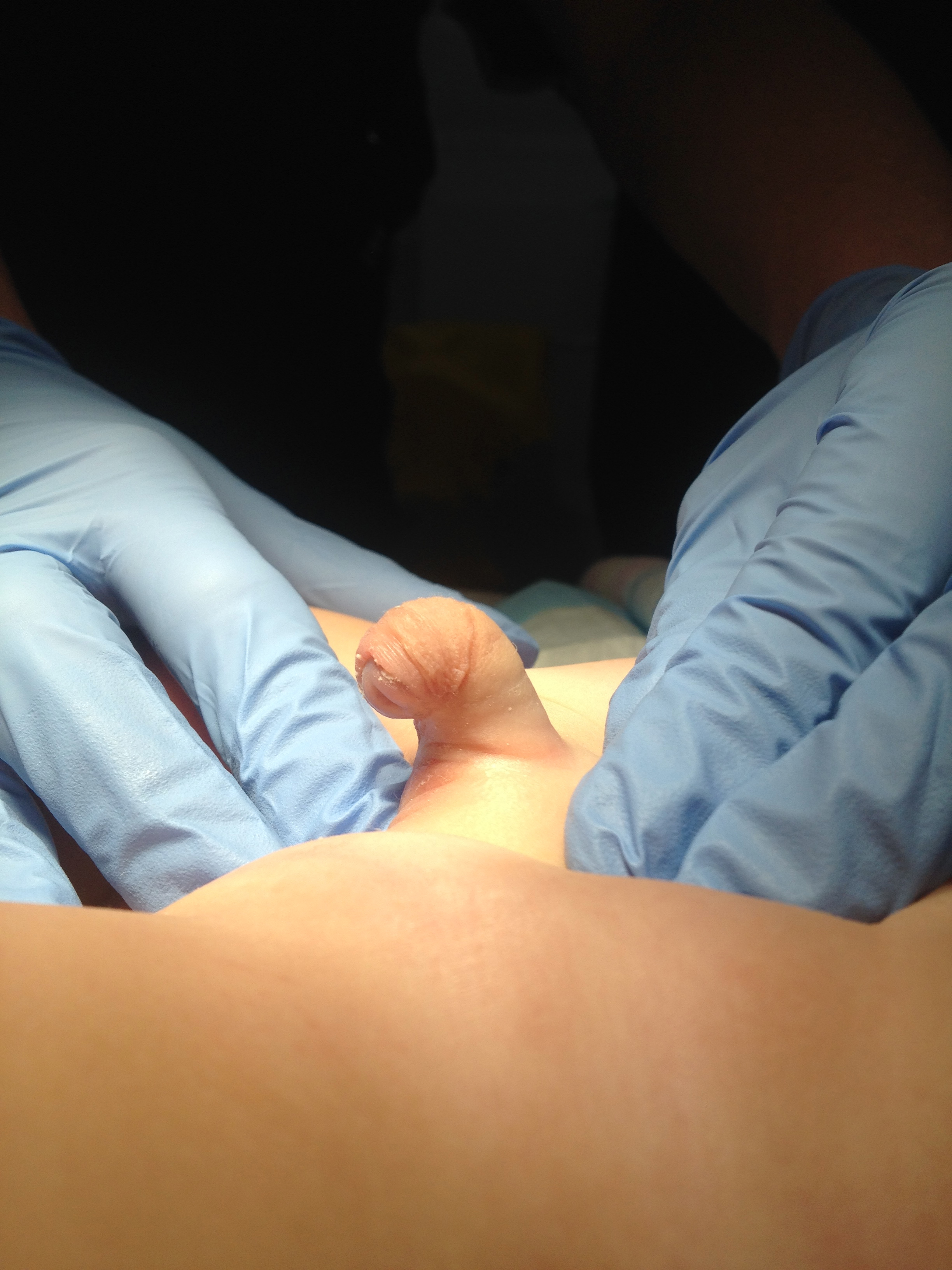
Figure 1 Courbure de type 1 avec prépuce en capuchon et méat urétral apical.
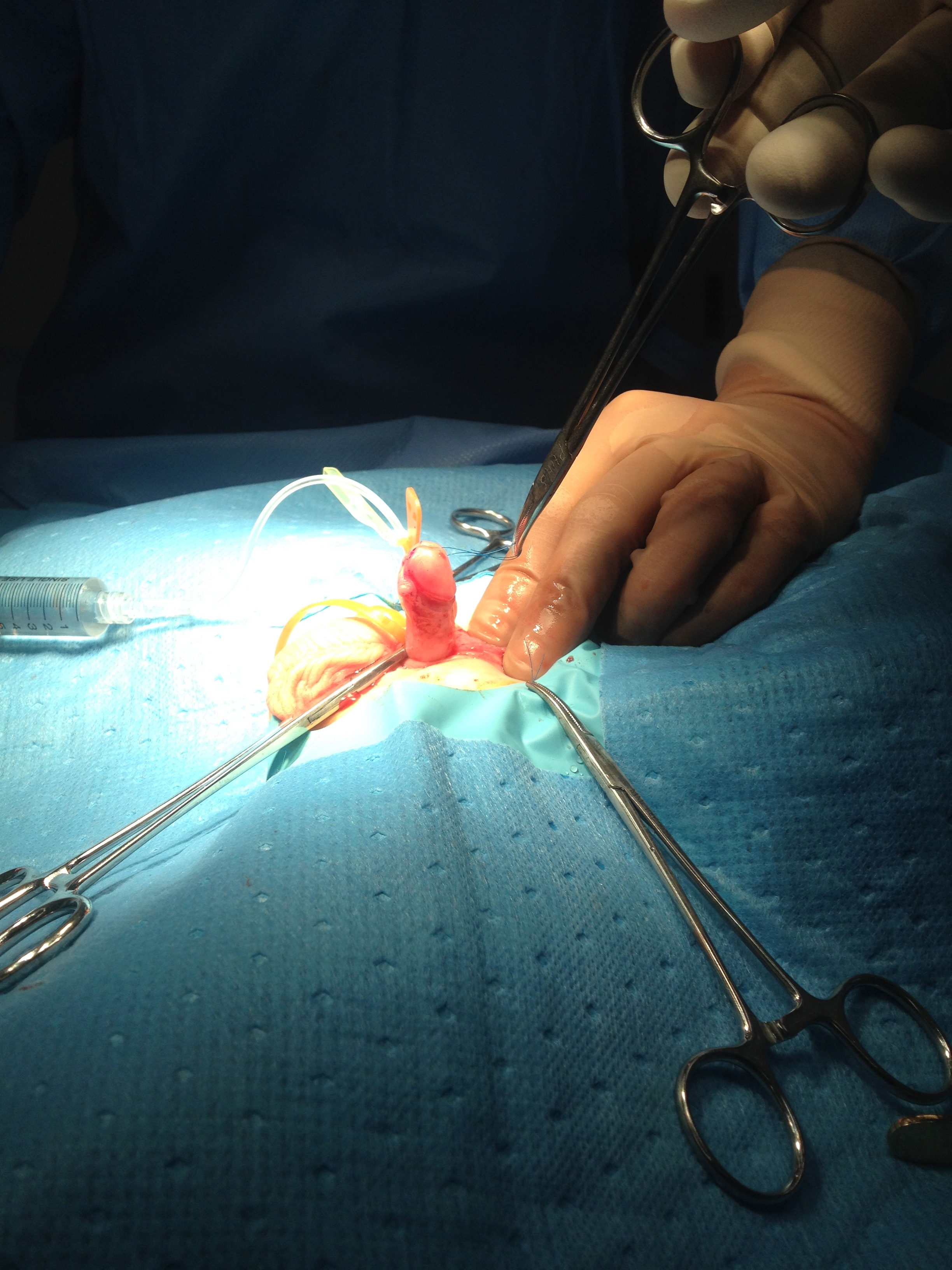
Figure 2 Test d’érection après dégantage montrant une courbure corrigée.
Options de traitement
En cas de diagnostic précoce, la correction chirurgicale de la courbure pénienne congénitale devrait idéalement être réalisée au cours de la première année de vie.21 Les options chirurgicales pour la prise en charge de la courbure pénienne dépendent de la gravité, en privilégiant, dans un premier temps, la technique la moins invasive.19 Une enquête auprès d’urologues pédiatres menée par l’AAP a constaté qu’une courbure pénienne jusqu’à 10 degrés était fréquemment laissée sans traitement. Une courbure pénienne supérieure à 20–30 degrés nécessite une intervention; ce degré de sévérité a donc été qualifié de chordée significative.22,23 L’enquête a montré que toute courbure pénienne inférieure à 50 degrés était souvent prise en charge par plicature dorsale, tandis qu’une courbure supérieure à 50 degrés nécessitait le plus souvent une procédure d’allongement ventral.22
En présence d’une bascule du gland, une libération initiale du frein est recommandée comme première étape. Le pénis est déganté jusqu’à sa base afin de traiter le bridage cutané. Un test d’érection artificielle est réalisé pour mettre en évidence une courbure pénienne persistante. Une plicature est proposée pour une courbure pénienne résiduelle jusqu’à 30 degrés.1 La technique de Nesbit fut l’une des premières méthodes de correction de la courbure pénienne. Elle consistait en une dissection du paquet vasculo-nerveux dorsal des corps caverneux, suivie d’une plicature de la tunique albuginée pour corriger la disproportion de longueur existante par rapport au versant ventral. Cette technique a été ensuite modifiée après l’observation de récidives et a consisté en l’excision d’un coin en losange au site de courbure maximale, avec apposition transverse des berges de la tunique.9 Des études neuroanatomiques ont montré que les branches nerveuses destinées au pénis sont situées à 11 h et 1 h et se répartissent ventralement.5 En conséquence, une plicature dorsale médiane est réalisée à 12 h en évitant le paquet vasculo-nerveux. Cette zone est également la région la plus épaisse et la plus résistante de la tunique.21,24 Le choix entre un point de plicature unique ou plusieurs points de plicature relève du chirurgien.
Il existe diverses techniques pour prendre en charge une courbure pénienne supérieure à 30 degrés, notamment la section de la plaque urétrale, la corporotomie ventrale (avec ou sans greffe du défaut des corps caverneux) et l’urétroplastie en plusieurs temps.1,13 Cela permet un allongement ventral pour corriger la disproportion des corps caverneux. La première greffe dermique a été décrite par Devine et Horton.17
Pour éviter la section de la plaque urétrale, Mollard et Castagnola ont proposé la dissection de l’urètre des corps caverneux sous-jacents en plus d’une plicature dorsale.25 De même, la dissection de l’urètre des corps caverneux a été réalisée et étendue jusqu’à l’urètre bulbaire.26
La courbure pénienne congénitale a été traitée par Donnahoo et al au moyen d’une mobilisation complète de l’urètre avec greffe dermique ventrale.12 Cela était similaire à l’expérience de Tang chez jusqu’à un quart de ses patients.23
D’autres techniques pour prendre en charge les présentations complexes de chordée associée à l’hypospadias ou à l’épispadias comprennent la dissociation des corps caverneux et le désassemblage pénien avec greffe de sous-muqueuse de l’intestin grêle,27,28,29,30
Une modification des techniques Shaeer I et II précédentes consistait en une rotation des corps caverneux avec fixation par sutures sans corporotomie.31
La correction de la torsion pénienne est considérée comme une intervention à visée esthétique, le pénis restant fonctionnellement acceptable. Certains auteurs ont préconisé la réparation de la torsion pénienne si le degré de torsion dépasse 45 degrés. Plusieurs options chirurgicales existent pour la correction de la torsion pénienne. Une approche opératoire en étapes a été proposée, comprenant un dégantage pénien, un large lambeau de rotation basé sur le dartos, la mobilisation de la plaque urétrale et du corps spongieux, la mobilisation de l’urètre proximal, et la mobilisation de la plaque urétrale/de l’urètre hypoplasique avec le corps spongieux jusque dans le gland.32,33 Une méthode supplémentaire décrite consiste à suturer latéralement la tunica albuginea au périoste pubien.20 Certains ont décrit un dégantage pénien avec réattachement cutané, toutefois ces résultats n’ont pas toujours été concluants.20
Complications
Les complications après la correction de la courbure pénienne varient de 5 % à 50 % selon la sévérité de la courbure, avec un taux global de 8 % et comprennent la déhiscence du gland, une fistule uréthrocutanée, une récidive de courbure et la dysfonction érectile étant la plus fréquente,23,12,34
Les complications de la correction de la torsion pénienne comprennent l’hématome, la torsion pénienne résiduelle et une diminution de la satisfaction des parents ou du patient.35
Suivi recommandé et résultats
Le premier contrôle postopératoire en consultation externe peut varier de six à douze semaines, selon la préférence du chirurgien. Concernant la courbure pénienne, l’évaluation se fait par l’observation par les parents et/ou par le patient des érections naturelles, en plus de l’examen physique en consultation externe. Il existe peu d’études portant sur la durée appropriée du suivi postopératoire.23
Mégaprépuce congénital
Historique
La première description publiée du pénis enfoui a été faite par Keyes en 1919, où il a décrit que l’affection survenait parce que le pénis manquait de sa ‘gaine cutanée’ adéquate et restait ‘enfoui sous le tégument de l’abdomen, de la cuisse ou du scrotum’.36,37 Depuis 1919, plusieurs rapports de cas documentés et des discussions sur ce sujet ont été publiés, les premiers contributeurs ayant posé les bases des travaux plus importants réalisés au cours des vingt à trente dernières années. Campbell en 1951 a décrit “pénis dissimulé” comme “un organe rudimentaire caché sous la peau du scrotum, du périnée, de la partie inférieure de l’abdomen ou de la cuisse dans des tissus adipeux pouvant être exceptionnellement épais”, Glanz en 1968 a rapporté un cas chez un adulte, Warkany en 1971 a décrit un “micropénis ou pénis dissimulé”. Williams en 1974 a décrit et illustré par un exemple. En 1977, outre la description de ses six cas, Crawford a proposé la première classification du pénis enfoui.38
Fait intéressant, deux rapports de référence précoces comprenaient des études radiologiques. En 1974, Gwinn et ses collègues ont décrit, dans leur “cas radiologique du mois”, un garçon de 18 mois qui a bénéficié d’une urographie intraveineuse dans le cadre du bilan d’extension d’un lymphome de Hodgkin. Au cours de la phase mictionnelle, ils ont noté que “l’ensemble du produit de contraste présent dans sa vessie descendait pour former une spectaculaire distension bulbeuse du prépuce”.
Bien que non spécifiquement nommé, leur rapport fournit probablement la première description d’un mégaprépuce.39,40 Vingt ans plus tard, en 1994, O’Brien et al ont rapporté le cas d’un garçon de onze mois chez qui l’on avait noté une “volumineuse tuméfaction sphéroïde, de la taille d’une orange environ” et comment sa mère “a montré comment la tuméfaction pouvait être facilement dégonflée par compression manuelle”. À l’urétroscopie, ils n’ont pas réussi à trouver le méat en raison du prépuce redondant. Un cathéter sus-pubien a été mis en place et une cystographie mictionnelle a été réalisée. Outre la mise en évidence d’une vessie et d’un urètre normaux, il a été noté que le produit de contraste s’écoulait dans une grande vessie préputiale dont la capacité était aussi grande que celle de sa vessie urinaire”. Ils ont forgé le terme mégaprépuce congénital pour décrire cela, ce qui en constituait la première utilisation documentée,40,41
Épidémiologie
L’incidence exacte du pénis inapparent est inconnue. Cependant, il a été proposé qu’il s’agisse d’une entité clinique émergente.42 Dans une revue récente de la littérature, le nombre de cas variait de 1 à 134 patients, avec des âges allant de 2 mois à 33 ans. En moyenne, l’intervention chirurgicale était réalisée avant l’âge de 24 mois.43
Pathogénie
Le pénis peu apparent peut se développer du fait de multiples facteurs plutôt que d’un seul. Ceux-ci peuvent inclure un déficit de peau pénienne, une attache anormale de la peau de la verge à la base du pénis, une peau pénienne tractée vers l’avant en raison d’un dartos dysgénésique et un bourrelet adipeux prépubien proéminent. Les causes secondaires résultent de complications de fibrose cicatricielle après circoncision ou d’une hernie ou d’une hydrocèle volumineuse.44
L’étiologie exacte du mégaprépuce congénital n’est pas comprise, mais la théorie la plus largement proposée est qu’il résulte des effets de bridage d’un dartos anormal sur le corps du pénis. Cela est étayé par les premières approches de la correction du pénis enfoui, qui ont noté que la correction du défaut était obtenue avec succès par la résection du tissu dartos. Une étude prospective examinant l’histologie du dartos a noté que près de 80 % des patients présentaient un tissu dartos anormal, soit avec des fibres musculaires lisses peu développées, soit avec des fibres musculaires lisses distribuées de manière aléatoire. Fait intéressant, les patients présentant un pénis enfoui étaient plus susceptibles d’avoir un dartos anormal par rapport au groupe des hypospadias (78 % contre 70 %).45 L’augmentation du volume d’urine produit après la période néonatale et un jet mictionnel anormal dû à un orifice préputial étroit sont les facteurs qui contribuent à l’effet de ballonisation de l’affection.46
Évaluation et diagnostic
Il est important de distinguer un pénis de taille normale mais enfoui d’un micropénis. Il s’agit de la première évaluation nécessaire, car la prise en charge est assez différente pour ces deux situations. Dans le premier cas, des soins continus et, très probablement, une intervention chirurgicale avec l’urologue seront nécessaires, tandis que dans le second, une évaluation plus poussée et une prise en charge conjointe avec les équipes d’endocrinologie et de génétique seront requises. Ce chapitre n’abordera pas la prise en charge du micropénis.
Crawford a d’abord classé le pénis caché en dissimulé, enfoui et palmure pénoscrotale.38 Maizels et al ont décrit les différentes étiologies comme : enfoui, palmuré, piégé ou micro/ diminué. Cette classification a été la plus largement utilisée car elle englobe les groupes auxquels l’enfant peut appartenir sur la base de l’examen clinique.47 En décrivant leur approche chirurgicale (V-plastie ventrale) pour la correction du mégaprépuce congénital, Alexander et ses collègues ont proposé une classification avec une description anatomique plus précise et la cause sous-jacente potentielle (Figure 3), (Figure 4), (Figure 5), (Figure 6), et (Figure 7)3
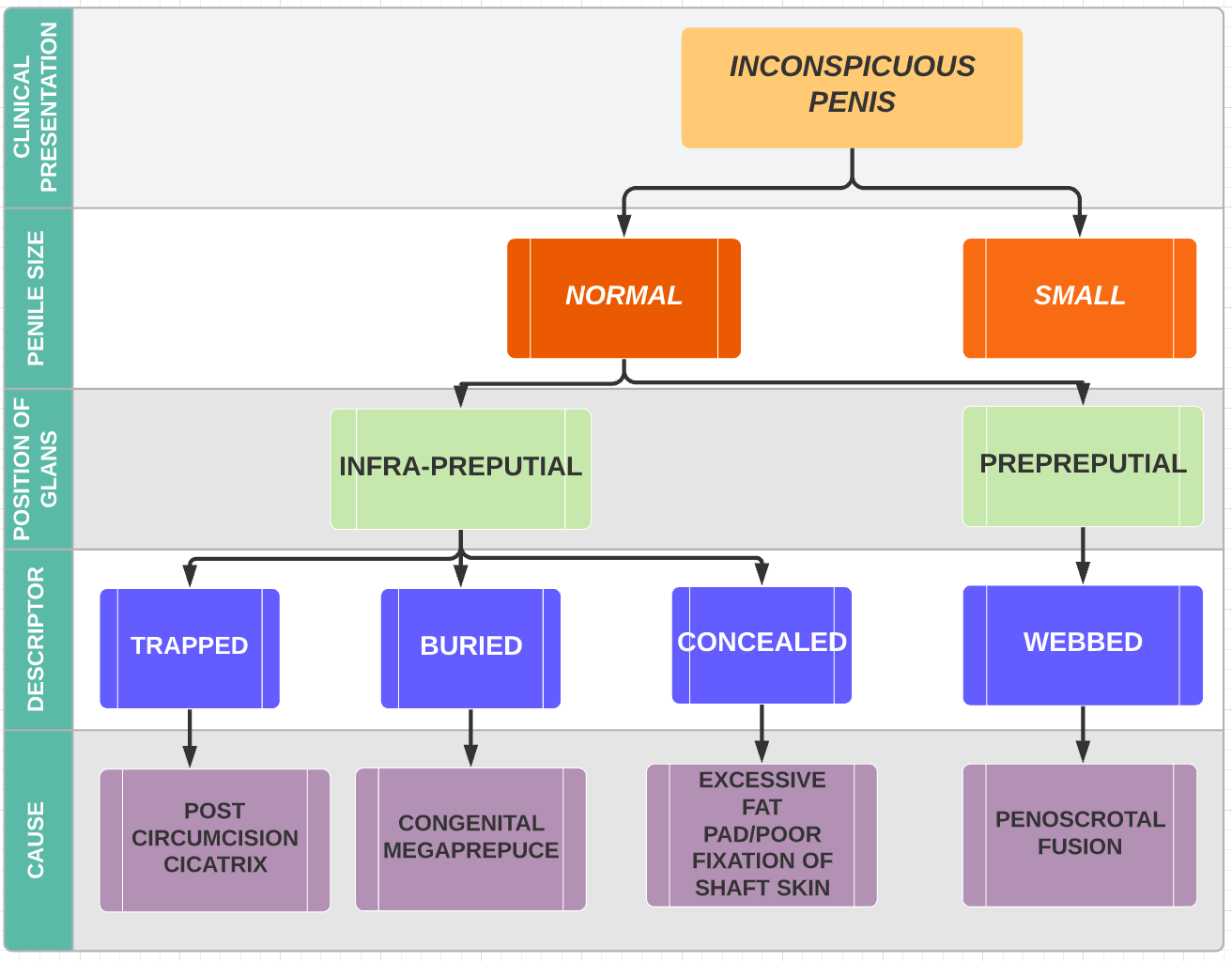
Figure 3 Classification des causes d’un pénis peu apparent (Alexander et al).
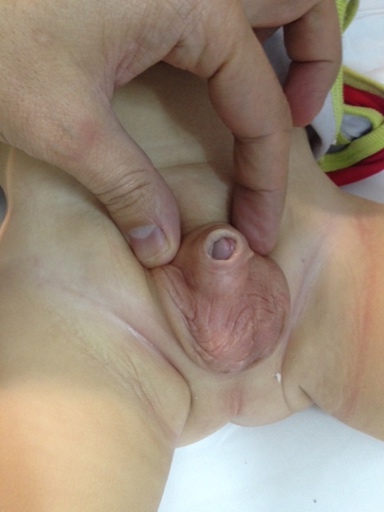
Figure 4 Pénis emprisonné après circoncision
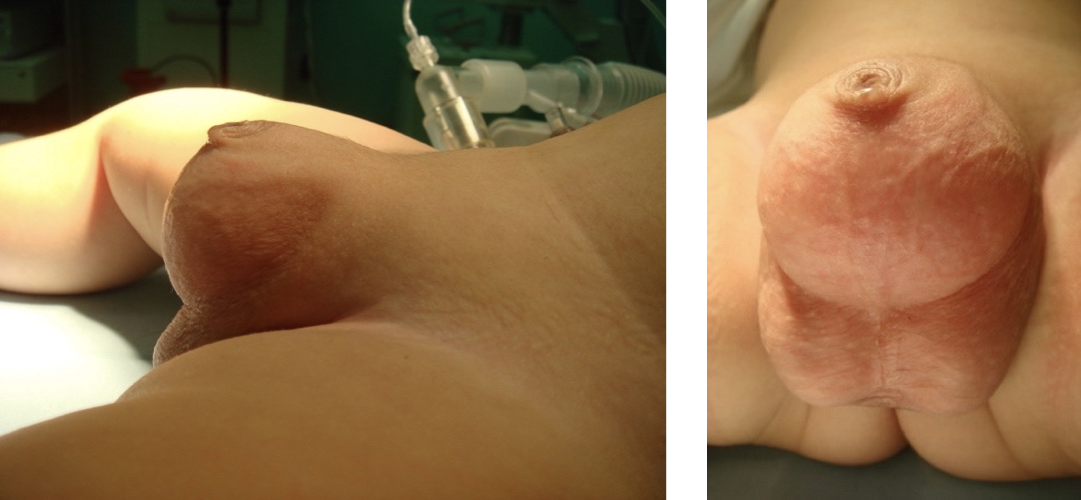
Figure 5 Mégaprépuce congénital

Figure 6 Pénis enfoui
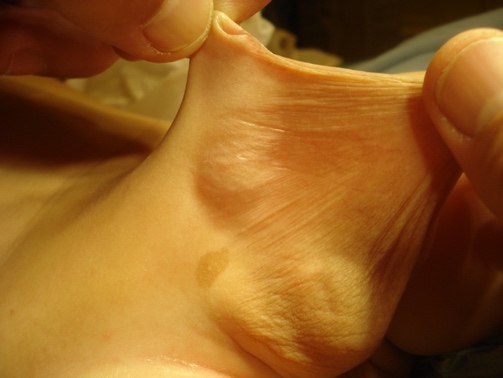
Figure 7 Fusion pénoscrotale
Hadidi a proposé de répartir les patients présentant un pénis enfoui en trois groupes selon les constatations peropératoires. Grade 1 – patients avec un feuillet interne du prépuce anormalement long (LIP), Grade 2 – LIP et insertions distales anormales des ligaments fundiforme et suspenseur du pénis au niveau de la portion médiane de la hampe pénienne, Grade 3 – Grades 1 et 2 plus excès de graisse sus-pubienne.37
Options de traitement
De multiples approches chirurgicales ont été décrites pour le désenfouissement et la correction de ce groupe d’affections. Le moment exact de la chirurgie a fait l’objet de controverses et est essentiellement influencé par la cause sous-jacente. Les partisans d’une intervention précoce avancent des raisons similaires à celles invoquées pour le calendrier de la réparation de l’hypospadias – une intervention précoce (6-12 mois) est recommandée afin d’éviter des conséquences psychologiques.44,48 Les patients symptomatiques (rétention urinaire, balanites récidivantes, infections des voies urinaires) bénéficieront d’une chirurgie plus précoce. D’autres auteurs recommandent une correction chirurgicale dès que le diagnostic est posé afin de résoudre à la fois les aspects urinaires et esthétiques,49,50 En revanche, la correction d’un pénis enfoui résultant d’un bourrelet adipeux prépubien proéminent peut être différée, car cela peut s’améliorer spontanément avec le temps, Donahoe et Keating ont décrit qu’une couverture cutanée adéquate de la hampe pénienne était observée lors des érections.51
Il existe un ensemble de publications et de techniques qui décrivent la correction du mégaprépuce congénital.3,42,43,46,52 Les principales étapes chirurgicales sont énumérées ci-dessous, avec des variations dans la manière dont chaque étape est réalisée, ce qui conduit à la diversité des techniques. Elles peuvent être classées principalement en une approche en un temps (majorité des techniques) ou en deux temps. Dans ce dernier cas, une préputioplastie est initialement réalisée, avec une réévaluation ultérieure de l’anatomie après l’acquisition de la propreté.
Les étapes opératoires sont:
- Ablation de l’anneau sténosé ou phimotique
- Dépliement du prépuce
- Résection ou réduction du feuillet interne redondant du prépuce
- Exérèse du muscle dartos dysplasique
- Reconstruction des angles pénopubien et pénoscrotal en fixant le derme de la hampe à la fascia de Buck à 4 et 8 heures
- Couverture de la hampe pénienne–la plupart des techniques diffèrent par le tissu utilisé pour couvrir la hampe pénienne. Cela peut être réalisé en utilisant la peau pénienne, le feuillet interne du prépuce redondant, ou une combinaison des deux.
Nous préférons utiliser l’approche anatomique, car nous avons obtenu de bons résultats dans notre expérience (Figure 8),52,53
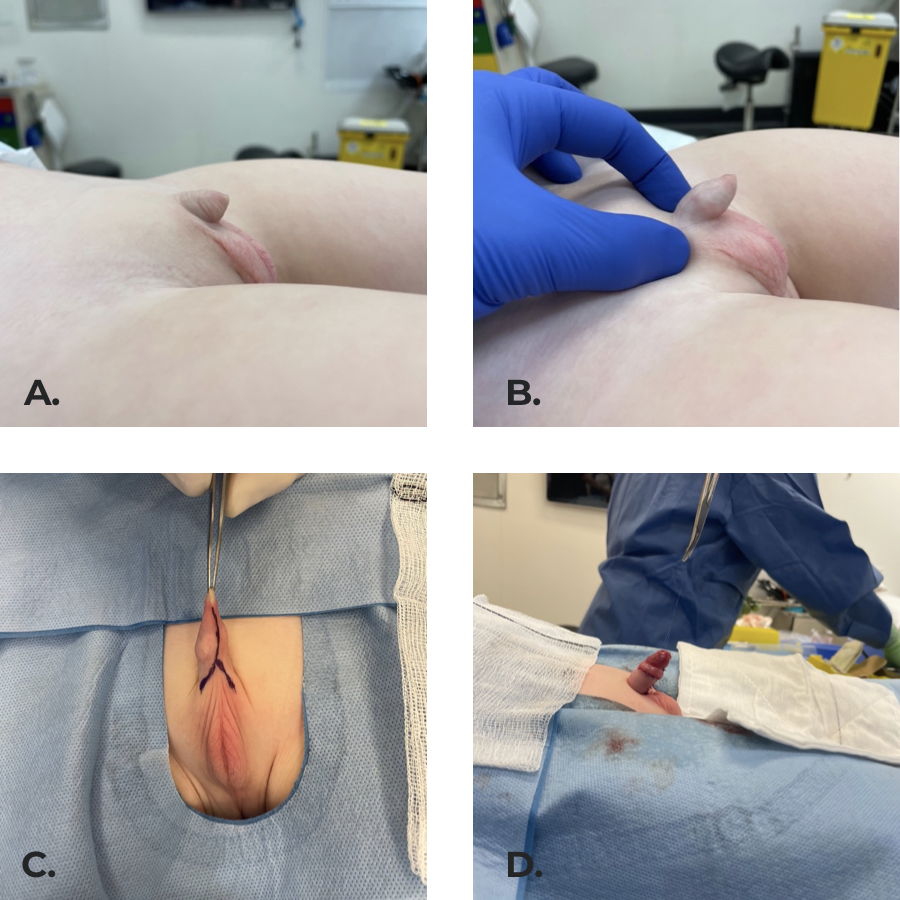 Figure 8 Pénis enfoui secondaire à une fusion pénoscrotale et à un angle pénopubien mal défini. (b) pénis extériorisé lors de l’examen. (c) Incisions chirurgicales marquées. (d) Résultat final avec la hampe pénienne recouverte de peau, les angles pénopubien et pénoscrotal créés en fixant le derme au fascia de Buck à 4 et 8 heures.
Figure 8 Pénis enfoui secondaire à une fusion pénoscrotale et à un angle pénopubien mal défini. (b) pénis extériorisé lors de l’examen. (c) Incisions chirurgicales marquées. (d) Résultat final avec la hampe pénienne recouverte de peau, les angles pénopubien et pénoscrotal créés en fixant le derme au fascia de Buck à 4 et 8 heures.
Complications
Les complications postopératoires à court terme sont l’hématome, la déhiscence de la plaie et l’œdème pénien / scrotal. Les complications à moyen et à long terme comprennent la nécessité d’une reprise chirurgicale en raison d’un lymphœdème entraînant un excès du feuillet interne du prépuce, une sténose du méat et une rétraction du pénis,3,42,46,52,54
Suivi recommandé et résultats
Étant donné que certaines des complications ont été rapportées plus tard au cours de la vie, un suivi à long terme est recommandé pour ces patients. Shalaby et Cascio ont rapporté une durée médiane de suivi de 17 à 61 mois.40
Conclusions
Les affections péniennes congénitales sont peu fréquentes; il est donc recommandé d’orienter le patient vers un urologue pédiatrique pour un diagnostic et une prise en charge appropriés.
Points clés
- La correction chirurgicale est recommandée pour une courbure pénienne congénitale supérieure à 20 degrés
- Une approche par étapes avec protection des structures neurovasculaires et préservation de la plaque urétrale est privilégiée lors de la réparation d’une courbure pénienne (sans hypospadias)
- Envisager la correction d’une torsion pénienne supérieure à 45 degrés
- L’exérèse du dartos dysplasique et la fixation cutanée au fascia de Buck sont des étapes clés lors de la correction d’un mégaprépuce congénital
- Limiter l’excision cutanée afin de garantir une couverture adéquate de la hampe pénienne
- Une prise en charge initiale non opératoire est privilégiée pour le pénis enfoui
Lectures recommandées
- Mingin G, Baskin LS. Management of chordee in children and young adults. Urol Clin North Am 2002; 29 (2): 277–284, DOI: 10.1016/s0094-0143(02)00044-7.
- Smeulders N, Wilcox DT, Cuckow PM. The buried penis-an anatomical approach. BJU Int 2000; 86 (4): 523–526, DOI: 10.1046/j.1464-410x.2000.00752.x.
- Alexander A, Lorenzo AJ, Salle JLP, Rode H. The Ventral V-plasty: a simple procedure for the reconstruction of a congenital megaprepuce. J Pediatr Surg 2010; 45 (8): 1741–1747, DOI: 10.1016/j.jpedsurg.2010.03.033.
- Shalaby M, Cascio S. Megaprepuce: a systematic review of a rare condition with a controversial surgical management. Pediatr Surg Int 2021; 37 (6): 815–825, DOI: 10.1007/s00383-021-04883-5.
Références
- Snodgrass WT. Management of penile curvature in children. Curr Opin Urol 2008; 18 (4): 431–435, DOI: 10.1097/mou.0b013e32830056d0.
- Slawin KM, Nagler HM. Treatment of congenital penile curvature with penile torsion: a new twist. J Urol 1992; 147 (1): 152–154, DOI: 10.1016/s0022-5347(17)37169-0.
- Alexander A, Lorenzo AJ, Salle JLP, Rode H. The Ventral V-plasty: a simple procedure for the reconstruction of a congenital megaprepuce. J Pediatr Surg 2010; 45 (8): 1741–1747, DOI: 10.1016/j.jpedsurg.2010.03.033.
- Gredler ML. Evolution of external genitalia: insights from reptilian development. Sex Dev 2014; 8 (5): 311–326, DOI: 10.1159/000365771.
- Yiee JH, Baskin LS. Penile embryology and anatomy. ScientificWorldJournal 2010; 10: 1174–1179, DOI: 10.1100/tsw.2010.112.
- Baskin L. Development of the human penis and clitoris. Differentiation 2018; 103: 74–85, DOI: 10.1016/j.diff.2018.08.001.
- Kaplan GW, Lamm DL. Embryogenesis of chordee. J Urol 1975; 114 (5): 769–772, DOI: 10.1016/s0022-5347(17)67140-4.
- Bellinger MF. Embryology of the Male External Genitalia. Urologic Clinics of North America 1981; 8 (3): 375–382, DOI: 10.1016/s0094-0143(21)01293-3.
- Nesbit RM. CONGENITAL CURVATURE OF THE PHALLUS: REPORT OF THREE CASES WITH DESCRIPTION OF CORRECTIVE OPERATION. J Urol 1965; 93: 230–232, DOI: 10.1016/s0022-5347(17)63751-0.
- Fevre. Treatment of bends and twists of the penis. Sem Hop 1947; 23 (14): 895,.
- Azmy A, Eckstein HB. Surgical correction of torsion of the penis. Br J Urol 1981; 53 (4): 378–379, DOI: 10.1111/j.1464-410x.1981.tb03202.x.
- Donnahoo KK. Etiology, management and surgical complications of congenital chordee without hypospadias. J Urol 1998; 160 (3 Pt 2): 1120–1122, DOI: 10.1016/s0022-5347(01)62713-7.
- Kramer SA, Aydin G, Kelalis PP. Chordee without hypospadias in children. J Urol 1982; 128 (3): 559–561, DOI: 10.1016/s0022-3468(83)80141-9.
- Kelâmi A. Classification of Congenital and Acquired Penile Deviation. Urologia Internationalis 1983; 38 (4): 229–233, DOI: 10.1159/000280897.
- Sarkis PE, Sadasivam M. Incidence and predictive factors of isolated neonatal penile glanular torsion. J Pediatr Urol 2007; 3 (6): 495–499, DOI: 10.1016/j.jpurol.2007.03.002.
- Ben-Ari J, Merlob P, Mimouni F, Reisner SH. Characteristics of the male genitalia in the newborn: penis. J Urol 1985; 134 (3): 521–522, DOI: 10.1016/s0022-5347(17)47272-7.
- Devine CJ Jr, Horton CE. Chordee without hypospadias. J Urol 1973; 110 (2): 264–271, DOI: 10.1016/s0022-5347(17)60183-6.
- Snodgrass W, Patterson K, Plaire JC, Grady R, Mitchell ME. Histology of the urethral plate: implications for hypospadias repair. J Urol 2000; 164 (3 Pt 2): 988–989 989–990, DOI: 10.1097/00005392-200009020-00017.
- Montag S, Palmer LS. Abnormalities of penile curvature: chordee and penile torsion. ScientificWorldJournal 2011; 11: 1470–1478, DOI: 10.1100/tsw.2011.136.
- Zhou L, Mei H, Hwang AH, Xie H-W, Hardy BE. Penile torsion repair by suturing tunica albuginea to the pubic periosteum. J Pediatr Surg 2006; 41 (1): 7–9, DOI: 10.1016/j.jpedsurg.2005.10.065.
- Mingin G, Baskin LS. Management of chordee in children and young adults. Urol Clin North Am 2002; 29 (2): 277–284, DOI: 10.1016/s0094-0143(02)00044-7.
- Bologna RA, Noah TA, Nasrallah PF, McMahon DR. Chordee: varied opinions and treatments as documented in a survey of the American Academy of Pediatrics, Section of Urology. Urology 1999; 53 (3): 608–612, DOI: 10.1016/s0090-4295(98)00656-6.
- Tang Y-M, Chen S-J, Huang L-G, Wang M-H. Chordee without hypospadias: report of 79 Chinese prepubertal patients. J Androl 2007; 28 (4): 630–633, DOI: 10.2164/jandrol.106.002436.
- Baskin LS, Erol A, Li YW, Cunha GR. Anatomical studies of hypospadias. J Urol 1998; 160 (3 Pt 2): 1108–1115. DOI: 10.1016/s0022-5347(01)62711-3.
- Mollard P, Castagnola C. Hypospadias: the release of chordee without dividing the urethral plate and onlay island flap (92 cases. J Urol 1994; 152 (4): 1238–1240, DOI: 10.1016/s0022-5347(17)32557-0.
- Bhat A. Extended urethral mobilization in incised plate urethroplasty for severe hypospadias: a variation in technique to improve chordee correction. J Urol 2007; 178 (3 Pt 1): 1031–1035, DOI: 10.1016/j.juro.2007.05.074.
- Koff SA, Eakins M. The treatment of penile chordee using corporeal rotation. J Urol 1984; 131 (5): 931–932, DOI: 10.1016/s0022-5347(17)50716-8.
- Perovic SV, Djordjevic ML. A new approach in hypospadias repair. World J Urol 1998; 16 (3): 195–199, DOI: 10.1007/s003450050052.
- Ballesteros N. Use of small intestinal submucosa for corporal body grafting in cases of epispadias and epispadias/exstrophy complex. J Pediatr Urol 2019; 15 (4): 406 1–406 6, DOI: 10.1016/j.jpurol.2019.05.024.
- Castellan M, Gosalbez R, Devendra J, Bar-Yosef Y, Labbie A. Ventral corporal body grafting for correcting severe penile curvature associated with single or two-stage hypospadias repair. J Pediatr Urol 2011; 7 (3): 289–293, DOI: 10.1016/j.jpurol.2011.03.008.
- Shaeer O, Shaeer K. Shaeer’s Corporal Rotation III: Shortening-Free Correction of Congenital Penile Curvature-The Noncorporotomy Technique. Eur Urol 2016; 69 (1): 129–134, DOI: 10.1016/j.eururo.2015.08.004.
- Bhat A, Bhat MP, Saxena G. Correction of penile torsion by mobilization of urethral plate and urethra. J Pediatr Urol 2009; 5 (6): 451–457, DOI: 10.1016/j.jpurol.2009.05.013.
- Fisher PC, Park JM. Penile torsion repair using dorsal dartos flap rotation. J Urol 2004; 171 (5): 1903–1904, DOI: 10.1097/01.ju.0000120148.79867.5c.
- Badawy H, Morsi H. Long-term followup of dermal grafts for repair of severe penile curvature. J Urol 2008; 180 (4 Suppl): 1842–1845, DOI: 10.1016/j.juro.2008.04.082.
- Bar-Yosef Y, Binyamini J, Matzkin H, Ben-Chaim J. Degloving and realignment-simple repair of isolated penile torsion. Urology 2007; 69 (2): 369–371, DOI: 10.1016/j.urology.2007.01.014.
- Keyes EL, Others. Phimosis, paraphimosis, tumors of the penis. Urology 1919; 67: 649,.
- Hadidi AT. Buried penis: classification surgical approach. J Pediatr Surg 2014; 49 (2): 374–379, DOI: 10.1016/j.jpedsurg.2013.09.066.
- Crawford BS. Buried penis. Br J Plast Surg 1977; 30 (1): 96–99, DOI: 10.1016/s0007-1226(77)90046-7.
- Gwinn JL, Lee FA, Haber K. Radiological case of the month. Unusual presentation of phimosis. Am J Dis Child 1974; 128 (6): 835–836,.
- Shalaby M, Cascio S. Megaprepuce: a systematic review of a rare condition with a controversial surgical management. Pediatr Surg Int 2021; 37 (6): 815–825, DOI: 10.1007/s00383-021-04883-5.
- O’Brien A, Shapiro AM, Frank JD. Phimosis or congenital megaprepuce? Br J Urol 1994; 73 (6): 719–720, DOI: 10.1111/j.1464-410x.1995.tb07856.x.
- Summerton DJ, McNally J, Denny AJ, Malone PS. Congenital megaprepuce: an emerging condition-how to recognize and treat it. BJU Int 2000; 86 (4): 519–522, DOI: 10.1111/j.1464-410x.2001.0003c.x.
- Werner Z, Hajiran A, Al-Omar O. Congenital Megaprepuce: Literature Review and Surgical Correction. .
- Park NC, Kim SW, Moon DG. Penile Augmentation. Berlin, Heidelberg: Springer; 2016, DOI: 10.1007/978-3-662-46753-4.
- Spinoit A-F, Praet C, Groen L-A, Laecke E, Praet M, Hoebeke P. Congenital penile pathology is associated with abnormal development of the dartos muscle: a prospective study of primary penile surgery at a tertiary referral center. J Urol 2015; 193 (5): 1620–1624, DOI: 10.1016/j.juro.2014.10.090.
- Ruiz E. Simplified surgical approach to congenital megaprepuce: fixing, unfurling and tailoring revisited. J Urol 2011; 185 (6 Suppl): 2487–2490, DOI: 10.1016/j.juro.2011.01.015.
- Maizels M, Zaontz M, Donovan J, Bushnick PN, Firlit CF. Surgical correction of the buried penis: description of a classification system and a technique to correct the disorder. J Urol 1986; 136 (1 Pt 2): 268–271, DOI: 10.1016/s0022-5347(17)44837-3.
- Shapiro SR. Surgical treatment of the ’buried’ penis. Urology 1987; 30 (6): 554–559, DOI: 10.1016/0090-4295(87)90435-3.
- Ferro F, Spagnoli A, Spyridakis I, Atzori P, Martini L, Borsellino A. Surgical approach to the congenital megaprepuce. J Plast Reconstr Aesthet Surg 2006; 59 (12): 1453–1457, DOI: 10.1016/j.bjps.2005.12.033.
- Philip I, Nicholas JL. Congenital giant prepucial sac: case reports. J Pediatr Surg 1999; 34 (3): 507–508, DOI: 10.1016/s0022-3468(99)90515-8.
- Donahoe PK, Keating MA. Preputial unfurling to correct the buried penis. J Pediatr Surg 1986; 21 (12): 1055–1057, DOI: 10.1016/0022-3468(86)90007-2.
- Betancor CEL, Cherian A, Smeulders N, Mushtaq I, Cuckow P. Mid- to long-term outcomes of the ’anatomical approach’ to congenital megaprepuce repair. J Pediatr Urol 2019; 15 (3): 243 1–243 6, DOI: 10.1016/j.jpurol.2019.02.007.
- Hirsch K, Schwaiger B, Kraske S, Wullich B. Megaprepuce: presentation of a modified surgical technique with excellent cosmetic and functional results. J Pediatr Urol 2019; 15 (4): 401 1–401 6, DOI: 10.1016/j.jpurol.2019.05.018.
- Rod J, Desmonts A, Petit T, Ravasse P. Congenital megaprepuce: a 12-year experience (52 cases) of this specific form of buried penis. J Pediatr Urol 2013; 9 (6 Pt A): 784–788, DOI: 10.1016/j.jpurol.2012.10.010.
- Callewaert PRH, Rahnama’i MS, Guimarães MNC, Vrijens DMJ, Kerrebroeck PEVA. DOuble LOngitudinal Megapreputium Incision TEchnique: the DOLOMITE. Urology 2014; 83 (5): 1149–1154, DOI: 10.1016/j.urology.2013.12.014.
- Lin H-W. An arc incision surgical approach in congenital megaprepuce. Chin Med J 2015; 128 (4): 555–557, DOI: 10.4103/0366-6999.151117.
- Smeulders N, Wilcox DT, Cuckow PM. The buried penis-an anatomical approach. BJU Int 2000; 86 (4): 523–526, DOI: 10.1046/j.1464-410x.2000.00752.x.
Dernière mise à jour: 2025-09-22 07:59