31: Hypospadias distal
Ce chapitre prendra environ 23 minutes de lecture.
Introduction
Dans la littérature grecque antique, Aristote fut le premier à décrire la dysfonction urinaire résultant d’une malformation pénienne.1 Le médecin grec Galien est crédité d’avoir forgé le terme hypospadias dans les années 100 apr. J.-C.1 À l’instar de ses premiers descripteurs, l’étymologie du terme hypospadias est grecque, dérivant des racines hypo (au-dessous) et spadon (fente, fissure).
L’hypospadias est l’une des anomalies congénitales les plus fréquentes chez les nouveau-nés de sexe masculin. Il se caractérise par une position ventrale de l’orifice urétral avec arrêt du développement de la face ventrale du pénis, de l’urètre et du prépuce.2 Du fait de cet arrêt du développement, la tubulisation urétrale est incomplète, ce qui entraîne un orifice urétral ectopique sur la face ventrale du pénis. Selon la sévérité, l’hypospadias est souvent associé à une chordée ventrale (courbure pénienne) et à un déficit ventral du prépuce, aboutissant à un prépuce « en capuchon dorsal ». La localisation anatomique de l’orifice urétral est généralement utilisée pour la classification de l’hypospadias. Le méat hypospadique peut être situé n’importe où, du gland au périnée. Environ 50 % des hypospadias sont distaux (gland, coronal et sous-coronal), 30 % sont moyens (corps du pénis) et 20 % sont proximaux (pénoscrotal, scrotal et périnéal) (Figure 1).3,4 Ce chapitre se concentrera sur l’embryologie, l’épidémiologie, l’étiologie, le diagnostic, l’évaluation, la réparation, le suivi et les complications de l’hypospadias distal. L’hypospadias proximal est considéré comme une présentation plus sévère et sera traité dans un autre chapitre.
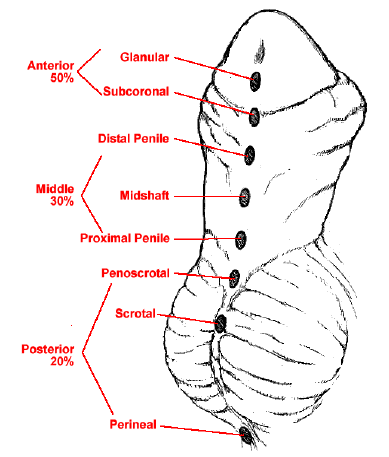
Figure 1 Spectre des présentations de l’hypospadias.4
Embryologie
Le développement des organes génitaux externes masculins débute à un stade ambisexué au cours de la cinquième semaine de gestation.5 Jusqu’aux septième et huitième semaines, le tubercule génital, le repli urogénital et les plis labioscrotaux sont identiques.5,6 La différenciation sexuelle commence pendant les semaines de gestation 8 et 9 lorsque l’expression du gène SRY initie la différenciation gonadique mâle, entraînant ainsi la production d’androgènes.5 Cependant, le développement pénien se déroule par des événements à la fois androgéno-indépendants et androgéno-dépendants.7,8 Les événements androgéno-indépendants sont communs aux deux sexes et comprennent la formation du tubercule génital, de la plaque urétrale, du sillon urétral, du gland, du prépuce et du corps caverneux.7 Les événements androgéno-dépendants comprennent la tubularisation urétrale, le développement circonférentiel du prépuce et l’allongement pénien.6,7,8
L’urètre masculin se développe selon un mécanisme de “double fermeture éclair” débutant à la 8e semaine de gestation.9,10 Dans ce processus, la fermeture éclair d’ouverture initiale implique la canalisation distale de la plaque urétrale pour former la gouttière urétrale. Une fermeture éclair de fermeture suit dans le sens proximal vers distal, à mesure que les bords médiaux des plis urétraux endodermiques fusionnent pour former un urètre tubulaire. La fermeture éclair poursuit sa progression distale jusqu’à ce que le méat urétral se situe à l’extrémité du gland. Ce processus, conjointement avec le développement circonférentiel du prépuce, est sous l’influence d’une stimulation androgénique et est généralement achevé vers la 17e semaine de gestation.7,8
Une perturbation de ce processus embryologique entraîne un défaut de fusion correcte des plis urétraux, aboutissant à un méat urétral situé sur la face ventrale du pénis.11 De plus, une perturbation empêche le prépuce de se développer de manière circonférentielle, ce qui se manifeste par un prépuce en capuchon dorsal dans l’hypospadias.12
Épidémiologie
L’hypospadias est l’une des anomalies congénitales les plus fréquentes chez les sujets de sexe masculin, survenant dans environ 1:200-300 naissances vivantes aux États-Unis, 1:500 dans l’ensemble de l’Europe et 1:2,000-3,000 dans l’ensemble de l’Asie.5,10,13 Bien que l’incidence de l’hypospadias varie dans le monde, plusieurs études fondées sur des bases de données ont montré une augmentation marquée de l’incidence dans l’histoire récente. Il y a eu un doublement du taux (de 0,2 à 0,4 %) aux États-Unis pendant les années 1970 et 1980.14 Cette augmentation est peu susceptible d’être due à une amélioration de la détection, car on a observé une augmentation disproportionnée des formes sévères par rapport aux formes plus légères. En revanche, des influences multifactorielles telles que la perturbation endocrinienne, des expositions environnementales et une prédisposition génétique peuvent contribuer à cette augmentation du taux.11,15 D’autres enquêtes de population ont également constaté des augmentations marquées de l’incidence de l’hypospadias à la fin du XXe siècle, notamment au Canada, en Australie, en Angleterre, en Norvège, au Danemark, en Finlande, au Japon et en Italie, entre autres.3,16 Une étude de base de données de Washington a montré que l’âge maternel avancé (>40 ans), le diabète maternel préexistant et la race blanche étaient chacun indépendamment associés à un risque accru d’avoir un nouveau-né atteint d’hypospadias.15
Étiologie/Pathogénie
La pathogenèse de l’hypospadias est probablement due à une perturbation du métabolisme des androgènes et de la réponse aux androgènes pendant la gestation, car la stimulation androgénique est responsable de processus clés du développement pénien.6,7,8 Ces perturbations sont probablement multifactorielles, résultant à la fois d’une prédisposition génétique et d’expositions environnementales.17
Génétique
L’agrégation familiale observée dans l’hypospadias constitue un argument en faveur d’une prédisposition génétique, puisqu’environ 7% des patients atteints ont un autre membre de la famille du 1er, 2e ou 3e degré également atteint, en particulier pour le type “antérieur” ou distal.18 Des antécédents familiaux positifs d’hypospadias ont également été rapportés chez près d’un quart des garçons atteints d’hypospadias.19 Des antécédents paternels d’hypospadias étaient présents chez environ 31% des garçons atteints.19
Les gènes associés à une augmentation du risque d’hypospadias sont liés à des anomalies de l’équilibre hormonal androgénique au cours du développement. Plus précisément, des gènes qui affectent les enzymes métabolisant les androgènes, les récepteurs aux androgènes et les récepteurs aux œstrogènes.20,21,22,23,24,25,26 Par exemple, l’expression des récepteurs aux androgènes et celle de la 5 alpha‑réductase de type 2 ont été localisées, respectivement, à l’épithélium urétral ventral et au stroma, au cours du développement.26 Des anomalies de leur activité peuvent conduire à un remodelage urétral anormal et entraîner un hypospadias.26 Parmi les syndromes d’anomalies congénitales pouvant également se manifester par un hypospadias figurent les syndromes WAGR, Denys-Drash, Smith-Lemli-Opitz, Opitz G et Frasier, parmi près de 200 autres.5,18,27
Environnemental
Il existe une hypothèse des deux coups concernant le développement de l’hypospadias, selon laquelle l’exposition environnementale à des perturbateurs endocriniens peut potentialiser les effets de la prédisposition génétique à l’hypospadias.17 Parmi les expositions identifiées susceptibles d’augmenter le risque d’hypospadias figurent la prise maternelle de progestatifs pendant la grossesse, les éthers diphényliques polybromés (retardateurs de flamme), le tabagisme maternel, l’utilisation par le père de médicaments sur ordonnance, l’exposition maternelle au diéthylstilbestrol, la supplémentation maternelle en fer et l’exposition paternelle aux pesticides.28,29,30 Parmi celles-ci, seules la prise maternelle de progestatifs, les éthers diphényliques polybromés, le tabagisme maternel et l’utilisation par le père de médicaments sur ordonnance se sont révélées statistiquement significatives dans les études.
Diagnostic et évaluation
L’hypospadias doit être diagnostiqué à la naissance lors d’un examen physique néonatal approfondi. La réalisation d’une circoncision néonatale est contre-indiquée chez ces patients, car le prépuce est souvent interposé lors de la reconstruction urétrale, soit comme lambeau vascularisé, soit comme greffe libre. Par conséquent, poser le diagnostic pendant la période néonatale est essentiel afin d’éviter de retirer, par une circoncision, le tissu préputial disponible et utile. Un examen génito-urinaire approfondi d’un patient présentant un hypospadias mettrait en évidence deux orifices urétraux : 1) une fossette urétrale borgne à la localisation glandulaire normale et 2) un orifice du véritable méat urétral sur la face ventrale du pénis (Figure 2). Parmi les autres caractéristiques classiques associées à l’hypospadias, qui peuvent être présentes ou non, figurent un prépuce dorsal en capuchon dû à une déficience du prépuce ventral et une chordée ventrale, ou courbure pénienne. Une fois le diagnostic posé, le médecin doit poursuivre l’évaluation à la recherche d’autres anomalies congénitales associées liées à des causes syndromiques.31 Cependant, environ 90 % des cas sont des hypospadias isolés.31 La présence concomitante d’une cryptorchidie bilatérale et d’un hypospadias évoque un trouble du développement sexuel (TDS), bien que cela soit considéré comme plus fréquent chez les garçons présentant un hypospadias proximal.32 Quoi qu’il en soit, tout patient présentant un hypospadias et une cryptorchidie bilatérale doit être évalué par un caryotype, une échographie pelvienne et un dosage des électrolytes sériques afin de dépister une perte de sel secondaire à une hyperplasie congénitale des surrénales (HCS).
Lors de la consultation urologique, plusieurs facteurs doivent être pris en compte lorsqu’on envisage une réparation. Un examen génito-urinaire approfondi par un urologue pédiatrique expérimenté doit être réalisé pour déterminer la localisation du méat urinaire, le volume du gland, la longueur de la verge, le degré de chordée, la présence d’une transposition pénoscrotale, ainsi que la profondeur et la largeur de la plaque urétrale. L’imagerie des voies urinaires n’est ni indiquée ni nécessaire en cas d’hypospadias isolé.31 Ces caractéristiques opératoires, en plus des préférences et de l’expérience du chirurgien, jouent un rôle dans la planification de la réparation. Enfin, les risques et les bénéfices de la chirurgie doivent être discutés de manière approfondie avec les parents afin de permettre une prise de décision partagée.
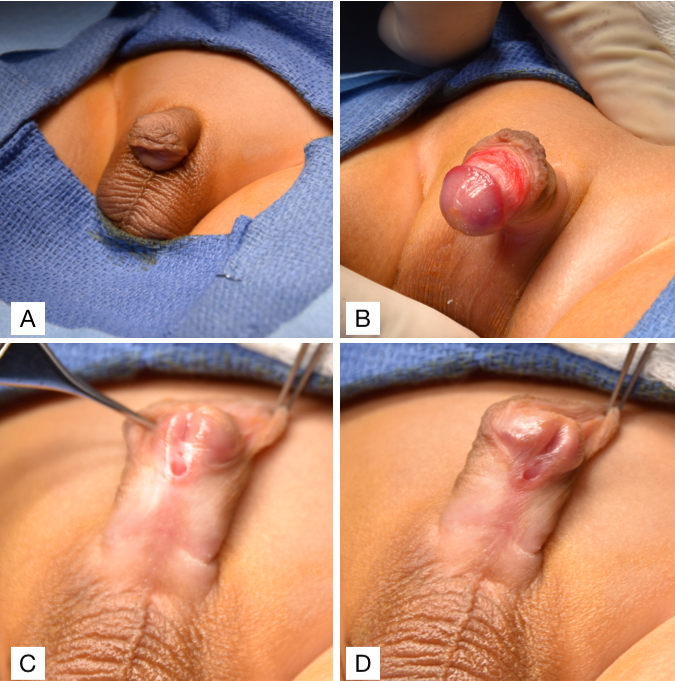
Figure 2 (A) Chordée ventrale avec prépuce en capuchon dorsal. (B) Chordée ventrale. (C et D) Hypospadias sous-coronal avec prépuce en capuchon dorsal.
Planification et prise en charge préopératoires
Pour la plupart des hypospadias distaux, la réparation chirurgicale n’est pas nécessaire, en particulier dans l’hypospadias glandulaire où le jet urinaire est rectiligne. Beaucoup de ces garçons présentent une miction normale et auront ultérieurement une fonction sexuelle normale de leur pénis. La position « normale » du méat est largement considérée comme l’extrémité distale du gland. Une grande variabilité de la position du méat a été rapportée, avec préservation de la fonction sexuelle et mictionnelle tout au long de l’âge adulte chez des hommes avec hypospadias non traités.33,34 Une enquête a constaté que les hommes ayant un hypospadias « plus léger » ou distal signalent des difficultés lors des rapports sexuels liées à la courbure, mais pas de problèmes urinaires significatifs par rapport aux hommes normaux.35 Cela suggère que la réparation de l’hypospadias distal devrait se concentrer sur la correction de la chordée et éviter l’urétroplastie et ses complications associées.43 En outre, l’infertilité est considérée comme un problème des hypospadias proximaux, et non distaux.34 Cependant, les patients présentant des hypospadias coronaux et médio-péniens peuvent avoir des éclaboussures urinaires ou une déviation du jet urinaire les amenant à uriner assis, ou des préoccupations esthétiques susceptibles d’entraîner des répercussions psychosexuelles ultérieures. De ce fait, de nombreux parents optent pour une correction chirurgicale de l’hypospadias distal de leur enfant.
En ce qui concerne le moment de la chirurgie, la plupart des urologues pédiatriques s’accordent à dire que la correction peut être réalisée à partir de l’âge de 6 mois. Cela coïncide avec les recommandations de 1996 du comité d’action de la Section d’urologie de l’American Academy of Pediatrics, qui considèrent 6–12 mois comme un âge acceptable pour la correction de l’hypospadias.44 Lorsqu’on opte pour des procédures en plusieurs temps, bien que cela soit rare dans l’hypospadias distal, un intervalle de 6 mois est recommandé entre les procédures afin de permettre une cicatrisation adéquate. Il convient notamment de s’efforcer de limiter la durée d’anesthésie chez l’enfant, car la littérature émergente exprime des préoccupations quant à l’effet d’une anesthésie prolongée sur le développement cérébral chez les enfants de moins de 3 ans.36
Il existe un débat parmi les urologues pédiatriques concernant l’utilisation de la stimulation androgénique préopératoire chez les garçons atteints d’hypospadias. De nombreux urologues en préconisent l’utilisation chez les garçons présentant un hypospadias sévère afin d’augmenter la longueur de la verge, la circonférence du gland, la vascularisation pénienne et la robustesse des tissus, pour optimiser les caractéristiques péniennes en vue de la réparation. Cependant, une revue systématique suggère que la stimulation hormonale préopératoire est associée à une augmentation des taux de complications postopératoires chez les patients présentant un hypospadias proximal, bien que cela n’ait pas atteint la signification statistique.37 Lorsque cela est jugé nécessaire, nous utilisons deux injections intramusculaires de 25 mg de depo-testosterone, avec un intervalle de six semaines entre les doses.
Prophylaxie antibiotique et antalgique
La prophylaxie antibiotique est couramment utilisée par les urologues pédiatriques afin de réduire le risque d’infections du site opératoire et des voies urinaires, en particulier lors des réparations avec stent.38 Cependant, les préoccupations concernant l’augmentation des taux de résistance aux antibiotiques ont soulevé des questions quant à l’efficacité de la prophylaxie antibiotique. Des études rétrospectives n’ont trouvé aucune différence significative dans les taux d’infections du site opératoire et des voies urinaires avec et sans recours à une prophylaxie antibiotique préopératoire lors de la réparation de l’hypospadias.39,40 Cependant, des études supplémentaires avec des tailles d’échantillon plus importantes seraient utiles pour préciser davantage l’efficacité de cette pratique. Dans notre établissement, nous utilisons de la céfazoline (30 mg/kg) par voie intraveineuse comme prophylaxie antibiotique préopératoire au moment de l’induction anesthésique. En ce qui concerne la prophylaxie antibiotique postopératoire, il est rapporté que 91 % des urologues pédiatriques prescrivent des antibiotiques postopératoires lorsqu’une sonde urétrale est laissée en place.38 Cependant, une méta-analyse récente évaluant les effets de la prophylaxie antibiotique postopératoire après réparation de l’hypospadias a constaté une utilité limitée pour prévenir les complications infectieuses et de cicatrisation, bien que le risque de biais ait été élevé dans de nombreuses études.41 Il existe actuellement un essai contrôlé randomisé international, multi-institutionnel, en cours pour évaluer la prophylaxie postopératoire.42 Dans notre établissement, nous prescrivons du TMP-SMX 2 mg/kg par voie orale par jour pendant toute la durée de la sonde.
Assurer une analgésie adéquate aux patients est particulièrement important dans cette population, car beaucoup de garçons qui subissent une correction de l’hypospadias sont trop jeunes pour communiquer verbalement. Diverses techniques analgésiques sont utilisées lors de la correction de l’hypospadias, notamment le bloc caudal et les blocs nerveux périphériques (bloc du nerf dorsal du pénis et bloc du nerf pudendal). Un débat se poursuit quant à l’efficacité de ces différentes techniques et à leurs effets sur les résultats postopératoires. Une méta-analyse d’essais randomisés et d’études observationnelles comparant le bloc caudal aux blocs nerveux périphériques ne rapporte pas de différence significative dans l’utilisation d’analgésiques supplémentaires au cours des 24 heures suivant l’intervention, mais des scores de douleur plus faibles 24 heures après la chirurgie avec un bloc caudal.43 Les auteurs rapportent également l’absence de risque supplémentaire de complications postopératoires avec les blocs caudaux.43 À l’inverse, une autre méta-analyse a trouvé une association significative entre l’analgésie par bloc caudal et les complications postopératoires après correction de l’hypospadias, bien que ces données aient probablement été confondues par la sévérité de l’hypospadias.44 Des données supplémentaires sont nécessaires pour déterminer la technique analgésique la plus efficace et la plus sûre. Dans notre établissement, le chirurgien préfère un bloc caudal préopératoire pour le contrôle de la douleur.
Réparation de l’hypospadias distal
La réparation de l’hypospadias doit viser à atteindre les trois objectifs principaux suivants : la capacité d’uriner confortablement en position debout, un jet mictionnel approprié et une apparence et une fonction péniennes « normales ».45 Bien qu’il existe une variation normale de l’apparence pénienne, l’objectif habituel est de créer un méat vertical, en forme de fente, à l’extrémité distale du gland.46 La plupart, sinon toutes, des réparations des hypospadias distaux peuvent atteindre ces objectifs en utilisant la réparation par plaque incisée tubulisée (TIP).47,48 La technique de réparation originale de Thiersch-Duplay a été complétée et popularisée par la technique TIP décrite pour la première fois par Snodgrass en 1994.47,49 Sa modification consistait en une incision longitudinale médiane profonde de la plaque urétrale dorsale, ce qui permet d’élargir la plaque urétrale pour faciliter la tubulisation. Voici les étapes réalisées dans notre établissement, qui constituent une variante de la technique TIP (Vidéo recommandée, (Figure 3), et (Figure 4)50,51
- Insérer une sonde d’alimentation 5-Fr à travers le méat hypospadique, placer des points d’attente de part et d’autre du futur méat distal, et poser le garrot pénien.
- Réaliser des incisions verticales sur chaque bord de la plaque urétrale, puis une incision transversale proximale au méat reliant les deux.
- Séparer le lambeau glandulaire et pratiquer une incision médiane dorsale de la plaque urétrale.
- L’urétroplastie est réalisée à l’aide d’un fil PDS 6-0 pour une fermeture sous-épithéliale en un seul plan par surjets continus sur la sonde d’alimentation de 5 French.
- Un lambeau de dartos latéral est prélevé et utilisé pour couvrir la ligne de suture.
- La glanduloplastie est complétée par le rapprochement ventral des lambeaux glandulaires.
- Déganter la verge jusqu’à la base.
- Circoncire l’excès de peau préputiale et mesurer le degré de chordée.
- Rapprocher la peau ventrale de la hampe pénienne.
- Fixer la sonde d’alimentation au gland et appliquer un film hydrocolloïde fin, compressif, imperméable et stérile, suivi d’un pansement adhésif transparent, fin, imperméable et stérile en enrobage, pour maintenir la verge surélevée (Figure 3)
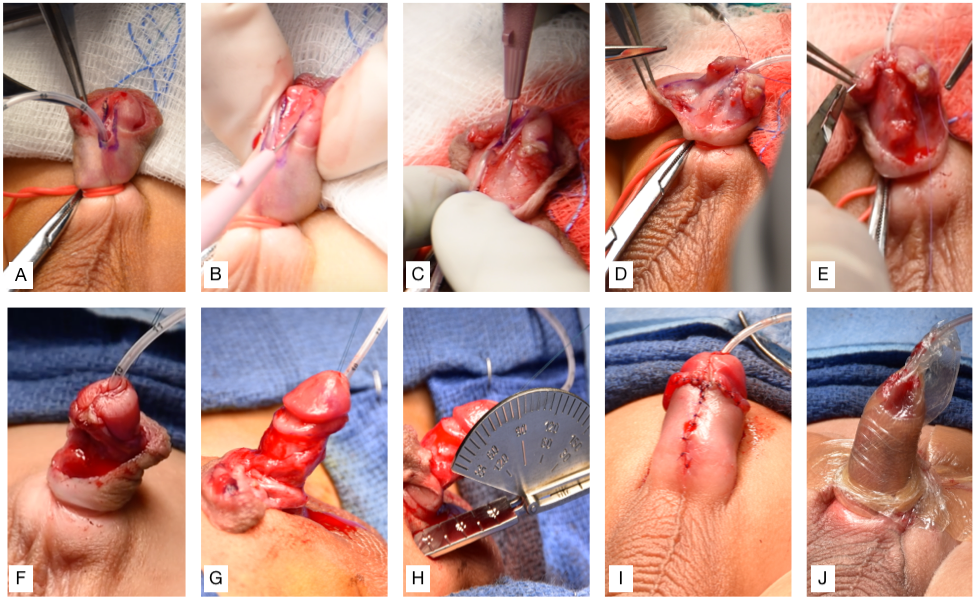
Figure 3 (A) Introduction d’une sonde d’alimentation 5-Fr à travers le méat hypospadique, mise en place de fils d’attente de part et d’autre du futur méat distal, et pose du garrot pénien. (B) Incisions verticales sur chaque bord de la plaque urétrale, puis incision transversale reliant les deux. (C) Séparation du lambeau glandulaire et incision médiane de la plaque urétrale. (D) Urétroplastie. (E) Un lambeau de dartos est utilisé pour recouvrir la ligne de suture. (F) La glanduloplastie est achevée par la ré-apposition du lambeau glandulaire. (G) Déglovage de la verge. (H) Circoncision et évaluation du degré de chordée au goniomètre. (I) Ré-apposition de la peau ventrale. (J) Fixation de la sonde d’alimentation au gland et pansement appliqué pour maintenir la verge surélevée.
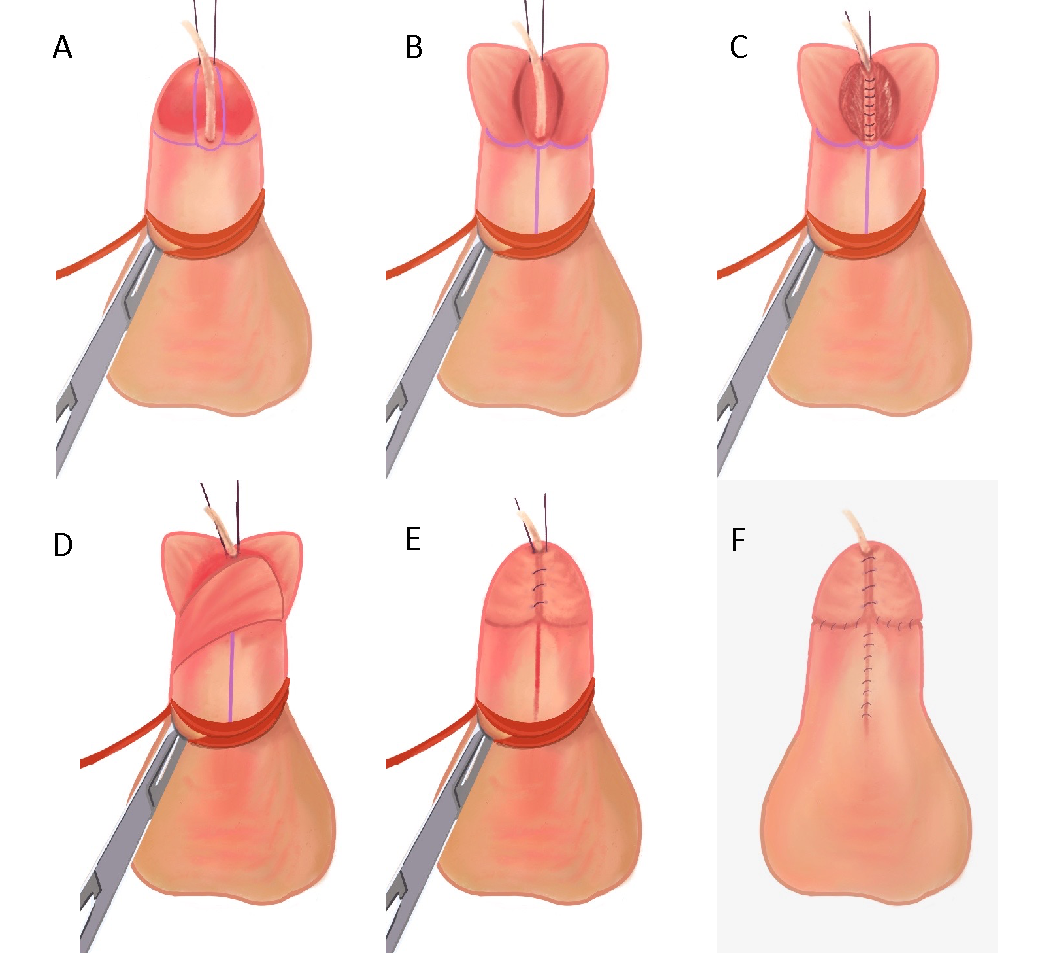
Figure 4 (A) Sonde d’alimentation 5 Fr passée à travers le méat hypospadique, fils de traction placés de part et d’autre du futur méat distal, et garrot pénien en place. (B) Incisions verticales sur chaque bord de la plaque urétrale, puis incision transversale reliant les deux. Les lambeaux glandulaires sont séparés et la plaque urétrale est incisée sur la ligne médiane. (C) Urétroplastie réalisée avec un fil PDS 6-0 pour une fermeture sous-épithéliale en un seul plan, par des points continus, sur la sonde d’alimentation 5 French. (D) Un lambeau de dartos est utilisé pour couvrir la ligne de suture. (E) La glansplastie est terminée en rapprochant les lambeaux glandulaires. (F) Rapprochement de la peau ventrale après déshabillage pénien et circoncision.
La technique de la plaque urétrale incisée tubulisée (TIP) est largement admise comme la méthode de choix pour la réparation des hypospadias distaux. Les réparations de l’hypospadias dans notre établissement sont réalisées à l’aide d’une variante de la technique TIP, dans laquelle le lambeau de dartos est prélevé sur la face latérale plutôt que dorsale du pénis, car c’est notre méthode préférée. D’autres techniques telles que la technique de Mathieu, la réparation onlay par lambeau îlot de Duckett et la MAGPI sont également des options. Cependant, l’approche TIP a été constamment rapportée comme ayant de faibles taux de complications, en particulier chez les chirurgiens à haut volume d’activité.52,53 Outre les faibles taux de complications, les résultats esthétiques après TIP ont été évalués et jugés meilleurs par rapport à la technique de Mathieu et à la réparation onlay par lambeau îlot de Duckett.46 Le bon résultat cosmétique de l’approche TIP est attribué à la création d’un orifice urétral vertical en fente, par opposition à un orifice urétral circulaire avec la technique de Mathieu. Il existe également des variations des techniques de suture de l’urétroplastie dans la procédure TIP, qui peut être réalisée avec des sutures interrompues ou continues. Des études comparatives des techniques d’urétroplastie avec sutures interrompues versus continues dans la réparation de l’hypospadias distal n’ont pas mis en évidence de différence significative des taux de complications, laissant donc le choix à la préférence du chirurgien.48,54
Vidéo recommandée
Soins postopératoires et suivi
La réparation de l’hypospadias dans notre établissement est réalisée en ambulatoire et les patients sortent le jour même. Nous sondons tous nos patients avec une sonde d’alimentation souple de 5 French et la fixons au gland par un point de fixation, qui reste en place pendant 5–7 jours. La question se pose de savoir si la réparation de l’hypospadias doit être réalisée avec stent, comme cela se fait classiquement pour la dérivation urinaire, ou sans stent, afin de prévenir les spasmes vésicaux et l’inconfort lié au retrait du stent. Une méta-analyse d’essais randomisés contrôlés et d’études de cohorte a comparé les complications précoces (spasme vésical, dysurie, infection urinaire, défaillance du stent, extravasation d’urine, saignement, rétention urinaire, et cetera) et tardives (sténose méatale, sténose urétrale, fistule, diverticule, déhiscence du gland, et autres taux de réintervention) après une réparation TIP de l’hypospadias distal avec stent vs sans stent.55 Aucune différence significative n’a été observée dans les taux de complications précoces ou tardives entre les réparations TIP avec stent et sans stent dans l’ensemble de la méta-analyse et du pool d’essais randomisés contrôlés, toutefois la qualité des preuves a été jugée faible à modérée. D’autres essais randomisés contrôlés sont nécessaires pour déterminer réellement son impact dans la réparation de l’hypospadias distal.
Le pansement est souvent utilisé pour optimiser la cicatrisation postopératoire en favorisant l’immobilisation, la protection du site opératoire, l’adhérence tissulaire et la compression.56 Actuellement, il n’existe pas de consensus sur le type de pansement le plus efficace, ni même sur le caractère bénéfique de la mise en place d’un pansement. Un essai randomisé n’a trouvé aucune différence significative des taux de complications ni des résultats cliniques en comparant les patients avec et sans pansement après réparation de l’hypospadias.56 À noter, on a observé une augmentation significative des appels postopératoires des parents dans le groupe sans pansement. Nous appliquons un pansement hydrocolloïde compressif suivi d’une bande adhésive qui maintient le pénis surélevé afin de minimiser l’œdème. Chez les patients n’ayant pas acquis la propreté, nous recommandons la double couche tant que la sonde est en place. Nous faisons un trou dans la couche intérieure pour permettre à la sonde de passer et de se drainer dans la couche extérieure. La sonde et le pansement sont retirés lors de la première visite de suivi post-opératoire du patient après 5–7 jours. Si le patient a acquis la propreté, soit nous conservons le feeding tube et dérivons les urines vers des pull-ups, soit nous utilisons une sonde sus-pubienne pour le drainage urinaire, mais nous ne posons jamais de sonde de Foley. Nous prescrivons du TMP-SMX par voie orale à 2 mg/kg par jour pendant toute la durée de la sonde. Nous prescrivons également de l’oxybutynine 0,2 mg/kg deux fois par jour jusqu’au retrait de la sonde afin de prévenir les spasmes vésicaux.
Le bloc caudal préopératoire aide à atténuer la douleur postopératoire. Le contrôle antalgique supplémentaire est généralement obtenu avec de faibles doses d’anti-inflammatoires non stéroïdiens (AINS). Bien qu’il existe une variabilité dans la prescription d’opioïdes chez les enfants après réparation de l’hypospadias, les urologues pédiatriques tendent à s’en écarter. Une initiative d’amélioration de la qualité reposant sur l’éducation et un schéma antalgique non opioïde prédéterminé a permis de réduire les prescriptions d’opioïdes après réparation de l’hypospadias.57 Ils ont observé des résultats équivalents en termes de douleur et de fonction en alternant le paracétamol et l’ibuprofène, ce qui suggère que les opioïdes peuvent être omis en toute sécurité tout en assurant un contrôle postopératoire adéquat de la douleur.57 Aucun de nos patients ne reçoit d’opioïdes, car nous visons à minimiser l’exposition des enfants aux opioïdes.
Notre calendrier de suivi postopératoire prévoit un retour en consultation à une semaine (pour l’ablation du pansement), puis de nouveau à un, trois, six et douze mois Les patients sont également programmés pour revenir en consultation au moins une fois après l’acquisition de la propreté. Nous soulignons aux parents l’importance du suivi postopératoire afin d’optimiser les résultats et la satisfaction des patients, d’autant plus que des complications peuvent se manifester de nombreuses années après la réparation.58
Complications
La majorité des patients qui subissent une réparation d’hypospadias distal obtiennent de bons résultats chirurgicaux. Cependant, certains patients peuvent développer des complications postopératoires nécessitant une réintervention. Parmi les complications précoces possibles figurent l’hémorragie, l’infection, la déhiscence, le déplacement du cathéter et l’obstruction urinaire. Les complications tardives susceptibles de survenir comprennent la fistule uréthrocutanée, la sténose méatale, la déhiscence glandulaire, la sténose du néo-urètre, le diverticule urétral et la balanite xérotique oblitérante (BXO).50
Une revue systématique portant sur 1 872 patients ayant subi une réparation d’hypospadias distal par la technique TIP dans 15 séries de cas a retrouvé un taux de fistule uréthrocutanée de 3,8 %, un taux de sténose méatale de 3,1 % et un taux de sténose néourétrale de 0 %.59 Une autre revue systématique portant sur 624 patients ayant subi une réparation d’hypospadias distal par la technique TIP dans 16 études a retrouvé un taux de fistule uréthrocutanée de 11,1 %, un taux de sténose méatale de 6,7 % et un taux de déhiscence de 4,2 %.60 De telles complications nécessitent souvent une réintervention chirurgicale afin d’éviter l’aggravation du problème. Notamment, les réparations distales primaires présentent des taux de réopération plus faibles que les réparations secondaires et les réparations proximales primaires.61 Lorsqu’une réopération est envisagée, il est important d’attendre au moins 6 mois après l’intervention initiale afin de permettre une cicatrisation tissulaire adéquate.
Points clés
- L’hypospadias est l’une des anomalies congénitales les plus fréquentes chez les nouveau-nés de sexe masculin, survenant à raison d’environ 1:200-300 naissances vivantes.
- Une fusion perturbée des replis urétraux a pour conséquence un orifice urétral situé sur la face ventrale du pénis.
- Hypothèse des deux coups : l’exposition environnementale à des perturbateurs endocriniens potentialise les effets d’une prédisposition génétique à l’hypospadias.
- Deux orifices urétraux à l’examen : 1) une fossette urétrale borgne à la localisation glandulaire normale et 2) un orifice du méat urétral véritable sur la face ventrale du pénis.
- D’autres caractéristiques classiques associées à l’hypospadias comprennent un prépuce dorsal en capuchon et une chordée ventrale.
- La réparation de l’hypospadias peut être réalisée à partir de l’âge de 6 mois.
- La technique de la plaque incisée tubulisée (TIP) est largement reconnue comme la méthode de choix pour la réparation des hypospadias distaux.
- Les complications les plus fréquentes de la réparation de l’hypospadias comprennent la fistule uréthrocutanée, la sténose méatique, la désunion du gland et la sténose du néourètre, bien que les taux soient faibles pour la réparation distale.
Conclusion
L’hypospadias est l’une des anomalies congénitales les plus fréquentes chez les nouveau-nés de sexe masculin. Il est dû à un arrêt du développement pénien entraînant un défaut de fusion correcte des replis urétraux. L’hypospadias est attribué à une étiologie multifactorielle découlant d’une prédisposition génétique et d’expositions environnementales. Un interrogatoire approfondi et un examen clinique minutieux doivent être réalisés pour établir correctement le diagnostic d’hypospadias et évaluer les facteurs de risque du patient. La réparation chirurgicale peut être réalisée dès l’âge de 6 mois et est généralement effectuée selon la technique de la plaque incisée tubulée. Bien que la réparation des hypospadias distaux soit constamment rapportée comme donnant d’excellents résultats, un suivi à long terme est nécessaire pour surveiller les complications et assurer la satisfaction du patient.
Ressources pour les patients
Lectures recommandées
- HJR H, LL W. Hypospadias, all there is to know. Eur J Pediatr 2017; 176 (4): 435–441. DOI: 10.1007/s00431-017-2864-5.
- Baskin L. What Is Hypospadias? Clin Pediatr (Phila. 2017; 56 (5): 409–418.
- Snodgrass WT, Bush NC, Wein AJ, Kavoussi LR, Partin AW, Peters C. Chapter 147. Hypospadias. Eleventh, Philadelphia, PA: Elsevier; 2016.
Références
- Laios K, Karamanou M, Androutsos G. A unique representation of hypospadias in ancient Greek art. Can Urol Assoc J 2012; 6 (1). DOI: 10.5489/cuaj.382.
- Baskin LS, Ebbers MB. Hypospadias: anatomy, etiology, and technique. Journal of Pediatric Surgery 2006; 41 (3): 463–472. DOI: 10.1016/j.jpedsurg.2005.11.059.
- Schneuer FJ, Holland AJA, Pereira G, Bower C, Nassar N. Prevalence, repairs and complications of hypospadias: an Australian population-based study. Arch Dis Child 2015; 100 (11): 1038–1043. DOI: 10.1136/archdischild-2015-308809.
- Newborn Clinical Guideline - Hypospadias [Internet. .
- Blaschko SD, Cunha GR, Baskin LS. Molecular Mechanisms of External Genitalia Development. Differentiation 2012; 84 (3): 261–268. DOI: 10.1016/j.diff.2012.06.003.
- Baskin L, Shen J, Sinclair A. Development of the Human Penis and Clitoris. Differentiation 2018; 103: 74–85. DOI: 10.1016/j.diff.2018.08.001.
- Cunha GR, Liu G, Sinclair A. Androgen-independent events in penile development in humans and animals. Differentiation 2020; 111: 98–114. DOI: 10.1016/j.diff.2019.07.005.
- Liu X, Liu G, Shen J. Human Glans and Preputial Development. Differentiation 2018; 103: 86–99. DOI: 10.1016/j.diff.2018.08.002.
- Li Y, Sinclair A, Cao M. Canalization of the Urethral Plate Precedes Fusion of the Urethral Folds during Male Penile Urethral Development: The Double Zipper Hypothesis. J Urol 2015; 193 (4): 1353–1360. DOI: 10.1016/j.juro.2014.09.108.
- Baskin LS, Erol A, Jegatheesan P, Li Y, Liu W, Cunha GR. Urethral seam formation and hypospadias. Cell Tissue Res 2001; 305 (3): 379–387. DOI: 10.1007/s004410000345.
- Baskin LS, Himes K, Colborn T. Hypospadias and endocrine disruption: is there a connection? Environ Health Perspect 2001; 109 (11): 1175–1183. DOI: 10.1289/ehp.011091175.
- Baskin L. What Is Hypospadias? Clin Pediatr (Phila. 2017; 56 (5): 409–418.
- Bergman J, Loane M, Vrijheid M. Epidemiology of hypospadias in Europe: a registry-based study. World Journal of Urology 2015; 33. DOI: 10.1007/s00345-015-1507-6.
- Li Y, Mao M, Dai L. Time trends and geographic variations in the prevalence of hypospadias in China. Birth Defects Research Part A: Clinical And Molecular Teratology 2012; 94 (1): 36–41. DOI: 10.1002/bdra.22854.
- S CK, S KK, Y PH. Trends in the incidence of cryptorchidism and hypospadias of registry-based data in Korea: a comparison between industrialized areas of petrochemical estates and a non-industrialized area. Asian J Androl 2011; 13 (5): 715–718. DOI: 10.1038/aja.2010.53.
- Springer A, Heijkant M, Baumann S. Worldwide prevalence of hypospadias. Journal of Pediatric Urology 2016; 12 (3). DOI: 10.1016/j.jpurol.2015.12.002.
- Paulozzi LJ, Erickson JD, Jackson RJ. Hypospadias Trends in Two US Surveillance Systems. Pediatrics 1997; 100 (5): 831–834. DOI: 10.1016/s0022-5347(01)63643-7.
- Porter MP, Faizan MK, Grady RW, Mueller BA. Hypospadias in Washington State: maternal risk factors and prevalence trends. Pediatrics 2005; 115 (4). DOI: 10.1542/peds.2004-1552.
- Brouwers MM, Feitz WFJ, Roelofs LAJ, Kiemeney LALM, Gier RPE, Roeleveld N. Risk factors for hypospadias. Eur J Pediatr 2007; 166 (7): 671–678. DOI: 10.1007/s00431-006-0304-z.
- Carmichael SL, Shaw GM, Laurent C, Croughan MS, Olney RS, Lammer EJ. Maternal progestin intake and risk of hypospadias. Arch Pediatr Adolesc Med 2005; 159 (10): 957–962. DOI: 10.1016/s0084-4071(08)70428-7.
- Baskin LS. Can we prevent hypospadias? Journal of Pediatric Urology 2007; 3 (6): 420–425. DOI: 10.1016/j.fertnstert.2007.12.024.
- Carmichael SL, Ma C, Choudhry S, Lammer EJ, Witte JS, Shaw GM. Hypospadias and genes related to genital tubercle and early urethral development. J Urol 2013; 190 (5): 1884–1892. DOI: 10.1016/j.juro.2013.05.061.
- Ollivier M, Paris F, Philibert P. Family History is Underestimated in Children with Isolated Hypospadias: A French Multicenter Report of 88 Families. J Urol 2018; 200 (4): 890–894. DOI: 10.1016/j.juro.2018.04.072.
- LFM Z, LM, WFJ F, B F, M KNV, N R. Aetiology of hypospadias: a systematic review of genes and environment. Hum Reprod Update 2012; 18 (3): 260–283. DOI: 10.1093/humupd/dms002.
- HJR H, LL W. Hypospadias, all there is to know. Eur J Pediatr 2017; 176 (4): 435–441. DOI: 10.1007/s00431-017-2864-5.
- Paulozzi LJ. International trends in rates of hypospadias and cryptorchidism. Environ Health Perspect 1999; 107 (4): 297–302. DOI: 10.1289/ehp.99107297.
- Lund L, Engebjerg MC, Pedersen L, Ehrenstein V, Nørgaard M, Sørensen HT. Prevalence of hypospadias in Danish boys: a longitudinal study, 1977-2005. Eur Urol 2009; 55 (5): 1022–1026. DOI: 10.1016/s8756-5005(09)79126-7.
- Abdullah NA, Pearce MS, Parker L, Wilkinson J JR, B MN, R.J.Q.. Birth prevalence of cryptorchidism and hypospadias in northern England, 1993-2000. Arch Dis Child 2007; 92 (7): 576–579. DOI: 10.1136/adc.2006.102913.
- Nassar N, Bower C, Barker A. Increasing prevalence of hypospadias in Western Australia, 1980-2000. Arch Dis Child 2007; 92 (7): 580–584. DOI: 10.1136/adc.2006.112862.
- Choudhry S, Baskin LS, Lammer EJ. Genetic polymorphisms in ESR1 and ESR2 genes, and risk of hypospadias in a multiethnic study population. J Urol 2015; 193 (5): 1625–1631. DOI: 10.1016/j.juro.2014.11.087.
- Kalfa N, Liu B, Klein O, Wang M-H, Cao M, Baskin LS. Genomic variants of ATF3 in patients with hypospadias. J Urol 2008; 180 (5): 2188.
- Liu B, Wang Z, Lin G. Activating transcription factor 3 is up-regulated in patients with hypospadias. Pediatr Res 2005; 58 (6): 1280–1283. DOI: 10.1203/01.pdr.0000187796.28007.2d.
- Wang Z, Liu BC, Lin GT. Up-Regulation of Estrogen Responsive Genes in Hypospadias: Microarray Analysis. The Journal of Urology 2007; 177 (5): 1939–1946. DOI: 10.1016/j.juro.2007.01.014.
- Qiao L, Tasian GE, Zhang H. Androgen receptor is overexpressed in boys with severe hypospadias, and ZEB1 regulates androgen receptor expression in human foreskin cells. Pediatr Res 2012; 71 (4 Pt 1): 393–398. DOI: 10.1016/j.yuro.2012.07.021.
- Kojima Y, Koguchi T, Mizuno K. Single Nucleotide Polymorphisms of HAAO and IRX6 Genes as Risk Factors for Hypospadias. J Urol 2019; 201 (2): 386–392.
- Kim K, Liu W, Cunha GR. Expression of the androgen receptor and 5α-reductase type 2 in the developing human fetal penis and urethra. Cell Tissue Res 2002; 307 (2): 145–153. DOI: 10.1007/s004410100464.
- Edery P. Genetics of hypospadias. Dialogues Pediatr Urol 2007; 28: 3–6. DOI: 10.1016/j.jpurol.2007.01.087.
- Poon S, Koren G, Carnevale A. Association of In Utero Exposure to Polybrominated Diphenyl Ethers With the Risk of Hypospadias. JAMA Pediatr 2018; 172 (9): 851–856. DOI: 10.1001/jamapediatrics.2018.1492.
- Snodgrass WT, Bush NC, Wein AJ, Kavoussi LR, Partin AW, Peters C. Chapter 147. Hypospadias. Eleventh, Philadelphia, PA: Elsevier; 2016.
- Tasian GE, Zaid H, Cabana MD, Baskin LS. Proximal hypospadias and risk of acquired cryptorchidism. J Urol 2010; 184 (2): 715–720. DOI: 10.1016/j.juro.2010.03.056.
- Fichtner J, Filipas D, Mottrie AM, Voges GE, Hohenfellner R. Analysis of meatal location in 500 men: wide variation questions need for meatal advancement in all pediatric anterior hypospadias cases. J Urol 1995; 154 (2 Pt 2): 833–834. DOI: 10.1016/s0022-5347(01)67177-5.
- Dodds PR, Batter SJ, Shield DE, Serels G SR, FA M, P.K.. Adaptation of Adults to Uncorrected Hypospadias. Urology 2008; 71 (4): 682–685. DOI: 10.1016/j.urology.2007.07.078.
- Schlomer B, Breyer B, Copp H, Baskin L, DiSandro M. Do adult men with untreated hypospadias have adverse outcomes? A pilot study using a social media advertised survey. J Pediatr Urol 2014; 10 (4): 672–679. DOI: 10.1016/j.jpurol.2014.01.024.
- Timing of elective surgery on the genitalia of male children with particular reference to the risks, benefits, and psychological effects of surgery and anesthesia. American Academy of Pediatrics; 1996, DOI: 10.1542/peds.97.4.590.
- Adler AC, Chandrakantan A, Sawires Y. Analysis of 1478 Cases of Hypospadias Repair. The Incidence of Requiring Repeated Anesthetic Exposure as Well as Exploration of the Involvement of Trainees on Case Duration. Anesth Analg 2019.
- Wright I, Cole E, Farrokhyar F, Pemberton J, Lorenzo AJ, Braga LH. Effect of preoperative hormonal stimulation on postoperative complication rates after proximal hypospadias repair: a systematic review. J Urol 2013; 190 (2): 652–659. DOI: 10.1016/j.juro.2013.02.3234.
- Hsieh MH, Wildenfels P, Gonzales ET. Surgical antibiotic practices among pediatric urologists in the United States. Journal of Pediatric Urology 2011; 7 (2): 192–197. DOI: 10.1016/j.jpurol.2010.05.001.
- Smith J, Patel A, Zamilpa I. Analysis of preoperative antibiotic prophylaxis in stented, distal hypospadias repair. Can J Urol 2017; 24 (2): 8765–8769.
- Baillargeon E, Duan K, Brzezinski A. The role of preoperative prophylactic antibiotics in hypospadias repair. Can Urol Assoc J 2014; 8 (7-8): 236–240. DOI: 10.5489/cuaj.1838.
- Chua ME, Kim JK, Rivera KC. The use of postoperative prophylactic antibiotics in stented distal hypospadias repair: a systematic review and meta-analysis. Journal of Pediatric Urology 2019; 15 (2): 138–148. DOI: 10.1016/j.jpurol.2018.10.012.
- Cheng EY, Faasse MA. Trimethoprim-sulfamethoxazole vs. Placebo After Hypospadias Repair: a Multicenter, Double-blind. Randomized Trial [Internet] Clinicaltrialsgov 2018.
- Zhu C, Wei R, Tong Y. Analgesic efficacy and impact of caudal block on surgical complications of hypospadias repair: a systematic review and meta-analysis. Reg Anesth Pain Med 2019; 44 (2): 259–267. DOI: 10.1136/rapm-2018-000022.
- Tanseco PP, Randhawa H, Chua ME. Postoperative complications of hypospadias repair in patients receiving caudal block vs. non-caudal anesthesia: A meta-analysis. Can Urol Assoc J 2019; 13 (8). DOI: 10.5489/cuaj.5688.
- Deibert CM, Hensle TW. The psychosexual aspects of hypospadias repair: A review. Arab J Urol 2011; 9 (4): 279–282. DOI: 10.1016/j.aju.2011.10.004.
- Ververidis M, Dickson AP, Gough DCS. An objective assessment of the results of hypospadias surgery. BJU Int 2005; 96 (1): 135–139. DOI: 10.1111/j.1464-410x.2005.05582.x.
- Snodgrass W. Tubularized, incised plate urethroplasty for distal hypospadias. J Urol 1994; 151 (2): 464–465. DOI: 10.1016/s0022-5347(17)34991-1.
- Snodgrass WT, Bush N, Cost N. Tubularized incised plate hypospadias repair for distal hypospadias. Journal of Pediatric Urology 2010; 6 (4): 408–413. DOI: 10.1016/j.jpurol.2009.09.010.
- Snodgrass WT. Snodgrass technique for hypospadias repair. BJU Int 2005; 95 (4): 683–693. DOI: 10.1111/j.1464-410x.2005.05384.x.
- Barashi NS, Gundeti MS. Chapter 15. Surgical Reconstructions of Distal Hypospadias: The University of Chicago Experience. Gundeti MS. Surgical Techniques in Pediatric and Adolescent Urology. Jaypee Brothers,Medical Publishers Pvt. Limited; 2019.
- Herrera O, Mostafa S, Lomba T. A 10-step procedure for distal hypospadias repair with 50% resident involvement is safe and effective. Urology Video Journal 2021; 11 (100094). DOI: 10.1016/j.urolvj.2021.100094.
- Nguyen MT, Snodgrass WT, Zaontz MR. Effect of urethral plate characteristics on tubularized incised plate urethroplasty. J Urol 1262; 2004;171(3):1260-2. DOI: 10.1097/01.ju.0000110426.32005.91.
- Braga LHP, Lorenzo AJ, Salle JLP. Tubularized incised plate urethroplasty for distal hypospadias: A literature review. Indian J Urol 2008; 24 (2): 219–225. DOI: 10.4103/0970-1591.40619.
- Gupta A, Gupta R, Srivastav P. Comparison of interrupted- and continuous-suture urethroplasty in tubularised incised-plate hypospadias repair: A prospective study. Arab J Urol 2017; 15 (4): 312–318. DOI: 10.1016/j.aju.2017.10.004.
- Chua M, Welsh C, Amir B. Non-stented versus stented urethroplasty for distal hypospadias repair: A systematic review and meta-analysis. Journal of Pediatric Urology 2018; 14 (3): 212–219. DOI: 10.1016/j.jpurol.2017.11.023.
- JG S, LG P, BL S. A prospective randomized trial of dressings versus no dressings for hypospadias repair. Journal of Urology 2000; 164 (3 Part 2): 981–983. DOI: 10.1016/s0022-5347(05)67231-x.
- O’Kelly F, Pokarowski M, DeCotiis KN. Structured opioid-free protocol following outpatient hypospadias repair - A prospective SQUIRE 2.0-compliant quality improvement initiative. Journal of Pediatric Urology 2020; 16 (5). DOI: 10.1016/j.jpurol.2020.06.012.
- Lucas J, Hightower T, Weiss DA. Time to Complication Detection after Primary Pediatric Hypospadias Repair: A Large, Single Center, Retrospective Cohort Analysis. J Urol 2020; 204 (2): 338–344. DOI: 10.1097/ju.0000000000000762.
- Wilkinson DJ, Farrelly P, Kenny SE. Outcomes in distal hypospadias: A systematic review of the Mathieu and tubularized incised plate repairs. Journal of Pediatric Urology 2012; 8 (3): 307–312. DOI: 10.1016/j.jpurol.2010.11.008.
- Zhang Y, Shen Z, Zhou X. Comparison of meatal-based flap (Mathieu) and tubularized incised-plate (TIP) urethroplasties for primary distal hypospadias: A systematic review and meta-analysis. Journal of Pediatric Surgery 2020. DOI: 10.1016/j.jpedsurg.2020.03.013.
- Pfistermuller KLM, McArdle AJ, Cuckow PM. Meta-analysis of complication rates of the tubularized incised plate (TIP) repair. J Pediatr Urol 2015; 11 (2): 54–59. DOI: 10.1016/j.jpurol.2014.12.006.
Dernière mise à jour: 2025-09-22 07:59