28: Testicule non descendu
Ce chapitre prendra environ 18 minutes de lecture.
Introduction
Le testicule non descendu (UDT) désigne l’état dans lequel le testicule n’est pas situé dans le scrotum mais dans une localisation anormale, comme dans la cavité abdominale ou dans l’aine (Figure 1) Les testicules se forment et restent un certain temps dans la cavité abdominale pendant la vie fœtale, puis descendent progressivement vers le scrotum. La cryptorchidie inclut les testicules non descendus situés n’importe où le long du trajet normal de la descente et les testicules ectopiques, qui ne suivent pas le trajet habituel de la descente testiculaire. Le testicule non descendu doit être différencié du testicule rétractile. Un testicule rétractile est un testicule situé sous l’anneau inguinal externe, mais qui peut être mobilisé vers la partie supérieure du scrotum et a tendance à remonter à sa position initiale et/ou est un testicule qui a terminé son processus normal de descente et peut rester dans le scrotum, mais passe facilement d’avant en arrière entre le scrotum et l’aine (Vidéo 1).
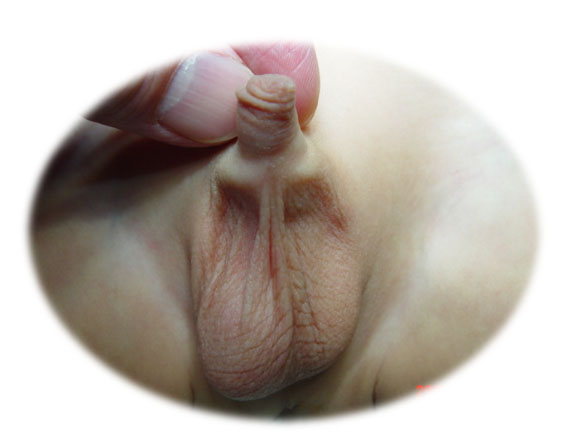
Figure 1 Scrotum vide du côté gauche chez un patient présentant un testicule non descendu.
Vidéo 1 Démonstration d’un testicule rétractile.
Épidémiologie
Le testicule non descendu est l’une des anomalies congénitales les plus fréquentes chez le nouveau-né de sexe masculin. Le risque de testicules non descendus est 3.5 fois plus élevé chez les garçons ayant un frère atteint de testicules non descendus, et 2.3 fois plus élevé chez ceux dont le père est atteint de cette affection.1 L’incidence chez les nouveau-nés à terme est rapportée à 1.0–4.5% et les cas unilatéraux sont 2 fois plus fréquents que les cas bilatéraux.2 Environ 70% des testicules non descendus descendent à l’âge de 3 mois sous l’influence de la mini-puberté et l’incidence du testicule non descendu diminue à 0.8-1.2% à l’âge de 1 an.3,4
Étiologie
Il n’existe pas de facteurs de risque clairement associés à la cryptorchidie (UDT); cependant, le tabagisme maternel pendant la grossesse, les mesures à la naissance, notamment le poids de naissance et l’âge gestationnel, les antécédents familiaux de testicule non descendu, et des variants génétiques rares tels que des mutations d’INSL3 ont été associés à la cryptorchidie. La descente testiculaire normale repose sur un axe hypothalamo-hypophyso-gonadique (HPG) intact. Bien que l’étiologie exacte reste inconnue, des facteurs génétiques, hormonaux (dysfonction de l’axe HPG, hypogonadisme congénital, dysplasie testiculaire) et anatomiques (canal déférent et vaisseaux spermatiques courts) sont impliqués. Un poids de naissance <2,5 kg, petit pour l’âge gestationnel, prématurité, de faibles taux maternels d’œstrogènes et une insuffisance placentaire, ainsi qu’une sécrétion réduite de gonadotrophine chorionique humaine (hCG) ont été suggérés comme facteurs de risque de testicule non descendu. En outre, l’exposition à des facteurs environnementaux tels que l’exposition continue aux composés organochlorés, aux monoesters de phtalates, le tabagisme maternel et le diabète maternel a été rapportée comme facteur de risque de troubles du développement chez l’homme. Cependant, aucun de ces facteurs ne s’est avéré, à lui seul, responsable de la pathogenèse de la cryptorchidie.
Descente testiculaire normale
Les mammifères peuvent être divisés entre ceux qui ont un scrotum et ceux qui n’en ont pas. L’hypothèse générale concernant l’évolution du scrotum chez certains mammifères est qu’il fournit un environnement plus frais, inférieur à la température centrale du corps, favorisant une meilleure spermatogenèse. Cependant, nous ne disposons d’aucune donnée pour étayer ou réfuter l’hypothèse thermique, car certains mammifères peuvent se reproduire avec des testicules internes et certaines espèces dépourvues de scrotum possèdent des mécanismes de refroidissement testiculaire.5,6 Une réduction du taux de mutations des cellules germinales à des températures corporelles plus basses a peut-être été un facteur moteur du développement du scrotum chez les mammifères. Chez certains animaux dont les testicules restent proches du rein dans la cavité abdominale, l’épididyme s’étend jusqu’à une localisation sous-cutanée, ce qui pourrait procurer un effet de refroidissement pendant le stockage et la maturation des spermatozoïdes.7 Dans ce cas, l’emplacement des testicules pourrait avoir suivi celui de l’épididyme. Chez l’être humain, la température scrotale est maintenue à un niveau optimal pour la spermatogenèse, environ 2,7 ℃ en dessous de la température centrale du corps.8
Bien que les testicules et les ovaires dérivent des mêmes tissus embryologiques adjacents au rein, les testicules entreprennent un long trajet hors de la cavité abdominale.9 La descente testiculaire normale comporte une phase transabdominale et une phase inguino-scrotale, toutes deux se déroulant chez l’humain avant la naissance. La descente transabdominale survient à la 12e semaine de gestation, lorsque le testicule descend vers l’anneau inguinal profond. La progression résulte d’une combinaison d’effets de poussée et de traction.10 Avant le début de la descente, la gonade en développement est ancrée par le ligament suspenseur crânial et le ligament génito-inguinal caudal, ou gubernaculum.11 Le gubernaculum distal augmente de volume pendant la phase transabdominale de la descente, rendant le gubernaculum mâle court et épais. Cette réaction de tuméfaction ancre le testicule au canal inguinal (Figure 2) Les muscles de la paroi inguinale se différencient autour du gubernaculum tuméfié, également appelé le bulbe, pour constituer le canal inguinal. L’hormone de type insuline 3 (INSL3) est reconnue comme l’hormone régulant la réaction de tuméfaction.12,13,14 Les cellules de Leydig du testicule sécrètent l’INSL3 pour stimuler la réaction de tuméfaction, et cela maintient le testicule au contact de la paroi abdominale inguinale à mesure que l’abdomen fœtal croît.14 L’hormone anti-müllérienne (AMH), sécrétée par les cellules de Sertoli du testicule, est également supposée jouer un rôle dans la descente testiculaire. Chez les enfants présentant des mutations du gène de l’AMH ou de son récepteur, on observe une cryptorchidie avec persistance d’un utérus et de trompes de Fallope infantiles, connue sous le nom de syndrome des canaux müllériens persistants (PMDS).14
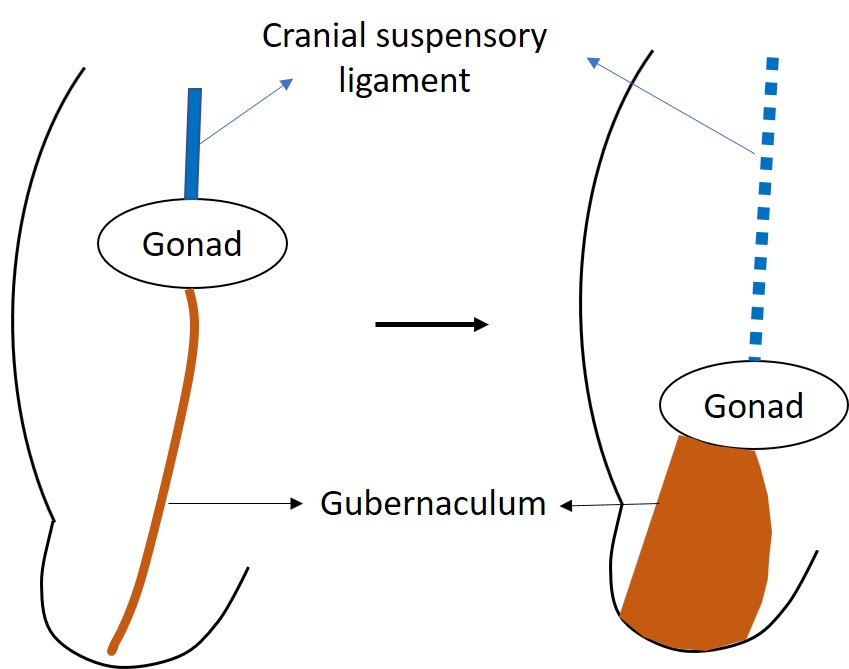
Figure 2 La gonade indifférenciée est initialement située haut dans l’abdomen, ancrée par le ligament suspenseur crânial. INSL3 provoque la tuméfaction et l’augmentation de volume du gubernaculum, qui tire le testicule en développement vers la région inguinale.
La phase inguino-scrotale de la descente survient entre 25 et 35 semaines. Le processus global est assez similaire chez la plupart des mammifères.15 Au cours de cette étape, les testicules transitent par le canal inguinal pour finalement se loger dans le scrotum. Le gubernaculum s’allonge en direction du scrotum en même temps que le processus vaginal. Après que le gubernaculum a atteint le scrotum, le bulbe se résorbe pour laisser un reliquat fibreux adhérent à la face interne du scrotum. La portion proximale du processus vaginal se ferme pour prévenir une hernie inguinale ou une hydrocèle chez l’humain. De nombreux autres mammifères, tels que les souris et les rats, présentent un processus vaginal perméable toute leur vie. Chez l’humain, le processus vaginal finit par involuer complètement et permet au cordon spermatique de s’allonger normalement après la naissance. La phase inguino-scrotale de la descente testiculaire est sous le contrôle des androgènes. Dans des modèles animaux, il a été constaté que, selon l’action des androgènes, les branches sensitives du nerf génito-fémoral contrôlent le développement du gubernaculum, lequel est modulé par le peptide lié au gène de la calcitonine (CGRP).
Classification des testicules non descendus
En général, les testicules non descendus sont classés en testicules palpables ou non palpables. Le caractère palpable ou non des testicules détermine les examens diagnostiques et la stratégie thérapeutique, ainsi que le pronostic. Les testicules sont mobilisables par la contraction du muscle crémaster. Par conséquent, la localisation exacte des testicules doit être déterminée avant l’âge de 6 mois, lorsque le réflexe crémastérien est faible, ou sous anesthésie générale. Environ 80 % des testicules non descendus sont palpables au niveau de la région inguinale. Si le testicule n’est pas palpable, il peut être situé dans la cavité abdominale, ou il peut s’agir d’une agénésie, d’un testicule atrophique ou régressé.
Pathologie associée
Développement anormal des cellules germinales
Le développement histologique des testicules cryptorchides prépubères a été étudié dans de nombreux types d’études observationnelles. Ces études apportent des preuves solides qu’un développement anormal des cellules germinales est souvent présent après les premiers mois de vie dans les testicules cryptorchides. Le nombre de spermatogonies par tubule est réduit après la petite enfance et n’augmente pas normalement avec l’âge dans les testicules cryptorchides, et dans une moindre mesure dans les testicules scrotaux controlatéraux.16 Il a été rapporté que la transformation des gonocytes en spermatogonies est altérée dans les testicules cryptorchides. Le rapport gonocytes/spermatogonies semble normal dans les testicules cryptorchides vers l’âge de 1,5 mois; on observe, dans les testicules cryptorchides par rapport aux testicules scrotaux controlatéraux, une disparition retardée des gonocytes et l’apparition de spermatogonies sombres adultes. Il a été rapporté que le testicule cryptorchide n’est pas significativement plus petit à la naissance, mais croît moins bien que le testicule scrotal.17
Infertilité
Il est bien établi qu’un antécédent de cryptorchidie est associé à une hypofertilité. Dans une série d’études cas-témoins bien conçues sur la fertilité dans la cryptorchidie, qui ont analysé une large cohorte d’hommes ayant subi une orchidopexie et un groupe témoin d’âge similaire, 65% des anciens cryptorchides bilatéraux, 90% des anciens cryptorchides unilatéraux et 93% des témoins ont accédé à la paternité.18,19 Selon les études rapportant l’histologie testiculaire au moment de l’orchidopexie, le potentiel de fertilité était maximal lorsque l’orchidopexie était réalisée avant l’âge de 1 an.20,21,22 Par conséquent, il est recommandé de réaliser l’orchidopexie avant l’âge de 1 an.
Risque de malignité
On sait bien que le risque de tumeur germinale testiculaire est accru chez les hommes ayant des antécédents de cryptorchidie. Le risque relatif de transformation maligne dans un testicule non descendu est globalement de 2,5 à 8 et de 2 à 3 chez les garçons subissant une orchidopexie prépubertaire.23 Environ 10 % des hommes présentant une tumeur germinale testiculaire ont des antécédents de cryptorchidie. Dans une revue de la pathologie tumorale dans les cryptorchidies traitées versus non traitées, le séminome est le plus souvent associé à un testicule restant cryptorchide et la tumeur germinale non séminomateuse constitue la majorité des tumeurs des testicules scrotaux.23 Aujourd’hui il a été montré que cela n’est pas lié, l’auto-examen testiculaire est recommandé pour le dépistage du cancer testiculaire, et il devrait être enseigné à tous les patients ayant des antécédents de cryptorchidie après la puberté.
Hernie
Plus de 90 % des cas de cryptorchidie s’accompagnent d’un processus vaginal perméable, et une hernie peut survenir dans 25 % des cas.
Anomalie de l’épididyme
La prévalence des anomalies épididymaires dans la cryptorchidie est rapportée entre 32 % et 72 %.24 Des anomalies épididymaires peuvent survenir en raison d’une involution anormale du canal mésonéphrique adjacent au testicule normal.25 Les anomalies de fusion épididymo-testiculaire seraient fortement associées à une position plus proximale du testicule. Les anomalies épididymaires peuvent entraîner une altération de la fertilité en raison de difficultés de transport et de maturation des spermatozoïdes.26
Diagnostic du testicule non descendu
Avant l’examen physique, il est essentiel de s’enquérir d’un accouchement prématuré, de l’utilisation d’hormones féminines par la mère ou d’une exposition à des hormones féminines, de lésions du système nerveux central, et d’antécédents de chirurgie inguinale. Il convient également de vérifier des antécédents familiaux d’autres anomalies congénitales ou d’infertilité associées à la cryptorchidie. Comme le caractère palpable du testicule cryptorchide est plus important que la localisation des testicules, un examen physique minutieux est essentiel. En cas de doute, il est recommandé de répéter l’examen ou d’adresser à un spécialiste. En particulier, en cas de testicule non palpable, il est important de vérifier sous anesthésie avant la chirurgie. Pour la méthode d’examen physique, la pièce doit être chaude. Puis, avec le patient en position de grenouille, vérifier d’abord la taille, la localisation et la surface du testicule controlatéral, puis, avec une main chaude, balayer de la crête iliaque du côté atteint jusqu’à la symphyse pubienne afin de déterminer la présence et la localisation du testicule. Si le testicule est palpable, il faut également vérifier qu’il descend jusqu’au scrotum.27 S’il est difficile de palper, par exemple chez un nourrisson potelé ou un enfant obèse, faites-les s’asseoir les jambes croisées ou s’accroupir pour les examiner, et appliquez du gel lubrifiant sur vos mains pour une meilleure palpation des testicules. En l’absence d’un testicule, une hypertrophie compensatrice du testicule controlatéral peut être observée. Une fois les testicules palpables, il n’est pas nécessaire de réaliser d’examens complémentaires, car la précision diagnostique de l’échographie, de la tomodensitométrie ou de l’imagerie par résonance magnétique (IRM) n’est pas aussi élevée que celle d’urologues experts, et le traitement est rarement différent en fonction des résultats des examens d’imagerie. Les examens d’imagerie ne peuvent pas vérifier avec certitude si un testicule est présent ou non.28 En pratique clinique, l’échographie ou l’IRM n’est recommandée que dans des cas sélectionnés chez des patients suspects de TDS.29
Pour les testicules non palpables qui ne peuvent pas être confirmés par l’examen clinique et l’examen radiologique, une laparoscopie diagnostique ou une chirurgie exploratrice par incision inguinale ou scrotale est réalisée. Traditionnellement, si un testicule ou un moignon testiculaire était trouvé lors d’une exploration inguinale, une orchidopexie ou une orchidectomie était réalisée. Avec l’avènement de la laparoscopie, il est devenu possible de vérifier la présence ou l’absence des testicules, leur localisation et l’état du canal déférent et des vaisseaux gonadiques. En laparoscopie, si les vaisseaux testiculaires se terminent en cul-de-sac, on peut poser le diagnostic de testicule disparu et aucune prise en charge supplémentaire n’est nécessaire. Si l’on observe que les vaisseaux spermatiques pénètrent dans l’orifice inguinal interne, une exploration inguinale ou scrotale doit être réalisée.
En cas de testicules bilatéralement non palpables avec tout signe de TDS, comme une ambiguïté génitale ou un hypospadias sévère, une évaluation endocrinologique et génétique complémentaire est obligatoire.30 Chez les enfants de moins de 3 mois, on dose l’hormone lutéinisante (LH), l’hormone folliculo-stimulante (FSH) et la testostérone. Chez les enfants âgés de 3 mois ou plus, un test de stimulation par la gonadotrophine chorionique humaine (hCG) est recommandé. Si la testostérone est à peine détectable et que la LH et la FSH sont élevées, on peut conclure à une anorchidie. Lors du test de stimulation à l’hCG, après injection intramusculaire de 2 000 UI d’hCG pendant 3 jours, la testostérone sérique est dosée le 5e jour. Toutefois, en raison d’un risque de faux négatif, une confirmation chirurgicale est nécessaire chez tous les enfants dont les taux de gonadotrophines sont dans l’intervalle de référence et chez lesquels les deux testicules ne sont pas palpables, qu’ils répondent ou non au test de stimulation à l’hCG.
Traitement de la cryptorchidie
L’objectif du traitement des testicules non descendus est de réduire le risque d’infertilité en minimisant la dégénérescence histologique des testicules en les plaçant dans le scrotum précocement et de faciliter la détection d’un cancer du testicule, dont l’incidence est plus élevée que pour un testicule normalement descendu. En outre, un objectif secondaire est de corriger les lésions associées, de prévenir des complications telles que la torsion testiculaire, d’atténuer l’impact psychologique chez le patient et d’améliorer l’aspect cosmétique. Jusqu’à présent, il était admis que l’orchidopexie ne pouvait pas prévenir le cancer du testicule, mais récemment, il a été rapporté qu’une chirurgie précoce peut en réduire le risque. Le moment du traitement des testicules non descendus est important. L’orchidopexie doit être réalisée après l’âge de 6 mois et dans l’année qui suit, au plus tard à 18 mois.31 La justification d’une chirurgie aussi précoce est que la descente naturelle des testicules après l’âge de 6 mois est improbable, qu’il n’y a pas de différence significative quant aux risques de l’anesthésie générale ou de la technique chirurgicale, et que la possibilité de lésions histologiques des testicules augmente au-delà de cet âge.31,32 Et il existe également des préoccupations concernant les enfants de plus de 18 mois, qui pourraient présenter une forte anxiété de séparation et une peur de la castration liée à la chirurgie, susceptibles d’affecter leur santé mentale.
Le traitement chirurgical, l’orchidopexie, est le traitement standard des testicules non descendus, et un traitement hormonal peut être utilisé de façon sélective selon la localisation et l’état des testicules non descendus. Lorsque les testicules dégénèrent ou disparaissent et que seuls des reliquats ou un moignon testiculaire sont visibles, ou lorsque des testicules non descendus chez l’adulte présentent des anomalies anatomiques et morphologiques, ou lorsque la fixation testiculaire est impossible, les testicules sont excisés. L’orchidectomie ne doit être envisagée qu’avec prudence et seulement lorsque le testicule controlatéral est normal, et une orchidopexie controlatérale est réalisée simultanément pour prévenir la torsion testiculaire. Puisque le testicule rétractile est une variante normale, il est recommandé d’effectuer un suivi annuel jusqu’à la puberté ou jusqu’à ce que les testicules ne remontent plus.
Traitement hormonal pour la descente testiculaire
Le traitement hormonal de la descente testiculaire est un sujet de controverse. Cependant, on utilise principalement l’hCG, des agonistes de l’hormone de libération de l’hormone lutéinisante (LHRH) ou des agonistes de l’hormone de libération des gonadotrophines (GnRH). Le fondement du traitement hormonal repose sur des résultats expérimentaux montrant que les testicules non descendus résultent d’une anomalie de l’axe hypothalamo-hypophyso-gonadique, que la descente testiculaire est régulée par les androgènes masculins, et que de fortes concentrations de métabolites actifs synthétisés dans les testicules sont impliquées dans la physiopathologie de la cryptorchidie. L’hCG agit directement sur les cellules de Leydig comme la LH d’origine hypophysaire, tandis que la GnRH augmente la production de testostérone dans le testicule en stimulant, via l’hypothalamus, la sécrétion de LH. On suppose que l’hormone agit sur le cordon spermatique et le muscle crémastérien pour induire la descente naturelle des testicules et améliorer la fertilité. Cependant, le taux de succès du traitement hormonal par hCG ou GnRH n’est que de 20 % et près de 20 % de ces testicules descendus peuvent remonter secondairement.33,34
Traitement hormonal pour la fertilité
Le traitement hormonal peut améliorer les indices de fertilité et peut constituer un complément à l’orchidopexie.35,36 Il a été rapporté que les hommes traités par GnRH dans l’enfance présentaient de meilleurs résultats au spermogramme que les hommes ayant subi une orchidopexie seule ou un traitement placebo.35 À l’inverse, il est rapporté que le traitement par hCG pourrait être délétère pour la spermatogenèse future en augmentant l’apoptose des cellules germinales, en entraînant des modifications inflammatoires des testicules et en réduisant le volume testiculaire à l’âge adulte.37 Les données sur l’effet à long terme du traitement hormonal de la cryptorchidie font encore défaut et il est difficile de sélectionner le meilleur candidat présentant un testicule non descendu susceptible de bénéficier d’un traitement hormonal.
Traitement chirurgical
Testicule palpable
Dans la plupart des cas de testicules non descendus palpables, l’orchidopexie est réalisée par une incision inguinale. Le point le plus important de l’orchidopexie est d’obtenir une longueur suffisante pour abaisser le testicule jusqu’au scrotum sans tension. L’intervention comporte les quatre étapes suivantes. Premièrement, le testicule et le cordon spermatique sont séparés des tissus environnants pour en assurer la mobilité. Deuxièmement, une ligature haute est réalisée pour fermer le canal péritonéo-vaginal. Troisièmement, pour abaisser le testicule jusqu’au fond du scrotum sans tension, une dissection rétropéritonéale complémentaire est parfois nécessaire pour libérer le canal déférent. Enfin, une loge sous-dartos peu profonde est confectionnée dans l’hémiscrotum homolatéral, et les testicules y sont enfouis et fixés. Si la longueur du cordon spermatique n’est pas suffisante avec ces techniques de base, la méthode de Prentiss est nécessaire pour réduire la distance jusqu’au scrotum, en sectionnant le vaisseau épigastrique inférieur au niveau du plancher du canal inguinal ou en faisant passer le cordon spermatique en dessous. Ce n’est pas habituel pour un testicule non descendu palpable, mais une autotransplantation du testicule utilisant une technique microchirurgicale visant à anastomoser l’artère testiculaire à l’artère épigastrique a été rapportée (voir ci-dessous).
Testicule non palpable
Étant donné que la présence et l’état des testicules sont importants pour l’intervention sur des testicules non palpables, les testicules doivent être réexaminés sous anesthésie. S’ils restent non palpables, une exploration inguinale ouverte ou une laparoscopie diagnostique est réalisée. Les constatations laparoscopiques en cas de testicules non palpables sont les suivantes : premièrement, les vaisseaux testiculaires descendent à travers l’orifice inguinal interne. Dans ce cas, une incision est pratiquée au niveau de la peau inguinale ou scrotale pour rechercher la présence du testicule. Si les testicules sont trouvés normaux, une orchidopexie est réalisée. Le deuxième scénario est que le vaisseau testiculaire se termine en cul-de-sac dans la cavité abdominale près de l’orifice inguinal interne, ce qui évoque un testicule disparu ; l’intervention est alors interrompue sans geste supplémentaire. Enfin, lorsqu’un testicule est retrouvé dans la cavité abdominale, la décision chirurgicale est prise en fonction de la taille du testicule, de sa localisation dans la cavité abdominale, de la longueur du pédicule spermatique, de l’âge du patient, du testicule controlatéral et de l’expérience du chirurgien. Le taux global de succès chirurgical est de 67 à 84 %.
L’orchidopexie est réalisée selon l’une des trois méthodes
Orchidopexie de Fowler-Stephens
Il s’agit d’une procédure qui assure une longueur suffisante du cordon spermatique en réséquant les vaisseaux spermatiques internes comprenant l’artère testiculaire, et la survie du testicule dépend alors de l’apport sanguin assuré par l’artère crémastérique et l’artère du canal déférent. La technique en un temps consiste à réséquer les vaisseaux spermatiques internes et à fixer le testicule simultanément. Dans l’orchidopexie de Fowler-Stephens en deux temps, les vaisseaux spermatiques internes sont ligaturés lors de l’intervention initiale, puis l’apport sanguin collatéral depuis la cavité abdominale vers les testicules est augmenté pendant au moins 6 mois, après quoi les testicules sont abaissés dans le scrotum lors d’une seconde intervention. L’orchidopexie de Fowler-Stephens en un temps ou en deux temps peut être réalisée par voie laparoscopique.
Orchidopexie laparoscopique
Comme la chirurgie laparoscopique est réalisée avec un champ de vision élargi, elle a l’avantage de pouvoir minimiser les lésions des vaisseaux sanguins tout en disséquant largement, et d’assurer le trajet le plus court pour la mobilisation du testicule (Figure 3) et (Vidéo 1). L’orchidopexie laparoscopique comprend une technique consistant à abaisser le testicule dans le scrotum tout en préservant les vaisseaux spermatiques internes, ainsi que les techniques de Fowler-Stephens (Vidéo 2). Grâce à la laparoscopie, une autotransplantation microchirurgicale peut être réalisée.
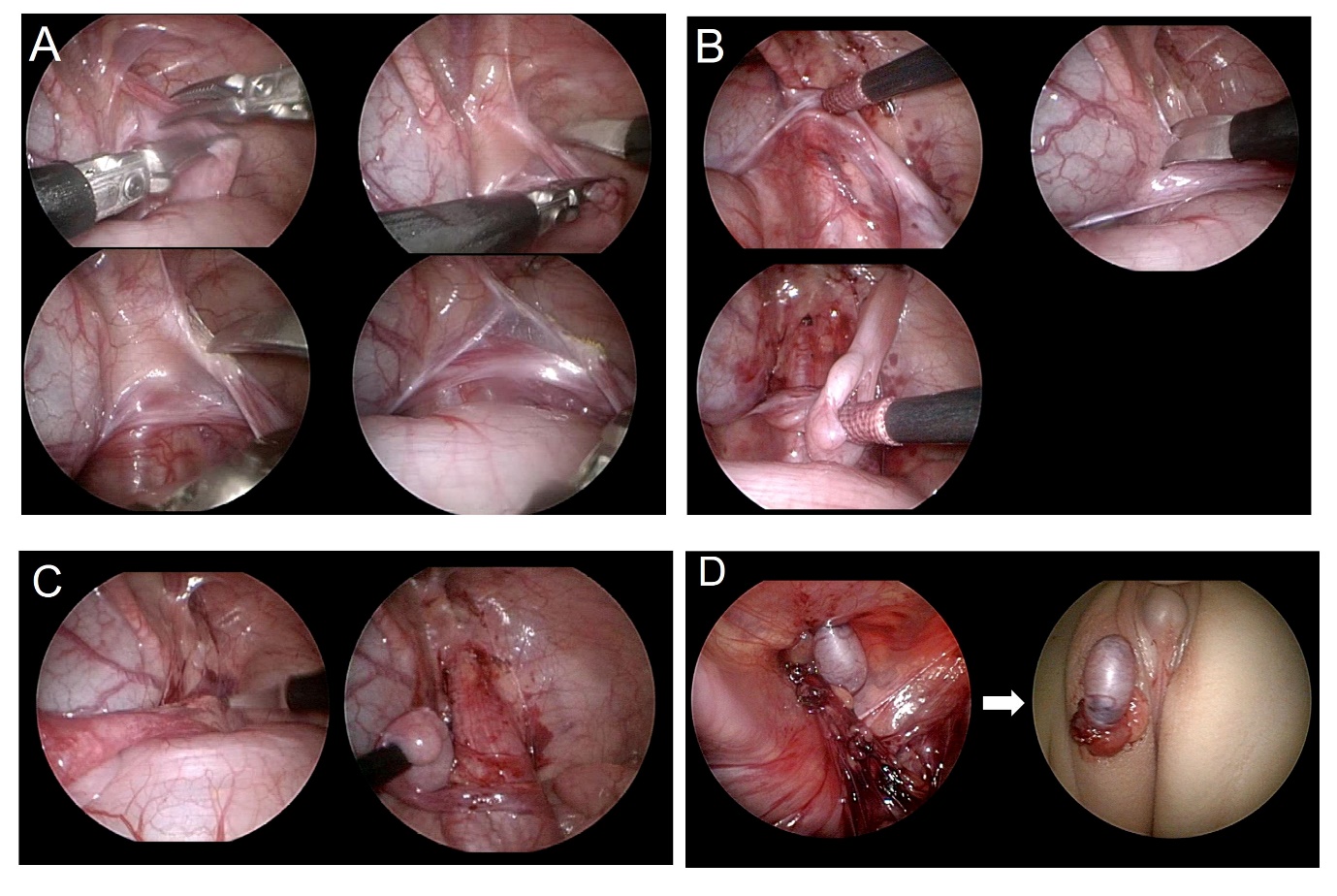
Figure 3 Images explicatives étape par étape de l’orchidopexie laparoscopique. (A) section du gubernaculum, (B) dissection du péritoine parallèle au canal déférent, (C) incision du péritoine parallèle aux vaisseaux spermatiques internes, (D) création d’un néo-hiatus et transposition du testicule hors de l’abdomen vers la loge scrotale.
Vidéo 2 Démonstration de l’orchidopexie de Fowler-Stephens.
Autotransplantation par microchirurgie
Ceci est réalisé dans des cas particuliers où les testicules sont situés profondément dans la cavité abdominale. Dans un premier temps, les testicules et les cordons spermatiques sont libérés, fixés dans le scrotum, puis les vaisseaux sanguins testiculaires sont connectés aux vaisseaux de la paroi abdominale inférieure par microchirurgie afin de rétablir le flux sanguin. Bien que le taux de succès soit relativement élevé, ce n’est pas une méthode de choix aisée, car elle exige un haut niveau de compétence et des efforts importants pour réaliser l’anastomose vasculaire en microchirurgie, et nécessite des soins postopératoires attentifs.
Orchidectomie
L’orchidectomie est pratiquée lorsqu’aucune fonction testiculaire ne peut être attendue en raison d’une atrophie testiculaire sévère ou d’anomalies morphologiques.
Complications de l’orchidopexie et réintervention
Les complications de l’orchidopexie comprennent la rétraction testiculaire, l’hématome, la lésion du nerf ilio-inguinal, la torsion du cordon spermatique, la lésion du canal déférent ou l’atrophie testiculaire. L’atrophie testiculaire est la complication la plus grave et survient après une dissection excessive du cordon spermatique ou un recours excessif à l’électrocoagulation, une torsion des vaisseaux spermatiques, ou lors d’une orchidopexie de Fowler-Stephens lorsque le testicule est abaissé sous tension, compromettant l’apport sanguin; la rétraction testiculaire est habituellement due à une dissection rétropéritonéale insuffisante, et le testicule est tiré vers le haut au-dessus du scrotum, sous l’anneau inguinal externe ou près du tubercule pubien. En cas de réintervention, il faut veiller à éviter l’ancien site opératoire et à pratiquer une incision, aborder le tissu cicatriciel à partir du tissu normal, et retirer le tissu cicatriciel dur, y compris du tissu normal, afin de ne pas léser les vaisseaux spermatiques, puis effectuer la fixation testiculaire.
Points clés
- Recommandations de l’AUA pour la cryptorchidie indiquent que la chirurgie pour testicule non descendu est de préférence réalisée avant l’âge de 1 an
- La campagne Choosing Wisely, en coopération avec l’AUA, a choisi de souligner que l’imagerie pour un testicule non descendu ne doit pas être réalisée de manière systématique, car la confirmation de la position testiculaire est mieux réalisée par l’examen ou, si nécessaire en cas de testicule non palpable, par laparoscopie.
- L’orchidopexie inguinale ou scrotale présente un taux de succès élevé avec un faible taux de complications
- L’orchidopexie laparoscopique est associée à des taux plus élevés d’atrophie testiculaire
Références
- Hutson JM, Balic A, T N. Cryptorchidism. Semin Pediatr Surg 2010; 19: 215. DOI: 10.1002/bjs.1800760203.
- Ashley RA, JS B, Kolon TF. Cryptorchidism: pathogenesis, diagnosis, treatment and prognosis. Urol Clin North Am 2010; 37: 183. DOI: 10.1016/j.ucl.2010.03.002.
- Elder JS. The undescended testis. Hormonal and Surgical Management Surg Clin North Am 1988; 68: 983. DOI: 10.1515/iupac.88.1460.
- Sijstermans K, Hack WW, RW M. The frequency of undescended testis from birth to adulthood: a review. Int J Androl 2008; 31: 1. DOI: 10.1111/j.1365-2605.2008.00883.x.
- Werdelin L, Nilsonne A. The evolution of the scrotum and testicular descent in mammals: a phylogenetic view. J Theor Biol 1999; 196: 61. DOI: 10.1006/jtbi.1998.0821.
- Lovegrove BG. Cool sperm. why some placental mammals have a scrotum. J Evol Biol 2014; 27: 801. DOI: 10.1111/jeb.12373.
- Bedford JM. Anatomical evidence for the epididymis as the prime mover in the evolution of the scrotum. Am J Anat 1978; 152: 483. DOI: 10.1002/aja.1001520404.
- Momen MN, Ananian FB, IM F. Effect of high environmental temperature on semen parameters among fertile men. Fertil Steril 2010; 93: 1884. DOI: 10.1016/j.fertnstert.2008.12.065.
- Hutson JM, S H, Heyns CF. Anatomical and functional aspects of testicular descent and cryptorchidism. Endocr Rev 1997; 18: 259. DOI: 10.1210/er.18.2.259.
- Costa WS, Sampaio FJ, LA F. Testicular migration: remodeling of connective tissue and muscle cells in human gubernaculum testis. J Urol 2002; 167: 2171. DOI: 10.1097/00005392-200205000-00065.
- P S, W E. Perinatal development of gubernacular cones in rats and rabbits: effect of exposure to anti-androgens. Anat Rec 1993; 236: 399. DOI: 10.1002/ar.1092360214.
- Nef S, Parada LF. Cryptorchidism in mice mutant for Insl3. Nat Genet 1999; 22: 295. DOI: 10.1038/10364.
- Zimmermann S, Steding G, JM E. Targeted disruption of the Insl3 gene causes bilateral cryptorchidism. Mol Endocrinol 1999; 13: 681. DOI: 10.1210/mend.13.5.0272.
- Hutson JM, Li R, BR S. Regulation of testicular descent. Pediatr Surg Int 2015; 31: 317. DOI: 10.1007/s00383-015-3673-4.
- Hutson JM, Baskin LS, G R. The power and perils of animal models with urogenital anomalies: handle with care. J Pediatr Urol 2014; 10: 699. DOI: 10.1016/j.jpurol.2014.03.003.
- Gracia J, Sanchez Zalabardo J, J SG. Clinical, physical, sperm and hormonal data in 251 adults operated on for cryptorchidism in childhood. BJU Int 2000; 85: 1100. DOI: 10.1046/j.1464-410x.2000.00662.x.
- Kollin C, Hesser U, EM R. Testicular growth from birth to two years of age, and the effect of orchidopexy at age nine months: a randomized, controlled study. Acta Paediatr 2006; 95: 318. DOI: 10.1080/08035250500423812.
- Miller KD, MT C, Lee PA. Fertility after unilateral cryptorchidism. Paternity, time to conception, pretreatment testicular location and size, hormone and sperm parameters. Horm Res 2001; 55: 249.
- Lee PA, Coughlin MT. Fertility after bilateral cryptorchidism. Evaluation by paternity, hormone, and semen data. Horm Res 2001; 55: 28.
- Park KH, Lee JH, JJ H. Histological evidences suggest recommending orchiopexy within the first year of life for children with unilateral inguinal cryptorchid testis. Int J Urol 2007; 14: 616. DOI: 10.1111/j.1442-2042.2007.01788.x.
- Kogan SJ, Tennenbaum S, B G. Efficacy of orchiopexy by patient age 1 year for cryptorchidism. J Urol 1990; 144: 508. DOI: 10.1016/s0022-5347(17)39505-8.
- Tasian GE, Hittelman AB, GE K. Age at orchiopexy and testis palpability predict germ and Leydig cell loss: clinical predictors of adverse histological features of cryptorchidism. J Urol 2009; 182: 704. DOI: 10.1590/s1677-55382009000500033.
- Wood HM, Elder JS. Cryptorchidism and testicular cancer: separating fact from fiction. J Urol 2009; 181: 452. DOI: 10.1016/s0084-4071(09)79277-2.
- Caterino S, Lorenzon L, M C. Epididymal-testicular fusion anomalies in cryptorchidism are associated with proximal location of the undescended testis and with a widely patent processus vaginalis. J Anat 2014; 225: 473. DOI: 10.1111/joa.12222.
- Mollaeian M, V M, Elahi B. Significance of epididymal and ductal anomalies associated with undescended testis: study in 652 cases. Urology 1994; 43: 857. DOI: 10.1016/0090-4295(94)90152-x.
- Kim SO, Na SW, HS Y. Epididymal anomalies in boys with undescended testis or hydrocele: Significance of testicular location. BMC Urol 2015; 15: 108. DOI: 10.1186/s12894-015-0099-1.
- Cendron M, Huff DS, MA K. Anatomical, morphological and volumetric analysis: a review of 759 cases of testicular maldescent. J Urol 1993; 149: 570. DOI: 10.1016/s0022-5347(17)36151-7.
- Hrebinko RL, Bellinger MF. The limited role of imaging techniques in managing children with undescended testes. J Urol 1993; 150: 458. DOI: 10.1016/s0022-5347(17)35510-6.
- Tasian GE, Copp HL. Diagnostic performance of ultrasound in nonpalpable cryptorchidism: a systematic review and meta-analysis. Pediatrics 2011; 127: 119. DOI: 10.1016/j.yuro.2011.05.011.
- Elert A, Jahn K, A H. Population-based investigation of familial undescended testis and its association with other urogenital anomalies. J Pediatr Urol 2005; 1: 403. DOI: 10.1016/j.jpurol.2005.04.005.
- Engeler DS, Hosli PO, H J. Early orchiopexy: prepubertal intratubular germ cell neoplasia and fertility outcome. Urology 2000; 56: 144. DOI: 10.1016/s0090-4295(00)00560-4.
- Wenzler DL, DA B, Park JM. What is the rate of spontaneous testicular descent in infants with cryptorchidism? J Urol 2004; 171: 849. DOI: 10.1097/01.ju.0000106100.21225.d7.
- Pyorala S, NP H, Uhari M. A review and meta-analysis of hormonal treatment of cryptorchidism. J Clin Endocrinol Metab 1995; 80: 2795. DOI: 10.1210/jc.80.9.2795.
- Rajfer J, Walsh PC. The incidence of intersexuality in patients with hypospadias and cryptorchidism. J Urol 1976; 116: 769. DOI: 10.1016/0022-3468(77)90475-4.
- Hagberg S, Westphal O. Treatment of undescended testes with intranasal application of synthetic LH-RH. Eur J Pediatr 1982; 139: 285. DOI: 10.1007/bf00442181.
- Hadziselimovic F, Herzog B. Treatment with a luteinizing hormone-releasing hormone analogue after successful orchiopexy markedly improves the chance of fertility later in life. J Urol 1997; 158: 1193. DOI: 10.1097/00005392-199709000-00132.
- Cortes D, J T, Visfeldt J. Hormonal treatment may harm the germ cells in 1 to 3-year-old boys with cryptorchidism. J Urol 2000; 163: 1290. DOI: 10.1097/00005392-200004000-00070.
Dernière mise à jour: 2025-09-22 07:59