26: Sténose urétrale congénitale et traumatique
Ce chapitre prendra environ 14 minutes de lecture.
Introduction
Les sténoses urétrales étaient initialement considérées comme peu fréquentes chez l’enfant.1 Des rapports ultérieurs ont suggéré qu’elles ne sont pas si rares.2 L’impression d’une faible incidence était principalement due à une sous-déclaration et à une littérature limitée. Johanson a été le premier à observer la formation d’une sténose en 1953 après une rupture urétrale complète.1 Les sténoses urétrales sont globalement classées selon leur étiologie en congénitales/idiopathiques, iatrogènes, inflammatoires et traumatiques. Il n’est pas clair si les sténoses sans cause définie doivent être classées comme congénitales ou idiopathiques.
Harshman et al et Kaplan & Brock ont recommandé d’éviter l’appellation de sténose urétrale congénitale et ont décrit de telles lésions comme des sténoses d’étiologie inconnue.3,4 Il n’est pas clair si les sténoses induites par un cathéter peuvent être classées comme iatrogènes ou inflammatoires. Puisqu’une telle sténose ne se serait pas produite sans la présence initiale d’un cathéter à demeure, on peut soutenir qu’elle devrait être classée comme iatrogène.2 Les causes iatrogènes telles que le cathétérisme ou la sténose après réparation d’un hypospadias représentent la majorité des sténoses urétrales antérieures dans la population pédiatrique, en particulier dans le groupe d’âge le plus jeune. Cependant, à mesure que l’enfant grandit, on observe une prépondérance progressive des sténoses urétrales traumatiques, y compris des sténoses urétrales postérieures.
Sténoses congénitales et idiopathiques
Mori et al ont rapporté que la sténose/le rétrécissement urétral congénital constituait une cause importante d’infections urinaires récidivantes, d’énurésie, de pollakiurie ou d’hématurie chez les garçons.5 Elle se reconnaît par une image de remplissage rectiligne typique (Figure 1) Également désignée sous les termes Cobb’s collar, Moorman’s ring ou membrane urétrale postérieure obstructive congénitale (COPUM), leur étiologie est obscure. Il est débattu de savoir si cette entité peut être qualifiée de rétrécissement.
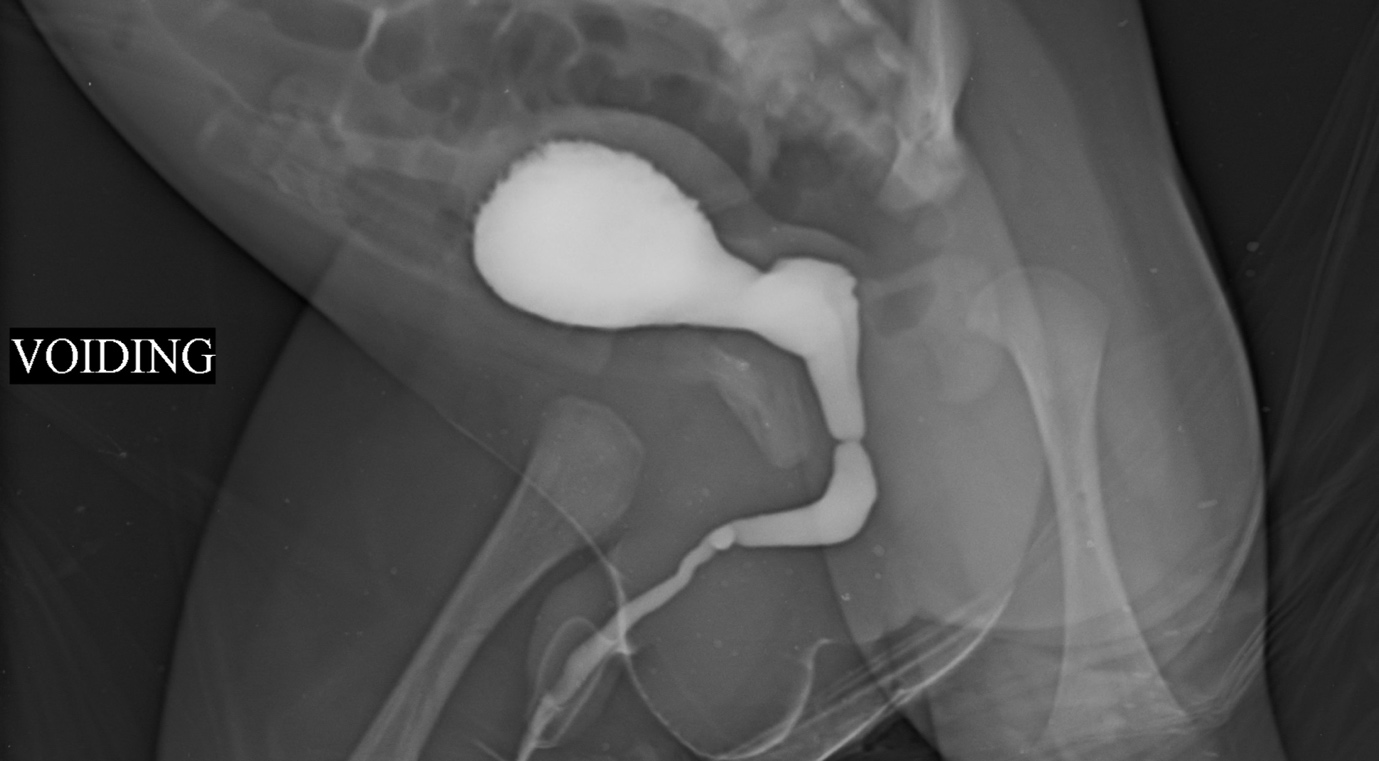
Figure 1 Cysto-urétrographie mictionnelle montrant une sténose/rétrécissement de l’urètre idiopathique/congénital. Un rétrécissement en anneau est visible à la jonction de l’urètre antérieur et postérieur. Souvent, les voies urinaires supérieures ne sont pas dilatées et la présentation se fait par des infections urinaires ou un goutte-à-goutte urinaire
Cette lésion est observée comme une sténose annulaire à la cystoscopie (Figure 2) juste en aval du sphincter urétral externe.6 Habituellement, les signes tels que l’irrégularité vésicale, l’épaississement ou les anomalies des voies urinaires supérieures observés dans les valves urétrales postérieures (PUV) sont absents. Le traitement le plus efficace de cette lésion est l’urétrotomie interne optique (OIU) sous vision directe. Elle est réalisée en position 12 heures à l’aide d’une lame froide (flèche de (Figure 2) Chez les garçons présentant des fuites urinaires diurnes et une sténose congénitale de l’urètre bulbaire, les épisodes de fuites se sont améliorés dans 69,4 % des cas après OIU.5 En outre, les infections urinaires et le reflux vésico-urétéral diminuent grâce au traitement rapide de cette pathologie.
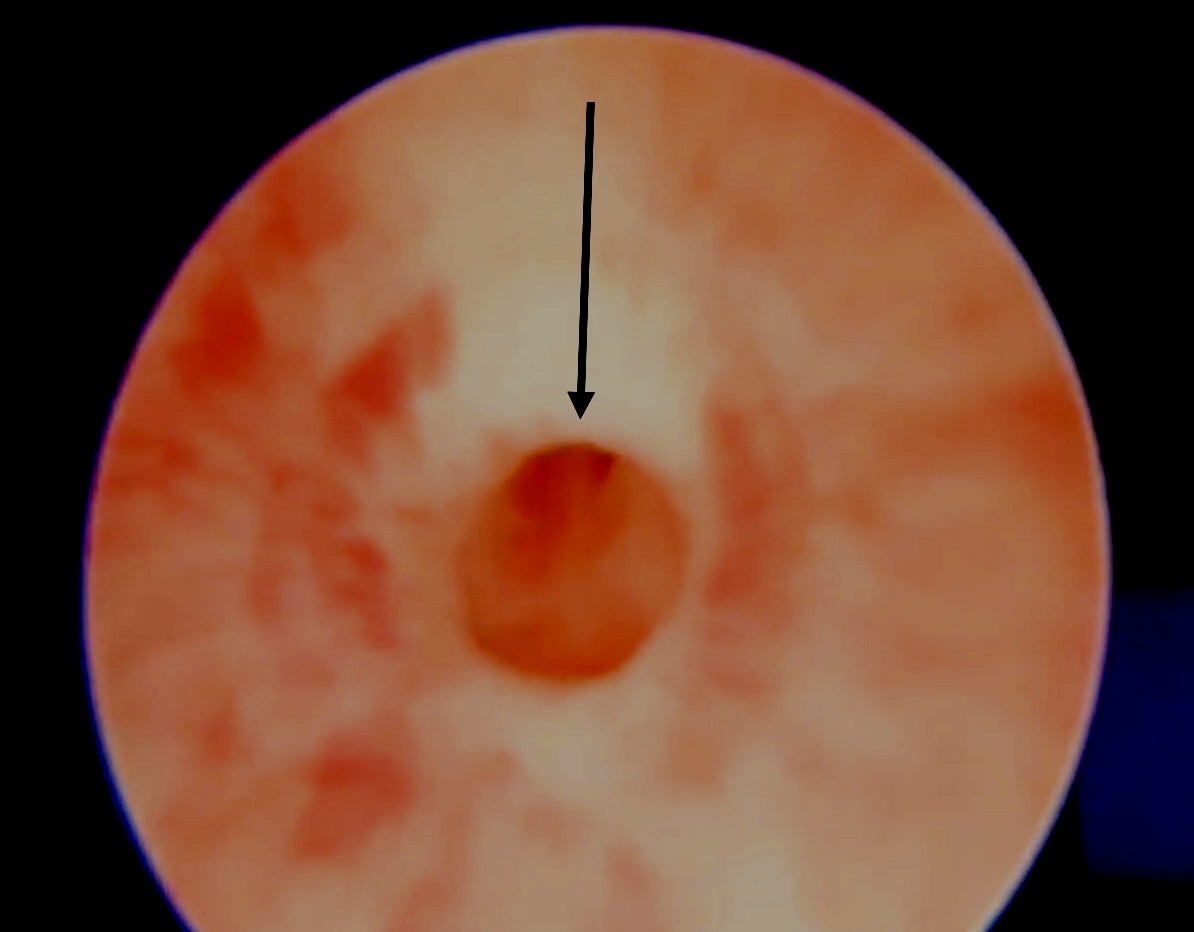
Figure 2 Urétrotomie interne optique (OIU) pour rétrécissement idiopathique/congénital, consistant en une incision au couteau froid à 12 heures
Sténoses iatrogènes
Sténoses induites par cathéter
Le cathétérisme urétral est une cause iatrogène importante (12,3 % au total), et constitue la cause principale de sténoses urétrales multifocales et pan-antérieures dans une étude d’Ansari et al.2 Les sténoses iatrogènes dues à un sondage prolongé (souvent inséré pour la surveillance de la diurèse dans les réanimations neurologiques) sont souvent situées au niveau de la région bulbo-membraneuse. Si certaines sont liées à des sondes de calibre trop important, d’autres résultent du gonflage du ballonnet dans l’urètre ou d’une ablation traumatique de la sonde (on note souvent un saignement urétral dans ce contexte). Le sondage prolongé en lui-même provoque une inflammation urétrale, une ischémie et, en fin de compte, une sténose urétrale. Elles se présentent souvent par une rétention après le retrait de la sonde. Dans une telle situation, l’auteur préfère réaliser la mise en place d’une sonde sus-pubienne (SPC) sous guidage échographique. Cela facilite une épreuve de miction ultérieure en clampant la SPC. De plus, la SPC peut être utilisée pour une cysto-urétrographie mictionnelle (VCUG) afin d’évaluer l’étendue de la sténose. Ces sténoses sont souvent des rétrécissements de court segment, accessibles à une OIU sous anesthésie générale. Après l’OIU, un nouveau VCUG et une épreuve de miction sont nécessaires pour s’assurer de la résolution de la sténose. Des indications claires et bien définies du sondage, une pose de sonde urétrale par un opérateur expérimenté, et la prise en compte d’une SPC lorsqu’un sondage prolongé est probable devraient diminuer l’incidence de ces sténoses iatrogènes.
Sténoses consécutives à une valve urétrale postérieure
La fulguration transurétrale des valves est une autre cause importante de sténose urétrale chez l’enfant. Bien que des données spécifiques sur la contribution de la fulguration des valves aux sténoses pédiatriques fassent défaut, l’incidence varie de 0 % à 25 % selon les différentes séries.7 Dans une série récente, 11 des 62 patients (5,6 % au total) ont présenté une sténose iatrogène après fulguration des valves.2 Alors que diverses causes ont été proposées dans le développement de ces sténoses, la plus importante étant l’insertion traumatique d’un résectoscope surdimensionné dans une lumière urétrale étroite et la fuite de courant monopolaire due à une isolation insuffisante du résectoscope ou à une activation (« buzzing ») trop zélée. On considère qu’il s’agit d’une cause évitable de sténoses chez l’enfant, que l’on peut prévenir par la douceur du geste opératoire, en utilisant des instruments de petite taille adaptés pour la fulguration dans un urètre infantile étroit, en diminuant le temps de contact pendant la fulguration afin d’éviter des coupes profondes et en ne fulgurant, sous vision directe, qu’au niveau des valves.8 Les auteurs préfèrent recourir à l’ablation au couteau froid plutôt qu’à la fulguration par diathermie pour l’ablation des VUP afin de prévenir les lésions thermiques et de réduire la formation de sténoses.9 Souvent, les sténoses après ablation des valves sont des sténoses de segment court, accessibles à une OIU. Celle-ci doit être réalisée avec prudence, après insertion préalable d’un fil-guide.
Sténoses urétrales associées à l’hypospadias
Les sténoses consécutives à la réparation de l’hypospadias représentent une part importante des sténoses urétrales antérieures chez les adolescents et les jeunes adultes. Elles peuvent se manifester précocement par un jet faible et un goutte-à-goutte ou tardivement par des infections urinaires (IU) récidivantes et des atteintes des voies urinaires supérieures. Leur présentation est très variable, et elles peuvent être diagnostiquées tard, notamment au début de l’âge adulte après une réparation supposément ‘réussie’ durant l’enfance sans fistules. Ansari a souligné la nécessité de prévenir les parents que les enfants subissant une réparation de l’hypospadias pourraient développer des sténoses à l’avenir et devraient être suivis durant l’adolescence pour dépister la formation de sténoses.2 Souvent, l’uroflow montre un tracé plat avec un résidu post-mictionnel important. Les sténoses d’hypospadias après réparation urétrale distale (plaque incisée tubulisée - TIP) sont souvent des sténoses de long segment dues à une lumière urétrale médiocre. Elles se manifestent précocement par des efforts de poussée et un goutte-à-goutte. Elles nécessitent souvent une mise à plat jusqu’à atteindre un urètre de calibre normal. Elles peuvent nécessiter une greffe cutanée prépuciale locale/ greffe de muqueuse orale (OMG) ou greffe de muqueuse buccale (BMG) en inlay lors de la mise à plat. Après une période de 6 mois, celles-ci peuvent être tubulisées afin de fournir un urètre de calibre plus large. La sténose d’hypospadias après réparation de l’urètre proximal (après une réparation tubulisée en un seul temps – Duckett) est souvent due à un rétrécissement à la jonction entre l’urètre natif et le néourètre tapissé de peau. Une urétrographie ascendante (AUG) est nécessaire pour démontrer la localisation exacte et l’étendue du rétrécissement (Figure 3) Si une sténose annulaire étroite est trouvée à la jonction du néourètre avec l’urètre natif, une OIU seule peut suffire. En revanche, une sténose dense de long segment peut nécessiter une réparation en plusieurs temps par OMG/BMG.10 (Figure 4) présente un organigramme de la prise en charge des sténoses urétrales antérieures sur hypospadias (HAUS). Tout le segment rétréci et cicatriciel est excisé et l’OMG est matelassée en place. Après une période de 6 mois à 1 an, une tubulisation est réalisée. Barbagli a rapporté que la longueur de la sténose, mais pas le nombre d’interventions antérieures nécessaires pour la réparation primaire de l’hypospadias, était associée au risque d’échec.11 Certains chirurgiens privilégient une réparation en un temps avec inlay dorsal d’OMG dans ces situations tandis que l’auteur préfère une approche en deux temps.12,13
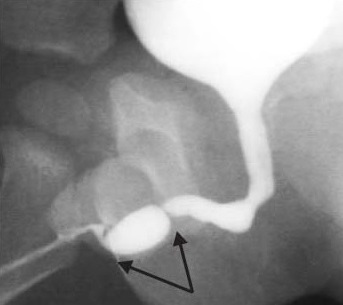
Figure 3 La sténose urétrale antérieure après réparation de l’hypospadias est souvent observée à la jonction de l’urètre natif et du néo-urètre. Des rétrécissements en plis multiples se prêtent à une OIU, tandis que les sténoses urétrales antérieures longues nécessitent une greffe de muqueuse buccale avec réparation en deux temps.
Figure 4 Un schéma décisionnel pour la prise en charge des sténoses urétrales antérieures associées à l’hypospadias (HAUS).
Sténoses inflammatoires
Contrairement aux séries chez l’adulte, les sténoses dues au lichen scléreux (LS) ou à des causes infectieuses sont rares chez l’enfant.14 Bien que le LS soit souvent considéré comme une maladie de l’adulte, la balanite xérotique oblitérante (BXO), apparentée au LS, est une cause importante de sténoses urétrales, en particulier chez les enfants plus âgés. Des rapports récents montrent qu’elles ne sont pas aussi rares qu’on le pensait auparavant.15 Ces sténoses sont plus difficiles à traiter et nécessitent plusieurs interventions, car il s’agit d’un processus inflammatoire chronique et elles ont tendance à récidiver.2 Les urologues pédiatres qui opèrent ces sténoses doivent expliquer aux aidants la nature de l’affection et la nécessité d’un suivi prolongé pour identifier les récidives.
Urétroplastie de substitution par greffe de muqueuse buccale et orale
Les sténoses urétrales antérieures non accessibles à une anastomose termino-terminale nécessitent une urétroplastie de substitution. Celle-ci peut être réalisée au moyen de lambeaux cutanés péniens ou de greffons libres de peau en épaisseur totale, de muqueuse orale (OMG) ou de muqueuse buccale (BMG). L’urétroplastie de substitution par OMG/ BMG s’impose rapidement comme la technique de choix pour les sténoses pan-urétrales impliquant l’urètre distal.16 Chez ceux présentant des sténoses de l’urètre pendulaire, une incision circum-coronale est utilisée, tandis que pour les sténoses plus proximales, une incision périnéale médiane est utilisée. Le corps spongieux est ensuite décollé dorsalement des corps caverneux et une urétrotomie est réalisée en position de 12 heures. Chez les patients avec des sténoses inflammatoires ou traumatiques, cette approche est plus aisée, tandis que chez ceux avec une sténose sur hypospadias, le corps spongieux est typiquement cicatriciel/absent, ne rendant possible qu’une ouverture « lay » ventrale en position de 6 heures. Dans ces cas, une procédure en deux temps consiste en l’exérèse complète du tissu fibreux et le piquetage de BMG au premier temps. L’urètre est reconstruit au deuxième temps, 4–6 mois après le premier.
Dans une réparation en une seule étape par onlay dorsal, pour des sténoses inflammatoires ou traumatiques, le BMG/OMG est fixé aux corps caverneux par des points séparés de polyglactine 6–0 en matelassure, puis suturé aux berges incisées de l’urètre par des sutures continues. Barbagli et al. ont décrit en détail les étapes opératoires (Figure 5)17 Pour la reconstruction méatique, le BMG le plus distal est fixé par des points séparés de polyglactine 5–0 aux berges dorsalement incisées du méat. Le patient est sorti 3–5 jours après la chirurgie avec une sonde urétrale à demeure et une sonde sus-pubienne. Les sondes sont retirées 3 semaines plus tard, après une urétrocystographie mictionnelle. Alors que certains auteurs privilégient la technique d’onlay dorsal, d’autres ont rapporté d’excellents résultats à long terme avec des techniques d’onlay ventral,5,18,19
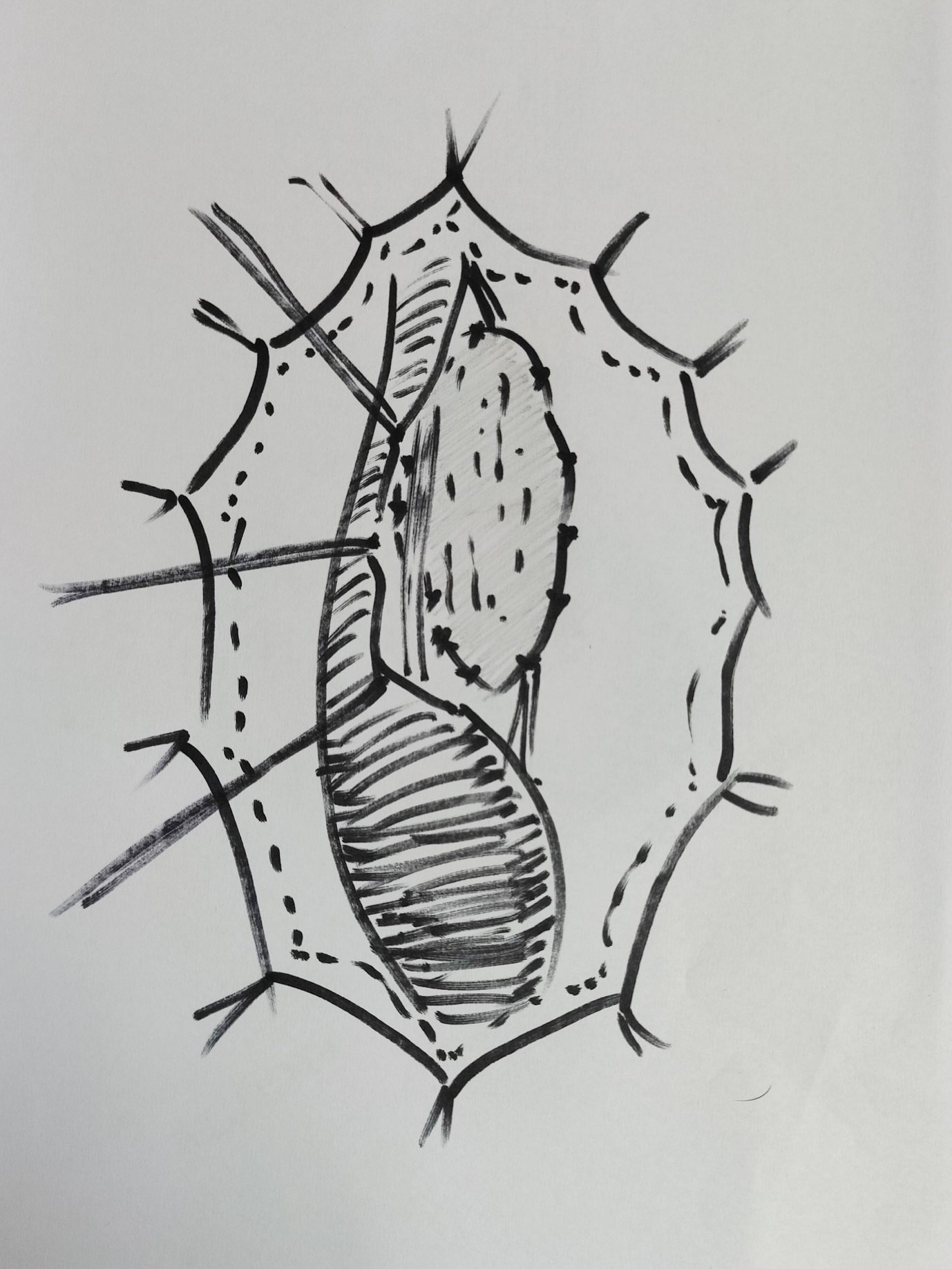
Figure 5 Urétroplastie de substitution par onlay dorsal de BMG; l’urètre a été mobilisé; ouvert à 12 heures sur la face dorsale; BMG matelassée dorsalement et en cours d’anastomose aux berges.
Sténoses traumatiques
L’étiologie traumatique devient un facteur majeur de la maladie de la sténose urétrale à mesure que l’âge avance. Dans une série d’Ansari, 36,9 % de l’ensemble des sténoses étaient d’étiologie traumatique.2 Alors que 18 % des sténoses chez les enfants de moins de 10 ans étaient secondaires à un traumatisme, 45 % des sténoses chez les patients de plus de 10 ans étaient d’origine traumatique. La fracture du bassin, cause importante de sténose urétrale chez les adolescents, est habituellement consécutive à une chute de hauteur ou à des accidents de la circulation, ou à un traumatisme périnéal en arçon.
Turner Warwick a introduit le terme de « défaut de distraction de l’urètre postérieur après fracture pelvienne » complexe (PFPUDD) lorsqu’une ou plusieurs des caractéristiques suivantes sont présentes : (a) le défaut de distraction est long (≥3 cm) et entouré d’une fibrose pelvienne étendue et (b) s’accompagne de diverticules para-urétraux, de faux trajets ou d’une lésion simultanée du col vésical.20 La plupart des défauts de distraction urétrale complexes nécessitent une exposition chirurgicale plus large pour rétablir la continuité urétrale.21
Bien que la pathogenèse du PFPUDD chez l’enfant tende à suivre un schéma similaire à celui de l’adulte, plusieurs éléments clés doivent être pris en compte. La localisation des lésions urétrales traumatiques chez l’enfant est souvent imprévisible en raison de la position abdominale de la vessie et de l’immaturité de la prostate.22 Parmi les autres facteurs à considérer chez l’enfant figurent : (a) les défauts de distraction urétrale ont tendance à être plus longs que chez l’adulte en raison d’un déplacement marqué vers le haut de la vessie et de la prostate, (b) des lésions doubles touchant le col vésical et l’urètre membraneux sont plus fréquemment observées chez l’enfant et (c) la petite taille prépubertaire du périnée peut rendre difficile l’accès à une extrémité urétrale proximale située haut.23
Colapinto et McCallum24 ont classé les lésions urétrales postérieures traumatiques en trois catégories selon l’aspect radiologique. Dans le type 1, la prostate ou le diaphragme urogénital est déplacé, mais l’urètre membraneux est seulement étiré et non sectionné. Dans le type 2, l’urètre membraneux est rompu au-dessus du diaphragme urogénital, à l’apex de la prostate. Dans le type 3, l’urètre membraneux est rompu au-dessus et au-dessous du diaphragme urogénital. Récemment, une nouvelle classification des lésions de l’urètre postérieur chez les patients présentant une fracture du bassin a été proposée.25 Ce nouveau schéma de classification permet de comparer différentes stratégies thérapeutiques et leurs résultats (Tableau 1)
Tableau 1 Classification anatomique et mécanique unifiée des sténoses urétrales traumatiques.
| Classe | Définition |
|---|---|
| I | L’urètre postérieur étiré mais intact |
| II | Déchirure de l’urètre prostato-membraneux au-dessus du diaphragme urogénital |
| III | Déchirure partielle ou complète des urètres antérieur et postérieur avec rupture du diaphragme urogénital |
| IV | Lésion vésicale s’étendant à l’urètre |
| IVa | Lésion de la base vésicale avec extravasation périurétrale simulant une lésion de l’urètre postérieur |
| V | Lésion pure de l’urètre antérieur, partielle ou complète |
Le débat persiste parmi les urologues pédiatriques quant à la meilleure approche : réalignement urétral précoce avec ou sans reconstruction primaire de l’urètre sectionné vs. SPC primaire et réparation différée de l’urètre. Nerli et al.26 ont rapporté que la moitié des enfants ayant bénéficié d’un réalignement primaire ont nécessité des urétrotomies endoscopiques supplémentaires, tandis que certains ont eu besoin d’une urétroplastie pour prendre en charge une sténose résultante. L’auteur privilégie une SPC primaire pour pallier la phase aiguë de rétention urinaire à la suite du traumatisme. Nous préférons également éviter l’instrumentation urétrale qui peut aggraver les lésions urétrales ou une exploration pelvienne risquée susceptible de perturber un hématome et d’empêcher un rapprochement correct. Après une période de 6-8 mois, lorsque la stabilisation orthopédique est retirée, une urétrographie opposée est réalisée afin d’évaluer la localisation et la longueur de la sténose (Figure 6) Plusieurs procédures chirurgicales ont été proposées pour la réparation différée des PFPUDDs. Celles-ci incluent la dilatation urétrale, des techniques endoscopiques comme l’OIU, des procédures de substitution et une réparation anastomotique sans tension différée.
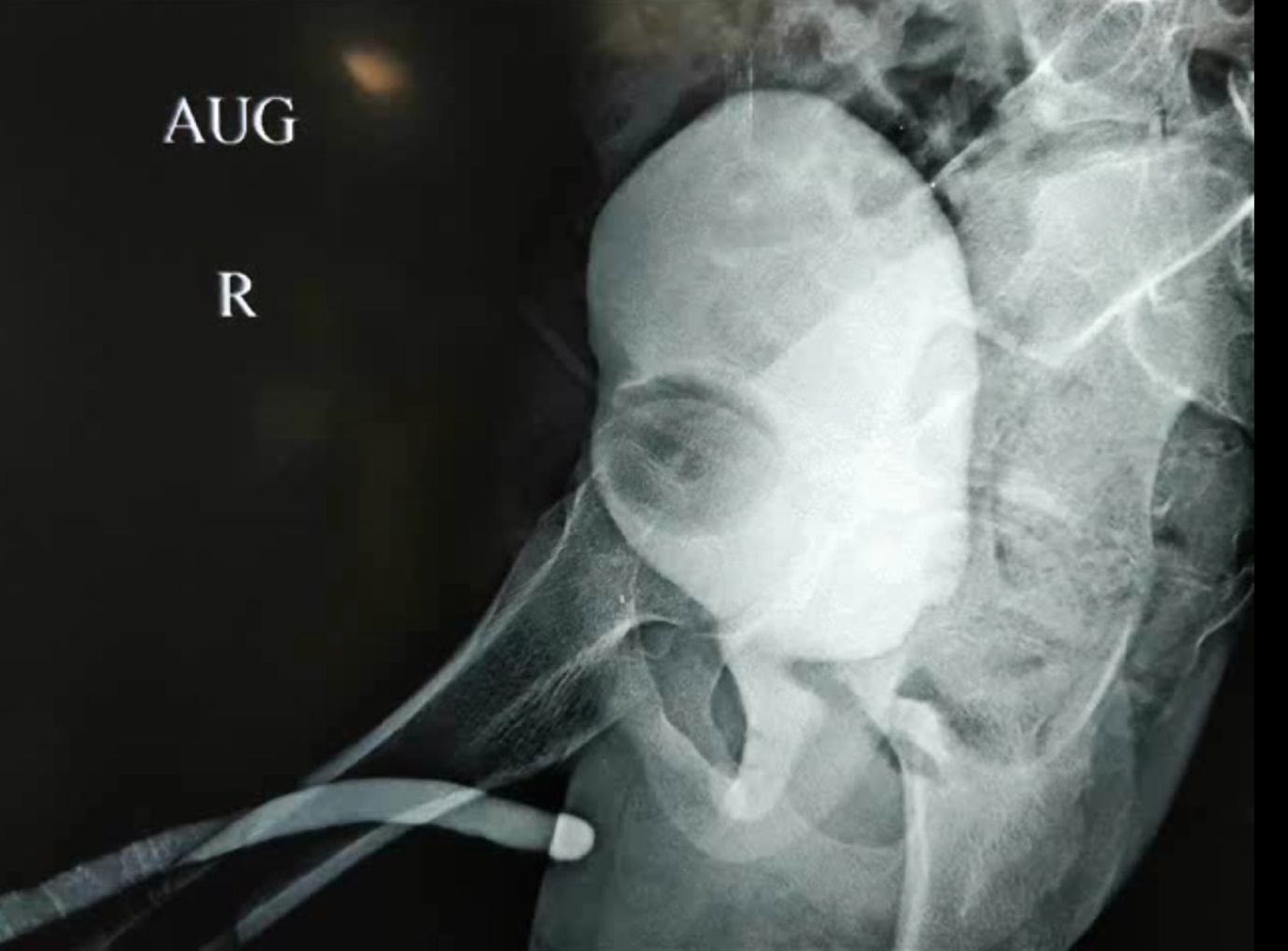
Figure 6 L’urétrographie opposée est une étape essentielle pour évaluer l’étendue des lésions de distraction urétrale post-traumatiques. Elle est généralement réalisée en injectant du produit de contraste depuis la SPC pour opacifier l’urètre postérieur, tandis qu’une injection via le méat permet d’opacifier l’urètre antérieur.
L’OIU peut être avantageuse pour la prise en charge à la fois des sténoses annulaires de l’urètre membraneux à la suite de lésions urétrales partielles et des sténoses courtes non oblitérantes après l’échec d’une réparation anastomotique primaire post-traumatique.27 L’état actuel des connaissances est que la dilatation urétrale et l’OIU pour les PFPUDD ne sont pas acceptables chez l’enfant ; les résultats rapportés étant médiocres, les patients soumis à ces procédures ont souvent besoin d’interventions chirurgicales supplémentaires.23,28
Urétroplastie anastomotique
L’urétroplastie anastomotique est l’approche actuellement privilégiée pour restaurer la continuité urétrale chez l’enfant et l’adulte présentant des PFPUDDs. Le succès de l’urétroplastie anastomotique dépend souvent d’une exposition chirurgicale adéquate, de l’exérèse de tout le tissu fibreux occupant le défaut de distraction, de la mobilisation de l’urètre bulbaire normal, de la fixation d’une muqueuse saine aux berges des extrémités urétrales bulbaire et prostatique et de la réalisation d’une anastomose spatulée sans tension (Figure 7), (Figure 8), lorsqu’une vascularisation adéquate de l’urètre est présente. La réparation anastomotique peut être tentée par plusieurs voies d’abord : (a) voie périnéale, (b) voie périnéale élaborée en un temps, (c) voie transpubienne (partielle ou totale), (d) voie périnéo-abdominale progressive (transpubienne), et (e) voie sagittale postérieure.
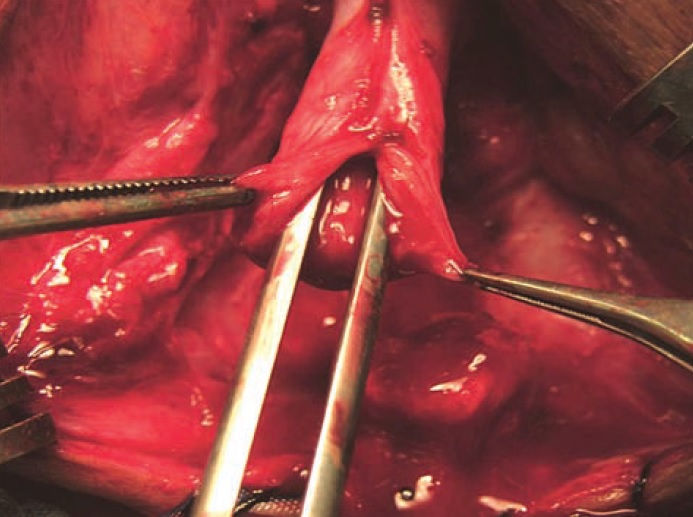
Figure 7 La mobilisation adéquate de l’urètre bulbaire et une anastomose large après spatulation sont des étapes cruciales
Figure 8 La mobilisation des piliers et le grignotage de la branche ischio-pubienne inférieure permettent un trajet plus court et un meilleur alignement
L’approche périnéo-abdominale (transpubienne) permet la progression d’un abord périnéal vers un abord périnéo-abdominal, avec ou sans pubectomie partielle, selon les caractéristiques anatomiques peropératoires du défaut de distraction urétrale, et autorise, si nécessaire, une réorientation supracrurale de l’urètre mobilisé. L’abord périnéal élaboré en un temps fournit des manœuvres séquentielles pour réaliser une anastomose sans tension : (a) mobilisation adéquate de l’urètre bulbaire, (b) séparation des corps caverneux proximaux, (c) résection du bord inférieur de l’arcade pubienne, et (d) possibilité de faire passer l’urètre antérieur autour d’un corps caverneux afin de raccourcir le trajet de l’urètre mobilisé
Un taux de succès global de 75 à 85 % est rapporté pour l’urétroplastie anastomotique.29 L’échec de l’urétroplastie périnéale a été attribué à une sélection inappropriée des patients - des défauts de distraction d’au moins 3 cm de longueur avec un déplacement cranial significatif de la prostate. Chez les enfants présentant une PFPUDD, la réparation chirurgicale doit débuter par une voie d’abord périnéale et, lorsqu’une anastomose sans tension n’est pas possible, une approche abdominale (pubectomie partielle) est requise pour la correction du défaut de distraction.21
Conclusions
Les causes iatrogènes (cathétérisme, PUV, réparation de l’hypospadias) représentent la majorité des sténoses urétrales antérieures dans la tranche d’âge la plus jeune ; alors qu’avec la croissance de l’enfant, les sténoses urétrales traumatiques et postérieures deviennent prédominantes. Le traitement initial des lésions traumatiques de l’urètre postérieur associées aux fractures du bassin doit viser à stabiliser le patient, à réaliser une SPC et à traiter les lésions associées mettant en jeu le pronostic vital. L’évaluation préopératoire du défaut de distraction urétrale constitué comprend des urétrographies opposées et une cystoscopie afin de définir l’étendue anatomique du défaut de distraction urétrale. Lorsqu’un urètre antérieur sain est présent, l’urétroplastie anastomotique est idéale pour traiter les PFPUDDs. Les urétroplasties de substitution en inlay avec BMG/OMG sont principalement indiquées pour les sténoses panurétrales.
Références
- Herle K, Jehangir S, Thomas RJ. Stricture Urethra in Children: An Indian Perspective. J Indian Assoc Pediatr Surg 2018; 23 (4): 192–197, DOI: 10.4103/jiaps.JIAPS_146_17.
- Ansari MS, Yadav P, Srivastava A, Kapoor R, Shekar PA. Etiology and characteristics of pediatric urethral strictures in a developing country in the 21st century. J Pediatr Urol 2019; 15 (4): 403 1–403 8, DOI: 10.1016/j.jpurol.2019.05.020.
- Harshman MW, Cromie WJ, Wein AJ, Duckett JW. Urethral Stricture Disease in Children. J Urol 1981; 126 (5): 650–654, DOI: 10.1016/S0022-5347(17)54675-3.
- Kaplan GW, Brock WA. Urethral Strictures in Children. J Urol 1983; 129 (6): 1200–1203, DOI: 10.1016/S0022-5347(17)52641-5.
- Mori Y. Treatment of congenital urethral stenosis (urethral ring) in children. Optic internal urethrotomy in the congenital bulbar urethral stenosis in boys. Nihon Hinyokika Gakkai Zasshi 1989; 80 (5): 704–710, DOI: 10.5980/jpnjurol1989.80.704.
- Gobbi D, Leon FF, Gnech M, Midrio P, Gamba P, Castagnetti M. Management of Congenital Urethral Strictures In Infants. Case Series. Urol J 2019; 16 (1): 67–71, DOI: 10.22037/uj.v0i0.4045.
- Lal R, Bhatnagar V, Mitra DK. Urethral strictures after fulguration of posterior urethral valves. J Pediatr Surg 1998; 33 (3): 518–519, DOI: 10.1016/S0022-3468(98)90102-6.
- Myers DA, Walker RD. Prevention of Urethral Strictures in the Management of Posterior Urethral Valves. J Urol 1981; 126 (5): 655–656, DOI: 10.1016/S0022-5347(17)54676-5.
- Babu R, Kumar R. Early outcome following diathermy versus cold knife ablation of posterior urethral valves. J Pediatr Urol 2013; 9 (1). DOI: 10.1016/j.jpurol.2012.02.014.
- Payne CE, Sumfest JM, Deshon GEJ. Buccal mucosal graft for hypospadias repairs. Tech Urol 1998; 4 (4): 173–176.
- Barbagli G. Correlation Between Primary Hypospadias Repair and Subsequent Urethral Strictures in a Series of 408 Adult Patients. Eur Urol Focus 2017; 3 (2–3): 287–292, DOI: 10.1016/j.euf.2017.02.005.
- Ye W-J, Ping P, Liu Y-D, Li Z, Huang Y-R. Single stage dorsal inlay buccal mucosal graft with tubularized incised urethral plate technique for hypospadias reoperations. Asian J Androl 2008; 10 (4): 682–686, DOI: 10.1111/j.1745-7262.2008.00398.x.
- Schwentner C. Interim outcome of the single stage dorsal inlay skin graft for complex hypospadias reoperations. J Urol 2006; 175 (5): 1872–1877, DOI: 10.1016/S0022-5347(05)01016-5.
- Palminteri E, Berdondini E, Verze P, Nunzio C, Vitarelli A, Carmignani L. Contemporary urethral stricture characteristics in the developed world. Urology 2013; 81 (1): 191–196, DOI: 10.1016/j.urology.2012.08.062.
- Celis S. Balanitis xerotica obliterans in children and adolescents: A literature review and clinical series. J Pediatr Urol 2014; 10 (1): 34–39, DOI: 10.1016/j.jpurol.2013.09.027.
- Dubey D, Kumar A, Mandhani A, Srivastava A, Kapoor R, Bhandari M. Buccal mucosal urethroplasty: a versatile technique for all urethral segments. BJU Int 2005; 95 (4): 625–629, DOI: 10.1111/j.1464-410X.2005.05352.x.
- Barbagli G, Sansalone S, Kulkarni SB, Romano G, Lazzeri M. Dorsal onlay oral mucosal graft bulbar urethroplasty. BJU Int 2012; 109 (11): 1728–1741, DOI: 10.1111/j.1464-410X.2012.11006.x.
- Dubey D. Substitution urethroplasty for anterior urethral strictures: a critical appraisal of various techniques. BJU Int 2003; 91 (3): 215–218, DOI: 10.1046/j.1464-410x.2003.03064.x.
- Heinke T, Gerharz EW, Bonfig R, Riedmiller H. Ventral onlay urethroplasty using buccal mucosa for complex stricture repair. Urology 2003; 61 (5): 1004–1007, DOI: 10.1016/s0090-4295(02)02523-2.
- Turner-Warwick R. Prevention of complications resulting from pelvic fracture urethral injuries–and from their surgical management. Urol Clin North Am 1989; 16 (2): 335–358. DOI: 10.1016/s0094-0143(21)01515-9.
- Podesta M, Podesta MJ. Traumatic Posterior Urethral Strictures in Children and Adolescents. Front Pediatr 2019; 7: 24, DOI: 10.3389/fped.2019.00024.
- Hagedorn JC, Voelzke BB. Pelvic-fracture urethral injury in children. Arab J Urol 2015; 13 (1): 37–42, DOI: 10.1016/j.aju.2014.11.007.
- Koraitim MM. Posttraumatic posterior urethral strictures in children: a 20-year experience. J Urol 1997; 157 (2): 641–645. DOI: 10.1016/s0022-5347(01)65239-x.
- Colapinto V, McCallum RW. Injury to the male posterior urethra in fractured pelvis: a new classification. J Urol 1977; 118 (4): 575–580, DOI: 10.1016/s0022-5347(17)58110-0.
- Goldman SM, Sandler CM, Corriere JNJ, McGuire EJ. Blunt urethral trauma: a unified, anatomical mechanical classification. J Urol 1997; 157 (1): 85–89, DOI: 10.1016/s0022-5347(01)65291-1.
- Nerli RB, Koura AC, Ravish IR, Amarkhed SS, Prabha V, Alur SB. Posterior urethral injury in male children: long-term follow up. J Pediatr Urol 2008; 4 (2): 154–159, DOI: 10.1016/j.jpurol.2007.11.002.
- Helmy TE, Hafez AT. Internal urethrotomy for recurrence after perineal anastomotic urethroplasty for posttraumatic pediatric posterior urethral stricture: could it be sufficient? J Endourol 2013; 27 (6): 693–696, DOI: 10.1089/end.2012.0592.
- Hsiao KC. Direct vision internal urethrotomy for the treatment of pediatric urethral strictures: analysis of 50 patients. J Urol 2003; 170 (3): 952–955, DOI: 10.1097/01.ju.0000082321.98172.4e.
- Singla M. Posttraumatic Posterior Urethral Strictures in Children—Management and Intermediate-term Follow-up in Tertiary Care Center. Urology 2008; 72 (3): 540–543, DOI: 10.1016/j.urology.2008.02.078.
Dernière mise à jour: 2025-09-22 07:59